Los últimos 15 años han visto aparecer de manera progresiva diferentes fármacos que se han mostrado eficaces para el tratamiento de fondo de la esclerosis múltiple. Esta inauguración y posterior ampliación del arsenal terapéutico en esclerosis múltiple seguirá un curso ascendente en los próximos años dados los resultados positivos ya conocidos de ensayos clínicos fase III con moléculas de administración oral. Junto a ellos también hemos observado la aparición de un grupo de fármacos que en lugar de definirse por su vía de administración lo hacen por su diseño: los anticuerpos monoclonales.
DesarrolloEn este artículo se revisan los principales resultados de seguridad y eficacia de tres de los anticuerpos monoclonales que ya han obtenido resultados positivos en estudios de fase II: alemtuzumab, rituximab-ocrelizumab y daclizumab. Para la elaboración de este trabajo se ha obtenido información de artículos ya publicados y de las siguientes páginas web: www.clinicaltrials.gov del National Institute of Health (NIH) de los EE. UU., de la EMA (Agencia Europea del Medicamento) y de la Agencia Española del Medicamento.
ConclusionesEs necesario disponer de los resultados de los ensayos fase III en marcha actualmente para emitir juicios adecuados sobre estos fármacos. Sin embargo, es de esperar que, confirmándose los datos de los ensayos fase II disponibles, nos hallemos ante fármacos de eficacia superior a los actuales, pero cuya seguridad será necesario ajustar para obtener perfiles adecuados de beneficio/riesgo.
The last fifteen years have see the gradual appearance of a number of different drugs that have been shown to be effective as disease modifying therapies in multiple sclerosis. The opening and subsequent widening of the therapeutic armamentarium in multiple sclerosis will continue on a expanding course in the next few years due to the already known positive results of phase III clinical trials with orally administered molecules. Along with these, we have also seen the appearance of a group of drugs which, instead of being defined by their route of administration, are considered together as a consequence of their similar design: the monoclonal antibodies.
Contents and methodsThe principal safety and efficacy results of three of the monoclonal antibodies that have already obtained positive results in phase II studies will be reviewed in this paper: alemtuzumab, rituximab / ocrelizumab, and daclizumab. For the preparation of this paper, information was obtained from already published articles and from the following web pages: www.clinicaltrials.gov of the National Institute of Health of the USA, the EMA (European Medicines Agency) web page and the Spanish Medicines Agency (Agencia Española del Medicamento) web page.
ConclusionsFinal results from the phase III clinical trials in progress are required to produce definitive statements on the efficacy and safety of the reviewed drugs. However, and subject to confirmation of the presently available data from phase II trials, it is likely that this group of drugs is to be placed one step beyond the currently available disease-modifying therapies in terms of efficacy, but with a safety pattern which will make careful monitoring of treated patients a mandatory requirement so as to obtain adequate risk/benefit profiles.
En las últimas décadas, de manera lenta pero imparable, nuestro arsenal terapéutico en neurología ha sido testigo de la irrupción de los primeros tratamientos para modificar el curso evolutivo de la esclerosis múltiple. Los interferones y el acetato de glatiramero han sido seguidos recientemente por el natalizumab. Es cierto que el camino por recorrer todavía es mucho, sobre todo para mejorar el confort en la administración y también, cómo no, para superar la eficacia de los fármacos disponibles hoy en día. El rápido progreso que estamos viviendo en estos últimos años, hace que sea difícil mantenerse al día de todos los ensayos fase II en marcha y, mucho menos de todas las moléculas que han entrado en fase I preclínica. Es obvio que, junto a los fármacos orales, los protagonistas de este rápido desarrollo han sido los anticuerpos monoclonales. Dedicaremos este artículo a revisar los principales resultados de seguridad y eficacia de algunos de los anticuerpos monoclonales que ya se han abierto camino a través de la fase II de desarrollo clínico: alemtuzumab, rituximab-ocrelizumab y daclizumab. En la búsqueda de información nos hemos basado, además de en las referencias citadas, en la información disponible en las siguientes páginas web: www.clinicaltrials.gov, página web de la EMEA y página web de la Agencia Española del Medicamento. A modo de resumen, en las tablas 1 y 2 se presentan los datos fundamentales de eficacia y seguridad de los tres anticuerpos monoclonales revisados, así como un sucinto resumen de sus mecanismos de acción directos e indirectos.
Principales características de seguridad y eficacia de los anticuerpos monoclonales revisados en este capítulo. Es importante destacar que la diferencia en los diseños de los estudios no permite una comparación directa de los datos de eficacia
| Seguridad | Eficacia | |
| Alemtuzumab | Fase II: procesos autoinmunitarios durante el periodo de reconstitución del sistema inmunológico (púrpura trombocitopénica idiopática, enfermedad de Graves, etc.); riesgo de infecciones | Fase II: reducción de un 74% en la tasa de brotes y en un 71% del riesgo de progresión frente a interferón-beta-1a sc 44μg; disminución de la discapacidad frente a un incremento en el grupo de interferón-beta-1a sc 44μg a los 36 meses (−0,39 vs. +0,38) |
| Rituximab | Fase II: riesgo de leucoencefalopatía multifocal progresiva por casos en otras patologías (sin casos declarados en pacientes con EM en el momento actual); riesgo de infecciones | Fase II: en EMRR reducción frente a placebo en el número de lesiones Gd+ (91% de reducción) y en el número de pacientes que experimentan brotes (14,5% vs. 34,3%, p=0,02); resultados negativos en EMPP |
| Daclizumab | Fase II: infecciones y reacciones cutáneas | Fase II: no se han observado diferencias en la tasa de brotes; reducción de un 72% en el número medio de lesiones Gd+ |
EM: esclerosis múltiple; EMPP: esclerosis múltiple primaria-progresiva; EMRR: esclerosis múltiple remitente-recurrente; Gd+: lesiones que realzan con gadolinio; sc: subcutáneo.
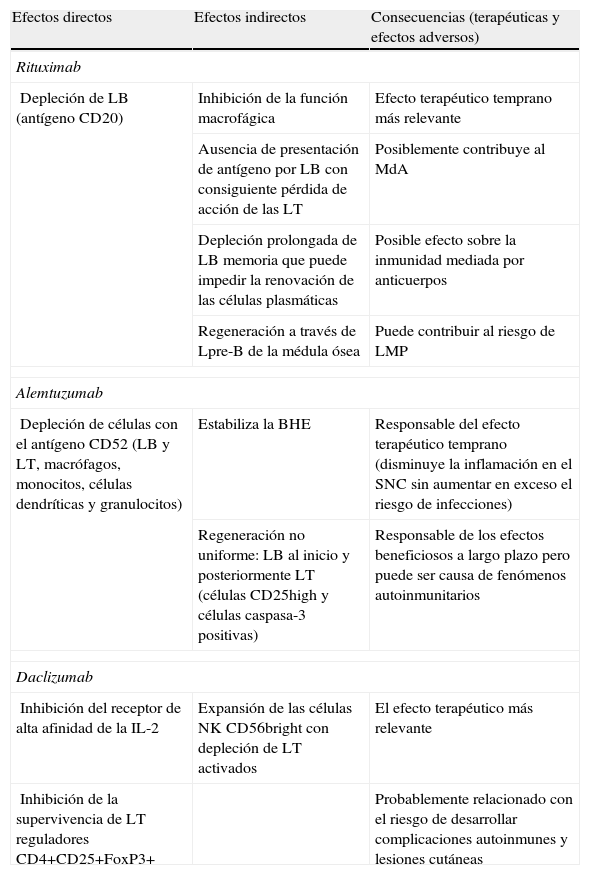
Mecanismos de acción y consecuencias tanto terapéuticas como en términos de efectos secundarios de los anticuerpos monoclonales revisados
| Efectos directos | Efectos indirectos | Consecuencias (terapéuticas y efectos adversos) |
| Rituximab | ||
| Depleción de LB (antígeno CD20) | Inhibición de la función macrofágica | Efecto terapéutico temprano más relevante |
| Ausencia de presentación de antígeno por LB con consiguiente pérdida de acción de las LT | Posiblemente contribuye al MdA | |
| Depleción prolongada de LB memoria que puede impedir la renovación de las células plasmáticas | Posible efecto sobre la inmunidad mediada por anticuerpos | |
| Regeneración a través de Lpre-B de la médula ósea | Puede contribuir al riesgo de LMP | |
| Alemtuzumab | ||
| Depleción de células con el antígeno CD52 (LB y LT, macrófagos, monocitos, células dendríticas y granulocitos) | Estabiliza la BHE | Responsable del efecto terapéutico temprano (disminuye la inflamación en el SNC sin aumentar en exceso el riesgo de infecciones) |
| Regeneración no uniforme: LB al inicio y posteriormente LT (células CD25high y células caspasa-3 positivas) | Responsable de los efectos beneficiosos a largo plazo pero puede ser causa de fenómenos autoinmunitarios | |
| Daclizumab | ||
| Inhibición del receptor de alta afinidad de la IL-2 | Expansión de las células NK CD56bright con depleción de LT activados | El efecto terapéutico más relevante |
| Inhibición de la supervivencia de LT reguladores CD4+CD25+FoxP3+ | Probablemente relacionado con el riesgo de desarrollar complicaciones autoinmunes y lesiones cutáneas | |
IL: interleucina; LB: linfocitos B; LMP: leucoencefalopatía multifocal progresiva; LT: linfocitos T; MdA: mecanismo de acción; NK: natural killer; SNC: Sistema Nervioso Central.
Tomado de Bielekova y Becker17.
El alemtuzumab o campath-1H es un anticuerpo monoclonal humanizado contra el antígeno CD52, de hecho uno de los primeros anticuerpos humanizados disponibles1. Dado que dicho receptor de superficie se halla en la mayoría de células del sistema inmunitario (linfocitos B y T, monocitos y eosinófilos), el tratamiento con este anticuerpo provoca una intensa y duradera depleción de células del sistema inmunitario. Es importante resaltar que el CD52 no se expresa todavía en los progenitores de médula ósea, que no sufren los efectos de dicho anticuerpo, y también hay que resaltar que esta depleción no es tan profunda en los órganos linfáticos lo que podría explicar la relativamente baja tasa de infecciones que sufren los pacientes tratados con este anticuerpo. En los mecanismos de muerte celular implicados es posible que intervengan poblaciones celulares de neutrófilos y linfocitos natural killer, y que el papel del complemento no sea tan importante como se creía2. Con el nombre de MABCAMPATH® se está ya comercializado en España para el tratamiento de la leucemia linfocítica crónica de células B en pacientes en los que el tratamiento con quimioterapia con combinaciones de fludarabina no sea adecuado (se puede consultar la ficha técnica en: http://www.ema.europa.eu/humandocs/PDFs/EPAR/mabcampath/emea-combined-h353es.pdf)1,3,4.
EficaciaEn los primeros ensayos clínicos publicados con este fármaco se puso de manifiesto que su uso en fases de la enfermedad con escaso componente inflamatorio iba a ser una estrategia de escaso rendimiento, por lo que los responsables del diseño del estudio fase II se decidieron a incluir únicamente a pacientes en las fases más tempranas de la enfermedad1,5; es por ello que en el estudio fase II CAMMS223 sólo se podía incluir a pacientes con una duración de la enfermedad inferior a 4 años6. Las características fundamentales del ensayo CAMMS223 son: ensayo aleatorizado fase II de 3 años de duración que incluyó a 334 pacientes con una puntuación en la escala EDSS inferior a 3 y una duración de la enfermedad como máximo de 3 años. Los pacientes no eran ciegos a la medicación administrada (debido al altamente reconocible síndrome de liberación de citocinas se consideró imposible mantener el ciego en las personas que iban a recibir este anticuerpo) y recibían en una proporción 1:1:1: a) interferón-beta-1a subcutáneo a dosis de 44μg 3 veces por semana (Rebif®), y b) alemtuzumab en 2 dosis diferentes (12mg/día o 24mg/día). El programa de administración de alemtuzumab endovenoso era el siguiente: 5 días consecutivos el primer mes del ensayo, y durante 3 días consecutivos los meses 12 y 24, hasta completar tres ciclos de tratamiento. El ensayo se interrumpió (por razones de seguridad) cuando casi todos los pacientes habían recibido la dosis del mes 12, pero sólo un 25% había recibido la del mes 24. Como se ha dicho, los pacientes y también los neurólogos tratantes no eran ciegos al tratamiento administrado; únicamente el neurólogo evaluador permanecía ciego a la asignación terapéutica. Aunque esto debe tenerse en cuenta a la hora de valorar los resultados de este ensayo es cierto que los dos coobjetivos primarios: EDSS y presencia de brotes arrojaron resultados muy alentadores. En el grupo de pacientes en alemtuzumab (ambas dosis juntas) el riesgo de progresión sostenida de la discapacidad se redujo en un 71% y la tasa de brotes en un 74% comparado con el brazo de Rebif 44®. Aunque no disponemos de datos sobre la evolución de las lesiones que realzaban con gadolinio, ya que no se realizaron resonancias magnéticas tras administración de gadolinio, el resultado en las medidas de volumen cerebral también es destacable. Se observaron diferencias estadísticamente significativas en el desarrollo de atrofia entre los pacientes en alemtuzumab y los pacientes en Rebif 44® entre los meses 12 y 36 (para evitar el efecto de seudoatrofia producido en los primeros meses tras el inicio de la terapia antiinflamatoria), siendo el cambio del volumen cerebral de –0,2% en los pacientes que recibieron Rebif 44® y de +0,9% en el brazo de alemtuzumab. Este último dato, junto a una mejora de la discapacidad durante el estudio en los brazos de tratamiento con alemtuzumab, ha llevado a especular sobre un posible efecto neuroprotector e incluso neurorregenerador de este anticuerpo monoclonal.
SeguridadLos muy alentadores resultados de eficacia del ensayo CAMMS223 vinieron, desgraciadamente, acompañados por el fallecimiento de dos pacientes en el brazo de alemtuzumab. Un paciente falleció por enfermedad cardiovascular; este paciente ya presentaba factores de riesgo previos; el segundo paciente desarrolló una púrpura trombocitopénica autoinmunitaria (en total se detectaron 6 casos de púrpura en los pacientes del ensayo) que le provocó una hemorragia cerebral. A consecuencia, posiblemente de fenómenos aberrantes durante el proceso de regeneración del sistema inmunitario (que se creen relacionados con la diferente cinética de recuperación de los linfocitos B y T [tabla 2]), aparecieron otros casos de patología autoinmunitaria, fundamentalmente trastorno tiroideo autoinmunitario (49 casos en pacientes tratados con alemtuzumab). También se detectó un mayor riesgo de infecciones, especialmente del tracto respiratorio, en los pacientes en alemtuzumab y 3 pacientes desarrollaron episodios de herpes labial recurrente tras las infusiones. Es importante el control de la reacción infusional mediante premedicación (corticoides, paracetamol y antihistamínicos).
Desarrollo clínicoExisten dos ensayos clínicos fase III activos en el momento actual: CAREMS-I y CAREMS-II. El CAREMS-I es un estudio a 2 años comparando la dosis de 12mg/día de alemtuzumab con Rebif 44® (proporción 2:1) en un diseño muy similar al del CAMMS223, aunque se permite reclutar a pacientes con duración de la enfermedad de hasta 5 años. En el ensayo CAREMS-II se trata de reclutar pacientes que no han respondido al tratamiento previo con inmunomoduladores, con una duración de la enfermedad como máximo de 10 años. Ambos estudios están en marcha y han terminado la fase de reclutamiento.
ConclusionesPara este fármaco, y aunque los resultados de eficacia son muy esperanzadores, es necesario afianzar el perfil de seguridad dentro de unos límites aceptables. Para ello esperamos que sean suficientes las medidas de control implementadas en los pacientes para evitar la aparición de efectos adversos graves, sobre todo los relacionados con la diátesis hemorrágica.
RituximabMecanismo de acciónEl rituximab es un anticuerpo monoclonal quimérico (murino/humano) contra el antígeno CD20 presente fundamentalmente en los linfocitos B desde el estadio pre-B hasta la fase de célula B activada; estas células sufren lisis tras la unión de este anticuerpo, aunque es importante recalcar que esto no sucede en los precursores hematopoyéticos más tempranos ni tampoco en las células plasmáticas, ya que no expresan dicho antígeno3,4. Esto permitiría una más rápida regeneración, así como mantener un cierto grado de defensa inmunitaria a través de las células plasmáticas. Las linfopenias inducidas por este fármaco son duraderas, y relativamente selectivas para células B, ya que un año tras la infusión sólo un 30,7% de los pacientes presentaban valores normales de linfocitos B en el ensayo fase II HERMES, mientras que no se observaron cambios en los niveles de linfocitos T en sangre7. Es de destacar que, a pesar de ello, también se hallan reducidos los niveles de linfocitos T en líquido cefalorraquídeo8. Con el nombre comercial de MABTHERA®, el rituximab está ya indicado en España para el tratamiento (en ciertos casos) del linfoma no-Hodgkin, la leucemia linfática crónica y la artritis reumatoide (ficha técnica accesible en: http://www.ema.europa.eu/humandocs/PDFs/EPAR/Mabthera/emea-combined-h165es.pdf).
Evidencia clínica disponible sobre eficaciaEl estudio HERMES investigó la eficacia y seguridad del rituximab en 104 pacientes con esclerosis múltiple remitente-recurrente en un ensayo fase II de 1 año de duración administrándose 1g del fármaco en 2 ocasiones (día 1 y día 15) o placebo (proporción 2:1). Se observó una reducción relativa del 91% en el objetivo primario (número total de lesiones que realzaban con gadolinio en las semanas 12, 16, 20 y 24 de estudio). También se observaron diferencias estadísticamente significativas beneficiando al brazo de tratamiento en la proporción de pacientes con brotes (14,5% versus 34,3% en placebo). El estudio OLYMPUS9 reclutó a 439 pacientes con esclerosis múltiple primaria progresiva en un estudio fase II/III que fue negativo para su objetivo primario. Únicamente se observaron diferencias estadísticamente significativas favoreciendo al brazo de rituximab en la acumulación de lesiones en secuencias potenciadas en T2, no observándose diferencias en el desarrollo de atrofia cerebral. Análisis post hoc parecen demostrar que el fármaco podría ser útil en un subgrupo de pacientes con mayor realce con gadolinio y menor edad.
Datos de seguridadLos resultados de seguridad, tanto del estudio HERMES como del estudio OLYMPUS, destacan la presencia de reacciones infusionales, que suceden fundamentalmente durante los primeros cursos del fármaco para disminuir hasta niveles comparables a placebo en los cursos subsiguientes; también se observó un mayor riesgo de infecciones, así como, en el estudio HERMES, un síndrome coronario y un tumor maligno de tiroides en el grupo de rituximab. Sin embargo, en su uso en otras indicaciones se han comunicado hasta 57 casos de leucoencefalopatía multifocal progresiva en pacientes que habían tomado rituximab10, aunque es claro que esta cifra puede ser superior dada la no obligatoriedad de la comunicación de dichos casos. Es de destacar, sin embargo, que muchos de estos pacientes ya sufrían de patologías que por sí solas ya predisponen a la aparición de leucoencefalopatía multifocal progresiva y que en la inmensa mayoría de estos casos los pacientes habían recibido otras terapias inmunosupresoras, aunque uno de estos casos se trataba de un paciente con anemia hemolítica autoinmunitaria que únicamente había recibido corticoides y rituximab10.
Programa de desarrollo clínicoEl desarrollo clínico en esclerosis múltiple prosigue en el momento actual a través de un anti-CD20 humanizado, el ocrelizumab (ensayo fase II WA21493), y de un anti-CD20 humano, el ofatumumab (ensayo de búsqueda de dosis fase I/II GEN414). Sin embargo, recientemente se ha detenido el desarrollo clínico del ocrelizumab en la artritis reumatoide y el lupus eritematoso sistémico, debido a un perfil de seguridad inaceptable en estas dos patologías (http://www.genengnews.com/analysis-and-insight/ocrelizumab-one-size-does-not-fit-all/77899315/).
ConclusionesLos resultados de eficacia obtenidos en la fase II HERMES son altamente esperanzadores, sin embargo se debe acabar de definir su perfil de seguridad en pacientes con esclerosis múltiple, sobre todo en lo que se refiere a la posibilidad de desarrollo de cuadros de leucoencefalopatía multifocal progresiva. También es necesario obtener más información sobre el riesgo real de infecciones, el cual ha motivado ya la detención del programa de desarrollo del ocrelizumab en algunas patologías.
DaclizumabMecanismo de acciónEl daclizumab es un anticuerpo monoclonal humanizado contra la molécula de superficie CD25, que es la cadena alfa del receptor de la interleucina 2, citocina proinflamatoria fundamental en los procesos de activación del linfocito T. El daclizumab se une de manera selectiva a la subunidad alfa de dicho receptor; esta subunidad es parte constituyente de los receptores de alta y baja afinidad para la interleucina 2, pero no forma parte de los receptores de afinidad intermedia (que sólo constan de las subunidades beta y gamma), que por consiguiente no queda bloqueado. Inicialmente, este anticuerpo fue probado en esclerosis múltiple bajo la hipótesis de detención de los procesos mediados por interleucina 2 de estimulación de linfocitos T autorreactivos (que no disponen de receptores de afinidad intermedia)11. Sin embargo, parece ser que el efecto beneficioso en el caso de la esclerosis múltiple se produce por el exceso de interleucina 2 circulante que provocaría una proliferación de células CD56-bright (que actúan como células reguladoras), que sí disponen de receptores de afinidad intermedia no bloqueados por el daclizumab12. Por otra parte, trabajos recientes indican que el incremento de fenómenos autoinmunes, fundamentalmente cutáneos, observados con este fármaco podría ser debido a una reducción de linfocitos T reguladores CD4+CD25+Foxp3+13. El fármaco se comercializaba con el nombre de ZENAPAX®; sin embargo, su autorización en Europa ha sido anulada a petición del propio laboratorio farmacéutico por razones comerciales no ligadas a alertas de seguridad (accesible en: http://www.emea.europa.eu/humandocs/PDFs/EPAR/Zenapax/68376508en.pdf). Su uso aprobado era para evitar el rechazo agudo del trasplante renal.
Evidencia clínica disponible sobre eficaciaUn primer ensayo clínico abierto demostró una reducción del 78% en el número de lesiones nuevas que realzaban con gadolinio; se trataba de un estudio abierto únicamente en 10 pacientes con diferentes formas de esclerosis múltiple (remitente-recurrente y secundaria progresiva), en pacientes no respondedores a fármacos de primera línea en los que el daclizumab subcutáneo se añadía al interferón-beta14. Un ensayo similar (aunque en este la mayoría de pacientes estaban en monoterapia con daclizumab) realizado por investigadores independientes obtuvo resultados similares15. Recientemente, se han publicado los resultados del estudio CHOICE16 que, con un diseño aleatorizado, doble ciego y de 6 meses de duración reclutó a 230 pacientes con esclerosis múltiple remitente-recurrente y secundaria progresiva (< 10%) que habían tenido un brote en el último año mientras se hallaban en terapia inmunomoduladora estable. El daclizumab (o placebo) se administraba por vía subcutánea cada 15 días en dos dosis posibles (1mg/kg y 2mg/kg). Se demostró una reducción del 72% en el número medio de lesiones que realzaban con gadolinio para la dosis alta, sin hallarse resultados significativos para la dosis baja (1,32 en el brazo de 2mg/kg vs. 3,58 en el de 1mg/kg vs. 4,75 en el grupo placebo) y sin resultados estadísticamente significativos para los parámetros clínicos (brotes, EDSS, MSFC).
Datos de seguridadLos primeros ensayos abiertos no detectaron problemas de seguridad importantes, aunque Rose et al15 ya detectaron cuatro pacientes con problemas cutáneos. Los resultados de seguridad del estudio CHOICE parecen confirmar estos hallazgos y demostrar la presencia de un riesgo incrementado de infección, aunque no se halló un mayor riesgo de infecciones oportunistas; en el grupo tratado, 2 pacientes desarrollaron tumores (un carcinoma de mama ductal in situ y una recurrencia de un seudomixoma peritoneal).
Programa de desarrollo clínicoEn el momento actual se están llevando a cabo un estudio fase II con diferentes dosis (150mg y 300mg) de daclizumab administrado mensualmente (DAC HYP) en monoterapia controlado con placebo (205-MS-201) con un periodo de extensión (205-MS-202 [estudio SELECT]) y un estudio fase III con una sola dosis (150mg) de daclizumab administrado mensualmente (DAC HYP) con un brazo comparador activo de interferón beta-1a (estudio DECIDE).
ConclusionesLos estudios en marcha como monoterapia nos ayudarán a conocer mejor el perfil de eficacia y seguridad de este anticuerpo monoclonal, ya que hasta el momento actual los datos de alta calidad obtenidos provienen fundamentalmente del estudio CHOICE, con un diseño add-on.
ConclusionesAunque se dispone ya de un buen número de datos en relación a la eficacia y seguridad de los tres anticuerpos monoclonales revisados, es todavía pronto para valorar el lugar que pueden ocupar dentro del arsenal terapéutico del que dispondremos en breve para el tratamiento de la esclerosis múltiple. A pesar de que, si se confirman los datos de los ensayos fase II disponibles, los parámetros de eficacia parecen ser superiores a los de los fármacos de primera línea disponibles en el momento actual, es crucial seguir acumulando datos de seguridad a corto y largo plazo sobre estos fármacos. Serán estos datos los que marcarán el futuro de los anticuerpos monoclonales en desarrollo en esclerosis múltiple revisados en este capítulo. Llegado el momento de su aplicación clínica será fundamental, además, desarrollar los algoritmos de manejo y prevención necesarios para minimizar el riesgo de efectos adversos.
Conflicto de interesesJaume Sastre-Garriga ha servido como consultor o miembro de advisory board para Novartis, TEVA, Biogen, Almirall, Bayer Schering Pharma y Merck-Serono y ha participado como ponente en actos organizados por Novartis, Sanofi-Aventis, Biogen, Almirall, Bayer Schering Pharma y Merck-Serono.
Xavier Montalban ha servido como consultor o miembro de advisory board para Novartis, TEVA, Biogen, Sanofi-Aventis, Almirall, Bayer Schering Pharma y Merck-Serono y ha participado como ponente en actos organizados por Novartis, Sanofi-Aventis, Biogen, Almirall, Bayer Schering Pharma y Merck-Serono.