Estudio prospectivo a lo largo de 4 meses de las ITS (infecciones de trasmisión sexual) en mujeres diagnosticadas de ASCUS (atipias de las células escamosas de significado incierto) y LSIL (lesión escamosa intraepitelial de bajo grado) en la citología cervicovaginal en medio líquido.
DiseñoEstudio de edad, paridad, abortos, nuligestas, fumadoras, métodos contraceptivos, antecedentes personales, citología, análisis de VPH-AR (virus del papiloma humano de alto riesgo) e ITS mediante RCP (reacción en cadena de la polimerasa, PCR en inglés) para Chlamydia trachomatis, Neisseria gonorrhoeae, Mycoplasma genitalium, Mycoplasma hominis, Ureaplasma urealyticum, Ureaplasma parvum y Trichomonas vaginalis.
ResultadosLa serie consta de 65 casos: 36 ASCUS y 29 LSIL. No hubo diferencias significativas en ningún parámetro entre ambos grupos. Las medias de edad fueron de 36,02 y 35,77 años, respectivamente. La paridad media fue 0,61 y 0,55 partos, respectivamente. Eran nuligestas el 44,44 y 48,27%, respectivamente. No hacían contracepción el 55,35 y 65,51%, respectivamente. Eran fumadoras el 25% en ASCUS y el 27,58% en LSIL.
Hubo VPH negativo en el 41,66% en ASCUS y en el 31,03% en LSIL. El VPH-AR (+) se dio en el 68,33% en ASCUS y en el 68,96% en LSIL. Los VPH-AR más frecuentes fueron: otros de AR en el 50% en ASCUS y en el 62,06% en LSIL. VPH(+) e ITS (+) ocurrió en el 44,44% en ASCUS y en el 58,62% en LSIL, sin diferencias.
El análisis para ITS fue negativo en el 30,55% en ASCUS y en el 20,68% en LSIL.
Hubo más gérmenes detectados en el grupo LSIL, con diferencia significativa (p<0,05) para Gardnerella vaginalis, 17,24% en LSIL frente a 2,77% en ASCUS. Los gérmenes más frecuentes fueron: U. urealyticum en el 13,88% en ASCUS y en el 24,13% en LSIL; y U. parvum en el 36,11% en ASCUS y en el 44,82% en LSIL.
ConclusionEl análisis de ITS es primordial, junto con la citología y el VPH, para detectar infecciones, a tratar, para poder regresar a la normalidad citológica.
Prospective study along 4 months of STI (sexually transmitted infections) in women diagnosed with ASCUS (atypias of squamous cells of undetermined significance) and LSIL (low-grade squamous intraepithelial lesion) in the cervicovaginal cytology by liquid medium.
DesignStudy of: age, parity, abortions, nulligravides, smokers, contraceptive methods, personal antecedents, cytology, HR-HPV(high-risk human papilloma virus) analysis, STI analysis by PCR (polymerase chain reaction) for: Chlamydia trachomatis, Neisseria gonorrhoeae, Mycoplasma genitalium, Mycoplasma hominis, Ureaplasma urealyticum, Ureaplasma parvum, and Trichomonas vaginalis.
ResultsThe series are 65 cases: 36 ASCUS and 29 LSIL. There weren’t significant differences in any parameter between both groups. The means of age there were 36.02 and 35.77 years, respectively. The mean of parity was 0.61 and 0.55, respectively. They were nulligravides 44.44% in ASCUS and 48.27% in LSIL. No contraception was used in 55.35% in ASCUS and 65.51% in LSIL. The active smokers were 25% in ASCUS and 27.58% in LSIL.
There was HPV negative in 41.66% in ASCUS and 31.03% in LSIL. There was HPV (+) in 68.33% in ASCUS and 68.86% in LSIL. The HPV-AR more frequent were: HR others in 50% in ASCUS and 62.06% in LSIL.
HPV (+) and STI (+) occurred in 44.44% in ASCUS and 58.62% in LSIL.
The STI analysis was negative in 30.55% in ASCUS and 20.68% in LSIL, without differences. There were more detected microorganisms in LSIL group, with significant difference (p<0.05) for Gardnerella vaginalis, 17,24% in LSIL versus 2,77% in ASCUS group. The more frequent microorganisms were: U. urealyticum, in 13.88% in ASCUS and 24.13% in LSIL; and U. parvum, in 36.11% in ASCUS and 44.82% in LSIL.
ConclusionThe STI analysis is primordial, together to cytology and HPV-HR, for detect infections, to treat, to advance to the cytologic normality.
El ecosistema vaginal es dinámico, abierto a la contaminación1. Muchos microorganismos pueden ser inocuos o dañinos, según las modificaciones de la carga bacteriana o las alteraciones de los mecanismos que controlan la homeostasis vaginal.
Los factores influyentes en el entorno vaginal son: la edad, las relaciones sexuales, el uso de antibióticos o contraceptivos, el embarazo, la inmunodepresión, los trastornos metabólicos, la higiene, los hábitos sexuales y la indumentaria sintética. Las relaciones sexuales, por el aumento del pH con la eyaculación y el orgasmo, los microtraumas del coito, los patógenos exógenos y la frecuencia coital. Y con el sexo urogenital o anogenital. La higiene, por el modo de lavarse, los lavados vaginales, el uso de desodorantes o absorbentes, y el salvaslip. Y la indumentaria sintética, por el aumento de temperatura, aumento de humedad e hipersensibilidad o alergia.
Si disminuyen los lactobacilos y la producción de H2O2, aumenta Gardnerella vaginalis, aumentan los anaerobios y aumenta Mycoplasma hominis.
La microbiota vaginal tiene un papel en la adquisición y persistencia de la infección por virus del papiloma humano (VPH) y el desarrollo del cáncer de cérvix2. Hay correlación temporal, progresión o regresión. La microbiota vaginal, su composición, influye en la respuesta inmune del huésped, la susceptibilidad a la infección y el desarrollo del cáncer de cérvix. Influyen el tabaco, la píldora contraceptiva, la paridad aumentada, la relación VPH y VB (vaginosis bacteriana): hay menos lactobacilos y más diversidad microbiológica. Y la inflamación crónica, con las citoquinas, el interferón, la actividad de los macrófagos, de las células NK (natural killer) y de la integración viral en el ADN de la célula.
La salud vaginal quiere decir menos gérmenes y más lactobacilos dominantes3. La microbiota depende de la etnia, debido a factores genéticos de inmunidad y metabolismo; las prácticas de higiene, con las duchas vaginales hay riesgo de VB y VPH; las hormonas, en la menopausia; fumar; el coito, el sexo oral, múltiples parejas sexuales, y el uso de lubricantes.
La disminución del pH, el ácido, inhibe a G. vaginalis, Neisseria gonorrhoeae y Chlamydia trachomatis. El H2O2 inhibe la VB. En la disbiosis hay disminución de moco, estrés oxidativo e inflamación crónica.
En este trabajo, estudiamos de forma prospectiva la detección de ITS (infecciones de trasmisión sexual) en mujeres afectas de alteraciones citológicas: atipias de significado incierto (atypies of squamous cell of undetermined significance [ASCUS]) y lesiones de las células escamosas intraepiteliales de bajo grado (low-grade squamous intraepithelial lesión [LSIL]).
Material y métodosEn la consulta de Ginecología del autor, en el Centro de Especialidades de Monteolivete, de Valencia (España), a lo largo de 4 meses (agosto a noviembre de 2018) estudiamos de forma prospectiva algunos casos con citología positiva de ASCUS y LSIL, practicando determinación analítica de ITS para el diagnóstico de infección vaginal.
La citología en medio líquido Thin Prep/Hologic Inc. (Marlborough, MA, EE.UU.) se realizó en el servicio de Anatomía Patológica del Hospital Dr. Peset de Valencia.
El análisis de VPH-ADN de AR (alto riesgo), mediante la técnica de RCP (reacción en cadena de la polimerasa; PCR en inglés), se realizó en el Laboratorio de Microbiología del Hospital Dr. Peset de Valencia. Se indicaba positividad o negatividad para los tipos de VPH-AR: 16, 18 y otros (que incluía los tipos: 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 y 68).
Así mismo, en dicho laboratorio se realizaba el cribado de ITS. La muestra se tomaba con Eswab, Copan (Italia), para recoger y preservar bacterias aerobias y anaerobias. En el laboratorio se llevaba a cabo examen en fresco y cultivo bacteriológico para N. gonorrhoeae (Ng), Trichomonas vaginalis (Tv), Levaduras, Streptococcus agalactiae y G. vaginalis (Gv).
En la microbiología molecular, con el Kit de Abbot Molecular Inc. (Des Moines, IL, EE.UU.) se hacía la detección de ADN/ARN cualitativo, con RT-PCR para C. trachomatis (Ct), Ng, Mycoplasma genitalium (Mg), M. hominis (Mh), Ureaplasma urealyticum (Uu), Ureaplasma parvum (Up) y Tv.
En el estudio estadístico, los datos cuantitativos se expresan como rango, media y desvío estándar. Se comparan con la prueba t de Student. Los datos cualitativos se expresan en porcentajes. Se comparan con la χ2 de Pearson. La consideración de significación estadística es mediante la p<0,05.
ResultadosLa serie consta de 65 casos: 36 ASCUS y 29 LSIL.
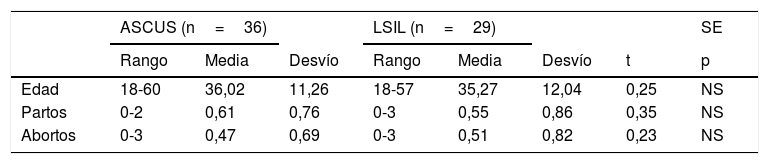
En la tabla 1, presentamos los datos cuantitativos de edad, paridad, abortos y nuligestas. No hubo diferencias significativas entre ambos grupos. Las medias de edad fueron, respectivamente, 36,02 y 35,77 años. Las medias de paridad fueron, respectivamente, 0,61 y 0,55 partos. Las medias de abortos, respectivamente, 0,47 y 0,51. Hubo 16 nuligestas en ASCUS (44,44%) y 14 en LSIL (48,27%).
Datos cuantitativos
| ASCUS (n=36) | LSIL (n=29) | SE | ||||||
|---|---|---|---|---|---|---|---|---|
| Rango | Media | Desvío | Rango | Media | Desvío | t | p | |
| Edad | 18-60 | 36,02 | 11,26 | 18-57 | 35,27 | 12,04 | 0,25 | NS |
| Partos | 0-2 | 0,61 | 0,76 | 0-3 | 0,55 | 0,86 | 0,35 | NS |
| Abortos | 0-3 | 0,47 | 0,69 | 0-3 | 0,51 | 0,82 | 0,23 | NS |
| N | % | N | % | χ2 | p | |
|---|---|---|---|---|---|---|
| Nuligestas | 16 | 44,44 | 14 | 48,27 | 0,07 | NS |
ASCUS: atipias en las células escamosas de significado incierto; LSIL: lesión escamosa intraepitelial de bajo grado; NS: no significativo; SE: significación estadística.
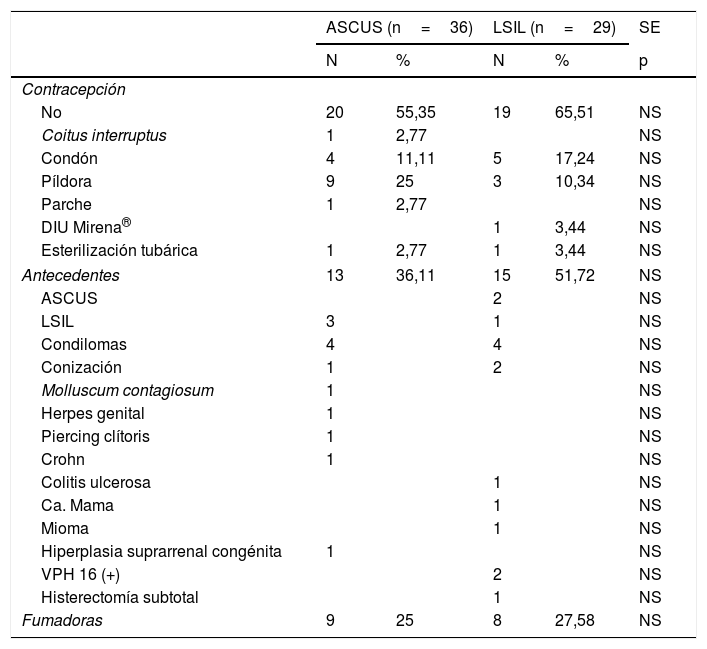
En la tabla 2, presentamos los métodos contraceptivos usados, los antecedentes personales y el número de fumadoras. No hubo diferencias significativas entre ambos grupos en ningún parámetro. No hacían contracepción el 55,35% en ASCUS y el 65,51% en LSIL. Eran fumadoras el 25% en ASCUS y el 27,58% en LSIL. Tenían antecedentes de condilomas 4 casos, en ambos grupos. Y antecedente de conización un caso en ASCUS y 2 casos en LSIL.
Contracepción. Antecedentes. Fumadoras
| ASCUS (n=36) | LSIL (n=29) | SE | |||
|---|---|---|---|---|---|
| N | % | N | % | p | |
| Contracepción | |||||
| No | 20 | 55,35 | 19 | 65,51 | NS |
| Coitus interruptus | 1 | 2,77 | NS | ||
| Condón | 4 | 11,11 | 5 | 17,24 | NS |
| Píldora | 9 | 25 | 3 | 10,34 | NS |
| Parche | 1 | 2,77 | NS | ||
| DIU Mirena® | 1 | 3,44 | NS | ||
| Esterilización tubárica | 1 | 2,77 | 1 | 3,44 | NS |
| Antecedentes | 13 | 36,11 | 15 | 51,72 | NS |
| ASCUS | 2 | NS | |||
| LSIL | 3 | 1 | NS | ||
| Condilomas | 4 | 4 | NS | ||
| Conización | 1 | 2 | NS | ||
| Molluscum contagiosum | 1 | NS | |||
| Herpes genital | 1 | NS | |||
| Piercing clítoris | 1 | NS | |||
| Crohn | 1 | NS | |||
| Colitis ulcerosa | 1 | NS | |||
| Ca. Mama | 1 | NS | |||
| Mioma | 1 | NS | |||
| Hiperplasia suprarrenal congénita | 1 | NS | |||
| VPH 16 (+) | 2 | NS | |||
| Histerectomía subtotal | 1 | NS | |||
| Fumadoras | 9 | 25 | 8 | 27,58 | NS |
ASCUS: atipias en las células escamosas de significado incierto; DIU: dispositivo intrauterino; LSIL: lesión escamosa intraepitelial de bajo grado; NS: no significativo; SE: significación estadística; VPH: virus del papiloma humano.
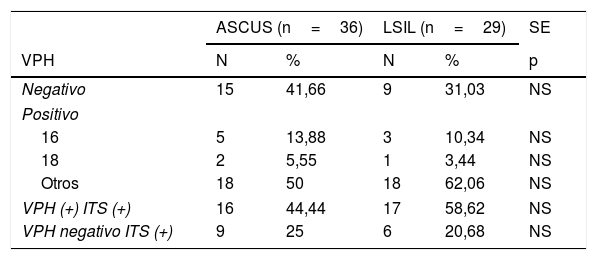
En la tabla 3, presentamos el resultado del análisis de VPH-AR. Fue negativo en el 41,66% en ASCUS y en el 31,03% en LSIL, sin diferencias significativas. Tampoco las hubo en los tipos de VPH-AR, 16, 18 y otros. El más frecuente fue otros, en el 50% en ASCUS y en el 62,06% en LSIL.
VPH. VPH+ITS
| ASCUS (n=36) | LSIL (n=29) | SE | |||
|---|---|---|---|---|---|
| VPH | N | % | N | % | p |
| Negativo | 15 | 41,66 | 9 | 31,03 | NS |
| Positivo | |||||
| 16 | 5 | 13,88 | 3 | 10,34 | NS |
| 18 | 2 | 5,55 | 1 | 3,44 | NS |
| Otros | 18 | 50 | 18 | 62,06 | NS |
| VPH (+) ITS (+) | 16 | 44,44 | 17 | 58,62 | NS |
| VPH negativo ITS (+) | 9 | 25 | 6 | 20,68 | NS |
ASCUS: atipias en las células escamosas de significado incierto; ITS: infecciones de transmisión sexual: LSIL: lesión escamosa intraepitelial de bajo grado; NS: no significativo; SE: significación estadística; VPH: virus del papiloma humano.
Otros en VPH positivo incluye los tipos: 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 y 68.
En la misma tabla, comparamos VPH (+) e ITS (+), siendo el 44,44% en ASCUS y el 58,62% en LSIL, sin diferencia significativa. También sin diferencias, VPH negativo e ITS (+), siendo el 25% en ASCUS y el 20,68% en LSIL.
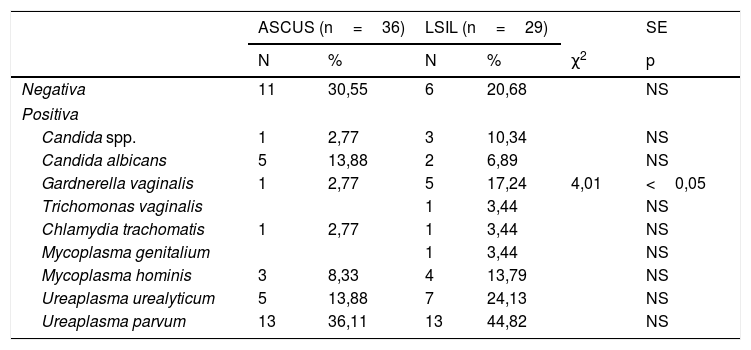
Finalmente, en la tabla 4 estudiamos las ITS encontradas. El resultado fue negativo en el 30,55% en ASCUS y el 20,68% en LSIL, sin diferencia significativa. Respecto a la detección positiva de gérmenes, hubo más en el grupo LSIL. La única diferencia significativa encontrada fue p<0,05 en Gv: 17,24% en LSIL versus 2,77% en ASCUS. Trichomonas y Chlamydia se encontraron en un caso, respectivamente. Y los gérmenes más detectados fueron: Uu en el 13,88% en ASCUS y 24,13% en LSIL, y Up, en el 36,11% en ASCUS y 44,82% en LSIL.
Infecciones de trasmisión sexual
| ASCUS (n=36) | LSIL (n=29) | SE | ||||
|---|---|---|---|---|---|---|
| N | % | N | % | χ2 | p | |
| Negativa | 11 | 30,55 | 6 | 20,68 | NS | |
| Positiva | ||||||
| Candida spp. | 1 | 2,77 | 3 | 10,34 | NS | |
| Candida albicans | 5 | 13,88 | 2 | 6,89 | NS | |
| Gardnerella vaginalis | 1 | 2,77 | 5 | 17,24 | 4,01 | <0,05 |
| Trichomonas vaginalis | 1 | 3,44 | NS | |||
| Chlamydia trachomatis | 1 | 2,77 | 1 | 3,44 | NS | |
| Mycoplasma genitalium | 1 | 3,44 | NS | |||
| Mycoplasma hominis | 3 | 8,33 | 4 | 13,79 | NS | |
| Ureaplasma urealyticum | 5 | 13,88 | 7 | 24,13 | NS | |
| Ureaplasma parvum | 13 | 36,11 | 13 | 44,82 | NS | |
ASCUS: atipias en las células escamosas de significado incierto; LSIL: lesión escamosa intraepitelial de bajo grado; NS: no significativo; SE: significación estadística.
En un caso (n.o 21) en el grupo ASCUS se encontró: Gv, Mh y Up.
En 3 casos en el grupo LSIL se encontraron (n.o 8): Gv, Up y Uu; (n.o 14): Candida spp., Mg, Mh y Uu, y (n.o 26): Candida albicans, Ct, Mh y Up.
En un caso en el grupo ASCUS (n.o 21), se repitió el análisis al mes: tenía Uu, y al mes del tratamiento con azitromicina fue negativo.
En un caso en el grupo LSIL (n.o 1), se repitió el análisis en 2 ocasiones, al mes del tratamiento con azitromicina. Tenía Mh y Up. En los 2 controles sucesivos Up persistió a pesar del tratamiento.
DiscusiónEn nuestra serie de 36 casos de ASCUS y 29 casos de LSIL, en la citología en medio líquido, encontramos VPH (+) en ASCUS en 21 casos (68,33%) y en LSIL en 20 casos (68,96%), sin diferencia significativa. Pero demuestra que con VPH (+) hay más posibilidad de mayor lesión citológica. También con VPH (+) e ITS (+), el 44,44% en ASCUS frente al 58,62% en LSIL, sin diferencia significativa.
Hubo diferencia significativa, p<0,05, en Gv en LSIL, 17,24% frente a 2,77% en ASCUS. En LSIL se encuentran más gérmenes, y más variados. Ct se halló en un caso, en ambos grupos. El más frecuente fue Up en el 36,11% en ASCUS y en el 44,82% en LSIL.
En las prácticas de higiene vaginal, se necesita educación, porque con duchas vaginales y uso de hierbas y otros agentes se interrumpe la flora vaginal natural, el pH cambia y el disturbio microbiológico favorece las infecciones vaginales. Esto se comprobó en un estudio en Haití4, donde las mujeres, en un 97%, se hacen lavados vaginales. El 11% tenía VPH-AR (+). Hay que hacer cribado y seguimiento.
En un estudio para observar cambios precancerosos e infecciones microbianas en Kenia5, en 2013-2014, con citología, microscopia y Gram en 244 mujeres, vieron inflamación cervical en 238 (97,5%) mujeres (se define la inflamación con >10 leucocitos a gran aumento). En 80 (32,8%) había infecciones: en el 77,5% Candida y en el 22,5% Trichomonas. En 12 (4,9%) hubo cambios precancerosos: 10 CIN1 (neoplasia intracervical, sigla en inglés) y 2 CIN2. Hubo un 83,3% de LSIL y un 16,7% de HSIL (lesión escamosa intraepitelial de alto grado). El uso del DIU (dispositivo intrauterino) se asociaba a la inflamación cervical. Hay que realizar citología y estudio de infecciones.
Las lesiones precancerosas se asocian a VB; en un estudio de 5 años6 se encontró VB en el 28,6%. Hay 2 tipos de VB: tipo I, disbacteriosis, hay pocos lactobacilos y muchos cocobacilos; y tipo II, hay infección por Gv, no lactobacilos y clue cells (células clave). Hubo preneoplasia en el 10,2% con VB y en el 5,7% con flora normal, p<0,001. Hubo más preneoplasia en el tipo II que en el tipo I. El pH vaginal alto predispone a persistencia de VPH, nitrosaminas y citoquinas inflamatorias alteradas.
La inflamación favorece la oncogénesis y hay infección secundaria de las células de la neoplasia. El VPH es causa necesaria, pero no suficiente. Existen cofactores7: Chlamydia, Trichomonas, Candida, VHS (virus del herpes simplex), etc. En lesiones precursoras de cáncer, hay VPH-AR (+) comparando con VPH negativo. Con VPH (+), la infección por Candida y Trichomonas no altera el riesgo de LSIL-HSIL. Pero con VPH (+) y Trichomonas, existe alto riesgo de cáncer de cérvix, no así con Candida spp. Hubo Trichomonas en el 54,7% de VPH negativo y en el 72,8% de VPH (+), p<0,001. Hubo Candida en el 23,5% con VPH negativo, y en el 28,1% con VPH (+).
En nuestra serie, solo tuvimos un caso de Trichomonas (3,44%) con LSIL. Hubo C. albicans en 5 casos de ASCUS (13,88%) frente a 2 casos en LSIL (6,89%), sin diferencias.
En un estudio de 6 años (2010-2016)8, constatan la correlación entre ASCUS, la microbiota vaginal y el VPH. Sobre 1.346 casos, había ASCUS en el 74,22% y ASC-H (atipias de las células escamosas, y no se puede descartar lesión de alto grado, sigla en inglés) en el 74,03%. En ASCUS, había VB en el 20% y 6% de Candida spp. En ASC-H, había un 25% de VB y un 5% de Candida spp. VPH-AR (+) era más frecuente con un microorganismo específico que con Candida spp. ASCUS se asocia a ausencia de inflamación o vaginosis. ASC-H se asocia a Trichomonas e infiltrado inflamatorio. VPH (+) se asocia a Candida spp con ASCUS. Se debe tratar la infección primero, porque VB es cofactor para infección por VPH.
En nuestra serie ya hemos visto que hay diferencia significativa, p<0,05, con Gv en LSIL, 17,24% frente al 2,77% en ASCUS.
En un estudio9 sobre 4.724 citologías, hubo 377 ASCUS y en 151 eran VPH (+). Sobre 56 casos de ASCUS (que eran VPH (+) en el 73,2%) hubo infección vaginal en 17 casos: Candida, 8 casos; Gv, 5 casos y Chlamydia, 3 casos. Hubo CIN2 o más, con VPH 16 (+) y con infección vaginal. También con VPH 16 (+) y VPH 18 (+), y con infección vaginal. Con ASCUS, infección vaginal y VPH (+), afecta para el desarrollo de CIN.
Respecto a los gérmenes detectados, tenemos un caso de Ct en cada grupo, sin diferencias. Pero vamos a centrarnos en los más frecuentes, los Mollicutes o Mycoplasmatales: micoplasma y ureaplasma. Los micoplasmas genitales10: Mg, Mh, Uu y Up no tienen pared celular, tienen el genoma más pequeño de los microorganismos de vida libre. La trasmisión es por contacto sexual. Son anaerobios facultativos y crecen lentamente11.
Disponen de ADN y ARN, y se reproducen por fisión binaria. Necesitan esteroles para el crecimiento. No penetran la submucosa12. Uu está en el cérvix y la vagina en el 40-80% de mujeres sexualmente activas; Mh, en el 20-50%, y Mg, en el 0-5%. La mujer tiene mayor susceptibilidad, en relación con las hormonas sexuales, ciclo menstrual, contracepción hormonal y embarazo13. Uu y Mh son comensales en el tracto genital y oportunistas en el tracto extragenital y en inmunocomprometidos. Mh aumenta en la VB, y tiene sinergia con la Gv. Muchas veces son difíciles de erradicar.
Mg produce UNG (uretritis no gonocócica) en el varón y EIP (enfermedad inflamatoria pélvica) en la mujer10,11, un cuadro más leve que con Chlamydia o Neisseria. Mh causa pielonefritis, fiebre puerperal e infección sistémica con inmunodepresión. Uu causa UNG, pielonefritis, aborto espontáneo y parto prematuro. Up es colonizador.
El diagnóstico es por amplificación de ácidos nucleicos. Hay pruebas14 de fácil uso y procesamiento para el diagnóstico seguro de ITS. Son de uso diario en el laboratorio. En una sola reacción se detectan 7 microorganismos implicados: Ct, Ng, Tv, Mh, Mg, Uu, y Up. En un estudio, con 162 muestras, se encontraron en el 60,67%: Mh, Mg, Uu y Up. El más frecuente fue Up, en el 34,08% (como en nuestra serie, 36,11% en ASCUS y 44,82% en LSIL).
Hay que realizar cribado de patógenos que causan coinfección con VPH15. En un estudio en China, VB se asoció al aumento de riesgo de VPH-AR, p<0,001. Hubo correlación de citología anormal y VPH-AR (+), p<0,001. Se halló Uu en el 35,5%. Uu es comensal y oportunista patógeno para cervicitis, uretritis, vaginitis, y tiene papel en iniciar anomalías celulares y en la persistencia viral.
Mg contribuye a la causa de cervicitis y acompaña a muchas infecciones. Mg predice cervicitis, definida con >30 leucocitos por campo de gran aumento (cga), con OR (odds ratio)=3,18. La prevalencia de Mg fue del 17,5%16. Mg se asoció a una edad inferior a 25 años (p<0,03) y a más de 2 parejas sexuales en los últimos 12 meses (p<0,03). Nosotros solo tenemos un caso de Mg, en el grupo LSIL.
La colonización genital de Uu y Mh es del 40% y 1,5-11%, respectivamente17. Los determinantes fueron: edad joven, nivel socioeconómico bajo, múltiples parejas sexuales, raza negra, y uso de ACHO (anticoncepción hormonal oral). Con Mh hubo más Gv (p<0,001), más pH>4,5 (p<0,001) y menos lactobacilos (p<0,001). Es necesario tratar la VB para evitar la colonización de Mh y Uu.
Uu y Up, ambas no causan síntomas en la mujer. Uu produce UNG en el varón. Up se dice no tiene significación clínica. O un papel desconocido, porque es difícil distinguir colonización de infección. En un estudio18 con 145 mujeres: 75 con síntomas y 70 sin síntomas, se constató que Uu y Up no tenían relación con los síntomas (leucorrea, disuria, irritación uretral, picor, lesiones genitales, dolor abdominal). Había un 89% con Up (+), 16,6% con Uu (+) y 5,5% con ambas (+). Hubo Ct+Up en el 9,7% y Mh+Up en el 6,2%.
Nosotros tuvimos un caso de Gv+Mh+Up. Un caso de Gv+Uu+Up. Un caso de Candida spp.+Mg+Mh+Uu. Y un caso de C. albicans+Ct+Mh+Up.
Up produce infección asintomática del sistema reproductor superior de la mujer e infertilidad. Se observó en 40 mujeres sin síntomas, haciendo laparoscopia y tomando muestras del líquido en el fondo del saco de Douglas19. En 5/27 infértiles había Up (+) en el 18,5%, y en 1/13 fértiles había Up (+) en el 7,7%. Con una concentración >10.000 organismos/ml se considera infección, y debe pautarse tratamiento. Con <10.000 organismos/ml se considera colonización, y no debe darse tratamiento si es en la vagina o el cérvix. Pero si fuera en el tracto superior, debe administrarse tratamiento siempre, y además tratamiento en la pareja sexual.
Up fue el microorganismo más frecuente en nuestra serie: 36,11% en ASCUS y 44,82% en LSIL. Nosotros pautamos tratamiento siempre, al estar asociado a otros gérmenes, y por la lesión citológica.
La limitación de nuestro estudio, a 4 meses de tiempo y con escaso número de casos de la patología, junto a no señalar si clínicamente padecían síntomas, obliga en el futuro a repetir el estudio con mayor número de casos, para poder distinguir si se trata de colonización o infección, y conocer el papel de las ITS en la progresión de las lesiones citológicas a cáncer de cérvix, junto al VPH.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.