Se sintetizaron muestras de silicatos de calcio, a partir de diferentes concentraciones de tetraetilortosilicato (TEOS) y mediante la metodología Pechini, asistida con intercambio iónico a base de alginato de sodio y cloruro de calcio, seguido de un tratamiento térmico a 800°C por 2h. Las muestras A, B y C, que se obtuvieron utilizando 1,7×10−3M, 3,4×10−3M y 5,1×10−3M de TEOS, respectivamente, y sin tratamiento térmico, se caracterizaron por análisis termogravimétrico (TGA) y espectroscopia infrarroja con reflectancia total atenuada (FTIR-ATR). Por otra parte, las muestras A800, B800 y C800, que se obtuvieron usando un tratamiento térmico a 800°C por 2h, se caracterizaron por FTIR-ATR, área superficial específica por la técnica de adsorción de gas nitrógeno (BET), difracción de rayos X (DRX) y por microscopia electrónica de barrido. Por espectroscopia FTIR-ATR se confirmó la presencia de enlaces Si-O-Si, indicativos de la formación de silicatos y de sílice en las muestras A800, B800 y C800. Los difractogramas indican que la muestra A800 contiene olivino (Ca2SiO4) en fase ortorrómbica y wollastonite-2M (CaSiO3); la muestra B800 presentó, además de las fases anteriores, cuarzo (SiO2) en fase hexagonal, mientras que la muestra C800, obtenida con una mayor cantidad de TEOS, presentó las fases de wollastonita-2M y larnita (Ca2SiO4).
Calcium silicates samples were synthesized using tetraethyl orthosilicate (TEOS) and by Pechini methodology assisted with ion-exchange of sodium alginate, followed by a heat treatment of 800°C by two hours. A, B and C samples were obtained using 1.7×10−3M, 3.4×10−3M and 5.1×10−3M of TEOS, respectively, and without heat treatment; these samples were characterized by thermogravimetric analysis (TGA) and infrared spectroscopy with attenuated total reflectance (FTIR-ATR). Furthermore, samples A800, B800 and C800 obtained using a heat treatment of 800° by two hours were characterized by FTIR-ATR, absorption technique (BET), X-ray diffraction (XRD) and by scanning electron microscopy. The XRD patterns indicate that sample A800 contains olivine (Ca2SiO4) in orthorhombic phase and wollastonite-2M (CaSiO3); sample B800 showed the earlier phases and quartz (SiO2), whereas sample C800 contains wollastonite phases and larnite-2M (Ca2SiO4).
Los materiales meso y macroporosos (tamaño de poro mayor de 2nm, según la IUPAC) [1] tienen uso potencial en catálisis, en la eliminación de contaminantes [2], administración de fármacos [3], adsorción, sistemas de liberación controlada [4], campos electromagnéticos y en fotoelectrónica [5], así como aplicaciones biomédicas [6]. Los silicatos de calcio con porosidad meso y macro tienen una alta demanda en la industria automotriz, en la textil, y en la cementera [7]. Los silicatos de calcio con fases como β-silicato de calcio (β-Ca2SiO4) y wollastonita (CaSiO3) son cerámicos con excelentes propiedades bioactivas, considerados como osteoconductivos y osteoinductivos, permitiendo la formación de apatita, con composición similar a la del hueso, al estar en contacto con una disolución fisiológica [8–12]. Existen 2 diferentes tipos de wollastonita: β-wollastonita (mineral en forma natural) y α-wollastonita; ambas estructuras se obtienen a temperaturas superiores de 1.125°C [13]. En 2014, Turkmen et al. [14] realizaron un estudio de wollastonita en porcelanas duras, obteniendo wollastonita a partir de 1.250°C.
Para la obtención de silicatos de calcio se utilizan diversas rutas de síntesis, como la reacción en estado sólido, métodos de precipitación [15], mecanosíntesis [16], métodos asistidos con microondas [17] y técnicas de sol-gel [18]. El método Pechini es una variante de tecnología sol-gel [19]. Este método ha sido utilizado con éxito para producir muestras de alta calidad, teniendo grandes ventajas, tales como mejor homogeneidad, temperatura y tiempos de procesamiento inferiores a los de otros métodos reportados [20]. Por otra parte, la tecnología sol-gel utiliza diversas soluciones en estado sólido empleando polvos orgánicos, tales como el alginato de sodio (ALG-Na), que puede funcionar como intercambiador iónico [21]. El ALG-Na es una sustancia química purificada obtenida de algas marinas pardas. Estas sustancias corresponden a polímeros orgánicos derivados del ácido algínico. La conformación estructural es una de las características más importantes de los alginatos, por el grupo carboxilato presente en el polímero que permite la reacción con cationes polivalentes, más específicamente con iones de calcio [22].
Recientemente se publicó la obtención de compositos de NiFe2O4 mediante intercambio iónico de ALG-Na y cloruro de calcio; sin embargo, aún no se ha estudiado esta metodología para la síntesis de silicatos de calcio.
En este trabajo se investiga sobre la síntesis de silicatos de calcio con meso y macro poros, utilizando el método Pechini, con diferentes concentraciones de TEOS (1,7×10−3M, 3,4×10−3M y 5,1×10−3M), combinado con intercambio iónico de ALG-Na y cloruro de calcio, seguido de un tratamiento térmico a 800°C por 2h.
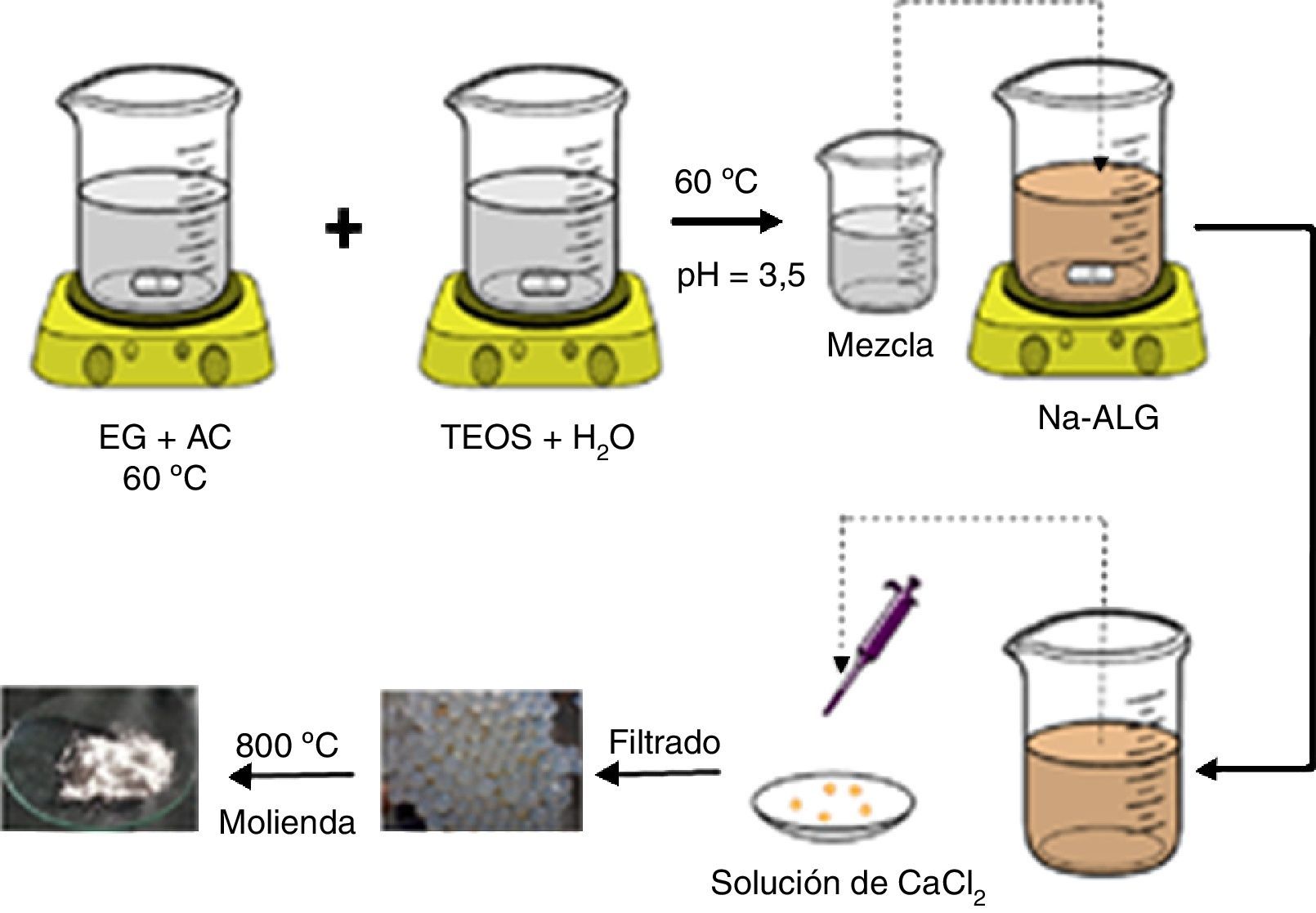
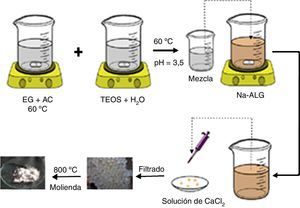
Parte experimentalSíntesisPara la obtención de silicatos de calcio por el método Pechini, primero se prepararon 3 disoluciones empleando 9,62ml de etilenglicol (EG) (Aldrich, 62,07g/mol, 99,8%), 12,8g de ácido cítrico anhidro (AC) Jalmek, 192,13g/mol, 99,5%) y 10ml de disolución acuosa de tetraetilortosilicato (TEOS) (Aldrich, 208,33g/mol, 98%) a concentraciones de 1,7×10−3M, 3,4×10−3M y 5,1×10−3M (muestras A, B y C, respectivamente). Las mezclas resultantes se dejaron bajo agitación y temperatura constante de 300rpm y 60°C, respectivamente, hasta obtener una disolución viscosa. Esta disolución viscosa se mezcló con 120ml de una disolución acuosa de 15g/l de ALG-Na (Aldrich, grado comercial) y se agitó por 5min para su homogenización, a una temperatura de 60°C. Esta disolución resultante (TEOS-EG-AC/ALG-Na) se goteó con ayuda de una micropipeta de 1μl sobre 1l de disolución de cloruro de calcio al 1% (CaCl2.2H2O, Jalmek, 147,02g/mol, 99%), obteniéndose inmediatamente la formación de esferas de alginato de calcio-TEOS (TEOS-EG-AC/ALG-Ca). La separación de las esferas de la disolución de CaCl2 se realizó por filtración utilizando un filtro de nylon, y se lavó con agua desionizada; posteriormente, las muestras se secaron en una estufa a 60°C por 24h. Las muestras así obtenidas A, B y C difieren en la cantidad de TEOS utilizado para su síntesis. También se preparó una muestra de EG-AC/ALG-Ca (denominada Blanco), siguiendo el mismo procedimiento, pero sin usar TEOS, con fines comparativos.
Para la obtención de silicatos de calcio, las 3 muestras A, B y C se sometieron a un tratamiento térmico de 800°C por 2h, en aire; a las muestras tratadas térmicamente se les denominó A800, B800 y C800. En la figura 1 se muestra un diagrama esquemático del procedimiento utilizado para la síntesis de silicatos de calcio.
CaracterizaciónLas muestras A, B, C, A800, B800 y C800 obtenidas se analizaron por espectroscopia infrarroja con transformada de Fourier, con reflectancia total atenuada (FTIR-ATR), marca Perkin Elmer, modelo Spectum GX. Para la caracterización térmica de las muestras A, B y C, se empleó un analizador termogravimético TGA-50 de marca Shimadzu; el análisis de las muestras se llevó a cabo en aire, desde temperatura ambiente hasta 800°C, con una velocidad de calentamiento de 10°C/min. Las muestras A800, B800 y C800 obtenidas después del tratamiento térmico fueron caracterizadas por difracción de rayos X (DRX), usando un equipo marca Siemens, modelo D-5000; los patrones de DRX se obtuvieron empleando radiación CuKα (λ=1,54 A˙), con un rango de barrido de 10 a 80° en la escala 2θ, y a una velocidad de 0,02°C/s. El área superficial específica de las muestras A800, B800 y C800 se calculó a partir de las isotermas Brunauer-Emmet-Teller (BET), obtenidas con un analizador de adsorción de gas nitrógeno, marca Beckman Coulter, modelo SA3100. Las muestras fueron previamente desgasificadas a 300°C y la adsorción de nitrógeno se realizó a –195,8°C. La morfología de estas muestras se analizó por microscopia electrónica de barrido, utilizando un microscopio marca Philips, serie XL30ESEM, con voltaje de 30kV.
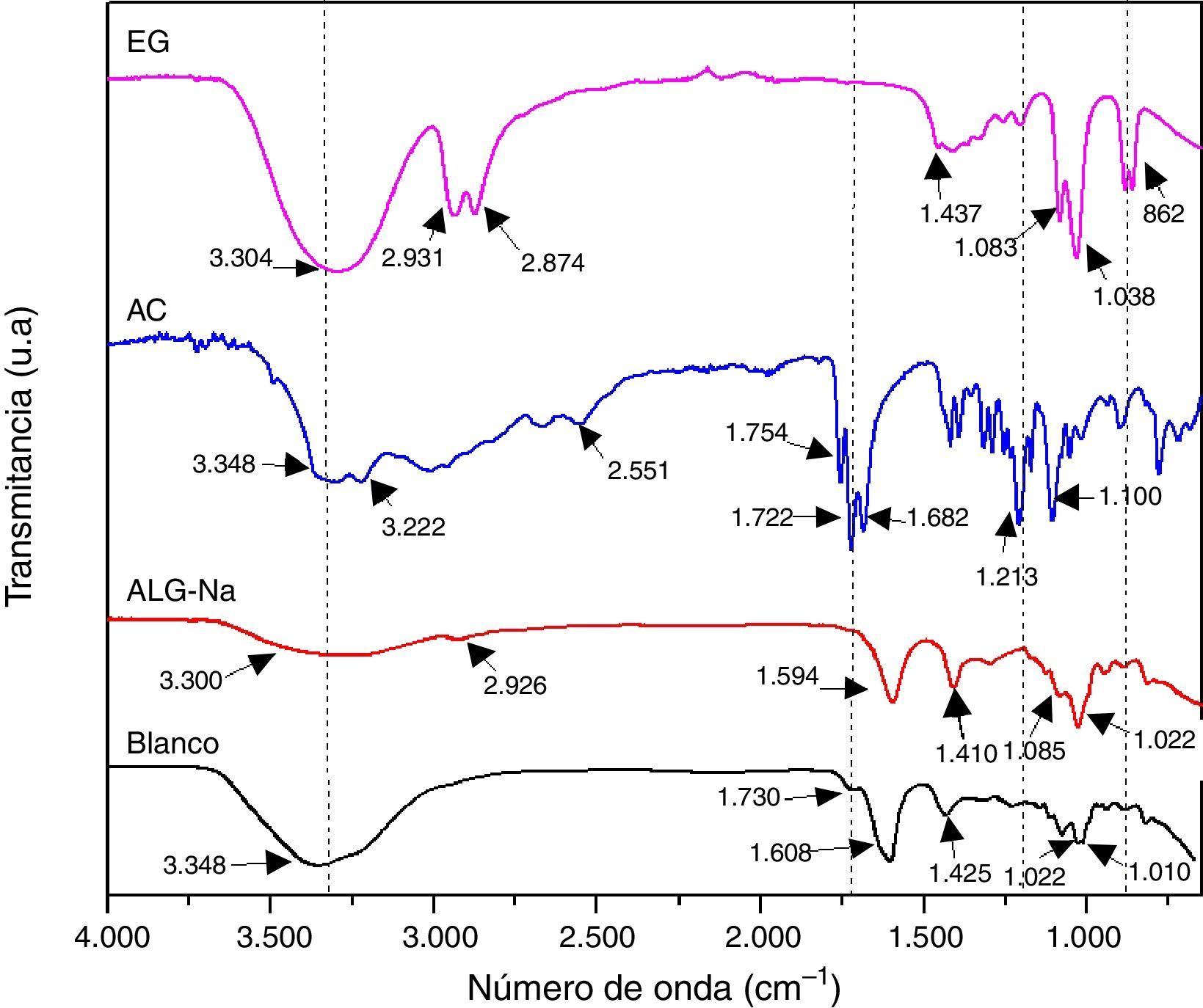
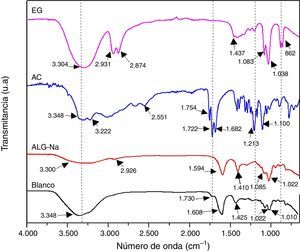
Resultados y discusiónCon la finalidad de determinar si existe la formación de alginato de calcio (ALG-Ca) en la muestra Blanco, en la figura 2 se compara su espectro infrarrojo con el espectro del reactivo ALG-Na y se incluyen los espectros infrarrojos del AC y del EG que se utilizaron en su preparación. Se observa que los espectros de ambas muestras, ALG-Na y ALG-Ca son similares; la muestra Blanco presenta en 3.348cm−1 una banda que corresponde al modo vibracional del enlace O-H y es notorio que su intensidad es mayor que la banda del espectro del ALG-Na. El espectro del EG presenta las bandas características del estiramiento O-H a 3.304cm−1 y del estiramiento de C-H en 2.931 y 2.874cm−1 de los grupos –CH2 y –CH3; como puede observarse en el espectro FTIR de la muestra Blanco, no hay presencia de estas bandas. El espectro del AC presenta las bandas de absorción del estiramiento O-H del grupo O=C-OH en 3.348 y 3.222cm−1. En el espectro de la muestra Blanco es difícil de distinguirlos debido a lo ancho de la banda de absorción en la región de 3.650 a 3.000cm−1. Otras bandas característica del AC son las correspondientes al estiramiento de C=O del grupo carbonilo en 1.754 y 1.722cm-1; la molécula del AC también presenta bandas de absorción de la tensión C-O en 1.213cm−1 y de la flexión C-O-H en 1.100cm−1. Se observa que el espectro del Blanco no presenta las bandas del estiramiento C-H de los grupos–CH2 y –CH3, lo que indica que no contiene EG, o por lo menos no lo contiene en cantidades detectables por esta técnica; en el espectro del Blanco también se observa una pequeña banda en 1.730cm−1 que corresponde al modo de tensión del C=O del grupo carboxílico de la molécula del AC, aunque está desplazada con respecto a las que presentan su espectro en 1.752 y 1.722cm−1[23]. Por lo anterior, el espectro FTIR de la muestra Blanco corresponde a un ALG-Ca, que contiene una pequeña cantidad de agua que no se eliminó durante el secado, y también contiene una pequeña cantidad de AC (que no se eliminó durante el lavado), esto último en base a la banda de absorción ancha en la región de 3.650 a 3.000cm−1 y a la pequeña banda en 1.730cm−1. A continuación se discute a mayor detalle sobre el tipo de complejo formado entre el alginato y el calcio.
Castro y Eceiza realizaron un estudio de obtención de fibras de alginato con metales polivalentes, los caracterizaron por espectroscopia infrarroja y sugirieron hacer una diferencia entre las bandas (Δν) de absorción asociadas a las vibraciones de –COOasim y –COOsim para determinar el tipo de interacción entre el alginato y el catión metálico; específicamente sugirieron que si no hay diferencia notable entre el valor Δν del ALG-M, entonces el complejo formado entre el alginato y el ión metálico (M) es del tipo bidentado [24]. El espectro infrarrojo de la muestra Blanco presenta las bandas ubicadas en 1.608 y 1.425cm−1 que corresponden a las vibraciones de –COOasim y –COOsim, respectivamente, dando un Δν de 183, y por otra parte, el espectro del ALG-Na presenta estas bandas en 1.594 y 1.410cm−1, dando una diferencia de 184; por lo tanto, el complejo formado entre el alginato y el calcio es del tipo bidentado (muestra Blanco). Los espectros del ALG-Na y del Blanco también presentan bandas localizada en 1.083 y 1.022cm−1 (ALG-Na), y en 1.022 y 1.010cm−1 (Blanco), que se deben al estiramiento asimétrico y de flexión de C-O [25].
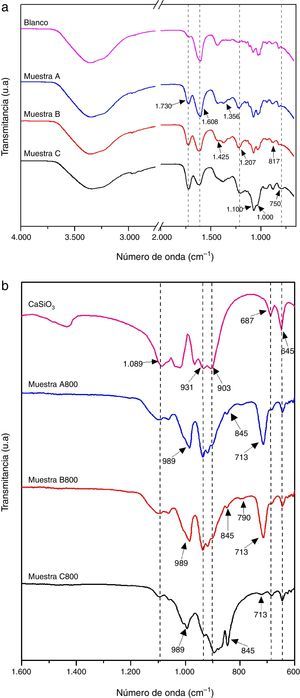
En la figura 3a se presentan los espectros infrarrojos de las muestras A, B y C, obtenidas antes del tratamiento térmico; con fines comparativos se incluye el espectro de la muestra Blanco. Se observa a simple vista que todos los espectros presentan las bandas características del alginato, y también la banda en 1.730cm−1 atribuida al carboxilato (COO−) que proviene del AC. En los espectros de las muestras A, B y C, la intensidad de la banda del carboxilato a 1.730cm−1 incrementa conforme se aumenta la concentración del TEOS que se utilizó para su síntesis; esto sugiere que existe interacción del COO− con el metal, en este caso el silicio, y que tal interacción es mayor al haber una mayor cantidad de silicio. El espectro de la muestra Blanco presenta la banda simétrica de COO− referente al ALG-Na en 1.425cm-1, mientras que los espectros de las muestras A, B y C presentan además otras bandas de ALG-M a números de onda menores. Los espectros de las muestras A, B y C presentan bandas a 1.207 y a 871cm−1 que corresponden a vibraciones del enlace Si-C del TEOS hidrolizado, aunque la banda en 871cm-1 también se atribuye al grupo carbonato. La aparición de la banda ancha entre 1.000 y 1.100cm−1 puede ser atribuida a varias absorciones traslapadas de estiramientos simétricos y asimétricos de Si-O-Si y Si-O-C [26].
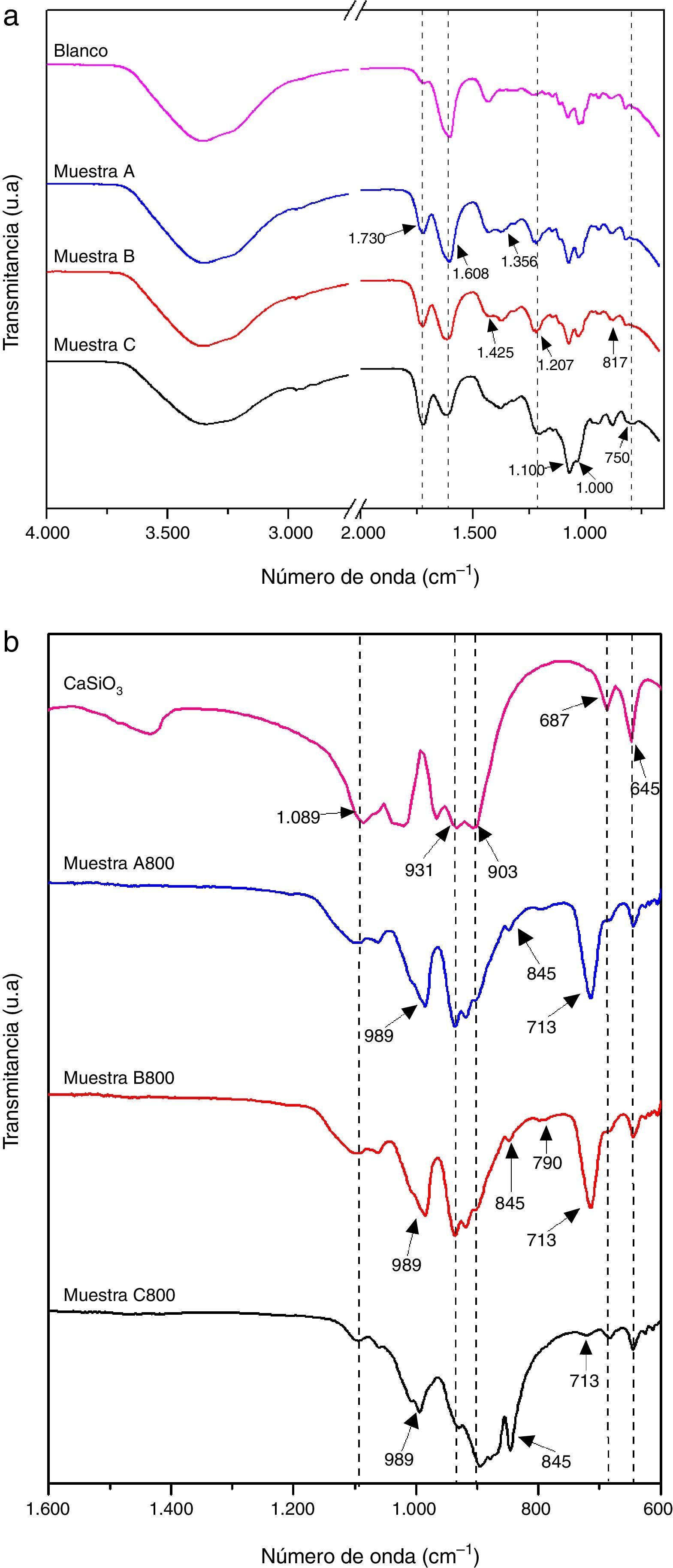
En la figura 3b se presentan los espectros de las muestras A800, B800 y C800 que se obtuvieron a partir de las muestras A, B y C, respectivamente, tratándolas térmicamente a 800°C por 2h. Con fines de comparación se incluye el espectro de wollastonita, el cual se obtuvo de la base de datos del National Institute of Standards and Technology (NIST) [27]. Los espectros de las 3 muestras presentan las bandas de absorción características de los silicatos entre 1.100 a 670cm−1. Se observan bandas asociadas a las vibraciones asimétricas de Si-O (850-1.090cm−1) del grupo SiO4[28,29], y bandas correspondientes al estiramiento de Si-O-Si en 670-744cm−1[30]. Los espectros de las muestras A800 y B800 son muy similares, en cambio el espectro de la muestra C800, que se obtuvo con la mayor cantidad de TEOS, es diferente, pues la región en la que se presentan las bandas de absorción características de los silicatos es más amplia; en el espectro de esta muestra C800 está presente el silicato de calcio tipo wollastonita, y muy posiblemente otros tipos de silicato de calcio. En esta figura también se observa que los espectros de las 3 muestras presentan una banda de absorción en 713cm−1 correspondiente a Si-O-Si, y que es de menor intensidad en el espectro de la muestra C800, lo cual sugiere que esta muestra contiene más de un tipo de silicato de calcio y posiblemente también contiene sílice. La presencia de sílice en la muestra C800 es muy probable debido a que se utilizó una mayor cantidad de TEOS para su síntesis.
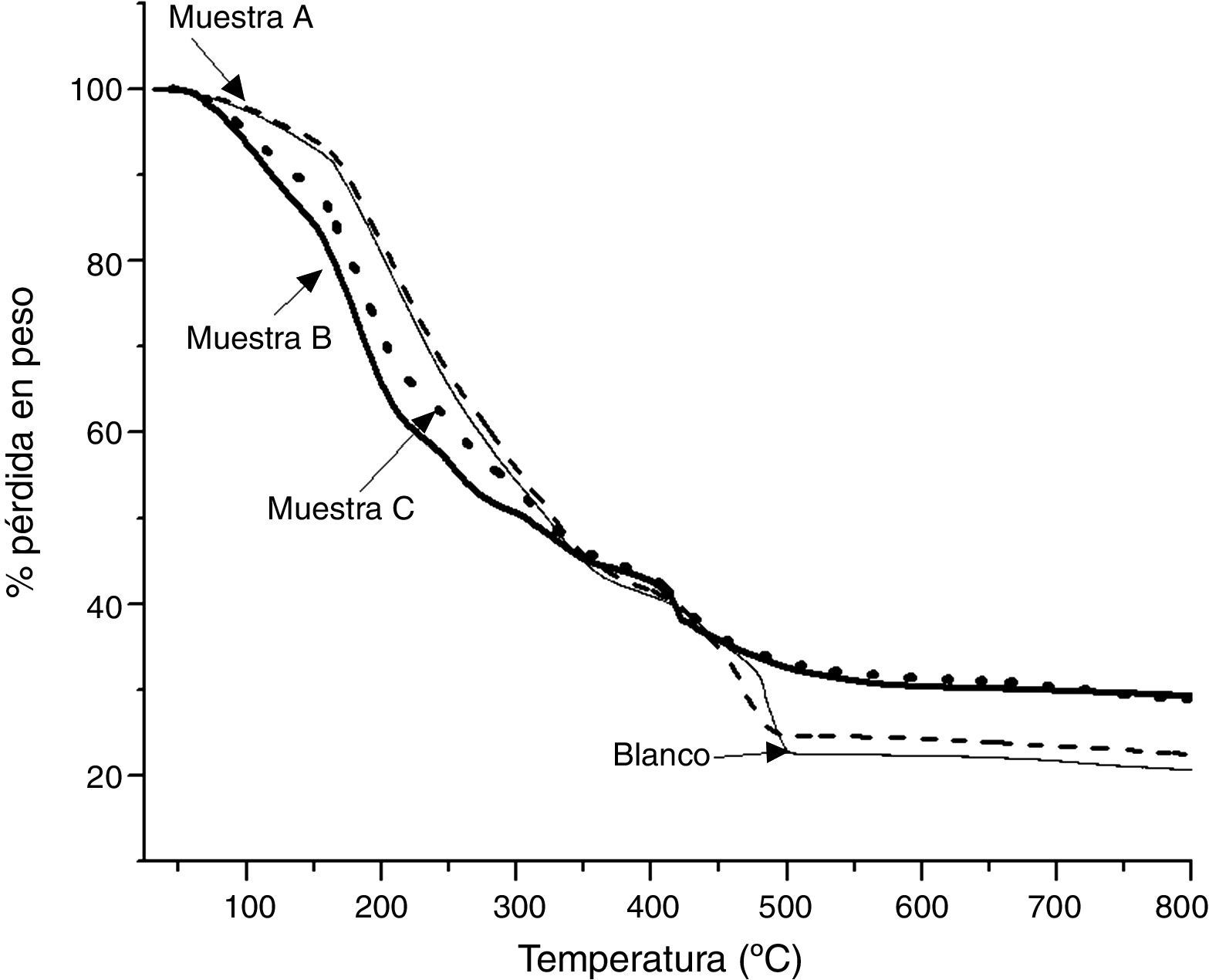
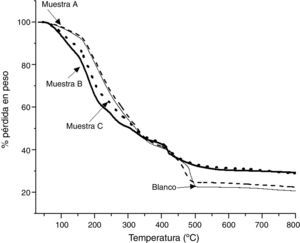
Con el objetivo de caracterizar térmicamente a las muestras obtenidas, se realizó un análisis termogravimétrico. En la figura 4 se presentan los termogramas de las muestras A, B, y C antes de ser sometidas al tratamiento térmico, y con fines comparativos se incluye el termograma de la muestra Blanco (muestra obtenida sin adición de TEOS). En todos los termogramas se presenta una ligera pérdida en peso a partir de los 50°C, la cual corresponde a la pérdida de disolventes presentes en las muestras; posteriormente se presenta una pérdida de casi un 50% para cada muestra, desde 165 a 350°C, que se atribuye a la ebullición y posterior descomposición del EG y del AC [31], y también se suma la pérdida de agua estructural. La siguiente etapa de pérdida en peso tiene lugar de 350 a 500°C para todas las muestras, y se debe a la descomposición del ALG-Ca [32], dando como resultado la formación de óxido de calcio; al seguir aumentando la temperatura se observa que las muestras B y C ya no presentan pérdidas significativas de masa a partir de 600°C, aproximadamente. El ALG-Ca (Blanco) presenta un termograma muy similar al de las muestras A, B y C, pero las pérdidas en peso en las regiones de 350 a 500°C y de 600 a 800°C son más parecidas a la que presenta la muestra A, la cual se sintetizó con una menor cantidad de TEOS. Estos resultados sugieren que el ALG-Ca se transforma a óxido de calcio (CaO), el cual participa en la reacción con la sílice (SiO2) para formar silicatos de calcio. La diferencia en la pérdida de peso de las muestras Blanco, A, B y C, en particular en la región de 350 a 500°C, se debe muy posiblemente a la cantidad de óxido de calcio que se forma a partir del ALG-Ca, ya que la muestra Blanco, al no contener sílice (puesto que no se utilizó TEOS en su obtención), todo el ALG-Ca se transformó en óxido de calcio, mientras que en las muestras A, B y C la cantidad de óxido de calcio es menor, ya que también contenían sílice, resultando en una menor pérdida en peso asociada con esta transformación.
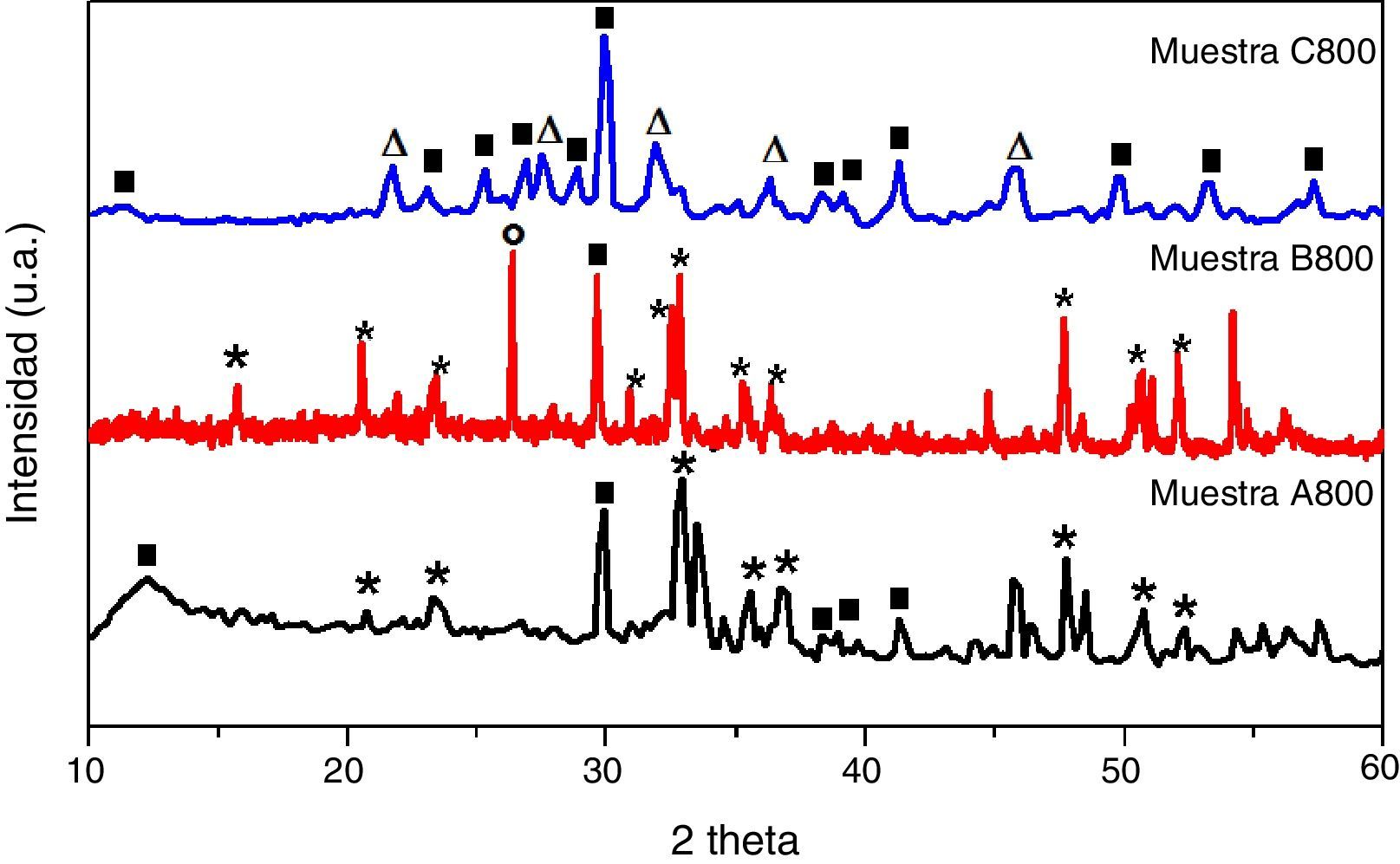
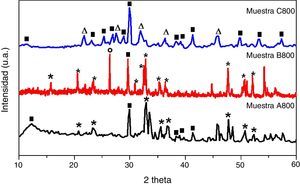
Los patrones de DRX de las muestras obtenidas después del tratamiento térmico a 800°C se presentan en la figura 5. El difractograma de la muestra A800 contiene olivino (Ca2SiO4) en fase ortorrómbica (ICCD 00-080-0941) y wollastonite-2M (CaSiO3) (ICCD 00-076-0925) que cristalizó en fase monoclínica. Con el incremento del contenido de TEOS (muestra B800), los picos de la fase de olivino son más intensos, y además de la presencia de wollastonita-2M, también está presente el cuarzo (SiO2) en fase hexagonal (ICCD 00-088-2487). La muestra C800, obtenida con una mayor cantidad de TEOS, contiene las fases cristalinas referentes a wollastonita-2M y larnita (Ca2SiO4) de forma monoclínica (ICCD 00-077-0409). Los difractogramas de las muestras A800, B800 y C800 indican que la cantidad de TEOS utilizada en su síntesis afecta en el tipo de silicato que se forma, y también en la presencia de impurezas; tales impurezas podrían tener un efecto positivo en este tipo de materiales si se las utiliza como biomateriales, ya que tanto los silicatos como la sílice son bioactivos.
Los resultados presentados en las figuras 2-5 indican que existe un intercambio entre el ALG-Na y el cloruro de calcio, dando lugar a la formación de ALG-Ca, mismo que durante el tratamiento térmico se transforma en óxido de calcio (Blanco), y si la sílice está presente, reaccionan para formar silicatos de calcio con diferentes formas cristalinas (muestras A800, B800 y C800). El tratamiento térmico a 800°C por 2h dado a las muestras A, B y C fue suficiente para que la sílice y el óxido de calcio (originado durante el tratamiento térmico) reaccionaran y formaran silicatos de calcio.
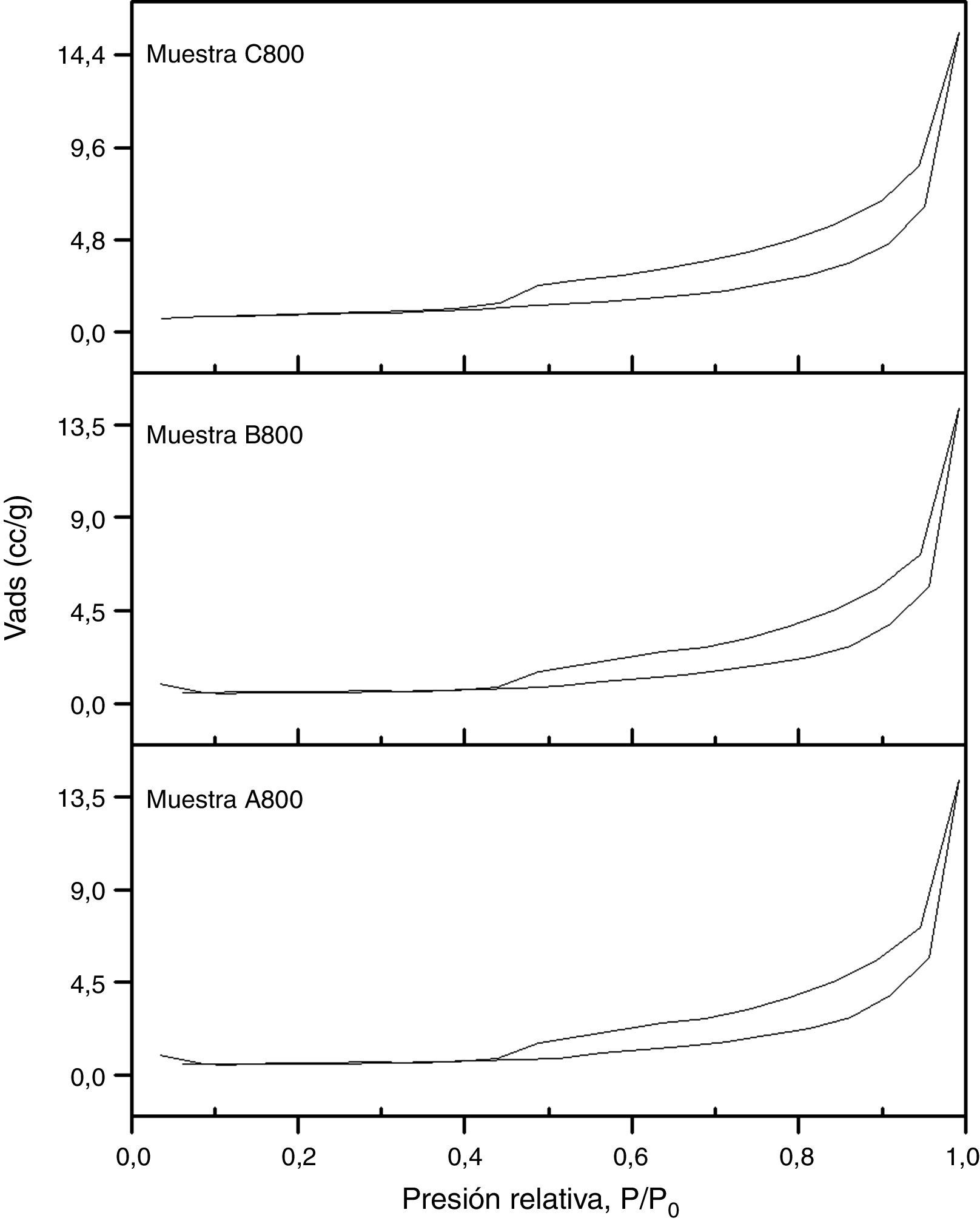
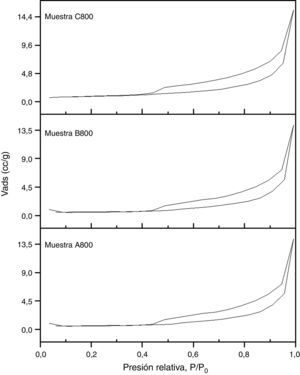
En la figura 6 se presentan las isotermas de adsorción-desorción de nitrógeno de las muestras A800, B800 y C800. Los valores de área superficial específica de las muestras A800, B800 y C800 son de 6,3, 5,9 y 5,1 m2g−1, respectivamente, los cuales fueron determinados por el modelo BET. El valor del área superficial específica disminuye con la cantidad de TEOS que se utilizó para la síntesis, ya que la cantidad de TEOS afectó intensamente en el tipo de fases de silicato presentes en cada muestra. La disminución en el área superficial específica también se debe a una disminución en el tamaño y volumen de poro.
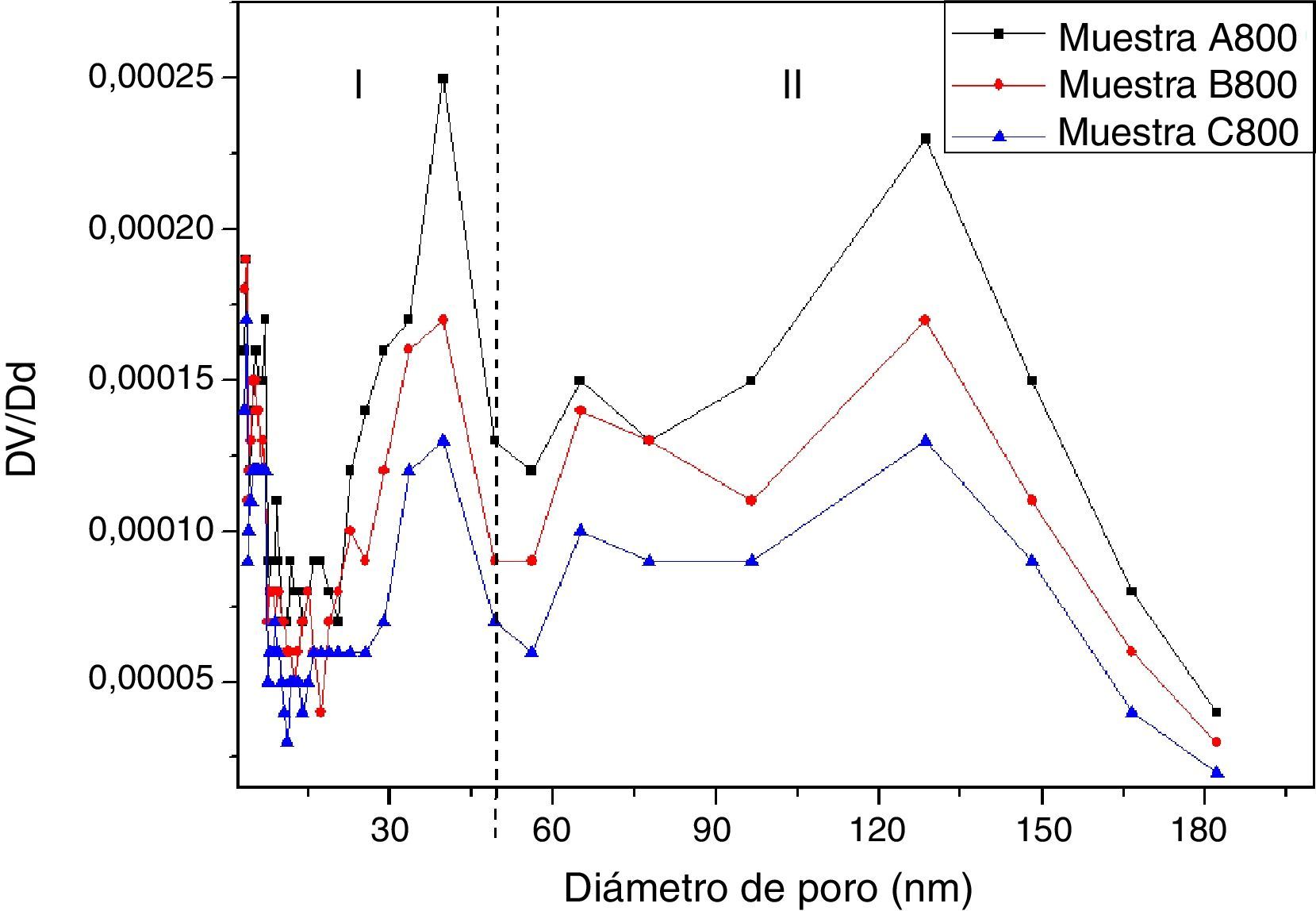
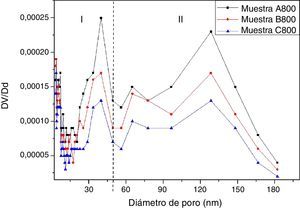
En la figura 7 se presenta la distribución de tamaño de poro de las muestras A800, B800 y C800, la cual se calculó mediante el modelo Barret-Joyner-Halenda (BJH), utilizando los datos de la isoterma de desorción (fig. 6). La región I corresponde al rango de tamaño de mesoporos y la región II corresponde al rango de tamaño de los macroporos presentes en las muestras. Las 3 muestras contienen tanto mesoporos como macroporos. La muestra con mayor cantidad de macroporos y mesoporos es la A800, que se sintetizó utilizando una menor cantidad de TEOS, y que es la que contiene solo las fases cristalinas de olivino y wollastonita-2M. La muestra C800 tiene menor área superficial específica y, por lo tanto, menor volumen de poro, y a su vez menor cantidad de mesoporos y macroporos.
En la figura 8 se presentan las micrografías obtenidas por microscopia electrónica de barrido de las muestras A800, B800 y C800. Se observa la presencia de partículas sinterizadas y la presencia de poros, los cuales son más grandes en la muestra C800; la presencia de poros grandes en esta muestra justifica su bajo valor de área superficial específica. En la microfotografía de la muestra C800 también se observa que contiene fases cristalinas de forma tipo aguja, lo cual coincide con los resultados obtenidos por Abd Rashid et al. para la wollastonita [13].
ConclusionesSe sintetizaron silicatos de calcio con una nueva metodología, haciendo una modificación en el método Pechini, utilizando diferentes concentraciones de TEOS y con intercambio iónico de ALG-Na en disolución salina de CaCl2, obteniendo diferentes fases de CaSiO3 y Ca2SiO4, a una temperatura de 800°C por 2h. Por espectroscopia FTIR se confirma la formación de enlaces Si-O-Si, indicativos de la formación de silicatos y de sílice. Los difractogramas de las muestras obtenidas indican que la muestra A800 contiene olivino (Ca2SiO4) en fase ortorrómbica y wollastonite-2M (CaSiO3); la muestra B800 presentó, además de las fases anteriores, cuarzo (SiO2) en fase hexagonal, mientras que la muestra C800, obtenida con una mayor cantidad de TEOS, presentó las fases de wollastonita-2M y larnita (Ca2SiO4).
El valor de área superficial específica de las muestras A800, B800 y C800 disminuye con el incremento de la concentración de TEOS utilizada para su síntesis, lo cual se debe a la diferencia de porosidad y al tipo de fases de silicato formadas, así como a la presencia de otras fases; la muestra A800 contiene una mayor cantidad de mesoporos y solamente contiene olivino (Ca2SiO4) y wollastonita-2M (CaSiO3).
Los autores agradecen al Consejo Nacional de Ciencia y Tecnología (CONACYT), quien financió este proyecto. Katya A. Flores-Garay agradece al CONACYT la beca otorgada para sus estudios de doctorado.