El aneurisma de la aorta abdominal (AAA) constituye una patología de alta mortalidad. En España, en atención primaria, no hay un programa de cribado implantado actualmente.
ObjetivosEvaluar la utilidad de la ecografía en la detección del AAA en la población de riesgo en atención primaria. Posteriormente, identificar a los sujetos cuyo riesgo vascular (RV) debe reclasificarse y determinar si el AAA se asocia a la presencia de placa carotídea y otros factores de riesgo.
Material y métodosEstudio descriptivo transversal, multicéntrico nacional en atención primaria. Se realizó una selección consecutiva de varones hipertensos de entre 65-75 años, fumadores o exfumadores; o mayores de 50 años de ambos sexos con antecedentes familiares de AAA.
MedicionesSe valoró el diámetro de la aorta abdominal y arterías iliacas, así como la detección de placa aterosclerótica aórtica abdominal y carotídea. Se calculó el RV inicialmente y tras las pruebas (SCORE).
ResultadosSe analizaron 150 pacientes (edad: 68,3±5 años; 89,3% varones). El RV inicial era alto/muy alto en 55,3%. Se detectó AAA en 12 personas (8%; intervalo de confianza [IC] 95%: 4-12); ectasia aórtica en 13 (8,7%); placa aórtica abdominal en 44% y placa carotídea en 62% de los participantes. Se reclasificó el RV en 50% de los sujetos. La detección de AAA o ectasia se asoció a la presencia de placa carotídea, tabaquismo actual y lipoproteína (a) (Lp[a]), p<0,01.
ConclusionesLa prevalencia de AAA en pacientes con RV es elevada. La ecografía en atención primaria permite detectar esta patología y la aterosclerosis subclínica y consecuentemente reclasificar el RV, demostrando su utilidad en el cribado de AAA en población de riesgo.
Abdominal aortic aneurysm (AAA) constitutes a pathology with high mortality. There is currently no screening program implemented in primary care in Spain.
ObjectivesTo evaluate the usefulness of ultrasound in the detection of AAA in the at-risk population in primary care. Secondarily, to identify subjects whose vascular risk (VR) should be reclassified and to determine whether AAA is associated with the presence of carotid plaque and other risk factors.
Material and methodsCross-sectional, descriptive, multicenter, national, descriptive study in primary care.
SubjectsA consecutive selection of hypertensive males aged between 65 and 75 who are either smokers or former smokers, or individuals over the age of 50 of both sexes with a family history of AAA. Measurements: Diameter of abdominal aorta and iliac arteries; detection of abdominal aortic and carotid atherosclerotic plaque. VR was calculated at the beginning and after testing (SCORE).
ResultsOne hundred and fifty patients were analyzed (age: 68.3±5 years; 89.3% male). Baseline RV was high/very high in 55.3%. AAA was detected in 12 patients (8%; 95% CI: 4–12); aortic ectasia in 13 (8.7%); abdominal aortic plaque in 44% and carotid plaque in 62% of the participants. VR was reclassified in 50% of subjects. The detection of AAA or ectasia was associated with the presence of carotid plaque, current smoking and lipoprotein(a), p<0.01.
ConclusionsThe prevalence of AAA in patients with VR is high. Ultrasound in primary care allows detection of AAA and subclinical atherosclerosis and consequently reclassification of the VR, demonstrating its utility in screening for AAA in the at-risk population.
El aneurisma de la aorta abdominal (AAA) se caracteriza por la dilatación de esta arteria, con un diámetro mayor o igual a 3cm. Más de 90% se localizan en la porción distal, por debajo de las arterias renales. Es una patología grave, con una prevalencia en mayores de 65 años de entre 5-8% en hombres y 2% en mujeres. Está muy relacionada con la aterosclerosis, con perfiles de riesgo parecidos; su desarrollo implica un proceso multifactorial que conduce a la destrucción del tejido conectivo de la pared aórtica. El tabaquismo es el factor de riesgo más relevante, otros que influyen son la edad, la hipertensión y los antecedentes familiares de AAA. Su historia natural se distingue por una primera fase asintomática de duración prolongada. Así, 70-75% de los AAA son asintomáticos, detectándose fortuitamente en la exploración clínica o en pruebas de imagen realizadas por otros motivos1–6. La rotura del AAA es la complicación más grave, y se relaciona directamente con su tamaño y velocidad de crecimiento. El tratamiento de la rotura es siempre quirúrgico, ya que, sin la intervención, todos los pacientes fallecerían por shock hemorrágico; la mortalidad quirúrgica de la rotura de aneurisma oscila entre 50-80%. Actualmente, se recomienda su detección precoz, el seguimiento del crecimiento y la reparación quirúrgica programada en los sujetos con diámetro mayor de 5,5cm en varones; de 5cm en mujeres; o con un incremento de tamaño mayor de 0,5cm en seis meses1–3,7,8.
La ecografía de abdomen es el método de elección, tanto para el diagnóstico como para el seguimiento de los AAA; se considera una buena herramienta de cribado en la población de riesgo, con una sensibilidad diagnóstica de 95% y una especificidad de 100%. La ecografía además de identificar el AAA, permite la detección de la ectasia aórtica (diámetro de entre 25-29,9mm) y la aterosclerosis subclínica (carga de placa carotídea o femoral) contribuyendo a una mejor clasificación del riesgo vascular (RV)5,9–11. En este contexto, en el estudio ARIC (Atherosclerosis Risk In Communities), se observó que los sujetos con placa carotídea aumentaban 31% el riesgo de desarrollar AAA clínico incidente, sugiriendo que la detección de placa carotídea podría considerarse como un marcador de riesgo para la formación de un AAA12. En el mismo sentido, algunos estudios consideran la ectasia como un marcador de RV y de desarrollo de AAA13–16.
El cribado sistemático de AAA con ecografía estaría indicado en la población mayor de 65 años, de sexo masculino y con antecedentes de hábito tabáquico o tabaquismo activo, nivel de evidencia IA. También en mayores de 50 años, hombres y mujeres, con antecedentes familiares de primer grado de AAA2,3,7,8,17,18. Algunos países, como Inglaterra, Suecia, Dinamarca, Italia y EE. UU., han implantado programas de cribado en la población de riesgo que han demostrado ser eficaces y coste-efectivos3,5,17,19,20.
En España, en el momento actual, no existe un programa de cribado implantado en atención primaria. Se han efectuado estudios de cribado; algunos estaban limitados a un solo centro21–23; y otros multicéntricos se realizaron en el ámbito hospitalario, o no son recientes14,24–26.
El objetivo de este estudio fue evaluar la utilidad de la ecografía en la detección de AAA en la población de riesgo en atención primaria. De manera secundaria, se propuso identificar a los sujetos cuyo RV debe reclasificarse y determinar si el AAA se asocia a la presencia de placa carotídea y de otros factores de riesgo.
Material y métodosDiseñoSe trata de un estudio descriptivo transversal multicéntrico a nivel nacional, no aleatorizado; realizado en atención primaria (seis centros de salud de cinco comunidades autónomas). Los investigadores fueron médicos de familia, con disponibilidad de ecógrafo en su centro y experiencia en su uso.
SujetosSe realizó una selección consecutiva, no probabilística, de los pacientes atendidos en consulta (durante 12 meses: junio 2022-junio 2023) que cumplieron con los criterios de inclusión siguientes: varones hipertensos de entre 65-75 años; fumadores o exfumadores; o mayores de 50 años de ambos sexos con antecedentes familiares de primer grado de AAA, en situación de prevención primaria o secundaria y que firmaron el consentimiento informado. Los criterios de exclusión fueron: personas previamente diagnosticadas de AAA; con deterioro cognitivo moderado-grave; con condiciones clínicas que desaconsejaban a criterio médico su inclusión y que manifestaron rechazo a participar. Se estimó una muestra aproximada de 156 para una prevalencia esperada de AAA de 8% en sujetos de riesgo; con un intervalo de confianza (IC) del 95%, una precisión de 4,5% y un porcentaje de pérdidas de 10%.
Obtención de datosSe recogió la información registrada en la historia clínica y mediante anamnesis, exploración física, analítica y ecografías vascular abdominal y carotídea. Los datos se introdujeron en una base electrónica centralizada, codificada y con filtro de errores creada en la plataforma REDCap (Research Electronic Data Capture), desarrollada por la Universidad Vanderbilt, EE. UU.
Para la definición de diagnósticos y variables se siguieron las recomendaciones de la Sociedad Española de Arteriosclerosis (SEA) sobre los estándares en riesgo cardiovascular27.
Variables principales o resultadoMediante la realización de una ecografía abdominal, se determinó el diámetro de la aorta abdominal, de las arterías iliacas y la existencia de placa de ateroma en cualquiera de las secciones. La exploración se efectuó en decúbito supino y utilizando una sonda convex de baja frecuencia, entre 3,5 y 5MHz. Se llevaron a cabo mediciones en la aorta proximal, medial y distal a nivel de la bifurcación en las iliacas. Se registró el máximo diámetro en el corte transversal desde las paredes más externas de la aorta. Se consideró AAA un diámetro de la aorta abdominal ≥ 3cm o de la iliaca ≥ 1,5cm; y ectasia aórtica un diámetro de la aorta de 25-29,9mm2,3.
Para valorar la existencia de placa carotídea, se realizó la ecografía con una sonda lineal de banda ancha de 7-10MHz; con el paciente en decúbito supino con la región cervical extendida. Se exploraron ambas carótidas buscando la presencia de placas en la carótida común, el bulbo carotídeo y las arterias interna y externa, al menos en tres ángulos de incidencia (anterior, lateral y posterior)2,3, considerándose como placa un engrosamiento focal del grosor íntima-media (GIM) ≥ 1,5mm27.
Variables independientesLas variables sociodemográficas fueron la edad y el sexo, mientras que las clínicas fueron los antecedentes familiares de primer grado de AAA o de enfermedad cardiovascular (ECV) precoz, tabaquismo actual o pasado (cuantificado en paquetes/año), actividad física (mediante el cuestionario Physical Activity Guidelines for Americans), índice de masa corporal (IMC), perímetro abdominal, presencia de diabetes, dislipemia, hipertrofia ventricular izquierda o ECV (cardiopatía isquémica, insuficiencia cardiaca, enfermedad cerebrovascular, arteriopatía periférica o enfermedad renal).
Determinaciones analíticasSe realizó una analítica sistemática de rutina, con perfil lipídico completo y la inclusión de posibles biomarcadores serológicos: microalbuminuria (cociente albúmina/creatinina: mg/g), filtración glomerular (FG) estimada según la fórmula Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) (FG: mL/min/1,73 m2), glicohemoglobina A1c (HbA1c), colesterol total (CT), colesterol de lipoproteínas de baja densidad (c-LDL), colesterol de lipoproteínas de alta densidad (c-HDL), colesterol no HDL (c-no-HDL), triglicéridos (TG), apolipoproteína B (ApoB), apolipoproteína A1 (ApoA1), lipoproteína (a) (Lp[a]), dímero-D y proteína C reactiva ultrasensible (PCRus). Se consideró que presentaban dislipemia aterogénica si obtenían valores de TG ≥ 150mg/dL y c-HDL bajo (< 40mg/dL en hombres y <50mg/dL en mujeres). Se calculó el RV de cada paciente inicialmente y tras las pruebas, mediante las tablas SCORE (Systematic Coronary Risk Evaluation) para los países de bajo riesgo y las guías europeas27,28.
Se guardó una copia digital de las imágenes ecográficas codificadas, para su revisión durante la duración del estudio. Los médicos de familia participantes acreditaron la formación en ecografía vascular. Además, se realizó un pilotaje previo con una muestra de sujetos para valorar el grado de concordancia entre las medidas efectuadas por los investigadores (mediante el coeficiente de correlación intraclase) obteniendo una concordancia excelente (0,93; IC 95%: 0,7-0,9).
Confirmación diagnósticaLos casos detectados y dudosos se consultaron con la radióloga del equipo, que realizó una ecografía en el Servicio de Radiodiagnóstico. Los casos confirmados de AAA se derivaron al Servicio de Cirugía Vascular de referencia para su valoración y seguimiento.
Análisis estadísticoSe realizó un análisis descriptivo para las variables cualitativas (frecuencias absolutas y porcentajes) y cuantitativas (medias, desviaciones estándares [DE] y rangos). Se comprobaron las condiciones de normalidad de las variables cuantitativas con la prueba de Shapiro Wilks y la homogeneidad de varianzas mediante el test de Levene. Posteriormente, se llevó a cabo un análisis bivariado: prueba X2 para contrastar proporciones (o F de Fisher, según las condiciones); t de Student (o U de Mann-Whitney, su equivalente no paramétrico) y análisis de la varianza (ANOVA) para la comparación de medias. Finalmente, se ajustó un análisis multivariante (regresión logística, método paso a paso Wald) incluyendo en el modelo las variables con p <0,10 en el análisis bivariado y las de relevancia clínica según los investigadores, tomando como variable dependiente la presencia o ausencia de AAA y ectasia aórtica (SPSS 26.0, IBM Corp., Armonk, Nueva York, EE. UU.).
Consideraciones éticasEl estudio fue aprobado por el Comité Ético de Investigación (CEI) de Málaga (acta 12/2021) y los CEI locales. Se siguieron las recomendaciones de la Declaración de Helsinki y las Guías de Buena Práctica Clínica. Se informó del estudio y se solicitó su colaboración a los Servicios de Radiodiagnóstico y Cirugía Vascular de referencia. Todos los participantes firmaron el consentimiento informado.
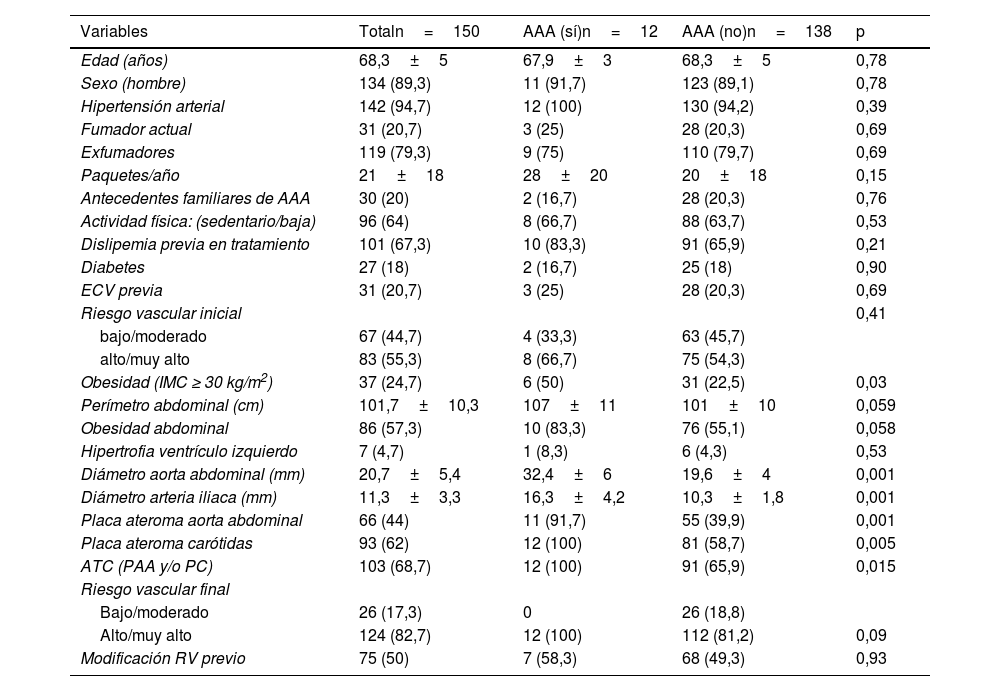
ResultadosDe los 157 pacientes seleccionados, 150 completaron el estudio ecográfico (edad: 68,3±5 años; 89,3% varones). Un total de 94,7% eran hipertensos; 20,7% eran fumadores activos y el resto exfumadores. Presentaron antecedentes familiares de AAA 20%. Tenían dislipemia previa 67,3% (79% tratados con estatinas en monoterapia). Presentaban ECV previa 20,7% y el RV inicial era alto/muy alto en 55,3% de los sujetos (tabla 1).
Tras el estudio ecográfico, se detectó AAA en 12 pacientes (8%; IC 95%: 4-12), con un diámetro máximo de 4,6cm; ectasia aórtica en 13 (8,7%; IC 95%: 4-13); placa aórtica abdominal en 66 casos (44%; IC 95%: 36-52) y placa carotídea en 93 sujetos (62%; IC 95%: 54-70).
Entre los pacientes asintomáticos, sin antecedentes de ECV previa, se identificaron placas ateroscleróticas en la aorta abdominal y/o las arterias carótidas en 63% de los casos (aterosclerosis subclínica). El RV final fue alto/muy alto en 82,7%. Estos hallazgos llevaron a la reclasificación del RV previo y a la revisión del objetivo de c-LDL en 50% de los sujetos del estudio (IC 95%: 42-58).
En la tabla 1 se muestran las características de los sujetos de forma global y según la presencia o no de AAA. Se detectó que de los 12 pacientes con AAA, 11 (91,7%) eran varones y 83,3% presentaba obesidad abdominal. Tenían un RV inicial alto/muy alto 66,7% de los casos y 25% padecían ECV previa. Entre los 30 individuos con antecedentes familiares se identificó a dos (6,7%) con AAA.
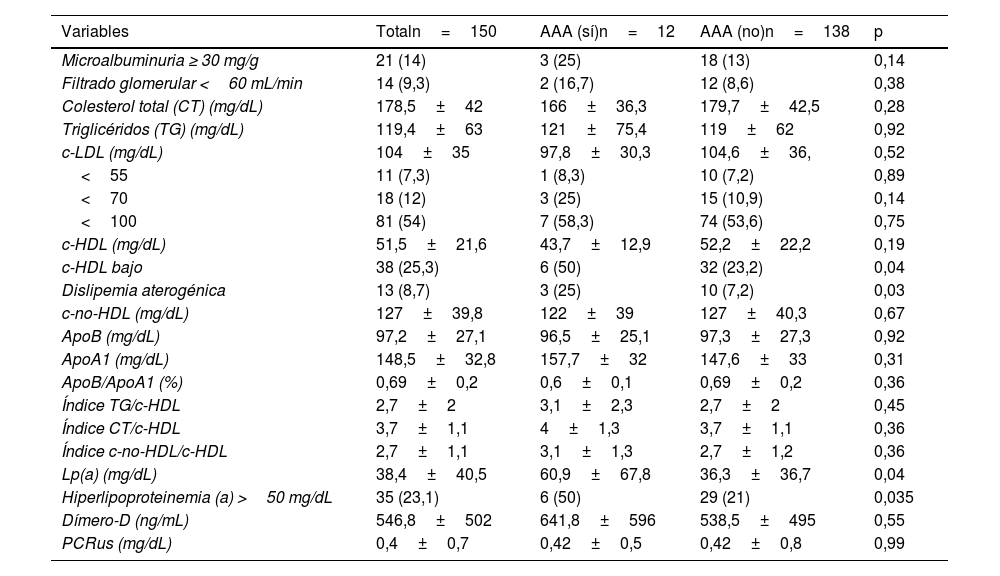
Todos los sujetos con AAA tenían placas de ateroma carotídeas (p <0,01), resultando a su vez, que entre todos los pacientes con placa carotídea la prevalencia de AAA fue de 12,8%. Además, aquellos con AAA presentaron mayor prevalencia de dislipemia, microalbuminuria, dislipemia aterogénica, hiperlipoproteinemia(a) y c-HDL bajo, en comparación con los pacientes sin la patología. El resto de las determinaciones (perfil lipídico, índices lipídicos, ApoB, c-no-HDL, dímero-D, PCRus) fueron similares en ambos grupos (tablas 1 y 2).
Características de la población de estudio
| Variables | Totaln=150 | AAA (sí)n=12 | AAA (no)n=138 | p |
|---|---|---|---|---|
| Edad (años) | 68,3±5 | 67,9±3 | 68,3±5 | 0,78 |
| Sexo (hombre) | 134 (89,3) | 11 (91,7) | 123 (89,1) | 0,78 |
| Hipertensión arterial | 142 (94,7) | 12 (100) | 130 (94,2) | 0,39 |
| Fumador actual | 31 (20,7) | 3 (25) | 28 (20,3) | 0,69 |
| Exfumadores | 119 (79,3) | 9 (75) | 110 (79,7) | 0,69 |
| Paquetes/año | 21±18 | 28±20 | 20±18 | 0,15 |
| Antecedentes familiares de AAA | 30 (20) | 2 (16,7) | 28 (20,3) | 0,76 |
| Actividad física: (sedentario/baja) | 96 (64) | 8 (66,7) | 88 (63,7) | 0,53 |
| Dislipemia previa en tratamiento | 101 (67,3) | 10 (83,3) | 91 (65,9) | 0,21 |
| Diabetes | 27 (18) | 2 (16,7) | 25 (18) | 0,90 |
| ECV previa | 31 (20,7) | 3 (25) | 28 (20,3) | 0,69 |
| Riesgo vascular inicial | 0,41 | |||
| bajo/moderado | 67 (44,7) | 4 (33,3) | 63 (45,7) | |
| alto/muy alto | 83 (55,3) | 8 (66,7) | 75 (54,3) | |
| Obesidad (IMC ≥ 30 kg/m2) | 37 (24,7) | 6 (50) | 31 (22,5) | 0,03 |
| Perímetro abdominal (cm) | 101,7±10,3 | 107±11 | 101±10 | 0,059 |
| Obesidad abdominal | 86 (57,3) | 10 (83,3) | 76 (55,1) | 0,058 |
| Hipertrofia ventrículo izquierdo | 7 (4,7) | 1 (8,3) | 6 (4,3) | 0,53 |
| Diámetro aorta abdominal (mm) | 20,7±5,4 | 32,4±6 | 19,6±4 | 0,001 |
| Diámetro arteria iliaca (mm) | 11,3±3,3 | 16,3±4,2 | 10,3±1,8 | 0,001 |
| Placa ateroma aorta abdominal | 66 (44) | 11 (91,7) | 55 (39,9) | 0,001 |
| Placa ateroma carótidas | 93 (62) | 12 (100) | 81 (58,7) | 0,005 |
| ATC (PAA y/o PC) | 103 (68,7) | 12 (100) | 91 (65,9) | 0,015 |
| Riesgo vascular final | ||||
| Bajo/moderado | 26 (17,3) | 0 | 26 (18,8) | |
| Alto/muy alto | 124 (82,7) | 12 (100) | 112 (81,2) | 0,09 |
| Modificación RV previo | 75 (50) | 7 (58,3) | 68 (49,3) | 0,93 |
Los datos se presentan como media±desviación estándar o n (%).
AAA: aneurisma de aorta abdominal; ATC: aterosclerosis; ECV: enfermedad cardiovascular; IMC: índice de masa corporal; PAA: placa en aorta abdominal; PC: placa carotídea; RV: riesgo vascular.
Datos analíticos globales y según la presencia o no de AAA
| Variables | Totaln=150 | AAA (sí)n=12 | AAA (no)n=138 | p |
|---|---|---|---|---|
| Microalbuminuria ≥ 30 mg/g | 21 (14) | 3 (25) | 18 (13) | 0,14 |
| Filtrado glomerular <60 mL/min | 14 (9,3) | 2 (16,7) | 12 (8,6) | 0,38 |
| Colesterol total (CT) (mg/dL) | 178,5±42 | 166±36,3 | 179,7±42,5 | 0,28 |
| Triglicéridos (TG) (mg/dL) | 119,4±63 | 121±75,4 | 119±62 | 0,92 |
| c-LDL (mg/dL) | 104±35 | 97,8±30,3 | 104,6±36, | 0,52 |
| <55 | 11 (7,3) | 1 (8,3) | 10 (7,2) | 0,89 |
| <70 | 18 (12) | 3 (25) | 15 (10,9) | 0,14 |
| <100 | 81 (54) | 7 (58,3) | 74 (53,6) | 0,75 |
| c-HDL (mg/dL) | 51,5±21,6 | 43,7±12,9 | 52,2±22,2 | 0,19 |
| c-HDL bajo | 38 (25,3) | 6 (50) | 32 (23,2) | 0,04 |
| Dislipemia aterogénica | 13 (8,7) | 3 (25) | 10 (7,2) | 0,03 |
| c-no-HDL (mg/dL) | 127±39,8 | 122±39 | 127±40,3 | 0,67 |
| ApoB (mg/dL) | 97,2±27,1 | 96,5±25,1 | 97,3±27,3 | 0,92 |
| ApoA1 (mg/dL) | 148,5±32,8 | 157,7±32 | 147,6±33 | 0,31 |
| ApoB/ApoA1 (%) | 0,69±0,2 | 0,6±0,1 | 0,69±0,2 | 0,36 |
| Índice TG/c-HDL | 2,7±2 | 3,1±2,3 | 2,7±2 | 0,45 |
| Índice CT/c-HDL | 3,7±1,1 | 4±1,3 | 3,7±1,1 | 0,36 |
| Índice c-no-HDL/c-HDL | 2,7±1,1 | 3,1±1,3 | 2,7±1,2 | 0,36 |
| Lp(a) (mg/dL) | 38,4±40,5 | 60,9±67,8 | 36,3±36,7 | 0,04 |
| Hiperlipoproteinemia (a) >50 mg/dL | 35 (23,1) | 6 (50) | 29 (21) | 0,035 |
| Dímero-D (ng/mL) | 546,8±502 | 641,8±596 | 538,5±495 | 0,55 |
| PCRus (mg/dL) | 0,4±0,7 | 0,42±0,5 | 0,42±0,8 | 0,99 |
Los datos se presentan como media±desviación estándar o n (%).
AAA: aneurisma de aorta abdominal; ApoB: apolipoproteína B; ApoA1: apolipoproteína A1; c-HDL: colesterol de lipoproteínas de alta densidad; c-LDL: colesterol de lipoproteínas de baja densidad; c-no-HDL: colesterol-no-HDL; Lp(a): lipoproteína (a); PCRus: proteína C reactiva ultrasensible.
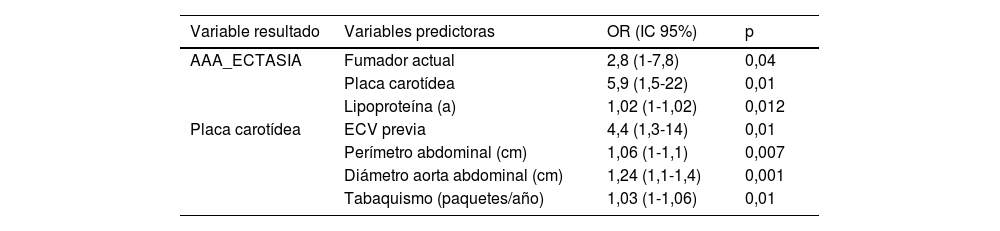
En el análisis multivariante (tabla 3), la detección de AAA o ectasia se asoció significativamente con ser fumador actual, presentar placa carotídea y el aumento de Lp(a). Otras variables relacionadas no alcanzaron la significación estadística. Por otra parte, la detección de placa carotídea se vinculó significativamente con ECV previa, intensidad de tabaquismo (paquetes/año), obesidad abdominal y diámetro de la aorta abdominal, p <0,01.
Análisis multivariante mediante regresión logística
| Variable resultado | Variables predictoras | OR (IC 95%) | p |
|---|---|---|---|
| AAA_ECTASIA | Fumador actual | 2,8 (1-7,8) | 0,04 |
| Placa carotídea | 5,9 (1,5-22) | 0,01 | |
| Lipoproteína (a) | 1,02 (1-1,02) | 0,012 | |
| Placa carotídea | ECV previa | 4,4 (1,3-14) | 0,01 |
| Perímetro abdominal (cm) | 1,06 (1-1,1) | 0,007 | |
| Diámetro aorta abdominal (cm) | 1,24 (1,1-1,4) | 0,001 | |
| Tabaquismo (paquetes/año) | 1,03 (1-1,06) | 0,01 |
AAA_ECTASIA: aneurisma de aorta abdominal y/o ectasia; ECV: enfermedad cardiovascular; IC 95%: intervalo de confianza al 95%; OR: odds ratio.
En cuanto al grado de control de los factores de RV, se observó que de 83 pacientes con RV inicial alto/muy alto, 79,5% tenía un buen control tensional en los últimos seis meses; 57,8% tenía un c-LDL <100mg/dL y solo 15,7% un c-LDL <70mg/dL. Además, 25% continuaba fumando.
DiscusiónNuestros resultados muestran que en pacientes de riesgo (varones entre 65-75 años, hipertensos y tabaquismo actual o pasado, o antecedentes familiares de AAA) el cribado oportunista, mediante ecografía clínica realizada por médicos de familia, permitió identificar a 12 con AAA (8%) y 13 con aorta abdominal ectásica (8,7%). Además, se detectó en la muestra global una prevalencia elevada de placas ateroscleróticas (carotídeas y en la aorta abdominal) lo que conllevó la reclasificación del RV previo y la revisión del objetivo de c-LDL en 50% de ellos.
Las características de los pacientes con AAA o ectasia eran similares, como lo observaron Cornejo et al.14 Esto concuerda con algunos estudios poblacionales que sugieren que la ectasia puede considerarse un marcador de riesgo para desarrollar AAA13,15,20.
Todos los pacientes con AAA presentaron placas de ateroma carotídeas. Estos datos coinciden con Torres et al.5 y Yao et al.12, que encuentran una asociación entre la presencia de placa carotídea y AAA. En esta línea, nuestros resultados sugieren, coincidiendo con Yao et al.12, que la detección de placa carotídea podría ser de utilidad como marcador de riesgo para el cribado de AAA, además de los factores de riesgo ya conocidos.
A nivel analítico, se encontró una relación entre la presencia de AAA y Lp(a), dislipemia aterogénica y niveles más bajos de c-HDL, coincidente con otros autores5,29. Hay que destacar que, en la mitad de los casos de AAA, observamos hiperlipoproteinemia(a), con una asociación estadísticamente significativa que se mantuvo en el análisis multivariante. La elevación de Lp(a) constituye una de las alteraciones lipídicas más frecuentes, siendo considerada un factor de riesgo hereditario independiente de la ECV arteriosclerótica y de AAA, que no se modifica con el tratamiento empleado para descender los niveles de colesterol LDL. Se recomienda su determinación al menos una vez en la vida, ya que sus niveles son muy estables5,11,27. Un metaanálisis reciente halló una relación entre la elevación de Lp(a) y el AAA, sin embargo, se necesitan más estudios para evaluar su utilidad en la detección temprana de este último29.
La prevalencia de AAA en nuestra muestra (8%) fue elevada, aunque similar a la de otros estudios realizados en nuestro país en pacientes de RV en consultas de angiología, cardiología y medicina interna14,24,30. En otros trabajos efectuados en atención primaria las prevalencias fueron algo inferiores a las del presente análisis, oscilando entre 3,3 y 5,8%23,25,31. Estas diferencias son debidas probablemente al tipo de cribado llevado a cabo y a los factores de riesgo considerados en los criterios de inclusión; nuestro cribado fue muy selectivo, dirigido a la población de riesgo recomendada en las guías7,8,18. Cada estrategia de cribado será factible según la prevalencia y los recursos disponibles, siendo más efectivas en poblaciones con una prevalencia de AAA superior a 4% para reducir la mortalidad asociada17,19,24.
La detección de placas de ateroma en arterias carótidas mediante ecografía se sugiere actualmente como un nuevo paradigma en la predicción cardiovascular (recomendación IIa); cuando son significativas implican automáticamente la reclasificación del paciente a muy alto RV, ya que presentan un fuerte valor predictivo tanto para ictus como para infarto de miocardio con independencia de los factores de RV tradicionales10,11,27. La prevalencia de la placa carotídea en nuestro estudio (62%) es algo más elevada que las encontradas en algunos de cribado poblacional, que oscilan entre 25 y 47%12,32,33. Estas diferencias podrían deberse, tal como ya se ha comentado, al distinto tipo de cribado (poblacional vs. selectivo, y edad de la población diana, entre otros).
Es destacable, que en este estudio se detectó aterosclerosis subclínica en 75 (63%) de los pacientes sin ECV previa. La identificación de estos sujetos recalificó su nivel de RV y llevó a la intensificación de las medidas preventivas11. Este hecho es de gran importancia, ya que se ha demostrado que los individuos asintomáticos con aterosclerosis de la arteria carótida tienen un alto riesgo de enfermedad coronaria y un mayor riesgo de AAA12. Estos resultados son similares a los comunicados en otros estudios de base poblacional34 y en atención primaria35.
En cuanto a la prevalencia de otros factores de RV (que no formaban parte de los criterios de inclusión de este trabajo), son similares a los descritos por otros autores36–38, con diferencias poco significativas.
Resulta de interés comentar el grado de control lipídico en los pacientes de alto y muy alto riesgo, en el que nuestros resultados son mejorables, sin embargo, son similares a los encontrados en el estudio del Observatorio sobre Dislipemias39, y a otras investigaciones a nivel nacional40, con un grado de cumplimiento todavía lejos del recomendado por las guías. Aunque este no era el objetivo del presente trabajo, refleja una realidad que requiere una investigación más detallada, evidenciando un amplio margen de mejora.
Limitaciones del estudioAl tratarse de un estudio transversal no se podrán establecer relaciones causales. Por otra parte, se incluyeron a los pacientes que acudieron a las consultas de los médicos participantes mediante un cribado no probabilístico y los resultados no serán extrapolables a la población general; sin embargo, consideramos que, a pesar de no ser un muestreo aleatorio, ha sido suficiente para responder al objetivo principal del trabajo.
En cuanto a las medidas ecográficas, podrían existir errores motivados por limitaciones de la propia técnica y la variabilidad interobservador. Para controlarlos se realizó un entrenamiento previo de los médicos participantes; así como una evaluación del grado de concordancia entre las medidas efectuadas por los investigadores y el experto referente.
Respecto a la valoración inicial del RV, hemos utilizado el sistema SCORE en lugar de SCORE2/SCORE2-OP, porque cuando se diseñó el estudio era el recomendado; también esto nos permite comparar la valoración del RV con otros artículos publicados que han empleado el mismo sistema mayoritariamente. Este hecho no afecta al objetivo principal, ni a la reclasificación del paciente a un nivel de riesgo superior al previo tras el uso de la ecografía clínica y detectar AAA o aterosclerosis.
Otra de las limitaciones del estudio es que no se consideraron las características de las placas; la evaluación de la ecogenicidad de la placa mejora la predicción del riesgo de ECV; sin embargo, no era un objetivo planteado y hubiera añadido mayor complejidad a la investigación.
ConclusionesLa prevalencia de AAA en pacientes con RV alto es elevada. Las técnicas diagnósticas no invasivas, como la ecografía realizada en atención primaria permiten detectar AAA en sujetos asintomáticos, demostrando su utilidad en el cribado en la población de riesgo. La detección de placa carotídea en todos los casos de AAA, confirma una asociación significativa entre ambas; lo que podría ser útil como marcador de riesgo para el cribado de esta patología. La detección de AAA y aterosclerosis subclínica permite reclasificar el RV de los pacientes para optimizar su tratamiento. Con base en estos resultados, y aunque son necesarios estudios de efectividad y con una muestra más amplia, resultaría beneficiosa la implementación de programas de cribado de AAA realizada por los médicos de familia en la población de riesgo.
FinanciaciónEl presente trabajo ha sido parcialmente financiado con una beca FEA/SEA 2022 de Investigación en Atención Primaria y una ayuda no condicionada del Ayuntamiento de Naut de Aran (Lleida). No existió ningún tipo de participación por parte de estas instituciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los pacientes y a todos los participantes, al Grupo de Trabajo de Vasculopatías de SEMERGEN y a los siguientes médicos que han colaborado: J.M. Boxó Cifuentes, E. Cámara Sola, S. Martín Izquierdo, M.L. Moya Rodríguez, M.P. Navarro Gallardo, I. Quiñones Begines y M.D. Rodríguez Santos.
Extendemos un agradecimiento especial a Andrés Cobos Díaz (Laboratorio Análisis Clínicos, Hospital Virgen de la Victoria, Málaga), Andrés González y sus colaboradores (bioinformático, Instituto de Investigación Biomédica de Málaga) y Fernando Javier Sánchez Lora (director de la Unidad de Gestión Clínica de Medicina Interna, Hospital Virgen de la Victoria, Málaga), por su inestimable ayuda, sin la cual no hubiera sido posible realizar este trabajo.
Reconocemos al Excmo. Ayuntamiento de Naut Aran (Lleida) por su colaboración no condicionada.
Aguado Castaño, Ana Carlota. Centro de Salud Parque Lo Morant, Alicante.
Aicart Bort, María Dolores. Médica Jubilada.
Babiano Fernández, Miguel Ángel. C. de Salud Argamasilla de Calatrava, Ciudad Real.
Bonany Pagès, Maria Antònia. Medicina privada, Girona.
Caballer Rodilla, Julia. Centro de Salud Algete, Madrid.
Cabrera Ferriols, María Ángeles. Centro de Salud San Vicente del Raspeig I, Alicante.
Carrasco Carrasco, Eduardo. Centro de Salud de Abarán, Murcia.
Frías Vargas, Manuel. Centro de Salud San Andrés, Madrid.
Fuertes Domínguez, Diana. Centro de Salud Cervera de Pisuerga, Palencia.
García Lerín, Aurora. Centro de Salud, Almendrales, Madrid.
García Vallejo, Olga. Centro de Salud Almendrales, Madrid
Gil Gil, Inés. Centro de Salud Vielha, Lleida.
Lahera García, Ana. Hospital Universitario de Getafe, Madrid.
López Téllez, Antonio. Centro de Salud Puerta Blanca, Málaga.
Lozano Bouzon, Víctor Manuel. Hospital Universitario de Getafe, Madrid.
Padilla Sáez, Alicia. Centro de Salud San Vicente del Raspeig I, Alicante.
Parra Valderrama, Adriana. UGC La Lobilla. Estepona, Málaga.
Peiró Morant, Juan. Centro de Salud Ponent, Islas Baleares.
Perdomo García, Frank J. Urgencias, Hospital La Paz, Madrid.
Pérez Vázquez, Estrella. Centro de Salud Vielha, Lleida.
Piera Carbonell, Ana. Centro de Salud la Corredoria. Área IV, SESPA, Oviedo.
Pietrosanto, Teresa. Centro de Salud San Vicente del Raspeig I, Alicante.
Ramírez Torres, José Manuel. Centro de Salud Puerta Blanca, Málaga.
Ruíz Calzada, Marta. Centro de Salud Simancas, Arroyo de la Encomienda, Valladolid.
Vázquez Gómez, Natividad. Centro de Salud Auxiliar Moncófar, Castellón.