Os inibidores de integrase (INI) são uma classe de antirretrovirais que apresenta elevada potência, poucos eventos adversos, boa tolerabilidade e perfil favorável de interação medicamentosa, possibilitando uso em pacientes com múltiplas comorbidades. Estas características da classe foram exploradas nos estudos apresentados na XV European AIDS Clinical Society, em outubro de 2015, na cidade de Barcelona.
A implicação clínica da rápida supressão de carga viral (CV) promovida por INI não está, até a atualidade, completamente compreendida. Uma análise post-hoc cross--sectional de indivíduos que participaram dos estudos de fase 3 de dolutegravir (DTG) em terapia inicial (SPRING-2, SINGLE e FLAMINGO) foi apresentada, tendo sido analisadas a resposta virológica inicial e a possibilidade de predizer a ocorrência de CV suprimida em 96 semanas. Resposta virológica rápida (RVR) foi definida como CV < 50 cópias/mL em 4 semanas de tratamento, e resposta virológica sustentada (SVR), como CV < 50 cópias/mL em 96 semanas. Valores preditivos foram calculados da seguinte maneira: valor preditivo positivo (VPP), como a proporção de pacientes com CV indetectável na semana 4 e que também estariam indetectáveis na semana 96; e valor preditivo negativo (VPN), como a proporção de pacientes não suprimidos na semana 4, e que apresentavam CV suprimida na semana 96. Foram avaliados 2.139 pacientes, incluindo os dos grupos baseados em DTG e seus braços comparadores.
A análise revelou que pacientes com esquemas baseados em DTG atingiram RVR em 70% das vezes, e SVR em 80%. VPP e VPN para SVR no braço DTG foi 85 e 29%, respectivamente. O VPP dos pacientes dos braços DTG foi numericamente maior do que o dos pacientes que usaram efavirenz (EFV) ou darunavir/ritonavir (DRV/r) associados à dupla de análogos de nucleosídeos e semelhante ao dos pacientes que usaram raltegravir (RAL). O VPN com RAL foi numericamente superior nos pacientes do braço DTG, evidenciando que mais pacientes sem RVR atingiram supressão em 96 semanas (tabela 1). A alta ocorrência de CV indetectável em 4 semanas e a alta previsibilidade de manter CV indetectável em 96 semanas podem ter implicações na frequência de monitoramento de CV em pacientes em uso de DTG. Este fato pode também estar relacionado à boa tolerância ao medicamento, favorecendo a adesão.
Outro estudo confirmou a potência do DTG, promovendo rápida queda da carga viral plasmática, e essa queda foi comparada com o efeito da medicação na carga viral do sêmen.
Pacientes virgens de tratamento que iniciaram terapia antirretroviral (TARV) com abacavir + lamivudina + dolutegravir (ABC + 3TC + DTG) foram avaliados. O estudo prospectivo de braço único incluiu 15 pacientes do gênero masculino. CV foi dosada em sêmen e plasma nos dias 0, 3, 7, 14 e nas semanas 4, 12 e 24. A velocidade de queda de CV foi analisada por meio de modelos não lineares, e a concentração total de DTG foi medida ao final do intervalo da dose (C24) nas amostras de sêmen e plasma nas visitas das semanas 4 e 24, com o uso de cromatografia líquida e espectrometria de massa.
O estudo, prospectivo de braço único, incluiu 15 pacientes do gênero masculino.
Os pacientes apresentavam 35 anos em média (22-60), CD4 504 (60-782) cél/mm3, CV plasmática 5,03 (4,02-5,76) log cópias/ mL, CV sêmen 3,91 (2,97-4,83) log cópias/ mL. HIV-1 era subtipo não B em quatro dos 15 pacientes. O tempo médio para atingir CV indetectável foi mais curto no sangue do que no sêmen (4 vs. 12 semanas, p = 0,008), independentemente da CV basal. No geral, a média de concentração C24 de DTG no sêmen foi 119,1 (27,2-377) ng/ mL, o que corresponde a 7,8% (3,7-21%) da concentração no sangue. A menor concentração seminal de DTG encontrada foi 78 vezes maior que a IC50 in vitro (0,2 ng/ mL). Embora a concentração seminal de DTG tenha sido de apenas 7,8% da plasmática, ela foi suficiente para atingir rápida supressão do HIV nesse compartimento.
A estratégia de troca de nevirapina (NVP) para DTG foi investigada no estudo de Allavena L et al. Como a NVP é um indutor do sistema enzimático do citrocromo P450, pode haver diminuição da concentração de medicamentos também metabolizados por essa via quando coadministrados. O presente estudo de dois centros, braço único, controlado e pros-pectivo analisou a farmacocinética (PK), o desfecho virológico e a segurança da troca de NVP para DTG em pacientes que faziam uso de 3TC, ABC e NVP, apresentavam CV indetectável e modificaram seu esquema ARV para ABC, 3TC e DTG comprimido único diário. Para o subestudo de PK, cinco pacientes adicionaram 50 mg de DTG ao seu esquema ARV nos dias D-5 a D0, e outros cinco participaram a partir do D0 (n = 10). Avaliações de PK foram também conduzidas no dia da troca para DTG e duas semanas após essa substituição. Os pacientes utilizavam NVP 200 mg duas vezes ao dia, NVP 200 mg dois comprimidos uma vez ao dia e NVP 400 mg XR (uma vez ao dia), por pelo menos seis meses. Nos dez pacientes que participaram do estudo de PK, notou-se um efeito breve e limitado da NVP como indutor do metabolismo hepático do DTG, porém, sem impacto clínico. A tolerância dos 53 pacientes participantes foi boa, sem mudança significativa da aspartato aminotransferase/alanina amino-transferase, havendo apenas um evento grau 2 (aumento de transaminase). Não houve interrupção ou evento adverso sério nos dois braços, e 100% dos pacientes mantiveram CV indetectável em 12 semanas de seguimento.
A barreira genética do DTG parece ser distinta daquela dos outros INI. Resistência transmitida a INI é um evento raro, e esse fato foi confirmado por Llácer Delicado T, Torrecilla E e Holguin A. A frequência de mutações de resistência associadas aos inibidores de integrase foi analisada por meio de sequências do GeneBank de pacientes que nunca utilizaram inibidor de integrase, disponíveis até janeiro de 2015. Raramente foi detectada mutação transmitida na integrase, especialmente nos vírus do grupo M e subtipos B (0,6%) e C (0,7%).
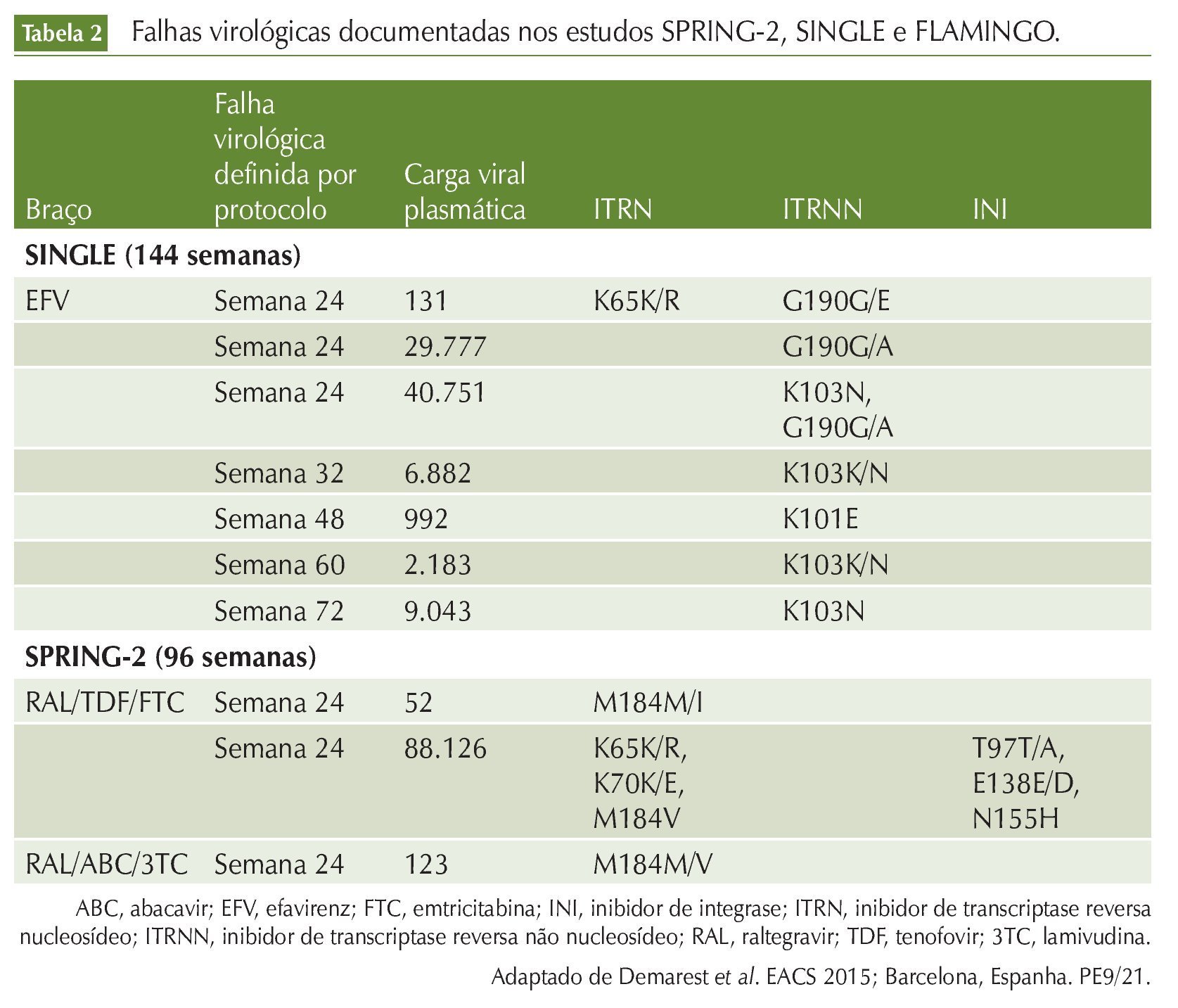
Além do interesse em mutações transmitidas, investiga-se muito o padrão mutacional do DTG na falha terapêutica. O DTG foi estudado em protocolos de fase 3 em indivíduos virgens de terapia. Os esquemas baseados em DTG atingiram não inferioridade quando comparados a esquemas baseados em RAL, e superioridade quando comparados a esquemas contendo DRV ou EFV. Análise dos casos de falha virológica definida por protocolo mostrou ausência de resistência no grupo baseado em DTG, enquanto resistência ao terceiro agente ou dupla de análogos foi observada nos comparadores do SPRING-2 e SINGLE. Falha virológica significativa definida por protocolo CV > 200 cópias/mL após 24 semanas no FLAMINGO e CV > 50 cópias/mL no SPRING-2 e SINGLE. Análises fenotípica e genotípica dos casos de falha virológica definida por protocolo foram feitas, independentemente da carga viral, utilizando-se PhenoSenseR GT. Nos estudos, 1.067 pacientes receberam esquema baseado em DTG. A carga viral na falha foi semelhante no grupo DTG e nos comparadores, apresentando-se sempre um pouco menor na segunda coleta (confirmatória) da carga viral. Ao todo, 73,2% das amostras de falhas dos estudos SINGLE e SPRING-2 testadas tiveram sucesso em demonstrar resultado e, em geral, o não sucesso esteve associado à baixa carga viral. No FLAMINGO, houve seis falhas definidas por protocolo (2DTG e 4DRV/r), e não houve emergência de resistência na PR, TR ou IN (tabela 2).
A supressão virológica nos esquemas baseados em DTG foi duradoura nos estudos até 96 e 144 semanas de seguimento. A carga viral no momento da falha virológica foi semelhante nos grupos DTG e comparadores, e resultados de genotipagem encontravam-se disponíveis mesmo em amostras com CV < 500 cópias/mL. Não foi detectada resistência ao DTG ou à dupla de nucleosídeos associada em pacientes virgens de terapia que receberam esquema baseado em DTG até o momento.
Estudos sobre estratégias de simplificação também foram apresentados na Conferência. Ressaltamos dois estudos de terapia dupla com DTG + lamivudina.
Após a publicação dos resultados do estudo Gardel, que investigou a eficácia da terapia tripla baseada em lopinavir/ritonavir associada à dupla de análogos ou apenas 3TC associado a LPV/r, Figueroa et al. apresentaram um estudo (PADDLE) piloto, prova de conceito de braço único, que investigou a eficácia, a segurança e a tolerabilidade da terapia dupla com lamivudina (3TC) e dolutegravir (DTG) como esquema antirretroviral inicial. Foram incluídos 20 pacientes infectados pelo HIV-1, virgens de terapia ARV, que não apresentavam mutações associadas à resistência para ITRN, eram HBsAg negativos e possuíam carga viral menor que 100.000 cópias/mL na visita de triagem. Foi realizada carga viral nas visitas triagem, basal (0), dias 2, 4, 7, 10, 14, 21, 28 e em semanas alternadas, até 12 semanas de seguimento. Após isso, mediu-se a carga viral a cada 12 semanas. O objetivo primário do estudo era o sucesso virológico, definido como proporção de pacientes com CV < 50 cópias/mL na análise por intenção de tratar em 48 semanas. Uma análise de 24 semanas foi previamente planejada, e os pacientes foram seguidos por 96 semanas. Os participantes receberam 300 mg de lamivudina ao dia, associado ao dolutegravir, 50 mg ao dia. Se na semana 8 mais de dois pacientes mostrassem queda de CV < 1 log, o estudo seria interrompido. Também eram retirados do estudo pacientes com queda de CV < 1 log na semana 8, quando comparados ao Baseline, pacientes com CV > 1.000 cópias/mL na semana 12, aqueles com CV > 400 cópias/mL na semana 24, rebote virológico confirmado (CV > 200 cópias/mL) após CV < 50 cópias/mL. A média da CV foi 24.128 cópias/mL (IQR 11.686-36.794). Quatro pacientes apresentaram CV > 100.000 cópias/mL na visita basal. A média de CD4 foi 407 cél/mm3 (IQR 296-517). Rápida queda da carga viral foi observada (média de redução da CV do basal para semana 12 foi 2,74 log). Todos os indivíduos atingiram CV < 400 cópias/ mL e < 50 cópias/mL em três e oito semanas, respectivamente. Todos mantiveram CV indetectável em até 24 semanas. Este é o primeiro relato de sucesso de terapia dupla com inibidor de integrase e análogo nucleosídeo em pacientes infectados pelo HIV, virgens de terapia.
Já o DOLULAM, também de investigação da terapia dupla com DTG e 3TC, foi um estudo prospectivo, de simplificação da TARV, para avaliar a eficácia e a segurança da terapia de manutenção com DTG e 3TC. Pacientes em TARV estável e CV < 50 cópias/mL por mais de 12 meses, com problemas de tolerância ao esquema atual e sem resistência aos inibidores de integrasse, foram convidados a trocar sua TARV para DTG 50 mg/dia associado à lamivudina 300 mg/dia. O objetivo principal do estudo foi a manutenção da CV indetectável em 12 semanas. Visitas e exames foram feitos nas semanas 6, 12, 24 e 48 após a troca da terapia. Foram incluídos no estudo 27 pacientes, a maioria homem, média de idade 59 anos, nadir CD4 médio 167 cél/mm3, 601 cél/mm3 no Baseline. Antes da troca, os pacientes usaram ARV por 215 meses (22-239) e o esquema antes da troca incluía TDF (48%), IP/r (81%), RAL (26%). No total, oito (30%) pacientes apresentavam genotipagem com M184I/V antes da troca. Durante as 12 semanas de seguimento, não houve falha virológica documentada, definida como duas CV > 50 cópias/mL. Não houve, também, perda de seguimento ou evento adverso sério, clínico ou laboratorial. Um paciente apresentou blip (52 cópias/mL). Houve duas descontinuações por fadiga. Supressão virológica foi mantida em 24 semanas para os 13 pacientes que completaram 24 semanas na data da apresentação do estudo.
Algumas características do DTG, como alta potência, barreira genética, baixo risco de interações medicamentosas, meia-vida longa, boa tolerância, baixo potencial de interferências nas comorbidades e conveniência, tornam a medicação atrativa para uso em monoterapia. Além disso, sabe-se que as mutações de resistência associadas ao DTG conferem um grande prejuízo ao fitness viral. Monoterapia com DTG foi testada em pacientes com opções terapêuticas limitadas por eventos adversos, interações medicamentosas ou resistência viral prévia. Pacientes sem história de resistência aos inibidores de integrasse e CV < 37 cópias/ mL por mais de 12 meses trocaram sua medicação para DTG quando apresentavam dois dos seguintes critérios: evento adverso relacionado ao ARV em uso, comorbidades complicadas pela toxicidade do ARV, risco de interações por uso crônico de medicamentos ou resistência prévia documentada que comprometesse as opções de tratamento. O objetivo primário foi a proporção de pacientes sem falha virológica, considerada análise por intenção de tratar para falha em 24 semanas. Foram incluídos no estudo 32 pacientes, sendo que 22 estavam usando inibidor de protease e 18 encontravam-se em monoterapia. Em média, os pacientes tinham 19 anos de infecção pelo HIV, 39% tinham história prévia de AIDS, oito anos (4-13) de carga viral indetectável e CD4 596 (420-843) cél/mm3. A maioria dos pacientes utilizou monoterapia, por enfrentar evento adverso aos ARV (n = 25, 76%). Outros usaram monoterapia para evitar piora de comorbidades (n = 32, 97%); 28 (85%), risco de interação medicamentosa com outros medicamentos de uso crônico; e 16 (48%), mutações de resistência. Em 24 semanas, a eficácia terapêutica foi de 97% (IC 95% 83-100). Um paciente teve falha virológica na semana 4, mas foi mantido em DTG 50 mg ao dia. Sua CV permaneceu detectável até 24 semanas (79-101 cópias/ mL). Genotipagem do RNA e DNA nas semanas 4 e 24 não mostraram resistência na integrase. Houve redução nos níveis séricos de triglicérides (-117 mg/dL), colesterol total (-36 mg/dL) e PCR ultrassensível (-0,05 mg/dL) (p < 0,007), embora o clearance de creatinina, estimado pela equação CKDEPI, também tenha sido reduzido (-7,1 mL/ min), p < 0,0001.
Mesmo em pacientes previamente experimentados, a estratégia de simplificação para DTG monoterapia ou terapia dupla parece ser segura e eficaz.
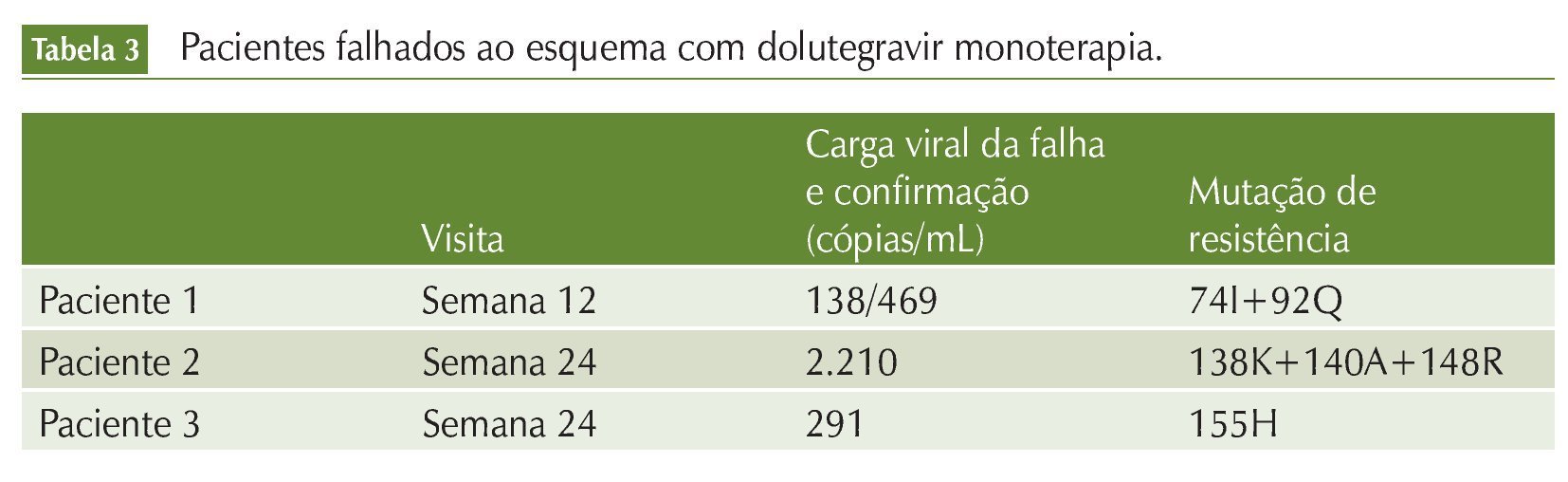
Outro estudo observacional incluiu pacientes com CV < 50 cópias/mL por pelo menos 12 meses em uso de TARV, CD4 > 350 cél/mm3, sem história de falha aos inibidores da integrase. Esses pacientes modificaram a TARV para DTG 50 mg ao dia em monoterapia. O objetivo primário foi avaliar a proporção de pacientes que atingiram CV < 50 cópias/mL em 24 semanas, e os objetivos secundários foram avaliação das falhas virológicas e determinação da concentração mínima de DTG. A CV do HIV RNA foi mensurada nas semanas 4, 8, 12, 24 (resultado apresentado), 36 e 48. HIV DNA também foi coletado no D0 em amostras congeladas para quantificação e verificação de mutações de resistência. A concentração de DTG (C24h) foi deter-minada nas visitas W4 e W24. Foi considerava falha virológica 2 CV > 50 cópias/ mL consecutivas. Teste de resistência e medida da C24h de DTG foram executados nas amostras dos pacientes em falha. Foram incluídos 28 pacientes, com média de CD4 de 624 (524-761) cél/mm3, duração da TARV de 17 anos (11-20) e CV indetectável, em média, há 79 meses (42-95), utilizando TARV tripla (n = 10), dupla (n = 10) ou monoterapia com darunavir/r (n = 8). Dos 28 pacientes incluídos, 13 tinham história de uso de INI. A proporção de pacientes que mantiveram CV indetectável (< 50 cópias/mL) foi 96% (IC 95%:79-100) em quatro semanas, 100% (85-100), 93% (76-99) em 12 semanas e 92% (75-99) em 24 semanas. Três pacientes apresentaram rebote da CV com desenvolvimento de mutações de resistência associadas aos INI. Esses três pacientes eram experimentados ao INI (dois ao RAL e um ao EVG/COBI). Todos tiveram suas amostras da visita basal testadas para identificação de mutações de resistência aos INI por meio da análise do DNA viral. Não houve detecção de resistência na visita basal, exceto no paciente 1, que se encontrava com a documentação da 74I enquanto estava com CV suprimida em uso de EVG/COBI (tabela 3).
Mesmo em pacientes previamente experimentados, a estratégia de simplificação para DTG monoterapia ou terapia dupla parece ser segura e eficaz. Um estudo retrospectivo, de centro único, que incluiu pacientes usando monoterapia (mDTG) ou terapia dupla baseada em DTG (bDTG), foi apresentado. O objetivo principal era avaliar a proporção de pacientes que mantinham CV indetectável até a última visita do seguimento. Foram identificados 21 pacientes em mDTG (50 mg/dia) e 30 em bDTG (50 ou 100 mg/dia) associado a rilpivirina (n = 11), atazanavir (n = 8), atazanavir/r (n = 4), darunavir/r (n = 1), maraviroque (n = 3), lamivudina (n = 3) e abacavir (n = 1). Todos os pacientes eram experimentados à TARV e 47% tinham uma ou mais falhas virológicas no passado. Nove pacientes apresentavam história de falha em esquema contendo raltegravir, dos quais sete tinham genotipagem basal. Cinco pacientes apresentavam mutações de resistência (N155H, n = 4; V72I, n = 4; G163R, n = 1; E157Q, n = 1; L74I, n = 1), todos fenotipicamente sensíveis ao DTG.
Características dos pacientes com mDTG: média de idade de 54 anos; média de 11 anos de infecção pelo HIV, com média de CV indetectável antes de mudar para mDTG de 5,9 anos (3,5-9,9). Razões para troca foram: simplificação do esquema ARV em 71%, e reação adversa em 29%. No follow up de, em média, 14 semanas (11-25), todos os pacientes mantiveram CV indetectável.
Características dos pacientes com bDTG: HIV, em média, há 18 anos; 90% CV indetectável antes da troca para terapia dupla por, em média, 3,7 anos (1,5-8,1). Seis pacientes apresentavam CV detectável no momento da troca (66, 76, 711, 850, 2.410, 6.750 cópias/mL). As razões para troca foram: simplificação em 60%, eventos adversos à terapia prévia em 20%, falha virológica em 17%, e interações medicamentosas em 3%. Após um seguimento médio de 21 semanas (11-49), 98% dos pacientes apresentavam CV indetectável (incluindo cinco dos seis que apresentavam CV detectável antes da troca). O único paciente que apresentou falha virológica foi uma mulher com falha prévia ao RAL, com genotipagem basal que mostrava N155H, e que informava tomar metade da dose recomendada da medicação (DTG+MRV). Na falha, sua CV aumentou para 736 cópias/mL, e a genotipagem mostrou mutações adicionais (V72I, F121, S147G), com resistência ao DTG e tropismo CXCR4. Não houve decréscimo significativo da taxa de filtração glomerular, e 12% dos pacientes apresentaram aumento de creatinofosfoquinase, todos assintomáticos.
Algumas características do DTG tornam a medicação atrativa para uso de monoterapia.
Todos os profissionais que trabalham com terapia de resgate em HIV frequentemente deparam com o questionamento sobre quantos ARV ativos são necessários numa combinação para resgate após falha. Um estudo investigou quantos medicamentos ativos são necessários em um esquema de resgate quando a combinação contém DTG. Raadson MP et al. realizaram um estudo observacional com pacientes portadores de HIV cuja TARV foi trocada para DTG, entre novembro de 2014 a abril de 2015, e calcularam os escores de sensibilidade genotípica (GSS) conforme algoritmo REGA (v.9). Pacientes em monoterapia com DTG ou backbone com alta resistência foram considerados GSS 0. Análises de subgrupos compararam níveis de supressão de CV (< 50 cópias/mL) em pacientes com backbone com GSS < 2 ou ≥ 2, vírus com ≥ 1 mutação, conferindo pelo menos baixa resistência ao ITR não nucleosídio ou IP em comparação a pacientes com vírus selvagens e história prévia de falha, comparado a não ter falha ao ARV no passado. Foram incluídos 91 pacientes, dos quais 29 com vírus com mutação de resistência e 30 com GSS < 2. Ao todo, 68 pacientes com dados disponíveis de seguimento 12 e 24 semanas foram analisados, e 28 de 29 pacientes portadores de vírus com mutação de resistência mantiveram CV indetectável, em comparação com 34 de 39 pacientes com vírus selvagem. Todos os 23 pacientes que apresentavam GSS < 2 mantiveram CV indetectável, em comparação com 39 de 45 com GSS ≥ 2. Apresentaram GSS 0 oito pacientes, e todos mantiveram CV indetectável. No tratamento com regime que contenha DTG, a força do backbone não parece afetar o desfecho.
Dolutegravir é um inibidor de integrase com características farmacológicas que possibilitam a investigação para uso em situações adversas, como casos de múltiplas comorbidades e em pacientes de difícil tolerabilidade à TARV. Apresenta alta barreira genética, comodidade posológica e excelente perfil de segurança, o que proporciona possibilidade de investigação em cenários diversos daqueles atualmente recomendados para tratamento envolvendo terapia antirretroviral tripla.