La respuesta inmune a los antígenos de las vacunas está disminuida en los niños con cáncer. El objetivo de este estudio fue evaluar la seroconversión frente a vacuna ADN recombinante contra hepatitis B al momento del inicio de la quimioterapia y/o remisión en niños con cáncer.
Pacientes y métodoEstudio prospectivo, bicéntrico, controlado, no aleatorizado de niños con diagnóstico reciente de cáncer pareados con niños sanos. Los casos fueron vacunados a tiempo 0, 1 y 6 meses, a dosis de 20 y 40μg si eran<ó>10 años, respectivamente, con vacuna ADN recombinante contra hepatitis B, en el momento del diagnóstico en el caso de los tumores sólidos y luego de la remisión en el caso de los tumores hematológicos. El grupo control recibió el mismo esquema, con dosis de 10 o 20μg respectivamente. Se midieron anticuerpos séricos anti-HBs a los 2, 8 y 12 meses posvacunación. Seroconversión se definió como títulos anti-HBs>10 mUI/ml al octavo mes.
ResultadosUn total de 78 niños con cáncer y 25 controles fueron evaluados con títulos anti-HBs al octavo mes. La tasa de seroconversión fue de 26,9%, en niños con cáncer, sin diferencia por edad, género ni tipo de tumor (p=0,13; 0,29; y 0,44, respectivamente), y de 100% en el grupo control (p<0,0001, comparado con los niños con cáncer). En el seguimiento a los 12 meses solo el 31,9% de los niños con cáncer presentaba títulos anti-HBs>10mUI/ml.
ConclusionesLa vacunación contra hepatitis B con vacuna ADN recombinante, con esquema reforzado de 3 dosis, en el momento del inicio de la quimioterapia y/o remisión provee una respuesta inmune insuficiente en la mayoría de los niños con cáncer. En esta población debieran evaluarse vacunas de tercera generación, con adyuvantes más inmunogénicos, esquemas reforzados a los 0, 1, 2 y 6 meses, medición de títulos de anticuerpos al octavo y duodécimo mes, eventual uso de refuerzos y reevaluación de inmunogenicidad si correspondiese.
Immune response against vaccine antigens may be impaired in children with cancer. The aim of this study was to evaluate the seroconversion response against hepatitis B vaccination (HBV) at the time of chemotherapy onset and/or remission in children with cancer.
Patients and methodProspective, two-centre, controlled, non-randomised study conducted on children recently diagnosed with cancer, paired with healthy subjects. Cases received HBV at time 0, 1 and 6 months with DNA recombinant HBV at a dose of 20 and 40μg if<or>than 10 years of age, respectively, at the time of diagnosis for solids tumours and after the remission in case of haematological tumours. Controls received the same schedule, but at of 10 and 20μg doses, respectively. HBs antibodies were measured in serum samples obtained at 2, 8 and 12 months post-vaccination. Protective titres were defined as>10 mIU/ml at 8th month of follow up.
ResultsA total of 78 children with cancer and 25 healthy controls were analysed at month 8th of follow up. Seroconversion rates in the cancer group reached 26.9%, with no differences by age, gender or type of tumour (P=.13, .29, and .44, respectively). Control group seroconversion was 100% at the 8th month, with P<.0001 compared with the cancer group. At month 12 of follow up, just 31.9% of children with cancer achieved anti-HBs antibodies>10 mIU/ml.
ConclusionsVaccination against hepatitis B with three doses of DNA recombinant vaccine at an increased concentration, administrated at the time of onset of chemotherapy and/or remission provided an insufficient immune response in a majority of children with cancer. More immunogenic vaccines should be evaluated in this special population, such as a third generation, with more immunogenic adjuvants, enhanced schedules at 0, 1, 2, 6 month, evaluation of antibody titres at month 8 and 12h to evaluate the need for further booster doses.
Chile es un país con baja endemicidad de infección por el virus de la hepatitis B (VHB). Su seroprevalencia es de 0,15% según la encuesta nacional de salud 2009-20101,2, alcanzando hasta 1,8% en la población de niños con cáncer3. La vacunación programática en nuestro país se inició en 1990, enfocada a grupos de riesgo, masificándose a lactantes desde el año 2005, a través del Programa Nacional de Inmunizaciones (PNI). La estimación del riesgo residual de su transmisión a través de transfusión de hemoderivados ha disminuido a través de los años, permaneciendo aún un riesgo marginal4,5. La infección por VHB durante la quimioterapia (QT) puede favorecer que el virus permanezca en estado latente o de inmunotolerancia, con posibilidades de reactivarse y provocar injuria hepatocelular durante la QT de mantenimiento, e incluso en los periodos posteriores a esta3. La inducción de enfermedad hepática crónica podría determinar una alteración en la farmacodinamia de antineoplásicos metabolizados en el hígado, lo que obligaría a postergar su uso, con una mayor posibilidad de recaída del cáncer y exacerbación de la hepatitis6.
Por otra parte, se sabe que la QT produce aplasia medular, que trae consigo alteraciones inmunes de los componentes humorales y celulares, los cuales se normalizan alrededor de 6 meses posterior al fin del tratamiento7,8. Los factores de riesgo para que esto se prolongue no están del todo aclarados, postulándose la menor edad, enfermedad subyacente, duración y tipo de terapia9–12. Múltiples estudios han abordado el tema de falta y pérdida de inmunidad humoral post-QT contra variados antígenos de las vacunas, la cual persiste incluso hasta 15 meses después de la QT y/o 6 meses postransfusión de hemoderivados13–18, variando acorde al tipo de inmunización, involucrando a la mayoría de las vacunas del PNI de Chile y a las de recomendación para grupos de riesgo11–15.
La inmunización con vacunas inactivadas durante la QT es segura, pero su eficacia es cuestionable, por lo que no existe consenso respecto de su aplicación rutinaria durante el tratamiento19,20. Inclusive, se plantea que el revacunar antes de los 6 meses post-QT sería de poco beneficio, ya que no generaría respuesta con niveles protectores para el individuo. Los estudios internacionales en relación con la inmunogenicidad de vacuna anti-VHB en niños con función inmune anormal son discordantes21–28, lo que ha llevado a consensuar que en inmunocomprometidos por QT, virus de la inmunodeficiencia humana (VIH) y niños con insuficiencia renal en hemodiálisis se utilicen dosis reforzadas de vacuna anti-VHB, de 20 y 40μg en niños menores o>a 10 años respectivamente, para optimizar la respuesta y alcanzar niveles protectores, definidos como anti-HBs>10 mUI/ml, con utilización de dosis de refuerzo, en caso de no alcanzar estos niveles29–32.
El objetivo de nuestro trabajo fue determinar la seroprotección anti-VHB después de primovacunación reforzada con vacuna ADN recombinante, en esquema 0, 1 y 6 meses, y su persistencia a los 12 meses en niños con cáncer de reciente diagnóstico, comparándola con la de una población control de niños sanos.
Pacientes y métodosDiseño general del estudioEstudio prospectivo, abierto, bicéntrico, controlado, no aleatorizado de niños entre 2 y 18 años con cáncer recientemente diagnosticado (grupo 1) en tratamiento en las unidades de oncología de los hospitales de niños Dr. Exequiel González Cortés y Dr. Luis Calvo Mackenna, Santiago, Chile. Como grupo control (grupo 2) se incluyeron niños sanos, hijos de funcionarios de los hospitales participates, pareados por edad y género en una relación de un control cada 3 casos. El estudio fue aprobado por los Comités de Ética Científicos de los Servicios de Salud Metropolitano Sur y Metropolitano Oriente. Los sujetos se incluyeron en el protocolo luego de que los padres o tutores legales firmaron su consentimiento informado y los niños firmaron su asentimiento si eran mayores de 10 años.
Criterios de inclusiónGrupo 1: niños con cáncer de 2 a 18 años de edad, no vacunados anti-VHB, sin infección previa demostrada por VHB (antígeno de superficie y anticuerpos anti core total negativos), con diagnóstico reciente (<40 días) de cáncer, que fueran a iniciar protocolos de tratamiento quimioterápico del programa infantil nacional de drogas antineoplásicas (PINDA) vigentes al momento de su diagnóstico. Los pacientes con tumores sólidos fueron vacunados en el momento del diagnóstico y los pacientes con cáncer hematológico en el momento de su primera remisión, demostrada por mielograma realizado al día 33.
Grupo 2: niños sanos de 2 a 18 años, no vacunados anti-VHB, sin infección previa demostrada por VHB (antígeno de superficie y anticuerpos anti-core total negativos), sin enfermedad oncológica ni inmunológica conocida o sospechada.
Criterios de exclusiónNiños con cáncer diagnosticado hace 40 o más días; cáncer hematológico que no se encuentre en remisión al día 33; niños con o sin cáncer vacunados previamente contra VHB; niños con o sin cáncer infectados por el VHB.
VacunaciónSe utilizaron las recomendaciones vigentes en el momento de la inclusión de pacientes, correspondientes a las normas del comité asesor de inmunizaciones de Estados Unidos en diciembre del 200533. Se administraron 3 dosis de vacuna anti-VHB ADN recombinante, Recombax® (Sanofi Pasteur) en esquema de 0, 1 y 6 meses, en dosis de 20 y 40μg cada una, en niños<o>de 10 años, respectivamente en el grupo 1 (casos), y de 10 y 20μg cada una, en niños<o>de 10 años respectivamente en el grupo 2 (controles). Seroconversión se definió como una concentración de anti-cuerpos anti-HBs > 10 mUI/ml32 al octavo mes desde el iniciode la vacunación.
Muestras de sangrea) Niveles de HBsAg y anti-HBc. Se determinaron mediante test de EIA, Axsym Laboratorios Abbott, al inicio y al final del estudio, para excluir a aquellos que hayan presentado infección previa por VHB y para determinar la eventual presencia de niños infectados durante el período de estudio.
b) Niveles de anticuerpos anti-HBs. Se determinaron mediante test de EIA, Axsym Laboratorios Abbott, a los 2, 8 y 12 meses posprimovacunación, a través de muestras sanguíneas, definiéndose como niveles protectores una concentración de anticuerpos anti-HBs>10mUI/ml32.
Análisis estadísticoEl tamaño muestral se estimó para detectar una diferencia de tasa de seroconversión de al menos 30%, asumiendo entre 50% y 65% para niños con cáncer, extrapolada desde población inmunocomprometida sin VIH, comparada con 100% de seroconversión en sanos, para un estudio con poder de 90%, error α de 5% e intervalo de confianza de 95%, requiriendo 80 niños con enfermedad neoplásica y 27 niños sanos como grupo control. Las variables discontinuas se compararon con pruebas de Chi cuadrado o Fisher, según correspondía. Se utilizó software StatCalc Epi Info 2000.
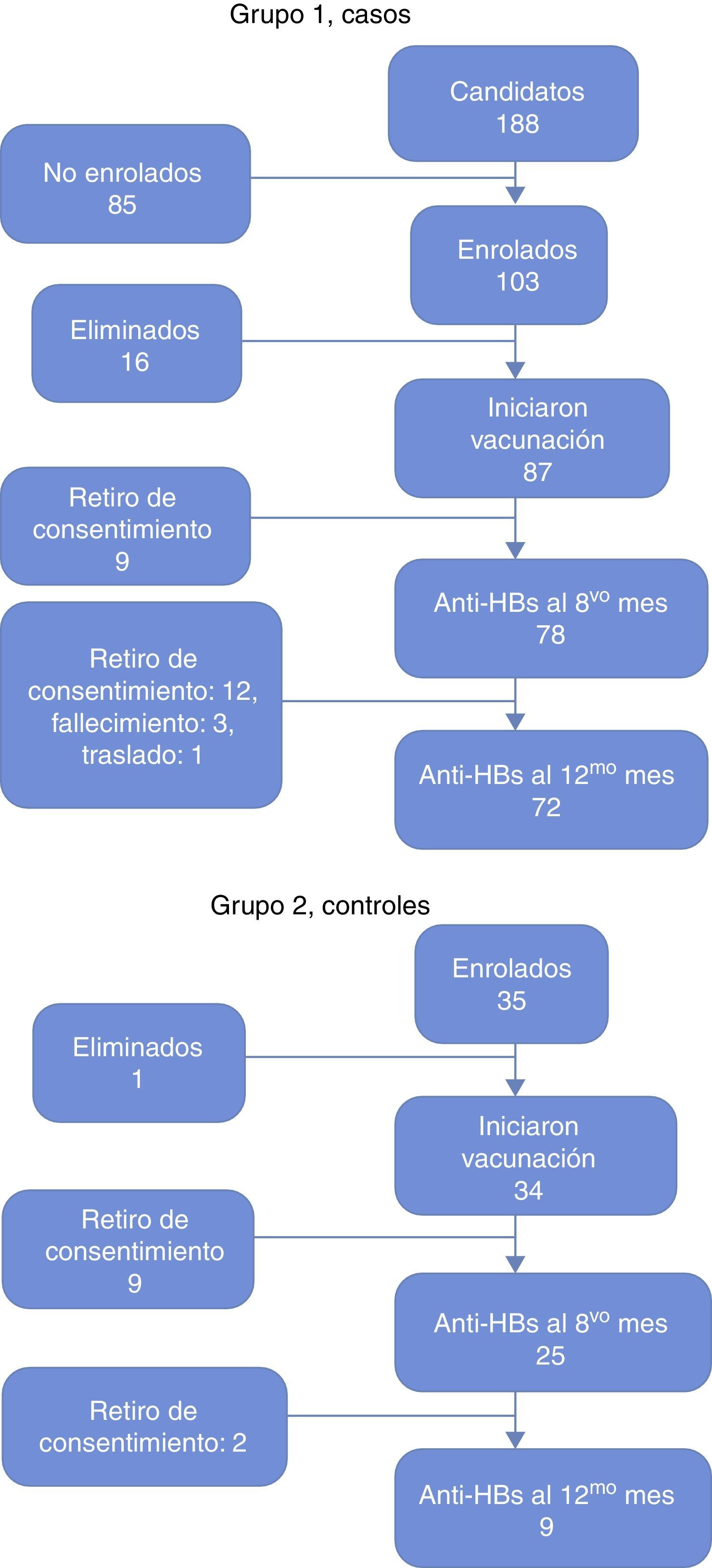
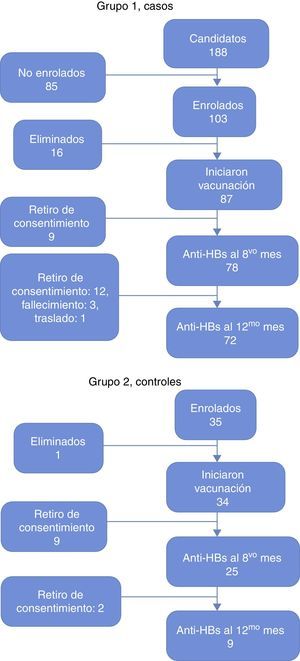
ResultadosPoblación estudiadaLa inclusión en el estudio se realizó entre los meses de mayo de 2007 y junio de 2010, con un seguimiento programado de 12 meses para cada sujeto incluido. Durante este período se diagnosticaron 188 nuevos casos de cáncer infantil en los 2 centros, de los cuales 103 fueron incluidos en el estudio (fig. 1). La causa de no inclusión en 85 pacientes fue falta de consentimiento y/o asentimiento informado (n=30), falla de reclutamiento antes de los 40 días (n=25), pacientes con cáncer hematológico que no remitió antes de los 40 días (n=17), tumores sólidos que no requerían QT (n=8) y pacientes con indicación de trasplante de precursores hematopoyéticos (TPH) (n=5). De los 103 pacientes incluidos 87 recibieron su esquema de vacunación completo. Dieciséis fueron retirados del estudio antes de terminar su esquema de vacunación. Las causas de retiro fueron: fallecimiento (n=5), mala adherencia al protocolo (n=5), recaída de la enfermedad oncológica (n=3), indicación de TPH (n=2) y abandono de QT (N=1). De los 87 pacientes con esquema de vacunación completo 9 retiraron su consentimiento para la segunda toma de títulos de anticuerpos, por lo que 78 pacientes completaron su seguimiento al octavo mes y 72 al duodécimo mes. Los 6 pacientes retirados entre los 8 y 12 meses de seguimiento obedecieron a fallecimiento (n=3), retirada de consentimiento (n=2) y traslado a otra región (n=1).
El grupo 2, control, consistió en 35 sujetos sanos pareados por edad y género, con un mínimo de 3 casos por cada control; un paciente se retiró después de consentir, antes de iniciar la vacunación. Los 34 restantes completaron su esquema de vacunación, en 25 de ellos se midió los niveles de anticuerpos anti-HBs al octavo mes de seguimiento y en 9 pacientes a los 12 meses de seguimiento. Nueve y 16 sujetos retiraron su consentimiento para la toma de anticuerpos anti-HBs al mes 8 y 12 de seguimiento respectivamente (fig. 1). Las características de los grupos 1 y 2 se describen en la tabla 1.
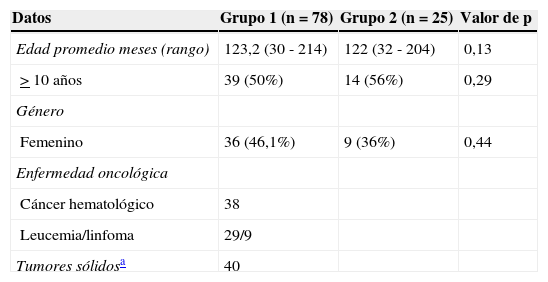
Características demográficas de los niños con cáncer de reciente diagnóstico (grupo 1) y controles (grupo 2)
| Datos | Grupo 1 (n=78) | Grupo 2 (n=25) | Valor de p |
|---|---|---|---|
| Edad promedio meses (rango) | 123,2 (30 - 214) | 122 (32 - 204) | 0,13 |
| >10 años | 39 (50%) | 14 (56%) | 0,29 |
| Género | |||
| Femenino | 36 (46,1%) | 9 (36%) | 0,44 |
| Enfermedad oncológica | |||
| Cáncer hematológico | 38 | ||
| Leucemia/linfoma | 29/9 | ||
| Tumores sólidosa | 40 |
Tumores sólidos: osteosarcoma (13), rabdomiosarcoma (8), sarcoma de Ewing (5), tumores de sistema nervioso central (4), tumor de Willms (2), PNET (2), hepatocarcinoma (n=1), tumor ovárico (n=1), retinoblastoma (n=1); sarcoma de pelvis (n=1); tumor pulmonar (n=1); tumor de vaina de nervio periférico (n=1) y tumor ectodérmico (n=1).
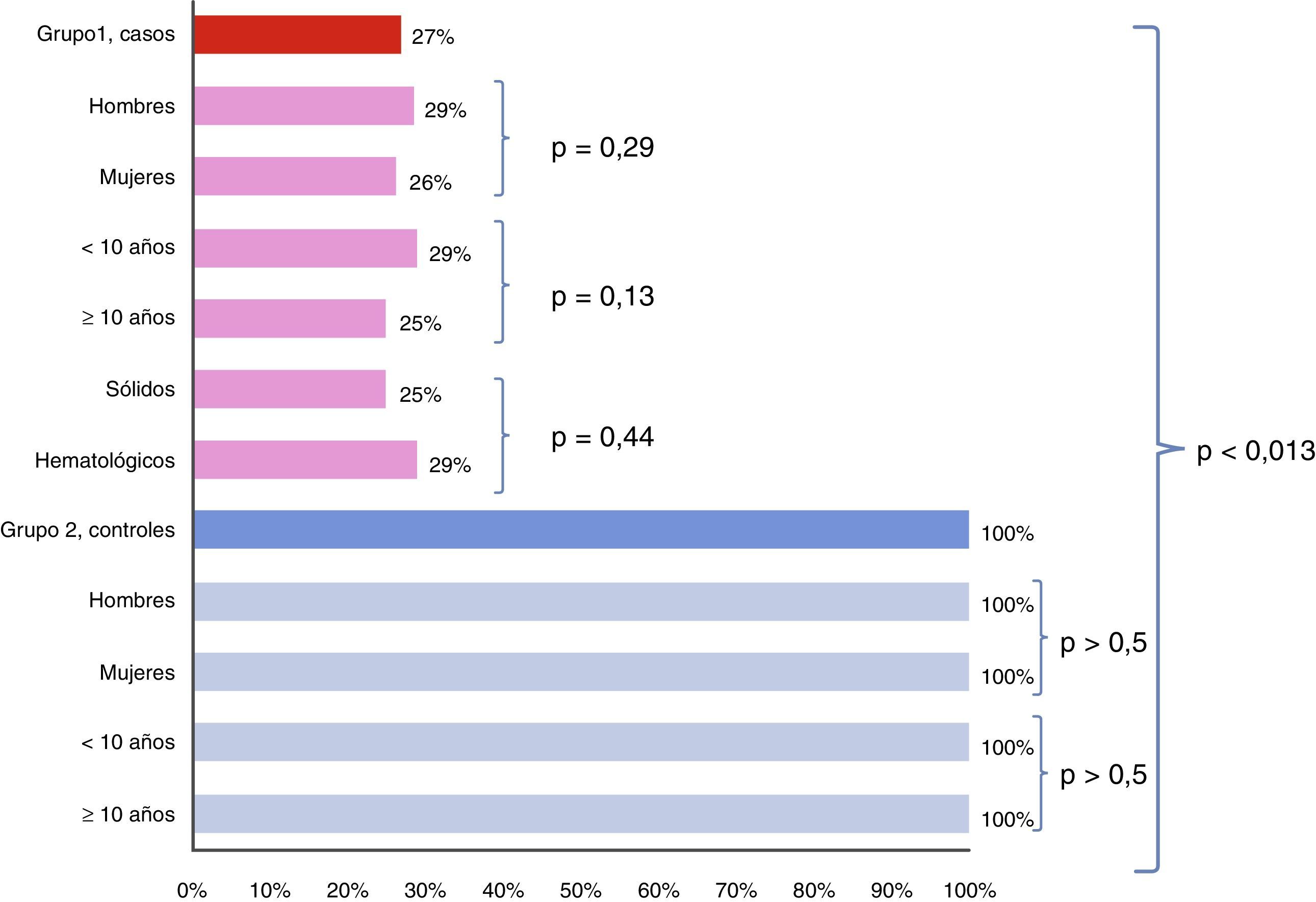
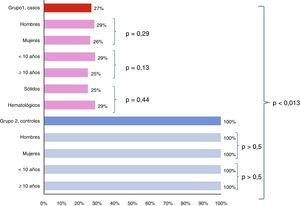
La seroconversión al completar el esquema de vacunación propuesto fue de 26,9% (n=21) en el grupo 1, casos, (RR: 0,13; IC: 0,02-0,94), sin diferencia significativa por edad (p=0,13), por género (p=0,29), ni por tipo de enfermedad oncológica (p=0,59), comparado con 100% de seroprotección en el grupo 2, control (p<0,013) (fig. 2). El análisis comparativo de la seroprotección entre los niños de los grupos 1 y 2 al completar el esquema de vacunación demuestra que existe un riesgo relativo de no lograr seroprotección de 0,38 (IC: 0,24-0,59) (p<0,003) en los niños con cáncer. En el seguimiento a los 12 meses el grupo 1, casos, solo logró títulos anti-HBs>10mUI/ml en el 31,9%, mientras que los sujetos del grupo control se mantenían en el 100% (fig. 3).
Porcentaje de sujetos que presentaron seroconversión* comparando los grupos 1 (casos) y 2 (controles) en general y por categorías de edad, género y tipo de cáncer dentro del grupo 1.
*Seroconversión se definió como títulos de anti-HBs>10mUI/ml al octavo mes de seguimiento postinicio de vacunación.
El cáncer infantil es la segunda causa de muerte en niños mayores de 5 años en Chile desde 1990. Su sobrevida se ha incrementado sostenidamente gracias a los avances en QT34–37, sin embargo la intensidad de esta produce una deficiencia inmune global, que se suma a los trastornos propios de la enfermedad subyacente9,16,38,39, cuya recuperación cuantitativa y funcional es variable9,12,38. Los factores de riesgo para estos trastornos no están del todo aclarados, proponiéndose la menor edad de la persona, independiente del género, enfermedad subyacente, duración y tipo de terapia9–12. Nuestro estudio no mostró diferencias significativas entre los grupos<y>de 10 años, ni en relación con el género ni entre los distintos tipos de cáncer.
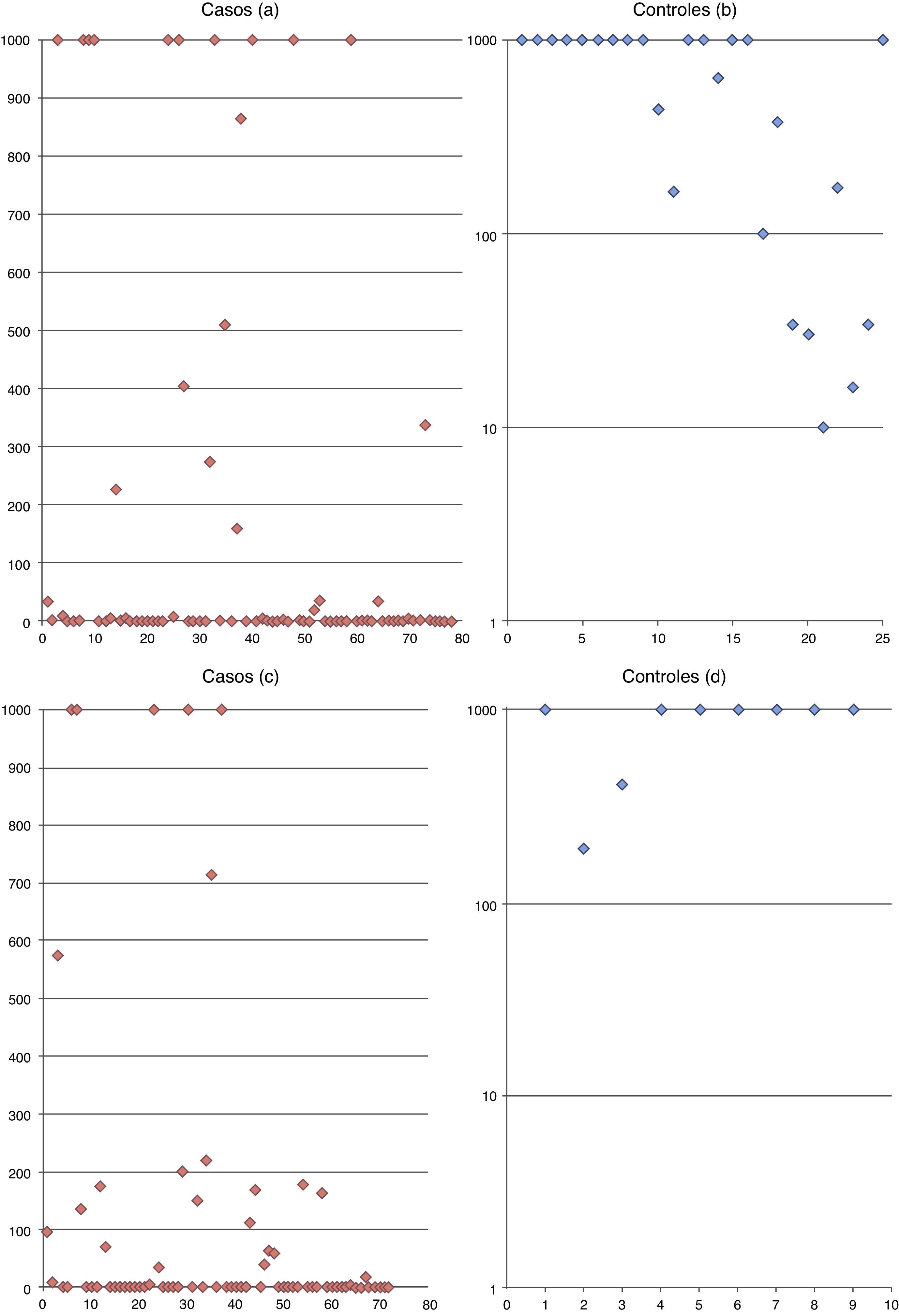
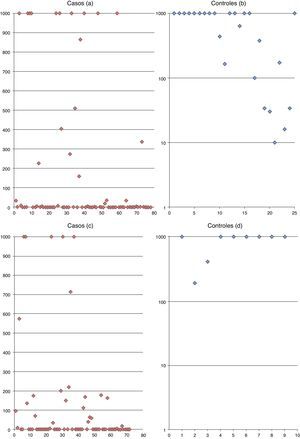
En los pacientes incluidos se logró una seroprotección de 26,9%, menor que lo reportado en otras series extranjeras (60%)21–23,40, probablemente por diferencias en el tipo de adyuvantes vacunales utilizados, momento precoz de vacunación, no consideración de la interferencia por el uso de hemoderivados durante nuestro esquema de vacunación o causas que no conocemos. El hecho de que la seroprotección en el grupo control alcanzó el 100% al octavo mes con títulos>1.000mUI/ml, manteniéndose al duodécimo mes (84% con títulos>1.000mUI/ml) en todos los sujetos, sugiere que el problema podría radicar en los trastornos inmunes asociados al cáncer y su QT, los que afectarían la inmunogenicidad en primovacunación anti-VHB con esquema reforzado, indistintamente del tipo de tumor, edad y género de los sujetos.
Ningún sujeto con seroprotección a los 8 meses vio disminuidos sus títulos de anticuerpos anti-HBs a los 12 meses, los que se mantuvieron o aumentaron. Así mismo ninguno de los pacientes con niveles bajos de anticuerpos presentó evidencia clínica ni serológica de infección por el VHB, lo que podría explicarse porque Chile es un país de baja endemicidad de infección por el VHB1,2, aun en los grupos de mayor riesgo4, como podría ser el hospedero con cáncer.
Nuestro estudio tiene limitaciones, entre ellas la alta deserción en el grupo control, con retirada de consentimiento asociado a la sucesiva toma de muestras de sangre. Los resultados, sin embargo, en los niños en que se evaluó título de anticuerpos en el grupo control, fueron altamente consistentes, mostrando una respuesta inmune robusta y sobre los niveles considerados protectores en todos los sujetos evaluados.
La conducta que debiera asumirse para los pacientes oncológicos una vez terminada su QT está aún en discusión, planteándose como estrategias el retomar el esquema habitual de vacunas, revacunar sin medir títulos de protección y, por último, medir niveles y revacunar de acuerdo a los resultados obtenidos. Zignol plantea que realizar refuerzos postesquema de vacunación sería una medida simple, costo-efectiva y útil para restaurar la inmunidad en pacientes con enfermedades neoplásicas11; sin embargo, se requieren más estudios con diseños apropiados y seguimientos prolongados para poder dar una recomendación basada en la evidencia. Nuestro estudio muestra un aumento de seroprotección hasta 31,9% en el grupo 1 a los 12 meses de seguimiento, lo cual aún es insuficiente para alcanzar los objetivos sanitarios deseados. El uso de vacunas recombinantes de tercera generación contra el VHB, expresadas en células mamíferas que contienen epítopes Pre-S/S, ha presentado mayor inmunogenicidad en grupos de riesgo, lo cual abre nuevas perspectivas para nuestros pacientes41.
Como conclusión, este estudio muestra que la primovacunación con vacuna ADN recombinante, en el momento del diagnóstico y/o remisión de la enfermedad neoplásica en niños, utilizando esquema de 0, 1 y 6 meses, con dosis reforzada no es eficaz para proteger contra el VHB. Estos resultados avalan que debiera evaluarse en esta población utilizar vacunas de tercera generación contra el VHB, con adyuvantes más inmunogénicos, esquemas reforzados a los 0, 1, 2 y 6 meses, considerando medición de títulos de anticuerpos anti-HBs a los 8 y 12 meses, con eventual uso de refuerzos vacunales y/o reevaluación de inmunogenicidad, si correspondiese.
FinanciaciónSociedad Chilena de Pediatría, Proyecto de Investigación P2008008.
Conflicto de interesesEste trabajo cumple con los requisitos sobre consentimiento/asentimiento informado, comité de ética, financiamiento, estudios animales y sobre la ausencia de conflictos de intereses según corresponda.