Los pilares terapéuticos del niño con shock séptico se mantienen en el tiempo, sin embargo, se han incorporado nuevos conceptos, siendo importante que el pediatra y el intensivista tengan conocimiento a cabalidad de ellos.
La reanimación con fluidos es una intervención fundamental, no obstante, aún no se ha establecido un tipo de fluido ideal, presentando cada uno limitaciones específicas, no existiendo evidencia sobre la superioridad de un tipo de fluido. Si a pesar de una adecuada resucitación con fluidos persiste el shock, el inicio de inótropos y/o vasopresores está indicado. En caso de refractariedad al uso de vasopresores, nuevos fármacos vasoactivos pueden ser empleados y el uso de hidrocortisona debe considerarse en niños con sospecha de insuficiencia suprarrenal.
Existe controversia respecto a la transfusión de glóbulos rojos o el nivel óptimo de glucemia, no existiendo consenso en el valor umbral para el uso de estos hemocomponentes o el inicio de insulina, respectivamente. Asimismo, la utilización de la hemofiltración de alto volumen (HFAV)aún permanece controversial, requiriendo mayores estudios para su recomendación en forma rutinaria en el curso de un shock séptico refractario. El soporte nutricional es primordial, ya que la desnutrición es una grave complicación que debe ser prevenida y tratada adecuadamente.
El objetivo de la presente revisión es entregar una actualización en los más recientes avances en tratamiento del shock séptico en la población pediátrica.
Essential therapeutic principles in children with septic shock persist over time, although some new concepts have been recently incorporated, and fully awareness of pediatricians and intensivists is essential.
Fluid resuscitation is a fundamental intervention, but the kind of ideal fluid has not been established yet, as each of these interventions has specific limitations and there is no evidence supportive of the superiority of one type of fluid. Should septic shock persists despite adequate fluid resuscitation, the use of inotropic medication and/or vasopressors is indicated. New vasoactive drugs can be used in refractory septic shock caused by vasopressors, and the use of hydrocortisone should be considered in children with suspected adrenal insufficiency, as it reduces the need for vasopressors.
The indications for red blood cells transfusion or the optimal level of glycemia are still controversial, with no consensus on the threshold value for the use of these blood products or the initiation of insulin administration, respectively. Likewise, the use of high-volume hemofiltration is a controversial issue and further study is needed on the routine recommendation in the course of septic shock. Nutritional support is crucial, as malnutrition is a serious complication that should be properly prevented and treated.
The aim of this paper is to provide update on the most recent advances as concerns the treatment of septic shock in the pediatric population.
El shock séptico es una causa importante de morbimortalidad en niños. La resucitación precoz, agresiva y guiada por metas es el pilar del tratamiento en la etapa inicial, siendo el uso de fluidos, administración de antibióticos, empleo de inótropos y/o vasopresores y la eliminación del foco infeccioso la base de este. Sin embargo, nuevas terapias han surgido como elementos coadyuvantes, algunas de ellas con evidencia de su real utilidad en la práctica clínica para determinados grupos de pacientes, mientras que otras presentan menor nivel de evidencia que apoye su uso1.
Así, el objetivo de la presente publicación es una puesta al día en el estado del conocimiento en los más recientes avances en tratamiento del shock séptico en pediatría.
Se efectuó una búsqueda en PubMed de las publicaciones sobre shock séptico y su terapéutica actual, empleando las palabras claves sepsis, shock séptico, tratamiento. Se seleccionaron, las que, en opinión de los autores, eran las más relevantes de conocer para el intensivista infantil. No es una revisión sistemática sobre el tema.
Fluidos de reanimación, productos sanguíneos y fármacos vasoactivosFluidos de reanimaciónLa reanimación con fluidos es una intervención de primera línea y piedra angular en el tratamiento del shock séptico, siendo su fin reestablecer la estabilidad hemodinámica y perfusión tisular2,3. Asimismo, cuando la administración de fluidos se realiza precozmente en el curso de shock séptico, la mortalidad se reduce2,4,5. Sin embargo, a pesar de que el uso de fluidos ha sido aprobado por décadas, solo recientemente se han realizado estudios controlados aleatorizados para evaluar su impacto en la sobrevida de estos pacientes6.
Todos los fluidos de reanimación pueden contribuir a la formación de edema, mediante la extravasación de fluidos al espacio intersticial, especialmente en condiciones de alteración de la permeabilidad como la sepsis7,8.
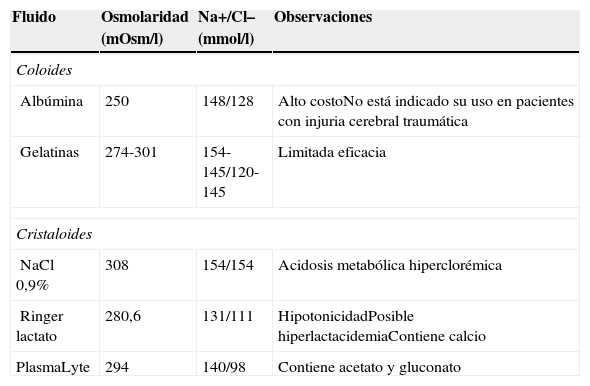
Las soluciones cristaloides son aquellas que contienen iones libremente permeables y donde el sodio y cloro determinan su tonicidad (solución salina normal 0,9% y Ringer lactato). Las soluciones coloidales se definen como aquellas que presentan moléculas relativamente incapaces de cruzar membranas capilares sanas (semipermeables) debido a su peso molecular y las cuales pueden ser naturales (albúmina) o sintéticas (dextranos, gelatinas). Ambos tipos de soluciones de reanimación poseen ventajas y desventajas. Recientemente se ha recomendado no utilizar las soluciones coloidales que contienen hidroxieltilalmidones, debido a que sus riesgos sobrepasan los beneficios que estos presentan9,10.
La solución salina normal es el fluido más utilizado y su ventaja radica en su gran disponibilidad y bajo costo, constituyéndose en la primera línea de los fluidos de resucitación. Aproximadamente, solo el 25% de la cantidad infundida permanece en el compartimento intravascular, lo que ocasiona la administración de grandes cantidades en el paciente críticamente enfermo y el consecuente desarrollo de edema intersticial. La administración excesiva de este fluido puede provocar acidosis metabólica hiperclóremica11-13, como también vasoconstricción renal y disminución de la tasa de filtración glomerular14-16. En un reciente trabajo, la administración de suero salino isotónico se asoció a una disminución de la perfusión cortical renal en comparación con la misma cantidad de Plasma-Lyte17. Sobre la base de esta hipótesis, Yunos et al.18, en un estudio prospectivo, no ciego, demostraron que en aquellos pacientes que recibieron soluciones con lactato «balanceadas» o albúmina disminuyó el uso de terapia de sustitución renal como también la incidencia de daño renal agudo.
En contraparte, para las soluciones coloidales existen datos que sugieren una mejoría en la función cardiaca en pacientes con hipovolemia19-21, como también se ha asociado a una menor administración de fluidos de reanimación (3 a 4 veces) en comparación con los cristaloides19,22. No obstante, estudios actuales con hidroxietilalmidones, han demostrado efectos dañinos con este tipo de fluidos, tales como alteración en la función renal y aumento en la necesidad de terapia de sustitución renal23-25. Considerando estos riesgos, se ha desanconsejado su uso en pacientes críticamente enfermos. Por lo tanto, no hay un tipo de fluido de reanimación ideal y cada uno presenta sus limitaciones específicas, las que van desde alteraciones de la función renal9,10 hasta su escasa disponibilidad (tabla 1). Actualmente, no hay información que confirme la superioridad de un tipo de fluido sobre otro en la resucitación hemodinámica tanto de niños como adultos10,26-29, por lo tanto, más que el tipo de fluido a emplear, lo primordial es la premura con la que este se administre. Finalmente, su elección dependerá, entre otros factores, del tipo de fluido perdido por el paciente según el sustrato fisiopatológico subyacente, los potenciales efectos adversos y la disponibilidad de estos en cada centro hospitalario30.
Tipos, composición y potenciales efectos adversos de fluidos utilizados en resucitación
| Fluido | Osmolaridad (mOsm/l) | Na+/Cl– (mmol/l) | Observaciones |
|---|---|---|---|
| Coloides | |||
| Albúmina | 250 | 148/128 | Alto costoNo está indicado su uso en pacientes con injuria cerebral traumática |
| Gelatinas | 274-301 | 154-145/120-145 | Limitada eficacia |
| Cristaloides | |||
| NaCl 0,9% | 308 | 154/154 | Acidosis metabólica hiperclorémica |
| Ringer lactato | 280,6 | 131/111 | HipotonicidadPosible hiperlactacidemiaContiene calcio |
| PlasmaLyte | 294 | 140/98 | Contiene acetato y gluconato |
La anemia es una condición común en los pacientes críticamente enfermos. Aproximadamente el 95% de los pacientes que ingresan a unidades de cuidados intensivos presentan cifras de hemoglobina bajo el valor normal, especialmente después de 3 días de permanencia31.
La causa de la anemia del paciente crítico es multifactorial32 y la importancia de la normalización de los niveles de hemoglobina radica en que la anemia está asociada a altas tasas de morbimortalidad en algunos subgrupos de pacientes, probablemente secundaria a hipoxia tisular32. La tolerancia a la anemia es dependiente del estado de la volemia, de la reserva fisiológica del paciente y si esta es de naturaleza aguda o crónica. Además, la anemia normovolémica es mejor tolerada que la hipovolémica, en la cual el gasto cardíaco (GC) disminuye agudamente.
La transfusión de glóbulos rojos tiene un papel fundamental en el tratamiento de la anemia aguda desarrollada por el paciente crítico, ya que tiene como objetivo reducir la hipoxia tisular e incrementar la entrega de oxígeno a los tejidos33. En la resucitación precoz de pacientes con sepsis grave, la instauración de un protocolo terapéutico que incluyó la transfusión de glóbulos rojos para obtener un hematocrito mayor del 30% se asoció a una disminución en la mortalidad hospitalaria2.
Sin embargo, este tratamiento no está exento de complicaciones. Pacientes que han recibido transfusiones presentan mayores tasas de mortalidad y disfunción orgánica, como también una mayor estancia hospitalaria34,35. Asimismo, en una revisión sistemática de 45 estudios observacionales en adultos críticamente enfermos, Marik y Corwin36 identificaron que la transfusión de glóbulos rojos es un factor predictor de mortalidad, complicaciones infecciosas y desarrollo de síndrome de distrés respiratorio agudo, aunque, dado su diseño metodológico, sus conclusiones deben ser evaluados en forma criteriosa.
En cuanto a cuál es el nivel apropiado de hemoglobina en los pacientes con shock séptico, es aún controversial. En una interesante publicación de Laverdière et al.37, se describe el escaso consenso existente entre los intensivistas en las prácticas de transfusión en el paciente con shock séptico, entre otros escenarios clínicos. Un hallazgo similar fue reportado por Nahum et al.38, donde un 41% de los encuestados señaló un umbral de 10g/dl de hemoglobina.
En las más exhaustivas revisiones sobre el nivel óptimo de hemoglobina en pacientes pediátricos críticos en condiciones estables, se ha corroborado que el umbral de 7g/dl disminuye los requerimientos de transfusión, sin aumentar el desarrollo de síndrome de disfunción orgánica múltiple (SDOM) o mortalidad39,40.
En el año 2011, en la comunicación del Grupo Canadiense y la red Pediatric Acute Lung Injury and Sepsis Investigators (PALISI) se evaluó el impacto de una estrategia de transfusión restrictiva (< 7,0g/dl) vs. liberal (9,5g/dl) en el pronóstico clínico. No se encontraron diferencias en el desarrollo de SDOM, estada en UCI o mortalidad41. En una reciente revisión se señaló que utilizar un umbral de hemoglobina de > 7g/dl no se asoció a un mejor pronóstico; no obstante, si a un mayor riesgo de morbimortalidad42. Además, una estrategia liberal transfusional puede ser deletérea en el paciente séptico a nivel microcirculatorio43. En la actualidad, la evidencia apoya que para el paciente inestable se debe buscar un nivel de Hb ≥ 10g/dl, salvo en el grupo etario neonatal donde este debe ser mayor.
Referente al tiempo de almacenamiento de los glóbulos rojos, Koch et al.44 demostraron que pacientes adultos transfundidos con eritrocitos con almacenamiento menor de 15 días presentaron mejores resultados (disminución de la morbimortalidad intrahospitalaria, disminución de la necesidad de soporte ventilatorio) que aquellos que recibieron glóbulos rojos con almacenamiento mayor. En otro estudio, en una cohorte de 455 pacientes pediátricos, se demostró que la transfusión de glóbulos rojos de más de 14 días de almacenamiento se asoció, de forma independiente, a un incremento de SDOM y aquellos con más de 21 días con un aumento del Pediatric logistic organ dysfunction score (score PELOD) y mortalidad45.
Es importante destacar que el médico intensivista debe evaluar el caso individualmente para establecer un apropiado umbral de transfusión de hemoglobina y tener presente los riesgos, tanto del acto de transfundir (infecciones, reacciones transfusionales, sobrecarga de fluidos, inmunosupresión, daño pulmonar, etc.) como el transfundir glóbulos rojos «viejos». Prevenir o al menos disminuir el riesgo de anemia derivada de la excesiva extracción de sangre es además una importante estrategia. Una reciente encuesta entre intensivistas concluyó que el adecuado umbral para transfundir es aún uno de los tópicos sobre el cual no hay consenso46.
PlasmaLa transfusión de plasma fresco congelado (PFC) está indicada ante sangramiento o cuando se planifique un procedimiento invasivo en un paciente con deficiencia documentada de factores de coagulación.
Se ha comprobado el amplio uso de PFC en adultos críticos, siendo su principal indicación la hemorragia y la corrección de coagulopatía adquirida47. Sin embargo, su empleo en otras situaciones no es útil, pues se observa solo un efecto discreto sobre la international normalised ratio cuando esta no se encuentra alterada (> 2,5)48.
Debe utilizarse en infusión rápida para lograr niveles efectivos de factores de coagulación.
No está recomendado como líquido de reanimación y su uso no está exento de reacciones adversas (sobrecarga de fluidos, reacciones alérgicas, etc.)49.
Fármacos vasoactivosVasopresores e inótroposLa administración de fármacos vasopresores y/o inótropos es adecuada solo luego de una apropiada resucitación con fluidos o mientras esta se efectúa. Según el perfil hemodinámico del paciente, será preciso iniciar soporte inotrópico (cuando exista evidencia de hipodébito evaluado por saturación venosa central de oxígeno), agentes nitrodilatadores y/o vasopresores.
En los pacientes pediátricos hay diversos patrones hemodinámicos de shock séptico refractario a fluidos. En su clásica comunicación, Ceneviva et al.50 reportaron que un 58% presentó un GC bajo, que respondió a inótropos y/o vasodilatadores; un 20% exhibió un GC elevado con resistencia vascular sistémica baja, respondiendo a terapia vasopresora, y un 22% presenta disfunción cardiaca y vascular, necesitando soporte inotrópico y vasopresor50.
La dopamina sigue siendo el medicamento de primera línea para la hipotensión arterial refractaria a fluidos5, aunque estudios controlados no han demostrado sus efectos protectores en el territorio esplácnico y renal51,52. Otro aspecto a considerar para el empleo de dopamina es la insensibilidad edad-específica a su uso53-55, pues por su mecanismo de acción, pacientes prematuros y lactantes menores de 6 meses, pudieran presentar inmadurez de las vesículas sinápticas que contienen noradrenalina en el sistema nervioso simpático53. Luego, ante la situación de refractariedad al uso de dopamina, podemos optar por 2 opciones, epinefrina (predominante efecto β−adrenérgico a dosis bajas) o norepinefrina según el patrón hemodinámico (shock frío o caliente).
A pesar de que el uso de fármacos inótropos y/o vasopresores está indicado en el shock séptico refractario a fluidos, estos no deben utilizarse en búsqueda de un valor arbitrario de GC y, por ende, en lograr una determinada meta de entrega de oxígeno (oxygen delivery [DO2])56-58.
Nuevos fármacos vasoactivos (vasopresina, terlipresina, levosimendán)El papel de estos fármacos aparece en el contexto de shock séptico refractario a altas dosis de catecolaminas, el cual se asocia a una elevada tasa de morbimortalidad. La mayoría de los trabajos actualmente disponibles son pequeñas casuísticas, donde se han empleado como terapia de rescate. Es frecuente observar una mejoría de la presión arterial, la diuresis y la depuración de lactato, en concomitancia con descenso de las dosis empleadas de fármacos vasoactivos59.
Arginina vasopresinaEs una neurohormona sintetizada a nivel hipotalámico, con un papel clave en la homeostasis circulatoria y en la regulación de la osmolalidad sérica60. Actúa en los receptores vasculares (V1) causando vasoconstricción arterial; no obstante, en ciertos órganos puede provocar vasodilatación selectiva61 y a nivel de túbulo renal (V2) incrementando la reabsorción de agua libre. Su uso fue sugerido al demostrarse niveles plasmáticos inapropiadamente bajos en pacientes con shock séptico62-64. Su indicación es en shock séptico vasopléjico, refractario al uso de altas dosis de vasopresores65-67.
En una reciente comunicación en población pediátrica se utilizó a dosis bajas (0,0005-0,002 U/kg/min) vs. placebo, no demostrándose mejoría en el tiempo de estabilización hemodinámica como tampoco en el pronóstico, pero sí se encontró una tendencia hacia una mayor mortalidad (aunque no significativa) en los niños tratados68.
A pesar de estos datos, es necesario disponer de estudios controlados para determinar su real eficacia, dosis, tiempo ideal de inicio y perfil de seguridad en pacientes pediátricos, ya que la evidencia actual está limitada por el reducido número de estudios existentes.
TerlipresinaEs un análogo sintético de la arginina vasopresina que presenta una mayor selectividad para los receptores V1, con una vida media más larga. Se puede utilizar en bolo (20μg/kg cada 4 a 6h) o en infusión continua (4-20μg/kg/h)69.
Rodríguez-Núñez et al.70 presentaron una serie de 15 niños, la mitad de ellos con enfermedad meningocócica, quienes fueron reclutados luego de estar recibiendo al menos 2 catecolaminas en dosis altas. Se observó una rápida elevación de la presión arterial con la consiguiente disminución de dosis de fármacos vasoactivos empleados y mejoría en la sobrevida.
En otro trabajo, niños con shock séptico e hipotensión arterial refractaria71 fueron aleatorizados para recibir tratamiento con terlipresina por un máximo de 96 h, observándose un incremento en la presión arterial pero sin efecto sobre la mortalidad. Recientemente, Filippi et al.72 comunicaron su uso en pacientes neonatales con hipotensión refractaria asociada a hipertensión pulmonar. Se observó un incremento en la presión arterial, diuresis y mejoría en la depuración de lactato, permitiendo un rápido destete en el uso de las catecolaminas empleadas. Sin embargo, su uso no está exento de eventos secundarios, dentro de los cuales se han reportado lesiones isquémicas73, desequilibrio electrolítico y graves alteraciones en el flujo microcirculatorio74, por lo que su utilización debe ser en forma cautelosa. Finalmente, según la evidencia actualmente disponible, tanto vasopresina como terlipresina deben ser vistos como agentes de rescate en el shock refractario75.
LevosimendánEs un fármaco con efecto en la contractilidad miocárdica, actúa primariamente por unirse a la troponina C y aumentar la sensibilidad del miofilamento al Ca+2. Además presenta un efecto vasodilatador por estimulación de los canales de potasio ATP dependiente en el músculo liso vascular, logrando una caída en la poscarga. El levosimendán no aumenta el Ca+2 intracelular, como tampoco aumenta el consumo de oxígeno (VO2), además no presenta actividad proarrítmica. Su efecto hemodinámico se mantiene hasta 7 a 9 días después de suspender su infusión76.
Su utilidad ha sido estudiada, principalmente, en pacientes adultos con falla cardíaca aguda. Los reportes pediátricos son escasos y se limitan la mayoría de ellos a estados de hipodébito en el postoperatorio de cardiocirugía77 o en miocarditis aguda78.
Las comunicaciones sobre su utilidad en shock séptico comenzaron hace más de una década, con el estudio experimental animal de Oldner et al.79, donde se observó una mejoría en el GC y DO2. Así, dado su efecto en la depresión cardíaca inducida por sepsis, se ha propuesto su uso en esta condición80, observándose mejoría en los indicadores de hemodinamia sistémica y regional81. Recientemente, se comunicó la experiencia clínica con la infusión de levosimendán en dos lactantes con shock séptico hipodinámico resistente a catecolaminas, demostrándose un aumento en la contractilidad miocárdica y mejoría de la perfusión tisular, mientras hubo una reducción de los niveles de lactato e incremento en el débito urinario82. La combinación de levosimendán y epinefrina parece ser, desde el punto de vista teórico, una muy buena alternativa para el shock séptico con hipodébito significativo83,84. Su gran inconveniente, en la actualidad, es su elevado costo.
Suplementación esteroidalLos esteroides fueron ya propuestos para el tratamiento de las infecciones graves en el año 195485, sin embargo, su uso en el shock séptico ha sido controversial por décadas86,87. Un resurgimiento de este tema fue generado por Annane et al.88, quien describió un estado de insuficiencia suprarrenal relativa (ISR) en adultos con shock séptico y cuyo tratamiento con hidrocortisona logró una reducción en la mortalidad. Es sabido que la incidencia de insuficiencia suprarrenal (ISR) variará según la etiología, gravedad y los criterios empleados para definirla89 pero se asume que existe ISR absoluta en el contexto de un shock séptico refractario a catecolaminas, cuando la concentración de cortisol realizada al azar es < 18μg/dl e ISR relativa cuando 30 a 60 min postestimulación con hormona adrenocorticotropa el incremento de cortisol es ≤ 9μg/dl5, no obstante, no se recomienda usar sistemáticamente esta prueba.
Su uso en el contexto de shock séptico refractario a fluidos y catecolaminas logra una mejoría en el estado hemodinámico y disminuye la necesidad del uso de vasopresores88,90-92. En los estudios iniciales se utilizaron altas dosis de corticoides en cursos cortos, pero no produjeron efectos favorables93,94. La observación de que la sepsis grave está asociada a ISR relativa88 o resistencia del receptor de glucocorticoides inducida por inflamación sistémica95 hizo utilizar bajas dosis de corticoides por largos periodos, obteniéndose reducción de los días de uso de vasopresores y en la mortalidad a los 28 días. A raíz de estos datos, la dosis actualmente recomendada es de 1-2mg/kg/día cada 6-8h (200-300mg/día)96,97.
El estudio CORTICUS98 fue un ensayo clínico aleatorizado, controlado con placebo, el cual se efectuó en medio millar de pacientes adultos (65% quirúrgicos) con sepsis o shock séptico de menos de 72 h de evolución. El resultado primario fue la mortalidad a los 28 días, no encontrándose diferencia para la totalidad de los pacientes (hidrocortisona 34,3%; placebo 31,5%) o en los no respondedores al test de estimulación con corticotropina. En el grupo en que se usó hidrocortisona, el shock revirtió más rápido que en el grupo placebo, observándose una pronta recuperación de la disfunción cardiovascular.
En niños con shock séptico, entre un 30-55% desarrolla esta condición89,99, presentando mayor riesgo aquellos con shock séptico grave100, terapia esteroidal crónica, anomalías estructurales del sistema nervioso central y púrpura fulminans meningocóccico101. En este último grupo se ha descrito que los pacientes fallecidos presentan una inadecuada respuesta endocrina102.
En una reciente comunicación, Hebbar et al.89 desarrollaron un protocolo con una prueba con bajas dosis de adrenocorticotropina y suplementación empírica de gluco/minerolocorticoide en niños con síndrome de respuesta inflamatoria sistémica y shock dependiente de vasopresores. La mayoría de ellos presentaron alguna forma de insuficiencia suprarrenal, siendo significativamente superior en niños mayores de 2 años. Con la administración de esteroides hubo reducción en la dosis y duración del uso de vasopresores.
La presencia de ISR en pacientes pediátricos con sepsis grave está asociada con un pobre pronóstico103. De otro modo, un estudio de cohorte retrospectivo pediátrico señaló que no existe evidencia que los esteroides estén asociado a mejor pronóstico en pacientes sépticos, y aunque pudieran ser utilizados en pacientes con mayor gravedad, su uso se asoció a mayor mortalidad104.
Su uso está indicado en aquellos pacientes con shock séptico refractario a catecolaminas o en quienes presentan factores de riesgo para desarrollar ISR. En la actualidad, la mayoría de los centros hospitalarios emplean bajas dosis de esteroides si el paciente persiste con shock séptico, después de una adecuada resucitación con fluidos y catecolaminas46.
Control de glucemia y uso de insulinaEl interés por mantener la condición de normoglucemia resurgió luego del trabajo de van den Berghe et al.105, donde se utilizó terapia insulínica para mantener niveles de glucemia entre 80-110mg/dl, observándose una reducción de la mortalidad. Está ampliamente demostrado que la presencia de hiperglucemia en el paciente críticamente enfermo es un biomarcador de gravedad de la enfermedad y está asociado a mal pronóstico106,107.
Fisiopatológicamente, la hiperglucemia observada en el paciente crítico es secundaria a hiperinsulinismo por resistencia periférica a esta en el tejido adiposo, músculo estriado esquelético y cardíaco108,109 e incremento de la gluconeogénesis hepática por aumento de las hormonas contrarreguladoras de la insulina110. No obstante, en una provocadora comunicación de niños con meningococcemia se describió la existencia de hiperglucemia asociada a hipoinsulinemia, más que a la existencia de resistencia a la insulina111.
El objetivar esta condición metabólica es trascendental, ya que puede inducir un estado proinflamatorio atribuible a la sobrecarga de glucosa y estrés oxidativo celular109,112 y ser uno de los mecanismos involucrados en la refractariedad al uso de vasopresores, secundario a un aumento de óxido nítrico por la enzima óxido nítrico sintetasa inducible113 y causar disfunción inmunitaria, tanto celular como humoral, desempeñando un papel importante en el desarrollo de la inmunoparálisis del paciente séptico114,115.
Empero existe controversia en relación con el estricto control de la glucemia y en qué momento de la evolución comenzar a tratarla116. Según un metaanálisis efectuado por Griesdale et al.117 y Wiener et al.118 en población adulta, la terapia intensiva con insulina aumentó el riesgo de hipoglucemia y no confirió beneficio en la mortalidad. En el estudio Normoglycemia in Intensive Care Evaluation-Survival Using Glucose Algorithm Regulation (NICE SUGAR)119 se demostró una mayor mortalidad a los 90 días en el grupo tratado con insulina en comparación con el grupo convencional, como también el desarrollo de hipoglucemia grave fue más frecuente en el grupo sometido a un control estricto de la glucemia. La hipoglucemia debe ser considerada como un factor de riesgo independiente de mortalidad (neuroglucopenia)23,120.
A diferencia de los estudios realizados en adultos, en pacientes pediátricos no se ha encontrado diferencia en la mortalidad en relación con los niveles de glucemia. Branco et al.121 diseñaron un estudio prospectivo sobre control de la glucemia en una población pediátrica general. El objetivo fue mantener la glicemia entre 60-140mg/dl con el uso de insulina. Empleando este protocolo, un tercio de los pacientes requirió el uso de insulina, pero con un mayor incidencia de hipoglicemia (20% vs. 3%). No hubo diferencia en la mortalidad en relación con los niveles de glicemia.
La variabilidad de la glucemia es un predictor independiente de mortalidad en pacientes críticos, especialmente con sepsis/shock séptico122,123. Existe evidencia que cambios rápidos en la concentración plasmática de glucosa originan daño endotelial y celular124-128.
Actualmente, en la población adulta se recomienda mantener niveles de glucemia menor a 150mg/dl5, pero en pacientes pediátricos no se puede recomendar un nivel óptimo de glicemia por ausencia de datos para este grupo etario.
Soporte nutricionalAproximadamente, un 20 a 30% de los niños hospitalizados presentan malnutrición en el momento de su ingreso o durante su estadía129; sin embargo, en los pacientes críticamente enfermos esta incidencia puede variar entre un 25 y un 70%130,131. La malnutrición presentada por estos niños es usualmente de origen multifactorial132.
El desequilibrio energético y proteico de estos pacientes es secundario a la liberación de mediadores proinflamatorios, lo que contribuye a la mantención de un estado catabólico permanente. La desnutrición calórico-proteica ocasiona una disminución en la concentración de antioxidantes (glutatión y vitamina E), comprometiendo la capacidad de neutralizar radicales libres y por ende evitar el daño tisular133. Perez et al.134 en un estudio observacional y prospectivo evaluaron la relación existente entre el estado nutricional con pronóstico de la enfermedad meningocócica, encontrándose una asociación de mayor gravedad y letalidad en los que presentaban mayor relación peso/edad, talla/edad e índice de masa corporal. En contraparte, al analizar los parámetros clínicos y de laboratorio habitualmente empleados como predictores de gravedad para la enfermedad meningocócica, ninguno se asoció a las variables antropométricas evaluadas.
En un estudio de cohorte prospectivo efectuado en Brasil se reportó que un 45% de los pacientes admitidos eran desnutridos al momento del ingreso. No se correlacionó la presencia de desnutrición con la mortalidad, pero sí con la duración de la ventilación mecánica y estadía intra-UCI135.
Recientemente, se evaluó la suplementación de la dieta con cinc, selenio, glutamina y un secretagogo de prolactina (metoclopramida) en el desarrollo de sepsis nosocomial, no observándose ventaja en la población inmunocompetente, pero sí un descenso en la frecuencia de infecciones nosocomiales en pacientes inmunocomprometidos136.
Con respecto a cuál vía utilizar (enteral/parenteral) para iniciar la nutrición, varios estudios han demostrado que la mayoría de los niños críticamente enfermos toleran bien la nutrición enteral precoz, sin aumentar la incidencia de complicaciones130,137. Su ventaja radica en que es más fisiológica, presentando un efecto trófico sobre la mucosa intestinal y estimula el sistema inmunitario local, disminuyendo la translocación bacteriana, reduciendo la incidencia de sepsis y falla multiorgánica132.
Terapia de sustitución renal-hemofiltración de alto volumenTerapia de sustitución renalEl daño renal agudo es frecuente en el paciente críticamente enfermo y es una grave complicación en el curso del shock séptico, empeorando su pronóstico138. En el paciente séptico las técnicas de depuración de carácter continuo (hemodiafiltración venovenosa) son mejor toleradas que las de carácter intermitentes y que la diálisis peritoneal139,140.
En el contexto de shock séptico, esta terapia es una herramienta útil, al permitir un uso de fluidos más liberal e independiente del débito urinario horario141 y, a su vez, si esta es utilizada precozmente, evita sobrecargas de fluidos deletéreas en estos pacientes, lo cual ocasiona disfunción orgánica secundaria142-145.
Hemofiltración de alto volumenEl tratamiento en la actualidad del shock séptico considera una resucitación guiada por objetivos hemodinámicos e intervenciones basadas en la evidencia, como acciones primordiales1,146-148. No obstante, para el shock séptico refractario han surgido terapias no convencionales consistentes en técnicas extracorpóreas de purificación sanguínea, dentro de las cuales está, entre otras, la hemofiltración de alto volumen (HFAV)149-152. La HFAV debe ser iniciada sin necesidad de encontrarse establecida una falla renal aguda, sino que con un objetivo hemodinámico.
El uso de HFAV es una terapia relativamente reciente y es definida por una dosis continua de volumen de filtración > 50ml/kg/h o intermitente (pulsos) por 4 a 12h en un rango de 100-120ml/kg/h149,153.
La hipercitocinemia es riesgosa en el paciente séptico y la reducción de sus niveles a un rango homeostático pudiese ocasionar una mejoría en el pronóstico154. Para esto, la remoción de citocinas mediante el uso de técnicas extracorpóreas de purificación sanguínea es una opción. Las citocinas son moléculas medianas hidrosolubles (0,5-60 kDa), las cuales existen en forma libre en la circulación. Estas características las convierten en objetivos adecuados para su remoción mediante técnicas extracorpóreas.
La remoción de mediadores inflamatorios no es selectiva y ocurre principalmente por el mecanismo de transporte convectivo (proporcional a la dosis de ultrafiltración y al coeficiente de cribado de los solutos) y en parte por adsorción. En la actualidad, para aumentar la eliminación se emplean membranas con alto punto de corte (high cut-off hemofiltration techniques) que permite la eliminación más eficaz de citocinas155.
Se ha postulado la combinación de diversos mecanismos hipotéticos como son: 1) la remoción solo del peak de concentración de citocinas pro y antiinflamatorias en sangre156, cambiando el foco desde la simple eliminación de citocinas a la inmunomodulación; 2) el umbral de inmunomodulación, en el cual la remoción de citocinas desde la sangre provoca un arrastre desde el espacio extra e intracelular, ocasionando una caída de mediadores inflamatorios intersticiales hasta un punto donde se inhibe la cascada inflamatoria157, y 3) la optimización del flujo linfático (entre 20 a 40 veces) ocasionada por la elevada cantidad de cristaloides usados como solución de reemplazo para con la HFAV, lo que origina un significativo arrastre de mediadores inflamatorios al compartimento sanguíneo, dejándolos así disponibles para su remoción158.
Recientemente, se ha señalado que la HFAV puede actuar al nivel inflamatorio restaurando la función inmunitaria a través de la regulación de monocitos y neutrófilos159.
La base científica del concepto de HFAV se apoyó en un inicio en modelos ex vivo, que mostraron eliminación de citocinas y factores del complemento160, y también en experimentación animal, que evidenció mayor estabilidad hemodinámica y sobrevida161.
En los últimos años la HFAV ha evolucionado a una terapia auxiliar frecuentemente utilizada en el shock séptico162; sin embargo, su eficacia no está aún completamente establecida163, existiendo variabilidad en la técnica aplicada en cuanto a duración, dosis de la terapia y tipo de hemofiltro empleado.
Las primeras comunicaciones de estudios clínicos en humanos, la mayoría efectuados en shock séptico refractario, señalaron una disminución en el requerimiento de vasopresores con el uso de HFAV164. Ha sido documentado para la modalidad de pulso una mejoría en la hemodinamia sistémica y descenso en la mortalidad, lo cual presenta evidentes ventajas prácticas y de costo165,166.
En el reciente trabajo IVOIRE se concluye que no se puede recomendar el uso de HFAV para los pacientes adultos con shock séptico y falla renal163. Aquí se utilizó una dosis de 70ml/kg/h por 96 h, no demostrándose ningún efecto benéfico en la mortalidad. Con el uso de HFAV existen potenciales consecuencias adversas relacionadas con la pérdida excesiva de electrolitos (hipofosfatemia, hipocalemia)163, micronutrientes 167, aclaramiento de antibióticos168-170 y de anticonvulsivantes.
De las escasas comunicaciones reportadas en la población pediátrica, destaca la de Journois et al.171, en donde se utilizó HFAV en pacientes sometidos a cirugía cardiaca con bypass cardiopulmonar, mostrando una disminución del sangrado postoperatorio, el tiempo de extubación y los niveles plasmáticos de citocinas. Sin embargo, aún falta confirmar la real utilidad de esta terapia en pacientes pediátricos sépticos.
Una reciente revisión sistemática y metaanálisis sobre el uso de HFAV, ya sea en la modalidad continua o intermitente, no demostró beneficio en la mortalidad o en la recuperación comparada con la hemofiltración estándar172.
En la actualidad existe controversia sobre si la HFAV presenta un papel eficiente para ser recomendada rutinariamente como terapia coadyuvante en el shock séptico refractario.
ConclusionesEl shock séptico es un problema de salud pública, con una importante morbimortalidad asociada. Su tratamiento debe ser precoz y agresivo, con el objetivo de normalizar la perfusión tisular.
El tratamiento mediante el uso de fluidos, administración de antibióticos de amplio espectro, empleo de agentes inótropos y/o vasopresores y la eliminación del foco infeccioso, posee contundente evidencia que mejora el pronóstico de los pacientes con shock séptico.
Luego de efectuada esta etapa de resucitación inicial, se puede señalar que para la reanimación con fluidos no existe evidencia sobre la superioridad de un tipo sobre otro. En caso de refractariedad al uso de vasopresores, el uso de hidrocortisona debe considerarse y nuevos fármacos vasoactivos pueden ser empleados.
Aún existe controversia referente a la transfusión de glóbulos rojos o uso de insulina, no existiendo consenso en el valor umbral de hemoglobina o nivel óptimo del control glucémico, respectivamente. El soporte nutricional precoz es primordial, ya que la desnutrición es una grave complicación que debe ser prevenida y tratada adecuadamente. Las técnicas de depuración sanguínea de carácter continuo son mejor toleradas que las de carácter intermitentes, evitando sobrecargas de fluidos deletéreas, las cuales ocasionan disfunción orgánica secundaria. Existen fundamentos teóricos para el uso de HFAV; no obstante, permanece controversial si presenta un papel eficiente para ser recomendada rutinariamente como terapia coadyuvante en el shock séptico refractario.
AddendumDesde la aceptación de este manuscrito han sido publicados relevantes artículos en pacientes adultos con shock séptico173–175, los cuales evalúan la efectividad del uso de la terapia temprana dirigida por metas (Early Goal-Directed Therapy, [EGDT]), base de las recomendaciones para el paquete de reanimación inicial de la Campaña sobreviviendo a la Sepsis. En ellos no se demostró con su aplicación una disminución de la mortalidad a los 90 días173,174, en comparación a un cuidado estándar. Además, una vez asegurada una terapia antibiótica y de fluidos de reanimación adecuada, el manejo hemodinámico de acuerdo al protocolo EGDT no resultó en una mejoría del pronóstico vital174.
Conflicto de interesesEste trabajo cumple con los requisitos sobre consentimiento/asentimiento informado, comité de ética, financiación, estudios animales y sobre la ausencia de conflicto de intereses según corresponda.