Las infecciones de presentación comunitaria por Staphylococcus aureus resistente a meticilina (SARM) son un fenómeno creciente. Sin embargo, existe escasa información acerca de las bacteriemias de presentación comunitaria (BPC) por SARM en nuestro medio. Los objetivos de este estudio son evaluar la frecuencia, la epidemiología clínica y molecular, las características clínicas y las características pronósticas de las BPC por SARM con respecto a las bacteriemias nosocomiales (BN).
MétodosEstudio de cohorte prospectivo y multicéntrico; se incluyeron todos los casos incidentes de bacteriemia por SARM en 59 hospitales españoles durante el mes de junio de 2003. Se consideró BPC a aquella que se diagnosticó en las primeras 48h de ingreso del paciente, y BN cuando se realizó posteriormente. Las cepas se tiparon mediante electroforesis en campo pulsante y multilocus sequence typing; los tipos de casete cromosómico estafilocócico mec y producción de leucocidina de Panton-Valentine se estudiaron por reacción en cadena de la polimerasa.
ResultadosSe incluyeron 64 bacteriemias; 21 (33%) de ellas se consideraron como BPC. En todos estos casos se encontró relación con la atención sanitaria o bien se detectó una cepa genotípicamente relacionada con las nosocomiales. No se observaron diferencias significativas entre los 2 grupos en cuanto a los datos demográficos, las características intrínsecas, el pronóstico o las características de las cepas. En relación con el foco de origen, las originadas en un catéter vascular fueron más frecuentes en las BN (el 39,5 versus el 5%; p = 0,005) y las originadas en el aparato urinario fueron más frecuentes en las BPC (el 25 versus el 0%; p = 0,001). La mayoría de las cepas perteneció a 2 clones relacionados con el clon pandémico denominado “pediátrico”.
ConclusiónEs necesario considerar SARM en el tratamiento empírico de determinados síndromes infecciosos de pacientes con sepsis de presentación comunitaria y relación previa con los cuidados sanitarios.
Community-onset infections caused by methicillin-resistant Staphylococcus aureus (MRSA) are increasing. However, there is little information about community-onset bacteremia (CB) due to MRSA in Spain. The objectives of this study were to evaluate the prevalence, clinical and molecular epidemiology, clinical features, and prognosis of CB due to MRSA in comparison with nosocomial bacteremia (NB).
MethodsProspective multicenter cohort study; all new cases of bacteremia due to MRSA occurring during June 2003 in 59 Spanish hospitals were included. Episodes diagnosed during the first 48 hours of admission were considered CB, and otherwise, NB. Isolates were typed by pulsed field electrophoresis and multilocus sequence typing. Staphylococcal cassete chromosome mec types and Panton-Valentine leukocidin genes were studied by polymerase chain reaction.
ResultsSixty-four cases were included; 21 (33%) were classified as CB. In all CB cases, a relation was found with health care, or the isolate proved to be clonally related to nosocomial isolates. There were no significant differences between the groups in terms of demographic data, underlying conditions, prognosis, or characteristics of the isolates. Regarding the source of bacteremia, catheter-related cases were more frequent in NB than CB (39.5% vs 5%, P=0.005), whereas a urinary source was more frequent in CB than NB (25% vs 0%, P=0.001). Most isolates belonged to 2 clones related to the pandemic “pediatric” clone.
ConclusionMRSA should be considered in empiric treatment for certain infectious syndromes in patients with healthcare-associated community-onset sepsis.
El Staphylococcus aureus resistente a meticilina (SARM) se ha considerado un patógeno principalmente nosocomial, aunque en los últimos años el problema ha trascendido los límites de los hospitales. La colonización por SARM puede ser muy prolongada. Esto puede originar la diseminación del microorganismo desde los hospitales de agudos a centros de crónicos y geriátricos, en algunos de los cuales SARM se ha convertido en un patógeno endémico1,2. Además, pacientes que adquirieron la colonización por SARM en un ingreso previo pueden presentar infecciones de presentación aparentemente comunitaria causadas por SARM. Dado que en los últimos años se están describiendo cepas distintas de SARM de adquisición puramente comunitaria3, es importante no confundir estas infecciones estrictamente comunitarias con las anteriores4.
El ingreso en hospitales de agudos de pacientes colonizados por SARM supone un problema desde varios puntos de vista: desde la perspectiva epidemiológica, porque si la colonización por SARM pasa inadvertida, no se toman las medidas de control necesarias para evitar la transmisión, y desde la perspectiva clínica porque, en caso de infección, supone frecuentemente un retraso en el inicio de un tratamiento apropiado, lo que se asocia con mayor mortalidad en los pacientes con sepsis5.
S. aureus es una causa frecuente y grave de bacteriemia. A pesar de que las bacteriemias de presentación comunitaria (BPC) por SARM suponen un problema emergente6,7 son muy escasos los datos disponibles acerca de este problema en nuestro medio8. El objetivo de nuestro estudio es analizar la frecuencia y las características epidemiológicas, microbiológicas y clínicas de las BPC por SARM en comparación con bacteriemias nosocomiales (BN).
Material y métodosÁmbito y diseñoEste estudio forma parte del proyecto SARM 2003 GEIH/GEMARA/REIPI: Grupo de Estudio de Infección Hospitalaria/Grupo de Estudio de Mecanismos de Acción y Resistencia Antimicrobiana/Red Española de Investigación en Patología Infecciosa), un estudio multicéntrico que tenía como objetivo investigar las características epidemiológicas, microbiológicas y clínicas de SARM en España. La metodología general del proyecto se ha publicado previamente5,9,10.
El proyecto incluyó el estudio de una cohorte prospectiva de todos los casos incidentes de colonización o infección por SARM en los 66 hospitales participantes en el mes de junio de 2003. En este análisis incluimos exclusivamente la subcohorte de casos de bacteriemia por SARM, ocurridos en 59 de los 66 hospitales participantes (en los otros 7 centros no hubo casos de bacteriemia). De cada uno de los pacientes se recogieron los siguientes datos: edad, sexo, adquisición, relación previa con los cuidados sanitarios, servicio, estancia previa al cultivo, enfermedades de base, procedimientos invasivos, tratamiento antimicrobiano recibido en los 2 meses previos, origen de la bacteriemia y gravedad, tratamiento empírico y dirigido recibidos y mortalidad. Se siguió a los pacientes hasta el fallecimiento (si ocurrió durante el ingreso) o hasta 30 días después del diagnóstico de la bacteriemia. Se compararon las características de los casos de presentación comunitaria y nosocomial.
DefinicionesSe consideró BPC a aquella que se diagnosticó en las primeras 48 h del ingreso del paciente, y BN cuando se realizó posteriormente11. Las BPC se consideraron como relacionadas con los cuidados sanitarios si se cumplía alguno de los siguientes criterios: 1) ingreso superior a 24h en un hospital de agudos en los últimos 3 meses; 2) tratamiento intravenoso domiciliario o en hospital de día, cuidados domiciliarios especializados o hemodiálisis en los últimos 30 días, o 3) residentes en centros de crónicos o residencias sociosanitaras2; cuando estas variables no pudieron recogerse se consideraron relacionados con los cuidados sanitarios los casos producidos por cepas clonalmente relacionadas con las cepas nosocomiales12.
La gravedad de la enfermedad de base se midió en función del índice de Charlson13. El diagnóstico de bacteriemia y el tipo de infección en cada caso se establecieron de acuerdo con criterios clínicos y microbiológicos, según los criterios de los Centers for Disease Control and Prevention11. Se definieron sepsis, sepsis grave y shock séptico por criterios estandarizados14.
Se consideró tratamiento empírico al indicado antes de conocer la etiología y sensibilidad del microorganismo causante de la infección, y se consideró tratamiento dirigido al indicado tras conocerlas. El tratamiento antimicrobiano se consideró como apropiado cuando incluyó al menos un antimicrobiano con actividad in vitro frente al aislado, a las dosis habituales (si el único fármaco activo era un aminoglucósido, se consideró inapropiado). Se estudió la mortalidad a los 30 días y la mortalidad asociada, definida como aquélla ocasionada en relación directa con la infección a juicio del investigador y sin evidencia de otra causa plausible.
Estudios microbiológicosLos aislados identificados como SARM en cada uno de los hospitales se enviaron a un laboratorio de referencia (Servicio de Microbiología, Hospital de Bellvitge, Barcelona), donde se comprobó la identificación mediante métodos fenotípicos y genotípicos. Se estudió la primera cepa aislada en cada paciente. La metodología de los estudios microbiológicos se ha publicado en otro artículo10. En resumen, la sensibilidad a los antimicrobianos se estudió mediante el método de difusión con disco, de acuerdo con las recomendaciones del Clinical Laboratory Standards Institute; los aislados se clasificaron en patrones de resistencia. La relación Clinical Laboratory Standards Institute; clonal se estudió mediante electroforesis en campo pulsado (ECP) y, en cepas seleccionadas, por multilocus sequence typing, cuyos perfiles se compararon con los de los clones pandémicos EMRSA-15, EMRSA-16, ATCC BAA-44 (clon ibérico) y ATCC BAA-42 (clon pediátrico). En cepas seleccionadas se estudió la presencia de los genes que codifican la producción de la leucocidina de Panton-Valentine (LPV) (incluyendo los casos de presentación comunitaria, los originados en infecciones de piel y partes blandas y las cepas sensibles a todos los antimicrobianos no betalactámicos) y el tipo de casete cromosómico estafilocócico mec (en representantes de cada clon identificado por ECP).
Análisis estadísticoLas variables cualitativas se compararon mediante el test de Chi cuadrado. Se consideró significativo un valor de p<0,05.
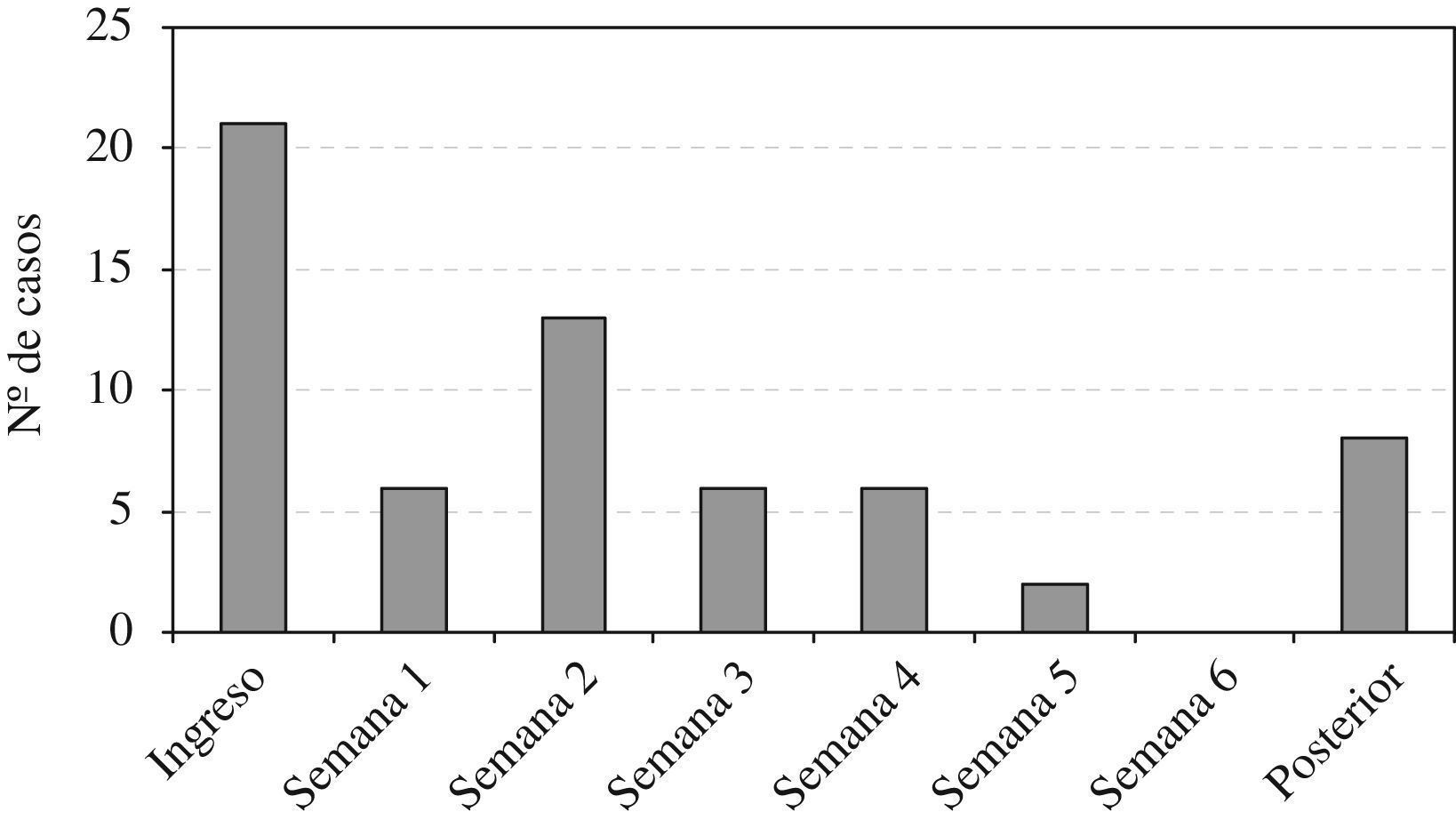
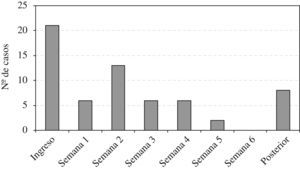
ResultadosSe incluyeron 64 episodios de bacteriemia por SARM; 21 (33%) se consideraron de presentación comunitaria; de éstos, en 12 casos se encontró relación previa con los cuidados sanitarios (6 habían ingresado previamente, 4 eran residentes de centros sociosanitarios y 2 habían recibido asistencia especializada ambulatoria) y en los 9 casos restantes (en los que esta relación no pudo estudiarse adecuadamente por falta de datos) se aisló una cepa genotípicamente relacionada con las nosocomiales. En la figura 1 se muestra el número de casos de bacteriemia por SARM en función de la duración del ingreso al diagnóstico.
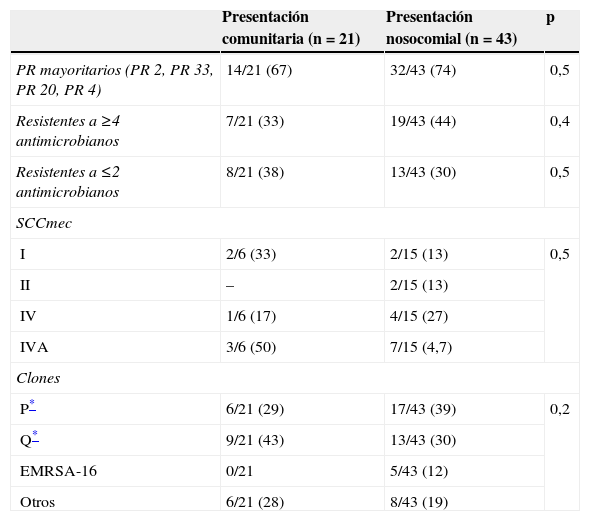
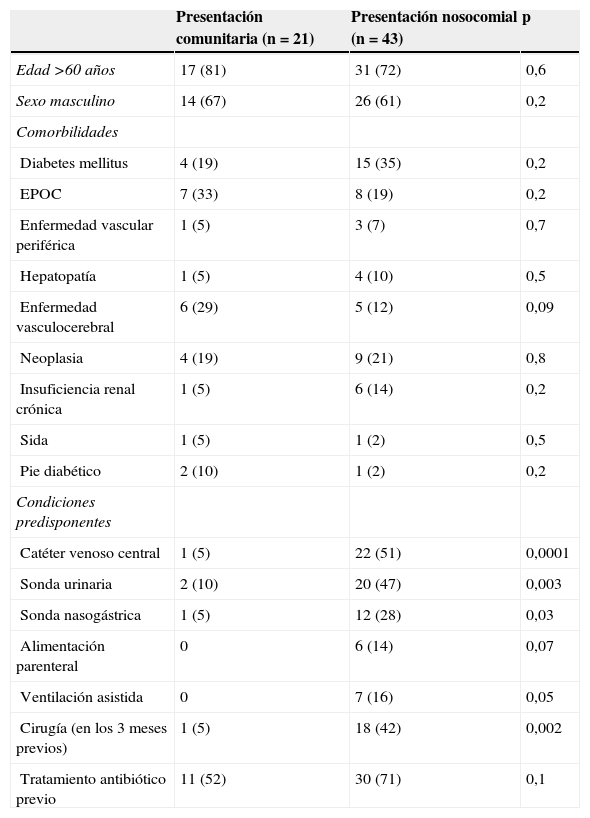
No se encontraron diferencias significativas en cuanto a las características microbiológicas de las cepas aisladas de episodios de presentación comunitaria y nosocomial (tabla 1) ni en cuanto al sexo, edad o enfermedades de base (tabla 2). Ninguna cepa fue productora de LPV. Sin embargo, las condiciones predisponentes a la bacteriemia (catéter venoso central, sonda urinaria, sonda nasogástrica, alimentación parenteral, ventilación asistida y cirugía previa) fueron más frecuentes en los casos nosocomiales, excepto la toma previa de antibióticos, que fue similar en los 2 grupos (tabla 2).
Características microbiológicas de las cepas de Staphylococcus aureus resistente a meticilina aisladas en los pacientes con bacteriemia de presentación nosocomial y comunitaria
| Presentación comunitaria (n = 21) | Presentación nosocomial (n = 43) | p | |
| PR mayoritarios (PR 2, PR 33, PR 20, PR 4) | 14/21 (67) | 32/43 (74) | 0,5 |
| Resistentes a ≥4 antimicrobianos | 7/21 (33) | 19/43 (44) | 0,4 |
| Resistentes a ≤2 antimicrobianos | 8/21 (38) | 13/43 (30) | 0,5 |
| SCCmec | |||
| I | 2/6 (33) | 2/15 (13) | 0,5 |
| II | – | 2/15 (13) | |
| IV | 1/6 (17) | 4/15 (27) | |
| IVA | 3/6 (50) | 7/15 (4,7) | |
| Clones | |||
| P* | 6/21 (29) | 17/43 (39) | 0,2 |
| Q* | 9/21 (43) | 13/43 (30) | |
| EMRSA-16 | 0/21 | 5/43 (12) | |
| Otros | 6/21 (28) | 8/43 (19) | |
Los datos se muestran como número de cepas con la característica/total estudiadas (porcentaje).
PR: perfiles de resistencia; PR 2: resistente a eritromicina, clindamicina, tobramicina y ciprofloxacino; PR 4: resistente a tobramicina y ciprofloxacino; PR 20: resistente a eritromicina, clindamicina, gentamicina, tobramicina y ciprofloxacino; PR 33: resistente a eritromicina, tobramicina y ciprofloxacino; SSCmec: casete cromosómico estafilocócico mec.
Características de los pacientes con bacteriemia de presentación comunitaria y nosocomial. Los datos se presentan como número de pacientes (porcentaje)
| Presentación comunitaria (n = 21) | Presentación nosocomial (n = 43) | p | |
| Edad >60 años | 17 (81) | 31 (72) | 0,6 |
| Sexo masculino | 14 (67) | 26 (61) | 0,2 |
| Comorbilidades | |||
| Diabetes mellitus | 4 (19) | 15 (35) | 0,2 |
| EPOC | 7 (33) | 8 (19) | 0,2 |
| Enfermedad vascular periférica | 1 (5) | 3 (7) | 0,7 |
| Hepatopatía | 1 (5) | 4 (10) | 0,5 |
| Enfermedad vasculocerebral | 6 (29) | 5 (12) | 0,09 |
| Neoplasia | 4 (19) | 9 (21) | 0,8 |
| Insuficiencia renal crónica | 1 (5) | 6 (14) | 0,2 |
| Sida | 1 (5) | 1 (2) | 0,5 |
| Pie diabético | 2 (10) | 1 (2) | 0,2 |
| Condiciones predisponentes | |||
| Catéter venoso central | 1 (5) | 22 (51) | 0,0001 |
| Sonda urinaria | 2 (10) | 20 (47) | 0,003 |
| Sonda nasogástrica | 1 (5) | 12 (28) | 0,03 |
| Alimentación parenteral | 0 | 6 (14) | 0,07 |
| Ventilación asistida | 0 | 7 (16) | 0,05 |
| Cirugía (en los 3 meses previos) | 1 (5) | 18 (42) | 0,002 |
| Tratamiento antibiótico previo | 11 (52) | 30 (71) | 0,1 |
EPOC: enfermedad pulmonar obstructiva crónica.
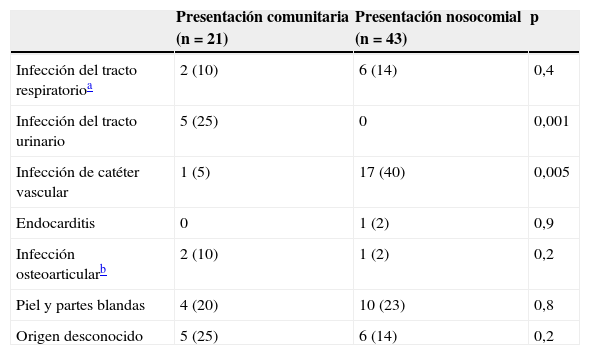
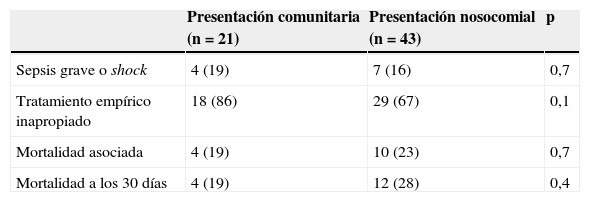
Se encontraron diferencias estadísticamente significativas entre ambos grupos en relación con el foco de origen de las bacteriemias (tabla 3), ya que las originadas en un catéter vascular fueron más frecuentes entre las nosocomiales (el 39,5 versus el 5%; p=0,005), y las originadas en el aparato urinario fueron más frecuentes entre las de presentación comunitaria (el 25 versus el 0%; p=0,001). No hubo diferencias entre ambos grupos en relación con la presencia de sepsis grave o shock séptico (tabla 4). El tratamiento empírico de la bacteriemia se consideró como inapropiado en el 73% del total de los pacientes, y fue algo superior en los de presentación comunitaria (el 86 versus el 67%; p=0,1). Aunque la mortalidad, tanto la asociada como la observada a los 30 días, fue ligeramente superior en las BN, los valores no alcanzaron diferencias significativas (tabla 4).
Foco de origen de las bacteriemias por Staphylococcus aureus resistente a meticilina de presentación comunitaria y nosocomial
| Presentación comunitaria (n = 21) | Presentación nosocomial (n = 43) | p | |
| Infección del tracto respiratorioa | 2 (10) | 6 (14) | 0,4 |
| Infección del tracto urinario | 5 (25) | 0 | 0,001 |
| Infección de catéter vascular | 1 (5) | 17 (40) | 0,005 |
| Endocarditis | 0 | 1 (2) | 0,9 |
| Infección osteoarticularb | 2 (10) | 1 (2) | 0,2 |
| Piel y partes blandas | 4 (20) | 10 (23) | 0,8 |
| Origen desconocido | 5 (25) | 6 (14) | 0,2 |
Los datos se presentan como número de pacientes (porcentaje).
Gravedad clínica en la presentación, mortalidad y tratamiento empírico de las bacteriemias por Staphylococcus aureus resistente a meticilina de presentación comunitaria y nosocomial
| Presentación comunitaria (n = 21) | Presentación nosocomial (n = 43) | p | |
| Sepsis grave o shock | 4 (19) | 7 (16) | 0,7 |
| Tratamiento empírico inapropiado | 18 (86) | 29 (67) | 0,1 |
| Mortalidad asociada | 4 (19) | 10 (23) | 0,7 |
| Mortalidad a los 30 días | 4 (19) | 12 (28) | 0,4 |
Los datos se presentan como número de pacientes (porcentaje).
Hasta un tercio de las bacteriemias por SARM recogidas en nuestro estudio se consideraron como de presentación comunitaria. La frecuencia de este hecho, descrito en estudios realizados en otros países1,2,6,7,14, se ha estudiado poco en España. En un estudio realizado en Barcelona entre 1992 y 20038 se encontró que la incidencia de bacteriemia por SARM al ingreso hospitalario había aumentado significativamente entre esos años (de 0,08 a 0,37 casos por cada 1.000 ingresos hospitalarios).
Resulta llamativo que el momento en que mayor número de casos ocurrieron fue al ingreso, seguido de la segunda semana de hospitalización. Esto refleja el cambio acontecido en la epidemiología de las infecciones por SARM10, de manera que hasta un tercio de las infecciones bacteriémicas por este microorganismo ya no son de presentación nosocomial, sino que ocurren en pacientes ambulatorios. Muchos de estos pacientes han estado ingresados anteriormente, proceden de centros sociosanitarios o son portadores de dispositivos intravasculares de larga duración1,7,8,10. De hecho, en el estudio previamente comentado, provenir de un centro de larga estancia fue un factor de riesgo independiente para SARM entre los pacientes con bacteriemia por S. aureus de presentación comunitaria8. En otros países, los centros de enfermos crónicos, de cuidados paliativos e instituciones sociosanitarias tienen un papel de gran relevancia como reservorio de SARM15–17, de manera que en EE. UU. se ha encontrado una prevalencia de SARM en centros de larga estancia de entre el 6 y el 13% y de hasta el 23–34% si estos centros se encuentran adscritos a los hospitales15. En España, la situación es menos conocida. Se ha publicado un estudio transversal realizado en 9 residencias de Cataluña y Baleares en el que se incluyeron 1.377 individuos durante el mes de noviembre de 2005. La prevalencia de colonización por SARM fue del 16,8%18.
En nuestro estudio no se ha detectado ningún caso de bacteriemia por SARM estrictamente comunitaria. En la cohorte completa del proyecto (todos los casos incidentes de colonización o infección por SARM) se diagnosticaron 3 casos de infección no bacteriémica causadas por cepas comunitarias10. Es conocido que las cepas de SARM estrictamente comunitarias presentan unas características genotípicas y patrones de resistencia distintos a las cepas clásicamente nosocomiales (pertenecen a determinados clones, producen con frecuencia LPV, y son habitualmente sensibles a los antimicrobianos no betalactámicos)19. Además, clínica y epidemiológicamente causan infecciones con un patrón diferente (pacientes sin los factores de riesgo clásicos para la adquisición de SARM, con frecuencia niños o jóvenes, infecciones comunitarias de la piel y partes blandas, en ocasiones graves y de carácter necrosante, y más raramente, neumonías necrosantes)19. En nuestro país, SARM estrictamente comunitario es todavía un fenómeno poco frecuente, aunque la comunicación de casos recientes en Madrid y Barcelona10,20–22 es un fenómeno preocupante.
Las características de los pacientes con BPC por SARM fueron similares a las encontradas en otros estudios6–8. Al compararlas con las de presentación nosocomial no se observaron diferencias significativas en las comorbilidades asociadas. Únicamente, como es lógico, los procedimientos invasivos fueron menos frecuentes en los casos de presentación comunitaria. Con respecto a los focos de origen de la bacteriemia, en las de presentación comunitaria se encontró una menor frecuencia de bacteriemias relacionadas con catéteres vasculares y una mayor frecuencia de infecciones urinarias, asociadas probablemente al sondaje. Manzur et al encontraron una frecuencia menor de casos originados en el aparato urinario8; aunque en este estudio se han utilizado criterios aceptados, puede existir la duda sobre si alguno de estos casos podría haber tenido otro origen. También es posible que anteriormente se haya subestimado el aparato urinario como origen de bacteriemia por SARM.
El hecho de que existan infecciones potencialmente graves de presentación comunitaria por SARM tiene una enorme importancia clínica, dado que el tratamiento empírico inadecuado de la sepsis y la bacteriemia por SARM se asocia con peor pronóstico5,23–25. Es destacable la baja frecuencia de tratamientos empíricos apropiados en las infecciones invasivas por SARM5,23–25. Nuestros resultados y los de otros autores demuestran que éste es un problema potencialmente más frecuente en las BPC8,26, por lo que es necesario identificar las variables que permitan aumentar el índice de sospecha. Varios estudios han encontrado que la detección previa de SARM es un factor de riesgo independiente7,8; sin embargo, este factor no pudo evaluarse en nuestro estudio, puesto que sólo se incluyeron casos incidentes de SARM. Otros factores de riesgo descritos fueron la presencia de un catéter venoso central, la celulitis, las úlceras cutáneas7 y el ingreso desde un centro de larga estancia8. Aunque puede haber diferencias epidemiológicas locales, estas variables han de tenerse en cuenta en pacientes con sepsis de presentación comunitaria potencialmente causada por S. aureus.
Desde el punto de vista microbiológico, los aislados de SARM causantes de BPC fueron genotípica y fenotípicamente similares a los de presentación nosocomial, lo que refuerza la idea de que su adquisición estaría relacionada con la atención sanitaria. Además, estas cepas son un reflejo de los clones predominantes en el país10,27,28. Así, la mayoría de las cepas se agrupan en 2 perfiles de ECP relacionados y pertenecientes a un mismo complejo clonal, relacionado con el clon pandémico denominado clon pediátrico. La única diferencia reseñable en cuanto a los clones nosocomiales y los de presentación comunitaria es que, entre éstos, no encontramos ninguna cepa perteneciente al clon EMRSA-16, lo que podría deberse a que este clon se ha importado recientemente en España, y se ha detectado en los últimos años en Canarias y Galicia10,27,28.
Nuestro estudio debe interpretarse teniendo en cuenta sus limitaciones: los hospitales incluidos no son representativos de todos los del país; el número de casos incluido es pequeño, lo que puede haber impedido encontrar algunas diferencias relevantes entre los grupos, y la situación epidemiológica podría haber tenido algunos cambios en los últimos años.
En resumen, un tercio de las bacteriemias por SARM en nuestro medio se presentaron como comunitarias, aunque todas ellas relacionadas con la atención sanitaria. Sus características clínicas y epidemiológicas fueron similares a las nosocomiales, salvo en el origen de éstas. Es necesario considerar SARM en el tratamiento empírico de determinados síndromes infecciosos en pacientes con sepsis comunitaria y relación previa con los cuidados sanitarios.
Conflicto de interesesBA ha prestado servicios de asesoría y ha actuado como ponente para Pfizer, Novartis y Gilead, y ha recibido financiación para proyectos de investigación de Pfizer y Gilead. JRB ha prestado servicios de asesoría y ha actuado como ponente para Pfizer, Novartis y Wyeth, y ha recibido financiación para proyectos de investigación de Wyeth y Novartis. ABM, MAD, CB, MPG, EC, BP y MP no presentan conflictos de intereses.
FinanciaciónEl Ministerio de Sanidad y Consumo, el Instituto de Salud Carlos III-FEDER, la Red Española de Investigación en Patología Infecciosa (REIPI C03/14) y la Red Española de Investigación en Patología Infecciosa (REIPI RD06/0008) han financiado el estudio.
Listado de participantes en el proyecto SARM 2003 GEIH/GEMARA/REIPIFundación Hospital de Cieza: J. Álvarez, M. Alcalde, C. Zamorano; Hospital de Mataró: G. Sauca, L. Force, E. Martínez; Hospital de Jove: E. Hidalgo, E. Mata, J. S. Rubio; Hospital de Gran Canaria Dr. Negrín: A. Bordes, M. A. Figuerola, B. Lafarga; Hospital Nacional de Parapléjicos, Toledo: A. Leturia; Hospital de Santa Marina, Bilbao: F. Calvo, J. Pérez, J. L. Sánchez; Hospital de San Vicente, Alicante: J. Blázquez, C. Domínguez, C. Mirete, M. Gea, M. Bermúdez; Hospital Universitario de la Princesa, Madrid: T. Alarcón, C. Cuevas, N. Carrasco, J. Jimeno; Hospital Santiago Apóstol, Vitoria: A. Canut, A. Labora, J. L. Novales, I. Orio; Clínica Benidorm: J. Serralta, D. Arzua; Hospital Santa María Mai, Ourense: G. Esteban, B. Fernández, M. D. Díaz; Complejo Hospitalario La Mancha Centro, Alcázar de San Juan: R. Carranza, D. Tena, J. R. Barberá; Hospital Universitario Puerta del Hierro, Madrid: A. Asensio, J. Lobera, T. Marco, A. Ramos; Hospital de Cabueñes: M. L. García, M. D. Miguel; Hospital Universitario 12 de Octubre, Madrid: F. Chaves, F. Jaén, M. Lizasoain, M. I. Sanz; Hospital General Universitario Gregorio Marañón: E. Cercenado, B. Padilla, F. Grande; Complejo Hospitalario Arquitecto Marcide/Profesor Novoa Santos, Ferrol: M. D. Rodríguez, J. F. García, M. V. Lorenzo; Hospital Vega Baja, Orihuela: A. Yagüe, A. Cabrera, J. Gregori, J. Salinas; Hospital General Universitario de Elche: M. Elía, J. M. Ramos, A. M. Haro; Hospital Esperit Sant, Santa Coloma de Gramenet: M. T. Bastida, R. Porrón, F. Nonell; Hospital Universitario de Canarias: T. Delgado, M. de Frutos, I. Montesinos; Mútua de Terrassa: M. Xercavins, N. Juan, M. Riera, N. Freixas; Hospital Virgen de la Salud, Toledo: M. A. Sepúlveda, C. Gómez; Complejo Hospitalario de Pontevedra: P. Álvarez, R. Ojeu, F. Vazquez, J. Paz; Policlínica Gipuzkoa: J. A. Jiménez, E. Laviñeta; Hospital Lluis Alcanyís, Xátiva: R. M. Ferreruela, A. Viñuales, J. M. Tenias; Hospital de Jerez de la Frontera: A. Zapata, J. L. de Francisco; Hospital Nuestra Señora de Candelaria: A. Moreno, M. C. Durán, N. Batista; Hospital Marina Baixa, Villajoyosa: C. Martínez, M. J. Gallego, C. Amador; Hospital General de Lanzarote: F. J. Noguera, D. Panizo, E. Melian; Hospital General Universitario de Asturias, Oviedo: A. Fleites, A. Moreno; Hospital Clínico Universitario de Santiago de Compostela: F. Pardo, M. L. Pérez, E. Carballo; Hospital Sant Joan de Déu, Martorell: M. A. Gasos, A. Pérez, M. Vidal; Hospital Universitario Virgen Macarena, Sevilla: J. Rodríguez Baño, J. R. Hernández, L. García, A. B. Millán; Hospital Santa Creu i Sant Pau, Barcelona: A. Coloma, F. Navarro, J. Barrio, P. Coll; Hospital Universitario Insular de Gran Canaria: M. Bolaños, E. E. Álvarez, M. Hernández, J. Molina; Hospital Universitario de Getafe: P. García, B. R. Blazquez, M. Cal; Hospital Dr. Moliner, Serra: S. Giner, P. García, N. Tolosa; Hospital Municipal de Badalona: A. Calderón; Hospital Universitario Virgen de la Victoria, Málaga: C. Arana; Hospital Nicolás Peña, Vigo: F. Ulloa, E. Pazos, M. Maresclot; Hospital Virgen de Valme, Sevilla: J. E. Corzo, J. L. García; Hospital de Cruces, Barakaldo: J. L. Hernández, K. Aguirrebengoa, J. M. Hernández; Hospital Dr. Josep Trueta, Girona: M. Motjé, J. de Batlle, D. García, L. Gavaldá; Hospital Xeral Cies, Vigo: M. Álvarez, C. Potel; Hospital de Sagunto: R. Escoms, J. Prat, C. González, M. Pinazo; Consorci Hospitalari Parc Tauli, Sabadell: M. Canals, D. Mariscal, N. García; Hospital Vall d′Hebron, Barcelona: A. Andreu, M. Campins, B. Almirante, N. Larrosa; Hospital Universitario Virgen del Rocío, Sevilla: J. M. Cisneros, A. C. Llanos; C. A. Son Dureta, Palma de Mallorca: J. L. Pérez, A. Oliver, M. Peñaranda, C. Juan, E. Ruiz; Hospital Ramón y Cajal, Madrid: V. Pintado, R. Cantón, J. Oliva, L. García, F. Grill; Hospital del Oriente de Asturias, Arriendas: J. Díaz, V. Cárcaba; Hospital de Figueres: C. García, J. Cucurull; Complejo Hospitalario Universitario Juan Canalejo, A Coruña: D. Sousa, G. Bou; CSU de Bellvitge, Hospitalet de Llobregat: M. A. Domínguez, M. Pujol, E. Limón; Hospital General de Granollers: J. Cuquet, C. Martí, M. D. Navarro; Hospital de Galdakao: P. Berdonces, J. Mayo; Hospital de Barcelona SCIAS: M. Sierra, M. Vaque, M. Calsina; Hospital Virgen de Altagracia, Manzanares: S. Illescas, A. López; Hospital Sant Jaume, Calella: A. Hernández, M. L. Abellán, A. García; Hospital Comarcal de la Selva, Blanes: A. García, C. Gallés; Hospital del Mar, Barcelona: M. Salvadó; Hospital Germans Trias i Pujol, Badalona: L. Matas, N. Sopena, M. Caraballo; Hospital Xeral Calde, Lugo: A. Coira, J. Varela; Hospital de la Ribera, Alzira: M. Cuenca, A. Guerrero; Hospital Clínico, Barcelona: J. P. Horcajada, F. Marco, M. Zaragoza, M. Piazuelo, J. A. Martínez.
Al final del artículo se incluye un listado de participantes en el proyecto SARM 2003 GEIH/GEMARA/REIPI.