La biopsia del ganglio centinela en el cáncer diferenciado de tiroides puede beneficiar a los pacientes sin ganglios clínicamente afectados y evitar la linfadenectomía profiláctica o de estadificación.
MetodosEstudio prospectivo de 23 pacientes consecutivos con carcinoma papilar de tiroides sin sospecha de afectación ganglionar clínica o radiológica. Tras inyección peritumoral de azul de metileno y biopsia intraoperatoria del ganglio centinela identificado, se realizó la tiroidectomía total y linfadenectomía ipsilateral via-b para estudio diferido con citoqueratina. Si el ganglio centinela era positivo se realizaba linfadenectomía radical modificada ipsilateral (grupos ii a v).
ResultadosEn 21 de los 23 pacientes (91,3%) se identificó claramente el ganglio centinela. Siete de los 21 ganglios identificados (33,3%) fueron positivos en el estudio intraoperatorio, de los cuales 3 (42,8%) mostraron afectación del compartimento lateral. En conjunto, 9 pacientes (39,1%) mostraron afectación ganglionar en el grupo vi al identificarse 2 pacientes más con micrometástasis en el estudio diferido. La biopsia del ganglio centinela aporta una sensibilidad del 87,5%, una especificidad del 100%, un valor predictivo positivo del 100% y un valor predictivo negativo del 93,7%, con 7,1% de falsos negativos. Cinco pacientes presentaron hipocalcemia transitoria (21,7%).
ConclusionesLa identificación del ganglio centinela en pacientes con tumores T1-T2 sin sospecha de afectación ganglionar permite la selección de pacientes que deberían ser tratados con linfadenectomías selectivas.
Sentinel lymph node biopsy in differentiated thyroid cancer may benefit patients with no clinically affected lymph nodes and can avoid a prophylactic or staging lymphadenectomy.
MethodsA prospective study was conducted on 23 consecutive patients with papillary thyroid carcinoma with no clinical or radiological suspicion of lymph involvement. After injecting methylene blue around the tumour during the biopsy of the identified sentinel lymph node, a total thyroidectomy and a via-b ipsilateral lymphadenectomy was performed for the later study with cytokeratin. If the sentinel lymph node was positive, a modified ipsilateral radical lymphadenectomy was perfumed (groups ii to v).
ResultsThe sentinel lymph node was clearly identified in 21 of the 23 patients (91.3%). Seven (33%) of the 21 lymph nodes identified were positive in the intra-operative study, of which 3 (42.8%) demonstrated involvement with the lateral compartment. All together, 9 patients (39.1%) showed lymph node involvement group vi, with two more patients being identified with micro-metastases in the later study. Biopsy of the sentinel lymph node had a sensitivity of 87.5%, a specificity of 100%, a positive predictive value of 100% and a negative predictive value of 93.7%, with 7.1% false negatives. Five patients (21.7%) had transient hypocalcaemia.
ConclusionsThe identification of the sentinel lymph node in patients with T1-T2 tumours with no suspicion of lymph node involvement helps in the selection of patients who should be treated with selective lymphadenectomies.
En los pacientes con diagnóstico pre o intraoperatorio de afectación ganglionar, la tiroidectomía total debe asociarse a una linfadenectomía radical modificada. Sin embargo, cuando no se ha llegado a este diagnóstico, la necesidad de la linfadenectomía es discutible para el tratamiento quirúrgico del carcinoma diferenciado de tiroides, especialmente en el carcinoma papilar. La razón es que, aunque la afectación cervical linfática suele encontrarse en el 50-90% de los casos, según el tipo de linfadenectomía realizada1–4, solo un 10% de los ganglios con afectación microscópica desarrollan enfermedad clínicamente evidente5. Se ha estimado que la posibilidad de recidiva ganglionar puede elevarse hasta un 30-50% a los 10 años6 y de acuerdo con Mazzaferri y Kloos7 las metástasis linfáticas, de modo especial las cervicales que son bilaterales (lo que suele ocurrir en un 10-23% de casos)2,8 y las mediastínicas, funcionan como variables independientes que afectan a la recidiva y a la supervivencia, de tal forma que una disección orientada a dichos compartimentos anatómicos mejora significativamente ambos parámetros en los pacientes con tumores T1-T39.
Independientemente del valor pronóstico de estas linfadenectomías, no hay duda de que su realización permite lograr una correcta estadificación de la enfermedad. Se han propuesto diversas acciones técnicas que varían desde las linfadenectomías rutinarias (profilácticas) a las selectivas10 limitando la biopsia a los ganglios sospechosos, una conducta no justificada debido al elevado número de recidivas que origina, especialmente con la técnica del «node picking» (72%)11. Aunque con una incidencia baja y variable, puede aparecer una metastatización discontinua12,13, y por ello se ha recomendado la disección rutinaria del compartimento central (nivel vi) en todos los casos teóricamente Nx y la disección radical modificada del compartimento lateral (niveles ii-v) si se confirma la afectación central, especialmente en los pacientes con carcinoma de alto riesgo de recidiva o mortalidad14,15, o se demuestra la presencia clínica de ganglios laterales afectados.
Por lo que respecta a la linfadenectomía central, se reconoce que entre un 50 y un 60% de los pacientes sin sospecha clínica presentan metástasis16, de las que hasta un 25% serían microscópicas. Este grupo de pacientes se beneficiaría de la intervención profiláctica, y el resto sería sometido a una evidente sobreactuación quirúrgica. Pero, aunque el valor pronóstico de esta opción quirúrgica no es unánimemente aceptado17–20, especialmente en lo que se refiere a las micrometástasis, se admita que puede cambiar la estadificación en un 35% de los casos21, evitar una reintervención por recidiva o modificar los criterios de tratamiento con 131I22, las recomendaciones expresadas en las distintas guías publicadas no muestran una opinión unánime. Estas varían desde recomendar la linfadenectomía rutinaria20,23 hasta no recomendarla15 o limitarla a los casos de «alto riesgo» como, por ejemplo, la de la guía ATA 200922 que lo hace solo para los tumores T3-T4.
Por otra parte, aunque la afectación del compartimento lateral del cuello se correlaciona con la del compartimento central24–28, existen claras discrepancias sobre cuándo realizar una linfadenectomía profiláctica, especialmente si se tiene en cuenta que no existen criterios definidos sobre el valor del número de ganglios centrales afectados como factor predictivo de afectación lateral. Aunque se indica que el número clave sería 4 ganglios26, un solo ganglio central afectado podría sugerir la presencia de afectación lateral29, pues el porcentaje de esta afectación lateral oculta puede llegar hasta el 55%26.
Como alternativa a la disección central profiláctica podría proponerse el análisis del ganglio centinela, que desde la primera publicación de Keleman et al.30 ha suscitado gran interés31–33. Comunicamos en este trabajo nuestra experiencia preliminar en la detección del ganglio centinela en el cáncer papilar de tiroides mediante una técnica colorimétrica con azul de metileno en pacientes con tumores T1-T2 que, según las recomendaciones de la guía ATA 2009, no serían candidatos a linfadenectomía profiláctica22. Analizamos también la posible relación entre la afectación central y la lateral ignorada.
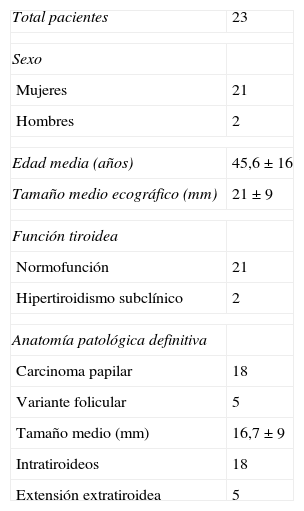
Pacientes y métodosSe han incluido en el estudio de modo prospectivo 23 pacientes consecutivos con nódulos de tiroides únicos de hasta 4cm de diámetro ecográfico máximo. Dos presentaban sospecha citológica de lesión papilar, 21 citologías claras de carcinoma papilar de tiroides y ninguno afectación ganglionar clínica o radiológica. Las características de la serie se resumen en la tabla 1.
Características de la serie
| Total pacientes | 23 |
| Sexo | |
| Mujeres | 21 |
| Hombres | 2 |
| Edad media (años) | 45,6±16 |
| Tamaño medio ecográfico (mm) | 21±9 |
| Función tiroidea | |
| Normofunción | 21 |
| Hipertiroidismo subclínico | 2 |
| Anatomía patológica definitiva | |
| Carcinoma papilar | 18 |
| Variante folicular | 5 |
| Tamaño medio (mm) | 16,7±9 |
| Intratiroideos | 18 |
| Extensión extratiroidea | 5 |
En todos los pacientes, una vez identificado el ganglio centinela, se realizó una tiroidectomía total, previa confirmación intraoperatoria del diagnóstico de carcinoma, seguida de una linfadenectomía de los ganglios del grupo via-b ipsilateral. Si el análisis intraoperatorio del ganglio centinela era informado como positivo se realizaba, además, una linfadenectomía radical modificada de los grupos laterocervicales ii-v. El ganglio centinela se identificó mediante inyección perinodular de 0,3-0,5 cc de azul de metileno al 2% con una jeringuilla de insulina y aguja del 27, siguiendo «de visu» la progresión del colorante hacia el primer ganglio teñido, que fue considerado el ganglio centinela. Una vez identificado, se extirparon todos los nódulos teñidos para estudio histológico intraoperatorio y examen definitivo mediante hematoxilina-eosina e inmunohistoquímica con citoqueratina para identificar posibles micrometástasis.
En este grupo de pacientes se decidió no seleccionar el tratamiento complementario con yodo radiactivo según la estadificación postoperatoria, por lo que todos los pacientes recibieron una dosis de 100mCi de 131I.
Se analizó el número de ganglios encontrados, su localización, porcentaje de positividad, relación con los hallazgos del estudio anatomopatológico final, posible influencia de los principales factores de riesgo (edad, tamaño tumoral y extensión), resultados del seguimiento, y sensibilidad y especificidad de la técnica.
Análisis estadístico: el estudio estadístico, para un nivel de significación de p<0,05, se ha realizado con el programa SPSS versión 12 para Windows (SPSS, Chicago, Illinois, EE. UU.) incluyendo estudio de frecuencias, comparación de medias con T test y análisis de proporciones (valor Z calculado).
ResultadosLa detección del ganglio centinela se logró con claridad en 21 de los 23 pacientes (91,3%). De los 2 casos que fueron considerados negativos, uno fue un verdadero negativo y el otro, situado en la cara anterior de la tráquea, se identificó sin teñir en el extremo de un linfático claramente teñido por el colorante.
El ganglio centinela se localizó en 20 casos (95,2%) en el compartimento central, con 19 casos en posición paratraqueal/perirrecurrencial (95%) y en un caso en posición pretraqueal (5%), mientras que el ganglio restante se identificó en posición yugular (skip metástasis) a la altura del grupo iv (4,7%). No se detectó ningún ganglio en posición contralateral, incluido un caso con afectación multifocal macroscópica.
El número de ganglios detectados fue de uno en 17 pacientes (74%) y 2 en 4 (17,4%), no identificándose ningún ganglio teñido en los 2 casos restantes (8,6%). El tamaño medio de los ganglios centinelas negativos fue de 3,7±1,1mm y el de los positivos 4,6±2,6mm (p<0,02).
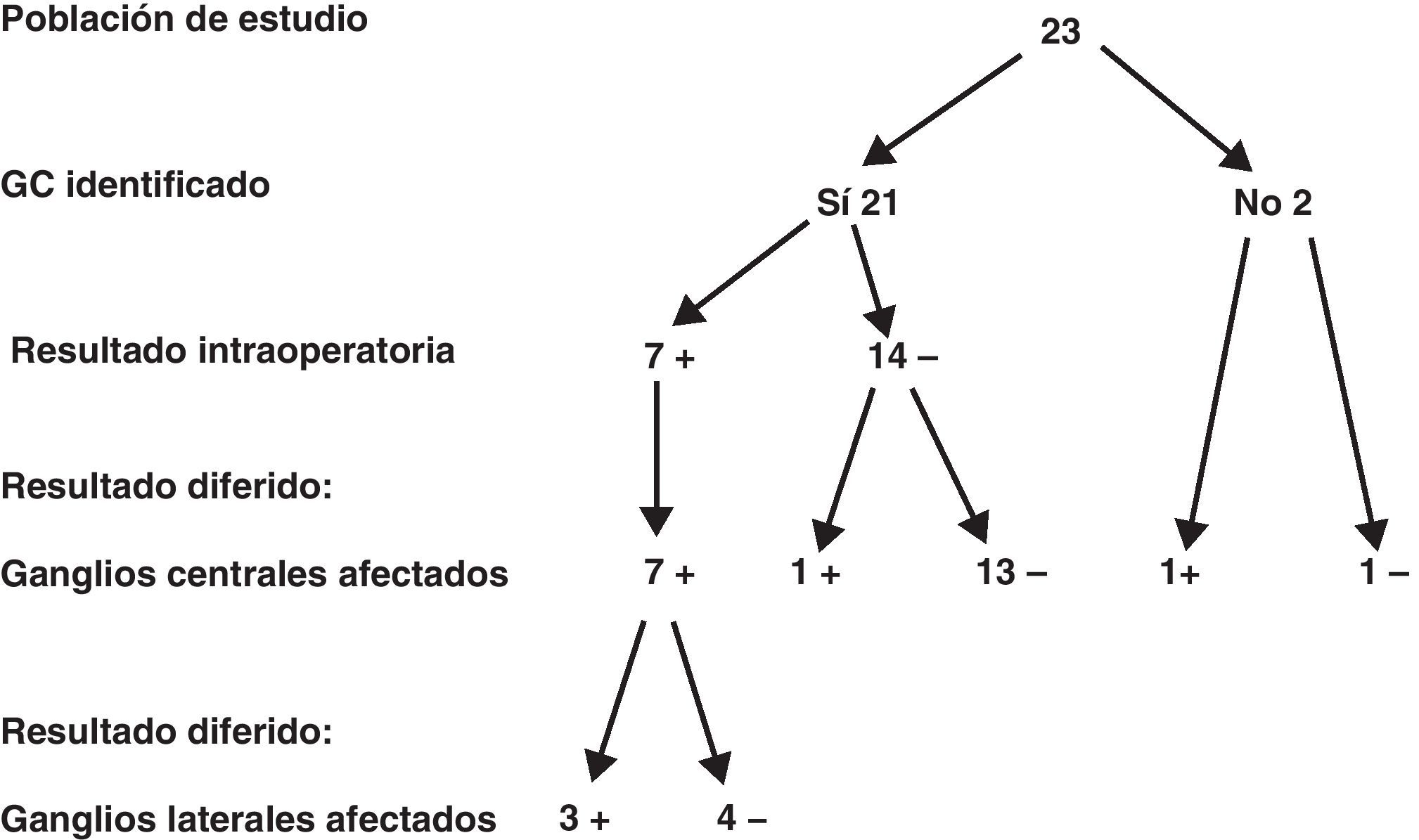
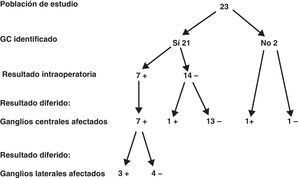
En la figura 1 se resume la relación existente entre los hallazgos anatomopatológicos intraoperatorios y los del estudio diferido en todos los ganglios encontrados en la disección central ipsilateral (media de ganglios identificados 8,4 [rango 6-15]). De los 21 pacientes en los que se identificó correctamente el ganglio centinela, 7 (33,3%) fueron informados como positivos en el estudio intraoperatorio. Cinco de los 7 pacientes (71,4%) con ganglio centinela positivo presentaron metástasis en otros ganglios del compartimento central. De estos 7 pacientes, 3 (42,8%) presentaron metástasis en los ganglios laterales. De los 14 pacientes con ganglio centinela negativo, uno (7,1%) presentó una micrometástasis y, por último, de los 2 pacientes en los que no se pudo identificar el ganglio centinela, uno presentó 2 adenopatías positivas. En definitiva, en el conjunto de los 23 pacientes estudiados, 9 (39,1%) presentaron metástasis en los ganglios del grupo central. De acuerdo con estos resultados, la determinación del ganglio centinela aporta una sensibilidad del 87,5%, una especificidad del 100%, un valor predictivo positivo del 100% y un valor predictivo negativo del 93,7%. Asimismo, el porcentaje de falsos negativos es del 7,2% si tenemos en cuenta que de los 14 pacientes con ganglio inicialmente negativo uno presentó micrometástasis en el estudio diferido.
Cinco pacientes presentaron una hipocalcemia transitoria (21,7%), no observándose ninguna hipocalcalcemia definitiva ni ninguna lesión recurrencial. No se ha registrado ninguna reacción adversa al colorante.
Con una media de seguimiento de 25 meses, todos los pacientes presentan tiroglobulina indetectable, excepto el caso con ganglio no teñido y 2 adenopatías positivas en el estudio diferido que a los 24 meses presenta una tiroglobulina de 3,5ng/ml sin localización anatómica.
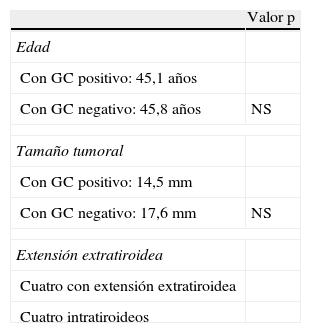
Es de destacar que ni la edad, ni el tamaño tumoral o la extensión ejercen influencia sobre la positividad o negatividad final del ganglio centinela (tabla 2).
Relación del ganglio centinela con los principales factores de riesgo
| Valor p | |
| Edad | |
| Con GC positivo: 45,1 años | |
| Con GC negativo: 45,8 años | NS |
| Tamaño tumoral | |
| Con GC positivo: 14,5mm | |
| Con GC negativo: 17,6mm | NS |
| Extensión extratiroidea | |
| Cuatro con extensión extratiroidea | |
| Cuatro intratiroideos | |
GC: ganglio centinela; NS: no significativo.
Aunque sigue siendo objeto de discusión la influencia que sobre el pronóstico del carcinoma diferenciado de tiroides pueda ejercer la afectación ganglionar, parece claro que esta es la responsable del mayor número de recidivas locorregionales y que en determinados grupos de riesgo puede afectar claramente la supervivencia34,35. Aunque los porcentajes de afectación ganglionar pueden variar respecto a la técnica utilizada para detectarla, es evidente que puede presentarse en más de un 70%1–4,9,36. En nuestra experiencia, la linfadenectomía sistemática del compartimento central, incluyendo cualquier tamaño tumoral, ha revelado un porcentaje de afectación del 73%, que llega al 60% en el compartimento lateral del cuello24. Este porcentaje de afectación coincide con los publicados por Pereira et al.37, quienes la encuentran en un 60% de casos, o con los comunicados previamente por Mirallié et al.2, Gimm et al.13 o Goropoulos et al.38 con pequeñas variaciones entre el 60-70%.
Aunque este grado de metastatización ganglionar es elevado, se mantiene la discusión sobre la forma de valorarla, especialmente en los casos teóricamente Nx. Dado el bajo rendimiento de las técnicas de estadificación preoperatoria, se ha propuesto la linfadenectomía profiláctica del grupo vi, e incluso también de los ganglios laterales, como única forma de poder detectar los ganglios afectados10,20,23,39. Sin embargo, este proceder, como ya había indicado Cady40, es evidente que conlleva una sobreactuación terapéutica no justificada en muchos casos (alrededor de un 40% de pacientes según los datos expuestos previamente) y se acompaña de una morbilidad nada desdeñable37,41.
De acuerdo con los resultados de este trabajo, la detección inequívoca del ganglio centinela en un 91,3% de pacientes con un porcentaje de afectación del 33,3%, una sensibilidad del 87,5%, una especificidad del 100%, un valor predictivo positivo del 100%, un valor predictivo negativo del 93,7% y un porcentaje de falsos negativos del 7,1% permitiría evitar las linfadenectomías profilácticas. Estos resultados son similares a la media publicada recientemente32,33,42, que oscila entre el 83 y el 96-100% dependiendo de la técnica de marcaje empleada, y muy similares a los comunicados por Fukui et al.43, Dzodic et al.27, Roh y Park28 y Anand et al.44 con una técnica similar a la nuestra. Además, la detección del ganglio centinela puede poner de manifiesto la presencia de metástasis discontinuas como han comunicado Chow et al.45 o Rubello et al.46, y hemos podido observar en el caso localizado en el grupo ganglionar iv.
Aunque se ha indicado que la inyección de coloide marcado con Tc-99 aporta un 13% más de porcentaje de detección que cuando se inyecta un colorante azul32,33,47–49, esta última técnica ha sido la más utilizada, siendo el azul de metileno el que parece aportar una mejor difusión50. Aunque con ambas técnicas se consigue un porcentaje de detección y de falsos negativos similar (11,3% para el Tc-9947 y un 12,7% para el colorante), o se haya propuesto una técnica combinada con un poder de detección del 100%48,51, el marcaje preoperatorio con coloides radiactivos está sujeto a una serie de problemas técnicos como el control ecográfico de la punción, el «shine through efect» (brillo difuso en la gammagrafía), la extravasación de contraste y la necesidad de realizar la tiroidectomía previa a la búsqueda del ganglio, que hace que sea desaconsejado por algunos autores49. De todos modos, y a pesar de la técnica utilizada, en un pequeño porcentaje de pacientes, un 8,6% en nuestra serie, puede haber problemas de identificación que podrían estar en relación con una localización pericapsular del ganglio que es extirpado junto con el lóbulo afecto30 o, incluso, ser debido a un defecto técnico relacionado con la peor difusión del contraste inyectado intratumoralmente, de modo especial en tumores menores de 1cm, en caso de rotura capsular o en tumores quísticos. No hemos tenido dificultades para identificar el ganglio centinela debido a la posible confusión con una paratiroides teñida como han indicado Wiseman et al.31.
Tampoco puede evitarse que en un pequeño porcentaje de casos el estudio intraoperatorio no detecte la presencia de micrometástasis, muchas veces identificadas solo en el estudio diferido después de realizar múltiples cortes y emplear técnicas de inmunohistoquímica para citoqueratina o tiroglobulina, lo que puede aumentar la precisión de la técnica al 100% como han indicado Arch-Ferrer et al.52 o aumentar en un 15% el número de pacientes afectados33. Si la micrometástasis, definida como un área de afectación menor de 2mm, se identifica durante el estudio intraoperatorio somos partidarios, a pesar de su discutido valor pronóstico, de completar la linfadenectomía del grupo vi. Si se descubre en el estudio diferido, parece razonable basar la reintervención ganglionar en el tamaño del área afectada. Si esta es verdaderamente una micrometástasis menor de 2mm en un tumor de bajo riesgo, la reintervención podría evitarse. Si, por el contrario, se considerara un caso de alto riesgo o el volumen de afectación fuera mayor de 2mm la reintervención estaría justificada.
Por último, aunque se acepte que la afectación central predice la afectación lateral ignorada24–28, no existe un claro consenso sobre cuándo realizarla o qué número de ganglios centrales afectados podría predecirla. La determinación del ganglio centinela podría aclarar esta duda26–28 y nos parece muy significativo que, aunque en el total de nuestra serie la afectación lateral se produce en un 13% de los casos, el 42,8% de los pacientes con afectación central presenta también afectación lateral ignorada, a pesar de que el número de ganglios afectados sea solamente de uno, lo que corrobora los datos de Anand et al.44 y Lee et al.29.
En resumen, a pesar de las limitaciones de este estudio realizado con una muestra relativamente pequeña debido a su carácter preliminar, los datos aportados podrían confirmar que la determinación del ganglio centinela con azul de metileno es efectiva y segura, altamente predictiva de la afectación central y, posiblemente, de la lateral ignorada, y útil para la selección de pacientes con tumores papilares T1-2 susceptibles de ser tratados con linfadenectomías selectivas orientadas por compartimentos.
Conflicto de interesesLos autores declarn no tener ningún conflicto de intereses.