Los individuos con diabetes constituyen un porcentaje desproporcionado y creciente de los pacientes hospitalizados, aunque frecuentemente está infraestimado1-7. Conforman un 30-40% de los pacientes atendidos en los servicios de urgencias hospitalarios, un 25% de los hospitalizados, tanto en áreas médicas como quirúrgicas, y alrededor del 30% de los pacientes sometidos a cirugía de derivación aortocoronaria. Ello es consecuencia del aumento en la prevalencia de la diabetes mellitus, así como de la comorbilidad asociada y procedimientos diagnósticos y terapéuticos indicados que requieren de la hospitalización. Además, los pacientes con diabetes permanecen en el hospital una media de 1–3 días más que los no diabéticos, y los pacientes con hiperglucemia al ingreso es más probable que requieran la utilización de la unidad de cuidados intensivos (UCI).
El reconocimiento del impacto de la hiperglucemia en la morbimortalidad y costes de los pacientes hospitalizados también es creciente7-11. En la actualidad, se dispone de datos experimentales sobre los mecanismos potenciales y de estudios clínicos observacionales y de intervención que apoyan el hecho de que la hiperglucemia, además de ser un marcador de gravedad, conlleva importantes efectos adversos que influyen en el pronóstico, incluido el incremento de la mortalidad, de las tasas de infección y estancia hospitalaria7,12–15. Finalmente, algunos estudios sugieren que un control más riguroso de la glucemia en pacientes críticos con y sin diabetes puede mejorar el pronóstico16-20.
Estos resultados han sustituido el concepto que proponía mantener al paciente hospitalizado dentro de límites de glucemia considerados "seguros" (150–250mg/dl) por otro en el que se aboga por un abordaje más activo que tiene por objetivo un control más exigente de la glucemia. Relacionado con esta hipótesis, en los últimos años, el manejo de la hiperglucemia durante la hospitalización ha adquirido una especial relevancia y se han establecido recomendaciones que sugieren que el objetivo de glucemia durante el ingreso hospitalario debería ser el de la normoglucemia21-25. Sin embargo, la norma en la mayoría de los centros sigue siendo el bajo reconocimiento de la hiperglucemia, y en los pacientes hospitalizados en los que consta el diagnóstico de diabetes o hiperglucemia, el manejo de la misma es pobre26-30.
Así, en 999 sujetos hospitalizados en 44 hospitales norteamericanos con el diagnóstico de diabetes, el 60% tenía al menos una glucemia>250mg/dl y entre el 18 y el 38% presentaron glucemias>200mg/dl durante 3 días consecutivos30. En el estudio de Knecht et al27, la mayoría de los pacientes tenía glucemias elevadas y en torno a un tercio mantenía glucemias medias>200mg/dl, mientras que, por el contrario, sólo el 11% presentó≥1 episodio de glucemia<70mg/dl. Sin embargo, lo más preocupante es que en este estudio únicamente se modificó el tratamiento en el 34% de los pacientes27. En el estudio de Wexler et al30 el 16% de los pacientes con diabetes tipo 1 y el 35% de los pacientes con diabetes tipo 2 tratados previamente con insulina recibieron tratamiento insulínico con pautas correctoras de insulina rápida (sliding scales) solas.
Las causas del control deficiente son múltiples e incluyen el mal control previo, las dificultades del tratamiento de la hiperglucemia durante la hospitalización y la falta de conocimientos/familiarización acerca del tratamiento con insulina y la inercia clínica29,31,32 (tabla 1). En este sentido, es conocido que los requerimientos de insulina para mantener la glucemia dentro de límites aceptables durante la hospitalización oscilan de forma notable por modificaciones del aporte de nutrientes (ayuno o reducción de comidas, aporte de glucosa intravenosa [IV], nutrición enteral o parenteral), la liberación de hormonas de contrarregulación como respuesta al estrés, la utilización de fármacos con efecto hiperglucemiante y otros factores. La hiperglucemia parece desempeñar un papel importante como medida de seguridad para evitar las hipoglucemias. Durante la hospitalización, además de los factores de riesgo clásicos de hipoglucemia, están presentes factores de riesgo adicionales, tales como la reducción repentina de la dosis de corticoides, la capacidad alterada de los pacientes para detectar los síntomas, la reducción de la ingesta oral, los vómitos, la reducción o retirada de la nutrición parenteral/enteral o la glucosa IV. La conciencia alterada por la anestesia puede también alterar los síntomas hipoglucémicos típicos. Por tanto, la hipoglucemia, aunque infrecuente, es un motivo de preocupación importante en los pacientes hospitalizados con diabetes y es una barrera importante en la optimización del control glucémico en la hospitalización31,33. La inercia clínica, que lleva a la no modificación del tratamiento cuando la situación lo requiere, es especialmente acentuada con la utilización de las pautas de insulina rápida sin insulina basal, de forma que si se prescriben al ingreso del paciente, es muy probable que se mantenga durante la estancia hospitalaria aunque el control sea deficiente27,29,30. Finalmente, la infrautilización de la infusión de insulina IV y, sobre todo, la sobreutilización de las pautas de insulina rápida solas son factores que contribuyen de forma relevante al deficiente control de la hiperglucemia en la hospitalización24,34,35.
Principales causas del control glucémico deficiente en la hospitalización
| Tolerancia a la hiperglucemiaComo medida de seguridad ante la hipoglucemiaInercia clínicaIgnorar el tratamiento previo del pacienteLa infrautilización de las bombas de infusión de insulina intravenosaLa sobreutilización de las sliding scales o pautas de insulina rápida sola |
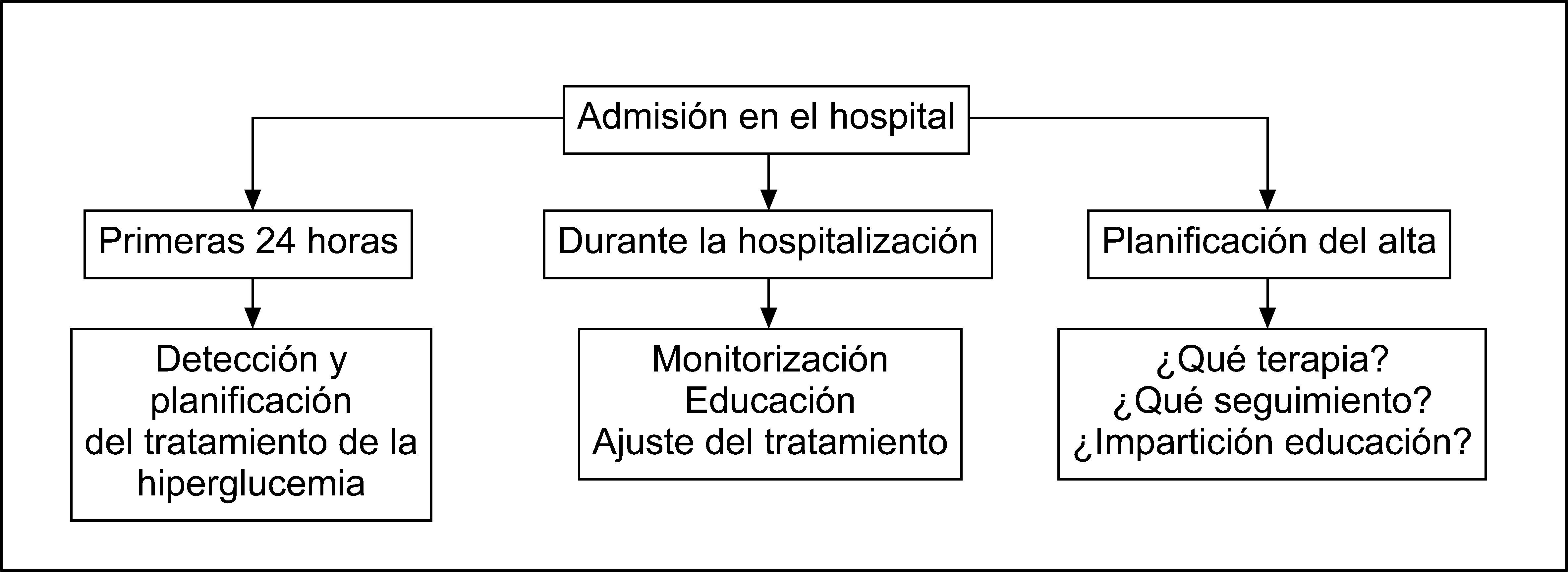
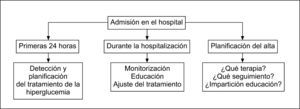
Desde el punto de vista del tratamiento de los pacientes hospitalizados con hiperglucemia, resulta útil establecer la actuación en el primer día de la hospitalización, el manejo durante la hospitalización y la planificación del alta hospitalaria (fig. 1).
En el primer día de la hospitalización, la evaluación debe dirigirse a la detección de la hiperglucemia, establecer su origen y el contexto hospitalario en el que se encuentra el paciente. Un segundo aspecto fundamental en estos momentos es planificar adecuadamente el tratamiento, ya que es muy probable que el prescrito se mantenga durante la estancia hospitalaria, independientemente del control glucémico obtenido27,29,30. El tratamiento de la hiperglucemia y el grado de control del paciente previos a la hospitalización son fundamentales para planificar el tratamiento al alta. Todos los pacientes con diabetes hospitalizados deberían tener una determinación de la hemoglobina glucosilada (HbA1C) si no se dispone de ella en los 2–3 meses previos21. El tratamiento durante la hospitalización se basa en la monitorización y los ajustes o el cambio de la pauta de tratamiento sobre la base de la monitorización de la glucemia y la situación clínica del paciente. En esta fase también es necesario prever las necesidades educativas del paciente y asegurar los aspectos de supervivencia. Finalmente, al alta debe establecerse un plan de tratamiento y seguimiento adecuados.
Objetivos del control glucémico en el paciente hospitalizadoEstudios preliminares en pacientes críticos mostraron que un mayor control de las glucemias se traducía en mejores resultados16,17,19,20. Un estudio realizado en un único centro en pacientes postoperados de cirugía cardíaca18 encontró que el mantenimiento estricto de la normoglucemia (glucemia entre 70 y 110mg/dl) reducía la mortalidad. Sin embargo, estudios posteriores no han logrado reproducir esos resultados y han encontrado que el tratamiento intensivo con insulina para obtener la normoglucemia aumenta el riesgo de hipoglucemia, cuya aparición constituye un factor pronóstico independiente de mortalidad37-41. En un ensayo clínico con un diseño antes-después42 se encontró que la aplicación de un protocolo dirigido a mantener glucemias por debajo de 140mg/dl en pacientes críticos se asociaba a una reducción de la mortalidad, la morbilidad y la estancia en la UCI sin un aumento significativo en el riesgo de hipoglucemia. Sobre la base de los anteriores estudios, se han establecido nuevas recomendaciones para el manejo de la hiperglucemia en el hospital, como las del American College of Endocrinology22. Éstas incluyen objetivos para los pacientes hiperglucémicos con diabetes y sin diabetes, tanto en estado crítico como no crítico y se han incorporado en los Standards of Medical Care in Diabetes de la American Diabetes Association21 (tabla 2):
- 1.
Pacientes en estado crítico: glucemia lo más próxima posible a 110mg/dl y generalmente<140mg/dl. Estos pacientes requerirán habitualmente insulina IV.
- 2.
Pacientes en estado no crítico: lo más cerca posible de los siguientes valores, teniendo en cuenta la situación clínica, como glucemia preprandial<130mg/ dl y glucemia posprandial<180–200mg/dl.
Objetivos para la glucemia en la hospitalización (Standards of Medical Care, American Diabetes Association 2009)21
| Enfermo crítico | Enfermo no crítico |
| Lo más cerca posible de 110mg/dl y generalmente<140mg/dl (A) | No hay evidencias claras (E) |
| Estos pacientes requieren un protocolo de insulina intravenosa que haya demostrado eficacia y seguridad en alcanzar el rango de glucosa deseado sin aumentar el riesgo de hipoglucemia severa (E) | Glucemia basal<130mg/dl y glucemia posprandial < 180–200mg/dl |
| La insulina es el fármaco preferido para tratar la hiperglucemia en la mayoría de los casos |
A y E: grados de evidencia.
La evidencia para establecer los objetivos para los pacientes no críticos es menor y se basa en los resultados de estudios epidemiológicos y fisiológicos. En espera de datos de estudios prospectivos, las recomendaciones sugieren que los objetivos de glucemia durante el ingreso hospitalario en los pacientes no críticos deberían ser los propuestos para los pacientes ambulatorios.
El mayor riesgo de hipoglucemia con los protocolos de tratamiento intensivo con insulina para mantener la normoglucemia ha obligado a suspender prematuramente 2 ensayos clínicos recientes en pacientes críticos38,39. Sin embargo, este mayor riesgo no se ha observado en otros protocolos de tratamiento de pacientes críticos con insulina en perfusión continua por vía IV en los que se monitorizan los valores de glucemia frecuentemente43. La eficacia y la seguridad de esos protocolos deberán, sin embargo, probarse en nuevos ensayos clínicos. Mientras tanto, la opinión dominante en la actualidad es la de perseguir objetivos de control glucémico más conservadores hasta disponer de los resultados de estos estudios44. Tanto en situación crítica como no crítica, para establecer los objetivos deben tenerse en cuenta la situación del paciente y los medios disponibles para realizar el tratamiento. En los pacientes con elevado riesgo de hipoglucemia o bien muy ancianos, baja expectativa vital, y en general cuando el alivio sintomático sea la principal y única consideración en el paciente hospitalizado, los objetivos deben ser menos estrictos. También es aconsejable iniciar el protocolo con objetivos de glucemia menos estrictos y posteriormente reducirlos hasta llegar a los valores recomendados.
Opciones terapéuticas en el paciente hospitalizado con diabetesTratamiento con agentes oralesEl papel de los agentes orales en el paciente con diabetes hospitalizado es limitado por los potenciales efectos adversos, el inicio lento de acción y la larga duración que condicionan la falta de flexibilidad para adaptarse a los requerimientos cambiantes a lo largo del día. Los secretagogos (sulfonilureas, glinidas) son una contraindicación relativa durante la hospitalización, especialmente en las situaciones en las que no se puede asegurar la alimentación y en las que los requerimientos de insulina pueden variar de forma drástica a diferentes horas del día, por el riesgo de hipoglucemia, sobre todo con las sulfonilureas de larga duración45. La metformina no tiene efecto inmediato y debe iniciarse a dosis bajas y progresivas para evitar los efectos gastrointestinales. Por otra parte, la metformina frecuentemente está contraindicada por la posibilidad de desarrollar una acidosis láctica. En el paciente hospitalizado son frecuentes las situaciones que predisponen a esta complicación por hipoxia tisular (presencia o riesgo de insuficiencia cardíaca, enfermedad pulmonar crónica, hipoperfusión) y las que pueden interferir en la eliminación de ácido láctico (presencia o riesgo de insuficiencia renal y hepática grave)46,47. Las glitazonas tampoco son útiles en la hospitalización por el inicio tardío de su efecto (2–4 semanas), que obviamente no permite el ajuste a corto plazo necesario en el paciente hospitalizado. Además, con estos agentes suelen aumentar el peso, la retención de líquido y el edema, y pueden inducir o agravar la insuficiencia cardíaca. No existe información sobre la utilización de los inhibidores de la DDP-4 y los análogos de GLP1 en la hospitalización, pero, por sus características, su eficacia probablemente será limitada, especialmente en los pacientes sin alimentación oral.
Tratamiento con insulinaPara la mayoría de los pacientes, por tanto, los agentes orales no son útiles. En consecuencia, los objetivos de control glucémico antes indicados únicamente pueden alcanzarse mediante el tratamiento con insulina administrada por vía IV o subcutánea (SC). Actualmente, la insulina se considera el fármaco más efectivo y de elección para tratar la hiperglucemia en los pacientes hospitalizados. La selección de la vía para la administración de la insulina dependerá de la situación clínica del paciente y de la disponibilidad de medios.
Tratamiento con insulina intravenosaLas situaciones en las que está indicado el tratamiento con insulina IV son la cetoacidosis diabética y coma hiperosmolar no cetósico, el enfermo crítico y otras enfermedades o procesos en los que el control glucémico se considera importante para su evolución, el perioperatorio en la cirugía mayor, especialmente en cirugía cardíaca y trasplante de órganos, y la hiperglucemia exacerbada por el tratamiento con altas dosis de glucocorticoides o nutrición parenteral. Estas situaciones tienen en común la inestabilidad metabólica, independientemente de si el paciente se encuentra o no en un área de críticos. Además, en la mayoría existe tendencia a cambios bruscos e importantes de los requerimientos de insulina, lo cual, junto al riesgo a desarrollar hipoperfusión hística, limita el tratamiento mediante insulina SC. La insulina regular por vía IV, por su rapidez de acción y corta vida media (4–5min), así como por la predictibilidad del efecto hipoglucemiante, es la forma de administración de la insulina más aconsejable en estas situaciones.
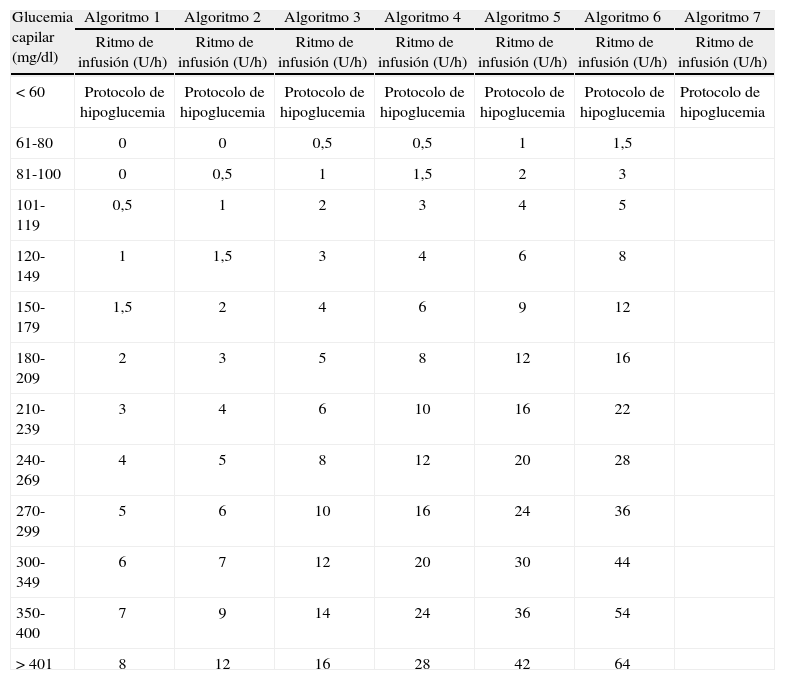
Aunque aún se sigue utilizando la combinación de insulina con glucosa y potasio (GIK), la infusión de la insulina mediante bomba de infusión IV es el sistema recomendado por ser el más eficiente, seguro y fácil de utilizar para el control de la glucemia. Consiste en la administración de insulina rápida, habitualmente a una concentración de 1 U/1ml de solución salina al 0,9%. Los protocolos son múltiples y no hay estudios que los comparen cara a cara, pero los que utilizan escalas dinámicas para la administración de la insulina según las glucemias son los que suelen ofrecer mejores resultados en términos de control glucémico y baja frecuencia de hipoglucemias5,48–51. El principal factor que contribuye a la seguridad del protocolo es la frecuencia de la monitorización de la glucemia, pero existen otros también importantes, como la utilización de tasas de infusión relativamente bajas en el rango de las glucemias próximas a la euglucemia, establecer objetivos menos estrictos, al menos inicialmente, y contemplar la actuación en caso de hipoglucemia y las situaciones en las que se debe avisar al médico. Otros aspectos importantes para establecer un protocolo en un determinado centro es considerar las características de cada hospital y adaptarlo a éstas, indicar el momento de inicio, así como la cantidad de glucosa y la dosis o algoritmo de insulina inicial, permitir la adaptación a los requerimientos de cada paciente según la sensibilidad individual a la insulina e incluir mecanismos para cambiar la velocidad de infusión ante cambios importantes de la glucemia. En el anexo 1 se muestra el protocolo diseñado y establecido en el Hospital de Sant Pau de Barcelona, que está basado en el de Markovitz y las modificaciones y adaptaciones posteriores de éste49. Para evaluar la eficacia y seguridad del protocolo, comparamos los resultados observados en los primeros 6 meses con los obtenidos en una cohorte retrospectiva en los 6 meses previos a la instauración del protocolo52,53. La glucemia media durante la estancia en la UCI (incluye período de tratamiento con insulina IV y SC) fue claramente inferior tras la instauración del protocolo (media [desviación estándar] de 118 [16] mg/dl frente a 143 [32] mg/dl) y la reducción relativa de las glucemias>200mg/dl fue de un 62,7%, sin un incremento significativo de las hipoglucemias (el 3,8 frente al 7,3%). El protocolo consiste en 6 algoritmos o escalas que consideran el nivel de sensibilidad a la insulina del paciente y cada algoritmo está formado por una tabla de decisión que indica la velocidad de infusión de la insulina según el valor de la glucemia. Por seguridad, se recomienda comenzar por el algoritmo 1 en la mayoría de los pacientes o por el algoritmo 2 en los pacientes en los que son previsibles requerimientos elevados.
Algoritmos de infusión intravenosa de insulina diseñado y evaluado en el Hospital de la Santa Creu i Sant Pau de Barcelona para el paciente crítico52,53
| Glucemia capilar (mg/dl) | Algoritmo 1 | Algoritmo 2 | Algoritmo 3 | Algoritmo 4 | Algoritmo 5 | Algoritmo 6 | Algoritmo 7 |
| Ritmo de infusión (U/h) | Ritmo de infusión (U/h) | Ritmo de infusión (U/h) | Ritmo de infusión (U/h) | Ritmo de infusión (U/h) | Ritmo de infusión (U/h) | Ritmo de infusión (U/h) | |
| < 60 | Protocolo de hipoglucemia | Protocolo de hipoglucemia | Protocolo de hipoglucemia | Protocolo de hipoglucemia | Protocolo de hipoglucemia | Protocolo de hipoglucemia | Protocolo de hipoglucemia |
| 61-80 | 0 | 0 | 0,5 | 0,5 | 1 | 1,5 | |
| 81-100 | 0 | 0,5 | 1 | 1,5 | 2 | 3 | |
| 101-119 | 0,5 | 1 | 2 | 3 | 4 | 5 | |
| 120-149 | 1 | 1,5 | 3 | 4 | 6 | 8 | |
| 150-179 | 1,5 | 2 | 4 | 6 | 9 | 12 | |
| 180-209 | 2 | 3 | 5 | 8 | 12 | 16 | |
| 210-239 | 3 | 4 | 6 | 10 | 16 | 22 | |
| 240-269 | 4 | 5 | 8 | 12 | 20 | 28 | |
| 270-299 | 5 | 6 | 10 | 16 | 24 | 36 | |
| 300-349 | 6 | 7 | 12 | 20 | 30 | 44 | |
| 350-400 | 7 | 9 | 14 | 24 | 36 | 54 | |
| > 401 | 8 | 12 | 16 | 28 | 42 | 64 |
- a.
Recomendaciones generales
- –
Objetivos de glucemias: 80–120mg/dl.
- –
Solución estándar (50 U insulina regular en 50ml de suero fisiológico: 1 U/ml).
- –
Aporte glucosa adecuado: suero glucosado al 5% a velocidad de 100ml/h o equivalente (suero glucosado al 10%, nutrición enteral, nutrición parenteral).
- –
Monitorización: glucemia capilar horaria.
- –
- b.
Inicio
- –
Todo paciente crítico con diabetes conocida o hiperglucemia >120mg/dl.
- –
Iniciar por algoritmo 1 en la mayoría de los pacientes, o algoritmo 2 en caso de requerimientos previos de insulina > 80 U/día, cirugía mayor no cardíaca o cardíaca, trasplante de órgano, tratamiento con glucocorticoides y nutrición parenteral.
- –
- c.
Cambio de algoritmo
- –
A superior: glucemia > objetivos durante 2h y cambio < 50mg en 1h.
- –
A inferior: glucemias < 80mg durante 2h.
- –
Los requerimientos de insulina suelen disminuir en caso de (optimización del control glucémico y mejoría del proceso de base, o aumentar en caso de infección-fiebre, utilización catecolaminas o esteroides, nutrición enteral y parenteral).
- –
Si ingesta oral: cambiar al algoritmo superior durante las 4h postingesta.
- –
- d.
Tratamiento de las hipoglucemias
- –
Suspender infusión de insulina.
- –
Administración de glucosa intravenosa (25–50ml de suero glucosado al 50%) y repetir/10-20min si glucemia < 60mg/dl.
- –
Restaurar la infusión de insulina con el algoritmo inferior.
- –
- e.
Avisar al médico si:
- –
Cambio de la glucemia > 100mg/dl en 1h.
- –
2 glucemias seguidas > 350mg/dl.
- –
Hipoglucemia no resuelta en 20min tras la administración de glucosa intravenosa y supresión de la infusión de insulina.
- –
La discontinuación de la infusión de la insulina y la transferencia a una pauta de insulina SC es tan importante como el inicio de la infusión. La vida media de la insulina IV es de 4–5min, la acción biológica de unos 20min y a los 30–60min los valores son indetectables. Por tanto, para mantener valores de insulina adecuados en plasma y evitar una posible descompensación hiperglucémica, es imprescindible mantener la infusión IV al menos hasta 2h después de haber administrado la insulina SC de acción rápida (regular o análogos de rápida) o hasta 2–4h después de la insulina NPH, NPL, glargina o detemir.
La estimación de la dosis inicial de insulina SC se realiza sobre la base de la tasa de infusión de las últimas 4–8h. Aunque no existen datos concluyentes, se suele recomendar iniciar con el 50-100% de la dosis estimada; lo más habitual es iniciar con el 75-80%23,43,54–56. En la estimación debe tenerse en cuenta la evolución probable de los factores que modifican los requerimientos en las siguientes horas, tanto para reducirlas como consecuencia de la optimización del control glucémico y la mejoría del proceso de base o complicación y la reducción-retirada de catecolaminas o esteroides, como para aumentarlas en caso de infección-fiebre, utilización de catecolaminas o esteroides, o nutrición enteral y parenteral.
Tratamiento con insulina subcutánea en la hospitalizaciónEn la mayoría de los pacientes hospitalizados no tributarios de tratamiento con insulina IV, el tratamiento con insulina SC es la mejor opción terapéutica en caso de que se requiera tratamiento farmacológico de la hiperglucemia y permite lograr el control de la glucemia en la mayoría de los pacientes diabéticos hospitalizados. Ello es posible si para diseñar la pauta de administración se tienen en cuenta la secreción fisiológica de la insulina, las características farmacocinéticas de la insulina exógena y la situación clínica del paciente. Sin embargo, lo que ya no está tan claro es cuándo iniciar el tratamiento con insulina en los pacientes no tratados previamente con insulina y qué pauta de administración de la insulina utilizar.
Para iniciar el tratamiento con insulina, debemos tener en cuenta fundamentalmente la glucemia, el tipo de diabetes y el tratamiento previo de ésta34,43,50,55–57.
En los pacientes tratados previamente con dieta sola, si las glucemias son<150mg/dl, se puede instaurar únicamente la pauta correctora y posteriormente, si las dosis correctoras son frecuentes o las glucemias son>150mg/dl, establecer una pauta de insulina programada. Si la glucemia al ingreso está entre 150–200mg/ dl iniciar la insulinoterapia con 0,3 U/kg/día, y si es>200mg/dl, con 0,4 U/kg/día. En los pacientes tratados previamente con dieta y agentes orales, si las glucemias son<150mg/dl podemos instaurar únicamente la pauta correctora (pacientes tratados con un solo agente oral y situación de bajo estrés) o bien la pauta de insulina programada (pacientes tratados con dos o más agentes orales y situación de estrés importante o ingreso prolongado). Si las glucemias al ingreso son>150mg/dl, iniciar insulinoterapia con 0,4 U/kg/ día si la glucemia al ingreso está entre 150–200mg/dl, o bien con 0,5 U/kg/día si la glucemia al ingreso es>200mg/dl. En los pacientes tratados con insulina en monodosis nocturna con o sin agentes orales, la supresión de los agentes orales supone una supresión de una buena parte de la cobertura de los requerimientos de insulina, que deberemos tener en cuenta para el cálculo de la dosis total diaria. La dosis inicial será 0,4 U/kg/día si la glucemia al ingreso es<150mg/dl, 0,5 U/kg/día si la glucemia al ingreso está entre 150–200mg/dl y 0,6 U/kg/día si la glucemia al ingreso es>200mg/dl. Los pacientes tratados previamente con programas de insulinización completa (2 dosis o múltiples dosis) requieren insulina desde el momento del ingreso y para el cálculo de la dosis se deben tener en cuenta los requerimientos insulínicos previos del paciente y considerar las condiciones clínicas que pueden modificarlos durante la hospitalización. Finalmente, en los pacientes tratados previamente con infusión de insulina IV, la mejor opción es calcular la dosis de insulina sobre la base de los requerimientos con la infusión en las últimas 4–8h.
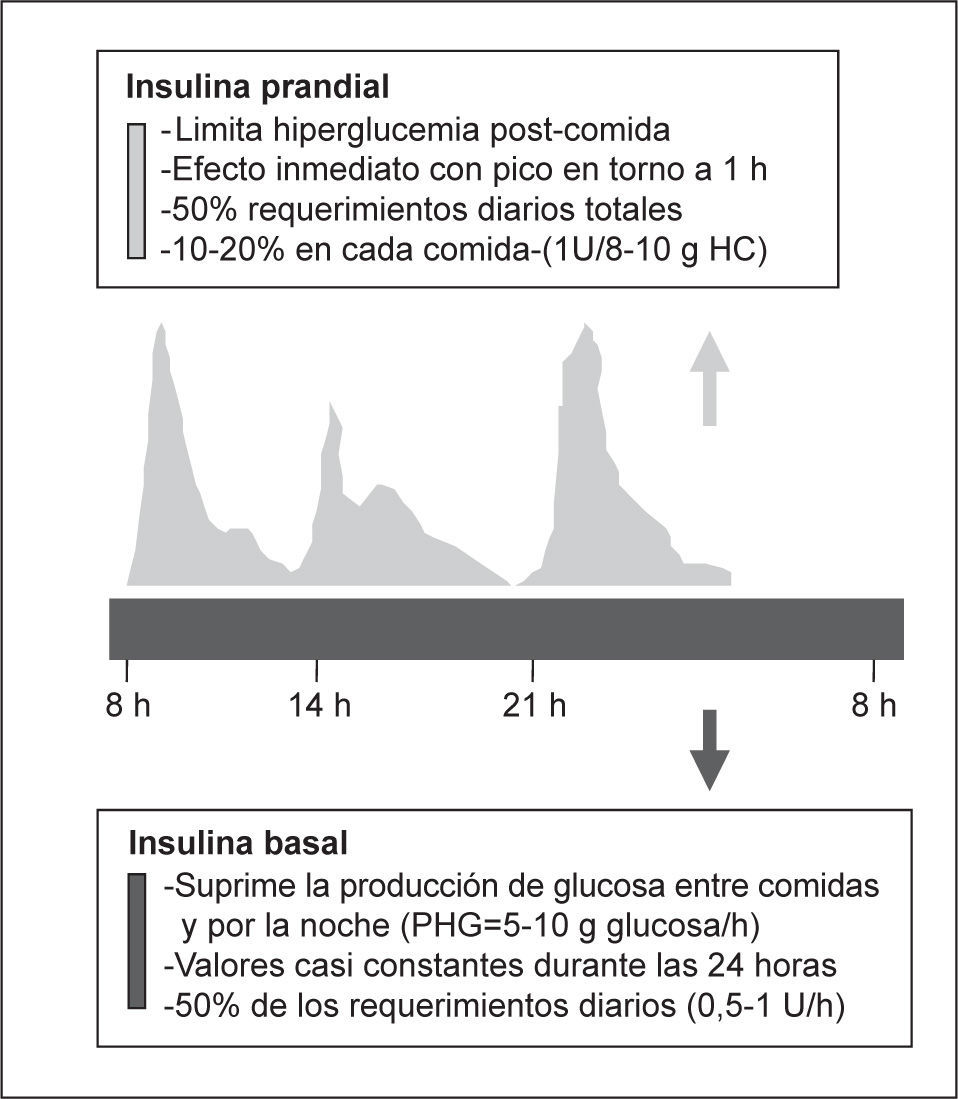
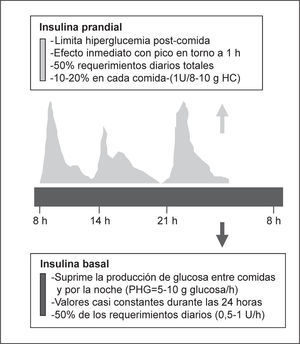
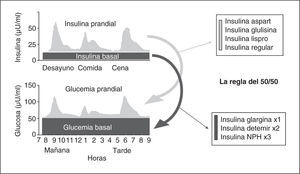
Para la selección de la pauta de insulina, de forma similar a lo que ocurre para el tratamiento ambulatorio de los pacientes con diabetes, debemos considerar los 3 componentes de la secreción fisiológica de la insulina. La producción fisiológica de insulina por el páncreas incluye el componente basal y prandial; el basal es la insulina necesaria en situación de ayuno y el prandial, la insulina necesaria después de la ingesta (fig. 2). El componente basal supone una secreción más o menos constante, que es necesaria para evitar la producción de glucosa a partir de diferentes sustratos energéticos en los períodos sin aporte de nutrientes y que representa en torno al 50% de los requerimientos. El componente prandial está constituido por la insulina necesaria para favorecer la utilización de los nutrientes aportados por la ingesta, evitando la hiperglucemia posprandial. Es frecuente que sobre este escenario se superponga durante la hospitalización una o más condiciones (enfermedad, tratamiento con corticoides, etc.) que incrementen los requerimientos de insulina (componente de corrección)5,43.
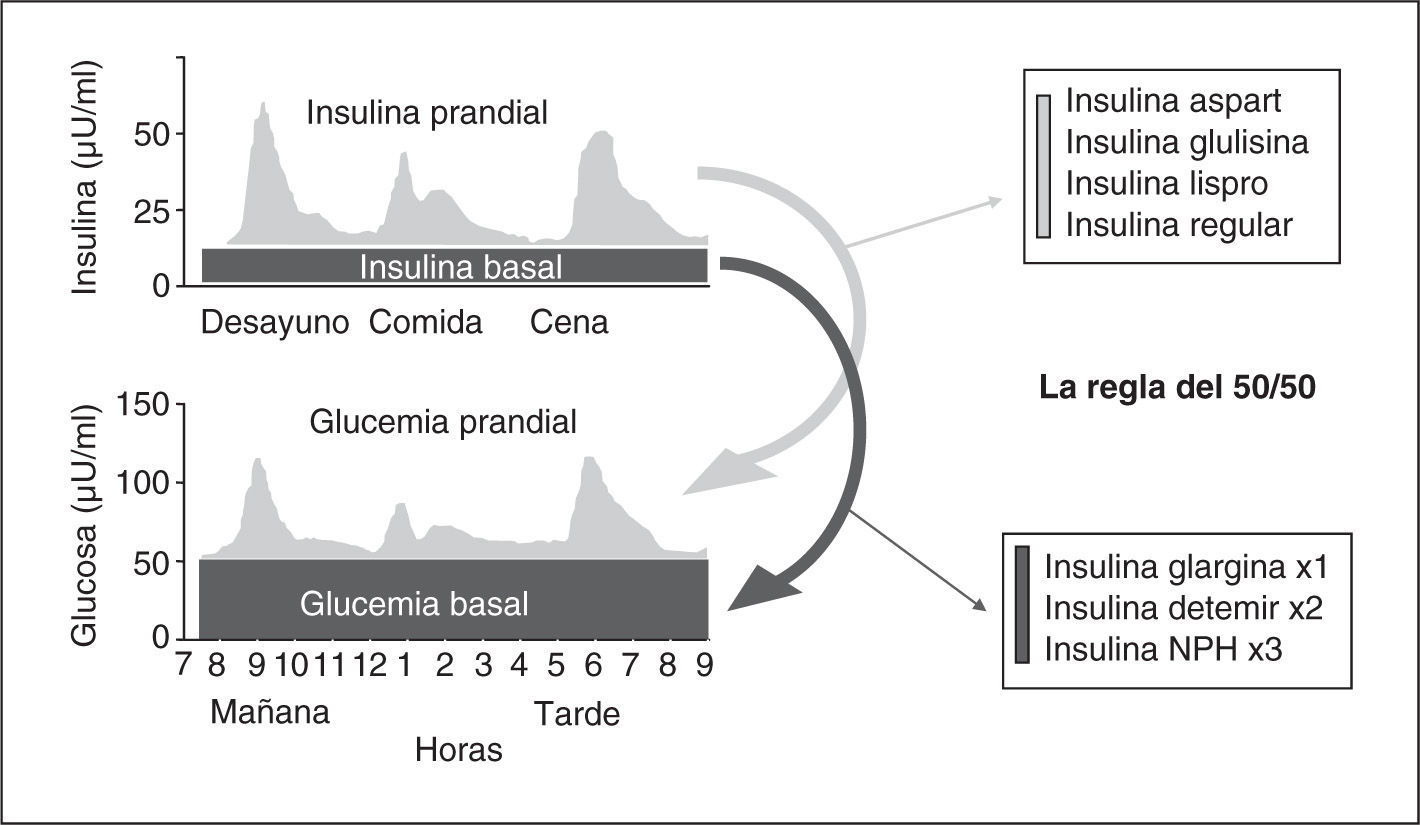
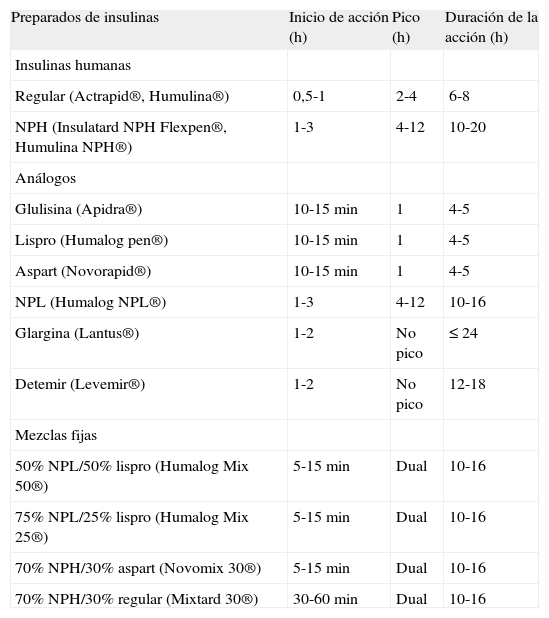
Las combinaciones de los diferentes preparados de insulina disponibles (tabla 3 y fig. 3) permiten diseñar múltiples opciones para su administración durante la hospitalización, que permiten, en mayor o menor medida, ajustamos a los requerimientos basales, prandiales y de corrección.
Características de las principales insulinas
| Preparados de insulinas | Inicio de acción (h) | Pico (h) | Duración de la acción (h) |
| Insulinas humanas | |||
| Regular (Actrapid®, Humulina®) | 0,5-1 | 2-4 | 6-8 |
| NPH (Insulatard NPH Flexpen®, Humulina NPH®) | 1-3 | 4-12 | 10-20 |
| Análogos | |||
| Glulisina (Apidra®) | 10-15min | 1 | 4-5 |
| Lispro (Humalog pen®) | 10-15min | 1 | 4-5 |
| Aspart (Novorapid®) | 10-15min | 1 | 4-5 |
| NPL (Humalog NPL®) | 1-3 | 4-12 | 10-16 |
| Glargina (Lantus®) | 1-2 | No pico | ≤ 24 |
| Detemir (Levemir®) | 1-2 | No pico | 12-18 |
| Mezclas fijas | |||
| 50% NPL/50% lispro (Humalog Mix 50®) | 5-15min | Dual | 10-16 |
| 75% NPL/25% lispro (Humalog Mix 25®) | 5-15min | Dual | 10-16 |
| 70% NPH/30% aspart (Novomix 30®) | 5-15min | Dual | 10-16 |
| 70% NPH/30% regular (Mixtard 30®) | 30-60min | Dual | 10-16 |
El tiempo de actuacion de cualquier insulina puede variar en diferentes personas o a diferentes horas y dosis en una misma persona. Por este motivo, estos periodos solo se deben considerar como unas recomendaciones generales.
Insulina rápida SC únicamente (sliding scales): únicamente incluyen la administración de insulina rápida antes de las comidas o cada 4–6h (sliding scales) y son las pautas de administración de la insulina más utilizadas todavía, aunque su ineficacia está ampliamente demostrada24,34–36,58,59. Constituyen la pauta estándar para el manejo de la diabetes tipo 2 durante la hospitalización en muchos centros y se utilizan en el 75% de los pacientes. A ello contribuye la transmisión entre generaciones como pauta fácil, segura y frecuentemente efectiva, la utilización por parte de los endocrinólogos de pautas complejas y no estandarizadas que conllevan baja aceptación por el resto de médicos y la ausencia de recomendaciones con evidencias claras sobre la idoneidad y, a la vez, asequibles para ser utilizadas por personal sanitario no experto en diabetes.
La ineficacia de estas pautas está relacionada con su enfoque "reactivo", ya que trata la hiperglucemia existente pero no la previene y no considera los diferentes componentes de la secreción fisiológica de la insulina y, por tanto, la sustitución fisiológica. Estas pautas suelen dejar de administrar insulina al paciente por debajo de un valor determinado de glucemia, por encima del cual se indican dosis crecientes de insulina rápida. No cubren las necesidades basales de insulina y especialmente en los pacientes insulinopénicos favorecen el desarrollo de episodios de hipo e hiperglucemia. Estas pautas únicamente pueden tener algún sentido en algunos casos en los que el control de la diabetes se realice con tratamiento dietético, como sistema de corrección de la hiperglucemia de manera puntual.
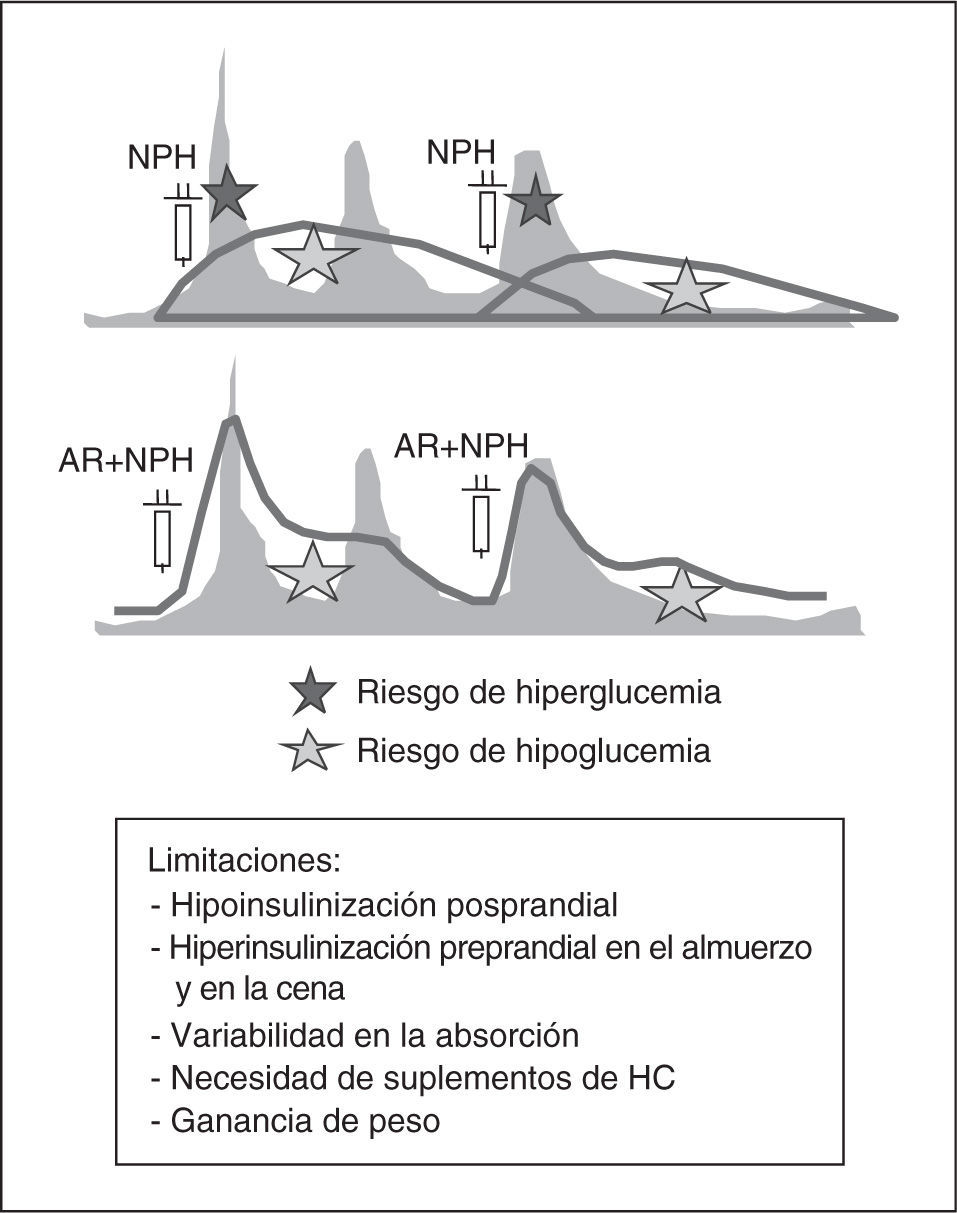
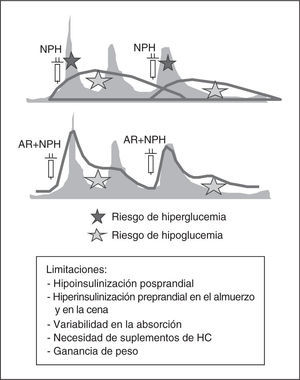
Dos dosis de insulina NPH/NPL o mezclas fijas de NPH/NPL con rápida o análogos de rápida (fig. 4): estas pautas son las más utilizadas en los pacientes con diabetes tipo 2 en régimen ambulatorio y permiten un control aceptable en muchos pacientes, mientras existe cierta producción endógena de insulina, pero no cuando la producción endógena de insulina es mínima o inexistente, independientemente de que exista o no resistencia a la insulina. Las ventajas de estas pautas respecto a las pautas basal-bolus radican en el menor número de inyecciones y glucemias capilares y una menor dependencia del autoajuste por parte del paciente. Todo ello las hace más aceptables para el paciente y el personal sanitario.
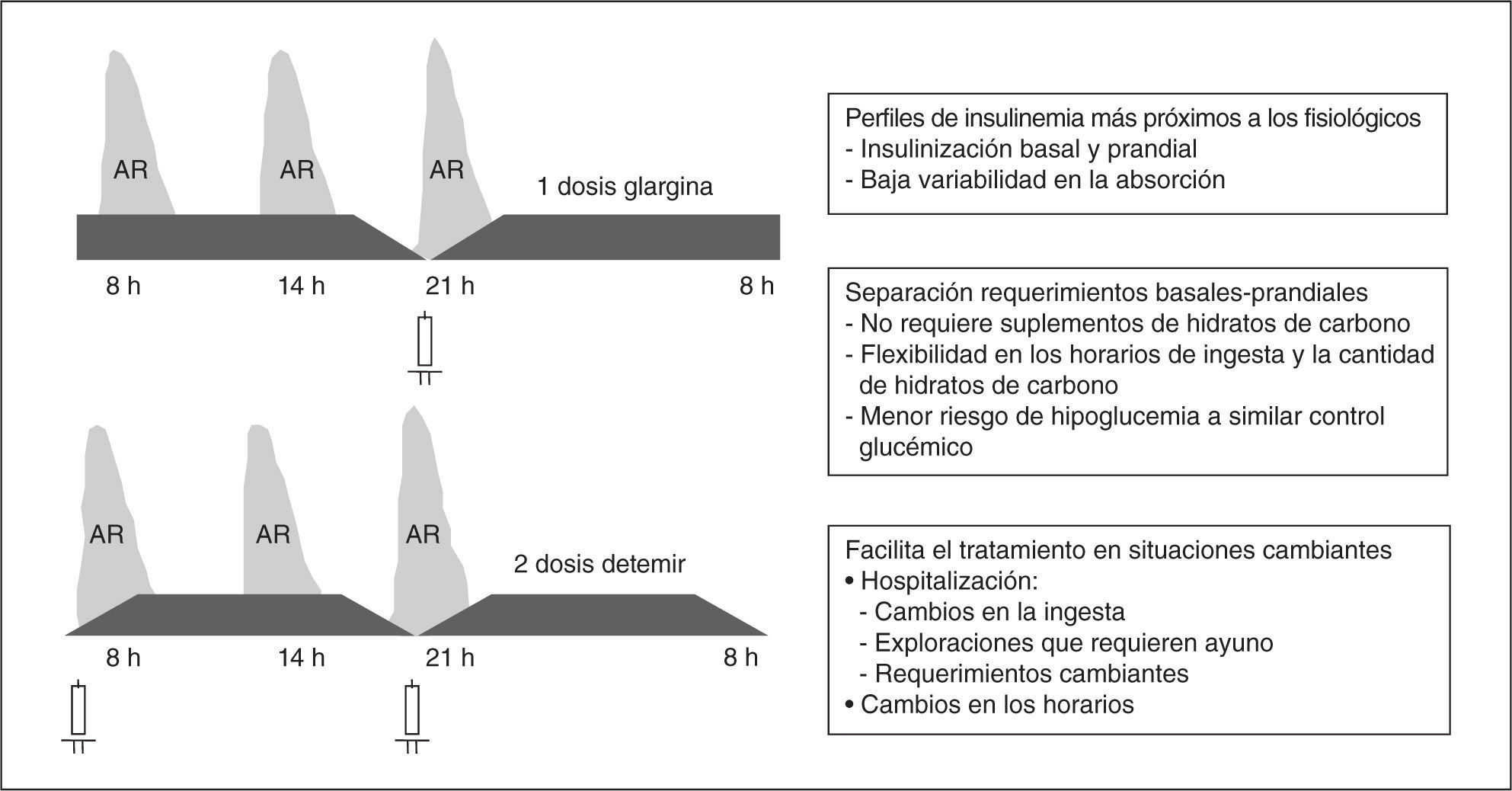
Sin embargo, por el perfil de acción de las insulinas NPH y NPL, estas pautas condicionan valores bajos de insulina antes del desayuno y de la cena, e hiperinsulinemia antes de la comida y en la madrugada, lo que conlleva riesgo de hipoglucemia en la madrugada y antes de la comida, y de hiperglucemia basal y antes de la cena. Asimismo, no permite el ajuste preprandial de las dosis según la glucemia y la cantidad de hidratos de carbono a ingerir, ya que la NPH y NPL cubren los requerimientos basales y, al menos en parte, los prandiales. Esto obliga a distribuir los hidratos de carbono de forma acorde al perfil de insulinemia (en general, en 5 tomas con suplementos de hidratos de carbono a media mañana y antes de acostarse) y un aporte fijo de
carbohidratos para evitar la hipoglucemia y la hiperglucemia. Si tenemos en cuenta que los requerimientos prandiales en los pacientes hospitalizados son frecuentemente imprevisibles y cambiantes, el manejo con dos dosis de insulina NPH/NPL o mezclas fijas de NPH/ NPL con rápida o análogos de rápida es más problemático. Además, en las situaciones que requieren ayuno es necesario administrar glucosa IV y los algoritmos para el ajuste de las dosis son más complejos. Todos estos factores posiblemente han contribuido al histórico fracaso de la estandarización de estas pautas para el manejo de la hiperglucemia en la hospitalización y desbancar las tan arraigadas pautas de insulina rápida según la glucemia.
Las opciones para los pacientes tratados antes de la hospitalización con pautas basadas en la administración de 2 dosis de NPH/NPL son continuar con dicha pauta, ajustando las dosis o utilizar una pauta basalbolus. Se cree que esta opción es la más adecuada en muchos pacientes por las razones antes indicadas. Una de las barreras para la utilización de las pautas basalbolus en estos pacientes es la transferencia de nuevo a esta pauta al alta. Sin embargo, la dificultad es más teórica ya que son pacientes que manejan la insulina y, conociendo la pauta y el grado de control (HbA1C) previos a la hospitalización y los requerimientos durante la hospitalización, se pueden realizar sin grandes problemas los ajustes de la pauta habitual del paciente en el momento del alta.
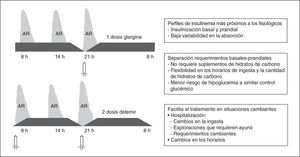
Pautas basal-bolus (fig. 5): son las pautas de administración SC de insulina que reproducen de forma más precisa la secreción fisiológica de la insulina, ya que permiten diferenciar claramente los requerimientos basales y prandiales.
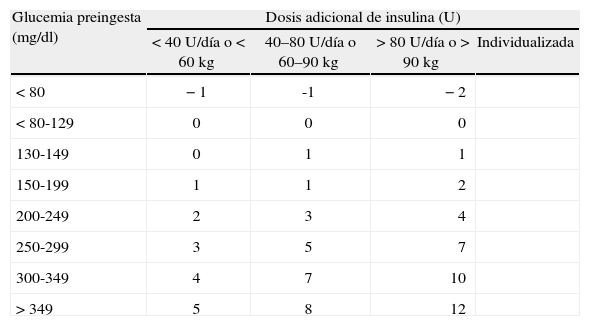
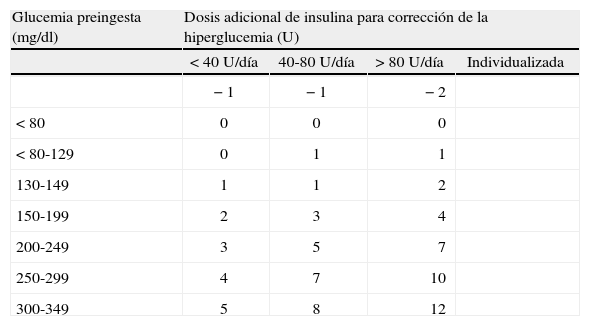
En estas pautas, la insulina basal sustituye la secreción de insulina en situación de ayuno y la insulina nutricional sería la insulina que es necesaria para cubrir cualquier nutriente que el paciente esté recibiendo como glucosa IV, alimentación IV o enteral, o el alimento consumido en las comidas. Si el paciente está comiendo y no está recibiendo ningún otro nutriente, la insulina nutricional será igual que la insulina prandial. Además de los requerimientos basales y nutricionales de insulina, los pacientes requieren, a menudo, dosis de insulina suplementarias o de corrección para tratar las hiperglucemias inesperadas. Por lo tanto, la insulina SC se puede dar como dosis programada (insulina basal más insulina nutricional) y dosis suplementarias de corrección para cubrir cualquier hiperglucemia por encima de los objetivos de control (tabla 4). Este algoritmo de corrección no debe confundirse con la pauta sliding scale de dosis de insulina regular.
Dosis de insulina (regular o análogo de acción rápida) suplementaria para la corrección de la hiperglucemia, según la sensibilidad individual valorada por los requerimientos de insulina o el peso corporal
| Glucemia preingesta (mg/dl) | Dosis adicional de insulina (U) | |||
| < 40 U/día o < 60kg | 40–80 U/día o 60–90kg | > 80 U/día o > 90kg | Individualizada | |
| < 80 | −1 | -1 | −2 | |
| < 80-129 | 0 | 0 | 0 | |
| 130-149 | 0 | 1 | 1 | |
| 150-199 | 1 | 1 | 2 | |
| 200-249 | 2 | 3 | 4 | |
| 250-299 | 3 | 5 | 7 | |
| 300-349 | 4 | 7 | 10 | |
| > 349 | 5 | 8 | 12 | |
Para la distribución de la dosis programada, aunque estará influida por otros factores (grado de estrés, medicaciones, características del paciente, etc.), el principal factor que se debe considerar es la alimentación. Si el paciente está en ayunas con suero glucosado, nutrición enteral o parenteral, la insulina basal necesaria supone el 100% de la dosis programada, mientras que si el paciente está comiendo, la dosis de insulina basal será el 50% de la dosis programada y el otro 50% como insulina prandial. Las dosis adicionales de corrección se administrarán como insulina de acción rápida (regular o análogos de acción rápida) en adición a la pauta programada para corregir la hiperglucemia preprandial, en el caso de pacientes con alimentación oral, o cada 4–6h en el caso de pacientes con suero glucosado o nutrición artificial. La dosis de corrección se establece según la glucemia y la sensibilidad individual a la insulina de cada paciente valorada por los requerimientos diarios de insulina o el peso corporal (tabla 4).
La sustitución de los requerimientos basales de insulina (fig. 3) puede realizarse mediante análogos de insulina de acción lenta (insulina glargina una vez al día, insulina detemir en 2 dosis) o insulina NPH o NPL en 3–4 dosis para mitigar los picos. Para cubrir los requerimientos prandiales (fig. 3) disponemos de la insulina rápida y de los análogos de acción ultrarrápida (insulina aspart, glulisina y lispro), que tienen un perfil de acción más rápido y de menor duración, que se acopla mejor al período prandial.
En los pacientes ambulatorios, las pautas de insulina basal-bolus son las más eficaces y constituyen la pauta de elección para los pacientes con diabetes tipo 121. En la hospitalización, los escasos datos disponibles hasta la actualidad van en este sentido34,60. En el estudio RABBIT 2 la utilización de una pauta basal-bolus consiguió mejor control glucémico que la sliding scale o pautas de insulina rápida/6h en pacientes sin tratamiento insulínico previo36. En este estudio, la glucemia media durante la hospitalización fue inferior (media [DE] de 166 [32] frente a 193 [54] mg/dl) y el porcentaje de pacientes que alcanzaron el objetivo de glucemia<140mg/dl fue superior (el 66 frente al 38%) con la pauta bolus-basal, sin incrementar la incidencia de hipoglucemias. Además, en la hospitalización estas pautas ofrecen ventajas adicionales como: a) no tener que tomar suplementos de hidratos de carbono entre las comidas principales para evitar la hipoglucemia; b) los algoritmos de ajuste de las dosis son más simples que para las pautas con dos dosis de insulina intermedia, lo que facilita la estandarización, y c) sobre todo, la flexibilidad para adaptarse a la situación cambiante de los pacientes hospitalizados como los cambios de la hora de la ingesta, la reducción de la ingesta por inapetencia y ayuno por exploraciones o cirugía menor, mediante la adaptación de la hora de administración de la insulina prandial, su reducción u omisión, respectivamente, sin la modificación de la insulina basal ni aporte de glucosa IV.
En el anexo 2 se resumen los ajustes de la pauta de insulina basal-bolus en la cirugía menor/situaciones que requieren ayuno corto y en la hiperglucemia secundaria a glucocorticoides. La flexibilidad para adaptarse a pacientes que requieren uno o más componentes de la pauta (tabla 5), la situación frecuentemente cambiante de los pacientes hospitalizados y la fácil estandarización de la dieta en 3 tomas y los ajustes de las dosis (tabla 6) deberían facilitar el desarrollo de protocolos estandarizados que permitan mejorar el control de la hiperglucemia durante la hospitalización.
Ajustes de la pauta de insulina basal-bolus en cirugía menor y tratamiento con corticoides
|
AR: análogo de insulina rápida; DTDI: dosis total diaria de insulina; IR: insulina regular.
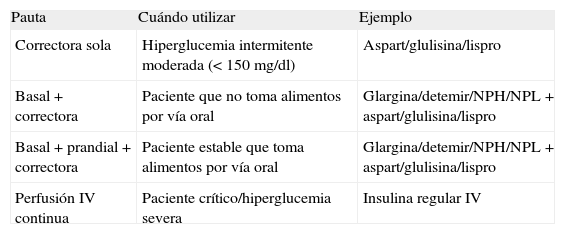
Selección y adaptación de la pauta de insulina a la situación clínica del paciente
| Pauta | Cuándo utilizar | Ejemplo |
| Correctora sola | Hiperglucemia intermitente moderada (< 150mg/dl) | Aspart/glulisina/lispro |
| Basal + correctora | Paciente que no toma alimentos por vía oral | Glargina/detemir/NPH/NPL + aspart/glulisina/lispro |
| Basal + prandial + correctora | Paciente estable que toma alimentos por vía oral | Glargina/detemir/NPH/NPL + aspart/glulisina/lispro |
| Perfusión IV continua | Paciente crítico/hiperglucemia severa | Insulina regular IV |
IV: vía intravenosa.
Ajustes de la dosis de insulina basal y prandial sobre la base de los perfiles glucémicos
| HiperglucemiaBasal (ayunas) sin hipoglucemia nocturna:Aumentar dosis basal 20%Preprandial sin hipoglucemia desde la comida previa:Comida: aumentar (10-20%) la dosis prandial del desayunoCena: aumentar (10-20%) la dosis prandial de la comida2h poscena o al acostarse: aumentar (10-20%) la dosis prandial de la cenaHipoglucemia o glucemias bajasNocturna o basal: reducir 20% la dosis basalDurante la mañana: reducir (10-20%) la dosis prandial del desayunoDurante la tarde: reducir (10-20%) la dosis prandial de la comidaDespués de cenar-acostarse: reducir (10-20%) la dosis prandial de la cena |
En el anexo 3 se muestra un modelo de hoja estandarizada para la prescripción de insulina SC, basado en el de la Asociación Americana de Endocrinólogos Clínicos.
PLANIFICACIÓN DEL TRATAMIENTO AL ALTAEl momento del alta suele ser una de la situaciones más conflictivas en los pacientes con diabetes hospitalizados por motivos no relacionados con el control glucémico. A ello contribuyen aspectos comunes a otros pacientes, como la reducción de las estancias hospitalarias, la complejidad de los pacientes, la superespecialización y la falta de comunicación/coordinación con los equipos de atención primaria61, pero también elementos más específicos como la falta de información sobre el manejo previo de la diabetes (tratamiento, capacidad de automanejo y grado de control glucémico), la no previsión de las nuevas necesidades del paciente en relación con el automanejo derivadas del tratamiento que se instaurará y la no planificación del seguimiento tras el alta.
Para planificar el tratamiento de la hiperglucemia al alta, además del tratamiento previo a la hospitalización, es fundamental documentar el grado de control glucémico previo por la historia clínica y la determinación de la HbA1C con el preoperatorio o cuando ingresa el paciente, si no se dispone de una determinación previa. La HbA1C, además de ayudar a tipificar la hiperglucemia no conocida62, facilita la planificación del tratamiento al alta en los pacientes con diabetes previa.
En los pacientes con buen control previo (HbA1C<7%), en ausencia de contraindicaciones, al alta debe instaurarse el tratamiento prehospitalización, aunque dependiendo de la situación clínica del paciente puede ser necesario instaurar una pauta puente.
En los pacientes con control deficiente (sobre todo si la HbA1C es>8%) con dieta y/o agentes orales, y cuando existe alguna contraindicación al tratamiento farmacológico previo, para la selección del tratamiento al alta debemos seguir el esquema recomendado para el seguimiento ambulatorio.
Así, siguiendo el algoritmo para seleccionar las medidas terapéuticas propuesto por la American Diabetes Association (ADA)63 y la European Association for the Study for Diabetes (EASD)64 dependiendo del tratamiento previo, podemos aumentar la dosis de los fármacos que recibía, añadir un segundo fármaco oral o insulina en monodosis nocturna.
En algunos pacientes con contraindicación para los agentes orales o con control previo muy deficiente y características que sugieren insulinopenia como diabetes de larga evolución, delgadez y/o pérdida de peso espontánea, y predominio de la hiperglucemia diurna respecto a la basal, deberá plantearse la insulinización completa con 2 dosis o con múltiples dosis, dependiendo de las características del paciente.
En los pacientes de nuevo diagnóstico, si las características sugieren que se trata de una diabetes tipo 1, el tratamiento al alta será la insulina en un programa basal-bolus de múltiples dosis con análogos de acción prolongada y acción rápida.
En los pacientes previamente tratados con insulina la situación es menos compleja, ya que son pacientes que manejan la insulina y, conociendo la pauta y el grado de control (HbA1C) previos a la hospitalización y los requerimientos durante la hospitalización, se pueden realizar sin grandes problemas los ajustes de la pauta habitual previa del paciente. En algunos pacientes con diabetes tipo 1 o con diabetes tipo 2 tratados previamente con 2 dosis y con control deficiente, puede ser la oportunidad para transferirlos a una pauta basal-bolus, por lo que al alta únicamente será necesario ajustar las dosis utilizadas en la hospitalización.
En el momento del alta, el paciente o la familia tienen que haber recibido la información "de supervivencia" sobre la medicación, la monitorización de la glucemia y el manejo de la hipoglucemia, así como el plan de seguimiento tras el alta.
| Insulina | Desayuno (U) | Comida (U) | Cena (U) | Acostarse (U) |
| Basal | ||||
| Glargina | ||||
| Detemir | ||||
| NPH | ||||
| Prandial | ||||
| Aspart | (1) | |||
| Glulisina | (1) | |||
| Lispro | (1) | |||
| Regular | (1) | |||
| Corrección (2) | ||||
| Glulisina | ||||
| Lispro | ||||
| Aspart | ||||
| Regular |
1: si toma HC al acostarse; 2: administradas para corregir la hiperglucemia preprandial según los algoritmos de corrección (< 40 U/día, 40–80 U/día y > 80 U/día).
Situación de hipoglucemia (glucemia < 60mg/dl o clínica)
- –
El paciente puede ingerir: 10–15g de HC (1/2-3/4 vaso de zumo, 1 vaso de leche, 1 sobre de azúcar, etc.).
- –
El paciente no puede ingerir: 25ml vía intravenosa de suero glucosado al 50% (de elección si vía intravenosa) o glucagón (1mg) subcutáneo o IM (de elección en ausencia de vía intravenosa).
- –
Control de la glucemia a los 10–15min y repetir mientras la glucemia < 80mg/dl.
Recomendaciones generales
- –
La insulina basal debe administrarse aunque el paciente no coma. La insulina prandial requiere aporte según la ingesta (no ingesta, no insulina prandial, pero sí la dosis de corrección).
- –
En ausencia de ingesta y aporte de suero glucosado o nutrición artificial: todos los requerimientos como insulina basal o infusión intravenosa (de elección especialmente en diabetes tipo 1 y nutrición parenteral).
- –
Los pacientes con glucocorticoides de acción intermedia (p. ej., prednisona) por la mañana tienen requerimientos de insulina muy elevados en la comida y cena.
Este artículo se ha publicado previamente en la revista Medicina Clínica [Med Clin (Barc). 2009;132:465-75].