INTRODUCCIÓN
Los trastornos de sueño son comunes en los pacientes deprimidos, de tal manera que incluso forman parte de los criterios diagnósticos asignados a esta enfermedad. Clínicamente, estos trastornos están definidos por la dificultad en la conciliación del sueño, los frecuentes despertares nocturnos, el despertar precoz, la reducción del tiempo total de sueño y las pesadillas, que conllevan la apreciación de un sueño no restaurador por parte del paciente1. Asimismo, la depresión ha sido uno de los trastornos psiquiátricos más ampliamente estudiados desde el punto de vista polisomnográfico. Una latencia de sueño alargada, una baja eficiencia del sueño y una reducción en la proporción de sueño delta son hallazgos comunes en pacientes deprimidos1. De especial importancia son las alteraciones observadas en el sueño REM, puesto que incluso han llegado a considerarse como específicas de este trastorno, aunque posteriormente se han describito en otras afecciones psiquiátricas, como la esquizofrenia, el trastorno obsesivo-compulsivo y los trastornos de la alimentación2. Estas alteraciones están caracterizadas fundamentalmente por una latencia de sueño REM acortada, un aumento en la proporción del sueño REM y un aumento de la densidad de los movimientos oculares durante éste. Esta última variable se ha identificado como la más sensible para distinguir a pacientes con depresión mayor de otros con otras enfermedades psiquiátricas o sujetos sanos3.
En la patogenia de la depresión parecen implicados un déficit de la neurotransmisión monoaminérgica (principalmente serotoninérgica, aunque también noradrenérgica), un incremento relativo de la actividad pontina colinérgica y algunas alteraciones endocrinológicas (p. ej., un exceso de las hormonas corticotropa [ACTH] o tirostimulante [TSH]). Los fármacos antidepresivos (AD) actúan mitigando o compensando estas alteraciones neuroquímicas, lo que a su vez se refleja en las modificaciones que su acción provoca en el sueño. Estas modificaciones se han evaluado tanto en voluntarios sanos como en pacientes deprimidos, puesto que, si bien el efecto sobre el sueño es el mismo, el resultado final se supone distinto, ya que actúan sobre patrones de sueño diferentes: en los voluntarios sanos originan un patrón opuesto al observado en pacientes deprimidos no tratados, mientras que en estos últimos "normalizan" las alteraciones. Además, estos efectos dependerán de las características farmacológicas de los distintos compuestos, especialmente de su mecanismo de acción neurobioquímico específico. El objetivo del presente artículo es realizar una revisión sobre lo descrito con relación al efecto de los diferentes AD en el sueño. Previamente se realizará una breve introducción a la clasificación de los AD, según su mecanismo de acción, básica para una buena comprensión.
CLASIFICACIÓN DE LOS FÁRMACOS ANTIDEPRESIVOS
Todos los AD interactúan con la neurotransmisión monoaminérgica (serotonina, noradrenalina y dopamina), y su clasificación se ha llevado a cabo clásicamente teniendo en cuenta los efectos agudos que estos compuestos provocan en el sistema monoaminérgico, aunque últimamente son sus efectos tras la administración repetida posiblemente variando la expresión genética en las neuronas donde actúan esos neurotransmisores la explicación que va adquiriendo mayor importancia a la hora de establecer el mecanismo que subyace en la acción terapéutica de estos fármacos4. Con independencia de que la transducción del impulso neuronal monoaminérgico sea anormal o no en el enfermo deprimido, la hipótesis monoaminérgica de la acción de los antidepresivos sobre la expresión genética propone que los AD, independientemente de sus acciones agudas iniciales sobre receptores y/o enzimas, provocan la activación o inactivación de determinados genes críticos, lo que condicionando, entre otros posibles efectos, una disminución en la síntesis de ciertos receptores (postsinápticos y presinápticos) y/o un incremento de la síntesis de proteínas críticas como el factor neurotrófico derivado del cerebro (BDNF).
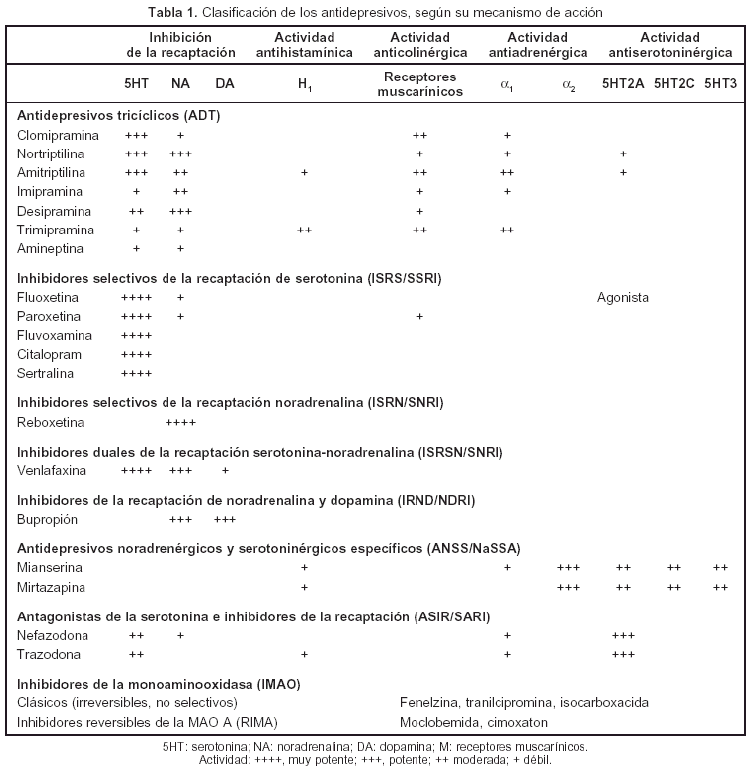
Así, en la actualidad, teniendo en cuenta los efectos agudos que los AD ocasionan en los receptores de los neurotransmisores monoaminérgicos o en enzimas se clasifican 8 grupos diferentes, de los cuales 2 se consideran clásicos y el resto, nuevos (tabla 1). En el subgrupo de los clásicos, se encuentran: a) los tricíclicos (ADT) (clomipramina, amitriptilina, nortriptilina, imipramina, desipramina), cuya acción fundamentalmente consiste en la inhibición, en grado variable de especificidad, de la recaptación de serotonina y/o noradrenalina, aunque también tienen, como mínimo, 3 acciones adicionales: el bloqueo de los receptores colinérgicos muscarínicos, histamínicos H1 y adrenérgicos α1. También bloquean los canales del sodio en el corazón y el cerebro, lo que puede causar arritmias y paro cardíaco, en caso de sobredosificación, así como crisis convulsivas; b) los inhibidores de la monoaminooxidasa (IMAO), que incrementan la transmisión monoaminérgica al inhibir el metabolismo de los neurotransmisores correspondientes. Se diferencian: los clásicos, irreversibles y no selectivos (fenelzina, tranilcipromina y isocarboxacida); los inhibidores selectivos de la MAO B, no efectivos como antidepresivos (deprenilo), y los inhibidores reversibles de la MAO A (RIMA) (cimoxaton, moclobemida); en el subgrupo de los nuevos, se encuentran c) los inhibidores selectivos de la recaptación de la serotonina (ISRS) (fluoxetina, paroxetina, fluvoxamina, citalopram y sertralina); d) los inhibidores selectivos de la recaptación de noradrenalina (ISRN) (reboxetina); e) los inhibidores duales de la recaptación de serotonina y noradrenalina (ISRSN) (venlafaxina), que se diferencian de los ADT en que no presentan efectos adicionales bloqueantes, de receptores ni de canales de sodio; f) los inhibidores de la recaptación de noradrenalina y dopamina (ISRND) (bupropión); g) los antidepresivos noradrenérgicos y serotoninérgicos específicos, antagonistas de los receptores noradrenérgicos α2 (ANSS) preautorreceptores en neuronas noradrenérgicas y preheterorreceptores en neuronas serotoninérgicas (mianserina, mirtazapina), y h) los antagonistas de serotonina e inhibidores de la recaptación (ASIR) (nefazodona, trazodona).
EFECTOS DE LOS ANTIDEPRESIVOS SOBRE EL SUEÑO REM
El efecto de los AD más consistentemente observado sobre el sueño es su acción sobre el sueño REM. La mayoría de los AD presentan un efecto REM supresor, de modo que, durante años, se estableció que el efecto antidepresivo provocado por el fármaco dependía invariablemente de su capacidad para presentar dicha actividad5. No obstante, esta idea ha quedado obsoleta, pues fármacos que suprimen el sueño REM, como las anfetaminas, no tienen efecto antidepresivo y, al contrario, hay compuestos con actividad antidepresiva que no presentan este efecto supresor6. La acción de los AD sobre el sueño REM no puede atribuirse a una única actividad farmacológica. Esta afirmación se verá respaldada por la revisión efectuada, ya que ciertos efectos de determinados AD todavía no están suficientemente dilucidados.
Antidepresivos tricíclicos
La mayoría de los antidepresivos tricíclicos (ADT) presentan un efecto supresor sobre el sueño REM, y alargan su latencia mediante la disminución de su proporción y la redución de la intensidad de movimientos oculares durante éste. De todos ellos, parece que la proporción de sueño REM podría ser un indicador más fiable que su latencia a la hora de evaluar el efecto supresor, pues se ha demostrado que los valores de esta variable dependen de las concentraciones del fármaco en el sistema nervioso central (SNC)6.
De entre los ADT, la clomipramina se ha mostrado como uno de los compuestos más potentes en este aspecto. Passouant et al7, realizando un estudio con clomipramina a dosis antidepresivas estándares sobre voluntarios sanos, observaron una importante disminución de la proporción de sueño REM, un aumento de su latencia y una disminución de los movimientos oculares. Estos efectos también se han descrito en estudios con pacientes deprimidos8,9. Se ha postulado que este importante efecto supresor podría estar relacionado con su potente, y muy específica, acción inhibidora sobre la recaptación de serotonina. La amitriptilina, la nortriptilina, la imipramina y la desipramina también presentan un efecto REM supresor, lo que se ha evidenciado tanto en voluntarios sanos como en pacientes deprimidos6,10,11. Kupfer et al12, en un estudio llevado a cabo con desipramina, en pacientes deprimidos durante 4 semanas, observaron que, mientras que la prolongación de la latencia REM y la reducción de la proporción de sueño REM permanecían durante todo el período de tratamiento, la intensidad de los movimientos oculares retornaba a los valores basales (antes del inicio del tratamiento), tras una previa reducción. Shipley et al13 observaron también este fenómeno de tolerancia en un estudio realizado con desipramina en pacientes deprimidos tras 3 semanas de tratamiento. Se han publicado varios estudios, cuyos resultados coinciden en que la acción supresora de los ADT sobre los componentes tónicos del sueño REM se mantiene durante todo el período en el que se administra el fármaco, mientras que la acción sobre los componentes fásicos (actividad oculomotora) presenta un cierto fenómeno de tolerancia, de modo que retorna a sus valores basales con la administración continuada del AD14,15. Sin embargo, no siempre es así: en varios estudios practicados con ciertos ADT en pacientes deprimidos se ha observado que, con relación a los movimientos oculares rápidos, éstos no sólo no disminuyen con la toma del fármaco, sino que se incrementan; este efecto se mantiene durante todo el período de estudio. Así, Kupfer et al16, en un estudio practicado en pacientes deprimidos, observaron un incremento de la actividad oculomotora durante la toma continuada de imipramina durante los 3 años que duró el estudio, que no quedó suficientemente aclarada. Mendlewicz et al17, en un estudio con pacientes deprimidos destinado a evaluar los efectos de la administración continuada de amitriptilina (7 semanas) observaron un efecto similar, esto es, un importante incremento de la actividad oculomotora durante el sueño REM, que persistió durante todo el tratamiento. En este estudio, este efecto se relacionó con la baja densidad de movimientos oculares que presentaban estos pacientes en condiciones basales. Además, basándose en la afirmación de que la intensidad de los movimientos oculares está inversamente relacionada con la proporción de sueño profundo18, Mendlewicz et al defendieron que, posiblemente, el aumento de la proporción de sueño ligero (fases 1 y 2) observado en este estudio tras la administración de amitriptilina estaría implicado también en la potenciación de la actividad oculomotora.
La amineptina y la trimipramina son ejemplos de ADT que no provocan alteraciones en el sueño REM, o éstas son muy discretas. La amineptina, aparte de las acciones típicas de los ADT, principalmente inhibiendo la recaptación de serotonina, actúa potenciando la liberación presináptica de dopamina6. Estudios realizados con voluntarios sanos (tras la administración aguda)19 y con pacientes deprimidos (tras administración repetida durante 17 días)20 han mostrado que este fármaco potencia el sueño REM, acortando su latencia e incrementando su duración. La trimipramina, por su parte, presenta un débil efecto inhibidor de la recaptación de la serotonina y la noradrenalina, que contrasta con una potente acción bloqueadora de los receptores adrenérgicos α1 e histamínicos H16. La mayoría de estudios realizados con este ADT, con distintas dosis y pautas, y tanto con voluntarios sanos como con pacientes deprimidos6, no ha observado efectos sobre el sueño REM. No obstante, Mouret et al21 sí que observaron un incremento de la latencia REM, pero no una disminución en su porcentaje, tras la administración aguda del fármaco en pacientes deprimidos, resultado que fue considerado secundario al incremento observado en la proporción de sueño delta.
Antidepresivos inhibidores de la monoaminooxidasa
Los estudios destinados a evaluar el efecto de los IMAO sobre el sueño son más escasos y la mayoría se ha llevado a cabo con pacientes deprimidos. Los IMAO inducen un potente efecto supresor sobre el sueño REM, y llegan incluso a provocar su total supresión. Sin embargo, este efecto se diferencia del provocado por otros fármacos AD en que es más tardío10. La fenelzina produjo una total supresión de sueño REM tras su administración repetida durante semanas, que coincidió con el inicio de su actividad antidepresora22. Asimismo, también es característico el importante efecto rebote, en cuanto a la proporción de sueño REM, que se observa tras el cese de la administración del fármaco.
Los estudios practicados con inhibidores selectivos y reversibles de la MAO A merecen una especial atención. Así, mientras que la administración aguda de cimoxaton en pacientes deprimidos provocó un rápido incremento en la latencia REM y una importante disminución en su proporción, la administración repetida de moclobemida produjo sólo un moderado efecto sobre estos parámetros. La causa de esta diferencia no está suficientemente aclarada23.
Inhibidores selectivos de la recaptación de serotonina
Dada la acción directa de los ISRS sobre el sistema serotoninérgico, sería esperable un importante efecto supresor sobre el sueño REM. De hecho, la mayoría de estudios realizados con ISRS demuestran este efecto supresor, aunque su correlación con los efectos antidepresivos del fármaco no es tan marcada como la observada con los clásicos AD.
La fluoxetina ha sido uno de los AD más ampliamente estudiados desde el punto de vista polisomnográfico. Varios estudios han evaluado los efectos de la fluoxetina en el sueño de voluntarios sanos. Aunque, de forma generalizada, se observa un efecto supresor sobre el sueño REM, la potencia de este efecto varía de un estudio a otro, probablemente por diferencias metodológicas. Diferencias en cuanto a las dosis, el momento de la administración o el período de tratamiento conllevan resultados dispares. La fluoxetina a dosis única de 80 mg, administrada por la tarde, produjo una disminución de la proporción de sueño REM y un alargamiento de su latencia, comparado con placebo24. Un estudio en el que se evaluaba el efecto de la fluoxetina en voluntarios sanos tras administración única vespertina de diferentes dosis (20, 40 y 60 mg) observó que los efectos REM supresores presentaban una relación dependiente de la dosis, de modo que las dosis menores de 60 mg causaban discretas modificaciones en el sueño REM25. Saletu et al26 evaluaron, en un estudio comparativo con otro AD, el efecto sobre el sueño de dosis matutinas únicas de 40 mg. El efecto observado fue un aumento de la latencia REM, sin modificar la proporción de sueño REM. Vasar et al27 observaron un importante efecto supresor sobre el sueño REM (disminución de la proporción, aumento de la latencia) con dosis tan bajas como 20 mg. En este caso, aunque la toma fue también matutina, ésta se realizó durante 6 días. Estas discrepancias podrían explicarse por las propiedades farmacocinéticas del AD. La fluoxetina presenta un pico plasmático tardío, de alrededor de las 6 h, y una vida media larga de 70 h, lo que condiciona su efecto máximo en el SNC alrededor de 10 h después de la ingesta del fármaco. Varios estudios en pacientes deprimidos inciden en que el efecto supresor sobre el sueño REM es mayor en relación con su latencia que con su proporción, ya que, aunque disminuye, lo hace menos significativamente. Además, se ha observado que hay un incremento de los componentes fásicos tras la administración continuada de fluoxetina. La actividad oculomotora se ha visto incrementada en cualquier estadio de sueño, aunque fundamentalmente durante el sueño ligero no REM (fases 1 y 2)11.
Los efectos de la paroxetina en el sueño también se han evaluado ampliamente. Estudios realizados in vitro han demostrado que, en comparación con otros ISRS (como la fluoxetina), la paroxetina presenta el mayor efecto inhibidor de la recaptación de serotonina. Este efecto se ve disminuido cuando los estudios se realizan in vivo. Parece que ello es debido a su menor vida media o a la escasa actividad de sus metabolitos28. En estudios en voluntarios sanos se ha observado un importante efecto supresor de sueño REM. Este efecto es dependiente de la dosis, de modo que 40 mg provocaron un efecto supresor superior al observado con 30 o 20 mg6. Asimismo, el momento de la administración influye en los efectos observados. Dosis matutinas provocaron un mayor efecto supresor de sueño REM que dosis administradas en el momento de acostarse26, lo que posiblemente dependa de la dinamia de las concentraciones plasmáticas en el SNC. Los estudios con pacientes deprimidos han demostrado que la paroxetina induce un efecto supresor inicial sobre el sueño REM, que persiste durante la administración repetida del fármaco10,11. Este efecto es mayor que el provocado por ciertos ADT como la amitriptilina29. La mayoría de estudios no establecieron relación entre la acción supresora sobre el sueño REM y la respuesta antidepresiva al fármaco, puesto que fue observada tanto en aquellos pacientes que respondían al tratamiento como en los que no se observó mejoría11.
El efecto de otros ISRS sobre el sueño ha sido objeto de menos estudios. La fluvoxamina, evaluada en pacientes deprimidos durante 4 semanas, produjo un inmediato efecto supresor sobre todos los componentes de sueño REM: un descenso del número de fases REM, una disminución de la proporción de sueño REM (en más del 10%) y una disminución de la actividad oculomotora (intensidad REM y recuento de movimientos oculares), con un efecto máximo a los 2 días de la administración12. Este retraso en el pico de la acción se ha relacionado con su vida media larga y su lenta absorción. A diferencia de lo observado con los ADT, la acción supresora sobre los elementos fásicos de REM no presentó tolerancia tras la administración repetida. La gran potencia inhibidora de este fármaco sobre la recaptación de serotonina observada in vitro podría explicar este importante efecto REM supresor. El citalopram y su efecto en el sueño se han evaluado en pacientes deprimidos, y los estudios han confirmado el efecto supresor que producía sobre el sueño REM, y su persistencia durante todo el período de tratamiento, sin observarse diferencias en cuanto a la relación con el efecto antidepresivo obtenido30. La sertralina también provocó incrementos de la latencia de sueño REM y reducciones en su proporción en estudios realizados con pacientes31.
Otros antidepresivos
El bupropión es un AD relativamente nuevo, que presenta una discreta acción inhibidora de la recaptación de dopamina y noradrenalina, con una falta de acción sobre el sistema serotoninérgico. Su efecto sobre el sueño se ha evaluado escasamente, aunque presenta aspectos que contrastan con los provocados por la mayoría de los AD. En el único estudio hallado en la búsqueda efectuada para llevar a cabo esta revisión, se comparó el bupropión con la fluoxetina32, y los resultados ofrecen aspectos opuestos: el bupropión incrementó significativamente la proporción de sueño REM y acortó su latencia, mientras que la fluoxetina provocó lo contrario. En ambos casos hubo un incremento en la actividad oculomotora. Estos resultados fueron inesperados, puesto que lo esperable era un efecto supresor sobre el sueño REM en un AD que actuaba sobre los sistemas noradrenérgico y dopaminérgico. La neurofarmacología del bupropión es compleja y no está suficientemente aclarada. Este AD debe presentar algún mecanismo de acción todavía desconocido que provoca tanto este incremento de sueño REM como su efecto antidepresivo.
La venlafaxina es un inhibidor dual de la recaptación de serotonina y noradrenalina (aunque también de dopamina, pero con menor potencia). Su efecto sobre el sueño REM es el común a la mayoría de los antidepresivos, con un importante alargamiento de su latencia y una disminución en su proporción, que llegó a ser total en el estudio practicado por Salín-Pascual et al33 sobre voluntarios sanos, tras 4 semanas de tratamiento. En pacientes también se observaron los mismos efectos34.
La mianserina es un AD tetracíclico con complejo mecanismo de acción, y no inhibe la recaptación monoaminérgica pero antagoniza una gran variedad de receptores monoaminérgicos, como los adrenérgicos α2 y α1, y los serotoninérgicos 5HT2A, 5HT2C. Estudios con voluntarios sanos han demostrado que la mianserina produce un descenso de la proporción de sueño REM y del número de fases REM, así como un alargamiento de su latencia35, mientras que, en pacientes, este efecto REM supresor se observa sólo en el incremento de su latencia, por lo que su proporción permanece inalterada36. La mitarzapina, a dosis de 30 mg, administrada por la noche en voluntarios sanos produjo una reducción en la latencia de sueño REM, pero no alteró su proporción37.
La nefazodona y la trazodona son AD que presentan un mecanismo de acción similar, que tienen como acción farmacológica más potente un antagonismo de los receptores serotoninérgicos 5HT2A, aunque también inhiben la recaptación de serotonina (pero con potencia muy inferior en relación con los ADT o los ISRS). La nefazodona, además, presenta una débil acción inhibidora de la recaptación de noradrenalina y de bloqueo α1, mientras que la trazodona también bloquea los receptores α1 e histamínicos, pero no inhibe la recaptación de noradrenalina4. Los estudios realizados con nefazodona, tanto en voluntarios sanos como en pacientes, han mostrado que no presenta efecto supresor sobre el sueño REM: la nefazodona o no altera las variables de sueño REM38,39 o actúa potenciándolos40,41. Vogel et al42 realizaron una revisión de los trabajos efectuados y observaron dificultades metodológicas. En algunos de estos estudios no se realizó control con placebo, tampoco se controló el tiempo durante el que el sujeto estaba en cama o no se valoró la proporción de sueño REM en condiciones basales (pretratamiento). Con el fin de aclarar el sorprendente efecto no supresor de REM de un fármaco que, por otra parte, se supone produce inhibición de la recaptación serotonina, estos autores plantearon un estudio controlando esas variables en sujetos sanos, durante 16 noches. Las conclusiones fueron que la nefazodona no modificaba ninguno de los componentes de sueño REM: tanto los tónicos (latencia, proporción, número de fases) como los fásicos (intensidad REM). Así, parece que, sean cuales fuesen las discordancias entre estudios, este AD no alteraría el sueño REM. Los estudios realizados con trazodona presentan resultados no coincidentes en relación con los efectos sobre el sueño REM. En voluntarios sanos se ha descrito tanto que trazodona no conlleva alteraciones en el sueño REM43 como que presenta un moderado efecto REM supresor41. Los estudios practicados con pacientes deprimidos han demostrado que, generalmente, la trazodona provoca un alargamiento de la latencia REM, sin alterar su proporción44,45. No obstante, Van Bemmel et al46 observaron que la trazodona provocaba tanto un alargamiento de la latencia REM como una disminución de su proporción. Diferencias en relación con la dosis empleada podrían explicar estas discrepancias, aunque lo que parece unánimemente reconocido es que el efecto supresor de la trazodona es menor al observado con otros AD.
Si bien se puede afirmar que la mayoría de AD provoca un efecto supresor sobre el sueño REM, en la actualidad el mecanismo responsable de este efecto no está esclarecido. Durante tiempo se asumió la denominada hipótesis de interacción recíproca, como fundamento neurobiológico del sueño REM47 en la que los fármacos colinérgicos potenciaban el sueño REM y los aminérgicos, como los inhibidores de la recaptación de serotonina y/o noradrenalina, lo suprimían. Los ADT con actividad anticolinérgica sería esperable presentaran mayor efecto supresor del sueño REM. El papel clásicamente atribuido al sistema serotoninérgico consitía en considerar que, durante el sueño REM, las neuronas del núcleo dosal del rafe (el principal núcleo serotoninérgico del cerebro) estaban silentes, mientras que, durante la vigila y/o durante el sueño de ondas lentas, las neuronas serotoninérgicas activas inhibían los centros generadores del sueño REM. Sin embargo, los efectos observados sobre el sueño REM tras la nefazodona, por ejemplo, han supuesto un claro desafío a los mecanismos explicativos tradicionalmente utilizados. Los resultados tras la administración de nefazodona, que mostraron no sólo que el sueño REM no se modificaba sino que incluso aumentaba, son difíciles de encajar, al considerar sus principales mecanismos de acción sobre la neurotransmisión serotoninérgica: inhibición de la recaptación conjuntamente con un bloqueo de los receptores 5HT2A/2C. Los antagonistas selectivos 5HT2A/2C también disminuyen el sueño REM48,49. La asociación de la inhibición de la recaptación con el boqueo postsináptico podría incrementar todavía más, si cabe, la disponibilidad de la serotonina para su interacción con los receptores presinápticos 5HT1a, inhibidores de la actividad serotoninérgica y, por tanto, eventuales facilitadores del sueño REM. Sin embargo, los efectos observados tras agonistas parciales 5HT1a, como la buspirona50 y la ipsapirona51 no sugieren un papel excesivamente relevante de este subtipo de receptores en la regulación del sueño REM. Así, a pesar de estar ampliamente reconocido el buen conocimiento de que se dispone sobre la acción de los AD en el sueño REM, se necesitan nuevos estudios que permitan dilucidar aspectos aún no aclarados. En la tabla 2 se resumen los efectos descritos de los antidepresivos sobre el sueño REM.
EFECTOS DE LOS ANTIDEPRESIVOS SOBRE EL SUEÑO DE ONDAS LENTAS
La mayoría de estudios realizados en pacientes deprimidos han mostrado un déficit en el sueño de ondas lentas (SOL). Esta disminución no puede explicarse por una mayor fragmentación del sueño, típica de la depresión, puesto que no se han observado correlaciones entre esas 2 variables. También se han detectado alteraciones en la distribución del SOL durante la noche, de modo que este decremento se localiza, sobre todo, durante la primera fase de sueño no REM. La proporción del SOL es una variable importante, puesto que se ha relacionado con la acción restauradora del sueño1.
Los efectos de los AD sobre el sueño SOL distan mucho de estar inequívocamente definidos, y los estudios realizados han mostrado resultados discordantes. Los AD pueden incrementar, disminuir o no alterar la proporción de SOL. Posiblemente esta disparidad de efectos está relacionada con el método utilizado en la evaluación de los registros PSG. En general, los estudios basados en una evaluación computarizada (análisis espectral) han detectado alteraciones en SOL que, por otro lado, son difícilmente apreciables cuando la evaluación efectuada es visual (análisis tradicional, según las reglas de Rechtschaffen y Kales). Además, estas discrepancias también podrían ser el resultado de la diferente acción farmacológica de los distintos AD. Por otra parte, es difícil precisar si los efectos observados en el SOL con los AD son el resultado directo de su acción o bien están relacionados con la mejoría clínica del paciente. Teniendo en cuenta que se dispone de mucha menos información de los efectos sobre el SOL que de los que se producen sobre el sueño REM, sólo se comentarán aquellos estudios en los que el tratamiento AD haya provocado algún efecto sobre el denominado sueño delta.
En relación con los ADT, se han observado incrementos en la proporción de SOL tras la administración de amitriptilina en pacientes deprimidos. Staner et al29 demostraron un incremento del porcentaje de estadio 3 tras la administración aguda de amitriptilina, que disminuía con la toma continuada. Otros autores observaron un incremento en la proporción de sueño delta, que se concentraba en la primera parte de la noche6. Mendlewicz et al17, en cambio, en un estudio realizado con pacientes deprimidos, no observaron alteraciones significativas en el sueño delta tras la administración continuada de amitriptilina, durante 35-46 días. En estudios realizados con imipramina también observaron alteraciones en el SOL. Así, Jarrett et al52 observaron, en un estudio con pacientes deprimidos, que la administración aguda de 50 mg imipramina provocaba un incremento en la proporción de SOL, que era más evidente en la primera parte de la noche. Kupfer et al16 evaluaron el efecto que la administración crónica de imipramina (3 años) provocaba en el sueño de pacientes deprimidos, y observaron que, a pesar de no provocar un incremento en la proporción total de sueño delta, existía un desplazamiento de éste hacia el primer período no REM, "normalizando" así el patrón del SOL. Este efecto persistió durante todo el período de tratamiento. En otros estudios llevados a cabo con otros ADT no se han observado modificaciones en el SOL6,10.
La mayoría de estudios en voluntarios sanos no han detectado alteraciones en el SOL tras la administración de ISRS10. En relación con pacientes deprimidos, la fluvoxamina no provocó alteraciones en la proporción de SOL tras su administración continuada durante 4 semanas12. Tampoco se observaron alteraciones en el sueño delta en estudios practicados con paroxetina29,53 o citalopram30 ni en los llevados a cabo con sertralina31. La fluoxetina merece una consideración particular. Así, varios estudios coinciden en que su administración provoca una disminución del SOL54-57, aunque también existen estudios en que no se han observado estas alteraciones58-60. Adicionalmente, tras la administración de fluoxetina, se evidencian alteraciones significativas en los movimientos oculares y en la actividad motora durante el sueño no REM54,55,60. Estas anormalidades se han relacionado con la potenciación de neuronas serotoninérgicas, que actuarían inhibiendo el tronco cerebral, que a su vez inhibe los movimientos sacádicos de los ojos, lo que conlleva la desinhibición de estos movimientos sacádicos oculares. Además, se ha observado que estas alteraciones se acompañan de aumento del tono muscular61. Este efecto no se ha observado en voluntarios sanos11, y se ha hipotetizado que tal efecto podría verse potenciado por la presencia de enfermedad psiquiátrica, o bien que podría ser el resultado de la administración del fármaco durante períodos prolongados.
Tormey et al35, evaluando la administración de mianserina en voluntarios sanos, concluyeron que producía un incremento en la proporción de SOL, resultado que no se replicó cuando el AD se administró a pacientes deprimidos36. La nefazodona parece no alterar el sueño delta40, mientras que la trazodona se ha relacionado con incrementos en la proporción de SOL, tanto en voluntarios sanos43,62 como en pacientes deprimidos44,45. Sin embargo, este efecto no se observó en el estudio realizado por Van Bemmel et al46, aunque en este caso las dosis administradas fueron menores que en el resto de estudios.
En conclusión, los efectos que los AD provocan en el sueño delta distan mucho de estar plenamente establecidos, y se requieren nuevos estudios que faciliten la interpretación de los resultados hasta ahora obtenidos. El mecanismo por el que ciertos AD modifican el SOL también es incierto, y no hay evidencias de que el sistema noradrenérgico desempeñe un papel significativo en la regulación del SOL. Tampoco puede decirse que el aumento de sueño profundo sea el resultado de los efectos sedativos del fármaco, puesto que los antihistamínicos H1 y las benzodiazepinas no conllevan incrementos en el SOL. En cambio, varios estudios indican que el sistema 5HT2A/2C podría ser importante en el mecanismo regulador del sueño delta. La ritanserina, un antagonista de estos receptores, provoca incrementos en la proporción de SOL tanto en voluntarios sanos63 como en pacientes64. Asimismo, hay evidencias de que ciertos fármacos AD (en particular, la mianserina, la trazodona y algunos ADT) son antagonistas significativos en estos receptores, mientras que, contrariamente, los ISRS y los IMAO no presentan esta actividad. La excepción sería la fluoxetina que, además de su actividad como ISRS, exhibe cierta afinidad sobre el sistema 5HT2C como agonista10, y se ha argumentado esta característica para explicar su particular efecto supresor sobre el SOL. En la tabla 3 se exponen los efectos observados en el SOL tras la administración de los AD.
EFECTOS DE LOS ANTIDEPRESIVOS SOBRE LA CONTINUIDAD DEL SUEÑO
Como se ha comentado anteriormente, el sueño del paciente deprimido se caracteriza generalmente por un escaso efecto restaurador y una baja eficiencia. Es, pues, importante el conocer los efectos de los AD sobre la continuidad del sueño, puesto que incluso puede llegar a condicionar la opción terapéutica que elegir. No obstante, estos efectos no parecen relacionados con la actividad antidepresiva del fármaco.
Los ADT tradicionalmente se han diferenciado en aquellos que provocan sedación importante (amitriptilina, trimipramina, clomipramina), moderada (nortriptilina, imipramina, maprotilina) y baja (desipramina, protriptilina), efecto que se relaciona con su acción antagonista sobre los receptores α1, H1 y también colinérgicos65. Estudios efectuados con amitriptilina en pacientes deprimidos han demostrado un incremento significativo en la eficiencia de sueño tras su administración aguda, que se mantuvo durante todo el período de tratamiento29. Mendelwiz et al17, sin embargo, sólo observaron un descenso en el número de despertares durante la noche en un estudio practicado con amitriptilina en pacientes deprimidos durante un mes, y la calidad del sueño se mantuvo deficiente; los resultados se atribuyeron a la gran variabilidad interindividual de esas variables observada en condiciones basales (pretratamiento). La trimipramina se ha evidenciado como sedante, tanto en voluntarios sanos66 como en pacientes21. Estudios llevados a cabo con imipramina no han demostrado este efecto positivo sobre la continuidad del sueño en pacientes deprimidos. Kupfer et al16 no observaron cambios significativos en las variables relacionadas con la continuidad del sueño en pacientes deprimidos tras la administración crónica de imipramina durante 3 años. La desipramina tampoco presenta un claro efecto sedativo. Su administración en pacientes demostró que tan sólo provocaba un acortamiento de la latencia de sueño, mientras que el resto de las variables relacionadas con su continuidad permanecían inalteradas12. Otros estudios describen el efecto de disipramina como alertizante13.
Entre los AD que específicamente ejercen un efecto positivo en la continuidad de sueño, la trazodona merece una mención especial. Este AD se ha mostrado claramente como sedante, de modo que incluso se ha asociado a los ISRS con el fin de contrarrestar los efectos disruptores que estos últimos provocan en el sueño. La trazodona, en un estudio practicado con pacientes, provocó una mejoría en la eficiencia de sueño, un descenso del número de movimientos y un incremento en el tiempo total de sueño44. Este efecto fue similar al observado con pacientes deprimidos insomnes45. Sin embargo, estos efectos positivos sobre la continuidad de sueño fueron menos evidentes cuando los estudios se realizaron con voluntarios sanos41. La acción antagonista de la trazodona sobre los sistemas histaminérgico H1 y adrenérgico α1 podría explicar estos efectos consolidadores sobre el sueño. La nefazodona también muestra un efecto positivo sobre la continuidad de sueño en estudios llevados a cabo en pacientes. Armitage et al38 observaron que la nefazodona provocaba una disminución significativa en el número de despertares y en los movimientos, así como un incremento de la proporción de estadio 2, a expensas del estadio 1. Estos efectos también se observaron en pacientes deprimidos insomnes67. Además, en varios estudios, se compararó la nefazodona con la fluoxetina en pacientes deprimidos, y se evidenció que ambos AD provocaban unos efectos opuestos en relación con la continuidad del sueño: mientras que la fluoxetina ejercía un claro efecto disruptor, la nefazodona ejercía un efecto consolidador, con un decremento del número de despertares y de movimientos57. En cambio, estudios realizados en voluntarios sanos con nefazodona no evidencian alteraciones significativas en las variables relacionadas con la continuidad de sueño41. Vogel et al42, además, con el fin de evaluar los efectos de la nefazodona sobre el estado de alerta diurno, efectuaron tests de latencias múltiples de sueño, y sorprendentemente encontraron que este AD provocaba un incremento en la latencia del sueño con respecto al placebo en las diferentes evaluaciones realizadas. El mecanismo por el que la nefazodona provoca este efecto es desconocido, si bien a diferencia de trazodona sólo bloquea los receptores adrenérgicos α1 (no los histamínicos H1) y, además, posee una débil acción inhibidora de la recaptación de noradrenalina.
La mianserina y la mirtazapina también parecen presentar un efecto consolidador de la continuidad del sueño. La mianserina provocó un efecto positivo en relación con la eficiencia de sueño, en un estudio llevado a cabo en pacientes deprimidos, si bien no contó con un grupo control36. En este trabajo se postuló que este efecto estaba relacionado con la acción de este AD sobre el sistema adrenérgico (también es un antagonista α1) y, en menor medida, con su débil acción antagonista sobre los receptores histaminérgicos H1. Asimismo, la mitarzapina también provocó un efecto positivo en la continuidad del sueño en un estudio llevado a cabo en voluntarios sanos a bajas dosis, y redujo la latencia de sueño así como la proporción de estadio 137. Se sugirió que este efecto podría estar relacionado con las dosis bajas utilizadas en el estudio, que condicionarían que predominara su acción antagonista sobre el sistema histaminérgico H1.
Los ISRS y los IMAO, en general, conllevan un efecto negativo en la continuidad de sueño. Así, la fluoxetina ha mostrado un claro efecto "alertizante", dependiente de las dosis y del momento de la administración, que se ha observado tanto en voluntarios sanos25,27 como en pacientes deprimidos57-60, aunque presentó características diferentes: en voluntarios sanos, los efectos sobre la continuidad del sueño (principalmente un incremento de la latencia de sueño y de la proporción de estadio 1) disminuían con la administración continuada, mientras que los efectos sobre la arquitectura del sueño permanecían; contrariamente, en pacientes deprimidos, los efectos sobre la continuidad del sueño persistían, aunque atenuados. La paroxetina también ha mostrado un efecto disruptor del sueño, tanto en voluntarios sanos26,39,68 como en pacientes deprimidos29,69 que, al igual que la fluoxetina, depende de la dosis y del momento de la administración. Los otros ISRS (el citalopram, la fluvoxamina y la sertralina) también producen un efecto alertizante, objetivado en estudios efectuados en pacientes deprimidos11. Cuando el fármaco utilizado es un IMAO, una de las quejas más frecuentemente descritas es el insomnio. Sin embargo, mientras que la fenelzina provocó un descenso en el tiempo total de sueño en pacientes deprimidos10, la moclobemida pareció que mejoraba la continuidad del sueño, si bien este aspecto coincidió con la mejoría clínica de los pacientes70.
En conclusión, los efectos sobre la continuidad de sueño suelen ser positivos en el caso de ciertos ADT, la trazodona o la mianserina, mientras que los ISRS o los IMAO presentan un efecto alertizante. Una variada gama de acciones farmacológicas puede estar en el origen de la sedación, como los ya mencionados antagonismos en los receptores adrenérgicos α1 o histaminérgicos H1. Sin embargo, estas mejorías en la continuidad del sueño parece que no sólo se relacionarían con la sedación: como ya se ha comentado, la nefazodona, a pesar de que no provoca sedación en voluntarios sanos, mejora la continuidad de sueño. Así, otras acciones farmacológicas parece que podrían estar implicadas en los mecanismos que consolidan el sueño nocturno: el antagonismo en los receptores 5HT2A/2C podría desempeñar un importante papel en esta acción. Estudios realizados con ritanserina (antagonista 5HT2A/2C) mostraron un efecto positivo en la continuidad del sueño en voluntarios sanos y en pacientes insomnes; en cambio, el agonista mCPP (meta-clorofenilpiperazina) provocó un incremento de los despertares y una reducción de la eficiencia del sueño10. El efecto beneficioso sobre la continuidad del sueño de AD, como la amitriptilina, la trazodona, la nefazodona, la mianserina o la mirtazapina, podría deberse no sólo a su acción sedante (a través del bloqueo de receptores adrenérgicos α1 e histamínicos H1), sino también a su capacidad para bloquear los receptores 5HT2A/2C. Por el contrario, la activación de este sistema de receptores podría estar relacionado con el efecto alertizante observado con los ISRS y los IMAO. Los efectos observados en la continuidad del sueño tras la administración de AD se presentan en la tabla 4.
EFECTOS DE LOS ANTIDEPRESIVOS SOBRE LA MICROESTRUCTURA DEL SUEÑO
Como ya se ha comentado, los efectos de los AD sobre el sueño se han evaluado ampliamente, aunque en la mayoría de las ocasiones las evaluaciones se han basado en los cambios que estos fármacos provocan en la macroestructura del sueño (variables relacionadas con la continuidad del sueño y su arquitectura, que valoran solamente la proporción que un estadio representa sobre el total de la noche). Algunos de los efectos observados son inconsistentes, sobre todo los relacionados con el sueño de ondas lentas.
Está claramente establecida la limitación que supone la utilización únicamente del análisis visual tradicional, cuando el objetivo del estudio es la determinación de los efectos que un fármaco produce sobre el sueño71. Además, se ha descrito ampliamente el efecto que la administración de los distintos AD produce en el electroencefalograma (EEG) de vigilia72. Ante ello, la determinación de los efectos farmacológicos sobre el sueño, solamente basándose en los cambios en la duración de determinados estadios, se evidencia como insuficiente para efectuar un estudio preciso de esa interacción, y se ha enfatizado por diferentes autores la necesidad de potenciar los estudios basados en el análisis cuantitativo del EEG73.
Se han seleccionado algunos ejemplos en los que se puede constatar claramente la importancia que supone esta aproximación a la hora de profundizar en el conocimiento del sustrato neurobiológico que relaciona la depresión, el sueño y el efecto antidepresivo de un fármaco.
Van Bemmel73 evaluó la relación existente entre los cambios observados en el poder espectral del EEG durante el sueño producido por 2 antidepresivos (trazodona y citalopram) y los cambios observados en la sintomatología depresiva de los pacientes. Este autor evidenció que, tras 5 semanas de tratamiento, la trazodona provocaba un decremento significativo del poder espectral de la banda de frecuencia comprendida entre los 13 y los 14 Hz, mientras que el citalopram lo provocaba en la banda comprendida entre los 8 y los 9 Hz, aunque no observó relación entre estos cambios y la respuesta antidepresiva a los fármacos. Se concluyó, así, que los fármacos AD eran capaces de provocar diferentes alteraciones en el poder espectral del EEG, seguramente debidas a diferencias en cuanto a su actividad farmacológica, y que eran necesarios nuevos estudios para interpretar el modo en que los AD producían esos cambios en la microestructura del sueño.
Roschke et al68 evaluaron los efectos que la administración de 30 mg de paroxetina durante 4 semanas en voluntarios sanos provocaba en la microestructura de sueño, mediante análisis espectral. Observaron que esta intervención no provocaba alteraciones en el poder espectral de toda la noche, si bien existía un incremento significativo de la correlación entre las bandas de frecuencia delta y alfa, que era positiva durante el sueño REM y negativa durante el no REM. Se hipotetizó que este efecto estaba relacionado con la acción antidepresiva del fármaco, ya que normalizaba la menor correlación entre estas bandas observada en pacientes deprimidos sin tratamiento.
Kupfer et al16 también evaluaron los efectos que sobre la microestructura del sueño provocaba la administración continuada de un AD, en este caso la imipramina. Estos autores observaron un incremento del poder espectral en la banda de frecuencias beta y un descenso del poder espectral en las bandas de baja frecuencia (delta y teta), tanto durante el sueño REM como el no REM, que se mantuvieron durante los 3 años del estudio. La disminución de la intensidad delta obtenida en este estudio contrasta con la hipótesis que mantiene que la fisiopatología de la depresión está íntimamente relacionada con una disminución en el denominado proceso homeostático regulador S (propensión al sueño delta, que se incrementa a lo largo de la vigilia y disminuye durante la noche)74, con lo que sería esperable observar un incremento del poder espectral en la banda delta tras la administración del AD. El efecto observado podría estar relacionado con la toma crónica del fármaco y no con su actividad antidepresiva. Asimismo, basándose en estudios que relacionan el poder de las bandas rápidas (beta) con el grado de alertización durante el sueño75, los autores relacionaron el incremento del poder espectral observado en ese grado con un elevado estado de "hipervigilancia" durante el sueño, en pacientes deprimidos en fase de recuperación bajo tratamiento con AD.
EFECTOS DE LOS ANTIDEPRESIVOS SOBRE LAS ENSOÑACIONES
Dada la íntima relación establecida entre el sueño REM y las ensoñaciones76,77 es predecible que fármacos con importantes efectos sobre el sueño REM conlleven modificaciones en la producción de ensoñaciones. Aun así, los estudios destinados a evaluar estos efectos son muy pocos.
Uno de los aspectos más ampliamente descritos en relación con las acciones de los AD sobre las ensoñaciones es su intensificación tras la supresión del tratamiento AD, y se ha relacionado con la intensificación del sueño REM que acontece en esa situación. Este fenómeno se ha observado tanto con ADT como con ISRS78,79.
El efecto de los AD sobre las ensoñaciones mientras se realiza el tratamiento ha sido mucho menos descrito, y preferentemente se ha evaluado el efecto observado con ISRS. Se han referido incrementos relativos de las ensoñacionhes durante el tratamiento con fluoxetina80-84 y citalopram85, así como alteraciones en el contenido onírico con la administración de sertralina86. Sin embargo, estos resultados no son fáciles de explicar si se tiene en cuenta el efecto bloqueante ejercido por esos fármacos sobre el sueño REM. Así, pueden identificarse varios factores de confusión que complican la interpretación de los resultados cuando se examina el efecto de los AD sobre las ensoñaciones en sujetos deprimidos: a) aunque la depresión se asocia típicamente con una reducción de la latencia de sueño REM y un incremento de la intensidad de los movimientos oculares, también se ha asociado con una disminución en el recuerdo de ensoñaciones en sujetos sanos87, y b) tratamientos antidepresivos eficaces se han asociado con ligeras reducciones adicionales en el recuerdo de ensoñaciones en relación con los valores pretratamiento80,87, excepto en el caso de la fluoxetina80. De esta forma, el efecto neto de los AD sobre las ensoñaciones en sujetos deprimidos reflejaría el resultado integrado de la supresión de ensoñaciones relacionada con la depresion, la posible recuperación de ensoñaciones relacionada con la mejoría, el incremento de REM relacionado con la depresión y la supresión de REM relacionada con el tratamiento.
Una posibilidad de controlar estos factores de confusión estriba en la realización de estudios con voluntarios sanos. Pace-Schott et al88 examinaron las ensoñaciones en 14 sujetos sanos según un diseño en paralelo y con evaluaciones en casa: 7 días pretratamiento, 10 días con 100 mg de fluvoxamina o 20 mg de paroxetina en dosis divididas (manaña y noche) y 5 días tras la interrupción brusca. Sus principales resultados durante la fase de tratamiento consistieron en una disminución en la frecuencia de la descripción de ensoñaciones, un incremento en su intensidad subjetiva y una disminución del sueño REM, con relación al período pretratamiento, tras ambos fármacos. Además, observaron que las ensoñaciones descritas, tras la supresión aguda de ambos fármacos también presentaban mayor intensidad subjetiva y había una intensificación del sueño REM, en relación con el pretratamiento. Sin embargo, sólo cuando se interrumpió la administración de fluvoxamina se obtuvieron ensoñaciones más extravagantes y de mayor "tamaño" (valorado por el recuento de palabras usadas en el reporte de la ensoñación) que las reportadas antes del tratamiento. Lorenzo et al89 también examinaron las ensoñaciones en sujetos sanos, 22 en este estudio, según un diseño cruzado, controlado con placebo y con evaluaciones en el laboratorio durante 15 días de administración de 20 mg paroxetina en monodosis matutina. Los cambios más relevantes tras el AD fueron un incremento del número de sueños reportados por noche (no del número de noches que los sujetos reportaban haber soñado) y un distinto patrón en el contenido onírico (contenidos más claros y familiares, relacionados con mayor frecuencia con parientes y, con menor frecuencia, amigos).
Parece fuera de toda duda que los AD pueden ocasionar modificaciones en las ensoñaciones; sin embargo, la naturaleza exacta de esos cambios dista mucho de estar claramente establecida, así como la posible implicación de los distintos elementos característicos de la fisiología del sueño (sueño REM, grado de activación cortical). Los estudios son especialmente escasos y con metodologías de difícil comparación: distintas estrategias de evaluación (cuestionario autoevaluación [propio individio], cuestionario heteroevaluado [evaluadores tras reporte grabado]) y/o distintos instrumentos de evaluación con distitintas variables derivadas cuyas definiciones, que pretenden abarcar distintos aspectos (frecuencia, intensidad, contenido), no están estandarizadas. Además, no hay estrategias que permitan diferenciar si los efectos observados son el resultado de cambios en los mecanismos de producción (origen) o de rememoración (elaboración). Es necesario desarrollar nuevos estudios destinados a evaluar estos efectos, puesto que permitirán alcanzar un mayor conocimiento de la neurobiología de las ensoñaciones y de su relación con el sueño REM.
CONCLUSIONES
Los diferentes AD provocan efectos evidentes sobre la estructura de sueño, aunque de distinta manera e intensidad. Su diferente interacción con los distintos sistemas de neurotransmisión que actúan tanto en la regulación del sueño como en la fisiopatología de la depresión es en gran parte la responsable de la diversidad de efectos observados. También es importante a la hora de evaluar los efectos el conocimiento del perfil farmacocinético-farmacodinámico de los compuestos, que ayudará a comprender los efectos dependientes de la dosis y el curso temporal de ciertos AD. Además, recientemente investigaciones en farmacogenética han permitido reconocer la importancia del factor genético en la variabilidad farmacodinámica de los AD; así, por ejemplo, estudios preliminares han detectado diferentes fenotipos de receptores serotoninérgicos y dopaminérgicos que podrían condicionar cierto grado de variabilidad en los efectos observados. Finalmente, ciertas limitaciones metodológicas observadas en los estudios efectuados (diferencias en cuanto a dosis, pauta de administración, pobre caracterización de los sujetos, ausencia de intervención control, tipo de análisis utilizado) podrían estar, asimismo, condicionando parte de las inconsistencias encontradas. Son necesarios, pues, estudios comparativos de AD con similares efectos terapéuticos, pero con distinto perfil farmacológico, tanto en voluntarios sanos como en pacientes deprimidos, tras administración única y repetida.
La supresión del sueño REM se ha demostrado como el efecto más consistentemente observado y el que más claramente se ha relacionado con el efecto antidepresivo del fármaco, si bien la existencia de AD que no sólo no alteran el sueño REM, sino que lo incrementan ha obligado a replantearse el modo en que depresión, sueño REM y actividad antidepresiva están relacionados. Los efectos sobre el sueño de ondas lentas plantean aún más controversias que deberían ser solucionadas con nuevos estudios en los que se utilizasen métodos de análisis computarizados más sensibles que los métodos basados en el tradicional análisis visual. Por otra parte, la mayoría de los AD conlleva alteraciones en la continuidad del sueño, que dependen, sobre todo, de sus acciones sobre los sistemas histaminérgicos, adrenérgicos y colinérgicos, aunque parece que la acción sobre el sistema 5HT2A/2C podría desempenar un papel importante. La evaluación de los efectos de los AD sobre la microestructura del sueño es todavía escasa y sería necesaria su potenciación con el fin de ayudar a identificar e interpretar los efectos observados. También son muy escasos los estudios destinados a evaluar los efectos de los AD sobre las ensoñaciones, aunque teniendo en cuenta las acciones que los AD producen en el sueño REM, y la íntima relación de éste con las ensoñaciones, es predecible que tales estudios podrían permitir profundizar en el conocimiento, aún limitado, de la neurobiología de los ensueños.
En resumen, considerando los recientes y rápidos avances en el conocimiento de la fisiología del sueño y la creciente disponibilidad de fármacos con diferentes acciones farmacológicas, es esperable que, incrementando este tipo de estudios, se pudieran desarrollar hipótesis más consistentes que fueran capaces de explicar la íntima relación existente entre sueño y depresión.
Correo electrónico: mbarbanoj@hsp.santpau.es