Una vez que las vacunas COVID-19 producidas en plataformas de ARN mensajero o de vectores de adenovirus estuvieron disponibles, la incidencia de infecciones por SARS-CoV-2 y, especialmente, las hospitalizaciones en la población altamente vulnerable empezaron a disminuir. Las estrategias de vacunación en España se consensuaron en el Ministerio de Sanidad entre un grupo de profesionales de muy diferentes ámbitos, y fueron ampliamente aceptadas por la población.
Once COVID-19 vaccines produced on messenger RNA or adenovirus vector platforms became available, the incidence of SARS-CoV-2 infections, particularly hospitalizations among the highly vulnerable population, began to decline. The vaccination strategies in Spain were agreed upon within the Ministry of Health among a group of professionals from various fields and were widely accepted by the population.
Son ya 5 años los transcurridos desde que se reportó un importante número de casos de neumonía en la provincia china de Wuhan, lo que motivó que semanas más tarde, el 11 de marzo de 2020, la Organización Mundial de la Salud declarara el comienzo de una pandemia causada por el β-coronavirus SARS-CoV-2. El virus nunca se había reportado con anterioridad, y tampoco antes había circulado entre los humanos.
El virus se caracteriza por tener 4 proteínas estructurales: la proteína S, como antígeno inmunodominante inductor de anticuerpos de unión y neutralizantes, la proteína de la nucleocápside, la proteína de cubierta E y la proteína M de membrana. El virus se une al receptor ACE2 (enzima convertidora de la angiotensina) de las células del huésped para penetrar en ellas e inducir las graves manifestaciones de la enfermedad.
Hasta la fecha, son varias las teorías acerca del origen del virus, aunque la más aceptada es que el ancestro común del SARS-CoV-2 está ligado al mercado chino Huanan Seafood Wholesale Market, habiéndose detectado ADN de mamíferos salvajes en muestras medioambientales positivas al SARS-CoV-21.
Desde el mismo momento en el que se tuvo conciencia de la gravedad de la situación, la industria farmacéutica mundial inició una carrera que culminó en diciembre de 2020 con la publicación de los resultados de seguridad, inmunogenicidad y eficacia de las vacunas de plataforma de ARN mensajero. Más adelante, se presentaron resultados igual de alentadores para las vacunas producidas en plataformas de adenovirus. Los investigadores se marcaron como objetivo que las vacunas deberían reunir unas características básicas: producción de anticuerpos neutralizantes, generación de respuestas de células T y evitación de la enfermedad potenciada por la vacuna (immune-enhanced disease)2. Las autoridades regulatorias exigían, además, que para poder ser utilizadas en campañas masivas de vacunación deberían tener como mínimo una eficacia del 50%3.
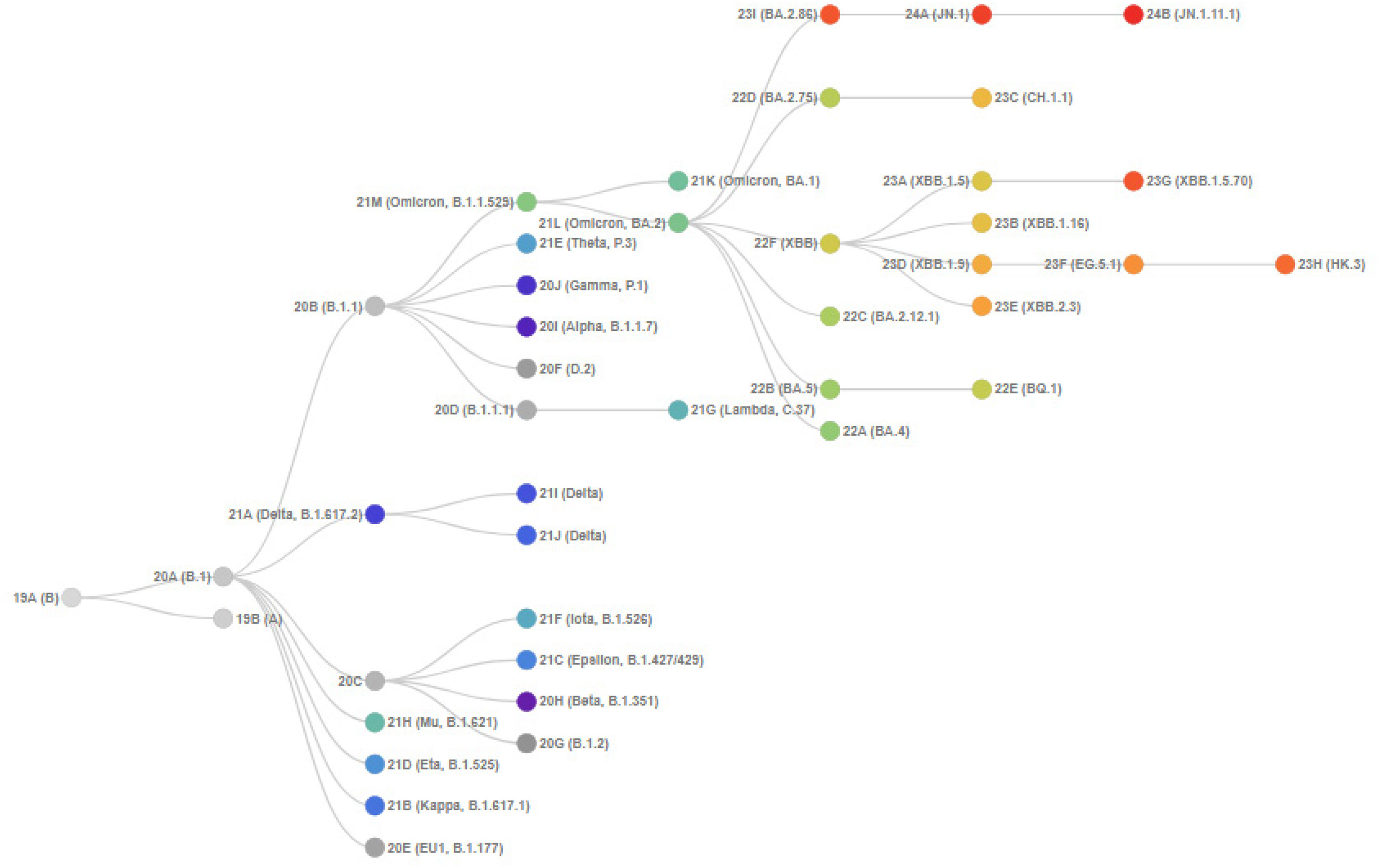
El devenir de la pandemia se ha caracterizado por la evolución continuada del virus, con la subsiguiente aparición de variantes con mayor o menor parecido con sus ancestros y por la inmunidad menguante, tanto tras el padecimiento de COVID-19 como tras la vacunación. A los pocos meses de la irrupción de la cepa original de SARS-CoV-2, comenzaron a circular las «variantes de preocupación» (Variants of Concern, VOC): alfa (B.1.1.7), beta (B.1.351), gamma (P.1) y delta (B.1.617.2). La última saga de variantes ha venido dada por la aparición de Ómicron BA.1 en noviembre de 2021, seguida de las subvariantes BA.4 y BA.5, con características patológicas, genéticas y antigénicas claramente distinguibles de las variantes previas. Con posterioridad, aparecieron las subvariantes XBB, EG.5 y BA.2.86 y, últimamente, JN.1, KP.2, KP.3, KP.2.3, KP.3.1.1, XEC y LP.8.14–6 (fig. 1). Con el objeto de mantener la protección clínica, especialmente en las personas vulnerables, se ha hecho necesario administrar dosis de recuerdo con vacunas adaptadas a la variante circulante. A este respecto, hay que reseñar el enorme esfuerzo de la industria farmacéutica para poner a disposición de la población y, en tiempo récord, esas vacunas.
Evolución de las Clados de SARS-CoV-27.
En la evolución de la pandemia, ha ido creciendo entre la población general un fenómeno de desapego hacia la aceptación de la vacunación, que ha dificultado los esfuerzos para controlar la pandemia. Entre los motivos que podrían explicar esta situación se encontraría el desarrollo acelerado de las vacunas, la diseminación de información falsa, la desinformación, la llamada «fatiga pandémica» por la vacunación repetida, y la preocupación sobre los muy infrecuentes efectos adversos graves posvacunales8.
Papel de las vacunas en el control de la pandemiaEl desarrollo de las vacunas frente al SARS-CoV-2 se ha caracterizado fundamentalmente por su rapidez (pandemic speed)9. Un gran pacto entre las agencias regulatorias, los gobiernos, la academia, la industria y la Organización Mundial de la Salud, entre otros, consiguió modificar el paradigma clásico que pasaba por transitar por las fases preclínicas y clínicas de una manera escalonada. Con una novedosa aproximación, se aprovechó la experiencia adquirida con SARS-CoV-1 y MERS para los pasos preclínicos (papel de la proteína S y de los anticuerpos neutralizantes), se solaparon las fases clínicas ejecutándolas en paralelo, se fabricaron vacunas prototipo a «riesgo» y se puso en marcha la evaluación continuada de los resultados provisionales de inmunogenicidad y seguridad (rolling review) por parte del regulatorio. Adicionalmente, la evolución del conocimiento de las plataformas de ácidos nucleicos y de adenovirus también contribuyó al rápido desarrollo de vacunas COVID-1910. Con esta estrategia, se consiguió comprimir el tiempo total de fabricación de una vacuna, de manera que solo transcurrieron 6 meses desde la secuenciación del virus hasta completar la fase I del ensayo clínico11, lo que contrasta con los 3 a 9 años que se precisan de promedio para disponer de las vacunas habituales12.
Para agosto de 2020 se disponía de 30 vacunas en distintas fases de ensayos clínicos: 5 vacunas inactivadas, 8 de subunidades proteicas, 5 de vectores víricos no replicantes, una de vectores víricos replicantes, 4 de ADN, 6 de ARN mensajero y una de virus-like particle (VLP)13.
El 10 de diciembre de 2020 se publicaron los resultados provisionales de seguridad, inmunogenicidad y eficacia de la vacuna BNT162b214, y un día más tarde, las farmacéuticas BioNTech/Pfizer presentaron al Advisory Committee on Immunization Practices (ACIP) de los Estados Unidos esos resultados15, y el 19 del mismo mes, siguió sus pasos la farmacéutica Moderna16. Un punto crucial e inesperado reportado fue la protección encontrada (superior al 95%) frente a la enfermedad por SARS-CoV-2 en personas mayores, con o sin factores de riesgo, que eran en las que el impacto de la pandemia era mayor.
Los primeros resultados publicados de la eficacia provisional frente a la enfermedad grave en mayores de 65 años, en distintas revisiones, para las plataformas proteicas y de vectores víricos no replicantes, fueron extraordinariamente positivos, superando el 85%2. En cuanto a la efectividad de las plataformas de ARN mensajero para evitar infecciones o enfermedad grave, esta llegó al 85,5 y 91,5%, respectivamente17. En España, el Grupo de Trabajo de Efectividad Vacunación COVID-19 emitió informes periódicos sobre la efectividad de la vacunación. Con fecha de 22 de mayo de 2022, el correspondiente informe recogía una efectividad frente a hospitalizaciones y fallecimientos para personas de 80 o más años del 91,0 y 92,5%, respectivamente, después de haber recibido la segunda dosis de vacuna de ARN mensajero18.
Como se exponía anteriormente, las vacunas aparecidas a finales de 2020 inducían una importante protección frente a las variantes que iban apareciendo en los meses siguientes, pero la llegada de la variante Ómicron cambió por completo el panorama, al tratarse de cepas con una gran distancia antigénica respecto de sus predecesoras, y que, por consiguiente, eran capaces de evadir las respuestas humorales y celulares posvacunales.
En cuanto al perfil de seguridad de las vacunas originales y adaptadas frente a COVID-19, ha quedado y está bien establecida la misma mediante los ensayos clínicos y los estudios de vigilancia poscomercialización. Sí hay que destacar, como efectos adversos graves, los cuadros de miocarditis con/sin pericarditis en individuos jóvenes tras la vacunación con ARN mensajero, especialmente tras la segunda dosis, y que aparecen con una frecuencia inferior a 1 por 10.000 personas19, así como los fenómenos tromboembólicos con/sin trombocitopenia (Vaccine-induced immune thrombotic thrombocytopenia [VITT]) con estimaciones de incidencia de 3,2–16,1 casos por millón y 1,7–3,7 casos por millón para Vaxzevria y JCOVDEN, respectivamente20, y el síndrome de Guillain-Barré, asociado a vacunas de vectores de adenovirus no replicantes21.
Estrategias de vacunación en EspañaEl 19 de septiembre de 2020, el Consejo Interterritorial del Sistema Nacional de Salud impulsó la creación de un grupo de trabajo técnico multidisciplinar que diseñara una estrategia de vacunación en España, que se publicó el 24 de noviembre22. La vacunación frente al nuevo coronavirus comenzó el 27 de diciembre en todas las comunidades autónomas. Las vacunas fueron llegando de manera progresiva, por lo que, desde el principio, se estableció un orden de prioridad para ir vacunando a la población en función del riesgo de enfermedad grave y del riesgo de exposición, fundamentalmente. Desde entonces, se han venido publicando periódicamente documentos con actualizaciones de las estrategias de uso de vacunas y antivíricos, e informes de farmacovigilancia.
Las distintas estrategias de vacunación abordaban aspectos técnicos y de seguridad acordes a la bibliografía que iba apareciendo en cada momento. La gran infodemia, la disponibilidad de un mayor número de plataformas de vacunación y sus características fueron, entre otras, las responsables de las actualizaciones, las cuales no siempre recibieron buenas críticas por parte de la población o del estamento sanitario.
Como consecuencia de los resultados de la fase III de los primeros ensayos clínicos, se planteó un esquema de vacunación de 2 dosis, separadas por 28 días, pero, debido a la escasez inicial de suministro de vacunas de ARN mensajero, proteicas y de adenovirus, su buena respuesta neutralizante tras la primera dosis, que garantizaba al menos cierta protección frente a las manifestaciones graves de COVID-19, y, también, siguiendo uno de los principios de la vacunología básica en relación al intervalo entre dosis (respuestas humorales y celulares más robustas al ampliar intervalos)23,24, se decidió que en ciertas situaciones podía ampliarse el intervalo entre dosis especificado en las correspondientes fichas técnicas.
Un fenómeno que alteró los esquemas iniciales de vacunación fueron las publicaciones procedentes de los Estados Unidos y del Reino Unido, que reflejaban las características de la respuesta inmune, acaecida por el padecimiento de la enfermedad y la exposición al antígeno vacunal, lo cual daba lugar a lo que se conoció como inmunidad híbrida25. La respuesta en los individuos con inmunidad natural y la inducida por la vacunación era de 25 a 100 veces mayor de la esperada para cada una de ellas individualmente, estando claramente en relación con las células B de memoria y las células T CD4+.Esa respuesta también se incrementaba en el caso de la protección frente a las variantes26,27. Este hecho, unido a la corta vida media de la protección tras la infección natural, sustentó la recomendación de vacunación en los que había padecido COVID-19, pero unos meses más tarde.
Otro acontecimiento que también modificó los esquemas de vacunación y que no fue suficientemente percibido de manera favorable por la población fue el del mix and match o esquemas heterólogos de vacunación28. Los problemas derivados de la seguridad de la vacuna de vector adenovírico AZD1222 abrieron la oportunidad de recibir vacunas de 2 plataformas diferentes, como primovacunación con esa vacuna y vacunas de ARN mensajero como dosis de recuerdo (fig. 2). Los estudios relativos a este esquema mostraron una inmunogenicidad potenciada respecto de los homólogos, tanto para el componente humoral como celular. La respuesta inmune tras la vacunación con pauta homóloga de adenovirus estaba limitada, ya que, a pesar de inducir una potente respuesta de células T, era menos efectiva que las vacunas de ARN mensajero a la hora de generar respuesta de anticuerpos. La estrategia mix and match conducía a la eliminación de las células infectadas por el virus, incluso en ausencia de anticuerpos séricos detectables, y potenciaba la respuesta humoral con producción de anticuerpos de unión y neutralizantes, incluyendo a las variantes del SARS-CoV-2. De nuestro país surgió una publicación relativa a la efectividad tras utilizar pautas homólogas o heterólogas, que sustentó con argumentos científicos la bondad de estos esquemas y la posibilidad de disponer de diferentes vacunas en las campañas masivas de vacunación29.
Respuesta inmune inducida por los esquemas heterólogos de vacunación28.
La entrada en escena de la variante Ómicron en el mes de noviembre de 2021, que parcialmente escapaba de la inmunidad inducida por las vacunas ancestrales30, junto a la constatación de una protección menguante a medida que transcurría el tiempo desde la vacunación31, volvió a modificar las políticas de inmunoprevención. Se implantaron campañas de vacunación dirigidas a población vulnerable, pero con vacunas adaptadas a las variantes que circulaban en ese momento entre la población (subvariantes BA.1, BA.2, BA.4, BA.5). De ahí surgió la vacuna bivalente, que combinaba la cepa ancestral de SARS-CoV D-614 y la subvariante BA.1 y BA.4/5, que fue autorizada para su uso por parte de la European Medicines Agency en septiembre de 202232, y que se utilizó en España en la campaña de vacunación de ese otoño. Pronto se constató cómo la respuesta inmune a las vacunas bivalentes se polarizaba hacia la cepa ancestral por el fenómeno conocido como impronta inmune (immune imprinting), lo que reducía la protección frente a las nuevas variantes, al estar las células de memoria preparadas (primed) para responder al primer patógeno con receptores de mayor afinidad33–36. Como consecuencia de esa polarización de la respuesta inmune, se decidió no volver a incluir en las vacunas antígenos de cepas que ya habían circulado previamente. Un elemento curioso es que las actuales dosis de recuerdo de vacunas Ómicron han mitigado, aparentemente, la impronta inmune hacia las variantes pre-Ómicron37.
Al seguir evolucionando la variante Ómicron, de manera que algunos autores ya apuntan a que no tiene sentido denominar así a las nuevas subvariantes, debido a las grandes diferencias con las cepas previas38, comenzaron a circular XBB, XBB-1.5/16 y EG.5 a principios de 2023, BA.2.86 a finales, posteriormente, y, surgida de la anterior, JN.1 en septiembre del mismo año, y sus descendientes, las variantes FLiRT KP.2, KP.1.1, KP.3 y, por último, las subvariantes XEC y LP.8.1 en el último trimestre de 2024 como un linaje recombinante de JN.13.1.1.1 y de JN.1.11.1.3.36,39. La European Medicines Agency y la Food and Drug Administration actualizaron, entre junio y septiembre 2024, sus recomendaciones de inmunización para otoño con vacunas adecuadas a las variantes circulantes JN.1 y KP.2. El fundamento de estas dosis de recuerdo con vacunas adaptadas es generar altos títulos de anticuerpos neutralizantes frente a las variantes circulantes para evitar infecciones sintomáticas, ingresos hospitalarios y fallecimientos en la población más vulnerable.
Dado que, hasta ahora, el virus infecta a lo largo de todo el año, y que el COVID-19 sí se puede considerar como estacional al ocurrir en cada estación38, y a la corta duración de la protección, algunos países occidentales han implantado una pauta de vacunación bianual en primavera y otoño.
Mortalidad, vacunas administradas e impacto de la vacunación en la salud públicaPara los primeros meses, desde el inicio de la pandemia, la Organización Mundial de la Salud reportó datos del impacto de la pandemia entre enero de 2020 y diciembre de 2021 para los fallecimientos por cualquier causa, estimando 14,83 (13,3–16,6) millones de exceso de muertes, lo que suponía 3 veces más de las 5,42 millones reportadas para ese periodo40. Para abril de 2024, el total de casos registrados de COVID-19 a escala mundial llegaban a 704.753.890, con 7.010.681 fallecimientos41 y 776.973.432 y 7,1 millones de casos y fallecimientos, respectivamente, para el 1 de diciembre de 202442. En nuestro país, y desde el inicio de la pandemia hasta julio de 2023, se habían notificado a RENAVE 122.057 defunciones43, aunque la cifra podría ser ligeramente superior44.
A finales de 2023, la Organización Mundial de la Salud publicó que en todo el mundo se habían administrado 13.640.000.000 dosis de vacunas frente a COVID-19, con un 67 y un 32% de la población mundial con una serie completa de vacunación recibida o con al menos una dosis de recuerdo, respectivamente45. En lo concerniente a España, desde el inicio de la vacunación en diciembre de 2020, el total acumulado de dosis administradas de cualquier tipo de vacuna ha ascendido a 105.872.140 dosis. En la temporada 2023-2024 y hasta abril de 2024, se habían administrado 1.869.338, 2.158.734 y 1.865.175 dosis de vacuna adaptada XBB.1.5 para los de 80 o más años, de 70 a 79 y de 60 a 69 años, respectivamente, que equivalen a unas coberturas del 65,26, 53,09 y 33,09%, respectivamente46.
Un documento del National Bureau of Economic Research de los Estados Unidos de Norteamérica, con datos recogidos entre marzo 2020 y agosto 2021, encontró que las campañas de vacunación en 141 países evitaron 2,4 millones de exceso de fallecimientos por cualquier causa, que hubieran ascendido a 3,03 millones si hubiera existido una distribución equitativa de vacunas a lo largo del globo47.
En el estudio retrospectivo de vigilancia WHO European Respiratory Surveillance Network se han publicado unas estimaciones sobre el número de vidas directamente salvadas por las vacunas, por grupos de edad, dosis y efectividad de las vacunas y por periodos de circulación de variantes en países, áreas y territorios (PAT) de la Región Europea de la Organización Mundial de la Salud. Entre diciembre de 2020 y marzo de 2023, en 34 de 54 PAT incluidos en el análisis, las vacunas redujeron las muertes, a escala global, en un 59% (17–82%), lo que representa, aproximadamente, 1,6 millones en los de 25 o más años de edad. El 96% de las vidas salvadas lo fueron en los de 60 o más años, y el 52% en los de 80 o más. La primera dosis de recuerdo salvó un 51% de vidas, y un 60% lo fueron en el periodo de circulación de la variante Ómicron48.
Por último, es importante considerar que la tendencia actual de la infección por SARS-CoV-2 sugiere que los riesgos para hospitalizaciones y fallecimientos vienen siendo inferiores a lo largo de la evolución de la pandemia, debido, probablemente, a la inmunidad natural, a la vacunación repetida y a los cambios intrínsecos del propio virus49.
Conclusiones y reflexionesFrente a algunas opiniones minoritarias, la vacunación, y, en menor medida, otras actuaciones de salud pública, ha jugado un papel capital en el control de la pandemia y, muy especialmente, en sus momentos más dramáticos. No obstante, nos encontramos actualmente en una situación bastante delicada. Hay una importante sensación de complacencia acerca de la necesidad de vacunarnos, una vez que ha desaparecido la urgencia en salud pública. Se palpa cierta confusión en relación con el nivel de riesgo de la infección por SARS-CoV-2, y no se asume, en general, que la vacunación debe ser una actividad rutinaria de promoción de salud. Por otra parte, la desconfianza en la vacunación por la desinformación y el escepticismo por su seguridad y efectividad son los responsables de las bajas coberturas de vacunación.
Hay que insistir en la necesidad de mantener la protección mediante la vacunación por varios motivos. Las vacunas adaptadas protegen a los adultos mayores y a los más vulnerables frente a una enfermedad grave, continúan mostrando un alto perfil de seguridad, el virus SARS-CoV-2 sigue evolucionando, y sigue siendo el responsable de ingresos hospitalarios y de fallecimientos. Sería deseable, por último, como señala el Profesor Stanley Plotkin50, potenciar otras estrategias de vacunación, ya que las actuales vacunas de ARN mensajero, aunque han supuesto un arma definitiva en el control de la pandemia, tienen algunas limitaciones derivadas, fundamentalmente, de la corta duración de la protección y de la escasa protección frente a infecciones de las mucosas.
FinanciaciónEl autor declara que no ha recibido financiación.
Conflicto de interesesEl autor declara que no tiene conflictos de intereses.