Determinados genotipos del virus del papiloma humano (VPH) son causa necesaria del cáncer de cuello de útero, y se relacionan con la etiología de una fracción de carcinomas anogenitales, y de cabeza y cuello. Actualmente, 12 tipos de VPH han sido clasificados como definitivamente cancerígenos por la Agencia Internacional de Investigación del Cáncer, de entre los cuales el VPH16 es el genotipo más carcinogénico. La clasificación carcinogénica de los VPH se basa en evidencias biológicas y en amplios estudios epidemiológicos realizados durante las últimas décadas, gracias a la estrecha colaboración entre científicos, que pretendía descubrir la etiología del cáncer de cuello de útero. Los VPH 16, 18, 31, 33, 35, 45, 52 y 58 son responsables de más del 90% de los cánceres de cuello de útero. Desde 2006, se han autorizado 3 vacunas profilácticas en Europa, que han demostrado ser seguras, inmunógenas, eficaces y efectivas. La demostración del VPH como causa necesaria del cáncer de cuello de útero también se ha traducido en el perfeccionamiento de las estrategias de cribado, como la introducción de la prueba de detección de genotipos del VPH como prueba primaria de cribado. La investigación integral del cáncer, desde la etiología hasta la prevención, ha tenido un impacto importante en las políticas de salud pública mundiales, tanto es así que, en 2020, la Organización Mundial de la Salud inició la campaña de eliminación del cáncer de cuello de útero, un hito posible nunca antes planteado en el campo de la oncología.
Certain human papillomavirus (HPV) genotypes are a necessary cause of cervical cancer and are linked to the etiology of a fraction of anogenital and head and neck carcinomas. Currently, twelve HPV types have been classified as definitively carcinogenic by the International Agency for Research on Cancer, of which HPV16 is the most carcinogenic genotype. The carcinogenic classification of HPVs is based on extensive epidemiological studies and biological evidence conducted over the past decades and thanks to the strong collaboration between scientists seeking to uncover the etiology of cervical cancer. HPVs 16, 18, 31, 33, 35, 45, 52, and 58 are responsible for more than 90% of cervical cancers. Since 2006, three effective prophylactic vaccines have been approved in Europe, and have demonstrated to be immunogenic, safe, efficacious and effective. The demonstration of HPV as a necessary cause of cervical cancer has also led to the refinement of screening strategies, such as the introduction of primary HPV testing. Comprehensive cancer research, from etiology to prevention, has had a significant impact on global public health policies, so much so that in 2020 the World Health Organization launched the campaign to eliminate cervical cancer, a possible milestone never before considered in the field of oncology.
Estudios de historia natural del virus del papiloma humano (VPH) han revelado que la infección por VPH es la infección de transmisión sexual más común en la población sexualmente activa. En la mayoría de las ocasiones esta infección es asintomática y, se aclara, tan solo una proporción menor del 10% de las infecciones persisten y pueden dar lugar a lesiones malignas1. El virus se asocia a lesiones precancerosas y cánceres en diferentes localizaciones anatómicas como en el cuello de útero, en el que el VPH es causa necesaria, y también es causa de lesiones benignas, como las verrugas anogenitales y la papilomatosis respiratoria recurrente. Después del descubrimiento del VPH como causa del cáncer de cuello de útero y como infección de transmisión sexual, se han realizado múltiples estudios en otras localizaciones anatómicas anogenitales, de cabeza y cuello, ya que comparten la misma vía de transmisión. Estos estudios también han demostrado el papel cancerígeno del VPH en los cánceres originados en estos otros sitios no cervicales, como la vulva, la vagina, el canal anal, el pene y el área de la cabeza y el cuello, especialmente en la orofaringe1. Esta asociación causal ha provocado grandes avances en la prevención de la infección y de las enfermedades asociadas, como el desarrollo de vacunas profilácticas frente a VPH (3 vacunas autorizadas en Europa desde 2006), el desarrollo de pruebas específicas de cribado del cáncer de cuello de útero basadas en la detección de VPH (técnicas aprobadas por agencias reguladoras) y, recientemente, la publicación de nuevas recomendaciones de cribado de cáncer del canal anal en las poblaciones de alto riesgo por parte de la International Anal Neoplasia Society2.
La carga de la enfermedad del cáncer de cuello de útero y la evidencia de la utilidad de estas estrategias preventivas es tan importante a nivel mundial, que en 2020 la Organización Mundial de la Salud (OMS) inició la campaña de eliminación del cáncer de cuello de útero, un hito posible nunca planteado anteriormente en el campo de la oncología: por primera vez en la historia se plantea eliminar un cáncer3.
En este artículo revisaremos cómo se descubrió la asociación del VPH con diferentes enfermedades, la epidemiología, la campaña de eliminación del cáncer de cuello de útero promovida por la OMS, y la evidencia hasta el momento del impacto de los programas de vacunación en la reducción de cáncer de cuello de útero y de otras enfermedades asociadas al VPH.
Relación causal del virus del papiloma humano con el cáncer de cuello de útero y otras lesiones asociadas a la infección por el virus del papiloma humanoUn descubrimiento importante en la etiología del cáncer humano fue el reconocimiento de que el cáncer de cuello de útero es una consecuencia poco frecuente de una infección persistente por algunos tipos de VPH. Esta infección, si no se resuelve, puede evolucionar a lesión precancerosa que, si no se detecta a tiempo, en una pequeña proporción de casos puede evolucionar a carcinoma invasivo. En salud pública, la importancia de este hallazgo es comparable a la asociación entre las infecciones crónicas de los virus de la hepatitis B y C y el riesgo de cáncer de hígado, o entre el tabaquismo y el cáncer de pulmón.
El descubrimiento del VPH como causa de cáncer de cuello de útero se remonta a los años 1974–1976, cuando epidemiólogos de la Agencia Internacional de Investigación del Cáncer (IARC, del inglés International Agency for Research on Cancer) recogieron un gran número de muestras de mujeres diagnosticadas de cáncer de cuello de útero en Colombia, Uganda, Brasil e Irán. El objetivo principal era detectar VPH, citomegalovirus y virus del herpes simple tipo 2. Finalmente, las muestras fueron positivas en un porcentaje alto a VPH y negativas para los otros virus estudiados4. Posteriormente, se desarrollaron múltiples estudios a nivel internacional con diferentes diseños, entre ellos, estudios de casos y controles y de cohortes, que situaron al VPH como causa principal del cáncer de cuello de útero. La presencia del VPH en prácticamente todos los cánceres de cuello de útero representaba la fracción atribuible más alta descrita hasta el momento para un agente etiológico de cualquier tipo de cáncer humano5. Así, se determinó que el VPH no solo era la principal causa de cáncer de cuello de útero, sino también causa necesaria6. En 2003, se publicó por primera vez la clasificación del riesgo epidemiológico del VPH5 y, en 2009, la IARC publicó una actualización de la lista, que es la actualmente vigente7.
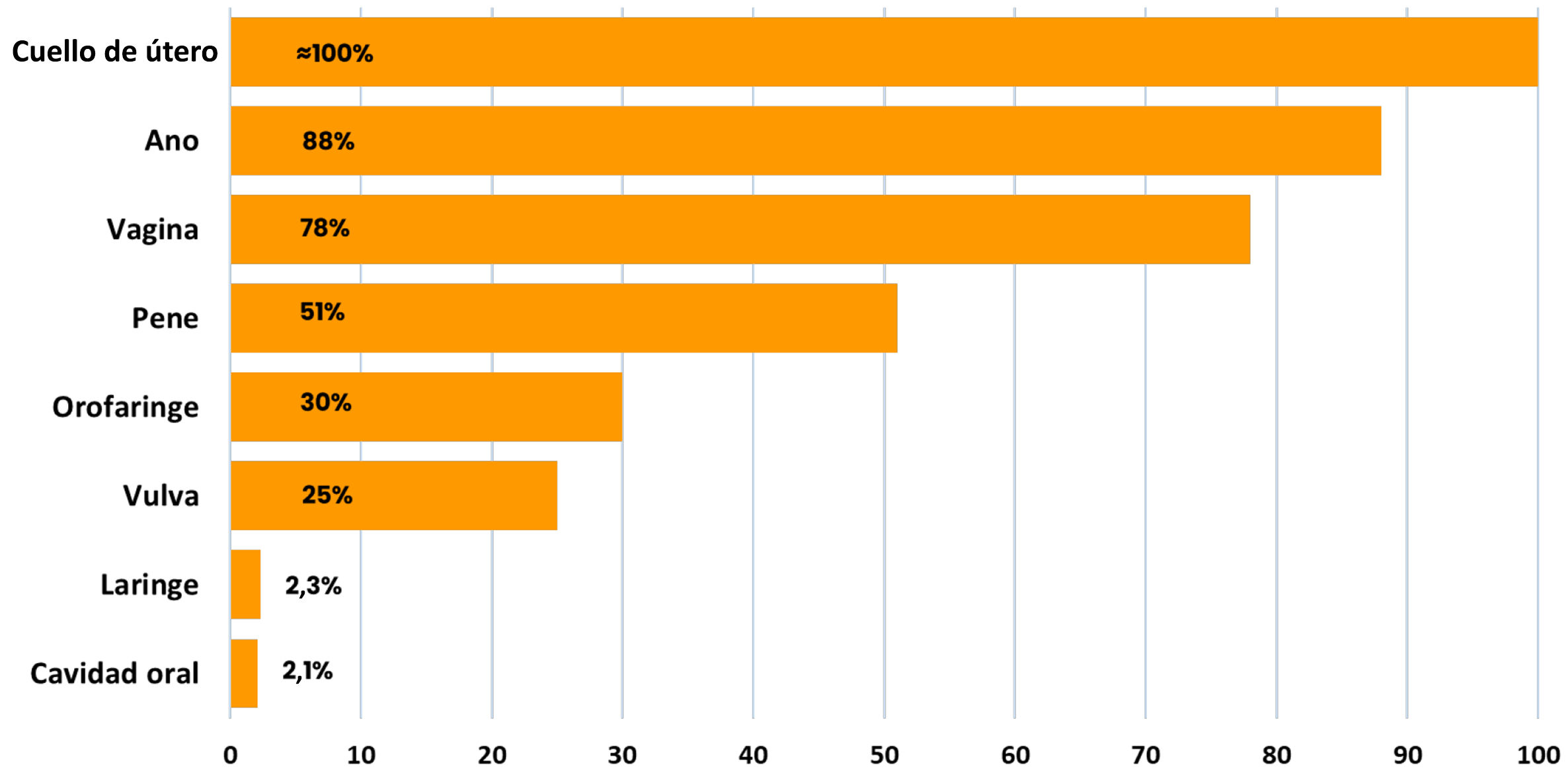
Existen más de 200 tipos de VPH que tienen diferentes clasificaciones, y una de ellas es por el riesgo oncogénico de cáncer de cuello de útero. Así, se definen 12 tipos del VPH como tipos de alto riesgo oncogénico-grupo 1 (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59). Otros tipos están clasificados como grupos 2A/2B, probables/posibles carcinógenos y, finalmente, están los de riesgo indeterminado, como los VPH 6 y 11. Estos últimos son los tipos del virus asociados al 90% de los casos de verrugas anogenitales, y prácticamente todos los casos de papilomatosis respiratoria recurrente. Así como hemos especificado, que el virus está asociado causalmente a prácticamente todos los casos de cáncer de cuello de útero, no sucede lo mismo para otros cánceres. Diferentes estudios han situado la proporción de cánceres asociados causalmente al VPH en: más del 80% para cáncer de canal anal, alrededor de 75% para cáncer de vagina, 50% para cáncer de pene, 30% para cáncer de vulva y orofaringe, y menos del 5% para los cánceres de la cavidad oral y la laringe8,9 (fig. 1). En el caso de los cánceres de cabeza y cuello, particularmente en la orofaringe, existe gran variabilidad en esta proporción según regiones, siendo superior al 80% en países como Estados Unidos o países del norte de Europa, mientras que en otras regiones del mundo es inferior al 10%9.
Proporción de casos de cáncer asociados al virus del papiloma humano9.
Cabe destacar que la epidemiología está en constante evolución, y en diferentes países se ha visto un aumento de la incidencia de cánceres de diferentes localizaciones fuera del cuello del útero asociados al VPH (como anal, vulvar y orofaringe). Además, se están investigando activamente 2 localizaciones anatómicas (la nasofaringe y los cánceres nasosinusales) para determinar cuál es la proporción de casos de estos cánceres asociada al VPH10,11.
En relación con los tipos de VPH, el VPH16 es el tipo del virus más frecuentemente detectado en todos los cánceres asociados al VPH, con mucha diferencia, tanto es así, que en ciertos cánceres como en el de orofaringe más del 80% de los casos de cánceres asociados al VPH se producen por una infección persistente del VPH16. En el cáncer de cuello de útero, el VPH16 se detecta en un 60% aproximadamente, seguido del VPH18, con un 10%, y conjuntamente suponen el 70% de estos cánceres. Los otros tipos de alto riesgo incluidos en la vacuna nonavalente (VPH31, 33, 45, 52 y 58) suponen aproximadamente un 20% de casos de cáncer de cuello de útero, por lo que la vacuna podría prevenir el 90% de estos cánceres8.
En cuanto a la carga de la enfermedad, en el mundo se diagnosticaron 662.301 nuevos casos de cáncer de cuello de útero en 2022, según estimaciones actualizadas de GLOBOCAN, y se produjeron 348.874 muertes por este cáncer12. En mujeres de 15 a 44 años, el cáncer de cuello de útero fue el tercer cáncer más común, después del de mama y el de tiroides, y el segundo en mortalidad, solo superado por el de mama. Las estimaciones en España fueron de 2.020 nuevos diagnósticos de cánceres de cuello de útero, y 802 muertes asociadas a este cáncer. En global, los cánceres relacionados con el VPH representan el 4,5% de todos los casos nuevos de cáncer en todo el mundo, siendo el 8,6% de los cánceres en mujeres y el 0,8% en hombres. La incidencia y mortalidad por VPH en las otras localizaciones, más allá del cuello de útero, es menor. En España, se estima que se diagnosticaron aproximadamente 1.600 casos nuevos de cánceres anogenitales y cánceres de cabeza y cuello atribuibles al VPH, contando ambos sexos.
Eliminación del cáncer de cuello de úteroEn mayo de 2018, el director general de la OMS anunció una acción global para la eliminación del cáncer de cuello del útero. El lanzamiento oficial de la campaña de eliminación fue el 17 de noviembre de 2020. Los puntos clave de la propuesta están vinculados al conocimiento de la historia natural de la infección por VPH y las estrategias preventivas del cáncer de cuello de útero3. Los pilares de la estrategia de eliminación son los siguientes:
- •
Prevención primaria: la intervención se realiza antes de que se produzca la enfermedad, eliminando los factores que pueden causarla. En este sentido, en la prevención primaria del cáncer de cuello de útero desempeñan un papel clave las vacunas profilácticas frente al VPH.
- •
Prevención secundaria: la intervención tiene como objetivo principal impedir o retrasar el desarrollo de la enfermedad, detectándola en estados tempranos y aplicando un tratamiento. Los programas de detección precoz del cáncer de cuello de útero tienen este papel.
- •
Prevención terciaria: la intervención tiene como objetivo, una vez diagnosticada la enfermedad, eliminar o reducir complicaciones o recidivas. Aquí entra el manejo adecuado de la enfermedad, incluyendo el tratamiento, la monitorización y los cuidados paliativos.
Teniendo en cuenta los pilares comentados, los 3 objetivos (la llamada estrategia 90–70–90) marcados en la campaña son conseguir en 2030 (fig. 2) que: el 90% de las chicas estén vacunadas con pauta completa antes de los 15 años, el 70% de las mujeres entre los 35 y 45 años se hayan hecho un cribado con una prueba de alta precisión (detección de VPH), y el 90% de las pacientes diagnosticadas con cáncer de cuello de útero sean tratadas y seguidas de forma adecuada.
Objetivos de la campaña de eliminación del cáncer de cuello de útero3.
Una de las cuestiones clave fue definir el umbral de eliminación del cáncer de cuello de útero, que después de revisar la información, se estableció en 4 casos por cada 100.000 mujeres por año. Hay algunos países que ya están por debajo de este umbral, otros están cerca, pero algunos todavía están lejos, sobre todo países de África subsahariana. Sin embargo, si se establecen las medidas propuestas y se logran los objetivos planteados, todos los países podrían conseguir llegar al umbral antes de que finalice el siglo XXI. Según las proyecciones estadísticas, esta estrategia sería capaz de prevenir más de 60 millones de muertes en los próximos 100 años13.
Vacunas frente al virus del papiloma humanoLas vacunas frente al VPH son vacunas de subunidades no infecciosas, que se componen principalmente de partículas similares al virus (VLP, del inglés virus like particle). Estas VLP se producen mediante el autoensamblaje de copias de L1 (proteína estructural principal del virus) de genotipos específicos.
En España, actualmente se dispone de 2 vacunas frente al VPH: una vacuna bivalente (Cervarix®), que contiene VLP de VPH16 y VPH18, y una vacuna nonavalente (Gardasil9®), que contiene VLP de VPH16, 18, 6, 11, 31, 33, 45, 52 y 58 (tabla 1). La vacuna tetravalente, que contiene VLP de VPH16, 18, 6 y 11, dejó de comercializarse en agosto de 2022.
Características de las vacunas frente al virus del papiloma humano disponibles en España
| Vacuna bivalente | Vacuna nonavalente | |
|---|---|---|
| Nombre comercial (laboratorio) | Cervarix® (GlaxoSmithKline) | Gardasil9® (Merck & Co., Inc.) |
| Tipos de VLP | 16/18 | 6/11/16/18/31/33/45/52/58 |
| Dosis de proteína L1 | 20/20 μg | 30/40/60/40/20/20/20/20/20 μg |
| Adyuvante | AS04 (500 μg de hidróxido de aluminio, 50 μg de 3-O-desacil-4′-monofosforil lípido A) | 500 μg de hidroxifosfato sulfato de aluminio |
| Indicaciones | Prevención de lesiones precancerosas de cérvix, vulva, vagina y anoPrevención de cáncer de cérvix y ano | Prevención de lesiones precancerosas y cáncer de cérvix, vulva, vagina y anoPrevención de verrugas anogenitales |
En los ensayos clínicos, las vacunas han demostrado ser altamente inmunógenas y conferir, en personas no infectadas en el momento de la vacunación, una protección excelente frente a la infección persistente por los genotipos incluidos en las vacunas, protección cruzada parcial frente a genotipos similares y protección frente a lesiones precancerosas cervicales, vulvares, vaginales y anales asociadas a estos genotipos14–18.
Programa de vacunación frente al virus del papiloma humano en EspañaEn España, la vacunación sistemática frente al VPH en mujeres adolescentes se inició en 2007, en una cohorte entre los 11 y 14 años, incorporándose a lo largo de 2008 en todas las comunidades autónomas19. Posteriormente, la edad de administración se rebajó a los 11–12 años20. En 2018, se incluyó la captación de mujeres hasta los 18 años que no se habían vacunado previamente, así como la vacunación de personas con determinadas condiciones de riesgo: mujeres con tratamiento escisional de cérvix, síndrome WHIM y, hasta los 26 años, en mujeres con trasplante de órgano sólido o de progenitores hematopoyéticos, personas con infección por el VIH, hombres que tienen sexo con hombres y personas en situación de prostitución21. En 2022, se incorporó la vacunación de los varones adolescentes, implantándose en las comunidades autónomas entre 2022 y 202322. Finalmente, en 2024 se aprobó incorporar en el calendario de vacunaciones, a lo largo de 2025, el cambio de pauta a una sola dosis, la captación de hombres no vacunados hasta los 18 años y la ampliación de la vacunación en grupos de riesgo hasta los 45 años (excepto en mujeres con lesión intraepitelial de alto grado en el cuello de útero, en las que se recomienda la vacunación independientemente de la edad)23. Las recomendaciones actuales son administrar una pauta de una dosis hasta los 25 años y 2 dosis a partir de los 26 años, separadas al menos 6 meses, excepto en personas con inmunosupresión y en mujeres con lesión intraepitelial de alto grado en el cuello del útero, en las que se administrará una pauta de 3 dosis23.
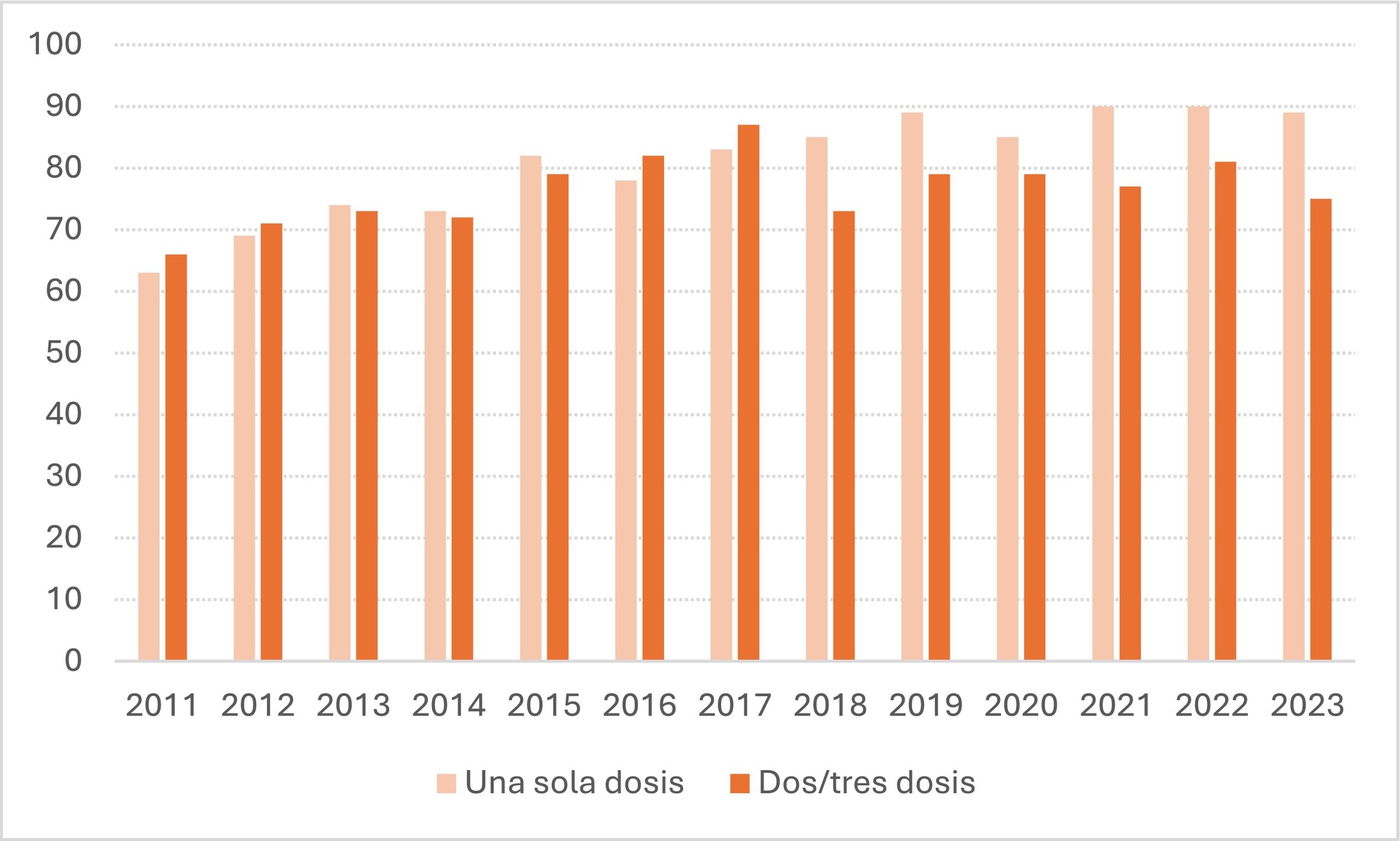
En los primeros años del programa de vacunación, la cobertura de vacunación frente al VPH en mujeres en España se situó alrededor del 70%, aumentando gradualmente hasta situarse alrededor del 80% en los últimos años para la pauta de 2 dosis, y del 90% para una sola dosis (fig. 3)24.
Evolución de las coberturas de vacunación frente al VPH en mujeres en España.
Fuente: WHO HPV vaccination Dashboard24.
El objetivo principal del programa de vacunación frente al VPH es la prevención del cáncer de cuello de útero y de otras enfermedades relacionadas con el VPH, pero dado el largo periodo de latencia desde la infección por VPH hasta el desarrollo del cáncer de cuello de útero, y al hecho de que se vacuna a preadolescentes antes del inicio de las relaciones sexuales en España, el efecto del programa de vacunación en cáncer podrá evaluarse a largo plazo.
No obstante, ya se dispone de evidencia del elevado impacto de los programas de vacunación frente al VPH en la reducción de la incidencia cáncer de cuello de útero en mujeres jóvenes, procedente de varios países europeos que incluyeron en sus programas de vacunación mujeres hasta los 18 años (26 años en el caso de Dinamarca)25–28.
Como la historia natural del cáncer de cuello de útero está bien establecida (diferenciándose 4 etapas: infección del epitelio cervical por un genotipo de VPH oncogénico, persistencia de la infección, progresión a lesión precancerosa cervical e invasión), es posible evaluar el impacto de los programas de vacunación en estos desenlaces intermedios en un periodo de tiempo más corto que el necesario para evaluar el impacto en cáncer de cuello de útero. Adicionalmente, en aquellos programas en que se ha administrado la vacuna tetravalente o la nonavalente se puede evaluar el impacto a corto plazo en verrugas anogenitales, ya que estas se desarrollan pocas semanas o meses después de la infección por VPH. Por último, los programas de vacunación frente a VPH también tendrán un impacto en lesiones precancerosas y cáncer de otras localizaciones relacionados con el VPH (vulva, vagina, ano, pene, orofaringe, cavidad oral y laringe), aunque, al ser lesiones con una menor incidencia, el impacto se podrá evaluar más a largo plazo.
Impacto en cáncer de cuello de úteroEn un metaanálisis realizado por Drolet et al. que evaluó el impacto poblacional de los programas de vacunación frente a VPH, comparando los periodos prevacunación y posvacunación, se evidenció una reducción de la prevalencia de infección cervical por VPH16 y VPH18 del 83% en las mujeres de 13 a 19 años y del 66% en las mujeres de 20 a 24 años a los 5–8 años de iniciar el programa, y una reducción de la prevalencia de infección por los genotipos frente a los que existe protección cruzada parcial (VPH31, VPH33 y VPH45) del 54% en las mujeres de 13 a 19 años29. A los 5–9 años tras la introducción, también se observó una reducción de lesiones precancerosas cervicales de alto grado (CIN2+) del 51% en las mujeres de 15 a 19 años que acudieron a cribado, y del 31% en las mujeres de 20 a 24 años29.
En los últimos 5 años, se han publicado diferentes estudios que han evidenciado que la vacunación frente al VPH en la adolescencia confiere una elevada protección frente al cáncer de cuello de útero en las mujeres jóvenes. Falcaro et al. evaluaron el impacto poblacional del programa de vacunación con la vacuna bivalente en Inglaterra, comparando la incidencia de cáncer de cuello de útero en las cohortes vacunadas 10 años después de introducir la vacunación, respecto a una cohorte de referencia no vacunada25. En las cohortes vacunadas entre los 16 y 18 años, con una cobertura de vacunación del 44,8%, se observó una reducción de la incidencia de cáncer de cuello de útero del 34% (IC 95%: 25–41); en las cohortes vacunadas entre los 14 y 16 años, con una cobertura del 73,2%, una reducción del 62% (IC 95%: 52–71); por último, en las cohortes vacunadas entre los 12 y 13 años, con una cobertura del 84,9%, la incidencia se redujo un 87% (IC 95%: 72–94)25. Además, en este estudio se observó una reducción de todos los casos de CIN3 (independientemente del genotipo causal) del 97% (IC 95%: 96–98) en las vacunadas a los 12–13 años respecto a cohortes de referencia no vacunadas, una reducción del 75% (IC 95%: 72–77) en las vacunadas entre los 14 y 16 años, y una reducción del 39% (IC 95%: 36–41) en las vacunadas entre los 16 y 18 años25. Los autores estiman que, hasta 2019, se han prevenido 448 cánceres de cuello de útero y 17,235 casos de CIN3 en Inglaterra, en las cohortes vacunadas25.
Otros estudios que han evaluado la efectividad de la vacuna tetravalente frente a VPH en Suecia y Dinamarca observan una protección similar frente al cáncer de cuello de útero26,27. En estos países, se evaluó la incidencia de cáncer de cuello de útero en mujeres hasta los 30 años, observándose una reducción de la incidencia del 86–88% en las mujeres vacunadas antes de los 17 años respecto a las no vacunadas, en el análisis ajustado26,27. En Suecia, en las mujeres que recibieron la vacuna entre los 17 y los 30 años se observó una reducción de la incidencia del 53%26, mientras que en Dinamarca se observó una reducción del 68% en las mujeres vacunadas entre los 17 y 19 años, y no se observó un efecto inmediato en las mujeres vacunadas entre los 20 y 30 años27.
Por último, un estudio que ha evaluado la efectividad de la vacuna bivalente a partir del análisis de registros en Escocia también ha evidenciado una efectividad menor a medida que aumenta la edad de vacunación, observando una efectividad del 100% en las vacunadas entre los 12 y 13 años, del 86,2% (IC 95%: 71,8–93,2) en las vacunadas entre los 14 y 16 años, del 38,9% (IC 95%: 3,1–61,5) en las vacunadas a los 17–18 años, y ausencia de efectividad en las vacunadas después de los 18 años28.
Impacto en otras enfermedades relacionadas con el virus del papiloma humanoLas verrugas anogenitales fueron la primera manifestación clínica de la infección por VPH en la que se pudo evidenciar el impacto de los programas de vacunación con la vacuna tetravalente, y numerosos países que introdujeron un programa de vacunación con la vacuna tetravalente o nonavalente han observado una disminución drástica de la incidencia de verrugas anogenitales. En el metaanálisis de Drolet et al., se observó que, tras 5–8 años de la introducción de la vacuna, los diagnósticos de verrugas anogenitales disminuyeron en las mujeres de 15 a 29 años. Esta disminución fue mayor en el grupo de edad más joven, siendo del 67% en las mujeres de 15 a 19 años, y del 54% en las mujeres de 20 a 24 años. Además, se observó una reducción de las verrugas anogenitales tanto en las mujeres de 25 a 29 años, que en su mayoría no estaban vacunadas, como en los varones no vacunados de 15 a 24 años, lo que indica protección comunitaria de los programas de vacunación. Este metaanálisis también evidenció que la reducción de verrugas anogenitales y la protección comunitaria son mayores, y se observan más rápidamente en aquellos países que alcanzaron una cobertura de vacunación superior al 50%, y que vacunaron a varias cohortes de mujeres al inicio, en comparación con países que alcanzaron coberturas inferiores al 50% o que vacunaron a una sola cohorte de niñas29.
En España, un estudio realizado en Cataluña a partir de la base de datos SIDIAP, que incluye información de la historia clínica electrónica de los individuos asignados a centros de atención primaria del Instituto Catalán de la Salud (cobertura del 74% de la población), evaluó el impacto del programa de vacunación en la incidencia de verrugas anogenitales en el periodo 2009–2016. A nivel global se observó un aumento de la incidencia de verrugas anogenitales tanto en hombres como en mujeres en el periodo de estudio30. En mujeres de 16–19 años la incidencia aumentó de 2009 a 2012, pero de 2012 a 2016 se observó un descenso del 61%, coincidiendo con que las cohortes vacunadas alcanzaron estas edades. En los hombres no vacunados de 20 a 22 años y de 23 a 25 años, se observó un aumento de la incidencia de verrugas anogenitales en la primera mitad del periodo (desde 2009 a 2013 y 2014, respectivamente), mientras que después se observó un cambio de tendencia en la incidencia, pasando a una disminución promedio anual de la incidencia de verrugas anogenitales del 4,5 y del 6%, lo que sugiere un efecto de protección comunitaria por la vacunación30.
Los datos disponibles del impacto poblacional de la vacunación frente a VPH en lesiones precancerosas vulvares, vaginales y anales son más limitados, ya que la incidencia de estas lesiones es baja. No obstante, la efectividad y el impacto poblacional se han podido evaluar en algunos países que disponen de registros.
En Dinamarca, se ha evaluado la efectividad de la vacuna tetravalente en la prevención de lesiones precancerosas en la vulva y en la vagina a los 10 años de la introducción del programa. En las mujeres que recibieron la vacuna antes de los 17 años, el riesgo de lesiones precancerosas de la vulva disminuyó un 78% comparado con las mujeres no vacunadas, y el riesgo de lesiones precancerosas de la vagina, un 84%. Sin embargo, esta disminución no se observó en mujeres que recibieron la vacuna a partir de los 17 años31. Otro estudio realizado en Dinamarca evaluó la efectividad de las vacunas frente a lesiones precancerosas anales en una cohorte de mujeres a nivel nacional. En las mujeres que recibieron la vacuna antes de los 17 años, el riesgo de lesiones precancerosas anales de alto grado disminuyó en un 70% respecto a las mujeres no vacunadas, mientras que en las mujeres que recibieron la vacuna entre los 17 y 32 años no se observó disminución32.
Otros estudios han evaluado el impacto poblacional de los programas de vacunación en estas lesiones en los Estados Unidos. En el periodo previo a la introducción de la vacuna se observó un incremento anual de la incidencia de lesiones precancerosas de vulva, vagina y ano. En el periodo posvacunación, en cambio, se observó un descenso de la incidencia de lesiones precancerosas de vulva del 21% anual en las mujeres de 15–19 años, y una disminución del 19,1% anual en las mujeres de 15–29 años. Respecto a la incidencia de lesiones precancerosas de ano, tras la introducción de la vacunación la incidencia se estabilizó en mujeres de 15–29 años y en hombres de 30–39 años; en hombres de 15–29 años la incidencia continuó aumentando, aunque el incremento es menor desde la introducción de la vacunación33. Otro estudio realizado en los Estados Unidos, a partir de registros de cáncer, observó un descenso de la incidencia de cáncer anal escamoso a partir de 2008 (considerando carcinoma in situ e invasivo) en mujeres y hombres de 20 a 44 años34.
Por último, también se ha podido evidenciar la alta efectividad de las vacunas en la reducción de la prevalencia de infección oral u orofaríngea por los genotipos de VPH incluidos en las vacunas. Una revisión sistemática publicada en 2021 estimó el porcentaje relativo medio de prevención de infección oral u orofaríngea en el 82,7%35.
ConclusionesLa investigación integral del cáncer uterino, desde la etiología hasta la prevención, ha tenido un impacto significativo en las políticas de salud pública a nivel mundial, tanto es así que, en 2020, la Organización Mundial de la Salud inició la campaña de eliminación del cáncer de cuello de útero, un hito sin precedentes en la historia de la oncología. Una de las medidas principales de prevención de las enfermedades asociadas al VPH es la vacunación profiláctica frente al virus. Ya existen datos del impacto de las vacunas en la reducción del cáncer de cuello de útero en mujeres de hasta 30 años. Este efecto observado en los programas de vacunación de Dinamarca, Suecia, Escocia e Inglaterra es consistente, mostrando la importancia de vacunar a una edad temprana. El impacto de la vacuna es tan alto que incluso se ha comprobado que ofrece protección comunitaria en hombres no vacunados y mujeres no vacunadas. En los próximos años se espera observar un alto impacto en la reducción de la incidencia y mortalidad por cáncer de cuello del útero a nivel mundial si se avanza en la implementación y cobertura de las diferentes medidas de prevención disponibles.
FinanciaciónLos autores declaran que no recibieron financiación para este trabajo.
Conflicto de interesesLos autores declaran que el PREC, Programa de Recerca en Epidemiologia del Càncer, ha recibido becas financiadas por Merck & Co. Inc., Roche, GlaxoSmithKline, Seegene, Vitro y Werfen.