La hepatitis A tiene una distribución mundial, variando su incidencia según el nivel de endemicidad. La endemicidad alta corresponde a países con prevalencia de infección en la población general superior al 50% e incidencia anual superior a 150 casos por 100.000 habitantes, mientras que la endemicidad muy baja corresponde a países cuya prevalencia de infección a la edad de 30 años es inferior al 50% y cuya incidencia anual es inferior a 5 casos por 100.000.
El impacto poblacional de la estrategia de vacunación universal se ha demostrado en múltiples contextos, habiéndose observado que se produce una disminución en la incidencia de casos, no solo en los grupos de edad que reciben la vacunación sino también en la población no vacunada.
Aunque los objetivos de eliminación de hepatitis víricas se cuantifican principalmente para las hepatitis B y C, que son las que ocasionan la mayoría de muertes, la estrategia sanitaria global planteada por la OMS está dirigida a los 5 virus (A, B, C, D y E) que causan hepatitis, y las intervenciones incluyen asegurar un elevado nivel de saneamiento y de control de agua y alimentos, así como también la vacunación frente a la hepatitis A.
La estrategia de vacunación con una única dosis de vacuna que se ha implementado en algunos países ha mostrado ser coste-efectiva. En la actualidad, el mayor obstáculo para la vacunación universal en países de baja endemicidad es su coste. Sería importante considerar el efecto protector indirecto de la vacunación para estimar el impacto real de la vacunación universal.
Hepatitis A has a worldwide distribution, with incidence varying according to the level of endemicity. High endemicity countries are those with a prevalence of infection in the general population greater than 50% and an annual incidence greater than 150 cases/100,000 inhabitants, while very low endemicity countries corresponds to a prevalence of infection at the age of 30 years less than 50% and an annual incidence of less than 5 cases/100,000.
Population impact of the universal vaccination strategy has been demonstrated in multiple contexts, with a decrease in the incidence of cases observed not only in those age groups that receive vaccination but also in unvaccinated population.
Although elimination targets for viral hepatitis are primarily quantified for hepatitis B and C, which cause the majority of deaths, WHO's global health strategy targets the five viruses (A, B, C, D, and E) that cause hepatitis. Interventions include ensuring high sanitation levels and water and food security, as well as vaccination against hepatitis A.
The single-dose vaccination strategy implemented in some countries has proven to be cost-effective. Currently, the biggest obstacle to universal vaccination in low-endemicity countries is its cost. It would be important to consider the indirect protective effect of vaccination to estimate the true impact of universal vaccination.
La hepatitis A es una enfermedad transmisible aguda que está causada por el virus de la hepatitis A (VHA), un virus ARN que pertenece al género Hepatovirus y a la familia Picornaviridae.
La infección por VHA, que se evidencia por la detección en suero de anticuerpos frente a la inmunoglobulina M (IgM) específica frente a VHA, puede producir un amplio espectro de manifestaciones clínicas, que van desde la infección subclínica sin elevación de aminotransferasas séricas, y que ocurre especialmente en la infancia, a formas subclínicas con elevación de aminotransferasas y a formas clínicas evidentes. El inicio de las manifestaciones clínicas, particularmente en niños mayores y adultos, puede ser abrupto y se caracteriza por fatiga, malestar, anorexia, fiebre, mialgias, dolor abdominal, náuseas, vómitos, coluria e ictericia. El cuadro clínico se resuelve en 4–6 semanas y no hay formas crónicas de la enfermedad. En adultos pueden presentarse formas recurrentes en las que hay 2 o más episodios de elevación de aminotransferasas. Otras formas clínicas son las hepatitis colestásicas, con ictericia prolongada, coluria intensa y prurito. El principal determinante de la clínica de la hepatitis A es la edad: solo entre 10 y 50% de las infecciones clínicas se adquieren antes de los 5 años de edad, mientras que entre el 70 y el 95% de los adultos infectados presentan manifestaciones clínicas. Las complicaciones aparecen raramente y pueden ser hepatitis fulminante, artralgias, vasculitis cutánea, crioglobulinemia, colecistitis, síndrome de Guillain-Barré, meningoencefalitis, afectaciones renales y pancreatitis, entre otras1. La letalidad es baja, inferior al 1% a nivel general, si bien en brotes puede ser más alta. La existencia de hepatopatías crónicas, otras hepatitis víricas y una edad superior a 50 años son factores que incrementan el riesgo de complicaciones2.
Se transmite predominantemente por vía fecal-oral, por lo que el contacto con personas infectadas en centros de educación infantil facilita la transmisión a educadores y a familiares de los niños. También se transmite mediante alimentos y agua, particularmente en lugares en los que los manipuladores de alimentos infectados no practiquen el lavado de manos adecuado tras la defecación. El VHA puede permanecer infeccioso en el ambiente durante largos periodos de tiempo, por lo que pueden producirse brotes de fuente común y casos esporádicos vehiculados por alimentos que hayan sido contaminados por heces. Además de los alimentos de consumo crudo, los alimentos contaminados que hayan sido cocinados pueden transmitir el virus si el cocinado no es apropiado para destruir el virus.
Aunque es raro, el VHA también puede transmitirse mediante transfusiones, en especial en receptores frecuentes de sangre1.
La transmisión vertical del VHA, aunque rara, se ha documentado y puede llevar a complicaciones durante el embarazo, tales como placenta abrupta, ruptura de membranas pretérmino y hemorragia previa al parto. Las mujeres embarazadas que padecen la infección en el tercer trimestre pueden transmitir la infección al recién nacido. La transmisión intrauterina del virus se ha asociado a peritonitis neonatal, aunque el riesgo es bajo. Cuando se ha producido infección intrauterina, los niños infectados suelen ser asintomáticos, por lo que es posible que a partir de ellos se transmita la infección al personal sanitario3.
La presencia de infecciones de transmisión sexual antes o en el curso de la infección por VHA no es infrecuente, si bien varía según las estrategias de cribado implementadas para detectar dichas infecciones. En varones que presentan hepatitis A, se ha descrito una frecuencia de infección por Treponema pallidum más de 100 veces superior a la de varones en la población general4.
La enfermedad tiene una distribución mundial, pero su incidencia varía según el nivel de endemicidad del país. Se consideran 4 niveles de endemicidad (alta, intermedia, baja y muy baja), que tienen en cuenta la prevalencia de anticuerpos de IgG específica frente a VHA y la tasa de incidencia de casos de hepatitis A. La endemicidad alta corresponde a países en que la prevalencia de anticuerpos IgG en la población general es superior al 50% y una tasa de incidencia anual superior a 150 casos por 100.000 habitantes, mientras que la endemicidad muy baja corresponde a países cuya prevalencia de IgG a la edad de 30 años es inferior al 50% y cuya tasa de incidencia anual es inferior a 5 casos por 100.0005. La situación de la hepatitis A en Europa en el año 2023 se muestra en la figura 16. En España, la tasa de incidencia anual en 2022 fue de 0,52 casos por 100.000 habitantes y de 0,61 en 2023, claramente inferiores al umbral de 5 por 100.000 habitantes considerado para países de muy baja endemicidad. Los resultados del estudio de seroprevalencia realizado en 2017–2018 en una muestra de personas residentes en España que acudieron a centros de extracción de atención primaria del Sistema Nacional de Salud muestran que, en el grupo de edad de 30 a 39 años, la prevalencia de IgG era de 22,95% (IC 95%: 19,62–26,1) considerando toda la muestra, y de 11,10% (IC 95%: 8,17–14,04) al excluir las muestras procedentes de comunidades en las que desde 1999 se viene aplicando la estrategia de vacunación universal7.
Casos confirmados de hepatitis A por cada 100.000 habitantes en Europa, 20237.
En los países de renta alta, el nivel de endemicidad es bajo o muy bajo, con baja frecuencia de infección y enfermedad en la edad infantil. Se presentan brotes esporádicos que afectan a las personas que tienen un mayor riesgo de infección, porque viajan a países endémicos, a los familiares y contactos estrechos de individuos infectados, a los hombres que tienen sexo con hombres (HSH), a las personas con hepatopatías crónicas, a las personas inmunodeprimidas, a las personas que se inyectan drogas, a los niños migrantes procedentes de países endémicos y a los familiares de niños adoptados procedentes de dichos países, entre otros. En las 2 últimas décadas se ha producido un elevado número de brotes de transmisión de persona a persona en HSH a nivel mundial5.
La enfermedad como problema de salud públicaEn 2016, los 194 estados miembros de la Organización Mundial de la Salud adoptaron el compromiso de implementar estrategias que permitieran alcanzar, para el año 2030, el objetivo de eliminar las hepatitis víricas como problema de salud pública.
Si bien la estrategia sanitaria global planteada por la OMS para este logro está dirigida a los 5 virus que causan las hepatitis A, B, C, D y E, los objetivos de dicha estrategia están cuantificados específicamente para las hepatitis B y C, que son las que ocasionaban el 47 y el 48%, respectivamente, de todas las muertes por hepatitis aguda, cáncer hepático y cirrosis en 2015.
Entre las intervenciones esenciales para hacer frente a las hepatitis víricas, además de asegurar un elevado nivel de saneamiento y de control de agua y alimentos, ya se incluía la vacunación frente a la hepatitis A, bien fuera en el programa de vacunaciones sistemáticas o como respuesta a brotes en comunidades específicas8. Seis años después, la OMS sigue recomendando estas medidas frente a la hepatitis A y añade que se debe considerar especialmente el riesgo de contraer hepatitis A en las personas desplazadas por conflictos bélicos y emergencias humanitarias9.
Diversos autores señalan que, al igual que ocurre con la hepatitis B, la monitorización de la carga de enfermedad que supone la hepatitis A y su prevención mediante vacunación debe mejorarse10,11. En Estados Unidos, en el marco de las estrategias para avanzar hacia la eliminación de las hepatitis víricas como problema de salud pública, además de los objetivos específicos para reducir las hepatitis B y C, se han planteado también objetivos sobre reducción de las hepatitis A, fijándose para 2025 el objetivo de que la incidencia sea igual o inferior a 1,17 por 100.000 habitantes, lo que supone reducir la incidencia de hepatitis A un 40% respecto a la de 2017. Para el 2030, se ha planteado que la incidencia sea igual o inferior a 0,7 por 100.000, lo que supone reducir la incidencia un 63% respecto a la de 201712.
La prevención de la enfermedad mediante vacunaciónLa disponibilidad de una vacuna frente a la hepatitis A, de inmunogenicidad y eficacia protectora probadas, llevó a introducir la vacuna en muchos países en grupos de riesgo, pero esta estrategia tenía un impacto muy limitado en la incidencia global de la enfermedad, por lo que se empezó a plantear la vacunación universal en algunos países o regiones.
En la actualidad, se dispone de vacunas inactivadas que están autorizadas para ser administradas a partir de los 12 meses de edad, con el propósito de reducir la posible interferencia con los anticuerpos maternos transferidos de la madre al recién nacido a través de la placenta o por la lactancia. De acuerdo con la ficha técnica, la pauta de vacunación consiste en 2 dosis administradas por vía intramuscular, con una separación mínima de 6 meses. Estas vacunas se pueden administrar simultáneamente con otras vacunas sin que se haya observado interferencia en la inmunogenicidad, ni tampoco cambios en la reactogenicidad y en la seguridad5.
Los resultados de vacunación con 2 dosis de vacuna inactivada son incontrovertidos, con una efectividad superior al 95%. En un estudio realizado en Cataluña, 3 años después de haber adoptado la estrategia de vacunación universal, comparando la incidencia de la enfermedad en las cohortes vacunadas (nacidas entre 1987 y 1989) con la de las cohortes que no habían recibido la vacuna (nacidas entre 1984 y 1986), fue del 97% (IC 95%: 78,5%-99,6)13.
El impacto a nivel poblacional de la vacunación con vacunas inactivadas se ha demostrado en múltiples países, con una reducción de la incidencia de la enfermedad en la población general que oscila entre el 76 y el 98%5.
Los resultados de vacunación con una dosis de vacuna inactivada son también muy favorables. Antes de 2012, se habían realizado estudios en Nicaragua y Argentina para valorar la pauta de vacunación con una dosis, mostrando que, a los 6 meses tras la vacunación, los títulos de anticuerpos superaban el umbral considerado protector. En 2012, se revisó la protección de una dosis a más largo plazo, observando que los títulos de anticuerpos protectores frente al VHA persistían después de 11 años y que dichos títulos aumentaban tras la administración de una dosis de recuerdo14. El impacto de los programas de vacunación universal con una dosis de vacuna inactivada se ha podido comprobar en estudios realizados en diversos países14,15, con descensos en la incidencia de enfermedad que van del 80 al 99%.
Los resultados de la vacunación con la vacuna atenuada que se fabrica en China también muestran elevada eficacia y efectividad. El uso de esta vacuna ha mostrado tener un gran impacto y también un efecto de protección indirecta muy marcado, que probablemente se explique porque, durante el mes que sigue a la vacunación, los vacunados excretan virus atenuados que pueden inmunizar a personas no vacunadas. A pesar de que la seroconversión disminuye a los 2 años de la vacunación, el efecto protector dura durante bastante más16.
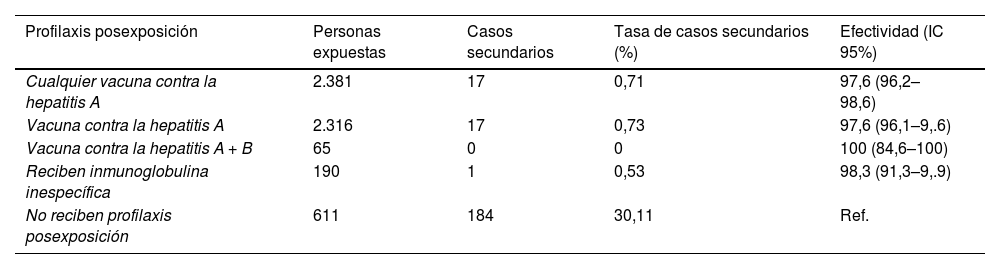
La vacuna frente a la hepatitis A también está indicada para prevenir la infección en personas no inmunizadas que se han expuesto al virus, y debería administrarse la primera dosis lo antes posible, y siempre que no hayan transcurrido más de 2 semanas desde la exposición, siendo una medida que contribuye a controlar de manera efectiva la incidencia de la enfermedad. En personas de 40 años o más, se recomienda administrar también inmunoglobulina en lugar anatómico distinto porque la eficacia de la vacuna puede ser menor. Dado que la inmunidad que proporciona la vacuna es de larga duración o de por vida, la profilaxis posexposición con vacuna es preferible a la profilaxis posexposición con inmunoglobulina, cuya protección es de corta duración5,17.
En un estudio realizado en Cataluña para evaluar la efectividad de la administración de una dosis de vacuna como prevención posexposición de la hepatitis A en personas expuestas que no estuvieran vacunadas, en el contexto de los brotes ocurridos entre enero de 2006 y diciembre de 2012, la efectividad resultó de 97,6% (IC 95%: 96,2–98,6), claramente no inferior a la de profilaxis posexposición con inmunoglobulina (tabla 1)18.
Efectividad de las medidas de profilaxis posexposición en brotes de hepatitis A. Cataluña, 2006–2012
| Profilaxis posexposición | Personas expuestas | Casos secundarios | Tasa de casos secundarios (%) | Efectividad (IC 95%) |
|---|---|---|---|---|
| Cualquier vacuna contra la hepatitis A | 2.381 | 17 | 0,71 | 97,6 (96,2–98,6) |
| Vacuna contra la hepatitis A | 2.316 | 17 | 0,73 | 97,6 (96,1–9,.6) |
| Vacuna contra la hepatitis A + B | 65 | 0 | 0 | 100 (84,6–100) |
| Reciben inmunoglobulina inespecífica | 190 | 1 | 0,53 | 98,3 (91,3–9,.9) |
| No reciben profilaxis posexposición | 611 | 184 | 30,11 | Ref. |
Ref: Categoria de referencia.
Los beneficios obtenidos en términos de reducción de la carga de enfermedad que supone la hepatitis A en los países o regiones en los que se ha seguido la estrategia de vacunación universal han sido muy importantes, como muestran los resultados de diversos estudios realizados en dichos territorios.
En Estados Unidos, en cuanto se dispuso, en 1995, de una vacuna eficaz y segura, se recomendó la vacunación, además de a los grupos de riesgo, a los niños y adolescentes de 2 a 18 años que vivían en áreas con elevada prevalencia de infección. En 1999, la recomendación se amplió a todos los niños de 17 estados en los que las tasas de incidencia fueran superiores a la media nacional del período 1987–1997 y, finalmente, en 2006, se recomendó a todos los niños de 12 a 23 meses19, observándose que, entre 1999 y 2011, había disminuido la carga de la enfermedad. La tasa de incidencia de la enfermedad pasó de 6 por 100.000 en 1999 a 0,4 por 100.000 en 2011, y la tasa de mortalidad también disminuyó, pasando de 0,1 por 100.000 en 1999 a 0,02 por 100.000 en 201120. Se ha señalado que el descenso de la mortalidad es más marcado en los estados que habían recomendado la vacunación, y que es importante reforzar la vacunación en adultos con mayor riesgo de exposición o de gravedad. Collier et al. analizaron la tasa de hospitalización y observaron un descenso importante entre 2002 y 2011, pasando de 0,72 por 100.000 habitantes en 2002 a 0,29 por 100.000 habitantes en 201121.
En Israel, se introdujo la vacunación universal en 1999, con 2 dosis a los 18 y 24 meses de edad, alcanzando una cobertura del 90% para la primera dosis y del 85% para la segunda dosis. Se evaluó el impacto, comparando la incidencia de la enfermedad tras la vacunación (2002–2004) con la incidencia del periodo previo a la vacunación (1993–1998). La disminución de la tasa de incidencia en el periodo vacunal respecto al periodo prevacunal fue del 95% a nivel general. En los niños de 1 a 4 años, el descenso fue del 98,2%, pero en otros grupos de edad que no habían sido vacunados también se observó una disminución en la tasa de incidencia. El descenso en las tasas de incidencia fue del 84,3% en los menores de un año, del 96,5% en los niños de 5 a 9 años, del 95,2% en el grupo de 10 a 14 años, del 91,3% en el grupo de 15 a 44 años, del 90,6% en el grupo de 45 a 64 años y del 77,3% en las personas de 65 o más años. Estos datos evidenciaron no solo un marcado impacto en los niños que recibieron la vacuna, sino también en otros grupos de edad, demostrando que la vacunación proporcionaba un efecto de protección indirecta en la comunidad22. Levine et al. evaluaron el impacto de la vacunación, comparando la incidencia de la enfermedad en el periodo 1993–1998 con la del periodo 2008–2012, y los resultados mostraron un descenso de la incidencia superior al 98%23.
En la región de Puglia (Italia), con una población aproximada de 4 millones de habitantes, la hepatitis A era endémica en el periodo 1989–1995, con una incidencia anual de 5 a 70 por 100.000 habitantes. Tras una epidemia importante en 1996–1997, que ocasionó más de 5.000 casos y una tasa de incidencia de 130 por 100.000 habitantes, en 1998 se introdujo la vacunación gratuita a todos los niños de 15 a 18 meses y a los preadolescentes de 12 años de edad. Se evaluó la evolución de las tasas de incidencia entre 1998 y 2009, y los resultados de un estudio de seroprevalencia. Las tasas de incidencia de la enfermedad mostraron un descenso muy marcado, pasando de 14,8 por 100.000 en 1998 a 0,8 por 100.000 en 2009. El estudio de seroprevalencia realizado en 2008 mostró una elevada prevalencia de susceptibilidad a la infección por VHA en las personas menores de 5 años (69,9% de susceptibles) y en los adultos de 26 a 30 años (69,4% de susceptibles). Los autores del estudio señalan que, aunque las actuaciones medioambientales para reducir la circulación del virus pudieron desempeñar un papel, la vacunación fue clave, y recomendaron una vacunación de rescate para los niños que no hubieran recibido la vacuna, así como también la vacunación a los adultos jóvenes que, según datos del estudio de seroprevalencia, mostraban una mayor susceptibilidad a la infección24.
En Argentina, en 2005, tras la aparición de un importante brote en 2003 y 2004, se empezó a vacunar a todos los niños de 12 meses de edad con una única dosis. Con una cobertura de vacunación superior al 90%, se observó, a partir de 2006, un descenso muy marcado en la tasa promedio de incidencia anual, que pasó de 66,5 por 100.000 habitantes en el periodo prevacunal, a 7,9 por 100.000 habitantes en el periodo posvacunal, lo que supuso un descenso del 88,1%. Además, en contraste con lo que ocurría antes de poner en marcha el programa de vacunación, desde 2007 no se produjeron casos de hepatitis fulminante en la edad pediátrica, ni fue preciso realizar trasplantes hepáticos en niños14. Los datos de seroprevalencia confirmaron que una dosis de vacuna confiere un nivel de seroprotección adecuado hasta por lo menos 9 años después de la vacunación25.
En Uruguay, tras importantes brotes de hepatitis A ocurridos a finales de 2004 y principios del 2005, con una tasa de ataque que llegó a ser de 2.987 por 100.000 en la ciudad de Bella Unión, el Ministerio de Sanidad empezó a indicar la vacunación como mecanismo de control para frenar estos brotes y, en 2008, se inició la vacunación universal, administrando 2 dosis de vacuna en niños a los 15 y 21 meses de edad. Se observó una reducción del 74,3%, pasando de una tasa de incidencia de la enfermedad de 16,3 en 2007 a 2,7 por 100.000 habitantes en 201026.
En la República de Tuva (Rusia), que tenía elevada incidencia de la enfermedad, especialmente en menores de 18 años, se adoptó la estrategia de vacunación universal a partir de 2012, administrándose sistemáticamente una dosis de vacuna inactivada a los niños de 3 años. Se observó que la incidencia anual de enfermedad en menores de 18 años pasó de 451,6 en 2012 a 7,5 por 100.000 habitantes en 2015 en este grupo de edad, suponiendo un descenso del 99,25%. Además, en la población general también se observó un descenso muy marcado (del 99,38%) de la enfermedad, pasando de 97,4 en 2012 a 0,6 por 100.000 habitantes en 201515.
En Brasil, tras la introducción de la vacunación universal con una dosis en niños entre 1 y 2 años de edad en 2014, se produjo igualmente un descenso en las tasas de incidencia. Entre 2014 y 2017, se observó una disminución en la tasa de incidencia del 98,8% en menores de 5 años; del 97,8% en los niños de 5 a 14 años, del 85,1% en el grupo de edad de 15 a 19 años, del 73,5% en la población de 20 a 39 años, y del 48,7% en las personas de 60 o más años27. La disminución observada en grupos de edad no vacunados nuevamente puso en evidencia el efecto de protección indirecta que tiene la vacunación en personas no vacunadas.
En la provincia de Henan (China) se inició la vacunación en 2008, administrándose gratuitamente a los niños de 18 meses una dosis de vacuna atenuada, con coberturas de vacunación elevadas, de 82,2% en 2008 y de 98,4% en 2018. Durante el periodo evaluado, se observó una disminución en la incidencia del 94,8%, siendo la disminución superior en los adolescentes, en quienes se observó un descenso del 98,2%. También se observó disminución de incidencia en las personas de 40 años o más, pero el descenso fue más lento y menos marcado28.
Los datos de impacto de la vacunación en el conjunto de España son muy limitados, ya que, como se ha señalado, la estrategia de vacunación universal solo se ha seguido en algunos territorios. En Cataluña, en 1999, se adoptó la estrategia de vacunación universal a los preadolescentes, además de la vacunación a grupos de riesgo, y en 2014 se adelantó la edad de vacunación a los 12 meses y 6 años. A los 7 años de haber introducido la vacunación sistemática en preadolescentes, la fracción prevenida de la enfermedad en la población de 12 a 19 años se estimó en 90,13% (IC 95%: 84,7–90,89)29. Ceuta y Melilla también adoptaron la estrategia de vacunación universal de la población pediátrica.
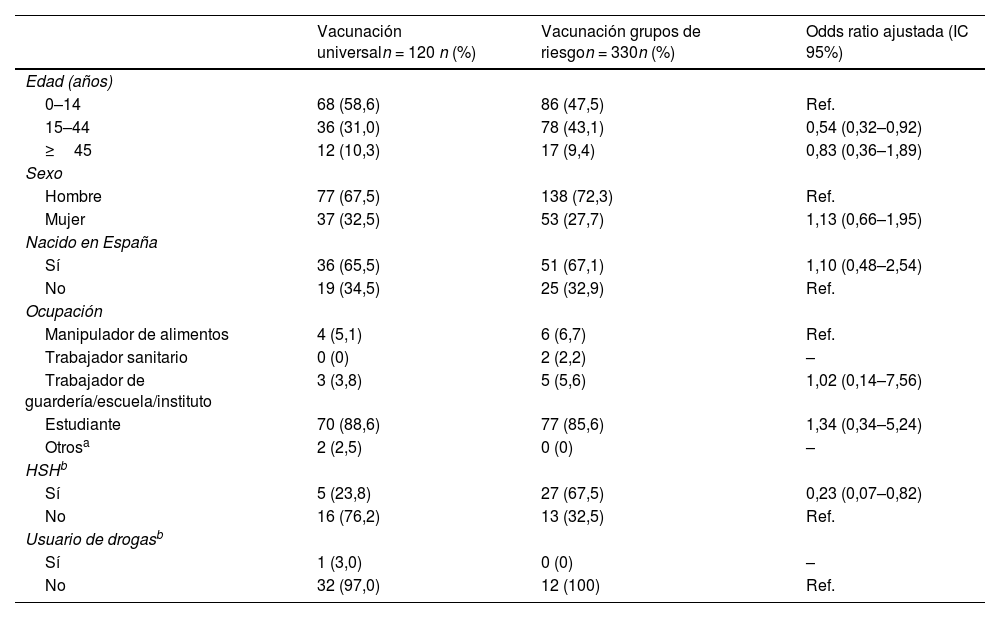
Comparando las características de los brotes ocurridos entre 2010 y 2018, en territorios en los que se ha seguido la estrategia de vacunación sistemática, además de la de grupos de riesgo, la incidencia acumulada de brotes fue inferior que en territorios en los que se ha seguido la estrategia de vacunar solo a grupos de riesgo (16,04 y 20,75 por millón de habitantes, respectivamente)30. En la figura 2 se muestran las tasas de incidencias de brotes y de casos de hepatitis A según la estrategia de vacunación seguida. Los adolescentes y adultos jóvenes entre 15 y 44 años, así como los hombres que tienen sexo con hombres, fueron menos frecuentemente el primer caso del brote en los territorios en los que se sigue una estrategia de vacunación universal que en aquellos en los que se sigue una estrategia de vacunación solo a grupos de riesgo (tabla 2).
Tasa de incidencia anual de casos de hepatitis A y tasa de brotes de hepatitis A según el modo de transmisión y la estrategia de vacunación. España, 2010–201831.
Características del primer caso en brotes de hepatitis A en territorios con diferentes estrategias de vacunación. España, 2010–2018
| Vacunación universaln = 120 n (%) | Vacunación grupos de riesgon = 330n (%) | Odds ratio ajustada (IC 95%) | |
|---|---|---|---|
| Edad (años) | |||
| 0–14 | 68 (58,6) | 86 (47,5) | Ref. |
| 15–44 | 36 (31,0) | 78 (43,1) | 0,54 (0,32–0,92) |
| ≥45 | 12 (10,3) | 17 (9,4) | 0,83 (0,36–1,89) |
| Sexo | |||
| Hombre | 77 (67,5) | 138 (72,3) | Ref. |
| Mujer | 37 (32,5) | 53 (27,7) | 1,13 (0,66–1,95) |
| Nacido en España | |||
| Sí | 36 (65,5) | 51 (67,1) | 1,10 (0,48–2,54) |
| No | 19 (34,5) | 25 (32,9) | Ref. |
| Ocupación | |||
| Manipulador de alimentos | 4 (5,1) | 6 (6,7) | Ref. |
| Trabajador sanitario | 0 (0) | 2 (2,2) | – |
| Trabajador de guardería/escuela/instituto | 3 (3,8) | 5 (5,6) | 1,02 (0,14–7,56) |
| Estudiante | 70 (88,6) | 77 (85,6) | 1,34 (0,34–5,24) |
| Otrosa | 2 (2,5) | 0 (0) | – |
| HSHb | |||
| Sí | 5 (23,8) | 27 (67,5) | 0,23 (0,07–0,82) |
| No | 16 (76,2) | 13 (32,5) | Ref. |
| Usuario de drogasb | |||
| Sí | 1 (3,0) | 0 (0) | – |
| No | 32 (97,0) | 12 (100) | Ref. |
HSH: hombres que tienen sexo con hombres.
Ref: Categoria de referencia.
Algo que sería deseable alcanzar con cualquier programa de vacunación es la erradicación, que supone la reducción permanente a cero de la incidencia mundial de la infección causada por un agente infeccioso específico, como resultado de esfuerzos deliberados (es decir, por la vacunación cuando se trata de una enfermedad inmunoprevenible).
El reservorio del VHA es humano y la infección y la enfermedad se pueden prevenir con vacunas que han mostrado elevada eficacia y efectividad, por lo que, potencialmente, la hepatitis A es una enfermedad cuya erradicación sería posible. En 1998, solo algunos años después de que se tuvieron vacunas disponibles, los expertos concluyeron que la erradicación de la hepatitis A era factible desde el punto de vista epidemiológico y biológico31 y estas conclusiones se mantuvieron durante algunos años. Sin embargo, no se han fijado nunca acuerdos a nivel internacional para conseguir la erradicación, fundamentalmente debido al coste de la vacunación y también a que, en países endémicos, la vacunación universal ha permitido alcanzar una incidencia anual menor a 1 por 100.000 habitantes, lo que hace que el problema que supone la enfermedad no se considere como un problema importante de salud pública32.
La estrategia de vacunación con una única dosis de vacuna resulta más coste-efectiva que la vacunación con 2 dosis1,5.
Un estudio realizado en Israel23 mostró que el programa de vacunación universal en la población pediátrica con 2 dosis de vacuna, considerando los efectos directos de la vacunación, suponía una razón beneficio-coste de 2,54; y los autores concluyeron que los beneficios estaban infraestimados por no tener en cuenta el efecto indirecto de la vacunación en los no vacunados.
Un estudio coste-efectividad realizado en los Estados Unidos, valorando la vacunación universal de los adolescentes con 2 dosis en los estados con elevada incidencia, mostró que el coste-efectividad era comparable al de otras vacunaciones y más favorable que el de otras intervenciones médicas33. Algunos programas de vacunación universal en adolescentes con vacuna combinada A + B también mostraron ser coste-efectivos34,35.
La razón coste-efectividad de la vacunación disminuye en países con mayor endemicidad y con un menor coste de la vacuna1. En la actualidad, el mayor obstáculo para la vacunación universal en países de baja o muy baja endemicidad es el coste de la vacuna5. Sería importante considerar el efecto protector de la vacunación en los no vacunados para estimar el impacto real de la vacunación universal.
FinanciaciónLos autores declaran que la presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran que no tienen conflictos de intereses.