Editado por: Dra. Núria Torner CIBER Epidemiologia y Salud Publica CIBERESP Unitat de Medicina Preventiva i Salut Pública Departament de Medicina, Universitat de Barcelona
Más datosla presente revisión se centra en la estimulación inmunitaria innata-adaptativa por las vacunas COVID-19, especialmente por las vacunas ARNm-iLNP. Se describen las tecnologías iLNP y ARNm modificado con nucleósidos, la transcripción inversa, las señales inflamatorias vinculadas a la reactogenicidad, incluye la diafonía vascular mediada por el factor de crecimiento endotelial vascular (VEGF), inducida por la proteína pico con efecto sistémico y que imitan el COVID-persistente. Por último, se discuten en detalle la conexión entre la manifestación de las formas graves de las reacciones adversas a la vacunación y el mimetismo molecular, la producción de autoanticuerpos particulares y el papel de ciertos adyuvantes de las vacunas.
Objetivosidentificar los artículos que publican información sobre los efectos adversos producidos después de la administración de las vacunas COVID-19 para demostrar su potencial terapéutico en el tratamiento y/o prevención de la enfermedad; así como evidenciar la asociación de causalidad y ocurrencia temporal.
Metodologíarevisión sistemática de la literatura científica publicada entre julio de 2021 y julio de 2023, que analiza todos los reportes sobre firmas inflamatorias de efectos adversos graves causados por las vacunas contra el COVID-19.
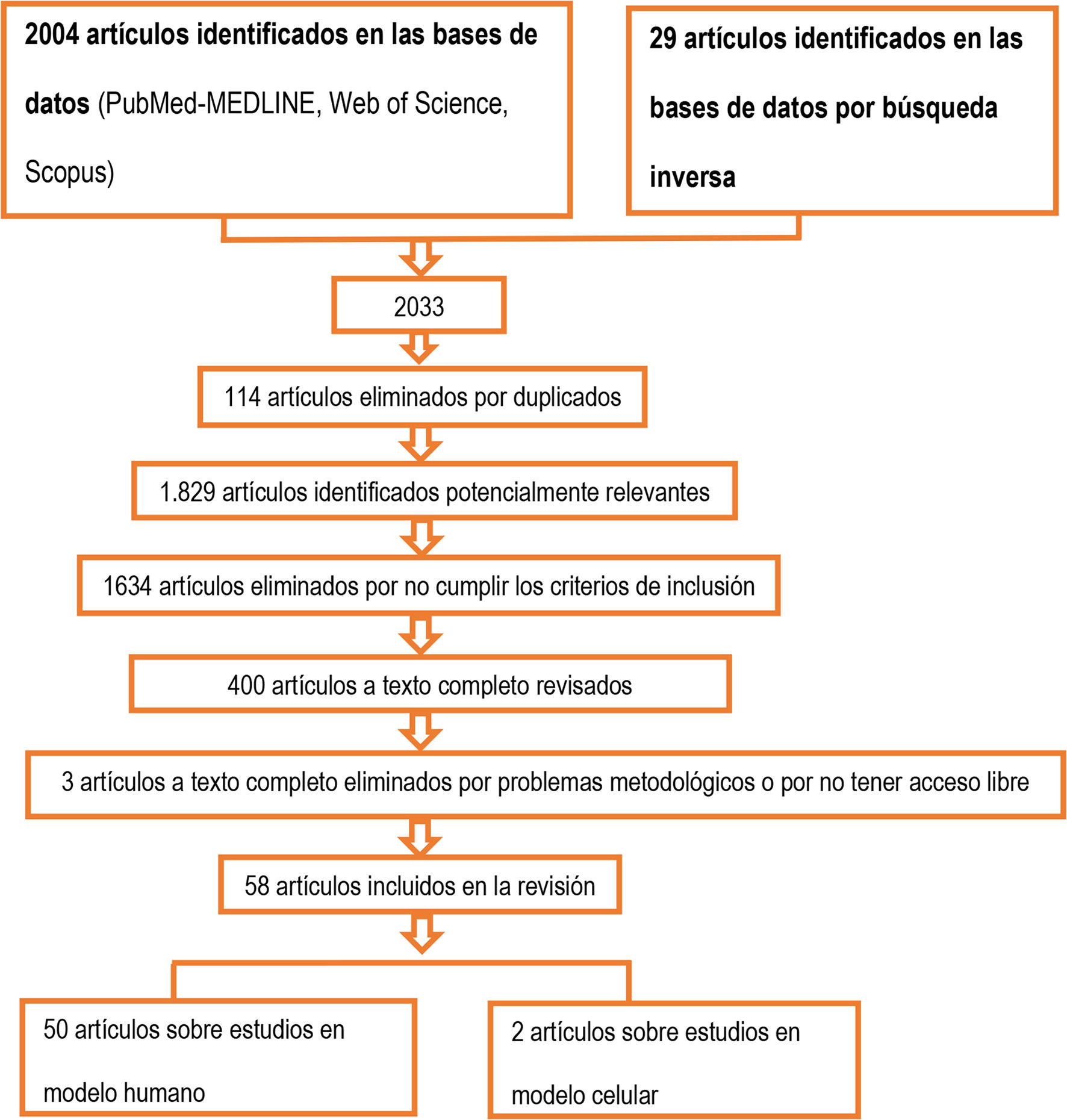
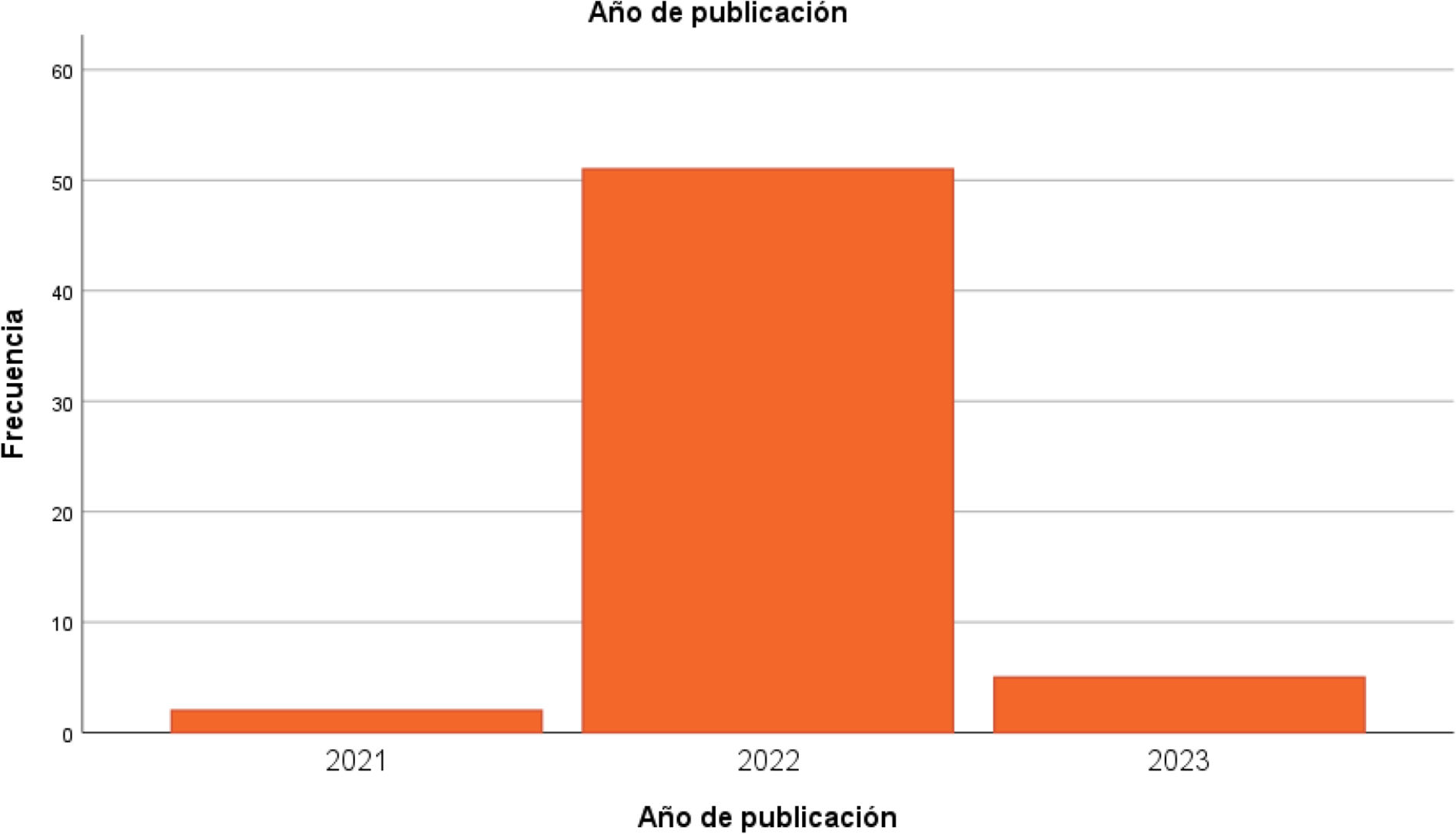
Resultadosla revisión sistemática ha permitido identificar 2033 registros que, tras un proceso de cribado de acuerdo con los criterios de inclusión y la eliminación de trabajos duplicados, de trabajos con problemas metodológicos y de trabajos sin acceso libre, se redujeron a 58 artículos; de ellos, 50 artículos son modelos humanos y 2 corresponden a modelos celulares.
Conclusiónlos resultados de esta revisión revelan la asociación causal y temporal de los distintos efectos adversos graves posteriores a la administración de las vacunas COVID-19 y se reconoce el «efecto de pico» de las vacunas COVID-19.
The present review focuses on innate-adaptative immune stimulation by COVID-19 vaccines, especially by mRNA-iLNP vaccines. It describes iLNP and nucleoside-modified mRNA technologies, reverse transcription, inflammatory signals linked to reactogenicity, including vascular endothelial growth factor (VEGF)-mediated vascular crosstalk, induced by systemic and spike protein, which mimic COVID-persistent. Finally, the connection between the manifestation of severe forms of adverse reactions to vaccination and molecular mimicry, the production of particular autoantibodies and the role of certain vaccine adjuvants are discussed in detail.
ObjectivesTo identify articles that publish information on the adverse effects produced after the administration of COVID-19 vaccines in order to demonstrate their therapeutic potential in the treatment-prevention of disease; as well as to demonstrate the association of causality and temporal occurrence.
MethodologySystematic review of the scientific literature published between July 2021 and July 2023, which analyzes all reports of inflammatory signatures of serious adverse effects caused by COVID-19 vaccines.
ResultsThe systematic review identified 2033 records which, after a screening process according to the inclusion criteria and the elimination of duplicated papers, works with methodological problems and works without open access, were reduced to 58 articles, of which 50 articles are human models and 2 are cellular models.
ConclusionThe results of this systematic review reveal the causal and temporal association of the various serious adverse events following administration of COVID-19 vaccines and the “peak effect” of COVID-19 vaccines is recognized.
Las principales tecnologías de vacunas contra el síndrome respiratorio agudo severo coronavirus 2 (SARS-CoV-2) incluyen en su composición la glicoproteína recombinante, el adenovirus debilitado/inactivado y el ARNm encapsulado en nanopartículas lipídicas (LNP) (Comirnaty de BioNTech de Pfizer, Spikevax de Moderna)1,2. Las vacunas de ARNm modificado con nucleósidos contra la enfermedad por coronavirus 2019 (COVID-19) son los primeros productos de ARNm en recibir la aprobación de la Administración de Alimentos y Medicamentos (FDA) y la Agencia Europea de Medicamentos (EMA). Los principales componentes de estas vacunas son: ARNm modificado con nucleósidos, tiene la capacidad de codificar la proteína antigénica, en este caso, la proteína espiga (S) del SARS-CoV-2 y nanopartículas lipídicas que contienen lípidos ionizables (iLNP), que funcionan como vehículo de entrega de ARNm intacto al citoplasma de las células que traducirán la proteína codificada3–5. Estas vacunas de ARNm-iLNP modificadas con nucleósidos son muy eficaces para inducir respuestas inmunitarias adaptativas específicas de picos en humanos, especialmente anticuerpos neutralizantes para crear inmunidad protectora contra la infección por SARS-CoV-2, así como promover la inmunidad humoral mediante las células T y prevenir formas graves del COVID-191,3,6–8. Sin embargo, el conocimiento sobre la dinámica y estructura de la proteína de pico de las plataformas de vacunas es casi desconocida, cómo las vías inmunitarias innatas regulan la inmunidad adaptativa, qué respuestas inmunitarias son protectoras y cuáles son prescindibles.
La presente revisión se centra en la estimulación inmunitaria innata-adaptativa de las vacunas COVID-19, especialmente por las vacunas ARNm-iLNP. En la primera parte se define el concepto de las tecnologías iLNP y ARNm modificado con nucleósidos, un estudio detallado sobre la dinámica y estructura de la proteína S de las vacunas COVID-19, transcripción inversa, exposición y posterior diseminación a la línea celular e integración en el genoma del huésped. Posteriormente, las señales inflamatorias vinculadas a la reactogenicidad, incluye la diafonía vascular mediada por el factor de crecimiento endotelial vascular (VEGF), inducida por la proteína pico con efecto sistémico y que imitan el COVID-persistente. Por último, se discuten en detalle la conexión entre la manifestación de las formas graves de las reacciones adversas a la vacunación y el mimetismo molecular, la producción de autoanticuerpos particulares y el papel de ciertos adyuvantes de las vacunas.
ARNm modificado con nucleósidos y tecnologías de nanopartículas lipídicas que contienen lípidos ionizablesSe refiere a las vacunas eficaces y seguras como las vacunas que estimulan el sistema inmunitario innato de manera que logre el equilibrio entre inmunogenicidad y reactogenicidad. Deben emitir las señales necesarias para mantener y preparar las respuestas inmunitarias adaptativas. Con ello se refiere a la capacidad de las vacunas para actuar en una situación específica sin producir efectos inflamatorios locales y sistémicos de forma excesiva3.
Se deben tener en cuenta una serie de factores que obstaculizan usar el ARNm sintético con aplicaciones en la biomedicina (vacuna o terapéutica), como las propiedades mecánicas y biocompatibles altamente inflamatorias para reconocer las moléculas de ARNm por los sensores innatos en los compartimentos subcelulares y la entrega citosólica ineficiente de ARNm in vivo3,9–11.
Primero, es importante destacar la necesidad de seleccionar un método de fabricación adaptado al reconocimiento inmunológico innato del ARNm. Karikó et al. 2005, identificaron la expresión de ciertos ribonucleósidos modificados que funcionaban como sensores inmunitarios discriminativos del ARN celular propio del extraño frente a los no modificados. En concreto, el reemplazo de la uridina con derivados naturales de la uridina (seudouridina [ψ] y sus derivados), son utilizados para atenuar la inflamación y facilitar la traducción. Las propiedades mecánicas mencionadas son esenciales para que el ARNm se mitigue o escape a la detección por parte de la mayoría de los sensores inmunitarios e imitar sus características microestructurales. Este avance tecnológico fue esencial para la creación de las vacunas de ARNm COVID-19 aprobadas, las uridinas son sustituidas con N1-metilseudouridina (m1ψ)3,4,12,13.
Por último, un requisito clave en la fabricación de vacunas COVID-19 es que sea biocompatible. Se debe elegir en función de la eficiencia de entrega del ARNm, la biodegrabilidad y la tolerabilidad para soportar la manipulación del cultivo celular y las actividades biológicas del huésped. Las vacunas ARNm-iLNP COVID-19 aprobadas utilizan lípidos ionizables (ALC-0315 en la vacuna de Pfizer/BioNTech y SM-102 en la vacuna de Moderna). Los iLNP se componen por: un lípido conjugado con polietilenglicol (PEG) que confiere estabilidad a la plataforma, colesterol, un aminolípido catiónico «ionizable» y 1,2-diestearoil-sn-glicero-3-fosfocolina3,14,15.
La tecnología iLNP, no solo posibilita la entrega de ARNm en las células inmunitarias innatas después de la vacunación, sino que desempeña un papel especial con una fuerte actividad adyuvante en este tipo de plataforma de vacunas. La principal característica del ARNm modificado con nucleósidos es su capacidad para no producir inflamación, las vacunas de ARNm-iLNP no son inmunosilenciosas, como se verifica en la fuerte activación inmune innata y en las notificaciones de eventos adversos locales y sistémicos posvacunales de COVID-19 en los humanos1,3,12,16–53. Esto cambiaría la comprensión del paradigma actual de las vacunas de ARNm de cómo activa el sistema inmunológico innato y plantea refinar el diseño para vacunas y tratamientos de ARNm más efectivos y seguros en un futuro próximo. La ventaja de las plataformas de ARNm-iLNP consiste en que no precisa la adición de adyuvantes para inducir respuestas inmunitarias protectoras sólidas contra varios patógenos1,3.
Es necesario comprender como funcionan los componentes del ARNm modificado con nucleósidos frente a los excipientes iLNP en la respuesta inmunitaria general de la nueva generación de vacunas de ARNm del COVID-19. Como se discutirá más adelante, el principal impulsor de la adyuvancia y reactogenicidad de las vacunas de ARNm-iLNP es el portador de iLNP. Activa una variedad de señales específicas que incluyen las citoquinas proinflamatorias y las quimiocinas. Por ejemplo, factor estimulante de colonias de granulocitos y macrófagos (GM-CSF); factor de necrosis tumoral (TNF); interferón-gamma (IFN-γ); interleucinas (IL): IL-1β, IL-6; quimiocinas CC, por ejemplo: ligando de quimiocinas con motivo CC 2, 3 y 4 (CCL2, CCL3, CCL4); motivo CXC ligando de quimiocina: 2 y 10 (CXCL2, CXCL10)3,15,16,54–57.
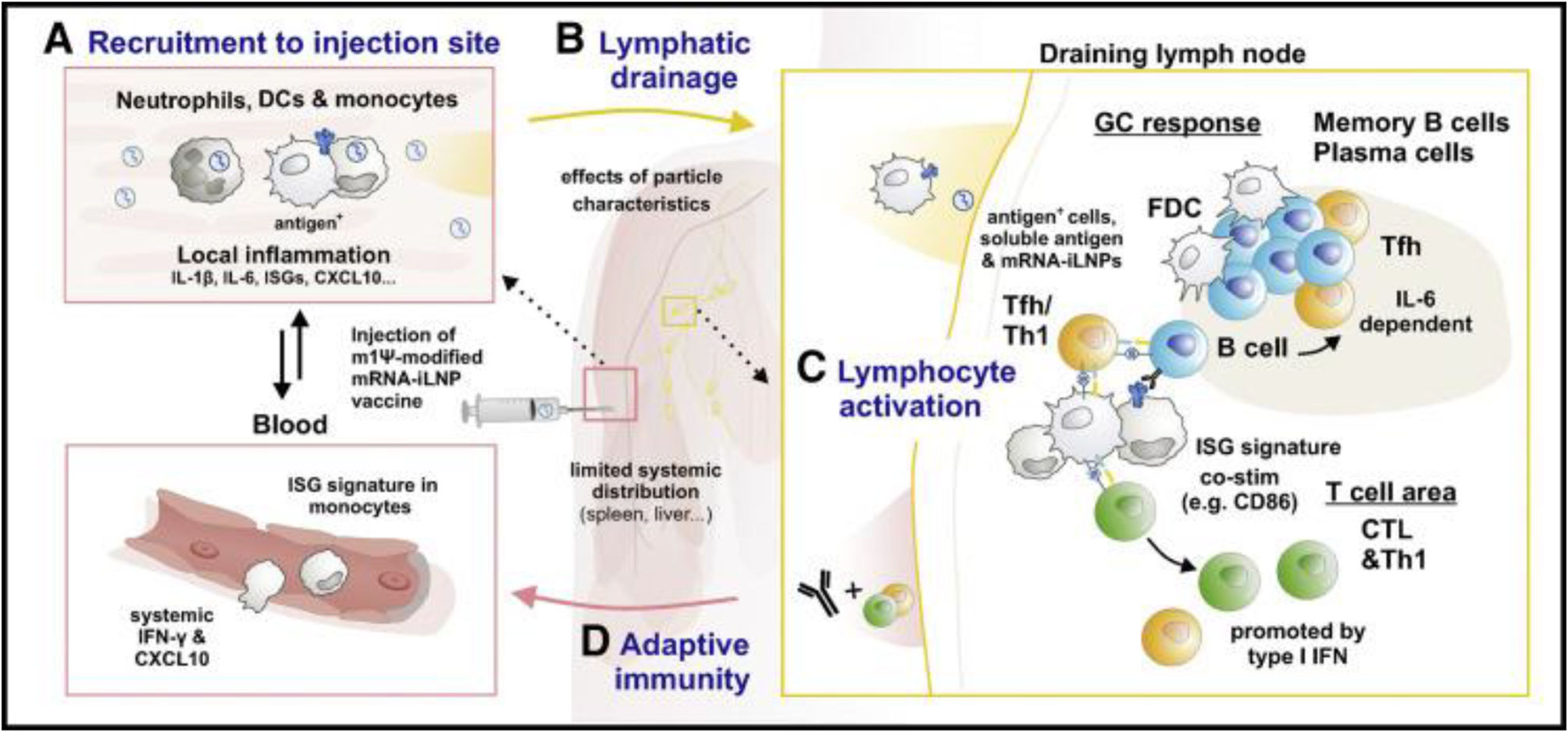
Farmacocinética de las vacunas ARNm-iLNP modificadas con nucleósidos. Biodistribución y dinámica de las células inmunitarias innatas tras la administración de vacunas ARNm-iLNPLas vacunas de ARNm-iLNP viajan en el cuerpo en función de la vía de administración y la formulación de iLNP. La administración intramuscular de las vacunas de ARNm de COVID-19 y otras vacunas de diseño similar resulta en la captación y producción del antígeno codificado en el sitio de la inoculación y el posterior drenaje en los ganglios linfáticos (GL). Además, se detectó una propagación limitada de ARNm y/o lípidos en otros tejidos no drenantes como los pulmones, el hígado, el bazo y los GL3,14,15,54. Verbeke R et al. 2022, identifican una biodistribución parecida en las vacunas de subunidades de proteínas adyuvantes3,58. En otros estudios muestran una seropositividad inferior de la proteína de pico de SARS-CoV-2 en el plasma de humanos y ratones que reciben la vacuna BNT162b2 de Pfizer, evidencian como la proteína de pico o su plantilla de ARNm (ARNm-iLNP o ARNm asociado a las células) se disemina sistemáticamente tras la inoculación intramuscular3,15,58–60. En la figura 1 se resumen los mecanismos de las células inmunitarias innatas después de la administración de vacunas ARNm-iLNP (biodistribución y dinámica).
Dinámica y biodistribución de células inmunitarias innatas tras la vacunación con ARNm-iLNP. A) Administración intramuscular de vacunas ARNm-iLNP modificadas con nucleósidos producen inflamación local, reclutamiento de neutrófilos, subconjuntos de células dentríticas (DC) y monocitos mediante la producción de quimiocinas y otros mediadores inflamatorios que participan en la extravasación de células inmunitarias. B) Expresión de antígenos. Los ARNm-iLNP se diseminan a los ganglios linfáticos y drenan. Biodistribución, captación celular y absorción de proteínas (opsonización), limitadas por las características de la superficie y el tamaño de las células inmunitarias innatas. C) Los monocitos/macrófagos y las DC participan en la expresión de antígenos y cebado de las células T. D) Inducción de la maduración por afinidad. Las células T auxiliares foliculares (Tfh) impulsan a las células B en las reacciones del centro germinal (GC) en presencia de DC foliculares. Disfunción en la señalización inflamatoria, por ejemplo: IL-6 reactiva por iLNP en la estimulación de respuestas de células B Tfh y GC, IFN tipo 1 induce respuestas CTL (linfocito T citotóxico). Verbeke et al. 20222,3,15,17,57.
Las proteínas producidas tras la inoculación de ARNm-iLNP tienen una aparición rápida. En estudios preclínicos, alcanzan el pico máximo de 4 a 24 horas tras la administración de la vacuna y disminuye progresivamente, pudiendo variar entre varios días, semanas o meses. Este proceso dependerá de la proteína codificada, la dosis de ARNm, la vía de administración de ARNm-iLNP y el tipo de iLNP3,13–15,25,35,43,59,61,62. Estas características no solo ofrecen una disponibilidad alta y mantenida de antígenos, sino que favorece respuestas de anticuerpos más sólidas, convirtiéndolas en soporte para las células adheridas y mejoran la supervivencia de la infiltración y diferenciación celular, favoreciendo la producción de proteínas a partir de la vacunación con ARNm en comparación con otras plataformas de vacunas. Por ejemplo, tanto el ARNm que codifica el pico como la proteína pico son detectables 60 días después de la segunda dosis de BNT162b2 y ARNm-1273 en humanos vacunados, localizados en los centros germinales (GC) axilares1,3,16,25,27,31,38,40,59,63,64.
La literatura sobre la dinámica de las interacciones proteína/iLNP para la diseminación linfática y celular es escasa, si se reconoce que la opsonización de ARNm-iLNP induce la detección y captación por parte de los receptores de las células inmunitarias innatas. Las vacunas de ARNm-iLNP modificadas con nucleósidos provocan respuestas de células auxiliares foliculares T (Tfh) y la creación de GC, esenciales para la generación de autoanticuerpos particulares, con alta afinidad y persistencia3,65. Verbeke R, et al. 2022, señalan una persistencia superior a los 6 meses tras la segunda dosis de ARNm con 30 μg, en los GL con drenaje en humanos, las células GC B y Tfh resultantes abocan en una generación de células B maduras por afinidad y células plasmáticas procedentes de médula ósea de larga vida. La versatilidad en los humanos de las vacunas ARNm de COVID-19 producen células Tfh circulantes específicas de antígeno, células T CD4+ con polarización T auxiliar 1 (Th1) y células T CD8+ productoras de IFN-γ, permaneciendo expresadas hasta 6 meses posvacunación1,3,15,66,67–71. Otro punto que se debe considerar es la fuerte inmunogenicidad asociada a la adición del adyuvante superficial de nanopartículas PEG que modifican la estructura topológica para prevenir la agregación de nanomateriales y facilitar la distribución en el sistema linfático, enlenteciendo la opsonización y su fagocitosis3,15,57. De acuerdo con esto, los lípidos PEG se desligan de los iLNP, para apoyar la unión entre las proteínas y los lípidos endógenos del espacio extracelular adquiriendo la conformación de una «corona» biomolecular alrededor del iLNP, incluyen varias lipoproteínas, inmunoglobulinas y fragmentos del complemento abundantes en sangre3,72–74. Otra alternativa sería que los neutrófilos compitan con otras células inmunitarias mediante la atracción de las vacunas de ARNm-iLNP al internalizarse eficientemente en el sitio de la inyección, pero demuestran una débil codificación de la proteína informadora. Por el contrario, los subconjuntos de monocitos y células dentríticas (DC) captan y traducen mejor ARNm-iLNP3,15,57,75.
En general, los grupos de células de macrófagos, monocitos y DC mieloides activadas son imprescindibles para la síntesis de la proteína codificada, el reconocimiento del ARNm-iLNP y la expresión de antígenos en el tejido linfoide para estimular la respuesta inmunitaria adaptativa. En estos estudios, los neutrófilos son prescindibles para las respuestas de las células B Tfh y GC en comparación con las frecuencias de monocitos y/o subconjuntos DC mieloides y macrófagos que aumentan en los GL con drenaje y expresan un mayor número de marcadores coestimuladores como el CD80 y CD86 equiparándolos con las células en los GL contralaterales sin drenaje3,60,76. Aún no se conocen bien los mecanismos de la captación de ARNm-iLNP por el sistema inmune innato ni sus parámetros fisicoquímicos como la composición de superficie, morfología y tamaño de los iLNP, que pueden condicionar la farmacocinética de estas vacunas.
Identificación inmunológica de ARNm modificado con nucleósidos y no modificadoLos métodos exactos de preparación del ARN (transcripción, protección y purificación) utilizados por Pfizer/BioNTech, Moderna y otras vacunas de ARN, no reportan mucha información pública, complicando la investigación en este campo. Investigan 3 formas de detección inmunitaria innata del ARNm sintético y son: 1) reconocimiento dependiente de la uridina derivado de un conjunto variado de especies de ARN68,77, 2) reconocimiento de ARN de doble cadena (dsARN)78–80 y 3) reconocimiento del extremo 5´ del ARNm si no se enmascara de forma completa3,81–83. La identificación de ARN compuesto de uridina se relaciona con una alta expresión de citoquinas proinflamatorias, especialmente el interferón tipo 1 (IFN-I), que demuestra una mayor afinidad para potenciar la expresión de los sensores de ARN, causando la inhibición de la presentación de antígenos del ARNm mediante la proteína cinasa R (PKR) y 2´- 5´- oligoadenilato sintetasa (OAS)3,4. La modificación de nucleósidos es necesaria para el éxito clínico y el despliegue generalizado de estas vacunas en la actualidad. Sin embargo, no está claro como la modificación de nucleósidos per se induce reacciones en las GC en comparación con el ARN no modificado. Verbeke R et al. 2022, diseñan varias hipótesis que no son mutuamente excluyentes: 1) La proteína del ARNm modificado se presenta con unos parámetros más altos y prolongados en el tiempo que el ARNm no modificado. Esto apoyaría las respuestas de las GC por la continua disponibilidad de antígenos en tiempo, confiriendo a la plataforma una mejor cinética3,64. 2) La principal diferencia entre el ARNm modificado y el ARNm no modificado no es (solo) la expresión general de la proteína, también la expresión diferencial de tipos clave de células presentadoras de antígenos (monocitos, macrófagos y DC). Estos tipos de células tienen una sensibilidad especial a los efectos inhibidores de la traducción del ARNm no modificado debido a la mayor expresión de los sensores de ARN, por ejemplo: los genes TLR7 y TLR8, dificultando una vía clave de preparación de las células T: presentación directa de antígenos traducidos a CD4+ y células T CD8+3,13,54,75,84, 3) la disfunción de las citoquinas provocada por ARNm-iLNP modificado produciría una reactogenicidad mayor, condicionando las respuestas de las GC en comparación con las respuestas inducidas por ARNm-iLNP no modificado3.
El ARNm no modificado también puede conseguir la expresión de proteínas y respuestas de anticuerpos neutralizantes, promoviendo así una fuerte expresión de antígenos e inmunogenicidad3,11. Esta teoría verifica la disminución de la inflamación producida por uridina tras la administración de ARNm. Sin embargo, la probabilidad de que provoque un ARNm inmunosilencioso es escasa, no se pueden eliminar todas las uridinas de la secuencia de ARNm. La alternativa podría ser la eliminación de la uridina de forma parcial1,3,6,17, esto explicaría las diferencias en la inmunogenicidad y reactogenicidad entre las vacunas contra el COVID-19.
Además, participa el ARNds (ARN no deseado) en el reconocimiento inmunitario innato «perjudicial». En el proceso de la transcripción in vitro (IVT) por la ARN polimerasa T7 crea el ARN deseado, pero también un conjunto de especies no deseadas, que incluyen transcripciones abortivas cortas. También produce ARN antisentido transcritos desde el extremo sin promovedor de la plantilla de ADN3,85. Con ello se refiere a que podría impulsar la creación de ARNds, conduciendo a una fuerte respuesta inflamatoria y a la disrupción en la traducción mediante la detección de múltiples receptores intracelulares: PKR, OAS, proteína asociada a la diferenciación de melanoma 5 (MDA-5), receptor tipo Toll 3 endosómico (TLR3), receptor citosólico gen I inducible por ácido retinoico (RIG-1), laboratorio de genética y fisiología 2 (LGP-2), proteína de señalización antivírica mitocondrial (MAVS), DEAH-box helicasa 33 (Homo sapiens, humano [DHX33]), etc., inician una respuesta de interferón al ARN monocatenario3,12,13,15,78,86. Los sensores de ARNds tienen un papel esencial en el bloqueo de la traducción, son los sensores citosólicos inducidos por IFN: OAS y PKR. Así mismo, se elaboran estructuras secundarias y terciarias de doble cadena dependiendo de la secuencia del ARNm3. Se puede afirmar que la preparación de la vacuna de ARNm implica la destrucción de cualquier ARNm terapéutico. Estas respuestas inmunitarias innatas nocivas pueden atenuarse químicamente mediante 2 procesos: primero, como se ha comentado, la adición de nucleósidos modificados como ψ, m1ψ y 5-metilcitidina para disminuir la activación de los sensores PKR y OAS. Posteriormente, la eliminación del ARNds del ARNm de IVT mediante otro tratamiento químico, se le conoce como purificación3,12,13. Por último, el método de protección cotranscripcional 5´ influye en la actividad de traducción y activación inmunitaria del ARNm de IVT3,83.
Actualmente, se reconoce la preparación modificada de las uridinas como un elemento necesario para lograr la eficacia clínica de las vacunas de ARNm de COVID-19 utilizados por Pfizer/BioNTech y Moderna. Desafortunadamente, tanto la capacidad inflamatoria del componente de ARNm como su traducción son alteradas por otros factores.
Actividad de los adyuvantes de las vacunas. Firma inflamatoria similar al COVID-persistente. Detección inmune innata de nanopartículas de lípidos ionizables (iLNP)Las nanopartículas de lípidos ionizables (iLNP) se usan como agentes de entrega, tanto los iLNP vacíos como los complejos ARNm-iLNP actúan como adyuvantes. El componente de lípido ionizable es necesario para el efecto adyuvante, solos no inducen respuestas sólidas de anticuerpos. Es importante señalar que las vacunas ARNm-iLNP y de proteína adyuvada con iLNP estimulan respuestas inmunitarias humorales y celulares parecidas en células Tfh y GC B, mucho más fuertes3,13,15,16,65. Se comienza a comprender la dinámica de actividad adyuvante de los iLNP y el medio inflamatorio que inducen. Tras la inmunización, en los GL de drenaje, tanto las plataformas de ARNm-iLNP modificadas con nucleósidos como los iLNP vacíos o iLNP compuestos por un ARN no codificante estimulan la producción de varias quimiocinas con motivo CC y CXC (CXCL1, CXCL2, CXCL5, CXCL10, CCL3, CCL4) y citoquinas IL-1β, IL-6, inhibidoras de la leucemia (LIF) y GM-CSF3,16,57. La producción rápida, eficiente y potente de estas señales inflamatorias demuestran la inducción de las células Tfh y las células GC B, así como el infiltrado de células inmunitarias en los tejidos inyectados3,56.
Los datos disponibles sobre la activación inmunitaria innata en humanos después de la administración de ARNm-iLNP son limitados, sin embargo, los estudios publicados hasta la actualidad coindicen con los reportes anteriores en animales. Indican una firma inflamatoria parecida en el suero de ratones tras la inoculación con BNT162b2: CXCL10, CCL4, IL-6, interferón alfa y gamma (IFN-α, IFN-γ)54. Li C et al. 2022, señalan como el IFN-I inducido por la vacuna y las firmas del gen estimulado por IFN (ISG) en un conjunto de tipos celulares que incluyen: monocitos, macrófagos, DC, células asesinas naturales (NK), logran su expresión máxima en el día uno y se recuperan el día 7, mientras las células NK y las células T expresan un aumento progresivo y continuo en la presentación de genes asociados con el ciclo celular y la transcripción (analizadas mediante perfiles transcripcionales de una sola célula en GL de drenaje). Comparan 6 horas después de la administración de la segunda dosis de la vacuna, la producción de IFN-γ sérico 8,6 veces mayor, promotor mayoritario de CD4+ y CD8+, equiparándose con 6 horas después de la primera dosis, cuando la mayor parte del IFN-γ deriva de las células NK3,54. No se conoce bien qué componente de la vacuna ARNm-iLNP es capaz de estimular los IFN tipo I. Afirman como la señalización de IFN-γ activa las células presentadoras de antígenos, pero, en esta condición, las DC plasmocitoides producen IFN-α únicamente cuando son expuestos a ARNm-iLNP y no a iLNP vacíos, esto refuerza la teoría de que el componente de ARNm es responsable para la inducción del IFN tipo I75.
En general, se observa una mayor concentración de IFN-γ, es decir, una disfunción inmunitaria general tras la vacunación, coincidiendo con las notificaciones de los efectos adversos después de las vacunas de ARNm COVID-19 aprobadas, principalmente para las reacciones sistémicas y teorizan que la activación mejorada de las células T y las células mieloides producen una diafonía entre los linfocitos y las células mieloides, promoviendo cambios epigenéticos en las células mieloides al aumentar su capacidad de respuesta a los futuros recuerdos vacunales y/o de infección por la enfermedad COVID-192,3,31,54,74,86–91. Sugieren que las vacunas ARNm-iLNP tienen efectos potenciadores persistentes en la inmunidad entrenada (células mieloides)3,60,91,92. Puede haber importantes diferencias dependientes de la especie en las respuestas inflamatorias que deben tenerse en cuenta al testar vacunas en modelos animales, incluidas la reactogenicidad, la fiebre y la inducción de otras citoquinas inflamatorias estimuladas por ARNm-iLNP. Se han detectado células mononucleares en sangre periférica humana (PBMC) tratadas in vitro con ARNm-iLNP modificado con m1ψ formulado con lípidos liberados SM-102: IL-β, IL-6, TNF, CCL5, factor endotelial vascular de crecimiento (VEGF-A), factor estimulante de colonias de granulocitos (GM-CSF) y otras moléculas, es necesario investigar este campo3,15,55. Plant-Hately AJ et al. 2022, observan la estimulación de basófilos en la generación y liberación de histamina dentro del sistema vascular50,57.
Las vías de señalización inmunitaria innata implicadas en el efecto adyuvante de iLNP son: 1) fosfolípidos oxidados o productos lipídicos metabolizados y/o modificados, por ejemplo: impurezas oxidativas de lípidos ionizables93; 2) colesterol y lípidos individuales, por ejemplo, lípidos ionizables16,56,57; 3) la nanopartícula completa u otras estructuras multimoleculares; 4) la unión de moléculas endógenas (proteínas de complemento o apolipoproteína (ApoE) a los iLNP después de la inoculación con la vacuna de ARNm, participan tanto en los mecanismos de detección como en la captación mediada por receptores procedentes de las células inmunitarias innatas; 5) por último, la presencia de un receptor celular, como un receptor de tipo Toll (TLR), que detecte concretamente a los iLNP3,13,15. Ciertos componentes de las vacunas como las LNP y los liposomas catiónicos son reconocidos por nucleótidos dominio de unión, TLR2, TLR4, el estimulador de genes de interferón (STING) y proteína 3 (incluye el dominio pirina repetido enriquecido en leucina [NLRP3])3,57,94–96. Por el contrario, Li et al. 2022 y Pichmair et al. 2009, sugieren que ciertos sensores de ácidos nucleicos y lípidos microbianos, además de los mediadores del inflamasoma, son prescindibles para una fuerte respuesta inmune a esta vacuna54,97. Por lo tanto, es posible que las vacunas contra el SARS-CoV-2 compuestas por vectores víricos (Vaxzevria de AstraZeneca y Janssen de Johnson & Johnson) y de subunidades proteicas (Nuvaxovid de Novavax) envíen señales inflamatorias más atenuadas o por otros mecanismos que contribuyen a la activación inmunitaria innata, no solo el ARNm encapsulado en nanopartículas lipídicas de Comirnaty BioNTech de Pfizer, Spikevax de Moderna y Curevac. Por ejemplo, Li et al. 2022, analizan la inmunogenicidad de la vacuna BNT162b2 (respuesta de las células T tipo CD8+ y anticuerpos), no se atenúa en ausencia de TLR2, TLR4, TLR5, TLR7, proteína 3 incluye el dominio pirina repetido enriquecido en leucina (NLRP3), proteína tipo mota asociada a apoptosis compuesta además por caspasa (CARD/ASC), GMP-AMP sintetasa clínica (cGAS) o el estimulador de genes de interferón (STING). Sugieren la posibilidad de que el ARNm (modificado con m1ψ y sin dsARN) o sus productos de degradación puedan ser detectados por los sensores citados que envían señales, apoyando la teoría de su función como adyuvante3,12,16,17,22,26–28,30,31,33,34,36,37,39,41–44,46–54,57,98.
Algunos de sus mecanismos se detallan a continuación:
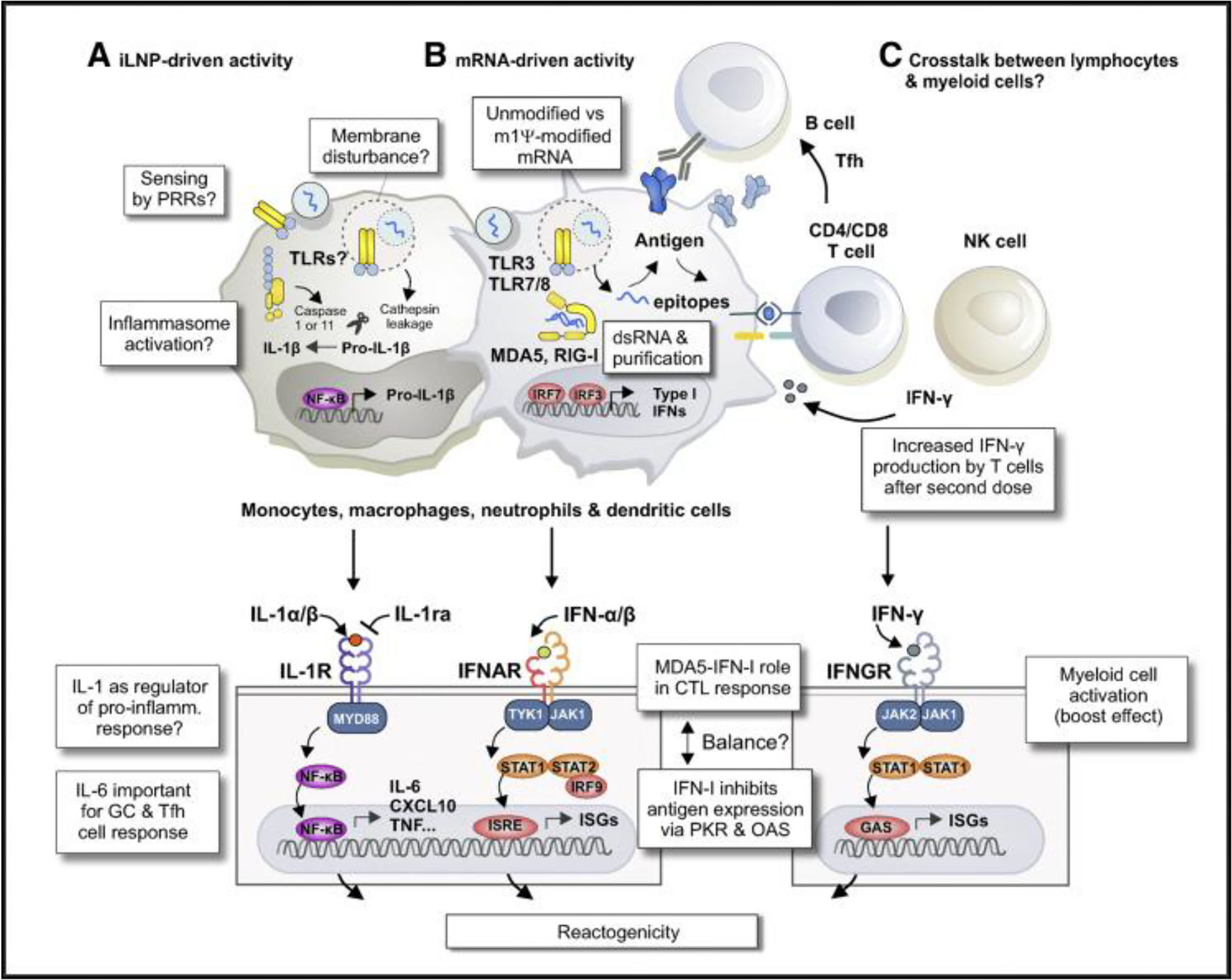
Como se mencionó anteriormente, un sensor particular es capaz de detectar directamente y/o indirectamente los iLNP o sus productos de degradación. Por ejemplo, Ndeupen et al. 2021, describen cómo un ARNm-iLNP de policitidina (no codificante) provoca la expresión de varios genes relacionados con la necroptosis, que desencadenan la liberación de ciertos patrones moleculares relacionados con el daño inflamatorio de células moribundas (DAMP)3,56. Recientemente, el estudio de Plant-Hately AJ et al. 2022, ha probado un importante mediador inmunorregulador proinflamatorio similar a la histamina, la IL-1β. Generalmente se estimula por exposición de las células inmunitarias a varios patrones moleculares asociados a microbios (MAMP) y patrones moleculares asociados a daños (DAMP) a través de inflamasomas como la NLRP3. Se ha demostrado que los liposomas que contienen el lípido catiónico ionizable SM-102 de Moderna puede inducir la liberación de IL-1β de las células sanguíneas periféricas, esto sugiere el reconocimiento de patrones intracelulares a través de un receptor como la NLRP357. También, es posible la detección de esta vacuna de ARNm asociada a las estructuras secundarias y terciarias de ARNm u otros elementos que participan en la preparación como: la eliminación incompleta de ARNds3. Otra vía de señalización inmunitaria innata es propuesta por Holm et al. 2012, consiste en la identificación de alteraciones en la membrana provocadas por la unión de iLNP con la membrana plasmática o endosomal (cambios morfológicos, parches de membrana catiónica, etc.)3,99. Los inflamasomas incluyen un conjunto de receptores de señalización de patrones y proteínas adaptadoras que responden a una variedad de señales de peligro. Por ejemplo, la citoquina IL-β1 tiene un potente efecto adyuvante de iLNP, es analizada comúnmente en PBMC, animales y humanos expuestos a iLNP vacíos y ARNm-iLNP3,54. Se podría demostrar que los iLNP están diseñados para ser fusogénicos y que logran penetrar la membrana endolisosomal hasta el citosol, una característica esencial de las infecciones víricas3. Verbeke et al. 2019, comparan la captación de ARN, capaz de mediar entre las respuestas inmunitarias innata y adaptativa en las infecciones víricas, además impide el papel terapéutico de las vacunas ARNm, obstaculizando el éxito clínico al eliminar la síntesis del antígeno codificado y causar reacciones adversas3,10,13. En la figura 2 se resumen los mecanismos de detección inmune innatos del ARNm sintético y su transporte lipídico.
Mecanismos inmunes innatos que participan en la inmunogenicidad y reactogenicidad de las vacunas ARNm-iLNP. A) Detección de iLNP vacíos por las células inmunitarias innatas y otros tipos producen inflamación local y sistémica, representada por la activación de citoquinas proinflamatorias como: IL-1β e IL-6. B) Preparación del ARNm sintético. Adición de uridinas modificadas y proceso de purificación del ARNm de IVT debilita la captación del ARNm de IVT por TLR3, TLR7, TLR8 y otros sensores del ARN. Estos cambios son necesarios para atenuar los efectos perjudiciales de los sensores de ARN estimulados por IFN tipo I sobre la expresión de proteínas del ARNm que codifica el antígeno y evitar citotocixidad. Vía de señalización asociada a la diferenciación de melanoma-interferón tipo α (MDA5-IFN-α) en la inducción de CTL a BNT162b2 en modelo animal con ratones indica actividad residual de IFN tipo I en la generación actual de vacunas de ARNm. C) Tras la inoculación de la segunda dosis de la vacuna, induce respuestas sólidas de las células T, relacionado con una producción mayor de IFN-γ. Activación mejorada de células T y mieloides después del refuerzo vacunal. Explica la diafonía entre los linfocitos y las células mieloides. Verbeke et al 20222,3,15,17,57.
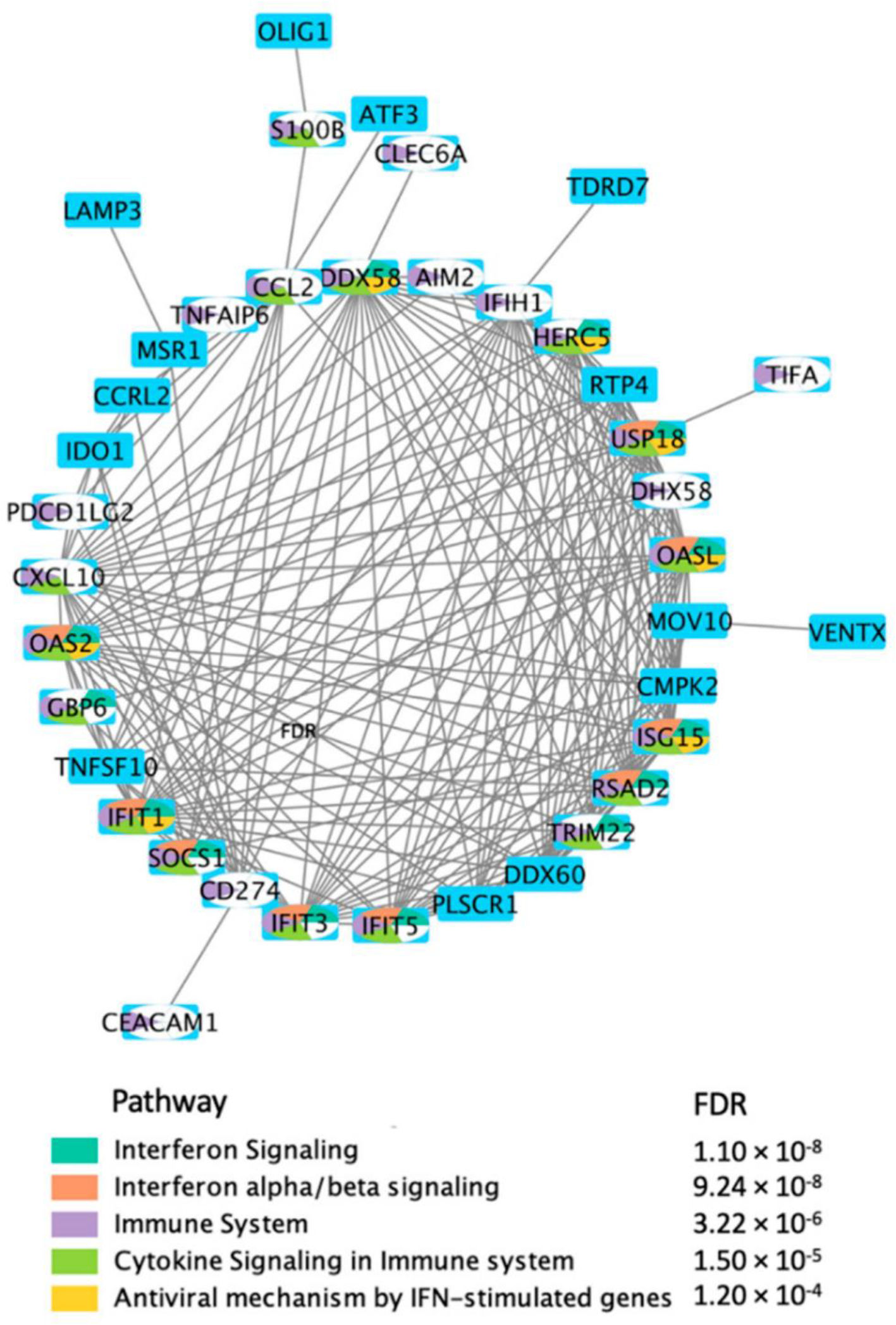
Red de interacción directa proteína: proteína (PPI) aplicando los DEG, en respuesta a la vacuna BNT162b2 el día 22. Hajio R. et al 2022156.
Szebeni et al. 2022, indican los adyuvantes adicionales como promotores del reconocimiento inmunitario y expresión de antígenos mediante la activación del complemento (CARPA), los efectos de depósito de antígenos y/o la capacidad de transporte que tienen los iLNP para entregar ARNm a tipos de células específicos o compartimentos subcelulares. Los lípidos y las nanopartículas basadas en lípidos inducen quimiocinas, mientras que los ácidos nucleicos terapéuticos (por ejemplo, ARNm) inducen respuestas interferón15.
Es necesario comprender los mecanismos moleculares por los que se detecta la firma inflamatoria inducida por las vacunas COVID-19, en particular el ARNm sintético y su transportador lipídico iLNP, facilitará la mejora del diseño de las próximas vacunas.
Eventos adversos graves posteriores a la vacunación. Teoría del mimetismo molecular-transcripción inversaAlgunos de los efectos adversos notificados de las vacunas COVID-19, pueden superponerse con manifestaciones reportadas durante el post-COVID-19 o COVID-19 prolongado, son: enfermedades neuroinmunológicas de nueva aparición (miastenia grave [MG], el síndrome de Guillain-Barré [SGB] o variante atípica «seudo Guillain-Barré», convulsiones), reactivación del virus varicela zóster, neuropatías craneales (neuritis vestibular, parálisis de Bell, parálisis del nervio abducente, disfunción olfativa, pérdida auditiva neurosensorial), neuromielitis óptica, mielitis transversa (TM), trastorno del espectro de neuromielitis óptica (NMOSD), mielitis transversa longitudinalmente extensa (LETM), encefalopatía aguda, encefalomielitis diseminada aguda (ADEM), vasculitis de pequeños vasos, narcolepsia, síndrome neuroléptico maligno (SNM), síndrome de fatiga crónica/encefalomielitis mialgica (SFC/EM); brotes o riesgo de conversión a esclerosis múltiple, miositis, disautonomía (POTS), cefaleas temporales (intermitentes o persistentes); deterioro cognitivo (los sujetos refieren pérdida o alteración de las funciones ejecutivas, de planificación, de memoria y léxico-semánticas); enfermedades autoinmunes hematológicas (trombocitopenia inmunitaria secundaria [ITP]), púrpura trombocitopénica trombótica inmunitaria (iTTP), anemia hemolítica autoinmune (AIHA), síndrome de Evans, anemia aplásica, síndrome antifosfolípido (SAF), SAF catastrófico (SAFC) y trombocitopenia trombótica inducida por vacuna (VITT); vasculitis (cutánea, vasculitis IgA, vasculitis asociada a ANCA, vasculitis de vasos grandes); complicaciones cerebrovasculares (trombosis del seno venoso cerebral, accidente cerebrovascular isquémico, ataques hemorrágicos); otras condiciones clínicas neurológicas raras (síndrome de Tolosa-Hunt, síndrome de Parsonage-Turner, neuropatía de fibras pequeñas) y trastorno neurológico funcional (FND); enfermedad glomerular (nefropatía por inmunoglobulina A [IgAN]); trastornos auditivos (tinnitus, pérdida progresiva sin remisión, vértigo con/sin nistagmo espontáneo y mareo); disbiosis intestinal; enfermedades cardiovasculares (miocarditis, pericarditis, perimiocarditis/miopericarditis, insuficiencia cardiaca, síndrome coronario agudo, arritmias, palpitaciones, inestabilidad hemodinámica y desregulación autonómica); alteraciones visuales (referidas como disminución de la agudeza visual, moscas volantes, destellos de luz, fotopsia, cortinas que obstruyen la visión, defectos de campo visual, manchas grisáceas o visión borrosa, proptosis, ojo rojo, dolor en el cuero cabelludo, oftalmoplejía, dolor retrobulbar, cefalea temporal, uveítis, neuritis óptica, etc.); neoplasias mieloides/linfoides; irregularidades del ciclo menstrual y resultados específicos del embarazo, incluyen datos maternos y fetales (abortos espontáneos, partos prematuros, enfermedades congénitas, tasas de mortalidad materna y neonatal); síndrome de respuesta inflamatoria sistémica (SIRS); reacciones alérgicas anafilácticas y anafilactoides (HSR de tipo III y IV, miocarditis eosinofílica necrosante fulminante fatal); trastornos cutáneos (síndrome de activación de macrófagos, eritemas sistémicos)1,12,16,23,24,26–39,41,42,44–53,100–106. Dichos efectos a largo plazo afectarán a la salud física y mental, interfiriendo con la actividad laboral, es por ello esencial identificar estos síntomas de manera inmediata y tratarlo en el menor tiempo posible, se debe evitar la evolución de estos efectos perniciosos y la condición de incapacidad que causan107,108. La patogenia de estos diagnósticos es principalmente neurológica, digestiva y cardiovascular, atribuible al mecanismo disfuncional desencadenado por la proteína S utilizada para la inmunización o durante la infección, que podría unirse al receptor neurovascular NRP-1 y antagonizar el acoplamiento de VEGF. También plantea el «efecto de pico», conocido como «intoxicación de pico» en el contexto de saturación y posterior deterioro de la función del receptor de la enzima convertidora de angiotensina II (ACE2)12,16,19,21,23,25–29,34,39–43,46,50–53,101,103,107,109,110. La tabla 1 resume la evidencia actual, que respalda las hipótesis sobre el mimetismo molecular, las señales inflamatorias atribuidas a la reactogenicidad postvacunal, su diseminación sistémica y la posibilidad de un «efecto acumulativo», es decir, la relación entre niveles elevados de anticuerpos (IgG anti-S, IgG anti RBD) posteriores a la vacunación y su persistencia temporal, que sugiere la imitación del post-COVID-19.
Mecanismos celulares y rutas patógeno/vírico, autoinflamatoria, autoinmune y paraneoplásica asociados a los efectos adversos en receptores de vacunas contra el COVID-19
| Mecanismos celulares e hipótesis asociadas a los eventos adversos graves posteriores a la vacunación | Mecanismos celulares | Asociación con los efectos adversos notificados de las vacunas COVID-19 | Referencias | ||
|---|---|---|---|---|---|
| TRANSCRIPCIÓN INVERSA | Aldén M et al. 2021, presentan el primer estudio sobre el efecto de la vacuna de ARNm de COVID-19 BNT162b2 en la línea celular de hígado humano Huh7 in vitro. Evidencian la entrada rápida de BNT162b2 en las células (6 horas después de la exposición a BNT162b2) y la posterior transcripción inversa intracelular de ARNm de BNT162b2 en ADN, indican un posible mecanismo para la transcripción inversa a través de la transcriptasa inversa endógena con el elemento nuclear intercalado largo de clase 1 (LINE-1) y la distribución de la proteína del núcleo de LINE-1 siendo elevada por BNT162b2 y conduciendo a una expresión robusta del antígeno BNT162b29 | Sugieren estudiar si las células hepáticas también presentan la proteína espiga del SARS-CoV-2 derivada de la vacuna, lo que podrían hacer que las células hepáticas sean objetivos para las células T citotóxicas reactivas a la proteína espiga previamente cebadas compatibles con los casos notificados de hepatitis autoinmunes tras la vacunación con BNT162b2En esta etapa de transcripción inversa, los autores muestran preocupación por el ADN derivado de BNT162b2 que se integra en el genoma del huésped y afecta a la integridad del ADN genómico, que provocaría la genotoxicidad9. En el informe de toxicidad de BNT162b2, no registran estudios de genotoxicidad ni de carcinogenicidad72, los autores señalan el desconocimiento de si el ADN transcrito de forma inversa a partir de BNT162b2 se integra en el genoma celular9 | Se necesitan más estudios que verifiquen el efecto de BNT162b2 en la integridad genómica, incluida la secuenciación del genoma completo de las células expuestas a BNT162b2 y los tejidos de los sujetos humanos que reciben la vacuna BNT162b2. También indican la expresión de LINE-1 endógeno y/o niveles elevados asociado con la infección vírica, incluye la infección por SAR-CoV-29. Se debe estudiar mejor la regulación exacta de la actividad LINE-1 en respuesta a BNT162b2 | El modelo celular que utilizan en este estudio es una línea celular de carcinoma con replicación de ADN activa que difiere de las células somáticas que no se dividen, muestran una expresión significativamente diferente entre proteínas y genes. Sin embargo, la proliferación celular también esta activa en varios tejidos humanos como: médula ósea, capas basales del epitelio y durante la embriogénesis. Además, informan la retrotransposición efectiva en células que no se dividen y diferenciadas terminalmente, como las neuronas humanas9. El informe de evaluación de Pfizer también mostró que BNT162b2 se disemina en el bazo, las glándulas suprarrenales, los ovarios y los testículos27. Por lo tanto, es necesario investigar el efecto de BNT162b2 sobre la integridad genómica en tales condiciones. No se disponen de datos sobre la transferencia placentaria de BNT162b2 en el informe de evaluación de Pfizer por la EMA | 9,27,72 |
| RESPUESTAS DE HIPERSENSIBILIDAD A LAS VACUNAS COVID-19 | En el estudio comentado anteriormente de Plant-Hately AJ et al. 2022, relacionado con los mecanismos celulares de los basófilos, han demostrado que las proteínas de la superficie celular (CD63, CD203c y CD164) aumentan durante la activación del sistema inmunitario en respuesta al reconocimiento de alérgenos111 | Es útil observar el nivel de expresión de los biomarcadores inflamatorios. En este caso, los 3 marcadores de activación de basófilos seleccionados exhiben patrones de expresión distintos entre sí que podrían no ser mutuamente excluyentes, sugieren varias rutas de activación. Estos mecanismos ocurren en los eosinófilos durante la granulación111 | - | - | 111 |
| Otro modelo útil en la evaluación de las respuestas de hipersensibilidad a las vacunas contra el SARS-CoV-2 basadas en ARNm lo desarrollan Szebeni J et al. 2022. Describen todos los componentes de las vacunas ARNm-iLNP (ARNm, portador, excipientes y antígeno expresado), tienen diversos efectos inmunoestimuladores sobre un gran espectro de células efectoras y células diana (células presentadoras de antígeno [APC], linfocitos T y B, plaquetas, células NK y miocitos) y, rutas bioquímicas (complemento y coagulación), todas son necesarias para lograr la eficacia de las vacunas. También, los mismos componentes contribuyen a las reacciones de hipersensibilidad (HSR) y otros tipos de efectos adversos inmunomediados (IMAE) por su amplia variabilidad interindividual tanto en calidad (espectro de mediadores inflamatorios) como en cantidad (productos de división del complemento, niveles de citoquinas, anticuerpos inducidos y/o preexistentes y triptasa)15 | La anafilaxia es un IMAE que pertenece a la categoría de hipersensibilidad de tipo inmediato (ITH) tipo I. La ITH clásica conduce a la liberación de mediadores preformados y sintetizados recientemente como: la histamina, la triptasa, interleucinas, prostaglandinas y leucotrienos, principalmente. Aunque las células inmunitarias activadas producen citoquinas durante la ITH y otros tipos de HSR, algunos autores separan la anafilaxia del síndrome de liberación de citoquinas, también destacan la función de los biomarcadores para definir los genotipos que subyacen a los diferentes fenotipos de la anafilaxia. Se conoce que la unión del mediador a los receptores celulares y tisulares producen síntomas sistémicos y locales que afectan a los sistemas respiratorio, gastrointestinal, tegumentario y cardiovascular1,2,15,16,35-39,41,42,45-53,82,86,88,110,112-114 | La anafilaxia puede suceder sin inmunoglobulina E (IgE) mediante receptores de proteínas acopladas a inmunoglobulinas G (IgG) ya descritas, por activación directa de mastocitos y/o basófilos y por activación del sistema complemento (reacción anafilactoide o seudoalergia CARPA). La escisión enzimática del complemento creará anafilatoxinas que funcionan como citoquinas y activan las células inmunitarias para estimular mediadores secundarios de la inflamación. Así mismo, las anafilatoxinas pueden activar los mastocitos, tanto las IgG como las inmunoglobulinas M (IgM) específicas de alérgenos participan en la activación del sistema del complemento1,2,15,41,42,48,50,52,82 | Las reacciones tardías notificadas por las vacunas COVID-19 sugieren HSR de tipos III y IV por su cronología de aparición y los síntomas, la mayoría han sido informadas en el contexto de IMAE a las vacunas contra el SARS-CoV-2, especialmente las de ARNm1,2,15,41,42,48,50,52,82.Se debe tener en cuenta la activación de los mastocitos a través de mecanismos IgE y no IgE, esta condición ocurre en personas con trastornos clonales y no clonales de los mastocitos, se incluyen: asma, mastocitosis, leucemia mielocítica aguda y síndrome mielodisplásico. Pueden presentar valores altos de proteasas (triptasas), histamina, heparina y citoquinas que se asocian con una fuerte activación de mastocitos. Se podría considerar que podrían desarrollar una predisposición mayor a tener HSR a las vacunas de ARNm de SARS-CoV-2 sin síntomas de anafilaxia, se requiere valorar el riesgo previa vacunación2,15 | 1,2,15,16,35-39,41,42,45-53,82,86,88,110,112-114 | |
| En otro estudio Yoshida M et al. 2023, confirman el riesgo potencial de experimentar más reacciones adversas tras la vacunación con BNT162b22,115 | Los autores sugieren que las personas con enfermedades alérgicas, como el asma, fiebre del heno, rinitis alérgica, dermatitis atópicas, alergias y/o intolerancias a los alimentos, que son potencialmente susceptibles al COVID-19, se asocian con el desarrollo de reacciones adversas sistémicas y un empeoramiento de sus enfermedades crónicas después de la vacunación con BNT162b2, siendo también un factor de riesgo para el shock anafiláctico y el HSR115 | - | - | 2,115 | |
| Granados Villalpando JM et al. 2022, concluyen que las vacunas BNT162b2 y ChAdOX1 nCOV-19 están fuertemente asociadas con la aparición de reacciones alérgicas, con OR de 1,6 (IC 95%; 1,18 a 2,3) y 1,87 (IC 95%; 1,35 a 2,6), respectivamente. También, relacionan una mayor probabilidad de desarrollar efectos adversos y/o reacciones alérgicas asociadas a las vacunas contra el COVID-19 con el sexo femenino, mayor edad y prevalencia de comorbilidades después de la vacunación e infección por COVID-19 tras la vacunación. Señalan una prevalencia significativamente alta de asma (7,8%) en este contexto, ya valorado en otros estudios75,116 | Otra variable a considerar consiste en la diversidad genética de la población humana y como induce la gran variabilidad interindividual en las respuestas de las citoquinas. Una dosis del mismo adyuvante inmunitario resulta en una respuesta óptima de citoquinas en un sujeto, que puede ser excesivamente fuerte o muy débil para otro sujeto. En resumen, las respuestas inmunitarias innatas y adaptativas varían entre personas debido a sus componentes celulares y bioquímicos. Además, la proteína del pico del SARS-CoV-2 contiene la secuencia y el motor estructural de un superantígeno, causante del síndrome hiperinflamatorio que participa en la estimulación directa de las células T y la hiperproducción de citoquinas en algunos sujetos1,2,12,15,16,20,24,26,28,29,31,35-39,41,44,45,47-52 | Estas citoquinas interactúan con los sistemas del complemento que además de producir la inflamación y la diafonía entre la inmunidad innata-adaptativa, activa el sistema de coagulación y aumenta la permeabilidad de la capa endotelial de manera dependiente en tiempo y dosis, promoviendo a su vez su diseminación a la circulación sistémica, que resulta en una inflamación elevada1,2,12,15,16,20,24,26,28,29,31,35–39,41,44,45,47–52 | De hecho, se sabe que la caída de la quimiocina de regulación por activación expresada y secretada por los linfocitos T (RANTES) aumenta el riesgo de eventos cardiovasculares en pacientes con arterioesclerosis. La baja concentración plasmática de RANTES puede reflejar su mayor depósito en el endotelio vascular de áreas con arteriosclerosis lo que a su vez conduce a un aumento de su receptor 5 de quimiocinas CC humano (CCR5) y empeora el daño orgánico por inflamación. Estos datos explicarían el reclutamiento de células T secretoras de IFN-gamma en la pared del vaso (confinadas a la adventicia y la íntima) y refuerzan la sugerencia de que puede ser un sitio de privilegio inmunológico, es decir, del reclutamiento, la retención y la infiltración de quimiocinas IP-10 y RANTES. El receptor CCR5 es un receptor acoplado a la proteína G (GPCR) que desempeña un papel importante en la inflamación y está involucrado en el cáncer, el VIH y el COVID-19117–119 | 1,2,12,15,16,20,24,26,28,29,31,35-39,41,44,45,47-52,75,116-119 | |
| ACTIVACIÓN DE LAS PLAQUETAS | Tanto el ARNm-LNP como la proteína espiga activan las plaquetas15,20,24,26–28,39,41,47–50,52 | En este estudio, se especifica la participación de las plaquetas en la inflamación, siendo propuesto como biomarcador de anafilaxia, CARPA y HSR por la liberación de moléculas biológicamente activas (ATP, tromboxano y quimiocinas) y moléculas inflamatorias lipídicas como el factor activador de plaquetas (PAF), que desencadena la desgranulación de los mastocitos perivasculares y la liberación de tromboxano y serotonina, también causantes de respuestas inflamatorias y lesiones tisulares15,20,24,26–28,39,41,47–50,52 | - | - | 15,20,24,26-28,39,41,47-50,52 |
| ESTRÉS OXIDATIVO | Otro estudio atribuye el estrés oxidativo a la toxicidad de algunos fármacos mediada por nanopartículas15 | Relacionado con la HSR, inhibe la regulación negativa del complemento e induciría las toxicidades mediadas por el complemento. Los individuos con inmunodeficiencia común variable (CVID) podrían desarrollar HSR a las vacunas de ARNm de SARS-CoV-2. También, discuten la variabilidad de los antígenos leucocitarios humanos (HLA) asociada a un mayor riesgo de reacciones mediadas por células T y de probabilidad de reacciones a las vacunas de ARNm contra el SARS-CoV-2 para la aparición de HSR1,15 | - | - | 1,15 |
| DIAFONÍA NEUROVASCULAR MEDIADA POR EL FACTOR DE CRECIMIENTO ENDOTELIAL VASCULAR (VEGF) E INDUCIDA POR LA PROTEÍNA ESPIGA DEL SARS-COV-2 | Se han informado efectos adversos neurológicos y cardiovasculares que simulan un COVID-19 prolongado en receptores de vacunas contra el COVID-191,12,16,21,24,26-28,30,34,35,37-39,41,42,44-47,49-52,103. El parecido clínico se debe al patógeno compartido de la proteína del pico (S) del SARS-CoV-2 utilizada para la inmunización y producida por el virus. El estudio de Talotta R 2022, describe el deterioro de la diafonía neurovascular mediada por el factor de crecimiento endotelial vascular (VEGF) inducida por la proteína espiga del SARS-CoV-2 asociado a los efectos secundarios de las vacunas contra el COVID-19 y su mediación en los síntomas prolongados del COVID-19107 | La proteína S puede unirse a la neuropilina 1 (NRP-1), que normalmente funciona como un correceptor para el factor A de crecimiento endotelial vascular (VEGF-A). Al antagonizar el acoplamiento de VEGF-A a NRP-1, la proteína S podría interrumpir las vías fisiológicas que participan en la angiogénesis y la nocicepción. La consecuencia sería el aumento de formas libres de VEGF que podrían unirse a otros receptores. Las personas vacunadas y/o infectadas con SARS-CoV-2 exhiben niveles plasmáticos elevados de VEGF durante la convalecencia y la enfermedad aguda, siendo responsable del daño neurológico y microvascular difuso. Señala otros estudios que sugieren que el VEGF sérico también puede ser un biomarcador potencial para las vacunas contra el COVID-19 y la infección prolongada en el tiempo1,16,107,22,104,27 | Requiere más investigación para comprender mejor el curso clínico, la patogenia y tratamiento de los efectos adversos tras la vacunación. Investigaciones recientes sugieren que los efectos adversos de las vacunas COVID-19 son el resultado de una endoteliopatía profunda causada tanto por daño vírico directo como por la hiperactivación de la respuesta inmune. Además de facilitar la entrada del virus, la proteína S del SARS-CoV-2 interfiere en la actividad fisiológica de unión de los receptores, por ejemplo: vías mediadas por el complejo NRP-1/VEGF-A, resultando en complicaciones disfuncionales y, por lo tanto, produciendo síntomas, incluso en ausencia de daño orgánico16,27,28,30,35,39,41,44-47,49,51,53,104,107,120 | Pero la evidencia a favor de este mecanismo es escasa dada la falta de datos experimentales | 1,12,16,21,22,24,26-28,30,34,35,37-39,41,42,44-47,49-53,103,104,107,120 |
| CALPROTECTINA, NIVELES DE TRAMPAS EXTRACELULARES DE NEUTRÓFILOS (NET) Y SINDECANOS COMO FACTORES PREDICTORES DE GRAVEDAD | Recientemente, el estudio de Hetland G et al. 2022, demuestran que los niveles de trampas extracelulares de neutrófilos (NET) se correlacionan con la gravedad de los efectos adversos de la vacuna ChAdOx1. La calprotectina, los NET y los sindecanos son marcadores inflamatorios clave con efectos fisiológicos que participan en la activación inmunitaria innata y en el daño del endotelio vascular, respectivamente. La calprotectina es la principal proteína citosólica en los granulocitos de neutrófilos, utilizada como marcador fecal sensible en enfermedades gastrointestinales, tiene propiedades antimicrobianas y citosólicas a través de la unión al cinc. Se le ha asociado como predictor del pronóstico grave en COVID-1946 | Los NET son redes de ADN rodeadas de histonas y proteínas granulares, son expulsadas de los neutrófilos para captar y destruir los patógenos invasores en el espacio extracelular. Han observado niveles elevados de NET en pos-COVID-19 y asocian la NETosis con la formación de trombosis en los pacientes con trombocitopenia trombótica inmune inducida por la vacuna (VITT). Los NET circulantes se eliminan de la sangre por ADNasas extracelulares que digieren el ADN libre. El sindecan-1 es un marcador de glucocáliz para el endotelio dañado en la vasculatura, se han demostrado niveles elevados de sindecan-1 en la enfermedad de COVID-1946 | Demuestran el daño y la disfunción del endotelio vascular como indicador pronóstico para el pos-COVID-19, en esta enfermedad se produce un efecto directo de la desregulación inmunitaria sobre el daño endotelial, como se ha comentado en este estudio, es una respuesta patológica esencial a la infección que en casos graves resulta en ciertos efectos secundarios de la vacunación46 | Por lo tanto, si los niveles elevados de NET y calprotectina pueden detectarse temprano después de la vacunación con ChAdOx1, estos biomarcadores pueden ser predictores útiles para identificar la gravedad de las reacciones adversas de las vacunas. Podrían usarse después de la vacunación con Janssen, que también es una vacuna de vector adenovírico con el potencial de causar VITT46 | 46 |
| PÉRDIDA DE LA ACTIVIDAD DEL RECEPTOR ACE2 | Angelini F et al. 2022, señalan que las proteínas Spike producidas tras la vacunación tienen el mimetismo nativo de la funcionalidad de unión al receptor y la estructura de prefusión de la proteína Spike del SARS-CoV-2. Las vacunas contra el COVID-19 aumentan la síntesis endógena de proteínas de punta del SARS-CoV-2. Una vez sintetizadas, las proteínas de punta flotantes liberadas por las células destruidas previamente atacadas por las vacunas circulan en la sangre e interactúan con receptores ACE2 (una metaloproteinasa de cinc) de otras células, lo que promueve la internalización y degradación del ACE2, imitando a las características patológicas del SARS-CoV-2121 | Este mecanismo puede aumentar el desequilibrio entre la hiperactividad de la angiotensina II (Ang II) y la deficiencia de Ang1-7 mediante la pérdida de la actividad del receptor ACE2, desencadenando la inflamación, la trombosis, el aumento de la presión arterial y otras reacciones adversas, es el mecanismo conocido como «efecto de pico» de las vacunas COVID-19. También, los efectos perjudiciales de la deficiencia de otras angiotensinas (propil oligopeptidasa [POP] y propil carboxipeptidasas [PRCP]) sobre la presión arterial, la trombosis y la inflamación están bien estudiados121,101 | Los autores comparan las relaciones entre los diferentes mecanismos de escisión y acumulación de Ang II ofreciendo la posibilidad de cerrar el ciclo fisiopatológico entre el riesgo de progresión a formas graves de COVID-19 y reacciones adversas de la vacunación contra el SARS-CoV-2101,121 | La hipótesis de la pérdida de las actividades de la ACE2 debido a la interacción entre estos receptores y las proteínas Spike que circulan libres se puede observar en todos los estados de la progresión de la enfermedad cardiovascular. Añaden que el aumento de la actividad catalítica de POP y PRCP no es común en la población joven, si es más frecuente en ancianos con comorbilidades o episodios cardiovasculares previos. Por ello, las reacciones adversas informadas con acumulación de Ang II asociadas a la vacunación contra el COVID-19 serán más propensas en afectados jóvenes y previamente sanos101,121 | 101,121 |
| NEUROINVASIÓN Y DIAFONÍA NEUROINMUNE COMO INDUCTORES DE LOS SÍNTOMAS NEUROLÓGICOS PRODUCIDOS POR LA VACUNACIÓN CONTRA EL SARS-CoV-2 | En el estudio comentado anteriormente de Talotta R, 2022 se detalla la diafonía fisiopatológica entre NRP y VEGF, refleja la interconexión entre vasos y nervios desde una perspectiva tanto funcional como anatómica, se ha estudiado ampliamente en la progresión tumoral y la invasividad de varios tipos de cáncer debido a los efectos mitogénicos de VEGF en la sobreexpresión NRP-1 sobre células malignas y en lesiones de esclerosis múltiple43,107,122,123 | La actividad deteriorada de NRP-1 puede causar síntomas neurológicos disfuncionales, se expresan en una variedad de células como las células endoteliales, neuronas, células gliales y células inmunitarias. NRP-1 interviene en la proliferación celular, la migración, la supervivencia y la invasión durante la embriogénesis y la carcinogénesis. Está implicada en la formación de sinapsis inmunológicas, la diferenciación de células B y la inmunotolerancia18,91,107,124,125 | El VEGF-A está directamente relacionado con la inflamación sistémica. Las neuropilinas 1 y 2 (NRP-1, NRP-2) actúan como correceptores facilitando la unión de VEGF-A al receptor 2 de VEGF (VEGF-R2) en los vasos sanguíneos y la unión del factor C de VEGF (VEGF-C) al receptor 3 de VEGF (VEGF-R3) en los vasos linfáticos, respectivamente107,125-128. La actividad fisiológica de NRP-2 está menos estudiada, este receptor puede unirse a otros tipos de ligandos de semaforina y VEGF y participar en el desarrollo del sistema linfático durante la embriogénesis. NRP-2 controla funciones como la fagocitosis, quimiotaxis y presentación de antígenos, por ser abundante en las células inmunitarias107,129,130 | La autora describe una única ruta para la patogenia de la vía NRP-1/VEGF-A, la entrada dependiente de NRP-1 para el virus linfotrópico de células T humanas tipo 1(HTLV-1), un retrovirus humano capaz de infectar linfocitos T CD4+ y CD8+, monocitos-macrófagos y DC. La infección causa trastornos linfoproliferativos, inflamatorios y/o neuromielopatías, incluye alteración neuroinflamatoria con disrupción de la barrera hematoencefálica, lo que quizás explique el desarrollo de los efectos adversos citados1,16,33-39,41,45,51,114,122,123,131. Además, igual que otras infecciones víricas las variaciones del VEGF-A producen cambios en los valores de los mediadores proinflamatorios circulantes, como el factor de necrosis tumoral alfa (TNF-α), IL-1β, IL-6, IL-8, proteína quimiotáctica de monocitos 1 (MCP-1, también conocida como ligando de quimiocinas 2 [CCL2]) y proteína 10 inducibles por IFN-γ (IP-10). La identificación de VEGF-A en muestras de plasma mediría de forma precisa las concentraciones reales de este mediador en sangre periférica, se conoce que la concentración de VEGF en las muestras de suero podrían alterarse por el número de plaquetas, las plaquetas son la fuente motora de VEGF-A3,107,112,127 | 1,3,16,18,33-39,41,43,45,51,91,107,112,114,122-131 |
| Chen F, et al. 2022 proponen la neuroinvasión y la diafonía neuroinmune como inductores de los síntomas neurológicos producidos por la vacunación contra el SARS-CoV-2. Por una parte, el patógeno compartido del SARS-CoV-2 puede infectar el cerebro directamente, mediante propagación hematógena y el transporte axonal retrógrado, exceptuando la vía de la neurona olfativa. Por otra parte, puede inducir neurotoxicidad indirecta a través de la patogenia inmunomediada y la infección gastrointestinal132 | Indican 13 casos de SGB clásico asociados a la vacunación, con un compromiso pulmonar leve y pruebas de SARS-CoV-2 negativas en líquido cefalorraquídeo. Concluyen que no todos los síntomas neurológicos requieren la infección directa del sistema nervioso, puede producirse la neurotoxicidad indirecta secundaria a la patogenia inmunomediada. También informan de la unión de los autoanticuerpos a las células endoteliales y epiteliales, que podrían producir algunas de las lisis celulares107,132 | De forma parecida, en pacientes con pos-COVID-19 por infección, los anticuerpos contra el virus pueden atacar los antígenos de las células endoteliales en los vasos cerebrales. La infección gastrointestinal amenaza también el sistema nervioso, debido a que aumenta el transporte de proteínas aberrantes como la alfa-sinucleína (α-sinucleína), asociadas a enfermedades neurodegenerativas 132 | Destacan la importancia del agravamiento del daño cerebral producido por la lesión nerviosa que conduce a un flujo sanguíneo intestinal anormal y dismotilidad intestinal, esto promueve una mayor entrada de metabolitos y componentes bacterianos en la sangre y el parénquima cerebral132 | 107,132 | |
| SISTEMA OREXINÉRGICO. ASOCIACIÓN ENTRE DESEQUILIBRIO REDOX, INFLAMACIÓN Y METABOLISMO ENERGÉTICO | Garrido Suárez BB, et al. 2022, postulan la hipótesis sobre el sistema orexinérgico (Ox) vinculado a las señales inflamatorias, concretamente su implicación en la somnoliencia reactogénica tras la activación periférica del sistema inmunológico innato por las vacunas COVID-19. Alertan su consideración por parte de farmacovigilancia y, una mayor comprensión de los posibles mecanismos inflamatorios a largo plazo adicionales en futuros estudios para preservar la confianza en estas vacunas. Son necesarias más investigaciones que identifiquen biomarcadores vinculados a la reactogenicidad de las vacunas COVID-19, permitirán una mejor comprensión de su inmunogenicidad133 | Sugieren la asociación mecánica entre los parámetros inflamatorios reactogénicos y los circuitos hipotalámicos que regulan el ciclo sueño-vigilia. Proponen que las citoquinas proinflamatorias INF-γ, TNF-α e IL-1β propagan una respuesta inflamatoria periférica tras la inoculación, a su vez, activa un subconjunto de neuronas gabaérgicas que expresan a través del área hipotalámica lateral el neuropéptido neurotensina (LHA Nts) perifornical, así como neuronas inhibidoras de áreas que inducen el sueño proporcionando una entrada inhibidora en las neuronas Ox que desencadenan la vigilia. Posibilitaría su implicación en la modulación adenosinérgica de las señales de sueño-vigilia133,134. En este caso, la inmunidad y el sueño están relacionados bidireccionalmente, pero los mecanismos celulares y moleculares que interfieren en estas interacciones son ilimitados y aún no se conocen en profundidad | Informan en algunos casos, como efecto adverso secundario moderado a la vacunación somnolencia, narcolepsia u otros trastornos del sueño (déficit de sueño prolongado), notificados más en la vacunación con Pfizer-BioNTech COVID-19. La deficiencia de sueño prolongado puede abocar en una inflamación sistémica crónica de bajo grado, asociada con varias enfermedades que comparten un componente inflamatorio (neurodegeneración, cáncer, diabetes y ateroesclerosis)12 | Esto indicaría que la vacuna es eficaz porque puede producir memoria inmunológica, en respuesta a la activación inmunitaria aguda. El efecto modulador del sueño es causado por los componentes y productos de descomposición de los patógenos, incluyen los patrones moleculares asociados a patógenos PAMP (endotoxinas), péptidos, lípidos y ARN vírico de doble cadena comentados anteriormente. Estos factores se reconocen en macrófagos o células dentríticas residentes en varios tejidos, así como, en las vías posteriores como el factor nuclear potenciador de las cadenas ligeras kappa de células B activadas (NF-κB), controla la transcripción y los inflamasomas, que favorecen la expresión de citoquinas y prostaglandinas. Reconocen los antígenos vacunales como patógenos potenciales causantes de las reacciones autoinmunes por los mecanismos del mimetismo molecular y la activación de células T, ameritan una mayor investigación1,2,12,13,16,24,26-29,31,35-39,41,44,47,48,50-53,105,135 | 1,2,12,13,16,24,26-29,31,35-39,41,44,47,48,50-53,105,133-135 |
| Otros mediadores involucrados en las bases neurobiológicas y la regulación del sueño son: hormonas del eje hipotálamo-pituitario-suprarrenal (HPA), neuropéptidos como la orexina, hormona de la melatonina y neurotransmisores clásicos (ácido γ-aminobutírico [GABA], glutamato, serotonina, acetilcolina, histamina, noradrenalina y dopamina). Estas moléculas sufren un desequilibrio en la interacción funcional entre el sistema inmunitario y el sistema nervioso135,136 | Además, las proyecciones densas de las neuronas Ox en regiones espinales, diencefálicas y corticales participan en la regulación de diversas funciones fisiológicas. Por ello, las neuronas Ox no solo modulan la alimentación, el metabolismo energético y el ciclo sueño-vigilia, sino que regulan directamente el control cardiovascular, la cognición y el estado del ánimo, la nocicepción, la reproducción, el estrés, la recompensa y la adicción18 | Estudios recientes verifican la coexpresión elevada del receptor de leptina (LepRb) en algunas subpoblaciones de neuronas Ox, que son activadas por la hormona leptina derivada del tejido adiposo137, también especifican la funcionalidad de la galanina (GAL) como un potencial mediador de la leptina para modular la recompensa de nutrientes al inhibir las neuronas de orexina mediante el receptor 1 de GAL (GalR1)138. Especulan que tras la vacunación con vacunas COVID-19, las citoquinas proinflamatorias provocan una respuesta inflamatoria al hipotálamo que causa los trastornos del sueño mediante 2 vías: la leptina, tiene propiedades proinflamatorias y regula al alza la secreción de múltiples citoquinas inflamatorias; por otro lado, el subconjunto de neuronas promotoras del sueño gabaérgicas. En ambos casos, la acción de las citoquinas proinflamatorias cerebrales puede estar mediada por las prostaglandinas o el óxido nítrico producido en las células endoteliales de vasos sanguíneos cerebrales y macrófagos perivasculares133 | Otro biomarcador potencial es la mieloperoxidasa (MPO), es una enzima proinflamatoria que desencadena estrés oxidativo y neuroinflamación cerebral durante las fases agudas y crónicas del COVID-19. El estrés oxidativo de la MPO se produce al promover la producción de especies reactivas de oxígeno y de nitrógeno, lo que a su vez provoca daño en los pulmones (hipoxia crónica) causando algunos de los síntomas que se observan en los efectos adversos de las vacunas COVID-19 y en el COVID-persistente. A su vez, el daño que provoca este factor sobre la barrera hematoencefálica acarrea neuroinflamación, por activación de la microglía, también conduce a una caída de la perfusión cerebral que genera entre otros síntomas típicos, la fatiga crónica y la confusión mental86,139,140 | 18,86,133,135-140 | |
| BIOMARCADORES POTENCIALES QUE AUMENTAN LA VULNERABILIDAD NEUROVASCULAR, CARDIOVASCULAR, HEPÁTICA (DAÑO HEPATOCELULAR) E INFLAMACIÓN DE LA MUCOSA INTESTINAL CON DISFUNCIÓN DEL SISTEMA INMUNE REGIONAL Y NEURO/MIOENTÉRICO | Se han estudiado otros biomarcadores potenciales que podrían proponerse para investigar los efectos adversos de las vacunas COVID-19. El factor de diferenciación de crecimiento 11 (GDF-11) se expresa en varios órganos y tejidos, incluidos el músculo esquelético, el intestino, el páncreas, el corazón, el sistema nervioso, el sistema olfativo, la retina y los riñones. También está altamente concentrado en las plaquetas135,141,142. Se ha demostrado que la baja concentración plasmática de este factor bioprotector se asocia al envejecimiento en ratones que pierden sus acciones informadas para promover la regeneración del músculo esquelético, disfunción muscular141,143. Los hallazgos de estudios posteriores muestran que GDF-11 puede causar atrofia del músculo esquelético en lugar de regeneración13,141,144 | Sin embargo, en humanos, los resultados relacionados con los niveles plasmáticos circulantes son variantes, muestran una disminución, aumento/tendencia al aumento o ningún cambio con el envejecimiento141,135,136,145. La caída de los niveles plasmáticos del GDF-11 en el contexto de los efectos adversos de las vacunas COVID-19 podrían contribuir a la mialgia y la fatiga crónica/astenia o síntomas referidos como fibromialgia de componente funcional en los pacientes, algunos son notificados por los sistemas de farmacovigilancia, como la encefalomielitis mialgica/síndrome de fatiga crónica (EM/SFC). Aunque primero habría que descartar el que los síntomas de mialgia (dolor muscular sin niveles elevados de creatin-fosfocinasa) no estén causados por tratamiento con estatinas (hasta el 10% de los pacientes tratados con estatinas tienen mialgias)141 | Por lo tanto, el factor GDF-11 podrían estar involucrado en el metabolismo, la regulación de la inflamación y es posible su participación en la fisiopatología de la tiroides141. Recientemente, ha sido validado como un gen objetivo regulado a la baja por Reference microARN (miRNA) y los genes objetivo YAE1 y RSU1 por la variante Delta del SARS-CoV-2, es un predictor diagnóstico a través del conjunto de datos de genes expresados diferencialmente (DEG)58,146. La caída en los niveles plasmáticos del factor de crecimiento fibroblástico 21 (FGF21) contribuye a una intolerancia a la glucosa, niveles más elevados de insulina en sangre y al desarrollo de hígado graso. FGF21 promueve la pérdida de peso a través de un aumento en la oxidación de los ácidos grasos y disminuye la trigliceridemia y la glucemia al mejorar la sensibilidad a la insulina. Este péptido funciona como una hormona con efectos antiinflamatorios, antidiabéticos y contra la obesidad. Se produce en el hígado, tejido adiposo, músculo esquelético y páncreas, aunque su acción endocrina depende sobre todo del hígado. El FGF21 se induce en situaciones de estrés muscular, particularmente en miopatías mitocondriales58 | La caída de ambos factores podrían aumentar la vulnerabilidad neurovascular, cardiovascular y hepática (daño hepatocelular), conduciendo al daño e inflamación de la mucosa intestinal y a una disfunción del sistema inmune regional y neuro/mioentérica. Los trastornos notificados por los sistemas de farmacovigilancia sugieren la persistencia en el tiempo de estos síntomas y son experimentados como: trastornos gastrointestinales (dismotilidad intestinal, inflamación y dolor abdominal, dispepsias), dolores musculoesqueléticos (mialgias), deterioro cognitivo (dificultad para concentrarse, pérdida de memoria, de funciones ejecutivas y de funciones léxico-semánticas), cefaleas, trastornos del sueño y una fatiga crónica incapacitante 1,16,42,49,51,58,141,146La asociación entre el desequilibrio redox, la inflamación y el metabolismo energético debe ser un objetivo inaplazable del plan terapéutico | 1,13,16,42,49,51,58,135,136,141-146 |
| DISFUNCIÓN ENTRE LA BARRERA INTESTINAL Y EL SISTEMA INMUNOLÓGICO | Los datos de estudios clínicos en modelos animales señalan que la composición de la microbiota intestinal tiene un papel esencial en la modulación de las respuestas inmunitarias a las vacunas, pero los mecanismos por los que la microbiota intestinal modula la inmunogenicidad a diferentes vacunas en diversas poblaciones son poco conocidos. Sugieren la adición de adyuvantes naturales para mejorar las respuestas a la vacunación147-149. La barrera intestinal juega un rol en la protección de los tejidos de la capa mucosa intestinal y el sistema circulatorio frente a la exposición a moléculas proinflamatorias, tales como microorganismos, toxinas, antígenos y es vital para el mantenimiento de la salud y el bienestar. La disfunción de la barrera intestinal ha sido implicada en numerosas enfermedades como: alergias alimentarias, infecciones microbianas, síndrome del intestino irritable, enfermedad inflamatoria intestinal, enfermedad celiaca, síndrome metabólico, enfermedad del hígado graso no-alcohólico, diabetes y choque séptico96,148,150,151 | En las muestras estudiadas la disminución de las bacterias thetaiotaomicron y cellulosilyticus es muy negativa para mantener la integridad de la pared intestinal (homeostasia intestinal), lo cual favorece un aumento de la permeabilidad intestinal por un deterioro de las uniones estrechas, lo que permite el paso del contenido intestinal al torrente sanguíneo, con sus graves consecuencias como son: aumento de la carga tóxica hepática y aumento de la carga antigénica entre otros148-150. Ng SC et al. 2022, describen la composición de la microbiota intestinal mediante secuenciación metagenómica de escopeta en muestras de heces de 138 vacunados (37 con CoronaVac y 101 con BNT162b2) en relación con las respuestas inmunitarias y los efectos adversos en adultos que recibieron vacuna inactivada CoronaVac y la vacuna de ARNm BNT162b2 BioNTech de Pfizer Comirnaty147 | Observan tanto los niveles de anticuerpos Spike como los de anticuerpos neutralizantes un mes después de la primera y segunda dosis con Pfizer correlacionados positivamente con la eficacia de la vacuna de ARNm. Sugieren una evaluación longitudinal del perfil de la microbiota intestinal y la respuesta de anticuerpos a largo plazo (mayor a un mes) tras las inoculaciones. Este estudio refuerza la teoría de la respuesta inmune a la vacuna en el contexto de la HSR1,147. La microbiota bacteriana con función protectora proporciona el microambiente que impide que haya un sobrecrecimiento de bacterias proteolíticas y de patógenos. El equilibrio entre las especies bacterianas residentes confiere estabilidad al conjunto de la población microbiana. El efecto de barrera se debe a la capacidad de ciertas bacterias para segregar sustancias antimicrobianas (bacteriocinas), que inhiben la proliferación de otras bacterias y también a la competición entre bacterias por los recursos del sistema, ya sea nutrientes o espacios ecológicos149,150 | Bifidobacterium adolescentis cuando es abundante, suele deberse al uso de probióticos de dicha especie bacteriana. Los probióticos deberían ser utilizados siempre bajo la supervisión de un facultativo. Se han descrito algunos experimentos donde los metabolitos proteicos de Bifidobacterium adolescentis podrían generar hepatotoxicidad en las células de origen humano (THLE-2). Por ello, sería recomendable llevar un control mediante marcadores hepáticos148–151Bacteroide thetaiotaomicron degrada los polisacáridos vegetales esenciales para el intestino humano, estimula la angiogénesis en el intestino. También media en la formación de la barrera mucosa intestinal, que protege de la invasión de patógenos a través de la regulación de la expresión de proteínas antibióticas específicas de la especie150,151 | 1,96,147-151 |
| Los géneros Bifidobacterium, Enterococcus y Lactobacillus forman parte de la microbiota asociada a la mucosa y cumplen un papel importante en la función protectora y de contención de patógenos. Los bajos niveles de estos géneros pueden comprometer su función151. Las Bifidobacterias reducen los niveles de lipopolisacáridos intestinales (LPS), disminuyen los niveles de citoquinas proinflamatorias, mejoran la motilidad intestinal y pueden reducir el estado inflamatorio. Cuando su abundancia está disminuida complica este funcionamiento149,151. El género Enterococcus son bacterias del ácido láctico (LAB) miembros de la flora comensal del colon humano. Los Enterococcus pueden producir bacteriocinas, compuestos antimicrobianos, que limitan la proliferación de patógenos, aunque pueden actuar como patógenos en determinadas enfermedades. Las Enterobacteriaceae tienen la capacidad de secretar LPS, que pueden actuar como una endotoxina, aumentando la inflamación en el intestino.149,151Collinsella aerofaciens a niveles fisiológicos es capaz de desconjugar los ácidos biliares y esta capacidad de modificar los ácidos biliares permite modular la virulencia y patogenicidad de patógenos entéricos. Los ácidos biliares en condiciones fisiológicas se relacionan con procesos inflamatorios y carcinogénesis del aparato digestivo147 | Las bacterias del género Streptomyces (filo Actinobacteria) se pueden encontrar tanto en el suelo como en el intestino. Aunque hay especies patógenas, también es verdad que producen compuestos antiproliferativos, antiinflamatorios, inmunosupresores y antibióticos. Estas sustancias son buenos aliados contra la alergia y la autoinmunidad, así como contra las enfermedades inflamatorias del intestino151. El estudio de Ng SC et al. 2022 sugiere la pérdida de la mucosa intestinal y la alteración de esta microbiota inmunomoduladora, también posibilitan que en el tracto intestinal se estén produciendo procesos inflamatorios de forma continua en el tiempo, y pueden darse situaciones de permeabilidad intestinal, en condiciones de un ecosistema alterado (disbiosis intestinal) y de darse determinadas enfermedades. Cuando los niveles son elevados en la muestra, posiblemente estén produciendo una serie notablemente compleja de neurotoxinas proinflamatorias que incluyen lipopolisacáridos de superficie (BF-LPS) y péptidos proteolíticos tóxicos y citoquinas proinflamatorias. Los factores liberados por las células epiteliales intestinales (IEC), como el ácido retinoico (RA) y el factor de crecimiento transformante beta (TGF-β), promueven el desarrollo en la lámina propia de células presentadoras de antígenos (APC), tanto las DC como macrófagos, con propiedades tolerogénicas149,151 | Las APC estimuladas por señales, como la flagelina, liberan IL-23 que, además, promueve la expresión de IL-22 por parte de los linfocitos innatos tipo 3 (ILC3). IL-22 estimula la producción de RegIIIγ, un producto del antimicrobiano-péptidos (AMP) producido por IEC, que se retiene en la capa de moco. Los linfocitos innatos tipo 2 (ILC2) controlan indirectamente la colonización de la microbiota al secretar IL-13, una citoquina que impulsa la diferenciación de las células madre epiteliales intestinales hacia células caliciformes, que a su vez producen glicoproteínas de mucina149. Estos mecanismos antimicrobianos se activan constitutivamente por el sistema inmunitario para evitar el crecimiento excesivo de microbios colonizadores y controlar la microbiota residente mediante la homeostasis inmunitaria149. La tolerancia de la microbiota intestinal normal es crucial para la homeostasis intestinal, que requiere una amplia red de células inmunitarias reguladoras, incluidas las células T reguladoras (Tregs) y las células dentríticas tolerogénicas. La detección de la microbiota comensal a través de la señalización TLR-MyD88 es un método aplicado por el sistema inmunitario para mantener la homeostasis microbiana del huésped. La expresión de los receptores de reconocimiento de patrones (PRR) varía en los diferentes tractos del intestino, así como la composición de la microbiota residente. Resulta en la diafonía entre la microbiota y el sistema inmunológico150,152 | Se ha demostrado la activación inmuno-inflamatoria regional en los pulmones, el sistema nervioso, el tracto gastrointestinal (GI) y el hígado tras la administración de las vacunas COVID-191,16,35,41,86,124. Como consecuencia de la infección en GI del SARS-CoV-2, las partículas víricas podrían infectar el hígado, provocando daño hepatocelular y una respuesta inmuno-inflamatoria que podría perdurar en el tiempo | 1,16,35,41,86,124,147,149-152 | |
| OTROS BIOMARCADORES PREDICTORES DE INFLAMACIÓN SISTÉMICA y LESIÓN INDUCIDA POR FÁRMACOS | Lyoumi S et al. 1998 y Vlasakova K et al. 2022, evalúan 2 biomarcadores de remodelación e inflamación de tejidos, la macroglobulina α2 (A2M) y la glicoproteína ácida α1 (AGP) como biomarcadores potenciales en la sangre de lesión tisular inducida por fármacos (DITI), lesión vascular inducida por fármacos (TIMP-1) y respuesta inflamatoria sistémica (SIR). Observaron un aumento de proteínas hepáticas reactantes de fase aguda (AGP, A2M) con toxicidad del sistema nervioso central (SNC)153,154 | Aunque los aumentos en plasma de AGP y A2M podrían tener efectos beneficiosos en relación con la respuesta antimicrobiana sistémica, su base inflamatoria tiene causas que deben ser investigadas. De hecho, la respuesta hepática sugiere la persistencia de antígenos víricos en el tracto GI con alteraciones en la permeabilidad de la barrera intestinal y activación de respuestas fisiopatológicas de base neuro-inmuno-inflamatoria, tales como dispepsias y colon irritable. A este respecto, conviene recordar que la persistencia de antígenos víricos en el tracto GI comporta alteraciones de la fisiología intestinal, que a su vez generan alteraciones de la permeabilidad intestinal, con consecuencias neuroinflamatorias y neurocognitivas en el encéfalo del paciente a través de la respuesta fisiopatológica hepato-pulmonar1,4,16,51,86,153,154 | Por otro lado, la comunicación fisiopatológica a través del eje encéfalo-hepatopulmonar es bidireccional e implica al sistema nervioso parasimpático, representado por el vago. Como nervio interoceptivo mixto, con fibras aferentes (80%) y eferentes (20%), supervisa constantemente la salud intestinal, detectando metabolitos de la microbiota y del sistema inmune regional, cuya información transmite a nivel central para activar una respuesta colinérgica antiinflamatoria que amortigua la inflamación GI y modula la composición de la microbiota, contribuyendo a regularizar la permeabilidad intestinal alterada. Sin embargo, cuando la activación cerebral anómala por vía vagal, coincide con una alteración de la barrera hematoencefálica, se produce una activación excesiva de la microglía que tiene efectos neuroinflamatorios, alterando a su vez vías de señalización neuronal con posibles consecuencias neuropsiquiátricas y neurocognitivas que deben ser prevenidas y tratadas1,4,16,51,86,153,154 | Los altos niveles de A2M interfieren con los efectos de la leptina lo que contribuye a la hiperleptinemia con consecuencias sobre el sistema nervioso entérico155. Se deben valorar los mecanismos que pueden afectar a la vacunación, son complejos e incluyen factores relacionados con las vacunas COVID-19 (naturaleza del antígeno, sistema de administración, adyuvantes e inmunomoduladores), el sistema inmunitario del huésped y la microbiota intestinal. Se ha demostrado este «potencial adyuvante endógeno» en las respuestas de anticuerpos significativamente deterioradas con estas vacunas1,2,13,25–29,31,35,38,39,43,46–52. Ng SC et al. 2022, ofrecen un modelo para estudiar cómo se podría explotar el potencial inmunogénico de la microbiota para mejorar la inmunogenicidad de las vacunas COVID-19 | 1,2,4,13,16,25-29,31,35,38,39,43,46-52,86,153-155 |
| EFECTOS DE LA BIOLOGÍA DE LOS SISTEMAS DE LAS VACUNAS DE ARNm CONTRA EL SARS-CoV-2 | Hajjo R et al. 2022, analizan los efectos de la biología de sistemas de las vacunas de ARNm de COVID-19 para evaluar su seguridad y efectos secundarios putativos. La vacunación simultánea a gran escala de la población mundial revelará la heterogeneidad en las respuestas inmunes, así como la predisposición a desarrollar efectos adversos posteriores a la vacunación, especialmente en sujetos vulnerables. Aplican un flujo de trabajo de biología de sistemas, en función de los datos de transcriptómica para BNT162b2 de Pfizer-BioNTech en sujetos vacunados. No hay publicaciones disponibles para el ARNm-1273 de Moderna en el momento que evaluaron estos resultados. Sin embargo, los generalizan a otras vacunas de ARNm sobre la base de la evidencia de la literatura biomédica57,71,156,157 | Analizan los efectos quimiogenómicos de las vacunas y su composición a nivel de biología de sistemas para generar hipótesis comprobables sobre los efectos de las vacunas en los sistemas biológicos. Su grupo y otros han validado y usado con éxito esta teoría para estudiar los efectos de las biologías de sistemas de los fármacos de molécula pequeña y las distintas vacunas del COVID-1917,74,92,101,111,156,158-161 | Los resultados evidencian que la vacuna BNT162b2 basada en ARNm afecta las vías de respuesta inmunitaria relacionadas con la señalización de interferón y citoquinas, que debería lograr el éxito de la vacuna, pero también puede producir efectos adversos posteriores a la vacunación. Indican también los efectos adversos cardiacos relacionados con las vacunas de ARNm, concretamente, los efectos de BNT162b2 en la homeostasis del calcio. Sus resultados son significativos para las agencias reguladoras de medicamentos y productos sanitarios, los médicos, los responsables políticos y para la ciudanía general156 | Usan múltiples firmas de genes transcripcionales para estudiar los efectos farmacológicos de las vacunas de ARNm. Sus resultados verifican que BNT162b2 produce una respuesta inmunitaria fuerte 21-22 días después de recibir la primera dosis y refuerzo posterior en sujetos vacunados156 | 17,57,71,74,92,101,111,156-161 |
| Las vías biológicas estimuladas son las vías de respuesta inmunitaria, necesarias para inducir la respuesta inmunitaria adaptativa por las vacunas. Destacan el papel de los mecanismos inmunes innatos e inflamatorios asociados con la señalización de IFN-gamma, interleucinas y proteína C. También, señalan la eficacia clínica de la vacuna al estimular la respuesta inmune innata, sin embargo, la señalización IFN-gamma desencadena respuestas inflamatorias con consecuencias perversas incluyendo la participación de hormonas femeninas y masculinas en algunos de los procesos inflamatorios1,22,24,28,35,38,45,51,104,156 | Estos datos deben utilizarse como hipótesis comprobables de la existencia de relaciones funcionales putativas de la vacuna BNT162b2. A su vez, comparan las enfermedades vasculares y cardiovasculares en pacientes con COVID-19, con las 50 principales enfermedades enriquecidas por genes expresados diferencialmente (DEG) priorizadas de datos transcriptómicos de una sola célula de BNT162b2, especialmente en el contexto de miocarditis asociada a la vacuna de ARNm COVID-1926,156 | Sus resultados indican que los 76 DEG seleccionados participan en: señalización de interferón, señalización de citoquinas, señalización de interferón alfa/beta, mecanismos antivíricos por genes estimulados por interferón y señalización de interferón gamma, figura 3.Señalan que los genes con mayor efecto sobre la transcripción, como los factores de transcripción, o aquellos que presentan más aberraciones en respuesta al tratamiento, tienen más efectos en la modulación de la biología subyacente, incluida la desregulación inmunitaria que se muestra. Por ejemplo, IP10 y CCL2, ambos genes se asocian a la infección por SARS-CoV-2 y la tromboinflamación. Sugieren que IP10 puede utilizarse como biomarcador para identificar la gravedad de la enfermedad inducida156 | En este estudio se clasifican todos los DEG de acuerdo con sus niveles de expresión y preparan 3 listas de genes para consultar los aciertos de compuestos que provocaron firmas transcripcionales parecidas a la vacuna de ARNm de BNT162b2. Si las listas de genes de consulta comparten pocos o ningún gen común se clasificarían en listas similares, esto aumenta la confianza de que los resultados son estadísticamente significativos y biológicamente relevantes. En general reconocen 13 aciertos de alta confianza que pertenecían a 6 clases farmacológicas: 4 inhibidores de la ATPasa (38,46%), 3 inhibidores de la síntesis de proteínas (30,76%), una tirosina cinasa de Bruton (BTK) (7,69%), un estimulante de la apoptosis (7,69%), un inhibidor de la ribonucleósido reductasa (7,69%) y un activador de guanilato ciclasa (7,69%). Destacan que 12 de las principales conexiones de los compuestos positivos que refieren son moduladores conocidos del sistema inmunitario por sus efectos en las vías inmunitarias innatas, como la estimulación de la apoptosis y de las vías del inflamasoma NLRP3156 | 1,22,24,26,28,35,38,45,51,104,156 | |
| SOBREEXPRESIÓN DE LAS PROTEÍNAS SERINA PROTEASA TRANSMEMBRANA (TMPRSS) | Otro dato que considerar es la sobreexpresión de varios miembros de la subfamilia de serina proteasa transmembrana (TMPRSS) a los 21-22 días de las inoculaciones. Las proteínas TMPRSS son necesarias para la hemostasia, la promoción de algunos tipos de cáncer y la entrada de virus respiratorios en células humanas. Se ha estudiado la activación de la proteína espiga del virus SARS-CoV-2 mediante la TMPRSS2 y TMPRSS4. En este estudio TMPRSS4, TMPRSS6, TMPRSS7 y TMPRSS9 se sobreexpresaron en respuesta a la vacuna de BNT162b2. Por ello, indican que los efectos adversos de BNT162b2 en la expresión de TMPRSS podrían favorecer la infección por SARS-CoV-2156 | Destacan, si el COVID-19 se presenta por una respuesta inflamatoria elevada y una respuesta inmunitaria disminuida que desencadenan enfermedades vasculares comunes, las vacunas de ARNm estimulan las vías inmunitarias para combatir el SARS-CoV-2, abocan en la producción de anticuerpos particulares y la inducción de respuestas inflamatorias que desencadenan enfermedades vasculares raras. Este estudio y otros han validado estas hipótesis, también demuestran que BNT162b2 desencadena respuestas inmunitarias parecidas a la activación plaquetaria producida por LPS4,156 | Se ha comentado con anterioridad el papel de las plaquetas en la hemostasia, los mecanismos de defensa del huésped y su efecto modulador en la comunicación entre las células T y B para la correcta inmunidad adquirida. Las plaquetas pueden reconocer patógenos, seleccionar péptidos de defensa del huésped como el factor plaquetario 4 (PF4), una quimiocina CXC derivada de las plaquetas, junto con los leucocitos construyen complejos trombóticos inmunes. Se han informado casos de trombocitopenia trombótica inmune inducida por la vacuna (VITT) tras la administración de vacunas con vectores de adenovirus y de ARNm1,76,156,162–168 | Por lo tanto, este estudio verifica que las vacunas de ARNm COVID-19 actúan como inmunógenos al codificar la proteína del pico del SARS-CoV-2 y también como adyuvante por su contenido de LNP o por las propiedades inmunoestimuladoras intrínsecas del ARN modificado y/o no modificado | 1,4,76,156,162-168 |
| MORTALIDAD CAUSADA POR LA VACUNACIÓN CONTRA EL COVID-19 | Murata K et al. 2022, presentan 4 casos que fallecieron en sus domicilios tras recibir la vacuna de ARNm contra el COVID-19. Tres casos vacunados con 2 dosis de Moderna ARNm y un caso recibió 2 dosis de la vacuna de Pfizer-BioNTech ARNm. El tiempo desde la administración de la segunda dosis hasta la muerte fue de uno a 10 días102 | En el caso del sujeto vacunado con Pfizer, los efectos adversos posteriores a la vacunación, como dolor de cabeza y fiebre, no se observaron el día anterior al fallecimiento, mientras que en los demás casos se observaron el día anterior a la muerte. El intervalo post mortem inferido de los fenómenos post mortem y las mediciones de temperatura rectal del forense registraron temperaturas corporales altas para todos los casos en el momento de la muerte. Utilizan la secuenciación de ARN e identifican genes que se expresaron de manera diferencial en los casos posteriores a la vacunación y el grupo de control que fallecieron por pérdida de sangre y estrangulamiento102 | Identifican 390 genes regulados al alza implicados en la desgranulación de neutrófilos y la señalización de citoquinas y 115 genes estaban regulados a la baja en los casos posteriores a la vacunación en comparación con los controles. Sugieren la causalidad de la muerte con ocurrencia temporal, por una desregulación inmunitaria después de la vacunación, síndrome de respuesta inmune sistémica (SIRS)102.El SIRS debe cumplir al menos 2 de los siguientes criterios: fiebre <38 °C o hipotermia <36 °C, taquicardia >90 latidos/minuto, taquipnea >20 respiraciones/minuto, leucocitosis >12 × 109/l o leucopenia <4× 109/l19. Se ha informado que el SIRS es inducido por varios factores, como: la infección (incluye la infección por COVID-19), isquemia, cirugías y traumatismos169 | Las autopsias de estos pacientes no revelaron la causa de la muerte de ningún paciente y el análisis patológico mostró hallazgos de muerte súbita, como congestión de órganos primarios sin hipoperfusión, y ninguna información sobre la causa de la muerte, incluida la miocarditis. En este estudio estiman la causa de la muerte por secuenciación de ARN obtenido de sangre periférica. Obtienen un promedio de 39,1 millones de lecturas de extremo emparejado (PE) de 150 pares de bases (pb) por muestra. De los 43.751 genes con recuentos de lectura totales distintos de cero, había 505 genes expresados de manera significativamente diferencial entre individuos con causa de muerte desconocida (sujetos vacunados) y el grupo control102. Definen la vacunación contra el COVID-19 como la seudoinfección por SARS-CoV-2 y como inductor del SIRS. En los 4 pacientes fallecidos, la función inmunológica estaba sensibilizada por la primera dosis y la segunda dosis provocó el SIRS y la muerte en los pacientes más susceptibles. Alertan de la necesidad de detectar esta respuesta aberrante de citoquinas, como el análisis de polimorfismos de un solo nucleótido para prevenir estos casos 1,13,16,37,39,52,82,102,114,170 | 1,13,16,19,37,39,52,82,102,114,169,170 |
| Ittiwut C et al. 2022, notificaron 13 casos de muerte súbita inexplicable (SUD) tras la vacunación contra el COVID-19 en Tailandia, con edades comprendidas entre 23 y 72 años; 10 (77%) eran hombres y 3 (23%) mujeres, 12 de origen tailandés y un australiano. Informaron enfermedades subyacentes en 5 pacientes, sin arritmias. Ningún caso tenía antecedentes de troponinas T ultrasensibles (TUS) en familiares. Ocho (61%), 4 (31%) y uno (8%) fallecieron tras la primera, segunda y tercera dosis de la vacuna, respectivamente. El SUD se desencadeno después de todos los tipos de vacunas COVID-19 administradas en Tailandia, 7 (54%), 2 (15%), 2 (15%), 1 (8%) y 1 (8%) muertes con ChAdOx1 nCoV-19 (AstraZeneca), BBIBP-CorV (Vero Cells) de Sinopharm (Beijing), CoronaVac (Sinovac), BNT162b2 (Pfizer/BioNTech) y mRNA-1273 (Moderna), respectivamente171 | Ocho (61%) fallecieron tras recibir la primera dosis de la vacuna de ChAdOx1nCoV-19 de Astrazeneca171.La fiebre fue autonotificada en 3 casos. Diez (77%) y 11 (85%) fallecieron entre las 24 y 72 horas posteriores a la inoculación. En 6 casos (46%), la autopsia no identificó causas explicables de muerte, registraron otros 6 casos con clínica cardiaca, incluyen: ateroesclerosis coronaria en 4 casos (31%), displasia arritmogénica del ventrículo derecho en un caso (8%) y un caso de miocardiopatía dilatada (MCD) (8%), el resto de la muestra manifestó talasemia (hemocromatosis y cirrosis hepática). Analizaron la secuenciación del exoma completo que identificaron 5 casos con las variantes del gen SCN5A, coincidentes en pacientes diagnosticados con síndrome de Brugada, siendo la frecuencia de las variantes del 38% (5 de 13 casos)171 | Una tasa significativamente más alta en comparación con los casos registrados de SUD en tailandeses que ocurren tras la vacunación con COVID-19 (entre 8 y 30 días), en una cohorte de SUD tailandés evaluado prepandemia (12%, 3 de 25 casos) y en su propia base de datos de exomas (12%, 386 de 3.231 casos). Todos los casos dieron negativo para el SARS-CoV-2 por reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR). Los pacientes confirmados de muerte natural fueron enviados para estudios genéticos171 | Los autores sugieren la hipótesis de la asociación de SUD durante los 7 días posteriores a la vacunación con COVID-19 con variantes de SCN5A, 13 variantes en 7 genes en 11 de 13 casos (85%). Evidencian que la vacuna tuvo un efecto directo y causa miocarditis en el área del tracto de salida del ventrículo derecho, con conducción aberrante preexistente en pacientes con SCN5A y termina en muerte. Independientemente del tipo de la vacuna, número de dosis y la presencia de enfermedades subyacentes o fiebre posterior a la vacuna171 | 171 | |
| EFECTOS NEOPLÁSICOS DE LAS VACUNAS COVID-19 BASADAS EN ARNm | Çinar OE et al. 2022, comentan el papel del propio COVID-19 y la proteína espiga producida endógenamente por las vacunas de ARNm y sus efectos inmunológicos, microambientales, protrombóticos y neoplásicos. Muestran 4 casos de neoplasias mieloides después de la administración de la vacuna COVID-19 basada en ARNm BNT162b2 de Pfizer172 | Han usado la inmunofenotipificación para comprender el impacto de la disfunción de las células B en la respuesta serológica a la vacunación contra el COVID-19 en las deficiencias primarias de anticuerpos172 | Refuerzan la teoría de los mecanismos patobiológicos probables y las causalidades de la toxicidad relacionada con la proteína espiga y los trastornos mieloides clonales172 | Piden un seguimiento objetivo basado en la farmacovigilancia para establecer la correlación clínico-biológica entre las vacunas de pico-ARNm y la leucemogénesis. A la vez, todos los eventos adversos hematológicos deber ser monitoreados e informados de cerca172 | 172 |
| RESPUESTAS INMUNITARIAS EN EL APARATO REPRODUCTOR FEMENINO HUMANO Y EFECTOS POTENCIALMENTE DAÑINOS SOBRE LA FERTILIDAD Y LA SALUD A LARGO PLAZO PARA LAS MUJERES DERIVADOS DE LAS VACUNAS COVID-19 | Por último, la revisión sistemática de Nazir M et al. 2022 resume los principales predictores y tasas de cambios menstruales tras la vacunación contra el COVID-19, incluyen 78.138 pacientes que recibieron: las vacunas basadas en ARNm (Pfizer-BioNTech [BNT162b2] y Moderna [mRNA-1273]), vacunas de virus completo inactivado (Sinopharm/BBIBP-CorV y Sinovac Biotech) y vacunas de vectores adenovirales recombinantes (Johnson & Johnson/Janssen/Ad26.COV2.S, Oxford-Astrazeneca/ChAdOx1nCov-19 y Sputnik V). De esta muestra, 39.759 (52,05%) participantes tuvieron anomalías menstruales (menorragia, oligomenorrea, polimenorrea, dismenorrea y metrorragia) posteriores las inoculaciones contra el COVID-19, una muestra significativa, indican una gran heterogeneidad en la aparición de estos efectos adversos. La tasa general de efectos adversos posteriores las vacunas COVID-19 en este estudio era variante, del 0,83% al 90,9%. Son escasos los estudios informados en la literatura que traten sobre la relación causal entre el estado de la vacunación contra el SARS-CoV-2 y las irregularidades menstruales173 | Señalan 3 estudios que establecen como predictor causal de los trastornos menstruales el aumento de la edad en las mujeres (edades comprendidas entre 18 y 30 años). Los autores añaden otros predictores, como: antecedentes de embarazos, primera dosis y refuerzos posteriores, efectos secundarios sistémicos del COVID-19 y tabaquismo. La mayoría de los casos informados eran estudios transversales basados en cuestionarios y debían asociarse a los predictores citados. Destacan 10 estudios retrospectivos que informan una proporción de mujeres con irregularidades menstruales relacionadas con la vacunación contra el COVID-19, por ejemplo, en una encuesta transversal noruega basada en 5.756 participantes mediante muestreo aleatorizado, del 39% al 41% refirieron estos efectos adversos173,21. Se experimentaron con mayor frecuencia después de la segunda dosis, 2 estudios registran de 3 a 6 ciclos menstruales posteriores a la vacunación. Los síntomas referidos son: sangrado más intenso, dismenorrea, ciclos más largos y/o cortos de lo normal y sangrado intermenstrual inesperado, también en pacientes que reciben tratamiento anticonceptivo20,21,173,174. La infección previa a la vacunación por SARS-CoV-2 también produjo alteraciones menstruales103,173,175 | Estos datos los relacionan con el efecto acumulativo inmunitario debido a la exposición repetida al antígeno, como se ha comentado anteriormente evidencia el «efecto de pico». También reconocen la necesidad de seguir más ciclos durante períodos más largos para estudiar las consecuencias a largo plazo, así como la probabilidad de embarazo173. Encontraron trastornos ginecológicos como la menorragia, la endometriosis, el síndrome de ovario poliquístico, los fibromas y la adenomiosis que provocaron en las participantes un aumento de la menstruación después de la vacunación en su mayoría de corta duración, pero sugieren que podría predisponer a estos cambios. La mayoría de los estudios publicados hasta la actualidad concluyen y repiten que el efecto de las vacunas contra el COVID-19 en el ciclo menstrual es temporal, leve y sin consecuencias a largo plazo. Sin embargo, se sabe que el antígeno particular que provoca esta respuesta inmunitaria es discutible, tanto la proteína de pico compartida con el SARS-CoV-2 como los adyuvantes usados en la vacunación se han considerado causantes de la intensa respuesta inmune tras la administración de las vacunas contra el COVID-19, y de forma parecida después de la infección por SARS-CoV-2 como potencial inductor que cambia la actividad del eje hipotalámico-hipófisis-ovario que regula el inicio y duración del ciclo menstrual113,173 | El ciclo menstrual y la restauración del endometrio están mediadas por células inmunitarias innatas que residen en el endometrio. La activación de estas células inmunitarias desencadenaría un sangrado más intenso, irregular e inesperado en el tiempo. Los parámetros hormonales participantes en el ciclo menstrual podrían alterarse por la disfunción inmunológica inducida por la vacuna173,176. Otras posibilidades atribuibles a la vacunación podrían producirse por cambios en la tiroides y la VITT, efectos ya observados en otras vacunas (sarampión, difteria y hepatitis)173,177–179. Otro hallazgo a considerar es el programa de dosificación entre 2 dosis (21 y 28 días) para Pfizer-BioNTech y Moderna, respectivamente; la primera dosis se administraría en la fase folicular temprana. Por ello, afectaría al desarrollo del folículo dominante durante la fase folicular y en consecuencia a la duración del ciclo1,98,156,173. Un hallazgo contradictorio que podría alterar de forma permanente la regulación homeostática endocrinológica del ciclo menstrual sería una enfermedad sistémica grave y crónica como el COVID-persistente, un efecto adverso a evaluar en el contexto de la vacunación COVID-19173Este estudio evidencia la compleja interacción entre los marcadores inflamatorios y las alteraciones hormonales inducidas por la infección por COVID-19, incluyendo la vacunación basada en ARNm, alertando de su potencial dañino para la fertilidad y la salud a largo plazo para las mujeres, especialmente diagnosticadas de forma previa a la vacunación176,177,180,181. Se debe garantizar la tolerabilidad y seguridad para una mejor aceptación de la vacunación contra el COVID-19. Se necesitan más estudios de cohortes para identificar el vínculo temporal con los cambios del ciclo menstrual. Los autores solicitan el deber de realizar estudios de base poblacional, que registre: la variación epigenética debido a los polimorfismos genéticos de las comunidades étnicas y las poblaciones de riesgo173 | 1,20,21,98,103,113,156,173-181 |
| La disponibilidad de los datos sobre la seguridad de las vacunas COVID-19 administradas durante, antes y posteriormente al embarazo es escasa. Moro PL et al. 2022, evalúan los informes del Vaccine Adverse Event Reporting System (VAERS) de 3.462 notificaciones de efectos adversos en embarazadas que recibieron una dosis de las vacunas contra el COVID-19: 1.831 (52,9%) con BNT162b2, 1.350 (39,0%) con mRNA-1273 y 275 (7,9%) con Ad26.COV2.S y 6 de fabricante desconocido. Se excluyeron los informes que indicaban que la vacunación se administró antes del último período menstrual o durante el posparto. Reportaron 8 muertes maternas y 12 muertes neonatales. Seiscientos veintiún (17,9%) informes fueron codificados como graves. Incluyeron: 878 (25,4%) abortos espontáneos (<20 semanas) (SAB), 101 (2,9%) episodios de sangrado vaginal, 76 (2,2%) partos prematuros (<37 semanas), 62 (1,8%) mortinatos (≥20 semanas) y 33 (sin tasa calculada) casos de bebes con defectos congénitos importantes o una anomalía cromosómica, siendo: 18 de 33 casos con la vacuna BNT162b2 y 15 de 33 casos con mRNA-1273182 | Registraron 107 condiciones infantiles que incluyen las 12 muertes neonatales, indican como causa de la muerte la prematuridad. Las tasas brutas de notificación de partos prematuros y mortinatos, así como las tasas de mortalidad materna y neonatal deben compararse con las tasas de referencia de las notificaciones reales publicadas. Observan una notificación desproporcionada. Estimaron 3.173.387 nacimientos vivos en los Estados Unidos durante su período de estudio (diciembre de 2020 hasta octubre de 2021)182 | De acuerdo con los métodos del Centro Nacional de Estadísticas de Salud que referencian incluyen muertes fetales de 20 semanas de gestación o más según la estimación obstétrica, entre mujeres de 15 a 44 años, excluyen residentes extrajeras. Datan 18.945 muertes fetales durante el período del estudio. La mayoría de SAB, (81,3%) 490 de 603 casos con datos de edad gestacional, sucedieron en <12 semanas de gestación y (39,3%) 338 de 859 casos la gestante tenía una edad ≥35 años. Entre los 849 casos de SAB que informan sobre el intervalo de inicio (período de tiempo desde la vacunación hasta la aparición de los efectos adversos) fueron: de 0 a 3 días (26,4%), de 4 a 7 días (12,0%), de 8 a 14 días (15,5%) y ≥15 días (46,1%)182 | Reportan las 8 muertes maternas como: embolia pulmonar, embolia de líquido amniótico, eclampsia con miocardiopatía periparto y hemorragia intraparenquimatosa cerebelosa aguda secundaria a trombocitopenia grave persistente debido a leucemia mielógena aguda en 4 casos, respectivamente. Otros 2 tuvieron un deterioro clínico repentino que terminó en muerte. Dos de 8 casos no hay descripción182. Todo hallazgo debe interpretarse con cuidado | 182 | |
| En un estudio reciente, Monin L et al. 2020, discuten las respuestas inmunitarias en el aparato reproductor femenino humano. Realizan una revisión detallada sobre el conocimiento actual de las respuestas inmunes del tracto reproductivo femenino (FTR) y su heterogeneidad dentro del órgano y entre compartimentos. En la vagina, rica en comensales, el sistema inmunológico debe permitir el crecimiento de microbios beneficiosos, mientras que el propósito del útero es permitir el crecimiento del feto183 | En ambos compartimentos, estos objetivos deben equilibrarse con la actividad de eliminar patógenos. Esto no solo facilitará intervenir para prevenir la propagación de enfermedades de transmisión sexual, sino que en el contexto del «efecto de pico» permitirá mejorar los resultados de la fertilización, la implantación y el embarazo para madres y bebés debido a que las infecciones se encuentran entre las causas comunes de infertilidad y fracaso tardío del embarazo183 | Los autores señalan que el sistema inmunitario uterino también cambia con el ciclo menstrual y el embarazo. Ahora se comienza a valorar que también ocurren cambios cíclicos en la vagina y que estos podrían tener un impacto en la susceptibilidad a la enfermedad. Reiteran e indican la composición de las células inmunitarias (células linfoides innatas y células T de tipo innato en la vagina y el útero, además de las APC) maternas en la sangre y decidua, y antes del embarazo, la frecuencia de las células inmunitarias en el endometrio varía durante el ciclo menstrual183 | En el aparato reproductor femenino (FRT), los anticuerpos contribuyen a la eliminación de patógenos a través de mecanismos que incluyen la neutralización de patógenos, opsonización y la lisis impulsada por el complemento. Las células plasmáticas que secretan IgG e IgA pueden detectarse en la lámina propia (LP) tanto del cuello uterino como de la vagina, aunque en comparación con otros sitios de la mucosa, IgG, en lugar de IgA, es el isotopo de anticuerpo predominante en la FTR inferior183,184 | 183,184 | |
| Recientemente, Mansour FR et al. 2023, vinculan las alteraciones menstruales posteriores a la vacunación contra el COVID-19 y el papel de las vías inmunitarias y endocrinas (eje hipotálamo-hipófisis-tiroides, eje hipotálamo-pituitario-suprarrenal y eje hipotálamo-hipófisis-ovario), se centra en los efectos adversos en las mujeres en edad reproductiva. Repite y evidencia los efectos perjudiciales de la proteína S compartida en las vacunas COVID-19, incluyen la entrada del SARS-CoV-2 en las células diana, el daño endotelial, la liberación de citoquinas proinflamatorias, la activación de receptores tipo Toll (TLR), la estimulación de la microglía, el mimetismo molecular con chaperonas y proteínas de choque térmico (HSP) y la activación de la proteína S del SARS-CoV-2 y su unión a la enzima convertidora de angiotensina 2 (ACE2)185 | También, puede inducir la hiperestimulación del sistema inmunitario y la síntesis de múltiples autoanticuerpos. Por lo tanto, demuestran que el ciclo menstrual normal puede alterarse ante el deterioro de cualquiera de estas vías. Estos hallazgos sugieren que al interrumpir el eje monocítico-endotelial-plaquetario podría restaurar la desregulación inmune observada en todos los efectos adversos secundarios a la administración de las vacunas COVID-19 y podría ser una posible alternativa terapéutica en un futuro próximo27–29,46,49,185–187. Los trastornos menstruales posteriores a la vacunación son comunes y pueden producirse en diferentes vacunas, como la vacuna contra el virus del papiloma humano (VPH)185,188 | Durante la fase folicular las vacunas pueden prolongar el ciclo menstrual y/o detener/retrasar la ovulación y, perturbar el ciclo reproductivo. Estos efectos adversos pueden atribuirse a la variación individual, siendo muy parecidos después de la primera y la segunda dosis185,189. Se podría definir un perfil específico en el sexo femenino, de edad temprana (segunda dosis con BNT162b2: DE = 38,9 años; tercera dosis con BNT162b2: DE = 45,9 años) y sin comorbilidades como factores de riesgo para la desregulación inmunitaria inducida por las vacunas190. La inactivación incompleta del cromosoma X en las mujeres estaría implicada en la eficacia de la vacuna185,190,191 | Esta inactivación no es uniforme entre todas las células inmunitarias y existe una probabilidad bialélica de los genes. Los cromosomas X derivan de diferentes padres y ofrecen más diversidad inmune en las hembras. Las hembras tienen una copia doble de genes inmunes debido a sus cromosomas XX, este cromosoma involucra los genes asociados a la inmunidad del genoma humano. El cromosoma X regula diferentes componentes del sistema inmunitario como los receptores TLR7, TLR8, CXCR3 y CD40L, se sobreexpresan en las mujeres y participan activamente en la respuesta a las vacunas185,190 | 27-29,46,49,185-191 | |
| Las mujeres responden a la vacunación mediante una mayor producción de anticuerpos y una respuesta inmune dominante de células Th2, que produce citoquinas antiinflamatorias185,192. El TLR7, es un TLR frecuente en las mujeres, fuertemente asociado con la eficacia de la vacuna y las diferencias de sexo en la autoinmunidad. Puede escapar a la inactivación del cromosoma X y conducir a una mayor expresión de células inmunitarias innatas y genes asociados a células T, esto induce la producción de IFN tipo I y activa la respuesta inmunitaria adaptativa. Explicaría la mayor frecuencia de efectos adversos en las mujeres debido a la respuesta inmediata más fuerte al antígeno, modulada a través del sistema inmunitario innato25,53,185,187 | La testosterona tiene el efecto de deprimir la respuesta inmunitaria innata y adaptativa, confirmaría que las hormonas sexuales se involucran en el mecanismo del aumento de la reactogenicidad de las vacunas en las mujeres. Por ejemplo, los factores genéticos también podrían participar en la reactogenicidad de las vacunas, como: el gen ACE2 y el receptor angiotensina II (Ang-II) tipo 2 mediante la interacción con las hormonas sexuales, péptido clave en el daño vascular y renal131,187,193–195 | También influyen, la actividad diferencial de los genes ligados al cromosoma X y los polimorfismos del gen ChrY (inmunidad diferenciada con el sexo) que están regulados por el escape de la inactivación del cromosoma X y los mecanismos epigenéticos, respectivamente. Por ello, pueden afectar la expresión génica global en células inmunitarias131,187,193–195 | En conjunto, el complemento de los cromosomas sexuales, la actividad de los elementos reguladores en los cromosomas sexuales y la expresión de los genes de los cromosomas sexuales contribuyen a las diferencias sexuales en la inmunidad a las infecciones víricas131,187,193–195. Los enfoques interseccionales serán necesarios para comprender mejor los efectos adversos de las vacunas COVID-19, así como los tratamientos para la disminuir la inmunidad adaptativa antivírica, la replicación del virus y la inflamación, teniendo en cuenta de que ambos difieran entre sexos193 | 25,53,131,185,187,192-195 |
El término «perfil de seguridad» hace referencia a todos los efectos adversos que podrían causarse, desencadenarse y/o empeorar en cualquier momento después de la vacunación, como reacciones anafilácticas, enfermedades diagnosticadas después de la vacunación y eventos autoinmunitarios196. La OMS define 5 tipos de efectos adversos posteriores a la vacunación (AEFI), registrados en una ventana de 30 días posteriores a las inoculaciones, que se analizan en la literatura publicada actual y algunos informes sobre efectos adversos espontáneos: 1) producto de la vacuna-reacción relacionada; 2) reacción relacionada con el defecto de calidad de la vacuna; 3) reacción relacionada con el error de administración; 4) reacción relacionada con la ansiedad por la inmunización y 5) evento coincidente197. El primer y tercer tipo de efecto adverso son probables en paralelo con la tecnología de vacunas COVID-19, la literatura biomédica actual ha evaluado más datos para: a) componentes de LNP, b) ARNm modificado y no modificado, c) proteína de espiga producida por las vacunas COVID-19, sin excluir su coexistencia.
La presente revisión sistemática discute, con base en la evidencia publicada, la estimulación inmunitaria innata y adaptativa inducida por las vacunas COVID-19, basada en la activación de biomarcadores de inflamación y su efecto en la inmunogenicidad y reactogenidad impulsarán el diseño de enfoques efectivos para el manejo de la enfermedad inducida por estas nuevas plataformas de vacunas contra el SARS-CoV-2. Para ello, se realizó un análisis de la literatura publicada acerca de los mecanismos inmunes innatos de esta nueva terapia. Además, de otras variables como los efectos adversos graves no conocidos y/o variantes atípicas de otros síndromes postvíricos, sus patrones clínicos y epidemiológicos, firmas inflamatorias y ocurrencia temporal asociada a la presencia de anticuerpos de reconocimiento postvacunales como IgG anti-RBD, IgG anti-S1, IgG anti-S2 y anti-N (nucleocápside) en el contexto de infección por contagio. Características clínicas que a priori lo convierten en un fármaco idóneo para prevenir la enfermedad y/o las consecuencias perniciosas como un sistema de prevención secundaria en forma de vacuna.
ObjetivosSe plantearon los siguientes objetivos de investigación: como objetivo general, revisar de manera sistemática la literatura sobre los efectos adversos producidos después de la administración de las vacunas COVID-19 para demostrar su potencial terapéutico en el tratamiento y/o prevención de la enfermedad; así como evidenciar la asociación de causalidad y ocurrencia temporal.
Como objetivos específicos se consideraron:
- 1.
Identificar los artículos que publican información sobre la inmunogenicidad y reactogenicidad de las vacunas COVID-19 que inducen la expresión duradera de la proteína de espiga SARS-CoV-2 con efecto sistémico y que imitan el COVID-persistente.
- 2.
Identificar y describir los aspectos metodológicos de los trabajos que reportan biomarcadores inflamatorios potenciales que podrían predecir la desregulación inmunitaria celular y humoral.
- 3.
Valorar la asociación entre los efectos adversos y el mimetismo molecular, la producción de autoanticuerpos particulares y el papel de ciertos adyuvantes.
- 4.
Proponer los mecanismos de exposición y posterior diseminación a la línea celular, integración en el genoma humano (genotoxicidad), diafonía vascular mediada por VEGF inducida por la proteína de pico y afectación de la composición de la microbiota intestinal.
- 5.
Verificar la reactogenidad de las vacunas COVID-19 con niveles más altos de anticuerpos posteriores a la vacunación.
Para ello se realizó una búsqueda sistemática de la producción científica que reportaba datos sobre los efectos adversos derivados de la vacunación contra el SARS-CoV-2.
El estudio se llevó a cabo en 2 fases: en la primera fase se realizó una revisión sistemática de los artículos científicos publicados en la literatura que abordarán el tema de la inmunogenicidad y reactogenidad tras la vacunación.
Se utilizaron las bases de datos más relevantes de ciencias de la salud: MEDLINE (a través de PubMed y Web of Science); Web of Science, selecciona otras bases de datos: colección principal de Web of Science (WOS), Current Contents Connect (CCC), Derwent Innovations Index (DIIDW), KCI - Korean Journal Database (JKD), MEDLINE, Russian Science Citation Index (RSCI) y SciELO Citation Index; Scopus (Elsevier).
Se utilizaron como descriptores de búsqueda los siguientes términos MeSH (Medical Subject Headings)198: vaccine COVID-19, adverse events, así como las mismas en español, con su correspondiente formulación booleana (AND) y el término de truncamiento para alguna de ellas. Los filtros de búsqueda utilizados para la plataforma de búsqueda PubMed-MEDLINE se adaptaron a las bases de datos Scopus y Web of Science. Para localizar los artículos de forma más precisa se buscó si el término existía en los tesauros de las bases de datos y cuando no era posible se utilizó como texto libre.
Los límites de la búsqueda para seleccionar los documentos en las bases de datos fueron: documentos en formato artículo, publicados en revistas científicas, sin restricciones de idiomas, de acceso libre. Se limitó a los títulos de los artículos y sus resúmenes.
Se tomó como período de búsqueda los últimos 3 años de cada base de datos hasta el 11 de julio del año 2023. Además, se llevó a cabo una búsqueda inversa analizando las referencias bibliográficas de los artículos seleccionados.
Para la selección de los artículos se establecieron como criterios de inclusión que entre sus objetivos e hipótesis se abordarán los mecanismos potenciales de reactividad inmunitaria no conocida y grave de las vacunas COVID-19. Así mismo, la plausibilidad putativa del mimetismo molecular entre los péptidos del pico vírico y los péptidos propios del paciente que hayan resultado en un brote (se tuvo en cuenta para la inclusión el diseño del estudio); artículos publicados en los últimos 3 años (2021-2023); aportar datos primarios, es decir, datos obtenidos directamente por los autores.
Los criterios de exclusión fueron los artículos sin resumen disponible, editoriales, ponencias a congresos, recensiones de libros, correspondencias y comentarios de redes sociales o no autorizados sobre las vacunas COVID-19, estudios con problemas metodológicos que condicionan la calidad de los datos reportados y artículos que reporten: eventos adversos espontáneos comunes de pronóstico leve y sin evolución tórpida, informes deficientes (subdiagnósticos y/o diagnósticos a medias), sin seguimiento claro, resultados de laboratorio de anticuerpos positivos frente a nucleocápside (IgG anti nucleocápside SARS-CoV-2) que solo aparecen por el contacto con el virus y no por la vacunación, condiciones médicas preexistentes que precisen tratamiento inmunosupresor en el momento de la vacunación y de forma crónica por subproducción inmunoestimuladora.
Inicialmente se seleccionaron los textos por la pertinencia del título y el resumen. En aquellos que fueron seleccionados de esta manera, se analizó el texto completo de los artículos para considerar ser incluidos en la revisión.
Los artículos incluidos en la revisión debían cumplir con los criterios de calidad establecidos por el Preferred Reporting Items for Systematic Reviews and Meta-Analyses statement (PRISMA)170,199.
Para la evaluación de la calidad de los estudios se utilizó el Critical Appraisal Skills Programme Español (CASPe)114,184 y en relación con la calidad metodológica de revisión, se planteó de acuerdo con los criterios establecidos por el instrumento Assenssing the Methodological Quality of Systematic Review (AMSTAR)200.
La información de interés para el estudio fue extraída mediante la aplicación de una planilla ad hoc que recogía información sobre características generales de los estudios, que analizaba los principales resultados.
De cada artículo se determinaron las siguientes variables: autores, año de publicación, diseño del estudio, participantes del estudio, tamaño de la muestra, tiempo desde la vacunación hasta el inicio de los síntomas (contabilizado en días), recomendaciones (título de anticuerpos posvacunales, alternativas terapéuticas/futuros tratamientos de las reacciones adversas causadas), riesgo de sesgos-limitaciones (no revisado por pares, tamaño de la muestra), biomarcadores de inflamación-activación inmunitaria de células T, patrones clínicos y epidemiológicos.
Los datos fueron extraídos y comprobados de manera independiente por la investigadora.
Para el posterior análisis, los datos se incorporaron a una tabla de base de recogida de datos en Excel y posteriormente a una base de datos creada con el programa SPSS Statistics IBM versión 29.
En la segunda fase, los artículos identificados en la revisión fueron agrupados y analizados según las características clínicas y epidemiológicas asociadas a los efectos adversos graves. Dada la extensión de la revisión sistemática, en este proyecto solo se presentan los datos referidos a la firma inflamatoria derivada de la reactogenicidad.
Para las variables incluidas en el análisis se han calculado, mediante el programa SPSS Statistics IBM versión 29 medidas de frecuencia en las variables de tipo cualitativo.
Después de realizar la revisión sistemática y establecer las evidencias existentes en la literatura, se decide si es posible la existencia de causalidad y ocurrencia temporal derivada por las vacunas COVID-19 que sea válido y fiable para la prevención de la enfermedad.
En relación con los aspectos éticos, la revisión sistemática se llevó a cabo a partir del análisis de fuentes primarias y secundarias, en ningún caso se ha experimentado con grupos de pacientes, ni con animales. El diseño y ejecución de la investigación se ha realizado de acuerdo con los criterios metodológicos especificados AMSTAR que pretenden garantizar la calidad y veracidad de la información recogida, facilitando su replicación en un futuro.
Con el apoyo de la declaración PRISMA y la herramienta CASPe se consiguió una estructuración clara y organizada para su interpretación. Se han tenido en cuenta los criterios de inclusión y exclusión, aportando rigor a la revisión.
ResultadosLa revisión sistemática ha permitido identificar un total de 2.033 registros que, tras un proceso de cribado de acuerdo con los criterios de inclusión y la eliminación de trabajos duplicados, de trabajos con problemas metodológicos y de trabajos sin acceso libre se redujeron a 58 artículos, como se describe en el flujograma PRISMA de la revisión (fig. 4); de ellos, se identifican 50 artículos sobre modelos humanos y 2 corresponden a modelos celulares. En las tablas A1 y A2 se resume la información más relevante de los artículos/reportes incluidos en la revisión (participantes de los estudios y tiempo desde la vacunación hasta el inicio de los síntomas contabilizado en días, así como las características de todos los estudios incluidos).
Análisis de los artículos identificadosTeniendo en cuenta los participantes del estudio se puede observar que 50 artículos (un 93,5%) proceden de estudios de modelos humanos; 2 (2,2%) de estudios de modelo celular.
En la figura 5 se observa la distribución temporal de los artículos según el año de publicación.
Observando el gráfico 5, se comprueba que el número de publicaciones no es equitativo, organizándose de menor a mayor: en el año 2021 se encontraron 2 artículos (3,4%); 5 (8,6%) en el 2023; 51 (87,9%) en el año 2022. La mayoría de los artículos publicados datan de hace un año.
En cuanto al número total de artículos de investigación, se han incluido un total de 58 artículos, tras descartar los estudios repetidos o duplicados, 15 proceden de estudios descriptivos (14 [15,1%] prospectivos y uno [1,1%], retrospectivo), así como 12 reportes de un caso (12,9%), 7 series de casos (7,5%), un reporte de un caso con revisión sistemática (1,1%), una revisión sistemática con metaanálisis (1,1%), 8 revisiones sistemáticas (8,6%), 11 revisiones narrativas (11,8%), un ensayo clínico aleatorizado (1,1%) y 2 ensayos experimentales (2,2%), en línea celular de hígado humano Huh7 in vitro e in vivo, respectivamente. Cuarenta y tres artículos registran el tamaño de la muestra de cada estudio, siendo la menor los reportes de un caso (12,9%) y la mayor de 1.057.000 participantes (1,1%).
Los estudios analizaban los efectos adversos graves basados en el análisis histológico, la especie humana, participantes del estudio, poblaciones diferenciadas por etnias, tiempo desde la vacunación hasta la aparición de los síntomas (contados en días), características clínicas, período de seguimiento del proceso de enfermedad, forma de tratamiento, fallecimientos, asociación temporal, identificación de la firma inflamatoria, diseño de los análisis realizados en los estudios y la medición de los resultados.
Las tablas A1 y A2 resumen la evidencia actual común asociada con los efectos adversos inducidos después de la inoculación con vacunas contra el COVID-19, basado en el efecto de pico de las vacunas COVID-19 y en la proteína de pico del virus SARS-CoV-2, así como variables relacionadas.
Los estudios incluidos en esta revisión han demostrado la relevancia de un enfoque de biología de sistemas para correlacionar la regulación positiva de los genes asociados con la inmunidad innata, la producción de citoquinas y las respuestas a la infección por virus, concretamente los genes inducibles por IFN, con los efectos adversos observados. La mayoría de los efectos adversos fueron informados después de la vacunación con BNT162b2 (37 de 58 artículos), siguiendo la clasificación de mayor a menor: 15 de 58 artículos con mRNA-1273, 12 de 58 artículos con ChAdOx1, 7 de 58 artículos con Ad.26.COV2.S, 4 de 58 artículos con CureVac, 3 con Sinovac, uno con AZD1222 y un caso con BBIBP-CorV.
Observando la tabla A1, se comprueba que el número de días para el inicio de los síntomas era muy variante, se registra de mayor a menor: entre 0 y 365 días se encontraron 31 artículos (un 70,8%); 8 artículos (8,8%) entre 0 y 15 días; 6 artículos (6,4%) entre 1 y 7 días; 4 artículos (4,3%) para 2 días.
Aquí se revisa la comprensión actual de que las vacunas contra el COVID-19 inducen la activación inmune innata y la adaptativa. Se discute el reconocimiento inmune innato de las vacunas de ARNm y la tecnología iLNP a nivel celular y se considera la contribución de los componentes de ARNm y LNP a su inmunogenicidad. En este contexto, desempeñan un papel adyuvante para este tipo de plataforma de vacunas3. En la tabla 2 se resumen los efectos inmunológicos derivados de los eventos adversos producidos por las vacunas contra el SARS-CoV-2.
Resumen sobre los efectos inmunológicos derivados de los eventos adversos producidos por las vacunas contra el SARS-CoV-2
| TRANSCRIPCIÓN INVERSA | Dos estudios observaron el efecto in vitro de la vacuna de ARNm BNT162b2 en la línea celular del hígado humano (Huh7) (Aldén M et al. 2022 y Mouliou DS et al. 2022), confirman la entrada rápida de BNT162b2 en las células y la posterior transcripción inversa intracelular de ARNm de BNT162b2 en ADN. Es probable que las células hepáticas también presenten la proteína de espiga del SARS-CoV-2 derivada de la vacuna, explicaría que las células hepáticas sean dianas para las células T citotóxicas reactivas a la proteína espiga previamente cebadas. Los autores sugieren modelos in vivo en futuros estudios para comprender mejor los efectos de BNT162b2 en la función hepática. Muestran que BNT162b2 se transcribe inversamente a ADN en la línea celular Huh7, observan que el ADN derivado de BNT162b2 se integra en el genoma del huésped y afecta a la integridad del ADN genómico, produciendo la genotoxicidad como efecto adverso | No está claro si el ADN transcrito de forma inversa a partir de BNT162b2 se integra en el genoma celular, incluida la secuenciación del genoma completo de las células expuestas a BNT162b2, así como la distribución sistémica en tejidos de sujetos humanos que recibieron la vacuna BNT162b2, esto genera una gran preocupación. También se ha demostrado una expresión diferente de genes y proteínas, además de ciertas proteínas reguladas al alza en el metabolismo del ARN | Aldén M et al. 2022, usan un modelo celular de carcinoma para verificar la retrotransposición efectiva de LINE-1, con replicación de ADN activa que distingue de las células somáticas que no se dividen, informan la proliferación celular activa en varios tejidos, como la médula ósea o las capas basales del epitelio y durante la embriogénesis, así como en células que no se dividen y diferenciadas terminalmente, por ejemplo: las neuronas humanas. Como se ha comentado la ventaja de las plataformas de ARNm-iLNP es que no precisan la adición de adyuvantes para producir respuestas inmunitarias protectoras contra patógenos, sin embargo, las vacunas de ARNm-iLNP no son inmunosilenciosas | (Aldén M et al. 2022, Mouliou DS et al. 2022) |
| RECONOCIMIENTO DE LOS ANTÍGENOS VACUNALES COMO PATÓGENO POTENCIAL CAUSANTE DE LOS EVENTOS ADVERSOS | Se reconocen los antígenos vacunales como patógenos potenciales causantes de las reacciones autoinmunes por los mecanismos del mimetismo molecular y la activación de células T en 26 artículos | Debemos recordar que las respuestas inmunitarias innatas y adaptativas varían entre personas debido a sus componentes celulares y bioquímicos. Se confirma que la proteína del pico del SARS-CoV-2 de las vacunas COVID-19 contiene la secuencia y el motor estructural de un superantígeno, causante del síndrome hiperinflamatorio que participa en la estimulación directa de las células T y la hiperproducción de citoquinas en ciertos sujetos | - | (Saluja P et al. 2022, Garrido Suárez BB et al. 2022, Mouliou DS et al. 2022, Castaldo M et al. 2022, Verbeke R et al. 2021, Morikawa MM et al. 2022, Lagousi T et al. 2022, Zagorec N et al. 2022, Piras A et al. 2022, Abu Serhan H et al. 2022, Mohseni Afshar Z et al. 2023, Lee HJ et al. 2022, Hoffmann C et al. 2022, Magen E et al. 2022, Pisani D et al. 2022, Ekobena P et al. 2022, Caliskan I et al. 2022, Aliasin M et al. 2022, Ahmed SH et al. 2022, Finsterer J et al. 2021, Mingot-Castellano ME et al. 2022, Watanabe H et al. 2022, Chow BT et al. 2022, Zlotnik Y et al. 2022, Ameratunga R et al. 2022, Duijster JW et al. 2023) |
| EFECTO DE PICO EN EL CONTEXTO DEL EFECTO ACUMULATIVO Y LA PÉRDIDA DE LA ACTIVIDAD DEL RECEPTOR ACE2 | Además, 19 estudios observaron el «efecto de pico», conocido como «intoxicación de pico» en el contexto de saturación y posterior deterioro de la función del receptor de la enzima convertidora de angiotensina II (ACE2) | Proponen los mecanismos: 1) reacción cruzada entre antígenos extraños y autoantígenos, 2) sobreactivación de células presentadoras de antígenos y la respuesta autoinmune subsiguiente y 3) activación de células B policlonales o testigos que provocan la síntesis de citoquinas y la activación de células T autorreactivas. Los estudios evidencian que las proteínas Spike producidas tras la vacunación poseen el mimetismo nativo de la funcionalidad de unión al receptor y la estructura de prefusión de la proteína Spike del SARS-CoV-2 | Las vacunas contra el COVID-19 aumentan la síntesis endógena de proteínas de punta del SARS-CoV-2. Una vez sintetizadas, las proteínas de punta libres liberadas por las células destruidas previamente atacadas por las vacunas circulan en la sangre e interactúan con receptores ACE2 de otras células, promoviendo la internalización y degradación del ACE2, e imita las características patológicas del SARS-CoV-2, este mecanismo es conocido como efecto de pico de las vacunas COVID-19 | (Talotta R. 2022, Lee HJ et al. 2022, Castaldo M et al. 2022, Saluja P et al. 2022, Namiki T et al. 2022, Levy I et al. 2022, Piras A et al. 2022, Abu Serhan H et al. 2022, Mohseni Afshar Z et al. 2023, Lee HJ et al. 2022, Tamborska AA et al. 2022, Aliasin M et al. 2022, Azzolini E et al. 2022, Ahmed SH et al. 2022, Kim YK et al. 2022, Angelini F et al. 2022, Zlotnik Y et al. 2022, Ameratunga R et al. 2022, Duijster JW et al. 2023) |
| RELACIÓN CON LAS HIPÓTESIS SOBRE EL MIMETISMO MOLECULAR, LA FIRMA INFLAMATORIA, LA DISEMINACIÓN SISTÉMICA, LA PERSISTENCIA Y LA DISPONIBILIDAD CONTINUA Y ELEVADA DE LOS ANTICUERPOS POSVACUNALES | En 6 estudios relacionan las hipótesis comprobables sobre el mimetismo molecular, las señales inflamatorias atribuidas a la reactogenicidad posvacunal, su distribución sistémica, persistencia temporal y la posibilidad de un «efecto acumulativo» de la proteína Spike con los anticuerpos IgG anti-S e IgG anti-RBD posteriores a la vacunación, que sugieren la imitación del post-COVID-19 | Estas características favorecen la disponibilidad alta y continua de antígenos, produciendo respuestas de anticuerpos más sólidas. Tanto el ARNm que codifica el pico como la proteína pico son detectables 60 días después de la segunda dosis de BNT162b2 y ARNm-1273 en los humanos vacunados | Por lo tanto, es posible que las vacunas contra el SARS-CoV-2 compuestas por vectores víricos y de glicoproteína recombinante envíen señales inflamatorias más atenuadas o por otros mecanismos que contribuyen a la activación inmunitaria innata, no solo el ARNm encapsulado en nanopartículas lipídicas | (Mouliou DS et al. 2022, Levy I et al. 2022, Pisani D et al. 2022, Azzolini E et al. 2022, Ahmed SH et al. 2022, Kim YK et al. 2022) |
| MECANISMO ADYUVANTE ENDÓGENO QUE PARTICIPA EN LA ACTIVACIÓN INMUNITARIA INNATA | Se puede observar el potencial adyuvante endógeno en las respuestas de anticuerpos significativamente deterioradas con estas vacunas | - | - | (Mouliou DS et al. 2022, Verbeke R et al. 2021, Morikawa MM et al. 2022, Namiki T et al. 2022, Levy I et al. 2022, Lee HJ et al. 2022, Magen E et al. 2022, Pisani D et al. 2022, Azzolini E et al. 2022, Abbasi S et al. 2022) |
| HIPÓTESIS PATÓGENA ASOCIADA A LOS EFECTOS NEOPLÁSICOS, INFLAMATORIOS, NEURO-INMUNES/VASCULARES PRODUCIDOS POR LA VACUNACIÓN CONTRA EL SARS-CoV-2 | La «seudoinfección» propuesta en esta revisión se asocia más a trastornos linfoproliferativos, inflamatorios y neuromielopatías, incluye la alteración neuroinflamatoria con disrupción de la barrera hematoencefálica, que explica el desarrollo de los efectos adversos descritos | - | - | (Mouliou DS et al. 2022, Castaldo M et al. 2022, Mohseni Afshar Z et al. 2023, Hoffmann C et al. 2022, Kim JE et al. 2022, Tamborska AA et al. 2022, Magen E et al. 2022, Pisani D et al. 2022, Ekobena P et al. 2022, Caliskan I et al. 2022, Aliasin M et al. 2022, Ahmed SH et al. 2022, Umezawa S et al. 2023, Zlotnik Y et al. 2022) |
| MECANISMOS CELULARES E HIPÓTESIS PATÓGENO/VÍRICO, AUTOINFLAMATORIA, AUTOINMUNE Y PARANEOPLÁSICA ASOCIADAS A LOS EFECTOS ADVERSOS EN RECEPTORES DE VACUNAS CONTRA EL SARS-cov-2 | Se ha estudiado que la tormenta de citoquinas es causada por una infección no controlada (hipótesis patógena/vírica, por ejemplo: neurotropismo), autoanticuerpos o células T autorreactivas asociadas con mutaciones de línea germinal predisponentes (hipótesis autoinmune), mutaciones de línea germinal en genes que regulan la inflamación (hipótesis autoinflamatoria) y/o mutaciones somáticas en células de ganglios linfáticos monoclonales que resultan en la secreción ectópica de citoquinas (hipótesis paraneoplásica) en ciertos casos | La mayoría de los artículos incluidos verifican la poderosa activación inmune innata en los informes de efectos adversos locales y sistémicos posvacunales de COVID-19 en humanos, 56 artículos (un 97,8%) y 46 artículos (87%) para el mimetismo molecular | - | (Mouliou DS et al. 2022, Hajjo R et al. 2022, Verbeke R et al. 2022, Castaldo M et al. 2022, Saluja P et al. 2022, Chen Y et al. 2022, Morikawa MM et al. 2022, Lagousi T et al. 2022, Pirani V et al. 2022, Zagorec N et al. 2022, Levy I et al. 2022, Piras A et al. 2022, Abu Serhan H et al. 2022, Mohseni Afshar Z et al. 2023, Lee HJ et al. 2022, Hoffmann C et al. 2022, Wong KK et al 2022, Magen E et al. 2022, Pisani D et al. 2022, Ekobena P et al. 2022, Caliskan I et al. 2022, Aliasin M et al. 2022, Ahmed SH et al. 2022, Finsterer J et al. 2021, Umezawa S et al. 2023, Hetland G et al. 2022, Mingot-Castellano ME et al. 2022, Watanabe H et al. 2022, Abbasi S et al. 2022, Chow BT et al. 2022, Zlotnik Y et al. 2022, Ameratunga R et al. 2022) |
| BIOMARCADORES QUE RECONOCEN Y DIAGNOSTICAN LAS FORMAS GRAVES DE LAS REACCIONES ADVERSAS CAUSADAS POR LAS VACUNAS COVID-19 | Se puede observar que se utilizaron diversos biomarcadores para el reconocimiento y diagnóstico de algunas formas graves de las reacciones adversas de las vacunas contra el SARS-CoV-2, los más representativos serían:3 estudios utilizaron el factor de crecimiento endotelial vascular (VEGF) (Talotta R. 2022, Mouliou DS et al. 2022, Abu Serhan H et al. 2022);9 estudios utilizaron los interferones humanos de tipo 1: las proteínas IFN-α, IFN-β, IFN-γ, MDA5-IFN- α (Verbeke R et al. 2022, Garrido Suárez BB et al. 2022, Hajjo R et al. 2022, Mouliou DS et al. 2022, Shafiq A et al. 2022, Watanabe H et al. 2022, Szebeni J et al. 2022, Castaldo M et al. 2022, Morikawa MM et al. 2022); | Cinco estudios utilizaron las células dentríticas plasmacitoides (pDCs), como: CD123+ y BDCA2+ (Verbeke R et al. 2022, Watanabe H et al. 2022, Szebeni J et al. 2022, Castaldo M et al. 2022, Morikawa MM et al. 2022);14 estudios utilizaron las células B: inmunoglobulinas específicas (IgG anti-S e IgG anti RBD posteriores a la vacunación COVID-19 (Mouliou DS et al. 2022, Levy I et al. 2022, Pisani D et al. 2022, Azzolini E et al. 2022, Ahmed SH et al. 2022, Kim YK et al. 2022, Verbeke R et al. 2022, Mohseni Afshar Z et al. 2023, Hoffmann C et al. 2022, Finsterer J et al. 2021, Ameratunga R et al. 2022, Szebeni J et al. 2022, Castaldo M et al. 2022, Morikawa MM et al. 2022); | Once estudios utilizaron los ganglios linfáticos de drenaje y un conjunto de tipos celulares, células T: monocitos, macrófagos, células dentríticas (DC), células T auxiliares foliculares (Tfh), linfocito T citotóxico (CTL), células asesinas naturales (NK) y factor estimulante de colonias de granulocitos y macrófagos (GM-CSF) (Verbeke R et al. 2022, Mohseni, Mouliou DS et al. 2022, Mohseni Afshar Z et al. 2023, Hoffmann C et al. 2022, Magen E et al. 2022, Ekobena P et al. 2022, Finsterer J et al. 2021, Ameratunga R et al. 2022, Szebeni J et al. 2022, Castaldo M et al. 2022, Morikawa MM et al. 2022); | Once estudios utilizaron las citoquinas: factor de necrosis tumoral alfa (TNF-α) y las interleucinas IL-1, IL-1β, IL-4, IL-5, IL-6 (Zlotnik Y et al. 2022, Garrido Suárez BB et al. 2022, Ameratunga R et al. 2022, Szebeni J et al. 2022, Castaldo M et al. 2022, Morikawa MM et al. 2022, Verbeke R et al. 2022, Mohseni Afshar Z et al. 2023, Piras A et al. 2022, Hoffmann C et al. 2022, Umezawa S et al. 2023);neuropilina-1 (NRP-1) (Talotta R. 2022);proteína serina proteasa transmembrana de tipo 2 (TMPRSS2) (Aliasin M et al. 2022); |
| Cuatro estudios utilizaron receptores de la enzima convertidora de angiotensina II (ACE2) (Castaldo M et al. 2022, Piras A et al. 2022, Aliasin M et al. 2022, Ameratunga R et al. 2022);calprotectina en sangre (Hetland G et al. 2022);otras proteínas: sindecan-1 y trampa extracelular de neutrófilos (NET)-histona H3 (H3-NET) (Hetland G et al. 2022);péptidos natriuréticos (NT-proBNP) (Lee HJ et al. 2022);prostaglandina (PG) E2 (Zlotnik Y et al. 2022); | Anticuerpos específicos: 2 estudios utilizaron anticuerpos anti-acuaporina 4 (AQP4-IgG) (Umezawa S et al. 2023, Caliskan I et al. 2022), anticuerpos contra la glicoproteína del oligodentrocito (MOG-IgG) (Umezawa S et al. 2023), 3 estudios utilizaron anticuerpos contra el factor plaquetario 4 (anti-PF4) (Mouliou DS et al. 2022, Mingot-Castellano ME et al. 2022, Abbasi S et al. 2022), anticuerpos contra el glioma inactivado 1 rico en leucina (anti-LGI1) (Zlotnik Y et al. 2022), anticuerpos contra el péptido citrulinado de ciclina (CEP) (Morikawa MM et al. 2022) y anticuerpos antigangliosidos (Mohseni Afshar Z et al. 2023); | Dos estudios utilizaron proteína C reactiva (Morikawa MM et al. 2022, Hajjo R et al. 2022);neurotransmisor ácido γ-aminobutírico (GABA) (Garrido Suárez BB et al. 2022);6 estudios utilizaron receptores tipo Toll: TLR3, TLR7 y TLR8 (Verbeke R et al. 2022, Watanabe H et al. 2022, Szebeni J et al. 2022, Castaldo M et al. 2022, Morikawa MM et al. 2022, Rahimi Mansour F et al. 2023);otros resultados de laboratorio sugestivos de VITT, como son: plaquetas bajas, fibrinógeno bajo y dímero D alto, junto con títulos elevados de anti-PF4, son hallazgos clásicos (Abbasi S et al. 2022). | También, estas citoquinas interactúan con los sistemas del complemento que además de causar la inflamación y la diafonía entre la inmunidad innata-adaptativa, activa el sistema de coagulación y aumenta la permeabilidad del endotelio vascular de manera dependiente en dosis y tiempo, favoreciendo su diseminación a la circulación sistémica, que causa la inflamación elevada. (Umezawa S et al. 2023, Pisani D et al. 2022, Abu Serhan H et al. 2022, Mouliou DS et al. 2022, Levy I et al. 2022) | |
| Varios estudios proponen las plaquetas como biomarcador de inflamación, sabemos que tanto el ARNm de LNP como la proteína espiga activan las plaquetas. La identificación de VEGF en muestras de plasma mide de forma precisa las concentraciones reales de este mediador en sangre periférica, igual que otras infecciones víricas las alteraciones del VEGF causan cambios en los valores de los mediadores proinflamatorios circulantes, como el TNF-α, IL-1β, IL-6 y proteína 10 inducible por IFN-γ (IP-10) | Se ha estudiado que la concentración de VEGF en las muestras de suero podrían cambiar por el número de plaquetas, las plaquetas son la fuente promotora de VEGF | Tres estudios identifican niveles plasmáticos elevados de VEGF en personas vacunadas contra el SARS-CoV-2, siendo responsable del daño neurológico y microvascular difuso. Los autores prueban la hipótesis de que los efectos adversos neurológicos y cardiovasculares de las vacunas contra el COVID-19 podrían ser causados tanto por daño vírico directo como por la hiperactivación de la respuesta inmune. A su vez, median los síntomas prolongados de los efectos adversos | (Talotta R. 2022, Verbeke R et al. 2022, Abu Serhan H et al. 2022) | |
| RESPUESTAS DE HIPERSENSIBILIDAD A LAS VACUNAS COVID-19 | También, se pueden observar reacciones alérgicas no anafilácticas, la mayoría son HSR de tipos III y IV clasificadas según la cronología de aparición y los síntomas, fueron informadas como IMAE en el contexto de las vacunas contra el SARS-CoV-2, especialmente con vacunas de ARNm | En 10 estudios se confirman las alteraciones en las plaquetas junto la activación del sistema del complemento en la mediación de anafilaxia, CARPA y HSR por la liberación de moléculas biológicamente activas (ATP, tromboxano y quimiocinas) y moléculas inflamatorias lipídicas como el PAF, que produce la desgranulación de los mastocitos perivasculares y la liberación de tromboxano y serotonina, también causantes de las respuestas inflamatorias y las lesiones tisulares | Incluyen síntomas sistémicos y locales que afectan a los sistemas tegumentario, gastrointestinal, respiratorio y cardiovascular | (Yoshida M et al. 2023, Szebeni J et al. 2022, Granados Villalpando JM et al. 2022, Mouliou DS et al. 2022, Morikawa MM et al. 2022, Piras A et al. 2022, Pisani D et al. 2022, Ahmed SH et al. 2022, Son CS et al. 2022, Ameratunga R et al. 2022) |
| DISFUNCIÓN Y DAÑO DE LA MICROBIOTA INTESTINAL Y EL SISTEMA INMUNOLÓGICO | Tres estudios evalúan la microbiota intestinal inmunomoduladora con las vacunas COVID-19 | Sugieren el daño e inflamación de la mucosa intestinal y la disfunción del sistema inmune regional y neuro/mioentérico que provoca trastornos gastrointestinales, la persistencia de antígenos víricos en el tracto gastrointestinal con alteraciones en la permeabilidad de la barrera intestinal y la activación de respuestas fisiopatológicas de base neuro-inmuno-inflamatoria con consecuencias neuroinflamatorias y neurocognitivas | Esta hipótesis refuerza la teoría del papel mediador de la inmunogenicidad desencadenada por la vacuna, de la HSR y cómo puede inducir neurotoxicidad indirecta a través de la patogenia inmunomediada y la infección gastrointestinal | (Ameratunga R et al. 2022, Ng SC et al. 2022, Chen F et al. 2022) |
| COEXISTENCIA DE LOS EFECTOS ADVERSOS CAUSADOS POR LAS VACUNAS COVID-19 CON LA AUSENCIA DE DAÑO ORGÁNICO | Tres estudios confirman la ausencia de daño orgánico produciendo síntomas tras la administración de las vacunas COVID-19 | Se ha estudiado en trastornos inflamatorios que producían el deterioro sin enfermedad estructural acompañada. Pero la evidencia a favor de estos hallazgos es escasa dada la falta de datos publicados | - | (Zlotnik Y et al. 2022, Chen Y et al. 2022, Finsterer J et al. 2021) |
| ASOCIACIÓN DE GENES IMPLICADOS CON LOS EFECTOS TRANSCRIPCIONALES DE LAS VACUNAS DE ARNm (BNT162b2 de Pfizer) | Seis artículos evalúan genes asociados con el ciclo celular y la transcripción, se observan enfermedades relacionadas con genes implicados en los efectos transcripcionales de BNT162b2, como: enfermedades del sistema inmunológico, enfermedades víricas, autoinmunes, musculoesquelético, reumatológicas, de las articulaciones, de la piel y tejido conjuntivo, del tejido conectivo, del aparato lagrimal, xerostomía y síndrome de Sjögren (Hajjo R et al. 2022) | Magen E et al. 2022, realizaron el mapeo parcial de la secuencia de ARNm de la proteína de pico de la vacuna BNT162b2 en la muestra de una paciente, mostró un patrón inusual de expresión del ARNm de la vacuna en las células sanguíneas, específicamente, revelaron las partes «cortadas» de las moléculas de la vacuna de ARNm de BNT162b2/Pfizer, señalan que el ARNm expresado exógenamente era lo suficiente estable para persistir en el tiempo | Lagousi T et al. 2022, añaden la hipótesis de que en individuos susceptibles es posible que la respuesta inmunitaria al ARNm no se reduzca, asociaron la edad más joven con mayores alteraciones en los monocitos, respuesta inflamatoria y la expresión génica relacionada con las plaquetas poco después de la segunda dosis de la vacuna BNT162b2. Es probable que la cantidad de antígeno de ARNm contenido en cada formulación de la vacuna también pueda ser un factor en la reactogenicidad del ARNm | (Murata K et al. 2022, Mouliou DS et al. 2022, Morikawa MM et al. 2022, Lagousi T et al. 2022, Magen E et al. 2022, Hajjo R et al. 2022) |
| Çinar OE et al. 2022, incentivan realizar estudios de inmunofenotipificación ampliados para detectar la disfunción de las células B y T en la respuesta serológica a la vacunación contra el COVID-19 | - | - | - | |
| MORTALIDAD CAUSADA POR LAS VACUNAS COVID-19 | Los datos referentes a la mortalidad son limitados, esta revisión incluye 3 artículos. Murata K et al. 2022, definen la vacunación contra el COVID-19 como la seudoinfección por SARS-CoV-2 y como inductor del SIRS. Presentan 4 pacientes fallecidos por las vacunas COVID-19. Identifican 390 genes regulados al alza implicados en la desgranulación de neutrófilos y la señalización de citoquinas, 115 genes estaban regulados a la baja en los casos posteriores a la vacunación en comparación con los controles. Alertan de la necesidad de detectar esta respuesta aberrante de citoquinas, así como el análisis de polimorfismos de un solo nucleótido para prevenir estos casos | Ittiwut C et al. 2022, describen 13 casos de muerte súbita inexplicable (SUD) tras la vacunación contra el COVID-19 | Moro PL et al. 2022, reportaron 8 muertes maternas y 12 muertes neonatales, 621 (17,9%) informes fueron codificados como graves. Incluyeron: 878 (25,4%) abortos espontáneos (<20 semanas) (SAB), 101 (2,9%) episodios de sangrado vaginal, 76 (2,2%) partos prematuros (<37 semanas), 62 (1,8%) mortinatos (≥20 semanas) y 33 (sin tasa calculada) casos de bebes con defectos congénitos importantes o una anomalía cromosómica, siendo: 18 de 33 casos con la vacuna BNT162b2 y 15 de 33 casos con mRNA-1273. Registraron 107 condiciones infantiles que incluyen las 12 muertes neonatales, indican como causa de la muerte la prematuridad | (Murata K et al. 2022, Ittiwut C et al. 2022, Moro PL et al. 2022) |
| ASOCIACIÓN DE LA APOPTOSIS CELULAR Y LA LEUCEMOGÉNESIS CAUSADAS POR LA VACUNACIÓN CONTRA EL SARS-CoV-2 | Se observan 5 estudios que comparan el potencial adyuvante endógeno en la vacunación asociado a células apoptóticas y la leucemogénesis (Verbeke R et al. 2021, Mouliou DS et al. 2022), como: eventos neoplásicos malignos relacionados con el papel patógeno de la proteína espiga de las vacunas COVID-19 (trastornos mieloides clonales) (Çinar OE et al. 2022), fibromas uterinos (no malignos) (Nazir M et al. 2022), trastornos linfoproliferativos asociados a la neuropilina (NRP-1), este mediador puede interrumpir la vías fisiológicas involucradas en la angiogénesis, la nocicepción, la embriogénesis, la carcinogénesis, trastornos inflamatorios y/o neuromielopatías y alterar la barrera hematoencefálica (Talotta R. 2022) | - | - | (Verbeke R et al. 2021, Mouliou DS et al. 2022,Çinar OE et al. 2022, Nazir M et al. 2022, Talotta R. 2022) |
| INMUNIDAD DIFERENCIADA CON LA MAYOR INCIDENCIA DE LOS EVENTOS ADVERSOS EN EL SEXO FEMENINO | Se observa inmunidad diferenciada con el sexo en 6 artículos, la mayor frecuencia de los efectos adversos en las mujeres se explicaría por la respuesta inmediata más fuerte al antígeno, modulada a través del sistema inmunitario innato-adaptativo | La actividad diferencial de los genes ligados al cromosoma X y los polimorfismos del gen ChrY están regulados por el escape de la inactivación del cromosoma X y los mecanismos epigenéticos, respectivamente. La testosterona deprime la respuesta inmunitaria innata y adaptativa, esto confirmaría que las hormonas sexuales participan en el mecanismo del aumento de la reactogenicidad de las vacunas en las mujeres | Los artículos incluidos confirman que las mujeres responden a la vacunación mediante una mayor producción de anticuerpos y de citoquinas antiinflamatorias | (Moro PL et al. 2022, Green MS et al. 2022, Namiki T et al. 2022, Rahimi Mansour F et al. 2023, Nazir M et al. 2022, Mouliou DS et al. 2022) |
| TRATAMIENTOS FARMACOLÓGICOS PROBADOS TRAS LA VACUNACIÓN Y OTRAS POSIBILIDADES TERAPÉUTICAS | Administraron tratamiento inmunosupresor y/o inmunomodulador tras la vacunación en 19 artículos:esteroides sistémicos orales en ciclos cortos intermitentes (Saluja P et al. 2022);Metilprednisona intravenosa (1 gr/24 horas) durante 5 días, con descenso gradual (Chen Y et al. 2022);metilprednisona intravenosa 1.000 mg/24 horas durante 5 días, seguido de una dosis decreciente de prednisona oral durante los 10 días siguientes (Pirani V et al. 2022);pulsos de ramipril y metilprednisona durante 2 meses (Zagorec N et al. 2022); | Anti-VEGF intravítreo (n = 39 casos, 30,4%), seguido de los corticoides, 18 casos (14,2%). Incluyen otros tratamientos (trombolítico, antiagregante o anticoagulante), además del quirúrgico (Abu Serhan H et al. 2022); los antivíricos y los esteroides se han probado con frecuencia como tratamiento y aceleran la recuperación en la parálisis de Bell y la mielitis transversa, la inmunoglobulina intravenosa y la plasmaféresis puede considerarse un tratamiento eficaz para el síndrome de Guillain-BarréMetilprednisona en dosis altas (1 gr/24 horas durante 3–7 días) de inicio inmediato en todos los casos de mielitis transversa, mejoró la función neurológica y aceleró la recuperación (Mohseni Afshar Z et al. 2023); | inician prednisolona oral 0,3 mg/kg/día (20 mg), colquicina (0,6 mg/12 horas) y heparina de bajo peso molecular (enoxaparina 40 mg/día). Se redujo gradualmente la prednisolona durante 2 meses después de la interrupción de todos los medicamentos y se administró colquicina durante 3 meses. La colquicina puede ser útil para tratar el síndrome inflamatorio multisistémico (MIS) o prevenir la recurrencia de la hiperinflamación con dosis moderadas de corticoesteroides sistémicos. En el seguimiento de 2 meses los resultados de laboratorio estaban en rango normal (Lee HJ et al. 2022);bloqueo de la interleucina-6 con siltuximab. Seis meses después de la finalización del tratamiento, el paciente no experimento signos de la enfermedad de Castleman multicéntrica idiopática (iMCD) o de inflamación (Hoffmann C et al. 2022); | Proponen el mismo tratamiento para efectos adversos relacionados con otros medicamentos o procesos inflamatorios (esteroides, antivíricos, ácido acetilsalicílico y/o implante coclear) (Pisani D et al. 2022);mismo tratamiento para otros efectos adversos relacionados con las vacunas COVID-19 (esteroides, antivíricos, antihistamínicos) (Ekobena P et al. 2022);mejoría clínica parcial tras el tratamiento con metilprednisolona intravenosa, tratamiento programado a largo plazo con rituximab (Caliskan I et al. 2022);recomiendan el uso inmediato de esteroides para el tinnitus de aparición repentina posterior a la vacunación COVID-19, debido a su mecanismo inmunosupresor subyacente (Ahmed SH et al. 2022); |
| Mostró mejoría 28 días después tras el tratamiento con dosis altas de glucocorticoesteroides: 2 ciclos de terapia, cada uno de 1.000 mg de metilprednisolona intravenosa durante 3 días (el primer ciclo se inició a los 21 días tras la vacunación, el segundo ciclo se inició a los 28 días), continuo durante 16 días con 40 mg de prednisona oral y una dosis decreciente durante 2 semanas más (Umezawa S et al. 2023);inmunoglobulinas intravenosas (IVIG) (n = 13 pacientes), esteroides (n = 3 pacientes) o ninguna terapia (n = 3 pacientes). Dos pacientes requirieron plasmaféresis porque las IVIG no fueron efectivas, 6 pacientes precisaron ventilación mecánica, un caso recibió pregabalina por disestesias. Solo un caso se recuperó por completo y parcialmente en 9 casos (todavía están discapacitados). No se informó el resultado en 9 pacientes (Finsterer J et al. 2021); | Caso 1: esteroides tópicos y antihistamínicos orales. Caso 2: terapia de inmunoglobulina intravascular en dosis altas y metilprednisolona intravenosa (Watanabe H et al. 2022);apixabán como anticoagulante e inmunoglobulina intravenosa (IGIV) (1gr/kg durante 2 días), las plaquetas mejoraron. Para el tratamiento a largo plazo, se pauto apixabán durante 6 meses y la recanalización de las venas previamente trombosadas (Abbasi S et al. 2022);prednisona (Chow BT et al. 2022); | Tratado inicialmente con dosis altas de metilprednisolona (1 gr/24 horas durante 5 días), con respuesta favorable, continuó el tratamiento con prednisolona oral (1 mg/kg), presenta una mejora notable en la orientación temporal, memoria a corto plazo y la función léxico-semántica, aunque las habilidades ejecutivas continuaron afectadas. Los niveles séricos de sodio se normalizaron en 3 semanas después desde el inicio de los síntomas. Continúo mejorando progresivamente 4 meses después, todavía persiste el deterioro de las funciones ejecutivas (Zlotnik Y et al. 2022).Todos los casos que recibieron tratamiento inmunosupresor con corticoides sistémicos mostraron mejoría clínica, pero no curación total | Patterson BK et al. 2023, proponen la interrupción el eje monocítico-endotelial-plaquetario con maraviroc 300 mg/12 horas y pravastatina 10 mg/24 horas para restaurar la desregulación inmune observada en las secuelas postagudas de COVID (PASC), podría ser una alternativa terapéutica en un futuro próximo para los efectos adversos de las vacunas COVID-19. Esto ofrece el marco para un futuro ensayo aleatorizado, doble ciego, controlado con placebo para investigar más la eficacia de los fármacos inmunosupresores, especialmente los antivíricos, las estatinas y los corticoesteroides en comparación con otros inmunomoduladores como la colquicina |
Con la presente revisión sistemática se ha dado respuesta a los objetivos iniciales planteados para conocer el estado de conocimiento acerca del tema objeto de investigación.
Los hallazgos de esta revisión son relevantes para las personas en general, los médicos, las agencias reguladoras de fármacos y productos sanitarios y los responsables políticos. Las principales vías biológicas enriquecidas son las vías de respuesta inmunitaria, esenciales para inducir la respuesta inmunitaria adaptativa. Los resultados del enriquecimiento en las redes de procesos destacan los mecanismos inflamatorios e inmunes innatos asociados con la señalización de: IFN-γ, citoquinas, VEGF, activación de las plaquetas, células B (inmunoglobulinas específicas IgG anti-S e IgG anti-RBD posteriores a la vacunación COVID-19), el conjunto de tipos celulares (células T: monocitos, macrófagos, células dentríticas [DC], células T auxiliares foliculares [Tfh], linfocito T citotóxico [CTL], células asesinas naturales [NK] y factor estimulante de colonias de granulocitos y macrófagos [GM-CSF]), procalcitonina y proteína C reactiva3,15,107,156,201,22,46. Esto confirma que las vacunas producen el efecto deseado de estimular la respuesta inmune, no obstante, algunos de los procesos inmunes innatos estimulados pueden desencadenar procesos inflamatorios y causar efectos adversos posteriores a las vacunas COVID-19, principalmente la señalización de IFN-γ. Los resultados confirman que las vacunas COVID-19 inducen una fuerte respuesta inmunitaria en sujetos vacunados las primeras 4 horas (es decir, el mismo día de recibir la primera dosis y/o de refuerzo) hasta 365 días (70,8%), en comparación con las respuestas de reactogenicidad evaluadas por la clínica y la expresión génica en los días 0, 1, 2, 3, 4, 5, 6, 7, 8, 10, 12, 13, 14, 15, 17, 20, 21, 22, 30, 37, 39, 42, 60, 62, 90, 117, 120 y 180 días.
Estos resultados deben verse como hipótesis comprobables de la presencia de vínculos funcionales putativos entre las vacunas COVID-19 y las enfermedades causadas, y no deben considerarse como una prueba de que la vacuna producirá, dependerá de la inmunidad particular de cada persona. Las enfermedades vasculares y cardiovasculares se consideran factores de riesgo conocidos en los pacientes infectados por contagio con COVID-19. Hajjo R et al. 2022, identificaron 50 enfermedades enriquecidas por DEG priorizadas a partir de datos transcriptómicos de una sola célula de BNT162b2, los autores asocian el vínculo funcional con los efectos cardiovasculares de las vacunas de ARNm COVID-19.
Se puede observar que las vacunas de ARNm, especialmente BNT162b2 y mRNA-1273, inducen respuestas inmunitarias parecidas a la activación plaquetaria provocada por lipopolisacáridos (LPS). Las plaquetas, además de mediar la comunicación entre las células T y B (inmunidad adquirida), regulan la hemostasia y los mecanismos de reconocimiento de patógenos y reclutamiento de péptidos de defensa del huésped, como el factor plaquetario 4 (PF4), una quimiocina CXC derivada de las plaquetas. A su vez, la activación plaquetaria puede desarrollar efectos adversos trombóticos, como la trombocitopenia inmune inducida por la vacuna (VITT) tras la administración de las vacunas de vectores de adenovirus y de ARNm, menos común, que participan los anticuerpos contra el factor plaquetario 4 (anti-PF4). Las plaquetas y los leucocitos construyen complejos trombóticos inmunes, un signo clásico de la coagulación intravascular diseminada47,49,156.
Gran parte de la activación inmunitaria innata depende del componente iLNP de las vacunas iLNP-ARNm modificadas con nucleósidos, ya que los iLNP vacíos estimulan una variedad de citoquinas (TNF-α, IL-1, IL-1β, IL-4, IL-5, IL-6, GM-CSF) y quimiocinas9,16,55,56,76. En relación con el componente de ARNm, la modificación del nucleósido m1ψ mejoraría la tolerabilidad de las vacunas de ARNm-iLNP en los humanos al atenuar el reconocimiento inmunitario innato que favorecería la eficiencia de la traducción y la inmunidad adaptativa, incluidas las vacunas de ARNm de SARS-CoV-2 autorizadas, son capaces de inducir una respuesta de IFN de tipo 1, que plantea la posibilidad de una activación inmunitaria innata complementaria, incluso sinérgica, por el componente de ARNm9,16,87. Las células NK y las células T expresan un aumento progresivo y continuo en la presentación de genes asociados con el ciclo celular y la transcripción. Otra observación a tener en cuenta es la ruta de señalización de MDA5-IFN-α, necesaria para la respuesta de las células T, por ejemplo, CD8+ puede tener implicaciones para el desarrollo de vacunas de ARNm para otras enfermedades infecciosas y cáncer, en las que las células T CD8+ son esenciales para la inmunidad efectiva3. La regulación al alza de estas vías inmunológicas parecen ser la base de las enfermedades mediadas por el sistema inmunitario, especialmente en las mujeres jóvenes, debido a la sobreexpresión de genes ligados al cromosoma X por la respuesta antivírica requerida y la estimulación del sistema inmunitario por las vías inmunitarias y endocrinas (eje hipotálamo-hipófisis-tiroides, eje hipotálamo-pituitario-suprarrenal y eje hipotálamo-hipófisis-ovario), se centra en los efectos adversos de las mujeres en edad reproductiva1,182,185.
Se ha demostrado que los LNP catiónicos, parecidos a los utilizados en las vacunas de ARNm, funcionan como adyuvantes, pueden activar receptores de tipo Toll (TLR2, TLR3, TLR4, TLR5, TLR7 y TLR8) y las vías del inflamasoma NLRP39,156. Este hallazgo confirma que las vacunas de ARNm contra el COVID-19 producen inmunogenicidad al codificar la proteína espiga del SARS-CoV-2 y funcionan como adyuvantes por su contenido de LNP y/o las características inmunoestimuladoras intrínsecas del ARN no modificado (usado en CureVac) y ARN modificado con nucleósidos (BNT162b2, mRNA-1273). Esto explica las diferencias en la inmunogenicidad y reactogenicidad entre las vacunas COVID-19. La duración prolongada de la biopersistencia de los adyuvantes o la capacidad de las partículas adyuvantes para moverse y acumularse lentamente en los órganos linfoides y otros tejidos son importantes preocupaciones de seguridad1.
Un estudio reciente confirmó que BNT162b2 se absorbe rápidamente en la línea celular del hígado humano Huh7 in vitro, provocando cambios en la expresión y distribución de LINE-1 después de la exposición a BNT162b2, el ARNm de BNT162b2 se transcribe de forma inversa intracelularmente en ADN de 4 a 24 horas, se debe estudiar la regulación de la actividad de LINE-1 en respuesta a las vacunas de ARNm de BNT162b2. Surgen dudas sobre si el ARNm derivado de la vacuna puede integrarse en el genoma humano, que causaría la genotoxicidad1,59.
Estas características no solo ofrecen una disponibilidad alta y mantenida de antígenos, sino que favorecen respuestas de anticuerpos más sólidas, una condición que se parece a una sobredosis de vacuna, en circunstancias específicas. Se ha logrado asociar la reactogenicidad con niveles más altos de anticuerpos posteriores a la administración de las vacunas COVID-19, esto refuerza la hipótesis del efecto acumulativo, es decir, la relación entre niveles elevados anticuerpos posteriores a la vacunación (IgG anti-S, IgG anti-RBD) y su persistencia temporal, que parece imitar del pos-COVID-19. Estos datos los relacionan con el efecto acumulativo inmunitario debido a la exposición y sensibilización repetida al antígeno con cada refuerzo vacunal25,36,40,41,43.
Se han identificado mediadores en ACE2 y TMPRRS2 que afectan a la expresión de receptores relacionados no solo con el PASC sino también en los efectos adversos de las vacunas contra el COVID-19121,156. Se reconoce el efecto de pico de las vacunas COVID-19, evidencian que la proteína del pico del SARS-CoV-2 contiene la secuencia y comparte el mimetismo nativo estructural y funcional del antígeno, causante del síndrome inflamatorio que participa en la estimulación directa de las células T y la hiperproducción de citoquinas en algunos sujetos. Estas citoquinas interactúan con los sistemas del complemento que además de producir la inflamación y la diafonía entre la inmunidad innata-adaptativa, activa el sistema de coagulación y aumenta la permeabilidad de la capa endotelial de manera dependiente en tiempo y dosis, promoviendo a su vez su diseminación a la circulación sistémica, que causa la inflamación elevada y regula los síntomas persistentes de los efectos adversos. Se verifica el parecido de los antígenos vacunales como patógenos potenciales causantes de las reacciones adversas por los mecanismos del mimetismo molecular y la activación de células T.
La producción de la proteína de pico podría estudiarse en las células hepáticas, se plantea la persistencia de antígenos víricos en el tracto GI que causaría alteraciones en la permeabilidad de la barrera intestinal y la activación de respuestas fisiopatológicas de base neuro-inmuno-inflamatoria, con consecuencias neuroinflamatorias y neurocognitivas, pudiendo producirse a través de la respuesta fisiopatológica hepato-pulmonar que podría alterar a su vez las vías de señalización neuronal. Mouliou DS et al. 2022, asocian la reactividad cruzada de la proteína de pico del SARS-CoV-2 con fuertes interacciones con transglutaminasas, proteínas básicas de mielina, mitocondrias, antígenos nucleares, miosina, colágeno, claudin 5/6 y S100B, entre otras proteínas, incluyen proteínas involucradas en el tráfico de vesículas sinápticas, endocitosis, transporte axonal, transmisión neuronal, trombosis, inflamación, la barrera hematoencefálica y mitocondrial, así como los factores de crecimiento.
En los últimos años se ha demostrado la diafonía entre la microbiota intestinal humana y el sistema inmunológico, en el contexto de las vacunas COVID-19 no es una excepción, también puede modular la respuesta inmunitaria a la vacunación y la alteración microbiana repercute en la respuesta inmunitaria a las vacunas COVID-19. El desequilibrio microbiano, un estado llamado «disbiosis» predispone al cuerpo a la enfermedad. Muchos estudios destacan el papel de la microbiota intestinal en las enfermedades inflamatorias intestinales, infección por Clostridium difficile, trastornos metabólicos y neuropsiquiátricos, enfermedades autoinmunes y de la microbiota no intestinal en enfermedades como trastornos del sistema nervioso central, enfermedad pulmonar obstructiva crónica y periodontal, fibrosis quística y rinosinusitis crónica. En la actualidad, la comprensión de la disbiosis es desafiante por la intravariabilidad e intervariabilidad dependiente de la microbiota humana que dificultan la identificación de las distintas comunidades microbianas anormales y normales. Conocer la dinámica subyacente de las interacciones entre la microbiota y el sistema inmunitario es necesario para aclarar las posibles implicaciones para la salud humana tras la vacunación147–152. El sistema inmunitario se construye por un conjunto de mecanismos inmunitarios innatos y adaptativos destinados a reforzar la contención de la microbiota, la inmunidad de barrera y la reparación de tejidos desvinculada de la inflamación. La tolerancia de la microbiota intestinal normal es esencial para la homeostasis intestinal, que requiere una gran red de células inmunitarias reguladoras, incluidas las células T reguladoras (Tregs) y las células dendríticas tolerogénicas. La detección de la microbiota comensal a través de la vía de señalización TLR-MyD88 es una estrategia usada por el sistema inmunitario para mantener la homeostasis microbiana del huésped147–152. Los enfoques combinados permitirán identificar el patrón de expresión génica, la función génica, la regulación y la fisiología de las bacterias en una comunidad para mejorar la caracterización del microbioma. Los diagnósticos basados en la secuenciación del ADN no distinguen entre células bacterianas vivas y metabólicamente activas, dañadas o muertas, o ADN libre, daría una visión incompleta del perfil funcional de una comunidad microbiana. Los análisis de secuenciación de ARN pueden identificar células vivas y metabólicamente activas e informan sobre la actividad transcripcional de la comunidad. Conocer detalladamente el transcriptoma de un organismo específico facilitará reconocer los procesos celulares y aquellas proteínas que puedan expresarse y/o no producirse en las condiciones de ensayo de cultivo actuales150.
Debido al número creciente de casos con síntomas posteriores a las inoculaciones con las vacunas COVID-19 y la falta de estudios y terapias aprobadas, muchos afectados han recibido diferentes terapias. Esto se refleja en los participantes de series de casos y casos únicos en los que habían recibido tratamientos de tipo inmunosupresor e inmunomodulador, como los antivíricos, las estatinas, los corticoesteroides sistémicos y la colquicina. Esto sugiere que la fisiopatología de los efectos adversos puede ser el eje monocítico-endotelial-plaquetario.186 Manifestándose la mayoría en el cerebro, el colón, el corazón, los pulmones, junto con células endoteliales y los astrocitos. Las plaquetas estimuladas también liberan RANTES, que se unen a las células endoteliales y estimulan la adhesión de los monocitos a tejidos endoteliales inflamados y funcionan como un agente quimiotáctico para las células inflamatorias. Las plaquetas activadas y las células endoteliales también secretan VEGF que induce la hiperpermeabilidad microvascular y la angiogénesis. VEGF es un biomarcador conocido de diagnóstico proinflamatorio, protrombótico y para la neuropatía vasculítica. Patterson BK et al. 2023186 dirigen el tratamiento para la endotelialitis vascular y los efectos asociados con el PASC, compatibles con los efectos causados por las vacunas contra el SARS-CoV-2 que requieren la necesidad de asistencia para las actividades de la vida diaria (síntomas neurológicos: cefaleas graves, deterioro cognitivo, neuropatía con debilidad; disfunción autonómica como el síndrome de taquicardia ortostática postural [POTS] que consiste en taquicardia inexplicable, mareos, aturdimiento, desmayos y dolor abdominal, junto con la sensibilidad a la luz; molestias cardiorrespiratorias que causan intolerancia al esfuerzo y limitan la actividad física [incluyen las actividades básicas para la vida diaria]; fatiga junto con mialgias). Utilizan la combinación del papel protector del maraviroc sobre el endotelio con la pravastatina, dirigidos contra los receptores CCR5 y la fractalquina. Su hipótesis se ha estudiado, describen como los monocitos CD14+ y CD16+ transmigran a través de la barrera hematoencefálica y median en la inmunidad del sistema nervioso central (SNC), estos monocitos actúan como reservorios del virus de la inmunodeficiencia humana (VIH) en el SNC produciendo neuroinflamación, daño neuronal y deterioro cognitivo. Tanto el maraviroc como las estatinas atraviesan la barrera hematoencefálica y, específicamente, se ha propuesto el maraviroc como tratamiento para el Parkinson, los accidentes cerebrovasculares y el deterioro cognitivo. Los autores reportaron una mejoría en la función y la capacidad neurológica. Sus hallazgos se correlacionaron con una disminución estadísticamente significativa de VEGF (r = 0,4; p = 0,02) y sCD40L (r =0,42; p = 0,01), lo que confirma que el tratamiento dirigido a las citoquinas asociadas con la endotelialitis vascular se correlacionó con una mejoría de los síntomas neurológicos. Es posible que el antagonismo de estos receptores pueda inhibir también los efectos autonómicos, lo que sugiere que la activación de los macrófagos proinflamatorios puede provocar la endotelialitis vascular, los autores asociaron niveles elevados en sCD40L, ya relacionado con la activación simpatoadrenal. Muchos afectados con síntomas cardiacos, neurológicos y pulmonares han sido estudiados con electrocardiograma, ecocardiograma, ergometría de esfuerzo, pruebas de función pulmonar, punción de líquido cefalorraquídeo, tomografía axial computarizada y resonancia magnética, que no han detectado anomalías estructurales ni enfermedades. Solo se han tratado los síntomas con antiarrítmicos, broncodilatadores, alfa-adrenérgicos, antiinflamatorios y antidepresivos, en lugar de tratar la causa subyacente. El tratamiento propuesto mejoró la tolerancia al esfuerzo, la movilidad y los síntomas respiratorios. Tanto el maraviroc como las estatinas pueden reducir el riesgo cardiovascular al proteger el endotelio de la infiltración de macrófagos proinflamatorios (IL-2, IL-8 y TNF-α).
Es necesario realizar ensayos clínicos para comprender la variabilidad en la duración del tratamiento y adaptarlos a las condiciones clínicas personales de cada paciente. En el futuro es recomendable estudiar las proporciones de CD4/CD8 y la cantidad de anticuerpos posvacunales antes, durante y después del tratamiento.
Se debe saber que las vacunas COVID-19 no contienen virus vivos y, por lo tanto, no deberían producir la enfermedad en la persona vacunada sin estar expuesto al virus previamente. Paradójicamente, los resultados de este estudio evidencian que las vacunas COVID-19 pueden exponer a un mayor riesgo de desregulación inmunológica en algunas personas. Esta probabilidad se confirma por la evidencia reciente de la literatura biomédica publicada que relaciona la desregulación inmune, el efecto de pico de las vacunas COVID-19 y la ocurrencia temporal con los efectos adversos causados. Estos resultados son comprobables, no se confunden con la infección por SARS-CoV-2, las enfermedades autoinmunes concurrentes o previas, ni con efectos de los antecedentes genéticos del huésped en la susceptibilidad a la reactogenicidad. Sin embargo, se han informado casos de reacciones adversas sistémicas en pacientes con enfermedades alérgicas, como: el asma, fiebre del heno, rinitis alérgica, dermatitis atópicas, alergias y/o intolerancias a los alimentos, que son potencialmente susceptibles al COVID-19 y al empeoramiento de sus enfermedades crónicas después de la vacunación con BNT162b2, como la disbiosis intestinal115. Algunos informes proponen la ocurrencia de enfermedades autoinmunes posteriores a la vacunación descartando que las condiciones autoinmunes fueran diagnosticadas al inicio o reaparecieran después de las vacunas, incluyendo las infecciones. En investigaciones post mortem de muertes producidas tras la vacunación se estableció la asociación causal, todas las muertes súbitas deben ser reveladas e investigadas para determinar la evidencia clara sobre el fallecimiento posterior a las vacunas COVID-19102,171, así como las tasas de mortalidad materna y neonatal deben compararse con las tasas de referencia de las notificaciones reales publicadas. Se debe realizar una vigilancia estrecha y continua de efectos adversos en embarazadas que recibieron vacunas contra el SARS-CoV-2 por el riesgo abortivo, el retraso en el crecimiento fetal y las alteraciones congénitas provocadas.
La mayoría de los estudios incluidos tienen tamaños de muestra pequeños, algunos informes presentaban casos únicos, este fenómeno se podría relacionar con un período de observación limitado, así como la adherencia inconsistente de la población a la vacunación masiva. Los datos más completos sobre eventos adversos se publicaron en informes de seguimiento obtenidos por cuestionarios en línea, sistemas de farmacovigilancia o series de casos, algunos de estos informes podrían no estar verificados clínicamente al estar sujetos a sesgos de registro y notificación por los sistemas de farmacovigilancia.
Es preocupante que una vacuna pueda causar una desregulación inmunitaria que puede producir la enfermedad contra la que se ha desarrollado, esta observación merece una mayor investigación por parte de los fabricantes de vacunas, los centros para el control y prevención de enfermedades (CDC) y la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Es probable predecir la desregulación inmunitaria celular y humoral después de las vacunas contra el SARS-CoV-2.
Este análisis plantea realizar estudios personalizados usando firmas genéticas específicas de los pacientes, para futuras investigaciones de genómica de vacunas. La aplicación de los métodos de biología de sistemas para analizar las respuestas farmacológicas de las vacunas COVID-19 refuerza la comprensión sobre los efectos adversos posteriores a las inoculaciones156. Ofrecen hipótesis comprobables junto con los datos clínicos sobre los efectos adversos.
ConclusionesEste estudio establece el marco para futuros diseños de ensayos clínicos para investigar más sobre la eficacia, la utilidad y en especial la posible curación de los efectos adversos causados por las vacunas COVID-19.
Una mejor comprensión de la naturaleza de la reactogenicidad permitirá que el diseño de vacunas COVID-19 de próxima generación estimulen respuestas inmunitarias adaptativas más tolerables y al mismo tiempo que mitiguen o eliminen las reacciones adversas graves experimentadas por los afectados de la vacuna. La sugerencia final sería que se deben realizar más pruebas diagnósticas de laboratorio y más precisas, con la evidencia clínica, estableciendo la causalidad correcta de los informes de casos. La información clínica y de laboratorio deben valorar la condición médica actual y pasada de cada caso para comprender los efectos adversos.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLa autora declara no tener ningún conflicto de intereses relacionado con la temática del artículo.
AgradecimientosA mi familia, me ha apoyado en todo el proceso.
ApéndiceVariables identificadas de los reportes incluidos en la revisión sistemática (tiempo desde la vacunación hasta el inicio de los síntomas [días], futuras recomendaciones y limitaciones relacionadas con las vacunas COVID-19)
| Reporte | Año de publicación | Participantes del estudio | Tamaño de la muestra | Tiempo desde la vacunación hasta el inicio de los síntomas (días) | Recomendaciones | Limitaciones |
|---|---|---|---|---|---|---|
| Verbeke Ret al.3 | 2022 | - | - | En estudios preclínicos, alcanzan el pico máximo de 4 a 24 horas tras la administración de la vacuna y disminuye progresivamente, pudiendo variar entre varios días, semanas o meses.Detectables en los GL axilares hasta 60 días después de la segunda dosis con BNT162b2 y mARN-1273 en humanos vacunados, aunque la expresión del antígeno podría ser mayor | Mejorar las próximas generaciones de ARNm-iLNP, deben ofrecer mayor tolerabilidad, seguridad y eficacia para garantizar el éxito clínico. Posible alternativa para la terapia génica y tratamiento de enfermedades autoinmunes | Muchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas de ARNm, dependientes del huéspedConocimiento deficitario sobre las interacciones de los componentes de ARNm-iLNP con los mecanismos inmunitarios innatos |
| Aldén Met al.59 | 2022 | Modelo celular. Línea celular de carcinoma, con replicación de ADN activa | - | 6 horas | Mejorar las próximas generaciones de ARNm-iLNP, deben ofrecer mayor tolerabilidad, seguridad y eficacia para garantizar el éxito clínico. Posible alternativa para la terapia génica y tratamiento de enfermedades autoinmunes | Muchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas de ARNm, dependientes del huéspedDiferente expresión de genes y proteínas, activadas en varios tejidos en procesos tanto de proliferación celular como de células diferenciadas terminalmente. No se disponen datos sobre el efecto en la transferencia placentaria, sin embargo, se produce durante la embriogénesis |
| Szebeni Jet al.15 | 2022 | - | - | En estudios preclínicos, alcanzan el pico máximo de 1 a 4 días tras la administración de la vacuna intramuscular en ratones detectable en el hígado, 10 días detectable en sitio de la inoculación, pudiendo variar según HSR tipo III y/o IV. Después de la primera dosis con ARNm-LNP (BNT162b2 o mARN-1273), aunque la expresión del antígeno podría ser mayor | Mejorar las próximas generaciones de ARNm-iLNP, deben ofrecer mayor tolerabilidad, seguridad y eficacia para garantizar el éxito clínico. Posible alternativa para la terapia génica y tratamiento de enfermedades autoinmunes | Muchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas de ARNm, dependientes del huéspedConocimiento limitado sobre los mecanismos inmunitarios y farmacocinética de las vacunas BNT162b2 y mARN-1273 |
| Yoshida Met al.115 | 2023 | Modelo humano. De 5 a 11 años | 421 participantes | 1 a 7 días posteriores a la primera y segunda administración de la vacunación con BNT162b2 | Mejorar las próximas generaciones de ARNm-iLNP, deben ofrecer mayor tolerabilidad, seguridad y eficacia para garantizar el éxito clínico | Estudio limitado, es necesario investigar las reacciones adversas de la vacuna BNT162b2 a largo plazo en función de la presencia o ausencia de enfermedades alérgicas en la muestra de 5 a 11 años |
| Granados Villalpando JM et al.116 | 2022 | Modelo humano. Se admitieron ambos sexos, edad entre 18 y 65 años, residentes de Tabasco y México, previa encuesta. Se excluyeron embarazadas y mujeres lactantes | 443 participantes | Una hora tras la primera, segunda, tercera y cuarta dosis | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad, seguridad y eficacia para garantizar el éxito clínico | Es necesario investigar las reacciones adversas de las vacunas COVID-19 a largo plazoEn la mayoría de los estudios la asociación entre edad joven y mayor prevalencia de efectos adversos es sólida, en este estudio asociar la mayor edad con una mayor prevalencia de efectos adversos podría ser una variable de confusiónEs deseable una mejor distribución por edad y sexo Estudio de cohorte más grande |
| Talotta R.107 | 2022 | - | - | - | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad, seguridad y eficacia para garantizar el éxito clínico. Amerita una mayor investigación para ofrecer un tratamiento | Es necesario investigar las reacciones adversas de las vacunas COVID-19 a largo plazoMuchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas COVID-19, dependientes del huésped |
| Chen F et al.132 | 2022 | - | - | - | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad, seguridad y eficacia para garantizar el éxito clínico. Amerita una mayor investigación para ofrecer un tratamientoLos efectos adversos de la vacunación en el sistema nervioso deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solos | Es necesario investigar las reacciones adversas de las vacunas COVID-19 a largo plazo. Evaluar los riesgos potenciales en población frágilMuchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas COVID-19, dependientes del huéspedLos tratamientos disponibles actualmente solo pueden controlar la infección, cambiar la gravedad y la duración del dolor |
| Garrido Suárez BBet al.133 | 2022 | - | - | - | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínico. Amerita una mayor investigación para comprender la inmunogenicidadLos efectos adversos de la vacunación en el sistema nervioso deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solos | Es necesario investigar las reacciones adversas de las vacunas COVID-19 a largo plazoMuchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas COVID-19, dependientes del huéspedFarmacovigilancia debe considerar futuros estudios para comprender los posibles mecanismos inflamatorios a largo plazo de estas nuevas vacunas |
| Ng SC et al.147 | 2022 | Modelo humano. Se admitieron ambos sexos, tenían 18 años o más sin antecedentes de infección por SARS-CoV-2 y recibieron 2 dosis de vacunas inactivadas o una dosis de ARNm, previo cuestionario estandarizado | 138 participantes | - | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínico. Amerita una mayor investigación para comprender la inmunogenicidadSugieren la adición de adyuvantes naturales para mejorar las respuestas a la vacunación | Es necesario investigar las reacciones adversas de las vacunas COVID-19 a largo plazoMuchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas COVID-19, dependientes del huéspedDebe comparar los efectos adversos de la vacunación con los análisis de secuenciación de ARN, pueden identificar células vivas y metabólicamente activas, informando sobre la actividad transcripcional de la población |
| Hajjo Ret al.156 | 2022 | Modelo celular. Análisis con los sistemas de biología para las vacunas de ARNm de COVID-19 mediante conjuntos de datos transcriptómicos | - | 21 a 22 días | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínicoLos efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solosAmerita una mayor investigación para ofrecer un tratamiento, recomendaciones personalizadas usando firmas genéticas específicas del paciente | Es necesario investigar las reacciones adversas de las vacunas COVID-19 a largo plazoMuchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas COVID-19, dependientes del huéspedEstudios limitados de genómica de vacunas, es necesario profundizar más |
| Murata Ket al.102 | 2022 | Modelo humano. Análisis de polimorfismos de un solo nucleótido en 4 sujetos fallecidos posterior a la vacunación COVID-19 con Moderna y Pfizer | 6 participantes | 1 a 10 días | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínicoLos efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solosAmerita una mayor investigación para prevenir la muerte, recomendaciones personalizadas usando firmas genéticas específicas del paciente, secuenciación del ARN de cada sujeto | Es necesario investigar las reacciones adversas de las vacunas COVID-19 a largo plazoMuchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas COVID-19, dependientes del huéspedEstudios limitados de genómica de vacunas, se debe investigar más |
| Ittiwut Cet al.171 | 2022 | Modelo humano. Secuenciación del exoma completo, gen SCN5A | 13 participantes | 1 a 7 días | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínicoLos efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solosAmerita una mayor investigación para prevenir la muerte, recomendaciones personalizadas usando firmas genéticas específicas del paciente, secuenciación del ARN de cada sujeto | Es necesario investigar las reacciones adversas de las vacunas COVID-19 a largo plazoMuchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas COVID-19 dependientes del huéspedEstudios limitados de genómica de vacunas, se debe investigar más |
| Çinar OEet al.172 | 2022 | Modelo Humano. Mecanismos patobiológicos y causales de la toxicidad mediada por la proteína espiga y los trastornos mieloides clonales después de la vacuna BNT162b2 | 4 participantes | 30 a 37 días | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínicoLos efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solosAmerita una mayor investigación para ofrecer un tratamiento, recomendaciones personalizadas usando firmas genéticas específicas del paciente | Es necesario investigar las reacciones adversas de las vacunas COVID-19 a largo plazoMuchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas COVID-19, dependientes del huéspedEstudios publicados limitados sobre la inmunofenotipificación de las vacunas, se debe investigar más |
| Nazir M et al.173 | 2022 | Modelo humano. Mujeres entre los 18 y 30 años. La mayoría de las encuestas incluidas en el análisis se realizaron en los EE. UU., Reino Unido y Noruega, países pertenecientes al «Norte Global» | 78.138 participantes | ≥14 días | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínicoLos efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solosRecomendaciones personalizadas usando firmas genéticas específicas de las pacientes. Evaluar la condición de intoxicación de pico, el llamado «efecto de pico» | Es necesario investigar las reacciones adversas de las vacunas COVID-19 a largo plazoMuchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas COVID-19, dependientes del huéspedEstudios publicados limitados sobre los efectos adversos que cambian el eje hipotálamo-hipófisis-ovario de las vacunas, se debe investigar más |
| Moro PLet al.182 | 2022 | Modelo humano. Mujeres entre los 15 y 44 años. Residentes en EE. UU., excluyen residentes extranjeras | 3.462 participantes | 0 a ≥15 días | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínicoLos efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solosRecomendaciones personalizadas usando firmas genéticas específicas de las pacientes. Evaluar la condición de intoxicación de pico, el llamado «efecto de pico» y la mortalidad | Es necesario investigar las reacciones adversas de las vacunas COVID-19 a largo plazoMuchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas COVID-19, dependientes del huéspedEstudios publicados limitados sobre los efectos adversos que modifican el eje hipotálamo-hipófisis-ovario y, las respuestas inmunes en el tracto reproductivo femenino y su heterogeneidad dentro del órgano y entre compartimentos debido a las vacunas COVID-19, se debe investigar más |
| Rahimi Mansour Fet al.185 | 2023 | Modelo humano. Mujeres en edad reproductiva experimentan trastornos menstruales inducidos por las vacunas COVID-19 | - | - | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínicoLos efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solosRecomendaciones personalizadas usando firmas genéticas específicas de las pacientes. Evaluar los cambios de las vías inmunitarias y endocrinas | Es necesario investigar las reacciones adversas de las vacunas COVID-19 a largo plazoMuchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas COVID-19, dependientes del huéspedEstudios publicados limitados sobre los efectos adversos que modifican los ejes hipotálamo-hipófisis-ovario/suprarrenal y eje hipotálamo-pituitario-suprarrenal |
| Green MSet al.187 | 2022 | Modelo humano. Primera y segunda dosis con Pfizer: 923 participantes, ≥30 años; tercera dosis con Pfizer: 266 participantes, entre 20 y 65 años | 923 participantes | Un día | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínicoLos efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solosRecomendaciones personalizadas usando firmas genéticas específicas de las pacientes. Evaluar los cambios de las vías inmunitarias y endocrinas | Es necesario investigar las reacciones adversas de las vacunas COVID-19 a largo plazoMuchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas COVID-19, dependientes del huéspedExceso notable y constante en las tasas de eventos adversos en mujeres después de la inmunización con Pfizer-BioNTech COVID-19, en todos los grupos de edad. Sugieren factores específicos de género que influyen en la respuesta a la vacuna. Se deben explorar diferentes dosis de la vacuna para hombres y mujeres, también las diferencias de género en el fenotipo de enfermedades asociadas a mastocitos (MC), se establecen en la infancia |
| Mouliou DSet al.1 | 2022 | Modelo humano. Tratan efectos adversos publicados en informes de seguimiento elaborados por agencias farmacéuticas u obtenidos por cuestionarios en línea | - | 1 a 60 días | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínico. Para lograr resultados de vacunación óptimos y a largo plazo, se necesitan más estudios mejor diseñados y basados en mutaciones para identificar epítopos con una heterogeneidad mínimaAmeritan diseñar más adyuvantes que estimulen la inmunidad innata en lugar de la hipersensibilidad e inflamación. Piden más estudios con evidencias diagnósticas de laboratorio y clínicas utilizando firmas genéticas específicasLos efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solos | Dichos informes no son verificados clínicamente, están sujetos a un mayor sesgo y no reflejarían una condición clínica honesta. Los informes deficientes o subdiagnósticos impiden a la comunidad científica hacer asociaciones y evaluaciones purasLas dosis repetidas de refuerzo pueden conducir a la toxicidad acumulativa y la sobreestimulación inmunitaria innata que contribuye a la excesiva inflamaciónLos beneficios/riesgos parecen no estar equilibrados. Muchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas COVID-19 son dependientes del huésped. Investigar las reacciones adversas de las vacunas COVID-19 a largo plazo |
| Castaldo Met al.201 | 2022 | Modelo humano. Hay 9.338 registros, el 94% recibió BNT162b2 o ChAdOx1 | 1.057.000 participantes | 1 a 7 días | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínicoLos efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solosInvestigar las reacciones adversas de las vacunas COVID-19 a largo plazo | No ha sido posible predecir la cronología exacta del inicio, duración, desaparición y/o agravamiento del desarrollo de la cefalea postvacunalLos beneficios/riesgos parecen no estar equilibrados. Muchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas COVID-19 son dependientes del huésped |
| Verbeke Ret al.202 | 2021 | - | - | 2 días | Mejorar las próximas generaciones de ARNm-iLNP, deben garantizar mayor tolerabilidad, seguridad y eficacia para lograr el éxito clínico. Posible alternativa para la terapia génica y tratamiento de enfermedades autoinmunesInvestigar las reacciones adversas de las vacunas COVID-19 a largo plazo | Muchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas de ARNm, dependientes del huéspedNo ha sido posible predecir la cronología exacta de la duración, desaparición y/o agravamiento de los efectos adversos |
| Saluja Pet al.203 | 2022 | Modelo humano. Reporte de un caso | Un participante | 2 días | Investigar las reacciones adversas de las vacunas COVID-19 a largo plazoEvaluar la plausibilidad putativa de la vacuna COVID-19 en más estudios. Amerita una mayor investigación para comprender la inmunogenicidad | No ha sido posible predecir la cronología exacta de la duración, desaparición y/o agravamiento de los efectos adversosEstudios limitados de genómica de vacunas, se debe investigar más |
| Chen Yet al.120 | 2022 | Modelo humano. Reporte de un caso | Un participante | 2 días | Investigar las reacciones adversas de las vacunas COVID-19 a largo plazoEvaluar la plausibilidad putativa de la vacuna COVID-19 en más estudios. Amerita una mayor investigación para comprender la inmunogenicidad | No ha sido posible predecir la cronología exacta de la duración (seguimiento de 45 días sin recuperación completa), remisión y/o agravamiento de los efectos adversosEstudios limitados de genómica de vacunas, se debe investigar más |
| Morikawa MM et al.22 | 2022 | Modelo humano. Reporte de un caso | Un participante | 3 días | Investigar las reacciones adversas de las vacunas COVID-19 a largo plazoSe necesitan estudios clínicos prospectivos para comprender las reacciones inmunológicas después de la vacunación contra el COVID-19. Además, la correlación entre la artritis reumatoide (AR) y los eosinófilos debe considerarse en el entorno clínicoMejorar las próximas generaciones de ARNm-iLNP, deben garantizar mayor tolerabilidad, seguridad y eficacia | En este caso la vacunación con BNT162b2 induce la producción de citoquinas relacionadas con la AR y desencadena la fase inicial de la enfermedadEstudios limitados de genómica de vacunas, se debe hacer un seguimiento estrecho de inmunofenotipificación individual/poblacionalEs deseable una mejor distribución por edad y sexo. Estudio de cohorte más grande |
| Chen Cet al.104 | 2022 | Modelo humano. Análisis de farmacovigilancia VAERS | 14.956 informes | - | Facilitar el acceso a los resultados sobre la asociación entre las vacunas COVID-19 y los efectos adversos sobre el órgano auditivo. Se necesitan estudios clínicos prospectivos para comprender las reacciones inmunológicas después de la vacunación contra el COVID-19. Establecer la correlación entre la disfunción auditiva y las vacunas COVID-19 de ARNm y de vectores de virusMejorar las próximas generaciones de vacunas, deben garantizar mayor tolerabilidad, seguridad y eficacia | Estudios limitados de genómica de vacunas, se debe hacer un seguimiento estrecho de inmunofenotipificación individual/poblacionalEstudio de cohorte más grande. Estudios personalizados usando firmas genéticas específicas del paciente |
| Namiki Tet al.23 | 2022 | Modelo humano. Estudio basado en encuestas con trabajadoras de la salud (médicas, enfermeras) y estudiantes universitarias de Medicina de un hospital afiliado en Japón | 424 participantes | 14 a ≥30 días | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínicoLos efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solosRecomendaciones personalizadas usando firmas genéticas específicas de las pacientes. Evaluar los cambios de las vías inmunitarias y endocrinasEvaluar la condición de intoxicación de pico, el llamado «efecto de pico» | Estudios limitados de genómica de vacunas, se debe hacer un seguimiento estrecho de las respuestas de anticuerpos con la vacuna BNT162b2 a nivel individual/poblacionalEstudio de cohorte más grande. Personalizando las firmas genéticas específicas del paciente. Sugieren factores específicos de género que influyen en la respuesta a la vacuna. Se deben explorar diferentes dosis de la vacuna para hombres y mujeres |
| Lagousi Tet al.105 | 2022 | Modelo humano. Resume los estudios que muestran la incidencia de miocarditis posvacunal contra el COVID-19 en diferentes grupos de edad (≤18 - 39 años) | - | 42-120 días | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínico. La vacunología de precisión podrá identificar biomarcadores inflamatorios que pueden predecir la hiperactividad de las nuevas vacunas. Piden una evaluación preclínica urgente de las vacunas COVID-19 en diferentes grupos de población. Serían necesarios estudios de cohortes durante períodos largosLos efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solos. El perfil distintivo de inmunidad e inflamación observado después de la infección natural también se ha observado tras la administración de las vacunas COVID-19 | Estos estudios no tuvieron poder estadístico para revelar los efectos graves de miocarditis asociada a la vacuna entre hombres jóvenesEstudios previos han demostrado la relevancia de un enfoque de biología de sistemas para correlacionar la regulación positiva de los genes asociados con la inmunidad innata, la producción de citoquinas y las respuestas a la infección por virus, particularmente los genes inducibles por IFN, con los efectos adversos observados en ensayos humanos. Facilitará una mejor comprensión de los mecanismos subyacentes de los efectos secundarios |
| Pirani Vet al.106 | 2022 | Modelo humano. Serie de casos | 2 participantes | 6-8 días | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínico. Serían necesarios estudios de cohortes durante períodos largosLos efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solos. El perfil distintivo de inmunidad e inflamación observado después de la infección natural también se ha observado tras la administración de las vacunas COVID-19 | Estudios limitados de genómica de vacunas, se debe hacer un seguimiento estrecho de las respuestas de anticuerpos con la vacuna BNT162b2 a nivel individual/poblacionalIndican una investigación adicional para aclarar la fisiopatología de la neuritis óptica posterior a la vacunación con BNT162b2 de Pfizer y la interacción entre la exposición ambiental y la predisposición genética en la neuritis óptica posterior a la vacunación justifica una mayor investigación |
| Zagorec Net al.24 | 2022 | Modelo humano. Serie de casos | 2 participantes | Un día | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínico. Serían necesarios estudios de cohortes durante períodos largos para futuros seguimientos de los efectos adversosLos autores piden reaccionar a la manifestación de signos de nueva aparición de enfermedades mediadas por el sistema inmunitario después de la vacunación COVID-19 | Estudios limitados de genómica de vacunas, se debe hacer un seguimiento estrecho de las respuestas de anticuerpos con la vacuna BNT162b2 a nivel individual/poblacionalNo ha sido posible predecir la cronología exacta de la duración (seguimiento de 65-160 días con recuperación parcial o completa), remisión y/o agravamiento de los efectos adversos en su totalidad |
| Levy I et al.25 | 2022 | Modelo humano. En trabajadores de la salud | 831 participantes | 7 días | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínico. Serían necesarios estudios de cohortes durante períodos largos para futuros seguimientos de los efectos adversosLos efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solos. El perfil distintivo de inmunidad e inflamación observado después de la infección natural también se ha observado tras la administración de las vacunas COVID-19 | Estudios limitados de genómica de vacunas, se debe hacer un seguimiento estrecho de las respuestas de anticuerpos con la vacuna BNT162b2 a nivel individual/poblacionalNo ha sido posible predecir la cronología exacta de la duración (seguimiento de 4 meses), remisión y/o agravamiento de los efectos adversos en su totalidadPiden una investigación adicional para aclarar la fisiopatología de los efectos adversos posteriores a la vacunación con BNT162b2. Son necesarios estudios de cohorte más grandes, personalizando las firmas genéticas específicas de cada paciente |
| Piras Aet al.26 | 2022 | Modelo humano. Reporte de un caso y revisión narrativa de 110 informes publicados hasta julio de 2022 | 111 participantes | 5- 13 días | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínico. Son necesarios estudios de cohortes durante períodos largos para futuros seguimientos de los efectos adversosLos efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solosRecomendaciones personalizadas usando firmas genéticas específicas de los pacientes. Evaluar los cambios de las vías inmunitarias y la condición de intoxicación de pico, el llamado «efecto de pico» | Estudios limitados de genómica de vacunas, se debe hacer un seguimiento estrecho de las respuestas de anticuerpos con las vacunas COVID-19 a nivel individual/poblacionalEstudios previos han demostrado la relevancia de un enfoque de biología de sistemas para correlacionar la regulación positiva de los genes asociados con la inmunidad innata, la producción de citoquinas y las respuestas a la infección por virus, particularmente los genes inducibles por IFN, con los efectos adversos observados en ensayos humanos. Facilitará una mejor comprensión de los mecanismos subyacentes de estos efectos secundarios |
| Abu Serhan H et al.27 | 2022 | Modelo humano | 130 participantes | 5 a 10 días | Los datos disponibles muestran síntomas persistentes en la mayoría de los pacientes, siendo una característica clínica común en la mayoría de los efectos vasculares-oculares, los autores piden una nueva investigación de seguimiento a largo plazo. El problema de los efectos adversos vasculares-oculares como consecuencia de la vacunación contra el COVID-19 es una causa importante de ceguera que merece más atenciónSe necesitan más estudios que determinen la incidencia, los factores de riesgo, el pronóstico y el tratamiento de los efectos vasculares-oculares tras las inoculaciones contra el COVID-19 | Se requiere más investigación dirigida a la fisiopatología subyacente de estos efectos, sus factores de riesgo y posibles métodos de prevención y tratamiento. Se debe asesorar a las personas en riesgo sobre estos efectos antes de recibir las vacunas COVID-19, el pronóstico visual parece reservadoResaltan la falta de información de diagnóstico en muchos casos, la falta de evaluación de resultados en los afectados y la incapacidad de analizar estadísticamente el riesgo relativo debido a datos insuficientes |
| Mohseni Afshar Zet al.28 | 2023 | Modelo humano | - | ≤3 a 30 días | Futuros estudios deberán determinar el riesgo real de estos efectos adversos tras la administración de las vacunas COVID-19. Evaluar los cambios de las vías inmunitarias y la condición de intoxicación de pico, el llamado «efecto de pico»Los efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solos. El perfil distintivo de inmunidad e inflamación observado después de la infección natural también se ha observado tras la administración de las vacunas COVID-19 | Los autores enfatizan que cualquier síntoma neurológico después de la vacunación con COVID-19 puede ser potencialmente pernicioso y debe evaluarse con cautela. Enfoque de biología de sistemas para correlacionar la regulación positiva de los genes asociados con la inmunidad innata, la producción de citoquinas y las respuestas a la infección por virus, particularmente los genes inducibles por IFN, con los efectos adversos observados en ensayos humanos. Facilitará una mejor comprensión de los mecanismos subyacentes de estos efectos secundarios |
| Lee HJ et al.29 | 2022 | Modelo humano | Un participante | 20 a 62 días | Durante la pandemia COVID-19, la colquicina fue uno de los fármacos que se exploró para su reutilización como posible fármaco antiinflamatorio en función de su mecanismo de acción. Plantean la hipótesis de que la colquicina puede ser útil pata tratar el MIS o prevenir la recurrencia de la hiperinflamación con dosis moderadas de corticoesteroides sistémicos. Los efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solos. Se deben evaluar los cambios de las vías inmunitarias y el efecto de picoPara detectar y tratar estos efectos adversos, se debe continuar el monitorización de la seguridad de la vacuna y la investigación de cualquier efecto adverso. Los médicos deben realizar un historial completo, una exploración física y de laboratorio para descartar otras enfermedades concurrentesSi la sospecha clínica de MIC-A es alta, no se debe demorar el tratamiento | La comprensión actual de la fisiopatología del MIS-C/A está creciendo, pero aún no está clara. Actualmente no existen protocolos establecidos para la gestión del MIS-C/A. La atención de apoyo general y la vigilancia estrecha de posibles compromisos son cruciales. Los esteroides en dosis altas también se han usado como agentes antiinflamatorios en la mayoría de los casos de MIS-A informados después de la vacunación contra el COVID-19La colaboración de investigación internacional es esencial para protocolizar las mejores acciones de tratamiento para cualquier efecto adverso |
| Chen CCet al.30 | 2022 | Modelo humano | 112 participantes | 4 a 10 días | Los efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solos. El perfil distintivo de inmunidad e inflamación observado después de la infección natural también se ha observado tras la administración de las vacunas COVID-19. Se deben evaluar los cambios de las vías inmunitarias y el efecto de picoEs útil con otras plataformas de vacunas para estudiar las propiedades vasculares | Estudio limitado por la proporción de sujetos con efectos cardiovasculares (muestra pequeña), para reforzar la confiabilidad de los análisis de puntuación de variabilidad del pulso se necesitan más participantes |
| Hoffmann Cet al.31 | 2022 | Modelo humano | Un participante | 14 días | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínicoRecomendaciones personalizadas usando firmas genéticas específicas de los pacientes. Evaluar los cambios de las vías inmunitarias y la condición de intoxicación de pico, el llamado «efecto de pico» | Estudios limitados de genómica de vacunas, se debe hacer un seguimiento estrecho de las respuestas de anticuerpos con las vacunas COVID-19 a nivel individual/poblacionalEstudios previos han demostrado la relevancia de un enfoque de biología de sistemas para correlacionar la regulación positiva de los genes asociados con la inmunidad innata, la producción de citoquinas y las respuestas a la infección por virus, particularmente los genes inducibles por IFN, con los efectos adversos observados en ensayos humanos. Facilitará una mejor comprensión de los mecanismos subyacentes de estos efectos secundarios |
| Wong KKet al.32 | 2022 | Modelo humano | 62.679 participantes | 0 a 365 días | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínicoLos efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solosRecomendaciones personalizadas usando firmas genéticas específicas de las pacientes. Evaluar la condición de intoxicación de pico, el llamado «efecto de pico» | Los autores alertan su potencial dañino para la salud a largo plazo para las mujeres. Destacan el deber de realizar estudios de base poblacional, que registre: variación epigenética debido a los polimorfismos genéticos de las comunidades étnicas, poblaciones de riesgo, seguir más ciclos durante períodos más largos para estudiar las consecuencias a largo plazo, no evalúan el riesgo para el embarazo. Muchas variables pueden afectar la reactogenicidad e inmunogenicidad de las vacunas COVID-19, dependientes del huéspedEstudios publicados limitados sobre los efectos adversos que modifican el eje hipotálamo-hipófisis-ovario y, las respuestas inmunes en el tracto reproductivo femenino y su heterogeneidad dentro del órgano y entre compartimentos debido a las vacunas COVID-19, se debe investigar más |
| Kim JEet al.33 | 2022 | Modelo humano | 4.290 participantes | - | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínicoInvestigar las reacciones adversas de las vacunas COVID-19 a largo plazoEvaluar la plausibilidad putativa de la vacuna COVID-19 en más estudios | No ha sido posible predecir la cronología exacta de la duración, seguimiento, remisión y/o agravamiento de los efectos adversosEstudios limitados de genómica de vacunas, se debe investigar más para comprender la inmunogenicidad |
| Tamborska AA et al.34 | 2022 | Modelo humano | 70 participantes | ≤12 a 90 días | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínicoInvestigar las reacciones adversas de las vacunas COVID-19 a largo plazoEvaluar la plausibilidad putativa de la vacuna COVID-19 en más estudios y el efecto de picoLos médicos y los organismos de vigilancia deben estar atentos a este efecto adverso y sus variantes atípicas | No pudieron asegurar que todos los pacientes tuvieran el mismo estudio microbiológico, electrofisiológico y de anticuerpos antigangliosidos. Notifican solo un paciente positivo para anticuerpos antigangliosidos, posiblemente debido a que las pruebas se analizaron en servicios de diagnóstico de rutina en lugar de un laboratorio especializadoEl sistema de vigilancia está sujeto al sesgo de verificación y de notificación de casos, así como al subregistro. La comparación de la distribución por edad está limitada por la determinación de casos y no esta ajustada por factores de confusión, por ejemplo, por la administración de diferentes vacunas en varias edades |
| Magen Eet al.35 | 2022 | Modelo humano. Reporte de un caso | Un participante | 4 días | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínicoResaltan la necesidad de realizar más estudios para comprender la autoinmunidad causada por las vacunas de ARNm modificado. Se necesitan ensayos clínicos adecuados para diseñar nuevas vacunas contra el COVID-19 sin riesgo de efectos adversos, en diferentes grupos poblaciones (con enfermedades autoinmunes - alergias, diferentes edades, diferentes etnias) | Se deben valorar los mecanismos que pueden afectar a la vacunación, son complejos e incluyen factores relacionados con las vacunas COVID-19 (naturaleza del antígeno, sistema de administración, adyuvantes e inmunomoduladores), el sistema inmunitario del huésped y la microbiota intestinal. Han demostrado este «potencial adyuvante endógeno» en las respuestas de anticuerpos significativamente deterioradas con estas vacunas |
| Pisani Det al.36 | 2022 | Modelo humano. Incluye 11 artículos científicos sobre trastornos audiovestibulares tras las vacunas contra el COVID-19 | - | 3 a 42 días | Falta sistematizar y estandarizar la información clínica, por subregistro de las notificaciones de los efectos adversos, así como del seguimiento y tratamiento de los afectados. Dificulta la interpretación de los resultadosSe deben investigar las reacciones adversas de las vacunas COVID-19 a largo plazo | Ausencia de pruebas de PCR-RT que podrían descartar la infección por SARS-CoV-2 en estos pacientes. Existe una sospecha razonable si los síntomas se deben a una infección por COVID-19, caracterizándose también por un alto tropismo neural con daño potencial en el oído interno, incluso en formas leves |
| Ekobena Pet al.37 | 2022 | Modelo humano | 4 participantes | ≥12 horas a 15 días | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínicoLos efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solos | Es necesario investigar las reacciones adversas de las vacunas COVID-19 a largo plazo. No ha sido posible predecir la cronología exacta del seguimiento, remisión y/o agravamiento de los efectos adversosMuchas variables dependientes del huésped pueden afectar la reactogenicidad e inmunogenicidad de las vacunas COVID-19Estudios publicados limitados sobre los efectos adversos otorrinolaringológicos, caracterizados también por un alto tropismo neural con daño en el oído interno, incluso en formas leves, se debe investigar más |
| Caliskan Iet al.38 | 2022 | Modelo humano. Informe de un caso | Un participante | Un día | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínicoLos efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solos | Señalan la necesidad de continuar el seguimiento de estos efectos adversos autoinmunes después de la vacuna de BNT162b2 e investigar los mecanismos de activación del sistema inmunológico en el desarrollo de la autoinmunidad del sistema nervioso central relacionada con la vacuna de ARNmNo ha sido posible predecir la cronología exacta de la duración, seguimiento, remisión y/o agravamiento de los efectos adversos |
| Aliasin Met al.39 | 2022 | Modelo humano | - | - | Se deben realizar más estudios con poblaciones más grandes. Los efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 por infección en lugar de considerarse solosMejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínico. Paralelamente, recomiendan encarecidamente buscar ciertos factores de riesgo modificables y no modificables que han predispuesto a los afectados a reaccionar de forma exagerada a las vacunas COVID-19 y a desarrollar efectos adversos graves. Por ejemplo, muestran la tasa de SGB tras la vacunación, aumenta con las mujeres que tienen entre 30 y 49 años, también tienen un mayor riesgo de trombosis del seno venoso cerebral (CVST) desencadenado por la trombocitopenia trombótica inducida por la vacuna (VITT) en personas vacunadas con vectores adenovíricas. Se proponen diferentes tipos de neuropatías craneales relacionadas con las vacunas de ARNmLa información recopilada por los informes de vigilancia de vacunas puede ayudar a los sistemas de atención médica a comparar diferentes plataformas y determinar la tolerabilidad en las diferentes poblaciones. Esto también puede guiar a los formuladores de políticas para que decidan y actúen correctamente | Proponen el estudio de los siguientes mecanismos: reacción cruzada entre antígenos extraños y autoantígenos, sobreactivación de células presentadoras de antígenos y la respuesta autoinmune subsiguiente y activación de células B policlonales o testigos que provocan la síntesis de citoquinas y la activación de células T autorreactivasEste enfoque facilitará a los expertos a determinar las contraindicaciones y precauciones exactas que deben tenerse en cuenta para tratar o evitar los efectos adversos de las vacunas COVID-19Los estudios también deben centrarse en las diferentes características de varias plataformas de vacunas. Se ha demostrado que es más probable que ocurran algunos resultados adversos después de ciertas plataformas de vacunas |
| Azzolini Eet al.40 | 2022 | Modelo humano. Cohorte prospectiva en profesionales de la salud de un hospital de atención terciaria en el Norte de Italia. Estudio IgG-COVID | 4.156 participantes | 10 días | Los cuestionarios autoinformados podrían aumentar el perfil de seguridad de la vacuna. Falta sistematizar y estandarizar la información clínica, por subregistro de las notificaciones de los efectos adversos, dificulta la interpretación de los resultadosSe deben investigar las reacciones adversas de las vacunas COVID-19 a largo plazoRecomendaciones personalizadas usando firmas genéticas específicas de los pacientes. Evaluar los cambios de las vías inmunitarias y el «efecto de pico» | Los datos autoinformados pueden no estimar bien la correlación entre los efectos adversos y la vacuna BNT162b2, la incidencia de efectos adversos debe obtenerse de estudios similares con un período de seguimiento más largoLa edad de esta población puede no reflejar la población general, el perfil de tolerabilidad en los sujetos mayores y la respuesta de IgG pueden diferir significativamente. La representación de los signos y síntomas puede ser menos confiable y representativa. Los autores señalan que no disponen del historial médico de los sujetos inscritos y tampoco pueden descartar la presencia de inmunosupresores en curso o comorbilidades coexistentes en la determinación de los efectos adversos o la respuesta sérica a la vacunación |
| Ahmed SHet al.41 | 2022 | Modelo humano | 4 participantes | ≥ 5 horas a 6 días | Se debe investigar la asociación entre las vacunas y otras desregulaciones vasculares, pueden interrumpir el flujo sanguíneo laminar y causar tinnitus pulsátil. La posibilidad de que uno o más componentes de la vacuna ejerzan efectos otóxicos no puede descartarse y requiere atenciónValorar las reacciones adversas de las vacunas COVID-19 a largo plazo, no solo la naturaleza transitoria | Estudios limitados de genómica de vacunas, se debe hacer un seguimiento estrecho de las respuestas de anticuerpos con las vacunas COVID-19 a nivel individual/poblacionalEstudios previos han demostrado la relevancia de un enfoque de biología de sistemas para correlacionar la regulación positiva de los genes asociados con la inmunidad innata, la producción de citoquinas y las respuestas a la infección por virus, particularmente los genes inducibles por IFN, con los efectos adversos observados en ensayos humanos. Facilitará una mejor comprensión de los mecanismos subyacentes de estos efectos secundarios |
| Shafiq Aet al.204 | 2022 | Modelo humano | 61 participantes | 3 a 14 días | Recomiendan caracterizar sistemáticamente los efectos adversos posteriores a la vacunación. Facilitará la identificación y el tratamiento precoz, así como el registro de la evidencia sobre la incidencia de los efectos adversos neurológicos. Se debe evaluar la plausibilidad putativa de la vacuna COVID-19 en más estudios y el efecto de picoMejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínico. Investigar las reacciones adversas de las vacunas COVID-19 a largo plazoLos médicos y los organismos de vigilancia deben estar atentos a este efecto adverso y sus variantes atípicas | Subregistro de los efectos adversos después de la administración de otras vacunas. La incidencia podría no ser realLa comparación de la distribución por edad está limitada por la determinación de casos, si esta ajustada por factores de confusión, por ejemplo, por la administración de diferentes vacunas en varias edades |
| Son CSet al.42 | 2022 | Modelo humano | 256.994 participantes | ≥5 horas a 15 días | Recomiendan recopilar la información sobre los efectos adversos de varias vacunas contra el SARS-CoV-2. Se debe: detectar efectos adversos inusuales, raros o nuevos; monitorear y seguir las tendencias de los informes (duración, remisión vs. curación y agravamiento); identificar factores de riesgo potenciales para efectos adversos particulares; detectar errores de administración y problemas de seguridad de las vacunas (conocimiento publicado limitado sobre la seguridad de las vacunas COVID-19)Valorar las reacciones adversas de las vacunas COVID-19 a largo plazo, no solo la naturaleza transitoria | Subregistro de los efectos adversos después de la administración de otras vacunas. La incidencia podría no ser real. La representación de los signos y síntomas puede ser menos representativaLa comparación de la distribución por edad está limitada por la determinación de casos, esta ajustada por factores de confusión, por ejemplo, por la administración de diferentes vacunas en varias edades, pero no incluye menores de 20 años |
| Kim YKet al.43 | 2022 | Modelo humano | 497 participantes | 0 a 117 días | Es necesario investigar y evaluar la efectividad vs reactogenicidad de las vacunas COVID-19 para desarrollar futuras políticas de vacunaciónMejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínico. Investigar las reacciones adversas de las vacunas COVID-19 a largo plazoLos médicos y los organismos de vigilancia deben estar atentos a este efecto adverso y sus variantes atípicas | No hay un control estricto del período transcurrido desde la vacunación. Por lo tanto, no hay concordancia entre los ensayosNo pudieron medir la cantidad precisa de anticuerpos por los límites paramétricos del laboratorioNo evaluaron la reactogenicidad de las vacunas a largo plazo (valoran hasta los 4 meses posteriores a la inoculación) |
| Finsterer Jet al.44 | 2021 | Modelo humano | 19 participantes | ≥3 horas a 39 días | Estos casos fueron recopilados por vigilancia pasiva y no fueron casos revisados. Según el subcomité COVID-19 del Comité Asesor Mundial sobre Seguridad de las Vacunas (GACVS) de la OMS sobre los informes de síndrome de Guillain-Barré tras las vacunas contra el vector de adenovirus COVID-19, solo han notificado casos raros de SCoVaG. El comité justifica estudios más rigurosos que utilicen fuentes de datos alternativas y diseños de estudios sólidos, que comparen poblaciones vacunadas y no vacunadasLa información recopilada por los informes de vigilancia de vacunas puede ayudar a los sistemas de atención médica a comparar diferentes plataformas y determinar la tolerabilidad en las diferentes poblaciones. Esto también puede guiar a los formuladores de políticas para que decidan y actúen correctamente | Los estudios también deben centrarse en las diferentes características de varias plataformas de vacunas. Se ha demostrado que es más probable que ocurran efectos adversos después de ciertas plataformas de vacunasNo se diagnosticó el síndrome de Guillain-Barré según los criterios validados de Brighton, sin diagnóstico por recuento de células en el líquido cefalorraquídeo (LCR) y sin la aplicación de estudios de conducción nerviosa (NCS) en todos los pacientes. Se debe recordar que la ausencia de daño orgánico también puede ocurrir en estos trastornos inflamatorios produciendo un deterioro de la función neurológica sin enfermedad estructural acompañada |
| Umezawa Set al.45 | 2023 | Modelo humano | Un participante | 1 a 17 días | No se produjeron reacciones inflamatorias locales en su brazo izquierdo (brazo inoculado), aunque esta característica fuera una coincidencia debe discutirse en términos de fisiopatologíaLos efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solos | Piden una investigación adicional sobre la fisiopatología del trastorno del espectro de neuromielitis óptica posterior a la vacunación con BNT162b2 de PfizerNo ha sido posible predecir la cronología exacta de la duración, seguimiento, remisión tota/parcial y/o agravamiento de los efectos adversos |
| Hetland Get al.46 | 2022 | Modelo humano | 50 participantes | 0 a 10 días | Se deben supervisar los efectos adversos emergentes, el análisis de NET también podría utilizarse con la vacuna de Janssen, que también es una vacuna de vector adenovírico y ha sido informada por desencadenar VITTUn punto fuerte a tener en cuenta para futuros estudios es la comparación de los resultados después de la vacunación con ChAdOx1 con controles sanos no vacunados de una población similar, que databan de la prepandemia COVID-19 (año 2015), por lo tanto, no estaban sensibilizados con el virus SARS-CoV-2Reiteran realizar ensayos relevantes sobre la inflamación, como demuestran en su estudio el alto grado de correlación entre sus resultados y el grado de gravedad de los efectos secundarios tras la vacunación. También estudios observacionales más grandes | Hay pocos informes sobre estos biomarcadores inflamatorios tras la vacunación con ChAdOx1 para COVID-19 en relación con el resultado clínico, la investigación en este contexto contribuye a la comprensión de los efectos adversos graves de la trombocitopenia trombótica inmune inducida por vacuna (VITT)Afecta al poder estadístico, el número de participantes del estudio es limitado, está sujeto a la variabilidad de los efectos adversos |
| Mingot-Castellano ME et al.47 | 2022 | Modelo humano | - | - | Es esencial el diagnóstico rápido y preciso para iniciar el tratamiento y continuar la vigilancia y la publicación de casos, es necesario conocer la incidencia real de estos efectos adversosMejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínico. Investigar las reacciones adversas de las vacunas COVID-19 a largo plazoLos médicos y los organismos de vigilancia deben estar atentos a estos efectos adversos y sus variantes atípicas | No ha sido posible predecir la cronología exacta de la duración, seguimiento, remisión y/o agravamiento de los efectos adversosMuchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas COVID-19, dependientes del huéspedEstudios limitados de genómica de vacunas, se debe investigar más para comprender la inmunogenicidad. Farmacovigilancia debe considerar futuros estudios para comprender los posibles mecanismos inflamatorios a largo plazo de estas nuevas vacunas |
| Watanabe Het al.48 | 2022 | Modelo humano | 2 participantes | 2 días | Recomiendan la investigación adicional de las células dentríticas plasmocitoides dérmicas (p-DC) en la erupción por fármacos y los exantemas víricas para determinar si las erupciones son causadas por la vacunación. Se necesitan estudiar más casos para establecer la importancia clínica de los biomarcadores de p-DCMejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad, seguridad y eficacia para garantizar el éxito clínico. Amerita una mayor investigación para ofrecer un tratamiento | Es necesario investigar las reacciones adversas de las vacunas COVID-19 a largo plazoMuchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas COVID-19 son dependientes del huésped |
| Abbasi Set al.49 | 2022 | Modelo humano | Un participante | 15 días | Es esencial el diagnóstico rápido y preciso para iniciar el tratamiento y continuar la vigilancia y la publicación de casos, es necesario conocer la incidencia real de estos efectos adversosMejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínico. Investigar las reacciones adversas de las vacunas COVID-19 a largo plazoLos médicos y los organismos de vigilancia deben estar atentos a estos efectos adversos y sus síntomas (cefalea, dolor abdominal y signos neurológicos) los primeros 5 - 24 días posteriores a la vacunación después de la primera dosis. El diagnóstico y el tratamiento son vitales para prevenir la morbimortalidad | No ha sido posible predecir la cronología exacta de la curación y/o agravamiento de los efectos adversosMuchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas COVID-19, dependientes del huéspedEstudios limitados de genómica de vacunas, se debe investigar más para comprender la inmunogenicidad Farmacovigilancia debe considerar futuros estudios para comprender los posibles mecanismos inflamatorios a largo plazo de estas nuevas vacunas. El estudio de los casos sospechosos incluye el perfil de coagulación, dímero D, fibrinógeno y niveles de anti-PF4 |
| Chow BTet al.50 | 2022 | Modelo humano | Un participante | 7 días | Es necesario caracterizar sistemáticamente los efectos adversos posteriores a la vacunación. Facilitará la identificación y el tratamiento precoz, así como el registro de la evidencia sobre la incidencia de los efectos adversos. Se debe evaluar la plausibilidad putativa de la vacuna mRNA-1273 en más estudios y el efecto de picoMejorar las próximas generaciones de vacunas ARNm COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínico. Investigar las reacciones adversas de las vacunas ARNm COVID-19 a largo plazoLos médicos y los organismos de vigilancia deben estar atentos a este efecto adverso y sus variantes atípicas | Muchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas de ARNm, dependientes del huéspedDiferente expresión de genes y proteínas, activadas en varios tejidos en procesos tanto de proliferación celular como de células diferenciadas terminalmente. Se deben comparar los efectos adversos de la vacunación con los análisis de secuenciación de ARN, pueden identificar células vivas y metabólicamente activas, informando sobre la actividad transcripcional de la población |
| Zlotnik Yet al.51 | 2022 | Modelo humano | Un participante | 14 a 21 días | Mejorar las próximas generaciones de vacunas ARNm COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínico. Amerita una mayor investigación para comprender la inmunogenicidadLos efectos adversos de la vacunación en el sistema nervioso deben compararse con los resultados adversos del post-COVID-19 en lugar de considerarse solos | Es necesario investigar las reacciones adversas de las vacunas COVID-19 a largo plazoMuchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas COVID-19, dependientes del huéspedFarmacovigilancia debe considerar futuros estudios para comprender los posibles mecanismos inflamatorios a largo plazo de estas nuevas vacunas |
| Ameratunga R et al.52 | 2022 | Modelo humano | Un participante | Un día | Futuros estudios deberán determinar el riesgo real de estos efectos adversos tras la administración de las vacunas COVID-19. Evaluar los cambios de las vías inmunitarias y la condición de intoxicación de pico, el llamado «efecto de pico»Es necesario realizar más estudios para comprender la autoinmunidad causada por las vacunas de ARNm modificado. Se necesitan ensayos clínicos adecuados para diseñar nuevas vacunas contra el COVID-19 sin riesgo de efectos adversos, en diferentes grupos poblaciones (con enfermedades autoinmunes- alergias, diferentes edades, diferentes etnias)Los efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solos. El perfil distintivo de inmunidad e inflamación observado después de la infección natural también se ha observado tras la administración de las vacunas COVID-19 | Se deben valorar los mecanismos que pueden afectar a la vacunación, son complejos e incluyen factores relacionados con las vacunas COVID-19 (naturaleza del antígeno, sistema de administración, adyuvantes - inmunomoduladores y el sistema inmunitario del huésped). Han demostrado este «potencial adyuvante endógeno» en las respuestas de anticuerpos significativamente deterioradas con estas vacunas. El perfil de ARN de una sola célula facilitará la identificación celular, pero no fue posible en este caso debido a la degradación del ARN post mortemMuchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas COVID-19 son dependientes del huéspedFarmacovigilancia debe considerar futuros estudios para comprender los posibles mecanismos inflamatorios a largo plazo de estas nuevas vacunas |
| Duijster JWet al.53 | 2023 | Modelo humano | 16.929 participantes | 30 a ≥180 días | Mejorar las próximas generaciones de vacunas COVID-19, deben ofrecer mayor tolerabilidad y seguridad para garantizar el éxito clínicoLos efectos adversos de la vacunación deben compararse con los resultados adversos del pos-COVID-19 en lugar de considerarse solosRecomendaciones personalizadas usando firmas genéticas específicas de las pacientes. Evaluar la condición de intoxicación de pico, el llamado «efecto de pico» | Es necesario investigar las reacciones adversas de las vacunas COVID-19 a largo plazoMuchas variables que pueden afectar la reactogenicidad e inmunogenicidad de las vacunas COVID-19, dependientes del huéspedEstudios publicados limitados sobre los efectos adversos que modifican el eje hipotálamo-hipófisis-ovario y, las respuestas inmunes en el tracto reproductivo femenino y su heterogeneidad dentro del órgano y entre compartimentos debido a las vacunas COVID-19, se debe investigar más |
Variables identificadas de los reportes incluidos en la revisión sistemática (diseño, inmunogenicidad/reactogenicidad y características clínicas relacionadas con las vacunas COVID-19)
| Reporte | Diseño y objetivos del estudio | Situación clínica-epidemiológica |
|---|---|---|
| Verbeke R et al. 20223 | Revisión narrativa. Se discuten los mecanismos de detección inmune innata de las vacunas de ARNm a nivel celular e intracelular e identifican la contribución de los componentes de ARNm y LNP a su inmunogenicidad y reactogenicidad. Comprensión mecánica detallada sobre como las vías inmunitarias innatas modulan la inmunidad adaptativa en las respuestas de las vacunas de ARNm | Limitado. Datos recientes obtenidos de estudios descriptivos y basados en hipótesis sobre la dinámica y activación de las células inmunitarias innatas. Estudios experimentales que evalúan la producción de proteínas in vitro o in vivo en modelos animales y humanos. Distribución sistémica |
| Aldén M et al. 202259 | Estudio experimental, en línea celular de hígado humano Huh7 in vitro. Investigar la captación de BNT162b2 en la línea celular de hígado humano Huh7, los cambios en la expresión y distribución de LINE-1. Demostrar que el ARNm de BNT162b2 se transcribe de forma inversa intracelularmente en ADN tras la exposición a BNT162b2 en ≤6 horas. Investigar la acumulación intracelular del antígeno de BNT162b2 en las células Huh7 de la línea celular del hígado humano | La vacuna de ARNm puede distribuirse de forma inespecífica a varios órganos como el hígado, el bazo, el corazón, los riñones, los pulmones, el cerebro, la médula ósea, las capas basales del epitelio, los ovarios y los testículos. La concentración del hígado es 100 veces inferior al sitio de la inyección intramuscular. Potencial mediador en la genotoxicidad y carcinogenicidad |
| Szebeni J et al. 202215 | Revisión narrativa. Tuvo como objetivo evaluar los mecanismos de la HSR en las vacunas de ARNm del SARS-CoV-2. Demuestra que los mismos componentes de las vacunas ARNm-LNP tienen efectos inmunoestimuladores tanto sobre células efectoras y diana como rutas bioquímicas (sistema del complemento y coagulación) esenciales para el éxito clínico | Limitado. Datos recientes obtenidos de estudios descriptivos y experimentales sobre la dinámica y activación de las células inmunitarias innatas relacionados con la HSR y otros tipos de IMAE debido a la amplia variabilidad interindividual de efectos adversos notificados (niveles de citoquinas, presencia de anafilatoxinas, productos de división del complemento, triptasa, histamina, heparina, PAF, anticuerpos inducidos y/o prexistentes y espectro de mediadores inflamatorios) en las respuestas inmunitarias. Potencial mediador en la genotoxicidad e inmunodeficiencia. Distribución sistémica |
| Yoshida M et al. 2023115 | Estudio descriptivo, de cohortes (duración 3 meses) que utilizó un cuestionario en papel. Investigar el tipo y la frecuencia de reacciones adversas en sujetos sanos y con enfermedades alérgicas de 5 a 11 años durante los primeros 7 días posteriores a la primera y segunda vacunación con BNT162b2 | Distrito de Ishikawa (4 municipios de 1.536 personas de 5 a 11 años. De los 806 niños reclutados, 421 (52,2%) aceptaron participar en el estudio. La edad media fue de 8,8 ± 1,9 años, 216 (51,3%) eran varones, 216 (51,3%) tenían enfermedades alérgicas y 190 (45,1%) experimentaron reacciones adversas sistémicas. Perfil de enfermedad alérgica de los pacientes: 162 tenían fiebre del heno, 71 rinitis alérgica, 54 dermatitis atópica, 46 asma y 16 alergias alimentarias. De los 216 participantes con enfermedades alérgicas, 45 (20,8%) experimentaron un empeoramiento de sus enfermedades crónicas después de la primera dosis con BNT162b2, 41 (19%) después de la segunda dosis con BNT162b2 y 54 (12,8%) refirieron un empeoramiento de sus enfermedades crónicas tras la primera y/o segunda dosis con BNT162b2. La frecuencia de empeoramiento de enfermedades crónicas (p<0,001), fatiga (p = 0,002) y nauseas (p = 0,038) tras la segunda dosis con BNT162b2 fue significativamente mayor entre las personas con enfermedades alérgicas |
| Granados Villalpando JM et al. 2022116 | Estudio descriptivo, transversal (duración 3 meses). Asociar los efectos adversos entre las vacunas COVID-19 y las reacciones alérgicas entre las categorías: sexo, edad y ausencia o presencia de comorbilidades. Evaluar sus factores de riesgo | Tipificación y clasificación epidemiológica, incluye: sexo, edad, vacunas aplicadas, infección por COVID-19 posterior a la vacunación, comorbilidades (especialmente las alergias y asma), número de dosis (1.272), efectos adversos y reacciones alérgicas. Las vacunas BNT162b2 50,62% (644 dosis) y ChAdOX1 41,9% (533 dosis) están fuertemente asociadas con la aparición de reacciones alérgicas, con OR de 1,6 (IC 95%, 1,18 a 2,3) y 1,87 (IC 95%, 1,35 a 2,6), respectivamente. Mayor probabilidad de desarrollar efectos adversos y/o reacciones alérgicas asociadas a las vacunas contra el COVID-19 en el sexo femenino 68,2% (p<0,001, OR 3,1), mayor edad y prevalencia de comorbilidades (p = 0,06, OR 7,63), en el contexto de la necesidad de atención médica tras la vacunación (IC 95%, 0,63 a 92,15). Edad media de todos los participantes: 25,93 años (DE± 11,29 años) |
| Talotta R. 2022107 | Revisión narrativa. Valora el deterioro de la diafonía neurovascular mediada por VEGF inducida por la proteína espiga del SARS-CoV-2 (efecto antagónico del acoplamiento de VEGF-A a NRP-1). Asociación causal de los efectos adversos de las vacunas COVID-19 y el patógeno | Se describen efectos adversos neurológicos y cardiovasculares que simulan un pos-COVID-19 en receptores de vacunas contra el COVID-19. La proteína S tiene un papel patógeno, puede unirse a la neuropilina (NRP-1). También interrumpe la vía fisiológica involucrada en la angiogénesis y la nocicepción. Interviene en la embriogénesis y la carcinogénesis (trastornos linfoproliferativos), trastornos inflamatorios y/o neuromielopatías, alterando la barrera hematoencefálicaPropone el VEGF como biomarcador potencial para detectar el daño causado por las vacunas COVID-19 |
| Chen F et al. 2022132 | Revisión sistemática. Discuten el impacto y la participación del sistema nervioso después de la vacunación contra el SARS-CoV-2 y los efectos adversos relacionados | Indican la neuroinvasión y la diafonía neuroinmune como inductores de los síntomas neurológicos producidos por la vacunación contra el SARS-CoV-2. Proponen 2 mecanismos: primero, el patógeno compartido del SARS-CoV-2 puede infectar el cerebro directamente, mediante propagación hematógena y el transporte axonal retrógrado, exceptuando la vía de la neurona olfativa. Por otro lado, puede inducir neurotoxicidad indirecta a través de la patogenia inmunomediada y la infección gastrointestinal |
| Garrido Suárez BB et al. 2022133 | Revisión narrativa. Tuvo como objetivo evaluar el sistema orexinérgico vinculado a las señales inflamatorias que inhiben las neuronas orexinérgicas que promueve la somnolencia tras la activación periférica del sistema inmunitario innato, causada por las vacunas COVID-19 | Verifican la asociación mecánica entre los parámetros inflamatorios reactogénicos y los circuitos hipotalámicos que regulan el ciclo sueño-vigilia. Proponen varias citoquinas proinflamatorias, especialmente: INF-γ, TNF-α, IL-1β, capaces de propagar la respuesta inflamatoria periférica tras la inoculación. Activación del subconjunto de neuronas GABAérgicas que expresan LHA Nts perifornical, así como neuronas inhibidoras de áreas que inducen el sueño proporcionando una entrada inhibidora en las neuronas Ox que causan la vigilia. Posible implicación en la modulación adenosinérgica de las señales de sueño-vigiliaPropone la identificación de biomarcadores vinculados a la reactogenicidad de las vacunas COVID-19 |
| Ng SC et al. 2022147 | Estudio descriptivo, de cohortes (duración 3 a 10 semanas tras las 2 dosis) Describen la composición de la microbiota intestinal mediante secuenciación metagenómica de escopeta en muestras de heces de 138 vacunados (37 con CoronaVac y 101 con BNT162b2) en relación con las respuestas inmunitarias y los efectos adversos en adultos que recibieron vacuna inactivada CoronaVac y la vacuna de ARNm BNT162b2 BioNTech de Pfizer Comirnaty | Identifican marcadores de microbiota intestinal específicos en asociación con la respuesta inmune y los efectos adversos tras la administración de las vacunas COVID-19. Proponen intervenciones dirigidas a la microbiota intestinal como mediador en la inmunogenicidad producida por su papel inflamatorioSeñalan la pérdida de la mucosa intestinal y la alteración de esta microbiota inmunomoduladora, con consecuencias en el tracto intestinal, produciéndose procesos inflamatorios de forma continua en el tiempo, y pueden darse situaciones de permeabilidad intestinal (disbiosis intestinal) |
| Hajjo R et al. 2022156 | Estudio experimental. Analizar los efectos de la biología de sistemas de las vacunas de ARNm de COVID-19 para evaluar su seguridad y efectos secundarios putativos | Aplican un flujo de trabajo de biología de sistemas, en función de los datos de transcriptómica para BNT162b2 de Pfizer-BioNTech en sujetos vacunados. Sus resultados verifican que BNT162b2 produce una respuesta inmunitaria fuerte 21-22 días después de recibir la primera dosis y refuerzo posterior. Las vías inmunitarias e inflamatorias estimuladas se asocian a con la señalización de IFN-gamma, interleucinas y proteína CPropone 76 DEG que participan en la señalización de interferón, señalización de citoquinas, señalización de interferón alfa/beta, mecanismos antivíricos por genes estimulados por interferón y señalización de interferón gamma, como biomarcadores potenciales para detectar el daño causado por las vacunas COVID-19 |
| Murata K et al. 2022102 | Serie de casos. Secuenciar el ARN de cada fallecido para establecer la causalidad de la muerte por la vacunación, en el contexto temporal. Evaluar el SIRS tras la inoculación | Cuatro casos que fallecieron en sus domicilios tras recibir la vacuna de ARNm contra el COVID-19. Tres casos vacunados con 2 dosis de Moderna ARNm y un caso recibió 2 dosis de la vacuna de Pfizer-BioNTech ARNmEl tiempo desde la administración de la segunda dosis hasta la muerte fue de 1 a 10 díasIdentifican 390 genes regulados al alza implicados en la desgranulación de neutrófilos y la señalización de citoquinas y 115 genes estaban regulados a la baja en los casos posteriores a la vacunación en comparación con los controles. Sugieren la causalidad de la muerte con ocurrencia temporal, por una desregulación inmunitaria después de la vacunación, síndrome de respuesta inmune sistémica (SIRS) |
| Ittiwut C et al. 2022171) | Serie de casos. Estudiar la base genética de SUD después de la vacunación COVID-19 en Tailandia | Trece casos de muerte súbita inexplicable (SUD) tras la vacunación contra el COVID-19 en Tailandia, con edades comprendidas entre 23 y 72 años; 10 (77%) eran hombres y 3 (23%) mujeres, 12 de origen tailandés y un australiano. Informaron enfermedades subyacentes en 5 pacientes, sin arritmias. Ningún caso tenía antecedentes de troponinas T ultrasensibles (TUS) en familiares. Ocho (61%), 4 (31%) y 1 (8%) fallecieron tras la primera, segunda y tercera dosis de la vacuna, respectivamente. El SUD se desencadeno después de todos los tipos de vacunas COVID-19 administradas en Tailandia, 7 (54%), 2 (15%), 2 (15%), 1 (8%) y 1 (8%) muertes con ChAdOx1 nCoV-19 (AstraZeneca), BBIBP-CorV (Vero Cells) de Sinopharm (Beijing), CoronaVac (Sinovac), BNT162b2 (Pfizer/BioNTech) y mRNA-1273 (Moderna), respectivamenteAsociación de SUD durante los 7 días posteriores a la vacunación con COVID-19 con variantes de SCN5A, 13 variantes en 7 genes en 11 de 13 casos (85%) |
| Çinar OE et al. 2022172 | Serie de casos. Relacionar la aparición de trastornos neoplásicos mieloides después de la administración de la vacuna COVID-19 basada en ARNm BNT162b2 | Los autores señalan la relación riesgo/beneficio de la vacuna basada en ARNm de proteína pico de SARS-CoV-2, e indica los posibles eventos adversos neoplásicos malignosPropone realizar estudios de inmunofenotipificación ampliados para detectar la disfunción de las células B y T en la respuesta serológica a la vacunación contra el COVID-19 |
| Nazir M et al. 2022173 | Revisión sistemática. Interpretación integral de los cambios en el ciclo menstrual tras la vacunación contra el COVID-19 para evaluar posibles problemas de seguridad de la vacuna | Evalúan informes de alteraciones en el ciclo menstrual después de la vacunación. Se resumieron las características de los estudios a nivel de las pacientes, tipo de estudio, tamaño de la muestra, vacunas administradas y anomalías menstruales. Incluyeron un total de 78.138 mujeres vacunadas de 14 estudios. De estas, 39.759 (52,05%), con edades comprendidas entre los 18 y 30 años, experimentaron problemas menstruales tras la vacunaciónLa tasa general de anomalías menstruales fue muy variante, del 0,83% al 90,9%. Los problemas observados con mayor frecuencia fueron: menorragia, oligomenorrea, polimenorrea, dismenorrea y metrorragia. También, trastornos ginecológicos como la endometriosis, el síndrome de ovario poliquístico, los fibromas y la adenomiosisLos autores alertan su potencial dañino para la fertilidad y la salud a largo plazo para las mujeres. Destacan el deber de realizar estudios de base poblacional, que registre: variación epigenética debido a los polimorfismos genéticos de las comunidades étnicas, poblaciones de riesgo, seguir más ciclos durante períodos más largos para estudiar las consecuencias a largo plazo (fertilidad-embriogénesis) |
| Moro PL et al. 2022182 | Revisión sistemática. Evaluar y resumir los informes del Sistema de Informe de Eventos Adversos a las Vacunas (VAERS), en personas embarazadas que recibieron una vacuna contra el COVID-19 para evaluar los posibles problemas de seguridad de la vacuna | De las 3.462 notificaciones de efectos adversos en embarazadas que recibieron una dosis de las vacunas contra el COVID-19: 1.831 (52,9%) con BNT162b2, 1.350 (39,0%) con mRNA-1273 y 275 (7,9%) con Ad26.COV2.S y 6 de fabricante desconocido. Se excluyeron los informes que indicaban que la vacunación se administró antes del último período menstrual o durante el posparto. Reportaron 8 muertes maternas y 12 muertes neonatales. Fueron codificados como graves 621 (17,9%) informes. Incluyeron: 878 (25,4%) abortos espontáneos (<20 semanas) (SAB), 101 (2,9%) episodios de sangrado vaginal, 76 (2,2%) partos prematuros (<37 semanas), 62 (1,8%) mortinatos (≥20 semanas) y 33 (sin tasa calculada) casos de bebes con defectos congénitos importantes o una anomalía cromosómica, siendo: 18 de 33 casos con la vacuna BNT162b2 y 15 de 33 casos con mRNA-1273. Registraron 107 condiciones infantiles que incluyen las 12 muertes neonatales, indican como causa de la muerte la prematuridad |
| Rahimi Mansour F et al. 2023185 | Revisión narrativa. Analizar los cambios endocrinos e inmunitarios posteriores a la vacunación contra el COVID-19 y los posibles mecanismos de los trastornos menstruales relacionados con la vacuna | Efectos perjudiciales de la proteína S compartida en las vacunas COVID-19, incluyen la entrada del SARS-CoV-2 en las células diana, el daño endotelial, la liberación de citoquinas proinflamatorias, la activación de receptores tipo Toll (TLR), la estimulación de la microglía, el mimetismo molecular con chaperonas y proteínas de choque térmico (HSP) y la activación de la proteína S del SARS-CoV-2. También, puede inducir la hiperestimulación del sistema inmunitario y la síntesis de múltiples autoanticuerpos |
| Green MS et al. 2022187 | Estudio descriptivo, transversal. Duración: diciembre 2019 hasta junio 2021. Observar diferencias de género en los efectos adversos posteriores a la vacuna Pfizer-BioNTech COVID-19 | Casi todos los efectos adversos clasificados como moderados o severos (sistémicos) fueron más frecuentes en mujeres (RR F:M de 3,43), tanto después de la primera como de la segunda dosis. Por ejemplo: dolor y pérdida de sensibilidad de la mano ipsilateral a la inoculación – RR F:M fueron 7,03 y 4,13 después de la primera y segunda dosis, respectivamente, distermia, escalofríos – RR F:M fueron 8,77 y 3,87 después de la primera y segunda dosis, cefalea - RR F:M fueron 9,15 y 3,28 después de la primera y segunda dosis, fatigabilidad – RR F:M fueron 3,32 y 2,27 y dificultad para ponerse en pie se informó exclusivamente en mujeresProponen un mecanismo para el aumento de la reactogenicidad de las vacunas en las mujeres. Debido a la respuesta inmediata más fuerte al antígeno, modulada a través del sistema inmunitario innato. Se incluyen mecanismos epigenéticos que regulan genes ligados al cromosoma X y polimorfismos del gen ChrY (inmunidad diferenciada con el sexo) |
| Mouliou DS et al. 20221 | Revisión narrativa. Analizar la naturaleza de todos los informes actuales de efectos adversos posteriores a la vacunación y las hipótesis existentes relacionadas. Discutir los mecanismos inmunes innatos inducidos por las vacunas de ARNm contra COVID-19, especialmente con BNT162b2 de Pfizer | Reconocen los antígenos vacunales como patógenos potenciales causantes de las reacciones autoinmunes por los mecanismos del mimetismo molecular y la activación de células T. Verifican las hipótesis sobre el mimetismo molecular, transcripción inversa en la línea celular de hígado humano Huh7 (causa cambios en la expresión y distribución de LINE-1), las señales inflamatorias atribuidas a la reactogenicidad posvacunal, su diseminación sistémica, daño endotelial y el «efecto acumulativo», es decir, la relación entre niveles elevados anticuerpos (IgG anti-S, IgG anti RBD) posteriores a la vacunación y su persistencia temporal, que sugiere la imitación del pos-COVID-19. Indican la duración prolongada de la biopersistencia de los adyuvantes comentados con anterioridad y su capacidad para moverse y acumularse lentamente en los órganos linfoides y otros tejidosAñade la predisposición genética en sujetos susceptibles, incluyen: HSR, antecedentes de alergias previas y sobreexpresión de genes ligados al cromosoma X (inmunidad diferenciada con el sexo)Propone la hipótesis de sobretraducción de ARNm y la consiguiente sobreproducción de proteínas de pico que resulta en la desregulación inmunitaria y toxicidad potencial (genotoxicidad, hepatotoxicidad, neurotoxicidad). La patogenia de estos diagnósticos es principalmente vascular, neurológica, digestiva, respiratoria, cardiaca, HSR/reacciones alérgicas espontáneas, lesiones cutáneas, endocrina, renal, eventos auditivos y oculares, paraneoplásica y las consecuencias sobre la fertilidad/embriogénesis y trastornos menstruales |
| Castaldo M et al. 2022201 | Revisión sistemática y metaanálisis. Describir el mecanismo de la cefalea posterior a la vacunación, teorizar los mecanismos de propagación e impacto en el cuerpo humano de las vacunas frente al SARS-CoV-2 | La cefalea fue el tercer efecto adverso más común. Se detectaron en el 22% (IC 95%, 18-27%) de los casos tras la primera dosis y en el 29% (IC 95%, 23-35%) después de la segunda, con una gran heterogeneidad. No observaron diferencias entre las diferentes vacunas o las basadas en ARNm contra el COVID-19 frente a las tradicionales. La clínica se caracteriza por una migraña con calidad pulsátil, fonofobia y fotofobia, en el 40-60% de los casos se agrava con la actividad. Los autores proponen la hipótesis de cefalea secundaria a una reacción inmunológica sistemática (SIR). Postulan varias rutas para la propagación en el cuerpo humano: 1) uso del torrente sanguíneo con posterior diseminación neuronal, infección de células endoteliales dentro de la barrera hematoencefálica o de la barrera hematoencefálica, 2) uso de las vías transinápticas tras la infección de las terminaciones nerviosas (transporte directo o retrógrado), cruzando la barrera hematoencefálica como resultado de la infección leucocitaria (mecanismo de caballo de Troya) o 3) diseminación mediante el sistema linfáticoConfirman el mecanismo receptor ACE2, incluye la expresión de ACE2 fuera del tejido pulmonar, se verificó en neuronas, astrocitos, oligodendrocitos, bulbo olfatorio, sustancia negra, tronco encefálico, corteza cingulada posterior, cuerpo estriado e hipotálamoDemuestran que el SARS-CoV-2 es un virus neurotrópico (capacidad para infectar y replicarse en cultivos de células neuronales y cerebros) y su potencial adyuvante endógeno en la vacunación |
| Verbeke R et al. 2021202 | Revisión narrativa. Comparan las diferencias de diseño-actividad entre 3 vacunas de ARNm (BNT162b2, mRNA-1273 y CureVac). Descripción detallada de la composición y el rendimiento (pre)clínico de las vacunas de ARNm, sobre el diseño estructural y como las vías inmunitarias innatas modulan la inmunidad adaptativa en las respuestas de las vacunas de ARNmSe discuten los mecanismos de detección inmune innata de las vacunas de ARNm a nivel celular e intracelular e identifican la contribución de los componentes de ARNm y LNP a su inmunogenicidad y reactogenicidad | Además de los conocimientos que tratan el modo de acción de las vacunas de ARNm destacados aquí, también señalan las hipótesis probables e incógnitas que requieren más investigación y, en un futuro, la optimización del desarrollo de las vacunas de ARNmEstudios experimentales que evalúan la producción de proteínas in vitro o in vivo en modelos animales y humanosDistribución sistémica. Potencial adyuvante endógeno en la vacunación, asociado con células apoptóticas. Verifican la gran similitud con la proteína S del SARS-CoV-1, convirtiéndose en el principal factor a investigar en el desarrollo de las vacunas de ARNm. También, comentan las respuestas de las células T y anticuerpos que se correlacionan con una enfermedad más leve, mientras que una respuesta desregulada, con frecuencia, no controló la enfermedad. Además, la experiencia previa con el SARS-CoV-1 estrechamente relacionado, mostró que las células T de memoria CD8+ y CD4+ eran detectables hasta 17 años después de la infección, mientras que los títulos de anticuerpos neutralizantes habían disminuido sustancialmente un año después de la infección |
| Saluja P et al. 2022203 | Reporte de un caso. Describen las características clínicas y los resultados del tratamiento de la neuritis óptica bilateral que se desarrolla tras la administración de la primera dosis de la vacuna ChAdOx1_nCoV-19 (Covishield) en un varón inmunocompetente joven previamente sano | Un hombre sano de 35 años, experimento una disminución repentina de la visión de forma progresiva. Los síntomas se iniciaron 2 días después de la primera dosis con ChAdOx1_nCoV-19Diagnóstico de neuritis óptica bilateral con edema de disco asociada a la vacuna se basó en la relación temporal entre la administración de la vacuna y el desarrollo de los síntomas oculares y descartan otras etiologías inmunológicas o infecciosasBuena respuesta a los esteroides sistémicos orales en ciclos cortos intermitentes |
| Chen Y et al. 2022120 | Reporte de un caso. Describen un caso de vasculitis espinal concurrente y mielitis transversa parcial aguda (APTM) después de la segunda dosis de la vacuna COVID-19 inactivada CoronaVac (Sinovac) | Concurrencia de un caso de vasculitis en cuerpos vertebrales y mielitis transversa aguda (ATM) tras la vacunación contra el COVID-19Un hombre de 33 años presentó debilidad en la extremidad inferior izquierda y sensación aberrante en la parte inferior del tronco y la extremidad derecha (desde nivel T9 hasta los dedos de los pies) durante 2 días tras la inoculación, sin alteraciones inflamatorias en la resonancia magnética craneal (RMN). El quinto día mostró una lesión desmielinizante en la médula espinal T7 mediante RMN de 3,0 T. Los cuerpos vertebrales de T3-T7 mostraban una señal alta en las imágenes ponderadas en T-2 (T2WI) acompañadas de múltiples sitios de efecto de vacío de flujo que indica vasculitis. La banda oligoclonal fue positiva en líquido cefalorraquídeo (LCR), siendo negativa en suero. Las pruebas de laboratorio convencionales fueron normales, incluyen: hemogramas, coagulación, función hepática, función renal, electrolitos, glucosa plasmática, lípidos, proteína C reactiva y procalcitoninaSu debilidad en las extremidades y la sensación aberrante mejoraron y pudo caminar sin ayuda después del tratamiento: metilprednisona intravenosa (1 gr/24 horas) durante 5 días, con descenso gradual de dosis posterior |
| Morikawa MM et al. 202222 | Reporte de un caso. Informar las reacciones eosinofílicas y reumatoides después de la vacunación con BNT162b2 COVID-19 como efecto adverso | La inflamación eosinofílica se refleja en una reacción antiinflamatoria en la fase inicial de la artritis reumatoide (AR)Mujer de 88 años diagnosticada de AR y neumonía eosinofílica crónica (NEC) tras la inoculación. Los síntomas articulares y respiratorios empeoraron gradualmente. Los análisis de laboratorio mostraron un aumento del factor reumatoideo, anticuerpos contra el péptido citrulinado de ciclina (CEP), proteína C reactiva, IL-6 sérica y recuento absoluto de eosinófilos periféricos e infiltración de tejido de eosinófilos. La ecografía mostró sinovitisMejoraron los síntomas respiratorios y articulares mediante la terapia de pulsos de metilprednisona oral (40 mg/24 horas), consiguieron estabilizar la AR y el CEPVerifican la tormenta de citoquinas como principal causa de lesión pulmonar y de varios factores inmunitarios, como IL-6, JAK1/2 y GM-CSF, eran cascadas de señalización comunes, como los que se producen en la condición de AR. En este caso, los autores informan la respuesta inmune causada por la vacunación contra el SARS-CoV-2 y no por la infección. También notifican el síndrome de liberación de citoquinas (CRS). Concluyen que las reacciones de las citoquinas contra las proteínas de punta del SARS-CoV-2 fueron similares a las de la infección por COVID-19 y su potencial adyuvante endógeno en la vacunación. Tanto las reacciones inmunitarias innatas como las de adaptación de las células Th al COVID-19 serían un desencadenante de la AR, que posteriormente induciría la activación la actividad de la enfermedad de la CEP. Podría involucrarse la reacción del fenotipo M2 |
| Chen C et al. 2022104 | Estudio descriptivo, transversal. Duración: enero de 2020 hasta noviembre de 2021. Asociar el trastorno auditivo a las vacunas COVID-19 | Identifican un mayor riesgo de trastornos auditivos tras la inoculación de vacunas COVID-19 de ARNm y vector de virus en comparación con la vacunación contra la influenza. Consultaron el Sistema de Notificación de Eventos Adversos (VAERS), el patrón de desproporcionalidad para la discapacidad auditiva de la vacuna contra el COVID-19 calculando el índice de probabilidad de notificación (ROR) y el índice de notificación proporcional (PRR). Realizaron otro análisis por subgrupos basado en el tipo de vacuna COVID-19 y las dosis administradas. Compararon las desproporcionalidades de la disfunción auditiva entre las vacunas contra la influenza y el COVID-19. Identifican un total de 14.956 informes de efectos adversos que relacionan la disfunción auditiva con la vacunación contra el COVID-19 y 151 contra la influenza durante el período analítico VAERSLa incidencia de trastornos auditivos tras la vacunación contra el COVID-19 fue de 6,66 por 100.000Los resultados del análisis de desproporcionalidad muestran que los efectos adversos de discapacidad auditiva tras la administración de las vacunas COVID-19 fueron significativamente más informados: (ROR 2,38, IC del 95% 2,20-2,56; PRR: 2,35, X 2.537,58), tanto para ARNm (ROR 2,37, IC del 95% 2,20-2,55; PRR: 2,34, X2 529,75) como para vacunas de vectores de virus (ROR 2,50, IC del 95% 2,28-2,73; PRR: 2,56, X2 418,57). En comparación con el nivel desproporcionado de disfunción auditiva en la vacuna contra la influenza, fue más bajo (ROR 0,36, IC del 95% 0,30-0,42; PRR: 0,36, X2 172,24) |
| Namiki T et al. 202223 | Estudio descriptivo, de cohortes. Investigar los efectos adversos ginecológicos en la población femenina japonesa vacunada contra el COVID-19 con BNT162b2 de ARNm | Fueron encuestadas 424 mujeres, consideraron apropiadas para el análisis 309 encuestas. Las frecuencias de sangrado anormal fueron 0,6%, 1,0% y 3,0% para la primera, segunda y tercera dosis con BNT162b2 de Pfizer, respectivamente. La frecuencia de un ciclo menstrual irregular fue más común que el sangrado anormal: 1,9%, 4,9% y 6,6% para la primera, segunda y tercera dosis. Tanto el sangrado anormal como el ciclo menstrual irregular podrían estar asociados al efecto de pico, sugiere el efecto acumulativo inmunitario debido a la exposición repetida al antígeno con el recuerdo vacunal. Refuerza la hipótesis del «potencial adyuvante endógeno» aunque no informan las respuestas de anticuerpos en esta vacuna |
| Lagousi T et al. 2022105 | Revisión narrativa. Revisar los datos epidemiológicos de la miocarditis tras la vacunación con ARNm de SARS-CoV-2 (BNT162b2, de Pfizer) y describir los mecanismos participantes que explican las diferencias relacionadas con el sexo y la reactogenicidad inmune del ARNm | Afirman la «reactividad inmunitaria del ARNm», ya propuesto, como mecanismo para las reacciones adversas sistémicas y la miocarditis, posteriores a la inmunización con vacunas de ARNm del SARS-CoV-2. Señalan que el ARNm exógeno es intrínsecamente inmunoestimulador y es reconocido por una variedad de receptores inmunes innatos citosólicos, endosómicos y de la superficie celular y puede provocar una respuesta inmunitaria exacerbada. Desencadena una cascada de hiperinflamación causando reacciones sistémicas desfavorables con efectos perjudiciales en diferentes órganos, incluye el miocardio. Añaden las hipótesis de que en individuos susceptibles es posible que la respuesta inmunitaria al ARNm no se reduzca; la edad más joven se asoció con mayores cambios en los monocitos, respuesta inflamatoria y la expresión génica relacionada con las plaquetas poco después de la segunda dosis de la vacuna BNT162b2; la cantidad de antígeno de ARNm contenida en cada formulación de vacuna también puede ser un factor en la reactividad del ARNm, la mayoría de los casos de miocarditis notificadas se asociaron con las formulaciones que contienen las cargas más altas de ARNm por dosis; y el mimetismo molecular entre la proteína espiga del SARS-CoV-2 y los autoantígenos cardíacos que resultan en autoanticuerpos de reacción cruzada dirigidos al miocardio (generalizable a la distribución sistémica) después de la inmunización. También, los autoanticuerpos que se encuentran en sangre periférica de los pacientes con miocarditis sintomática son el resultado de la inflamación y lesión miocárdica, y son el producto y no la causa de la miocarditisEn este estudio es evidente que la edad más joven (≤18-39 años) y el sexo masculino contribuyen como factores independientes a la susceptibilidad a la hiperactividad inmunitaria del ARNm |
| Pirani V et al. 2022106 | Serie de casos. El propósito del estudio fue informar 2 casos de neuritis óptica después de la vacunación con Pfizer-BioNTech COVID-19 en pacientes con enfermedades autoinmunes (tiroiditis de Hashimoto y espondilitis anquilosante) | Confirman el vínculo causal entre la inmunización inducida por la vacuna y la reacción autoinmune a nivel del nervio óptico, no solo es temporal sino también causal, especialmente en individuos genéticamente susceptibles. Afirman que la reactogenicidad de la vacuna de ARNm COVID-19 en individuos que padecen enfermedades inmunomediadas tienen una desregulación prexistente de la respuesta inmune. Apoyan la hipótesis de que los pacientes afectados o predispuestos a trastornos autoinmunes o autoinflamatorios deben ser evaluados para determinar los riesgos de la vacunaciónAsocian el mimetismo molecular, la producción de autoanticuerpos particulares y el papel de ciertos adyuvantes de las vacunas ARNm a la manifestación de estos efectos autoinmunes. En ambos casos no encontraron hallazgos patológicos después del examen neurológico y en las pruebas inmunológicas y serológicas, incluidos los anticuerpos contra la acuaporina-4 y la glicoproteína de oligodendrocitos de mielina. La resonancia magnética del cerebro, las órbitas y la médula espinal no revelaron lesiones de desmielinización dentro del cerebro o la médula espinal, si en la resonancia magnética ponderada en T1 del cerebro y las órbitas con contraste posterior al gadolinio. Ambas mujeres, de 31 y 46 años, fueron tratadas con metilprednisona intravenosa 1.000 mg/24 horas durante 5 días, seguido de una dosis decreciente de prednisona oral durante los 10 días siguientes. Experimentaron mejoría de la sensibilidad retiniana después del campo visual |
| Zagorec N et al. 202224 | Serie de casos. El objetivo del estudio fue informar 2 casos de enfermedades inmunomediadas relacionadas con la vacuna de Pfizer-BioNTech COVID-19 | Atribuyen enfermedades inmunomediadas después de la vacunación contra el SARS-CoV-2 a los mecanismos del mimetismo molecular y la reactividad cruzada entre la proteína espiga vírica y los antígenos endoteliales víricos y del huésped. Notifican un caso de nefropatía por inmunoglobulina A (IgAN) de novo en un hombre de 26 años y otro caso de vasculitis cutánea en una mujer de 68 años, ambos después de la segunda dosis con BNT162b2. En ambas enfermedades, el depósito de inmunocomplejos activa la respuesta inflamatoria con daño de órganos diana y se deposita en las paredes de los vasos, causando vasculitis. Ninguno de los pacientes tenía antecedentes de reacciones adversas a las vacunas o de autoinmunidad. En el segundo caso la afectación de arterias de tamaño mediano alertó de afectación sistemática debido a la vasculitis, pero en el estudio diagnóstico ampliado, incluida la biopsia renal, no observaron distribución sistémica. Sugieren el mecanismo causal por asociación temporal entre la vacunación y el desarrollo de la enfermedad en ausencia de otros posibles eventos desencadenantes intercurrentesEn ambos casos, se justificó el tratamiento inmunosupresor (pulsos de ramipril y metilprednisona) durante 2 meses para evitar el progreso de la enfermedad y resolver parcial o completamente la enfermedad mediada por el sistema inmunitario después de la vacunación con BNT162b2 |
| Levy I et al. 202225 | Estudio descriptivo, de cohortes. Duración: 4 meses. Determinar la correlación entre la inmunogenicidad y la reactogenicidad de la vacuna BNT162b2, evaluar las RAM y los títulos de anticuerpos después de cada inoculación | Verifican la reactogenicidad de la vacuna COVID-19 de ARNm BNT162b2, los efectos adversos están correlacionados con niveles más altos de anticuerpos posteriores a la vacunación (IgG anti-S, IgG anti-RBD) y se asocia de forma independiente con una edad más joven, sexo femenino y los niveles de anticuerposIncluyeron sujetos sin infección previa por SARS-CoV-2 que participaron en la vigilancia activa tras las inoculaciones con BNT162b2. Excluyeron los trabajadores de la salud inmunodeprimidos y con enfermedades autoinmunes. Los participantes informaron reacciones adversas a medicamentos (RAM) mediante cuestionarios administrados por mensaje de texto después de recibir cada dosis de la vacuna, puntuación basada en el tipo reactogenicidad, duración de las RAM, los niveles del dominio de unión al antirreceptor (RBD) y los ensayos de neutralización se realizaron de 7 a 21 días y de 7 a 38 días tras la primera y la segunda dosis de la vacuna, respectivamente. Se incluyeron 831 trabajadores de la salud. La edad media fue de 46,5 años (DE = ± 11,8 años) y el 75,5% eran mujeres (n = 627 mujeres). Las asociaciones entre las RAM y los niveles de anticuerpos se evaluaron mediante correlaciones de Spearman, identificaron los factores asociados con las RAM mediante el análisis de regresión logística multivariables (correlación significativa entre la puntuación ADR sistémica y los títulos de anti-RBD-IgG (R = 0,366; p < 0,0001) y una correlación más débil con los anticuerpos de neutralización (R = 0,283; p < 0,005) después del ajuste por edad, sexo y días tras la segunda dosis). El 33% y el 83,2% presentaron al menos una RAM sistémica después de la primera y segunda dosis, respectivamente. Ser mujer, ser menor de 55 años y tener niveles altos de IgG anti-RBD, se correlacionaron de manera significativa e independiente con un mayor riesgo de efectos adversos (OR = 2,86, IC del 95%: 1,6-5,1; p = 0,0004); (OR = 3,18, IC del 95%: 1,83-5,52; p < 0,0001); (OR = 1,36, IC del 95%: 1,33-1,39; p = 0,0029), respectivamenteAfirman que la reactogenicidad sistémica resulta del derrame de mediadores o productos inflamatorios en la sangre y a través de la activación del sistema inmune por la proteína de pico usada como antígeno. Proponen el efecto de pico por el efecto acumulativo inmunitario debido a la exposición repetida al antígeno con cada recuerdo vacunal. Refuerza la hipótesis del «potencial adyuvante endógeno»y distribución sistémica |
| Piras A et al. 202226 | Reporte de un caso. Describir un ejemplo típico de miopericarditis que ocurre en un adolescente de 16 años después de la segunda dosis con la vacuna de ARNm de Pfizer y evaluar 110 informes de casos publicados hasta julio de 2022 relacionados con las características clínicas y los resultados | Reporte de un caso clínico de miocarditis, dada la falta de factores de riesgo concurrentes, la vacunación reciente, la positividad a IgG anti- COVID-19 y la aparición de fiebre alta, los autores proponen los mecanismos sugeridos: reacción hiperinmune o inflamatoria tras la exposición a la proteína de pico, cadena de ARNm, aparición tardía de hipersensibilidad (HSR), miocarditis eosinofílica, hiperreactividad a los excipientes de la vacuna, reacción a los adyuvantes de la vacuna (LNP), autoinmunidad mediante el mimetismo molecular; otras vías como: liberación de anticuerpos antiidiotipo contra ciertas regiones de anticuerpos específicos de antígeno, activación de vías inmunitarias desreguladas preexistentes en sujetos predispuestos, amplificación de la inmunidad dependiente de anticuerpos u otras formas de intensificación inmune con reexposición al virus tras la vacunación, invasión celular directa a través de la interacción de la proteína espiga y ACE2, problema cardiaco inducido por viscosidad y el esfuerzo exigente causo la secreción de interleucina 6 proinflamatoriaAnálisis ampliado centrado en un número identificativo de informes de casos únicos, incluyen los artículos excluidos de revisiones sistemáticas y metaanálisis sobre los efectos adversos de miocarditis y/o pericarditis inducidas por las vacunas de ARNm (Pfizer-BNT162b2 y Moderna mRNA-1273) y de vectores (AstraZeneca y Janssen). Analizaron 110 informes que identificaban las características clínicas de la enfermedad: 12 casos de pericarditis (10,9%), 20 casos de perimiocarditis/miopericarditis (18,2%) y 78 casos de miocarditis (70,9%). Estos últimos eran prevalentes comparados con la pericarditis y la perimiocarditis combinadas (p < 0,00001). Confirman que la mayoría de los casos sucedieron en hombres tras la segunda vacuna de ARNm. Se informan casos recientes de que no solo afecta a niños y adolescentes (de 12 a 18 años) sino también a las personas mayores, especialmente mujeres, se vieron afectadas por este efecto adverso. Para los pacientes masculinos, la edad media de inicio era de 31,7 años (DE = ± 15,5 años), en las mujeres eran mayores 51,6 años (DE = ± 17,4 años). Esto fue estadísticamente significativo (p < 0,00001). Concretamente, los casos de pericarditis estaban equilibrados entre géneros (7 hombres frente a 5 mujeres, p = ns)La mayoría de los casos fueron atribuidos a Pfizer-BioNTech 60 de 110 casos (54,5%), 37 de 110 casos con Moderna (33,7%), 8 de 110 casos con AstraZeneca (7,3%) y 5 de 110 casos con Janssen (4,5%) |
| Abu Serhan H et al. 202227 | Revisión sistemática. Investigar la evidencia actual sobre la asociación entre la vacunación contra el COVID-19 y los eventos vasculares oculares | Se incluyeron un total de 49 estudios con 130 casos vasculares oculares desarrollados en personas vacunadas con vacunas COVID-19. Los efectos de oclusión venosa fueron los más comunes (54,3%), en su mayoría producidos tras la primera dosis (46,2%) y durante los 5 días posteriores a la vacunación (46,2%, p = 0,095). Los efectos adversos oculares se informaron más con las vacunas de Pfizer y AstraZeneca (81,6%), siendo presentados de forma equiparable (73,8%), Pfizer-BioNTech fue la más notificada (n = 56 casos, 43,1%), AstraZeneca la segunda (n = 50 casos, 38,5%). Los 24 casos restantes (18,6%) fueron informados con otros tipos de vacunas: Moderna, CoronaVac, Janssen, un caso sin datos disponibles sobre la vacuna y un caso con una vacuna de ARNm no especificada. El tratamiento más informado fue anti-VEGF intravítreo (n = 39 casos, 30,4%), seguido de los corticoides, 18 casos (14,2%). Incluyen otros tratamientos (trombolítico, antiagregante o anticoagulante) además del quirúrgico. La mayoría de los pacientes (90,1%) mostraron mejoría (p = 0,321) o persistencia (p = 0,414) en la agudeza visual mejor corregida inicial (BCVA) al final. La mejora se agrupo en 3 categorías: mejorada, persistente y deteriorada. No hubo diferencias significativas entre la mejoría, la persistencia o el empeoramiento entre los grupos (p = 0,369, p = 0,516 y p = 0,34, respectivamente). La edad de los pacientes era muy variante, entre 20 y 96 años, con una media (±DE) de 58,92 (±17,57) y la población se distribuyó casi por igual entre géneros (51,5%)Clasificaron los síntomas en 3 categorías: A) alteraciones visuales (disminución de la agudeza visual, moscas volantes, destellos de luz, fotopsia, cortinas que obstruyen la visión, defectos de campo visual y manchas grisáceas, representan el 68,5% de los síntomas referidos por los pacientes) y B) otros (proptosis, ojo rojo, dolor en el cuero cabelludo, oftalmoplejía, dolor retrobulbar, cefalea temporal, uveítis, visión borrosa, etc.)Afirman que los mecanismos mediados por el sistema inmunitario causan trombosis mediante la activación de las plaquetas, las células inmunitarias y los factores de hipercoagulabilidad. Proponen los mecanismos del mimetismo molecular, contaminantes de proteínas y proteínas de vectores de adenovirus. También, señalan que existe una mayor probabilidad de efectos adversos vasculares tras la administración de la primera dosis por la producción de picos más altos de inmunoglobulinas después de la primera exposición. Indican la asociación temporal atribuida a los anticuerpos relacionados con la vacuna |
| Mohseni Afshar Z et al. 202328 | Revisión narrativa. Investigar la evidencia actual sobre la asociación entre la vacunación contra el COVID-19 y los efectos adversos neuroinmunológicos | Relacionan la durabilidad y las secuelas debilitantes posteriores a la inmunización, pudiendo exacerbar o causar enfermedades neuroinmunológicas de nueva aparición, como la miastenia grave (MG), el síndrome de Guillain-Barré (SGB), convulsiones, reactivación del virus varicela-zoster, accidentes cerebrovasculares, parálisis de Bell, mielitis transversa (MT), mielitis transversa longitudinalmente extensa (LETM), encefalopatía aguda, encefalomielitis diseminada aguda (ADEM), vasculitis de pequeños vasos, narcolepsia, neuropatía de fibras finas, síndrome neuroléptico maligno (SNM) y brotes de esclerosis múltiple. Desarrollan cada uno de estos efectos adversos. Los síntomas neurológicos comunes son experimentados como dolor de cabeza, anosmia, disgeusia, mialgias, parestesias, debilidad, mareos, temblores, diplopía, tinnitus, disfonía, delirio, síncope, deterioro cognitivo y alteración de la conciencia que son significativos. El diagnóstico se realiza por la evidencia clínica típica de disfunción sensorial, motora o autonómica bilateral/unilateral, pudiendo no producirse daño orgánico, pero si inflamación. Estos efectos se han observado en varios tipos de vacunas: Pfizer-BioNTech, Moderna, Janssen, AstraZeneca y Sinovac y CureVac. No obstante, se ha estimado un mayor riesgo de desarrollar estas enfermedades neurológicas con las vacunas de ARNm que con otras plataformas de vacunas COVID-19Los agentes antivíricos y los esteroides se han probado con frecuencia como tratamiento y aceleran la recuperación (parálisis de Bell, TM), la inmunoglobulina intravenosa y la plasmaféresis puede considerarse un tratamiento eficaz para el SGB. Aunque no hay evidencia suficiente, la metilprednisona en dosis altas (1 gr cada 24 horas durante 3 – 7 días) debe iniciarse de inmediato en todos los casos de MT para mejorar la función neurológica y acelerar la recuperaciónProponen los mecanismos comentados: reacción hiperinmune o inflamatoria tras la exposición a la proteína de pico; activación de las APC; cadena de ARNm; autoinmunidad mediante el mimetismo molecular; otras vías como: liberación de anticuerpos antiidiotipo contra ciertas regiones de anticuerpos específicos de antígeno, activación de vías inmunitarias desreguladas preexistentes en sujetos predispuestos, amplificación de la inmunidad dependiente de anticuerpos u otras formas de intensificación inmune con reexposición al virus tras la vacunación, invasión celular directa a través de la interacción de la proteína espiga, accidente cerebrovascular inducido por hiperviscosidad. Como resultado de la formación de complejos de anticuerpos antigangliosidos, MAC y macrófagos se activan, atacando y destruyendo la mielina. En la condición del SGB, tal desmielinización disminuye la velocidad de transmisión del potencial de acción a través de los nervios, causando la polirradiculopatía inflamatoria ascendente. La encefalopatía aguda se ha atribuido también a toxinas, infecciones y vacunasIndican que las vacunas COVID-19 pueden inducir la activación de las células T, B y cambios en los parámetros de varios mediadores inflamatorios clave, incluye la IL-6 |
| Lee HJ et al. 202229 | Reporte de un caso. Tuvo como objetivo detectar y responder el desarrollo del MIS-C/A después de la vacunación contra el SARS-CoV-2 | Presentan un paciente diagnosticado con MIS-C/A (nivel de certeza diagnóstica: caso definitivo) después de la vacunación con ARNm BNT162b2 en función de la edad, fiebre, características clínicas (conjuntivitis, vómitos, hipotensión y dolor de cabeza), marcadores inflamatorios elevados y NT-proBNP, neutrofilia, linfopenia y derrame pericárdico. La PCR de SARS-CoV-2 fue repetidamente negativa. Recibió 2 dosis de la vacuna de ARNm de COVID-19, 62 días y 20 días antes del inicio de los síntomas y no tenía antecedentes personales de COVID-19 ni contacto cercano con casos conocidos de COVID-19 dentro de las 12 semanasFue tratado con éxito con dosis medias de esteroides y colquicina. Inician prednisolona oral 0,3 mg/kg/día (20 mg), colquicina (0,6 mg/12 horas) y heparina de bajo peso molecular (enoxaparina 40 mg/día). Se redujo gradualmente la prednisolona durante 2 meses después de la interrupción de todos los medicamentos y se administró colquicina durante 3 meses. En el seguimiento de 2 meses los resultados de laboratorio estaban en rango normal, el paciente estaba en buenas condiciones. El efecto adverso no ha vuelto a aparecer después del final del tratamientoEn febrero de 2021, Brighton Collaboration creó la definición de caso estandarizado para MIS-C/A como un evento adverso después de la inmunización con 3 niveles de certeza diagnóstica: definitivo (nivel 1), probable (nivel 2), y caso posible (nivel 3). La definición de caso de MIS-C/A de la Colaboración de Brighton podría facilitar el diagnóstico de MIS-C/A tras la administración de las vacunas COVID-19 y extrapolarlo en todo el mundoLa colquicina es un agente antiinflamatorio que inhibe la activación, desgranulación y migración de los neutrófilos e interrumpe el ciclo inflamatorio. Se recomienda en combinación con otros agentes antiinflamatorios para todos los pacientes con pericarditis aguda idiopática o vírica debido a sus tasas de remisión y menor riesgo de recurrenciaRefuerza las hipótesis del efecto de pico por el efecto acumulativo inmunitario debido a la exposición repetida al antígeno con cada recuerdo vacunal y la del «potencial adyuvante endógeno», también, la distribución sistémica |
| Chen CC et al. 202230 | Estudio descriptivo. Combinar las mediciones de pulso no invasivas y análisis de dominio de frecuencia para determinar si la vacuna de Pfizer-BioNTech COVID-19 (BNT162b2) y los efectos adversos cardiovasculares inducen cambios en la transmisión del pulso arterial y en la forma de onda | Se observaron efectos significativos en los índices armónicos del pulso en el grupo V (solo efectos secundarios vasculares) después de la vacunación con BNT162b2. Los análisis de puntuación de variabilidad del pulso y de aprendizaje automático (ML) pueden discriminar entre sujetos con efectos secundarios cardiovasculares. La proporción para las áreas bajo la curva característica operativa del receptor (AUC) del análisis de puntuación fue de 0,94 y 0,75 para los efectos adversos vasculares y cardiovasculares, respectivamente. Los hallazgos presentados muestran que la combinación de la medición no invasiva del pulso, el análisis de la forma de onda del pulso en el dominio de la frecuencia y los análisis de puntuación de variabilidad el pulso y ML pueden ser un método útil para detectar cambios en las propiedades vasculares asociadas con los efectos adversos cardiovasculares tras la vacunaciónLas secuelas cardíacas incluidas son: insuficiencia cardiaca, miocardiopatía, síndrome coronario agudo y arritmias. Verifican los mecanismos subyacentes al daño vascular incluidas la endoteliopatía profunda y trombosis vascular. La vasculitis puede causar la trombosis, la inestabilidad hemodinámica y la desregulación autonómica, que conducen a alteraciones de la integridad vascular e inflamación tisular. Los efectos cardiovasculares asociados con la vacunación de ARNm COVID-19 van desde la inflamación hasta la trombosis e isquemia. Informan de un aumento de la reactogenicidad sistémica e inmunogenicidad después de la vacunación con BNT162b2 |
| Hoffmann C et al. 202231 | Reporte de un caso. Informar de un caso de enfermedad de Castleman idiopática (iMCD), síndrome de TAFRO (trombocitopenia, anasarca, fiebre, fibrosis de reticulina, insuficiencia renal y organomegalia) tras la vacunación con ARNm SARS-CoV-2 | La iMCD es una enfermedad sistémica potencialmente mortal debida a una desregulación de las citoquinas. En este caso, se produce en un hombre joven (20 años) previamente sano poco después de la inmunización con ARNm SARS-CoV-2, segunda dosis con BNT162b2, que respondió al bloqueo de la interleucina-6 con Siltuximab. Seis meses después de la finalización del tratamiento, el paciente no experimentó signos de iMCD o de inflamación, los autores indican el desencadenante temporal de la enfermedad. No solo se suma al espectro patogénico de la MCD, sino que también amplía el cuadro clínico de los efectos adversos tras la inmunización contra el COVID-19. No se identificó ningún desencadenante alternativo de la enfermedad, la PCR de SARS-CoV-2 fue negativa. La etiología de la enfermedad, la rápida respuesta al tratamiento y la falta de recurrencia de la enfermedad durante más de medio año de seguimiento verifica la causalidad y la ocurrencia temporalProponen los mecanismos comentados: hipótesis patógeno/vírico, hipótesis paraneoplásica e hipótesis autoinmuneLa tormenta de citoquinas que induce la iMCD es causada por una infección no controlada (hipótesis patógena), autoanticuerpos o células T autorreactivas asociadas con mutaciones de línea germinal predisponentes (hipótesis autoinmune), mutaciones de línea germinal en genes que regulan la inflamación (hipótesis autoinflamatoria) y/o mutaciones somáticas en células de ganglios linfáticos monoclonales que resultan en la secreción ectópica de citoquinas (hipótesis paraneoplásica)Indican que las vacunas COVID-19 pueden inducir la activación de las células T, B y cambios en los parámetros de varios mediadores inflamatorios clave, incluye la IL-6 |
| Wong KK et al. 202232 | Estudio descriptivo, de cohortes. Duración: 2 años. Identificar y clasificar los informes de irregularidades menstruales y sangrado vaginal después de la vacunación contra el COVID-19 registrados en un sistema voluntario de vigilancia activa (v-safe) | Notificaron irregularidades menstruales 63.815 encuestas. Los problemas observados con mayor frecuencia fueron: menorragia, oligomenorrea, polimenorrea, dismenorrea y metrorragia. Incluyeron 57.997 mujeres encuestadas (≥18 – 49 años). La mayoría de las encuestas recibieron las vacunas BNT162b2 (33.149 casos [51,9%]) y mRNA-1273 (26.741 casos [41,9%]). Identifican según la población étnica una mayor afectación en mujeres blancas 49.795 casos (78%) en comparación con 4.866 casos (7,6% negras), 4.929 (7,7%) casos eran asiáticas y 8.116 casos (12,7%) eran sudamericanasLas notificaciones eran referidas, como: menstruaciones de inicio inesperado en el tiempo, anovulaciones, manchado intermenstrual, manchado abundante, más dolor de lo habitual, sangrado prolongado, también utilizan el descriptor «peores síntomas» para 56.890 casos (67%). Edad media: 37 años (30-40)Los autores afirman que el vínculo entre la vacunación contra el COVID-19 y las irregularidades menstruales es causal. Consideran tanto la proteína de pico compartida con el SARS-CoV-2 como los adyuvantes usados en la vacunación como causantes de la intensa respuesta inmune tras la administración de las vacunas contra el COVID-19, y de forma parecida después de la infección por SARS-CoV-2 como potencial inductor que cambia la actividad del eje hipotalámico-hipófisis-ovario que regula el inicio y duración del ciclo menstrual |
| Kim JE et al. 202233 | Estudio descriptivo, análisis de desproporcionalidad de la enfermedad desmielinizante del SNC después de la vacunación con COVID-19. Investigar las posibles señales de seguridad de las enfermedades desmielinizantes del SNC relacionadas con las vacunas contra el COVID-19 utilizando la base de datos de farmacovigilancia de la Organización Mundial de la Salud | Calculan la desproporcionalidad de la enfermedad desmielinizante mediante el cálculo del componente de información (IC) o el índice de probabilidad de informe (ROR) en comparación con la base de datos y las demás vacunas víricas. Identifican 715 casos de neuritis óptica, 515 casos de mielitis, 220 casos de encefalomielitis diseminada aguda (ADEM) y 2.840 eventos desmielinizantes del SNC para la totalidad de reacciones adversas a medicamentos desde julio de 2020 hasta febrero de 2022La desproporcionalidad para las vacunas de ARNm y ChAdOx1 nCoV-19 fue: (IC25 = -0,93, ROR25 = 0,38; IC25 = -1,76, ROR25 = 0,26) para la neuritis óptica: (IC25 = -0,69, ROR25 = 0,50; IC25 = -0,63, ROR25 = 0,53) para la mielitis : (IC25 = -1,05, ROR25 = 0,33; IC25 = -1,76, ROR25 = 0,20) para la ADEM (IC25 = -0,66, ROR25 = 0,52; IC25 = -1,31, ROR25 = 0,34) y para efectos adversos generales para enfermedad desmielinizante del SNC en comparación con otras vacunas víricasVerifican el riesgo de desarrollar enfermedad desmielinizante del SNC asociada a las vacunas COVID-19 |
| Tamborska AA et al. 202234 | Estudio descriptivo, de cohortes. Duración: 6 meses. Investigar las características del síndrome de Guillain-Barré (SGB) después de las vacunas contra el SARS-CoV-2 y evaluar el vínculo causal entre los 2 | Recopilan casos de SGB después de la vacunación contra el SARS-CoV-2 a través del sistema nacional de vigilancia de Reino Unido en línea de acceso abierto. Para cada caso, la certeza de SGB se calificó según los criterios de Brighton, y la relación con la vacuna se examinó utilizando los criterios de evaluación de causalidad de la OMS modificados. Comparan la distribución por edad de los casos con los informes de SGB prepandémicos y las características clínicas con el Estudio Internacional de Resultados de GBS (IGOS)Incluyen 67 informes de SGB tras la vacuna ChAdOx1 (65 primeras dosis) y 3 informes después con la vacuna BNT162b2 (todas las primeras dosis). La asociación causal de las vacunas se clasificó como probable para 56 casos vacunados con ChAdOx1 (80%), posible para 12 casos (10 con ChAdOx1 y 2 con BNT162b2, 17%) e improbable para 2 casos (3%, un caso con ChAdOx1). Señalan una mayor proporción de casos en el grupo de edad de 50 a 59 años en comparación con el SGB prepandémico. La mediana de edad de los pacientes con SGB tras la vacunación contra el SARS-CoV-2 fue de 59 (IQR 51-67) años, 36 (51%) eran hombres y 34 (49%) eran mujeres, todos menos uno eran blancos (99%). No se calculó la distribución por edad de SGB después de la vacuna BNT162b2 porque solo hubo 3 casosLas variantes clínicas más frecuentes fueron el SGB sensitivo-motor (n = 55 casos, 79%) y la diplejía facial con parestesias (n = 10 casos, 14%). El 10% (n = 7 de 69 casos) informó de una infección previa, en comparación con el 77% (n = 502 de 652 pacientes) de la cohorte IGOS (p < 0,00001). Debilidad facial (n = 44 de 70 pacientes, 63%) en comparación con el 36% (n = 220 de 620 pacientes); p < 0,00001 y disfunción sensorial 93% (n = 63 de 68 pacientes) versus 69% (n = 408 de 588 casos); p = 0En general, la mayoría de los informes de SGB fueron posteriores a la primera dosis, especialmente con la vacuna ChAdOx1. La ausencia de etiologías alternativas, la distribución de edad diferente a la esperada y la presencia de características clínicas inusuales respaldan el vínculo causal. Proponen el mecanismo de la reactividad cruzada de anticuerpos entre los componentes nerviosos y el vector de adenovirus y/o la proteína de punta del SARS-CoV-2 |
| Magen E et al. 202235 | Reporte de un caso. Caracterización clínica y molecular de un caso de miositis producida por la vacuna COVID-19 mRNA BNT162b2 | Informan un caso de miositis después de la inoculación de la primera dosis de BNT162b2 en el músculo deltoides izquierdo de una mujer sin infección previa por SARS-CoV-2, sana de 34 años, que presentó debilidad muscular proximal progresiva, disfagia progresiva y disnea con insuficiencia respiratoria. Un mes después de la vacunación, detectan la expresión de ARNm de la vacuna BNT162b2 en las muestras de ADN y ARN de la biopsia del tejido de los músculos deltoides y cuádriceps derechos y en sangre la pacienteEl mapeo parcial de la secuencia de ARNm de la proteína de pico de la vacuna en la muestra de la paciente indicó un patrón inusual de expresión del ARNm de la vacuna en las células sanguíneas, concretamente, las partes «cortadas» de las moléculas de la vacuna de ARNm de Pfizer. Esto fue respaldado por el bajo nivel de IgG anti-SARS-CoV-2 detectado, sugieren que la vacuna de ARNm no se tradujo en la proteína de pico, causando la intensa respuesta inmunitariaEste resultado destaca que, aunque el ARNm de la vacuna BNT162b2 no se expresó correctamente en las células sanguíneas 7 días después de la primera dosis, si persistió la expresión en el tejido muscular distante al sitio de la inoculación un mes después. Proponen que el patrón de expresión inusual del ARNm de BNT162b2 observado en las células musculares se asocia con el desarrollo de la miositis, también, indican que el ARNm expresado exógenamente era lo suficiente estable para persistir en el tiempo. La inflamación muscular asociada con el SARS-CoV-2 se desencadena por la expansión clonal de las células T y la producción de citoquinas proinflamatorias, provocando el daño muscular con debilidad bulbar grave |
| Pisani D et al. 202236 | Revisión sistemática. Evaluar la validez de los informes y proponer hipótesis comprobables que identifiquen una vía compartida para el tratamiento de estos pacientes | Informan la pérdida auditiva neurosensorial súbita (SSNHL), tinnitus de nueva aparición, neuritis vestibular, mareos y vértigo como efectos adversos que ocurrieron en el primer mes tras la inmunización, que requieren su atención inmediata. Proponen el mismo tratamiento para efectos adversos relacionados con otros medicamentos o procesos inflamatorios (esteroides, antivíricos, ácido acetilsalicílico y/o implante coclear). En general, a los pacientes se les realizó una resonancia magnética nuclear y/o una tomografía axial computarizada siendo normales, pocos consideraron la reacción en cadena de la polimerasa de transcripción inversa (RT-PCR), notificados con resultado negativo, evalúan críticamente los informes sin esta información esencial. Registran manifestaciones audiológicas tras la vacunación del COVID-19 con las vacunas de Pfizer, Moderna, AstraZeneca y SinovacSugieren la relación de varios mecanismos caracterizados por el alto tropismo neural: la reactividad cruzada debido al mimetismo molecular entre los anticuerpos contra el SARS-CoV-2 y los antígenos del oído, el mecanismo autoadyuvante de la vacuna de ARNm induce a que el ARNm funcione como antígeno y adyuvante al mismo tiempo desencadenando la autoinmunidad, la activación de linfocitos autorreactivos y una fuerte respuesta de células T y B. Encuentran concordancia entre el inicio de los síntomas y la producción de inmunoglobulina G (IgG) posvacunal (de 10 a 14 días). Señalan similar efecto vírico sobre las vías neurales del sentido del olfato, el vértigo o la pérdida de audición con secuelas conocidas de otros virus, por ejemplo, muestran el ADN del virus del herpes simple en las fibras nerviosas vestibulares de pacientes diagnosticados de neuritis vestibular. También postulan la diseminación hematógena de la plantilla compartida del patógeno, la alteración de la barrera hematoencefálica, la reacción de hipersensibilidad (HSR), la desregulación del flujo sanguíneo coclear debido a la alteración de la viscosidad del plasma, la agregabilidad celular y plaquetaria, la deformabilidad de los glóbulos rojos y la función endotelial que conducen a la inflamación localizada que daña los microvasos del oído interno. Por último, repiten el papel de la proteína espiga del SARS-CoV-2, es un activador eficaz de la vía alternativa del complemento, que puede contribuir al daño endotelial y es un potenciador de la agregación plaquetaria, conduciendo a la formación de trombos |
| Ekobena P et al. 202237 | Serie de casos. El objetivo del estudio fue informar el curso clínico y los efectos adversos otorrinolaringológicos después de la inmunización con vacunas basadas en ARNm de SARS-CoV-2 | Reportan 4 casos clínicos de pérdida auditiva neurosensorial súbita (SSNHL), tinnitus-hipoacusia de nueva aparición y neuritis vestibular, que sucedieron tras la administración de 2 vacunas BNT162b2 de Pfizer-BioNTech y 2 vacunas mRNA-1273 de Moderna (primera dosis y refuerzos). La hipoacusia fue unilateral en todos los casos con remisión parcial, asociaron inestabilidad de la marcha en 2 casos (un mes y 7 meses posteriores a la vacuna, respectivamente)Proponen el mismo tratamiento para otros efectos adversos relacionados con las vacunas COVID-19 (esteroides, antivíricos, antihistamínicos). En la exploración física de los 2 casos de neuronitis vestibular destacaron la persistencia de la inestabilidad de la marcha (uno a 7 meses) e inicio rápido de los síntomas de vértigo rotatorio ≥48 horas, uno de los pacientes presento nistagmo horizontal espontáneoAlgunos informes refieren síntomas como cefalea, mareo, náuseas, parálisis facial o sensación de entumecimiento que sugieren afectación de otros nervios craneales, como el nervio facial o vestibular. Plantean varias hipótesis relacionadas con las vacunas de ARNm: los síntomas cocleovestibulares sugieren el neurotropismo por SARS-CoV-2 para el nervio cocleovestibular; los procesos autoinmunes que involucran linfocitos T autorreactivos y una ruptura transitoria o persistente de la tolerancia inmune mediada por el mimetismo molecular del antígeno de la vacuna podrían aumentar la inflamación del nervio vestibulococlear o facial; trastornos endoteliales con daño focal en los vasos de la cóclea, la reacción inmunitaria mediada por IgG dirigida contra el nervio vestibulococlear; también incluyen la reactivación de virus latentes tras la inmunización. Sugieren el tropismo del SARS-CoV-2 por la mucosa del oído medio, el vello vestibular y las células de Schwann, causante del derrame transitorio del oído medio, además de la inflamación del oído interno en otros casos notificados. Destacan los síntomas que aparecen poco después de la inmunización, especialmente en afectados que reciben la primera dosis y sin infección previa por COVID-19 |
| Caliskan I et al. 202238 | Reporte de un caso. Identificar a la vacuna BNT162b2 como desencadenante del trastorno del espectro de la neuromielitis óptica (NMOSD) | Identifican un brote de neuritis óptica 24 horas después de la inmunización con la segunda dosis de la vacuna contra el COVID-19 de ARNm BNT162b2, seguido de otro brote de mielitis transversa con un título elevado de anticuerpos anti-AQP-4, se confirmó el diagnóstico de trastorno de neuromielitis ópticaProponen la hipótesis actual del mimetismo molecular entre la proteína espiga y los antígenos del huésped, la inmunidad predisponente del huésped y el perfil de expresión de citoquinas alterado. Los autores excluyeron las etiologías reumatológicas, infecciosas y neoplásicas. La unión del anticuerpo AQP-4, autoanticuerpo contra los canales de agua de la aquaporina-4, activa la citotoxicidad mediada por el complemento o la citotoxicidad mediada por células dependientes de anticuerpos, lo que da como resultado la muerte celular de los astrocitos con desmielinización secundariaSe produce en una mujer de 43 años, caucásica, previamente sana con antecedentes familiares de segundo grado de lupus eritematoso sistémico. Fue dada de alta, logrando una mejoría clínica parcial tras el tratamiento con metilprednisolona intravenosa, tratamiento programado a largo plazo con rituximabSeñalan los factores coincidentes de la asociación causal del NMOSD con la vacunación BNT162b2, los datos demográficos y el sexo. El aumento paralelo en los informes de NMOSD después de la infección y la vacunación COVID-19 sugiere el mecanismo compartido, como el aumento de la permeabilidad de la barrera hematoencefálica, el mimetismo molecular y la activación inmune periférica del espectador |
| Aliasin M et al. 202239 | Revisión narrativa. Tiene como objetivo evidenciar y discutir la relación de correlación o causalidad entre los efectos adversos neurológicos de las vacunas contra el COVID-19 y si pueden considerarse una amenaza para la salud pública | Los autores incluyen en la descripción general de los efectos adversos neurológicos informados después de las vacunas contra el SARS-CoV-2: enfermedades desmielinizantes (síndrome de Guillain-Barré, mielitis transversa, neuromielitis óptica, encefalomielitis diseminada aguda), neuropatías craneales (parálisis de Bell, parálisis del nervio abducente, disfunción olfativa, pérdida auditiva neurosensorial), complicaciones cerebrovasculares (trombosis del seno venoso cerebral, accidente cerebrovascular isquémico, ataque hemorrágico), convulsiones, otras condiciones clínicas neurológicas raras (síndrome de Tolosa-Hunt, síndrome de Parsonage-Turner, neuropatía de fibras pequeñas) y trastorno neurológico funcional (FND), este último es definido como una condición neuropsiquiátrica; sin embargo, se sabe que la ausencia de daño orgánico también puede ocurrir en estos trastornos inflamatorios produciendo un deterioro de la función neurológica sin enfermedad estructural acompañada. Pueden incluir síntomas como la parálisis, debilidad, disfagia y fenómeno conductual paroxístico no epiléptico que por sus características clínicas se parece a la epilepsia (PNES), y mecanismos hipotéticos que explican la causalidad de los efectos secundarios informadosDado que la producción adecuada de antígeno S en el cuerpo es un factor importante para que las vacunas contra el COVID-19 desencadenen una respuesta inmunitaria eficiente, los autores afirman teóricamente que estas vacunas pueden causar los efectos adversos citados. Otra hipótesis que comparan es la propia característica del virus para producir efectos adversos neurológicos tras las vacunas contra el SARS-CoV-2. El SARS-CoV-2 usa el receptor de la enzima convertidora de angiotensina 2 (ACE-2) y la serina proteasa 2 transmembrana (TMPRSS2) para introducir la célula objetivo con la participación de la proteína de pico (proteína S). Señalan estudios con altas concentraciones de ACE-2 y TMPRSS2 expresadas en el sistema nervioso central. Por ejemplo, plantean de manera detallada las reacciones autoinmunes causadas por la reactividad cruzada entre los epítopos de vacunas y los antígenos ubicados en las vainas de mielina puede inducir SGB, puede unirse al ácido siálico ubicado en los gangliósidos y glicoproteínas de la membrana celular de las neuronas. Los anticuerpos que atacan a las proteínas S también responden contra los antígenos de las vainas de mielina. No descartan los trastornos autoinmunes sistémicos y la toxicidad de los medicamentos o administración incorrecta de las vacunas COVID-19 con secuelas neurológicas gravesLos estudios presentados respaldan el hecho de que las personas que reciben vacunas contra el SARS-CoV-2 son estadísticamente más propensas a desarrollar efectos adversos neurológicos. Entre otras condiciones clínicas discutidas en este artículo, los trastornos desmielinizantes también producen una morbilidad significativa si no se tratan. La inmunoterapia podría considerarse en estas condiciones |
| Azzolini E et al. 202240 | Estudio descriptivo, cohorte prospectiva. Duración: 3 meses. Tuvo como objetivo determinar la incidencia de reacciones adversas a la vacuna BNT162b2 y el impacto de respuesta de IgG | El estudio incluyó 4.156 profesionales de la salud que recibieron 2 dosis de la vacuna BNT162b2 con 21 días de diferencia y obtuvieron 6.113 cuestionarios en línea sobre efectos adversos. La respuesta sérica se probó en 2.765 sujetos 10 días después de la segunda dosis (SARS-CoV-2 S1/S2 IgG) para determinar la cantidad de anticuerpos específicos, IgG anti-S1 y anti-S2El análisis multivariado mostró que el sexo femenino (OR = 1,95, IC del 95%: 1,74-2,19), p < 0,001; la edad más joven (OR = 0,98 por año, p < 0,001, la mediana de edad fue de 37 años (RIC de 27 a 48); la segunda dosis de la vacuna (OR = 1,36, p < 0,001; infección previa por COVID-19 (OR = 1,41, p < 0,001) se asociaron de forma independiente con los efectos adversos. La respuesta de IgG fue significativamente mayor en sujetos con efectos adversos (1.110 AU/ml – IQR: 345-1.630 en comparación con los sujetos que no notificaron ningún síntoma después de la vacunación 386 AU/ml – IQR: 261-1.350, p < 0,0001), y la asociación fue más informada en sujetos que experimentaron mialgia, fiebre y linfadenopatía. Los autores asocian una mayor expresión de IgG en sujetos que experimentaron efectos adversos específicos y los profesionales de la salud los informan comúnmente tras la administración de la vacuna de BNT162b2 para el SARS-CoV-2Sugieren el efecto de pico por el efecto acumulativo inmunitario debido a la exposición repetida al antígeno con cada recuerdo vacunal. Refuerza la hipótesis del «potencial adyuvante endógeno» y distribución sistémica |
| Ahmed SH et al. 202241 | Revisión sistemática. Evaluar cualquier manifestación otológica tras administración de las vacunas COVID-19, la fisiopatología, enfoque clínico y tratamiento del tinnitus asociado a las vacunas | Recopilan 4 casos de tinnitus después de vacunas contra el SARS-CoV-2 basadas en vectores y ARNm (2 casos de primeras dosis con BNT162b2). Informan el tinnitus como intermitente o continuo, unilateral o bilateral, pulsátil o no pulsátil, agudo o crónico y subjetivo u objetivoPlantean los mecanismos relacionados con otros efectos adversos producidos por las vacunas COVID-19: los anticuerpos antipico pueden reaccionar con antígenos en cualquier lugar a lo largo de la vía auditiva e iniciar la reacción inflamatoria que involucre la membrana timpánica, la cadena osicular, la cóclea, los vasos cocleares, el órgano de Corti, etc. Comprender el fenómeno de la reactividad cruzada y el mimetismo molecular será útil para protocolizar un tratamiento no solo para el tinnitus sino también para otros efectos adversos otológicos. Los síntomas cocleovestibulares sugieren el neurotropismo por SARS-CoV-2 para el nervio cocleovestibular; trastornos endoteliales con daño focal en los vasos de la cóclea, la reacción inmunitaria mediada por IgG dirigida contra el nervio vestibulococlear; también incluyen la reactivación de virus latentes tras la inmunización. Sugieren el depósito de inmunocomplejos circulantes y de anticuerpos vestíbulococleares en la incidencia de las reacciones autoinmunes del oído interno. Los anticuerpos forman complejos con uno o más antígenos que causan la reacción de hipersensibilidad de tipo III (HSR). Además de la inflamación del oído interno, predispone a la disfunción inmunitaria y, por lo tanto, a respuestas inmunitarias anormalesNumerosos fármacos y sustancias químicas han sido reportados como ototóxicos, causando daño a la vía auditiva y las células ciliadas cocleares, pudiendo causar tinnitus y otras manifestaciones otológicas. Los autores proponen los mecanismos de la ototoxicidad, aún no se comprenden bien, pero involucran alteraciones químicas y electrofisiológicas en las estructuras del oído interno y el octavo par craneal, provocan estos síntomas al inhibir la producción de endolinfa de la estría vascular y/o toxicidad directa sobre las células ciliadas del órgano de CortiRecomiendan el uso inmediato de esteroides para el tinnitus de aparición repentina posterior a la vacunación COVID-19, debido a su mecanismo inmunosupresor subyacenteDestacan los síntomas que aparecen poco después de la inmunización, especialmente en afectados que reciben la primera dosis |
| Shafiq A et al. 2022204 | Revisión sistemática. Evaluar la causalidad entre los efectos adversos neurológicos y las vacunas contra el COVID-19 | Esta revisión recopila datos clínicos de informes de efectos adversos neurológicos relacionados con el sistema inmunitario diagnosticados que ocurrieron tras la administración de las vacunas COVID-19, exceptuando los secundarios a trastornos hematológicos. La búsqueda dio 18 resultados que cumplieron con los criterios. Incluyen 61 pacientes (64 eventos) que habían recibido las vacunas contra el COVID-19 y experimentaron al menos un efecto adverso neurológico. El efecto neurológico más frecuente fue la parálisis del nervio facial (50% de todos los efectos adversos), también: síndrome de Guillain-Barré (6,2%), enfermedades desmielinizantes, incluyen la esclerosis múltiple, la encefalomielitis diseminada aguda y la mielitis transversa (6,2%), neuropatías como la neuritis, la neuralgia y la neuropatía periférica (10,9%), reactivación del herpes zóster (10,9%) y el 15,6% otros efectos: delirio, exantema vesicular periauricular, hipoacusia neurosensorial bilateral, alteraciones visuales, alteración de la marcha, síndrome serotoninérgico, ataxia vestibular y síndrome neuroléptico maligno. Estos efectos adversos se informaron después de la vacunación con BNT162b2, mRNA-1273, AZD1222, Janssen COVID-19, Sinopharm/BIBP y Covishield. El grupo de edad más afectado que desarrolló efectos adversos neurológicos después de la vacunación fue el de 35 a 54 años con BNT162b2. Las otras vacunas no tuvieron perfiles claros en términos de edad. Aparte de AZD1222, las pacientes femeninas desarrollaron efectos adversos neurológicos con mayor frecuencia que los pacientes masculinosMecanismos hipotéticos que explican la causalidad de los efectos secundarios informados: producción de interferón tipo 1 por la vacuna conduce a una menor tolerancia de los antígenos de la vaina de mielina; linfopenia transitoria causada por la vacuna; la desregulación inmunitaria (reacción hiperinmune o inflamatoria tras la exposición a la proteína de pico); cadena de ARNm; autoinmunidad mediante el mimetismo molecular; otras vías como: liberación de anticuerpos antiidiotipo contra ciertas regiones de anticuerpos específicos de antígeno, activación de vías inmunitarias desreguladas preexistentes en sujetos predispuestos, amplificación de la inmunidad dependiente de anticuerpos u otras formas de intensificación inmune con reexposición al virus tras la vacunación, invasión celular directa a través de la interacción de la proteína espiga |
| Son CS et al. 202242 | Estudio descriptivo, cohorte prospectiva. Evaluar los efectos adversos causados por las vacunas COVID-19 informados al VAERS durante 7 meses, confirmar la relación causal con la vacunación contra el COVID-19 | Recopilan datos completos que incluyen 1.122 AEFI de 3 vacunas COVID-19 (Ad26.COV2.S, mRNA-1273 y BNT162b2) en 256.994 afectados. Consideran los registros médicos: ID de VAERS, edad, sexo, enfermedad actual e historial médico en el momento de la vacunación, tipo de vacuna, fabricante, fecha de la inoculación, fecha de inicio del efecto adverso y recuperación de los efectos adversos causados por la vacuna. Excluyen 2 o más vacunas diferentes contra el COVID-19, menores de 20 años, datos asociados al número de días (duración, persistencia, remisión y agravamiento), casos notificados después de 2 semanas y recuperación no informadaLa edad media de cada grupo fue de 50,01± 16,59 años: 44,69 ±15,1 para Ad26.COV2.S; 51,45 ± 16,76 para mRNA-1273 y 49,4 ± 16,43 para BNT162b2. La distribución total por género fue de 718 (0,28%) desconocidos, 66.280 (25,79%) hombres y 189.996 (73,936%) mujeres. La proporción de mujeres fue mayor que la de los hombres (66 - 76%). Tres discapacidades concurrentes (hipertensión [8,31%], asma [4,87%] y diabetes [4,66%] fueron diagnosticadas antes del momento de la vacunación). La proporción fue mayor en la vacuna mRNA-1273 que en las otras 2 vacunasEl intervalo de inicio de aparición de los efectos adversos para cada vacuna COVID-19 fue de 2,07 ± 3,18 días: 1,67 ± 3,1 para Ad26.COV2S; 2,51 ± 3,43 para ARNm-1273 y 1,64 ± 2,8 para BNT162b2. El intervalo de inicio para los receptores de la vacuna mRNA-1273 fue de 0,84 a 0,87 días más largo en comparación con otros receptores de vacunas. Los resultaron mostraron que 128.821 (50,13%) sujetos se recuperaron y 128.173 (49,87%) no se recuperaron de los efectos adversos causados por las vacunas COVID-19Se observaron 21 diagnósticos según el sistema de clasificación de órganos (SOC), generalmente asociados a trastornos generales y afecciones en la zona de la inoculación, cardiovasculares, neurológicos, pulmonares, musculoesquelético y del tejido conjuntivo, gastrointestinales, de la piel (tejido conjuntivo), incluyen las reacciones de hipersensibilidad retardada de tipo I, II y III (HSR), fueron más prevalentes en las vacunas de ARNm y con el vector de adenovirus. Son propuestos como enfermedades incapacitantes secundarias a las vacunas COVID-19 |
| Kim YK et al. 202243 | Estudio descriptivo, cohorte prospectiva. Investigar las respuestas de anticuerpos del síndrome respiratorio agudo severo coronavirus 2 (SARS-CoV-2) después de varias vacunas contra el COVID-19 en trabajadores de la salud | Se recogieron muestras de sangre de 497 trabajadores sanitarios vacunados. Las vacunas inoculadas fueron ChAdOx1 (AstraZeneca/Oxford), BNT162b2 (Pfizer/BioNTech), JNJ-78436735 (Janssen) y mRNA-1273 (Moderna). Cada muestra se analizó para detectar anticuerpos contra el SARS-CoV-2 usando el ensayo Elecsys Anti-SARS-CoV-2 S (Roche Diagnostics), el ensayo SARS-CoV-2 IgG II Quant (Abbott) y R-FIND SARS-CoV-2 Kit de anticuerpos neutralizantes (Sgmedical Inc.). Utilizan diferentes anticuerpos objetivo en los 3 ensayos: 1) anticuerpos (incluidos IgG) contra la proteína RBD del SARS-CoV-2 S, 2) anticuerpos IgG (incluidos los anticuerpos neutralizantes) contra el RBD de la subunidad 1 S1 de la proteína S del SARS-CoV-2 y 3) anticuerpos neutralizantes. Como existen diferencias en el antígeno objetivo, el método de medición y los criterios de corte positivo para cada ensayo, sus resultados mostraron diferencias en la tasa de positividad de anticuerpos del mismo sujeto. Por ello, analizan las diferencias según el tipo de vacuna, los días transcurridos desde la vacunación y la relación entre los efectos adversos y las cantidades de anticuerpos. Utilizaron un cuestionario para identificar los efectos adversos relacionados con la vacunación que clasifica en diferentes grados: grado 1 (ninguna molestia), grado 2 (molestia, pero sin problemas en la vida diaria), grado 3 (síntomas que requieren automedicación), grado 4 (síntomas que requieren tratamiento ambulatorio y grado 5 (síntomas que requieren hospitalización). Independientemente del efecto adverso los sujetos se clasificaron según la necesidad de tratamientoEncontraron 99 sujetos (5%) con una tasa positiva de 96 -100% en los 3 ensayos de anticuerpos independientemente del tipo de vacuna. La tasa de anticuerpos positivos de los grupos de vacunación completados logró el 96-100% y las cantidades de anticuerpos aumentaron significativamente 2 semanas después de la vacunación. Los valores de anticuerpos medidos aproximadamente 3 meses después de la administración de la vacuna de BNT162b2 se correlacionaron significativamente con efectos adversosEl estudio comprendió sujetos entre los 20 y 50 años, el 26,4 y el 27%, respectivamente. El 80,9 % (402 de 497 sujetos) eran mujeres. El 79,9% (397 de 497 casos) completaron la vacunación. Aquellos que completaron la vacunación con ChAdOx1 y BNT162b2 representaron el 61% (303 de 497 casos) y el 17,7% (88 d 497 casos). El tiempo transcurrido desde la última vacuna y la medición de las tasas de anticuerpos positivos varió entre 0 días y 117 días. Los que habían pasado ≥15 días y experimentaron síntomas de grado 3 o superior con la primera o la segunda dosis se clasificaron en el grupo de efectos adversosEn el grupo de ChAdOx1 observaron una asociación significativa entre los efectos adversos y la edad, pero no con la cantidad de anticuerpos. Con BNT162b2, las cantidades de anticuerpos fueron mayores en el grupo de efectos adversos (medidos aproximadamente 3 meses después de la vacunación) |
| Finsterer J et al. 202144 | Revisión sistemática. Evaluar la relación causal entre las vacunas SARS-CoV-2 y el síndrome de Guillain-Barré como un efecto secundario de las vacunas contra el SARS-CoV-2 (ScoVaG), su fisiopatología, su presentación clínica, tratamiento y sus consecuencias | Esta revisión resume y analiza el ScoVag según informes de investigación reciente. Identifican 9 artículos que informaron 18 pacientes con ScoVag y una revisión coincidente con este artículo sobre otro paciente. La edad de los pacientes comprendió entre los 20 y 86 años, 9 pacientes eran hombres y 10 eran mujeres. En los 19 casos se desarrolló ScoVag tras la primera dosis de la vacuna: 14 pacientes con AstraZeneca, 4 pacientes con Pfizer-BioNTech y un paciente con Johnson & JohnsonEl período de tiempo desde la vacunación y el inicio del síndrome de Guillain-Barré osciló entre 3 horas y 39 días. El tratamiento incluyó: inmunoglobulinas intravenosas (IVIG) (n = 13 pacientes), esteroides (n = 3 pacientes) o ninguna terapia (n = 3 pacientes). Dos pacientes requirieron plasmaféresis porque las IVIG no fueron efectivas, 6 pacientes precisaron ventilación mecánica, un caso recibió pregabalina por disestesias. Solo un caso se recuperó por completo y parcialmente en 9 casos (todavía están discapacitados). No se informó el resultado en 9 pacientesConcluyen que el síndrome de Guillain -Barré puede desarrollarse relacionado con el tiempo de la primera dosis de una vacuna contra el SARS-CoV-2. Evidencian la relación causal entre las vacunas COVID-19 y el ScoVaG. Todos los pacientes tenían afectación de los nervios craneales, en algunos casos no se pudo definir el síndrome de Guillain-Barré o subtipos por presentarse de forma atípica, conocido también como seudo síndrome de Guillain-Barré, recibieron el mismo tratamiento y diagnóstico independientemente de su condición clínicaSugieren el estudio de los siguientes mecanismos: 1) reacción cruzada entre antígenos extraños y autoantígenos, 2) sobreactivación de células presentadoras de antígenos y la respuesta autoinmune subsiguiente y 3) activación de células B policlonales o testigos que provocan la síntesis de citoquinas y la activación de células T autorreactivasProponen los mecanismos del mimetismo molecular, contaminantes de proteínas y proteínas de vectores de adenovirus. También, señalan que existe una mayor probabilidad de efectos adversos neurológicos tras la administración de la primera dosis por la producción de picos más altos de inmunoglobulinas después de la primera exposición |
| Umezawa S et al. 202345 | Reporte de un caso. Presentar el trastorno del espectro de neuromielitis óptica (NMOSD) positivo para AQP4-IgG causado tras la administración con la vacuna de ARNm de COVID-19 BNT162b2 | Reportan un caso de una mujer de 52 años que desarrolló un NMOSD 4-IgG-positivo para acuaporina (AQP) 14 días después de la primera dosis con BNT162b21. Experimentó dolor de cuello, debilidad en el brazo y la pierna izquierdos, entumecimiento de la mano izquierda y alteración de la sensibilidad térmica en la pierna derecha. La resonancia magnética mostró lesiones hiperintensas T2WI en el área postrema y la médula espinal cervical que van desde C1 a C6 y lesiones realzadas con Gadolinio desde el nivel C3 a C5, especialmente localizada en la columna lateral izquierda, coincide el mismo lado donde recibió la vacuna (brazo izquierdo)Veintiocho días después mostró mejoría tras el tratamiento con dosis altas de glucocorticoesteroides: 2 ciclos de terapia, cada uno de 1.000 mg de metilprednisolona intravenosa durante 3 días (el primer ciclo se inició a los 21 días tras la vacunación, el segundo ciclo se inició a los 28 días), continuó durante 16 días 40 mg de prednisona oral y una dosis decreciente durante 2 semanas más. Se descartó infección por SARS-CoV-2 por prueba de reacción en cadena de la polimerasa (PCR) negativa y ausencia de anticuerpos contra la proteína N del SARS-CoV-2. La historia familiar fue negativa para cualquier trastorno neurológico y enfermedades autoinmunesSugieren que para el desarrollo del NMOSD sea positivo para AQP4-IgG suceden varios pasos tras la ruptura de la barrera hematoencefálica (BBB), que incluyen activaciones del complemento y lisis de astrocitos después de la ruptura de la BBB. Afirman que las respuestas inmunitarias posteriores a la vacunación (vías de señalización de la interleucina-6 (IL-6) y los factores humorales) causan alteraciones de la BBB, mayor permeabilidad. A través de la BBB limitadamente dañada, las células plasmáticas que producen AQP4Abs podrían reclutarse en el sistema nervioso central (SNC) y los AQP4Abs se unen a la médula cervical y el área postremaProponen el AQP4Abs como biomarcador, ampliamente reconocido como biomarcador específico de la enfermedad NMOSD, con un papel directo sobre el daño de los astrocitos en NMOSD. La fisiopatología radica en la lisis de los astrocitos y no la desmielinización, se cree que podría ser otro subtipo de NMOSD, como el NOSMD positivo para MOG-IgGEstablecen la causalidad putativa en términos de asociación temporal con la vacuna, el tipo de vacuna y el estado de AQP4-IgG |
| Hetland G et al. 202246 | Ensayo clínico en un modelo humano. Investigar si los marcadores inflamatorios clave relacionados con la NETosis y el daño endotelial aumentan después de la vacunación con ChAdOx1 nCoV-19 y sus niveles están asociados con la gravedad de los efectos secundarios de la vacunación | Se ha estudiado con anterioridad el mecanismo de trombosis en VITT asociado con niveles altos de trampas extracelulares de neutrófilos (NET). El principal resultado de este estudio fue que los efectos adversos graves VITT se asocian con niveles elevados de NET. Además, las mediciones de calprotectina están contenidas en los NET junto con las histonas de ADN y enzimas granulares, así como sindecan-1, diferenciaron entre pacientes con VITT y aquellos que experimentaron síntomas y signos prolongados, pero sin VITTIndican marcadores clave en sangre de NETosis, como H3-NET y calprotectina, también el sindecan-1 para la endoteliopatía, los proponen como factores pronósticos para predecir la gravedad de las complicaciones asociadas con la vacunación con ChAdOx1. Se examinaron 5 pacientes con VITT, 10 son síntomas persistentes y hemorragias cutáneas, pero sin VITT y 15 pacientes con síntomas breves y leves tras la vacunaLa muestra se dividió en 3 grupos según los diferentes grados de complicaciones de la vacuna, incluyen un grupo de control formado por 20 donantes de sangre sanos, no vacunados contra el COVID-19, muestreados en 2015. Grupo 1 (formado por pacientes con VITT, síntomas iniciados de 7 a 10 días después de la vacunación); grupo 2 (pacientes que habían contactado con los servicios de salud con síntomas prolongados (dolores de cabeza leves a fuertes) y signos (hemorragias cutáneas) con una mediana de inicio de 1,5 días después de la vacunación y una duración de 2,8 semanas; grupo 3 (formado por pacientes sin síntomas o síntomas breves y leves (dolor de cabeza leve) iniciados de 0 a 2 días desde la vacunación). Las muestras de los vacunados se incluyeron entre 7 y 64 días después de recibir la vacuna ChAdOx1Los niveles de H3-NET y calprotectina en los sujetos vacunados aumentaron significativamente en los pacientes con VITT en comparación con los vacunados con síntomas asociados a la vacunación más leves (r = 0,818, p < 0,0001) con la gravedad de los efectos adversos a la vacunación. También se correlacionaron positivamente los niveles de sindecan-1 en los vacunados con los efectos adversos después de la vacunación con ChAdOx1 nCoV-19 (r = 0,590, p < 0,001)Los autores recomiendan usar los marcadores inflamatorios NET y la calprotectina como pruebas confirmatorias en el diagnóstico del VITT |
| Mingot-Castellano ME et al. 202247 | Revisión narrativa. Tiene como objetivo describir las principales enfermedades autoinmunes de carácter hematológico causadas por la vacunación contra el SARS-CoV-2 | Describen terapias de uso común, mecanismos probables relacionados con las vacunas (BNT162b2, mRNA-1273, ChAdOx1 y Ad26.CoV2.S) y la fisiopatología autoinmune producida. Recomiendan unas pautas a seguir para identificar y tratar inmediatamente estos efectos adversos. Las estructuras afectadas por estos trastornos autoinmunes hematológicos incluyen: vasos sanguíneos, plaquetas y glóbulos rojos. Los asocian con las vacunas contra el SARS-CoV-2 de ARNm y vectores adenovíricos. Concluyen que las vacunas contra el SARS-CoV-2, al igual que otras, son capaces de inducir anticuerpos contra autoantígenos de los sujetos vacunados que desencadenan mecanismos que causan el desarrollo de enfermedades hematológicas autoinmunes. Demuestran el mimetismo molecular entre los antígenos víricos y los propios del huéspedInforman casos de trombocitopenia inmunitaria secundaria (ITP), púrpura trombocitopénica trombótica inmunitaria (iTTP), anemia hemolítica autoinmune (AIHA), síndrome de Evans, anemia aplásica, síndrome antifosfolípido (SAF), SAF catastrófico (SAFC) y trombocitopenia trombótica inducida por vacuna (VITT). Se han detectado autoanticuerpos contra la quimiocina plaquetaria catiónica factor plaquetario 4 (PF4) en el VITT, que es capaz de activar plaquetas. Los afectados por VITT presentan trombocitopenia y pueden ocurrir episodios de trombosis en lugares inesperados, como el lecho cerebral. El tratamiento de estos efectos adversos es parecido cuando la vacuna no es el desencadenante, salvo la recomendación de evitar el rituximab para garantizar la adecuada inmunización frente al SARS-CoV-2 (por subproducción inmunoestimuladora), ameritan la necesidad de un diagnóstico rápido y preciso para iniciar el tratamiento adecuado y evitar complicaciones tromboembólicas o hemorragias potencialmente mortales como la VITTEstos hallazgos sugieren que al interrumpir el eje monocítico-endotelial-plaquetario podría restaurar la desregulación inmune observada en todos los efectos adversos secundarios a la administración de las vacunas COVID-19 y podría ser una posible alternativa terapéutica en un futuro próximo |
| Watanabe H et al. 202248 | Serie de casos. Analizar histopatológicamente las reacciones cutáneas después de la vacunación contra la enfermedad por coronavirus 2019 con BNT162b2 | Informan una serie de casos de efectos adversos cutáneos tras la vacunación contra el COVID-19 y demuestran el mecanismo del incremento en el número de células dentríticas plasmocitoides infiltradasCaso 1: mujer de 47 años se le produjo una roncha delimitada en el sitio de la inoculación 2 días después de su primera dosis con BNT162b2. Tratada con esteroides tópicos y antihistamínicos oralesCaso 2: mujer de 51 años experimento un eritema petequial generalizado con fiebre (38,5 °C), sangrado genital, trombocitopenia, disfunción hepática y coagulación intravascular diseminada 2 días después de la primera dosis con BNT162b2. Se le diagnosticó síndrome de activación de macrófagos (MAS), la vacunación desencadenó la producción excesiva de citoquinas. Recibió terapia antiinflamatoria (terapia de inmunoglobulina intravascular en dosis altas y metilprednisolona intravenosa)El análisis inmunohistológico de la erupción cutánea en ambos casos mostró la infiltración de células dentríticas plasmacitoides (p-DC), fueron inmunohistoquímicamente positivos para CD123+ BDCA2+ (marcadores de células dentríticas plasmacitoides)Proponen que las p-DC se infiltran en la piel como respuesta cutánea a la vacuna COVID-19, donde producen IFN-I, que provoca trastornos cutáneos. Los hallazgos patológicos mostraron espongiosis intraepidérmica, degeneración por licuefacción e infiltración dérmica por células inflamatorias con predominio de linfocitosLa patogenia de los efectos adversos cutáneos después de la vacunación contra el COVID-19 es causada por una respuesta inmune parecida a la provocada por la infección por SARS-CoV-2. Los autores confirman el mecanismo del ingreso del virus al cuerpo, los receptores tipo Toll (TLR3, TLR7 y TLR8) en la superficie de las p-DC reconocen el ARNm vírico y producen IFN-I. Indican que la producción excesiva de IFN-I causa los efectos adversos de la vacuna. También señalan que el IFN-I derivado de la piel expuesto a la proteína 1 de resistencia a Mixovirus es una causa del trastorno de la piel después de la vacunación COVID-19En los 2 casos los niveles de p-DC fueron elevados basándose en los números de p-DC en la psoriasis asociada con el VIH y la psoriasis vulgarSugieren la contribución patógena de la vacuna de ARNm BNT162b2, es posible que las p-DC se infiltren en las glándulas sudoríparas perivasculares y periecrinas de la dermis media. Por lo tanto, confirman que los efectos adversos cutáneos son la consecuencia de la respuesta inmunitaria que imita la respuesta observada después de la infección por SARS-CoV-2 |
| Abbasi S et al. 202249 | Reporte de un caso. Presentar un caso de trombocitopenia trombótica inducida por la vacuna (VITT) de venas esplácnicas después de recibir la primera dosis con AstraZeneca | Describen el caso de una mujer de 36 años que experimentó dolor epigástrico 2 semanas después de la vacunación con la primera dosis de AstraZeneca. La prueba de reacción en cadena de la polimerasa (PCR) de COVID-19 fue negativaResultados de laboratorio sugestivos (fibrinógeno bajo, dímero D alto y plaquetas bajas), la presencia de trombosis en una zona inusual, junto con la condición de que la paciente estaba sana sin antecedentes de trombosis ni factores desencadenantes de la misma, excepto la administración de la vacuna COVID-19 confirmó la sospecha de VITT. Aparte detectaron un quiste del cuerpo lúteo en el ovario derecho y un endometrio levemente engrosado. Se le administró Apixabán como anticoagulante e inmunoglobulina intravenosa (IGIV) (1 gr/kg durante 2 días), sus plaquetas mejoraron. Para el tratamiento a largo plazo, se pauto apixabán durante 6 meses y la recanalización de las venas previamente trombosadas, se confirmó con una tomografía computarizada 5 meses después del altaComparan las vacunas basadas en vectores adenovíricos (ChAdOx1 de AstraZeneca y Ad26.COV2.S de Janssen), ambas asociadas al efecto adverso del VITT, causa la formación de trombos en sitios inusuales, principalmente en venas cerebrales y esplácnicas, siendo predominante en el género femenino. Produce cefalea, dolor abdominal, síntomas neurológicos y fiebre. Afirman que ciertos componentes de la vacuna, incluido el vector del adenovirus, provocan la formación de anticuerpos contra el factor plaquetario 4 (PF4). Proponen el mecanismo de los complejos antígeno-anticuerpo que se producen y activan una cascada de reacciones que eventualmente terminan en la coagulopatía de consumo. Destacan el parecido de la patogenia con la trombocitopenia inducida por heparina. Se trata de un fenómeno autoinmune. Los resultados de laboratorio en VITT revelan la fisiopatología propuesta: plaquetas bajas, fibrinógeno bajo y dímero D alto, junto con títulos elevados de anti-PF4 son hallazgos clásicos. Esto indica que la ausencia de exposición a heparina significa que la VITT imita a la trombocitopenia autoinmune inducida por heparina (aHIT). El tratamiento incluye anticoagulantes no heparinicos, inmunoglobulina intravenosa y plasmaféresis, puede ser necesario la intervención quirúrgica (trombectomía mecánica). Se ha asociado la mortalidad con la hemorragia cerebralEl estado protrombótico se logra posteriormente cuando los complejos PF4-antiPF4 entrecruzan los receptores Fc gamma RIIA en plaquetas, monocitos y neutrófilos para desencadenar vías intracelulares que producen el estado de hipercoagulabilidadEn resumen, plantean las hipótesis de que el vector adenovírico precipita la formación de anticuerpos, refuerza la teoría de las vacunas contra el SARS-CoV-2 compuestas por vectores víricos envíen señales inflamatorias más atenuadas o por otros mecanismos que contribuyen a la activación inmunitaria innata, no solo por las vacunas de ARNm y el «potencial adyuvante endógeno» |
| Chow BT et al. 202250 | Reporte de un caso. Presentar un caso de miocarditis linfohistiocítica confirmada por biopsia después de la vacuna de ARNm (mRNA-1273/Moderna) | Describen el caso de una mujer de 45 años previamente sana diagnosticada de una miocarditis linfohistiocítica con eosinófilos dispersos y un granuloma mal definido, se clasifica como una reacción de hipersensibilidad (HSR) posterior a la primera dosis de la vacuna de mRNA-1273. Presentó múltiples episodios intermitentes de palpitaciones que duraban de segundos a minutos, taquicardia ventricular, intolerancia al ejercicio físico, fatiga generalizada con disnea de esfuerzo y episodio sincopal derivado de convulsiones, una semana después de la vacunaLos hallazgos histológicos – inmunohistoquímicos y de imagen cardiaca eran compatibles con la miocarditis. La muestra de la biopsia endomiocárdica detecto infiltrados linfohistiocíticos parcheados endocárdicos e intramiocárdicos con eosinófilos dispersos y lesión focal de miocitos. Las inmunotinciones CD3 y CD68 confirmaron la naturaleza linfocítica e histiocítica del infiltrado, respectivamente. Observaron una colección histiocítica focal sugestiva de un granuloma mal definidoConfirman la asociación temporal del inicio de los síntomas de la paciente en relación con la primera dosis de la vacuna mRNA-1273 y el empeoramiento de los síntomas después de la segunda dosis, en vista de los hallazgos de la miocarditis inducida por el mecanismo de HSR, ante la sospecha o confirmación de reacción alérgica anafilactoide (HSR) o anafiláctica no se debe exponer de nuevo al alérgeno, el riesgo superaría al beneficio. Fue tratada con prednisona, mostró mejoría clínicaConfirman el mecanismo de la desregulación autoinmune que conduce a la infiltración linfocítica y eosinofílica del miocardio debido al mimetismo molecular de la proteína de pico del SARS-CoV-2, la respuesta inflamatoria sistémica no específica y la activación de la tormenta de citoquinas por el ARNm de la vacuna |
| Zlotnik Y et al. 202251 | Reporte de un caso. Informar un caso de encefalitis autoinmune anti-LGI1 después de la vacuna ARNm COVID-19 BNT162b2 | Describen el caso de un hombre de 48 años que presenta deterioro cognitivo rápidamente progresivo e hiponatremia leve diagnosticado con anti-LGI1 AE, tras la segunda dosis de la vacuna de ARNm COVID-19 de Pfizer. Dos semanas y media después de la inoculación experimenta deficiencias graves en la memoria a corto plazo, la orientación temporal, la abstracción y habilidades lingüísticas. Puntuación de 18/30 (rango normal: 26/30) en la Evaluación Cognitiva de Montreal (MoCA). Hallazgo suprarrenal compatible con adenoma, sin otros signos de tumor sólido. No había desarrollado infección por COVID-19 antes de la vacunación, serología positiva de respuesta a la vacunación. El análisis de líquido cefalorraquídeo demostró proteínas y glucosa normales sin pleocitosis. Los cultivos de LCR fueron negativos. El panel de encefalitis autoinmune basado en células (Euroimmune) fue positivo para anti-LGI1Ab tanto en suero como en LCRFue tratado inicialmente con dosis altas de metilprednisolona (1 gr/24 horas durante 5 días), con respuesta favorable. Su puntuaje MoCA tras el tratamiento mejoró a 22/30. Continuó el tratamiento con prednisolona oral (1 mg/kg) y su puntuaje MoCA 2 semanas después mejoró a 25/30, presenta una mejora notable en la orientación temporal, memoria a corto plazo y la función léxico-semántica, aunque las habilidades ejecutivas continuaron afectadas. Los niveles séricos de sodio se normalizaron 3 semanas después desde el inicio de los síntomas. Continúo mejorando progresivamente 4 meses después, puntuaje MoCA 27/30, todavía persiste el deterioro de las funciones ejecutivasLa encefalitis límbica autoinmune asociada a anticuerpos LGI1 (Anti-LGI1 AE) se caracteriza por: deterioro cognitivo o demencia rápidamente progresiva, trastornos psiquiátricos, convulsiones distónicas faciobraquiales (FBDS) e hiponatremia refractaria. Responde al tratamiento de inmunoterapia que incluye esteroides, inmunoglobulina intravenosa y otros agentes supresoresProponen los mecanismos comentados: reacción hiperinmune o inflamatoria tras la exposición a la proteína de pico; activación de las APC; cadena de ARNm; autoinmunidad mediante el mimetismo molecular; otras vías como: liberación de anticuerpos antiidiotipo contra ciertas regiones de anticuerpos específicos de antígeno, activación de vías inmunitarias desreguladas preexistentes en sujetos predispuestos, amplificación de la inmunidad dependiente de anticuerpos u otras formas de intensificación inmune con reexposición al virus tras la vacunación, invasión celular directa a través de la interacción de la proteína espiga, transcripción e inducción de muchos genes diana, que conduce a la síntesis y liberación de citoquinas pirogénicas (IL-1, IL-6, TNF-α y prostaglandina-E2) en sangre, imitando la respuesta a la infección natural. Confirman la neuroinvasión y la diafonía neuroinmune como inductores de los síntomas neurológicos producidos por la vacunación contra el SARS-CoV-2 de BNT162b2. Sugieren el mecanismo causal por asociación temporal entre la vacunación y el desarrollo de la enfermedad en ausencia de otros posibles eventos desencadenantes intercurrentesLos mecanismos comentados podrían resumirse en: hipótesis patógeno/vírico, hipótesis paraneoplásica e hipótesis autoinmune. La tormenta de citoquinas que induce la iMCD es causada por una infección no controlada (hipótesis patógena), autoanticuerpos o células T autorreactivas asociadas con mutaciones de línea germinal predisponentes (hipótesis autoinmune), mutaciones de línea germinal en genes que regulan la inflamación (hipótesis autoinflamatoria) y/o mutaciones somáticas en células de ganglios linfáticos monoclonales que resultan en la secreción ectópica de citoquinas (hipótesis paraneoplásica) |
| Ameratunga R et al. 202252 | Reporte de un caso. Informan un caso de miocarditis eosinofílica necrosante fulminante fatal después de la primera dosis de la vacuna de Pfizer-BioNTech ARNm COVID-19 (BNT162b2, Comirnaty): una reacción de hipersensibilidad idiosincrásica | Describen un caso de miocarditis necrosante fulminante mortal en una mujer de 57 años tras la primera dosis de la vacuna BNT162b2, descartaron otras causas. Falleció a los 3 días, no había antecedentes de enfermedades autoinmunes o alérgicas. La prueba de toxicología fue negativa, no se realizaron estudios de complemento ni de citoquinas porque no había sangre ante mortem disponible. La prueba PCR vírica para SARS-CoV-2 fue negativaEn el examen histológico de la autopsia había agregados multifocales de células linfoides, histiocitos y abundantes eosinófilos con necrosis miocitaria focal en las paredes libres de ambos ventrículos, tabique interventricular y alrededor del sistema de conducción (nódulos sinoauricular y auriculoventricular). No identificaron organismos parásitos ni células grandes. En el espacio pleural izquierdo mostró un timoma (subtipo AB de la OMS)La asociación temporal es compatible con la reacción de hipersensibilidad (HSR), se han excluido otras causas y la histomorfología es compatible con el diagnóstico. Es probable que la lesión cardiaca esté mediada por el contenido altamente tóxico de los gránulos (anafilatoxinas), incluida la proteína catiónica eosinofílica, la proteína básica principal de los eosinófilos, la peroxidasa de eosinófilos y la neurotoxina derivada de los eosinófilos. En ratones, la IL-4 derivada de los eosinófilos es necesaria para causar el daño cardiaco. La inmunopatología de este trastorno se confirma por los mecanismos mediados por células T citotóxicas que producen IL-5, liberación de anticuerpos antiidiotipo contra ciertas regiones de anticuerpos específicos de antígeno y la invasión celular directa a través de la interacción de la proteína espiga. Comparan el efecto de pico de la vacuna COVID-19 con el virus para producir efectos adversos tras las vacunas contra el SARS-CoV-2. El SARS-CoV-2 usa el receptor de la enzima convertidora de angiotensina 2 (ACE-2). Los miocitos cardíacos expresan receptores ACE2 que se unen a la proteína de pico, traducida de la vacuna de ARNm. Una reacción de hipersensibilidad específica inducida por ACE2 no explicaría la patogenia de esta enfermedad, indican que puede ser desencadenada por otros fármacos y vacunas. No haría falta una sensibilización previa al desarrolló de la enfermedad, puede ocurrir tras la primera exposición a un fármaco o vacuna. Las características histológicas mostraron un infiltrado inflamatorio compuesto por células T y macrófagos, eosinófilos, células B y células plasmáticas, sin embargo, no se identificó en la miocarditis eosinofílica necrosante fulminante |
| Duijster JW et al. 202353 | Estudio descriptivo, cohorte retrospectiva. Duración: 4 meses1. Describir la naturaleza y los posibles factores de riesgo asociados con los trastornos menstruales basándose en los datos informados espontáneamente y los datos de un estudio prospectivo de monitorización de eventos de cohortes (CEM) | Resumen de los informes de trastornos menstruales registrados por el Centro de Farmacovigilancia Lareb de los Países Bajos en el sistema de notificación espontánea entre febrero de 2021 y abril de 2022. También, realizaron un análisis de regresión logística sobre las irregularidades menstruales notificadas en el estudio CEM para establecer la asociación entre las características de la persona, la infección previa por SARS-CoV-2 y el tratamiento con anticonceptivos hormonales y la aparición de los trastornos menstruales posteriores a la vacunación con vacunas COVID-19El estudio demostró una alta incidencia de trastornos menstruales en mujeres de 54 años o más, esta observación se confirmó por el análisis de informes espontáneos. Analizan más de 24.000 informes espontáneos de irregularidades del ciclo menstrual (amenorrea/oligomenorrea y sangrado menstrual abundante), ≥500 episodios (n = 16.929 mujeres) en el estudio CEM. El estudio CEM tuvo una incidencia de 41,4 por 1.000 mujeres ≤54 años. Se observó una asociación significativa para el grupo de edad de 25 a 34 años (OR = 2,18, IC del 95%; 1,45-3,41) y la vacuna de Pfizer (OR = 3,04, IC del 95%; 2,36-3,93)Evidencian la relación entre la vacunación contra el COVID-19 y las irregularidades menstruales. Proponen el mecanismo que produce el aumento de la reactogenicidad de las vacunas en las mujeres. Debido a la respuesta inmediata más fuerte al antígeno, modulada a través del sistema inmunitario innato (inmunidad diferenciada con el sexo). Tanto el sangrado anormal como el ciclo menstrual irregular podrían estar asociados al efecto de pico, refuerza la hipótesis del «potencial adyuvante endógeno» aunque no informan las respuestas de anticuerpos en esta vacuna |