Editado por: Dra. Núria Torner CIBER Epidemiologia y Salud Publica CIBERESP Unitat de Medicina Preventiva i Salut Pública Departament de Medicina, Universitat de Barcelona
Más datosen 2020 hubo una campaña de vacunación en España para combatir el SARS-CoV-2 con las vacunas Comirnaty®, Moderna®, Vaxzeviria® y Janssen®. Observamos alteraciones en el International Normalized Ratio (INR) posvacunación, en pacientes tratados con acenocumarol. El objetivo del estudio fue averiguar si existe una asociación entre dichas alteraciones del INR y la vacunación frente a SARS-CoV-2.
Materiales y métodosse llevó a cabo un estudio observacional, longitudinal retrospectivo en 137 pacientes mayores de 60 años vacunados contra el SARS-CoV-2 y a su vez tratados con acenocumarol. Como variable principal se consideró INR antes y después de la vacunación, y como variables secundarias se tomaron la fecha de vacunación, la edad, el sexo, el tipo de vacuna y la dosis de acenocumarol que tomaba cada paciente. Se compararon las medias pareadas mediante pruebas no paramétricas de Friedman y Wilcoxon con corrección Benjamini-Hochberg, y se llevó a cabo un análisis de regresión lineal entre la edad y las diferencias entre las mediciones del INR pre- y posvacunación. El análisis se realizó sobre la muestra total y por subgrupos. Se consideró un nivel de significación estadístico en p<0,05.
Resultadosse hallaron diferencias estadísticamente significativas globales (Friedman, p<0,05) entre las mediciones INR en la muestra total, mujeres, vacuna Comirnaty® y las dosis Sintrom® 1g, aunque las diferencias encontradas son débiles (W-Kendall<0,01). No se encontraron diferencias estadísticamente significativas entre pares concretos en las mediciones de INR (Wilcoxon, p>0,05). La bondad de ajuste de todas las regresiones lineales fue de R2<0,1.
Conclusioneslas alteraciones de la coagulación a causa de la vacunación frente al SARS-CoV-2 es un posible efecto secundario, aunque no generalizado en las personas mayores de 60 años tratados con acenocumarol. Este hecho refuerza la evidencia de la seguridad de la vacunación frente a SARS-CoV-2 en este tipo de pacientes.
After the SARS-CoV-2 vaccination campaign, we observed alterations in post-vaccination International Normalized Ratio (INR) in patients treated with acenocoumarol. The aim of the study was to investigate whether there is an association between the observed blood coagulation alterations and SARS-CoV2 vaccination.
Materials and methodsA retrospective, longitudinal, observational study of patients over 60 years of age vaccinated against SARS-CoV-2 and treated with acenocoumarol was conducted. The main variable measured was the INR before and after vaccination, and secondary variables were date of vaccination, age, sex, type of vaccine and dose of acenocoumarol. Paired means were compared using nonparametric Friedman and Wilcoxon tests with Benjamini-Hochberg correction, and a linear regression analysis between age and differences between pre and post vaccination INR measurements. The analysis was performed on the total sample and by subgroups. Statistical significance was set at p-value<0.05.
ResultsOverall statistically significant differences (Friedman, p-value<0.05) were found between INR measurements in the total sample, women, Comirnaty® vaccine and Sintrom® 1g dose, although the differences found are weak (W-Kendall<0.01). No statistically significant differences were found between specific pairs in INR measurements (Wilcoxon, p-value>0.05). The goodness-of-fit of all linear regressions was R2<0.1.
ConclusionsThe alteration of coagulation due to vaccination against SARS-CoV-2 is not a population or generalized effect, but a possible side effect, and reinforces the safety of SARS-CoV-2 vaccination in this type of patients.
A finales de diciembre de 2019 se produjo un brote de neumonía de origen desconocido en Wuhan, China. En enero de 2020 se identificó un nuevo virus de la familia de los coronavirus, como el agente causante, que posteriormente se denominó SARS-CoV-21. La Organización Mundial de la Salud declaró la situación como una «emergencia de salud pública de interés internacional» en enero de 2020 y, su avance a pandemia, en marzo de ese mismo año. Este hecho desencadenó una intensa búsqueda para comprender la enfermedad, su modo de transmisión, su tratamiento y el desarrollo de vacunas eficaces. Tras un periodo de incertidumbre durante el cual murieron millones de personas, las esperanzas de frenar esta pandemia se volcaron en el desarrollo de nuevas vacunas.
En España, en diciembre de 2020, se inició la campaña de vacunación contra el SARS-CoV-2, utilizando varias de las vacunas autorizadas2, entre las cuales se encontraban: Comirnaty®3, Moderna®4, Vaxzevria® (Astra Zeneca)5 y Janssen®6. Una vez aprobadas las vacunas, se generaron diversas preocupaciones, especialmente en el ámbito el clínico-sanitario, acerca de los posibles efectos adversos de la vacunación en los pacientes de riesgo. Entre estos pacientes se encuentran aquellos que reciben tratamiento con acenocumarol, de nombre comercial Sintrom®7, un anticoagulante de la familia de los antagonistas de la vitamina K, utilizado para prevenir la formación y el crecimiento de coágulos sanguíneos o favoreciendo su desaparición, si ya se han formado. Los pacientes en tratamiento con acenocumarol requieren de un estricto control de su nivel de anticoagulación, el cual se evalúa mediante el International Normalized Ratio (INR)8,9, que es la unidad recomendada para medir el estado de coagulación deseada. En pacientes sin problemas de coagulación, se considera un rango terapéutico normal del INR de 0,9-1,310. En pacientes con tratamientos anticoagulantes como el acenocumarol, el rango terapéutico normal del INR es 2-3, en pacientes con trombosis venosa profunda, fibrilación auricular, y tromboembolismo pulmonar (aunque en los protocolos clínicos el rango suele ampliarse a 1,8-3,2)11,12, y de 2,5-3,5 en pacientes con tratamiento de deficiencias congénitas graves de proteína C o S, y en tratamiento con prótesis valvulares cardiacas13,14.
Durante el seguimiento rutinario en la consulta de enfermería del Centro de Salud Fernando el Católico de Castellón de la Plana, se observaron alteraciones en los niveles de INR en diferentes pacientes después de la vacunación contra el SARS-CoV-2, fuera del rango terapéutico. Esto condujo a la necesidad de ajustar las dosis de acenocumarol en usuarios que previamente mantenían un INR estable en las 6 mediciones anteriores a la vacunación. Debido a las posibles consecuencias a las que se pueden enfrentar estos pacientes15 cuando presentan un INR fuera del rango terapéutico, y considerando los informes reportados sobre casos raros de trombosis en personas vacunadas, se decide investigar si estas alteraciones del INR están relacionadas con las vacunas contra el SARS-CoV-2 incluidas en nuestro estudio. A su vez, se propone determinar si existen posibles diferencias según el género, la dosis y la edad de los pacientes, así como las variaciones en el INR después de la administración de la primera y/o segunda dosis de la vacuna, en una población mayor de 60 años, perteneciente al Centro de Salud Fernando el Católico de Castellón de la Plana.
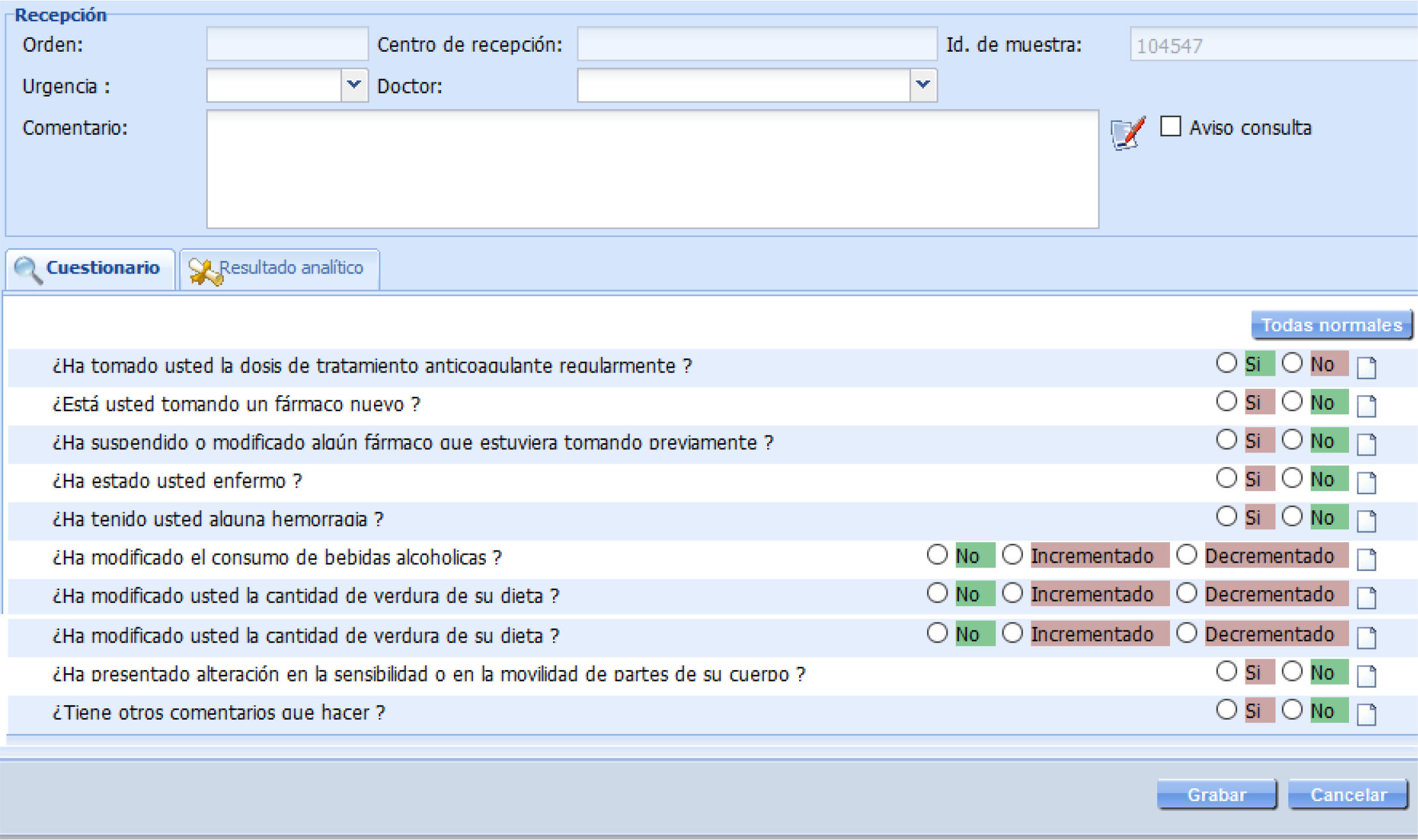
Material y métodosDiseño y población del estudioSe trata de un estudio observacional longitudinal retrospectivo llevado a cabo desde el 1 junio de 2020 hasta el 30 de abril de 2022. Como población de estudio se consideraron inicialmente pacientes del Centro de Salud Fernando el Católico (Castellón de la Plana, España) que cumplían los siguientes criterios de inclusión: a) mayores a 60 años, 2) tratados con acenocumarol, 3) vacunados contra la SARS-CoV-2 con vacunas Comirnaty® (BioNTech/Pfizer), Moderna®, Janssen® o Vaxzevria® y 4) que las respuestas de la encuesta que todos los pacientes cumplimentaron, fueran las indicadas en la figura 1 (opción «todas normales»). Para los datos referentes a la vacunación contra la SARS-CoV-2 se utilizó el Registro de Vacunación Nominal (RVN) de la comunidad valenciana, con base en el Sistema de Información Poblacional (SIP)16.
Se consideró como variable principal el índice normalizado del tiempo de coagulación de la sangre, medido con la prueba de tiempo de protrombina (TP), más conocido como INR o TP/INR. Para cada paciente incluido en el estudio, se recogieron las 6 mediciones de INR previas a su vacunación y las 3 mediciones posteriores, empleando un coagulómetro portátil sistema microINR® de iLine Microsystem, con un chip reactivo para la toma de muestra de sangre capilar mediante punción digital. El sistema microINR® determina el TP cuantitativo en unidades INR. Posteriormente, para garantizar la calidad de las mediciones en estudio, se descartaron aquellos pacientes cuyas 6 mediciones de INR previas a la vacunación, el porcentaje de tiempo en rango terapéutico (%TRT) fuera inferior al 60% mediante el método directo o inferior al 65% mediante el método de Rosendaal17. Se seleccionaron un total de n=137 pacientes.
Como variables secundarias se registraron las fechas de las mediciones de INR, las fechas de vacunación y la edad (a fecha del 31 de marzo de 2021) como variables continuas, y el sexo (hombre o mujer), el tipo de vacuna recibida (Comirnaty®, Moderna®, Janssen® o Vaxzevria®), y la dosis de acenocumarol pautada de cada paciente (Sintrom® 0,5 g; 1 o 4 g) como variables categóricas.
Análisis estadísticoEl objetivo del análisis estadístico fue comprobar si existían diferencias estadísticamente significativas del INR tras la vacunación contra la SARS-CoV-2. Como mediciones INR de referencia para realizar comparaciones, se consideraron la última medición previa a la vacunación (última) y la media de las 6 mediciones (media), para garantizar una mayor firmeza. La comparativa se realizó con las 3 medidas INR tras la vacunación (Post1, Post2 y Post3, de más cercana a más lejana a la última fecha de vacunación).
Inicialmente, se llevó a cabo un análisis descriptivo de la población de estudio, en el que se obtuvo la frecuencia absoluta (número de casos) y la relativa (porcentaje), la media y la desviación típica del INR para la población total y para cada categoría de las variables categóricas: sexo, vacuna y dosis de acenocumarol. Para este análisis, se descartó en los cálculos con la variable «vacuna» al único paciente que recibió la vacuna Janssen®, por ser un tamaño muestral insuficiente para el análisis estadístico, y a otro que recibió una primera dosis Janssen® y una segunda de Moderna®, por no mantener la homogeneidad en el tratamiento. Adicionalmente, se descartaron 3 pacientes en los cálculos con la variable «dosis», puesto que tomaban un fármaco distinto al Sintrom®. Asimismo, se obtuvieron los diagramas de caja de las mediciones INR para visualizar su distribución.
Para comprobar si existían diferencias estadísticamente significativas entre mediciones INR pre- y posvacunación en la muestra de pacientes, se planteó un análisis estadístico de medias pareadas, calculando todas las diferencias entre mediciones INR pos- y prevacunación (Post1/2/3 – última/media). En primer lugar, se comprobó la hipótesis de normalidad mediante el test de normalidad de Shapiro-Wilk, los estadísticos de asimetría y curtosis estandarizadas y los gráficos Q-Q. Al no poder asumir normalidad tras los resultados, se optó por emplear la prueba no paramétrica de Friedman (equivalente al ANOVA de medidas repetidas) para comprobar si existía alguna diferencia estadísticamente significativa entre mediciones en global, y se comprobó su efecto tamaño mediante el coeficiente de concordancia W de Kendall (que mide de 0 a 1 la fuerza de estas diferencias observadas). Finalmente, se aplicaron post hoc los test de rango y signo de Wilcoxon con corrección del p Benjamini-Hochberg entre todas las medidas para identificar qué pares en concreto eran significativamente diferentes. Este mismo análisis se llevó a cabo en las diferentes categorías de las variables sexo, tipo de vacuna, dosis y grupo de edad (se crearon los grupos menor de67, 67-76, 76-85 y mayor de85, tomando como límites de los intervalos los cuartiles de la edad). Finalmente, se llevó a cabo un análisis de correlación entre las diferencias entre mediciones INR y la edad como variable continua.
Los datos se analizaron mediante los softwares R (versión 4.2.0) y Excel (versión 2019). Para las pruebas estadísticas, se empleó el nivel de significación habitual de 0,05.
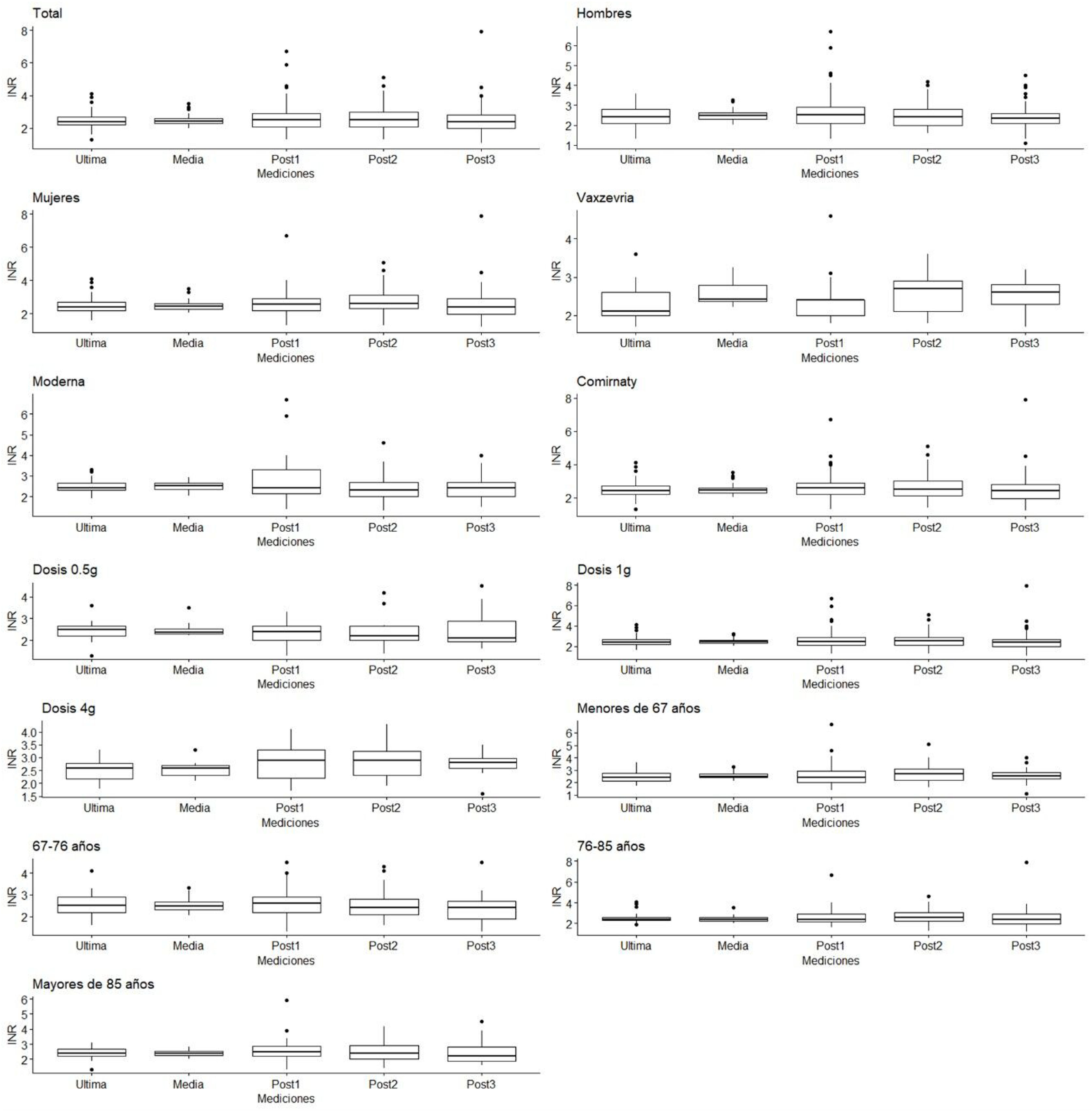
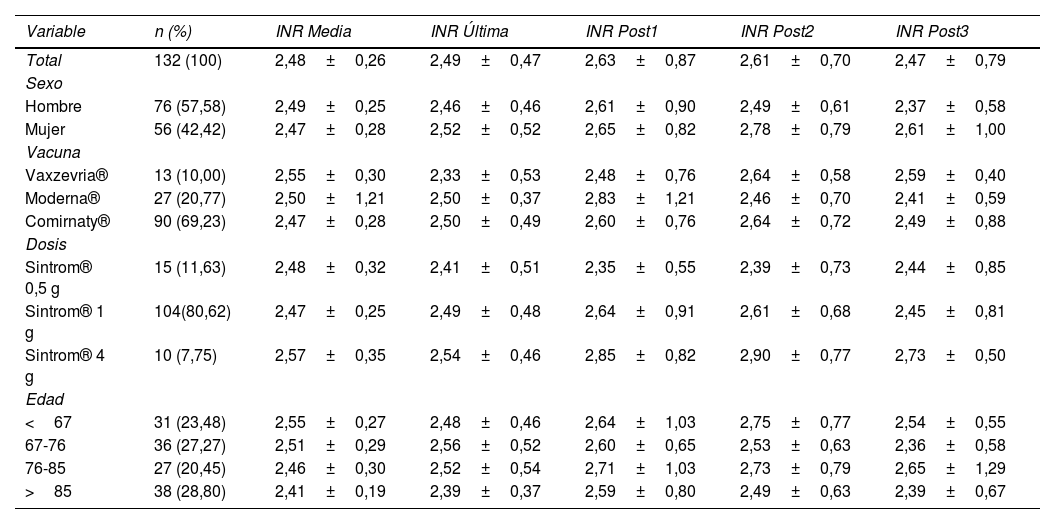
ResultadosLos resultados del análisis descriptivo de la población se muestran en la tabla 1. En las frecuencias se mostró que los sexos están balanceados (57,58% hombres frente a 42,42% mujeres), mientras que la mayor parte de los pacientes recibieron la vacuna de Comirnaty® (69,23%) y estaban siendo tratados con la dosis media de 1 g de acenocumarol (80,62%). En cuanto al INR, observamos que en todos los grupos oscila entre 2 y 3, rango terapéutico esperado para pacientes tratados con acenocumarol. Sin embargo, ciertos grupos como las mujeres o pacientes con dosis de acenocumarol de 4 g presentaron mediciones posvacunación ligeramente más elevadas. Los resultados de los diagramas de caja de las mediciones INR (fig. 2) mostraron que las distribuciones eran muy similares, y no se apreciaron diferencias significativas entre ellas.
Análisis descriptivo de las mediciones INR (International Normalized Ratio) (media ± desviación estándar) de la población total y subpoblaciones por sexo, tipo de vacuna, dosis de acenocumarol y grupo de edad
| Variable | n (%) | INR Media | INR Última | INR Post1 | INR Post2 | INR Post3 |
|---|---|---|---|---|---|---|
| Total | 132 (100) | 2,48±0,26 | 2,49±0,47 | 2,63±0,87 | 2,61±0,70 | 2,47±0,79 |
| Sexo | ||||||
| Hombre | 76 (57,58) | 2,49±0,25 | 2,46±0,46 | 2,61±0,90 | 2,49±0,61 | 2,37±0,58 |
| Mujer | 56 (42,42) | 2,47±0,28 | 2,52±0,52 | 2,65±0,82 | 2,78±0,79 | 2,61±1,00 |
| Vacuna | ||||||
| Vaxzevria® | 13 (10,00) | 2,55±0,30 | 2,33±0,53 | 2,48±0,76 | 2,64±0,58 | 2,59±0,40 |
| Moderna® | 27 (20,77) | 2,50±1,21 | 2,50±0,37 | 2,83±1,21 | 2,46±0,70 | 2,41±0,59 |
| Comirnaty® | 90 (69,23) | 2,47±0,28 | 2,50±0,49 | 2,60±0,76 | 2,64±0,72 | 2,49±0,88 |
| Dosis | ||||||
| Sintrom® 0,5 g | 15 (11,63) | 2,48±0,32 | 2,41±0,51 | 2,35±0,55 | 2,39±0,73 | 2,44±0,85 |
| Sintrom® 1 g | 104(80,62) | 2,47±0,25 | 2,49±0,48 | 2,64±0,91 | 2,61±0,68 | 2,45±0,81 |
| Sintrom® 4 g | 10 (7,75) | 2,57±0,35 | 2,54±0,46 | 2,85±0,82 | 2,90±0,77 | 2,73±0,50 |
| Edad | ||||||
| <67 | 31 (23,48) | 2,55±0,27 | 2,48±0,46 | 2,64±1,03 | 2,75±0,77 | 2,54±0,55 |
| 67-76 | 36 (27,27) | 2,51±0,29 | 2,56±0,52 | 2,60±0,65 | 2,53±0,63 | 2,36±0,58 |
| 76-85 | 27 (20,45) | 2,46±0,30 | 2,52±0,54 | 2,71±1,03 | 2,73±0,79 | 2,65±1,29 |
| >85 | 38 (28,80) | 2,41±0,19 | 2,39±0,37 | 2,59±0,80 | 2,49±0,63 | 2,39±0,67 |
Para el estudio de las diferencias entre mediciones INR, los test de normalidad Shapiro-Wilk indicaron que ninguna de las diferencias entre mediciones INR cumplían la hipótesis de normalidad (p<0,001). Complementariamente, todas las medidas de curtosis estandarizada caían fuera del rango [-2,2], y tampoco se observó linealidad en los extremos de los gráficos Q-Q. Por todo ello, no se asume que las diferencias siguen una distribución normal.
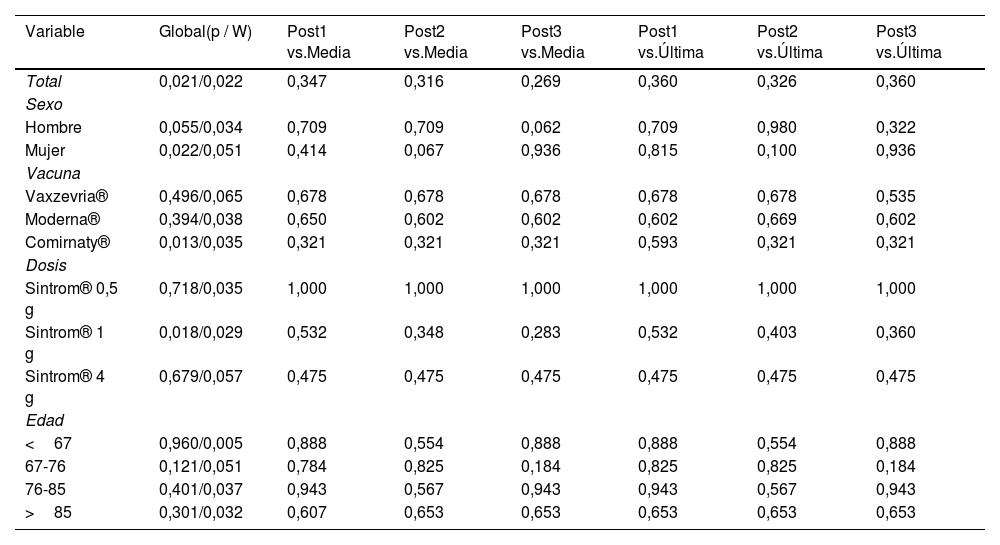
En referencia al análisis estadístico de las diferencias sobre el total de la muestra, el resultado de la prueba de Friedman (χ2=11,543, p=0,021) indicó que podría asumirse que existen diferencias estadísticamente significativas entre cierto par o pares de mediciones IRN, es decir, que las mediciones INR podrían haberse visto alteradas antes y después de la vacunación. Sin embargo, el coeficiente de concordancia W de Kendall presentó una magnitud baja (W=0,022), es decir, que las diferencias observadas son débiles. Por otro lado, las pruebas post hoc de rango y signo de Wilcoxon con corrección de p Benjamini-Hochberg, indican que ninguno de los pares de mediciones INR presentó diferencias estadísticamente significativas. El mismo análisis para las diferentes categorías de las variables sexo, tipo de vacuna, dosis y grupo de edad arrojó resultados globales significativos (en hombres, mujeres, Comirnaty® y acenocumarol 1 g), pero en todos los casos con coeficientes W de Kendall de magnitud baja (<0,1). En cuanto a las pruebas de medias pareadas entre mediciones INR, ninguna arrojó un resultado significativo. Los resultados se resumen en la tabla 2.
Resultados de las pruebas estadísticas de medidas repetidas (Friedman, p y coeficiente W de Kendall) y de comparación de medias pareadas global (Wilcoxon, p) para las mediciones INR (International Normalized Ratio) de la población total y subpoblaciones por sexo, tipo de vacuna, dosis de acenocumarol y grupo de edad
| Variable | Global(p / W) | Post1 vs.Media | Post2 vs.Media | Post3 vs.Media | Post1 vs.Última | Post2 vs.Última | Post3 vs.Última |
|---|---|---|---|---|---|---|---|
| Total | 0,021/0,022 | 0,347 | 0,316 | 0,269 | 0,360 | 0,326 | 0,360 |
| Sexo | |||||||
| Hombre | 0,055/0,034 | 0,709 | 0,709 | 0,062 | 0,709 | 0,980 | 0,322 |
| Mujer | 0,022/0,051 | 0,414 | 0,067 | 0,936 | 0,815 | 0,100 | 0,936 |
| Vacuna | |||||||
| Vaxzevria® | 0,496/0,065 | 0,678 | 0,678 | 0,678 | 0,678 | 0,678 | 0,535 |
| Moderna® | 0,394/0,038 | 0,650 | 0,602 | 0,602 | 0,602 | 0,669 | 0,602 |
| Comirnaty® | 0,013/0,035 | 0,321 | 0,321 | 0,321 | 0,593 | 0,321 | 0,321 |
| Dosis | |||||||
| Sintrom® 0,5 g | 0,718/0,035 | 1,000 | 1,000 | 1,000 | 1,000 | 1,000 | 1,000 |
| Sintrom® 1 g | 0,018/0,029 | 0,532 | 0,348 | 0,283 | 0,532 | 0,403 | 0,360 |
| Sintrom® 4 g | 0,679/0,057 | 0,475 | 0,475 | 0,475 | 0,475 | 0,475 | 0,475 |
| Edad | |||||||
| <67 | 0,960/0,005 | 0,888 | 0,554 | 0,888 | 0,888 | 0,554 | 0,888 |
| 67-76 | 0,121/0,051 | 0,784 | 0,825 | 0,184 | 0,825 | 0,825 | 0,184 |
| 76-85 | 0,401/0,037 | 0,943 | 0,567 | 0,943 | 0,943 | 0,567 | 0,943 |
| >85 | 0,301/0,032 | 0,607 | 0,653 | 0,653 | 0,653 | 0,653 | 0,653 |
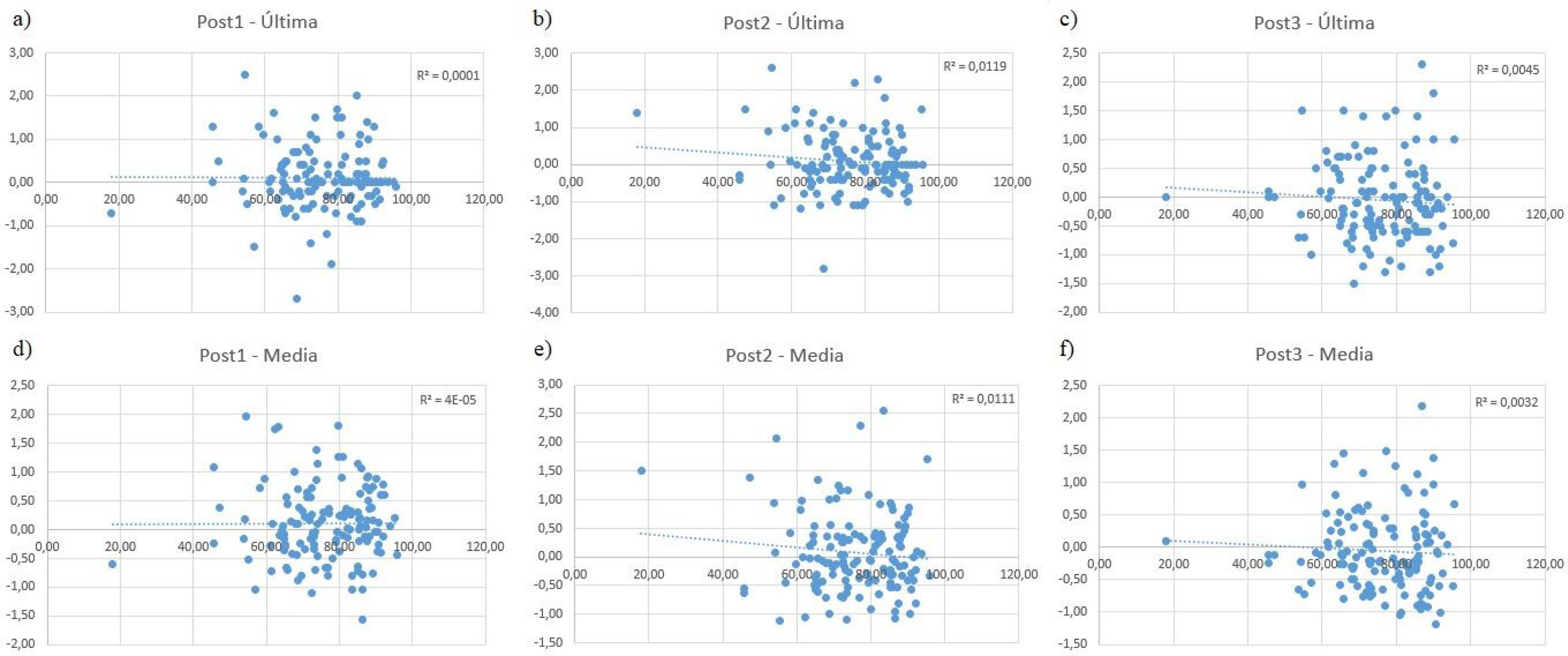
Finalmente, el análisis de correlación entre las diferencias entre mediciones INR y la edad (fig. 3) mostró que no existe ningún coeficiente de correlación significativamente distinto de 0 (p>0,05), y con los coeficientes R2 muy cercanos a 0 (todos inferiores a 0,1), indicando una muy baja bondad de ajuste.
DiscusiónEn los resultados del análisis descriptivo se muestra una gran similitud entre las distribuciones de las mediciones INR. Cabe mencionar que el IRN medio presenta una desviación menor al resto de medidas y unas cajas más estrechas en el diagrama caja-bigotes (tabla 1 y fig. 2). Esto se debe al hecho de que, al tratarse de un promedio de las 6 mediciones INR previas a la vacunación, su variabilidad se reduce. La mayor parte de los resultados no sugieren visualmente ninguna diferencia entre mediciones INR pre- y posvacunación. Además, observamos que todas las mediciones INR posvacunación se encuentran dentro del rango terapéutico esperado para pacientes tratados con Sintrom®. Este resultado es, sin duda, positivo para los pacientes, ya que implica que la vacunación ha provocado una alteración del INR a nivel grupal. Sin embargo, se aprecian ciertas mediciones posvacunación ligeramente más elevadas en ciertos grupos, como por ejemplo en las mujeres y en los pacientes con dosis de Sintrom® de 4 g.
El análisis estadístico de medias pareadas aporta más información sobre si las diferencias observadas eran estadísticamente significativas. Los resultados de los test aplicados, si bien muestran que se han encontrado diferencias estadísticamente significativas en el INR pre- y posvacunación de la muestra total, en las mujeres y en los vacunados con Comirnaty®, también indicaron que estas diferencias deben interpretarse con cautela. En primer lugar, debe tenerse en cuenta que se han aplicado test no paramétricos (Friedman y Wilcoxon) al no poder asumir normalidad en las mediciones, los cuales generalmente presentan una menor potencia estadística18. Asimismo, el coeficiente de concordancia W de Kendall mostró una magnitud baja, lo que sugiere que las diferencias observadas son débiles y poco significativas. Finalmente, las pruebas post hoc y las pruebas de medias pareadas no mostraron diferencias estadísticamente significativas. Asimismo, los tamaños muestrales son relativamente pequeños en comparación con otros estudios. Por todo ello, nos inclinamos más por sostener que las diferencias se deben a variaciones aleatorias de los pacientes en lugar de a un efecto de la vacunación en la población de estudio, de acuerdo con otros estudios realizados19. Finalmente, un aspecto importante a destacar es que los resultados del análisis de correlación entre las diferencias de las mediciones de INR y la edad mostraron que no había ninguna correlación significativa entre estas variables (la fig. 3 no muestra tendencias lineales claras). Esto nos indica que la edad no parece ser un factor que afecte a las diferencias observadas en las mediciones de INR pre- y posvacunación.
Estos resultados son muy positivos y pueden proporcionar tranquilidad en términos de la seguridad de la vacuna en relación con la alteración del INR de los pacientes. En general, los resultados de este estudio sugieren que la vacunación y la dosis de medicamentos anticoagulantes pueden tener un impacto mínimo en las mediciones de INR en la población estudiada. Es importante destacar que el no haber observado diferencias globales no implica que pacientes concretos hayan podido tener efectos no deseados a causa de la vacunación. Sin embargo, este estudio refleja que, si la vacunación hubiese tenido algún efecto, este no se habría observado a nivel poblacional, sino de forma secundaria. Para los casos particulares, se requeriría de otro tipo de pruebas clínicas (análisis sanguíneos, hemodinámicos, etc.) que aportaran más información sobre los pacientes afectados. Sin embargo, se debe tener en cuenta que este estudio presenta algunas limitaciones, como el reducido tamaño muestral, el desbalanceo en ciertos grupos. Por lo tanto, realizar estudios adicionales con muestras más grandes es fundamental para reforzar estos resultados y comprender mejor los posibles efectos de la vacunación en la alteración de la coagulación sanguínea.
ConclusionesEn este estudio se analizaron las mediciones de INR antes y después de la vacunación en una población de pacientes con problemas de coagulación sanguínea tratados con acenocumarol (Sintrom®). Si bien se encontraron algunas diferencias en las mediciones de INR en ciertos subgrupos, estas diferencias no fueron estadísticamente significativas. Estos resultados apoyan la seguridad de la vacunación en relación con las mediciones de INR y proporcionan una base para futuras investigaciones en este campo.
Responsabilidades éticasLos investigadores declaran que los procedimientos del estudio, detallados en el presente protocolo, son conformes con lo establecido en la versión vigente de la Declaración de Helsinki. El tratamiento de los datos de carácter personal está sujeto al Reglamento (UE) 2016/679 del Parlamento Europeo y del Consejo, de 27 de abril de 2016 (RGPD) y la normativa española (LOPD), Ley Orgánica 15/1999, de 13 de diciembre, y el reglamento que la desarrolla, así como futura normativa española que sustituya o complemente esta legislación. El presente estudio fue aprobado por el Comité de Ética de Ensayos Clínicos con medicamentos (CEIm) del Hospital Universitario General de Castellón, constando en acta 11/2021.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.