El antígeno prostático específico y el tacto rectal son herramientas diagnósticas que en la actualidad se quedan cortas al momento de diferenciar entre procesos malignos como el cáncer prostático y procesos benignos como la hiperplasia prostática.
Nuevos biomarcadores con altas sensibilidades en el diagnóstico de procesos malignos prostáticos han entrado a desempeñar un papel significativo en la determinación temprana de cáncer de próstata (CP).
El gen de cáncer de próstata 3 está implicado en la supervivencia de la célula cancerígena; puede identificarse en orina y permite diferenciar entre cáncer y prostatitis crónica/hiperplasia prostática. Por otro lado, la b2-microglobulina es una proteína que forma complejos con el complejo mayor de histocompatibilidad tipo I de la célula cancerígena prostática, y gracias a esta interacción hace parte de procesos moleculares que terminan generando metástasis ósea; sus niveles séricos pueden ser determinados por medio de exámenes de laboratorio, y de esta forma se puede hacer una diferenciación entre procesos benignos y cáncer. Las calicreínas (test 4K score), las mucinas (MUC1), la proteína LRPPRC, el ADN circulante del tumor, la alfa metilacil coenzima a racemasa y las células madre prostáticas son moléculas prometedoras, tanto en el diagnóstico temprano del CP como en el pronóstico y respuesta al tratamiento.
La importancia del hallazgo de nuevos biomarcadores con especificidades y sensibilidades altas para el diagnóstico precoz del CP no solo podrá reducir la mortalidad por esta enfermedad, sino también propiciará nuevos campos de investigación en busca de dianas terapéuticas más efectivas en el tratamiento del mismo.
Prostate specific antigen and digital rectal examination are diagnostic tools that currently fall short when differentiating between malignant processes, such as prostate cancer and benign prostatic hyperplasia. New biomarkers with high sensitivity in the diagnosis of prostate malignancies have come to play a significant role in the early identification of prostate cancer (PC). Prostate cancer gene 3 is involved in cancer cell survival. It can be identified in urine and used to differentiate between cancer and chronic prostatitis/. Furthermore, b2-microglobulin is a protein that complexes with major histocompatibility complex type 1 prostate cancer cell, and through this interaction is part of the molecular processes that end up generating bone metastases. Serum levels can be determined by laboratory tests and as such can be used to differentiate between benign processes and cancer. Kallikreins (4K score test), mucins, the leucine rich pentatricopeptide repeat containing protein, circulating tumour DNA, the alpha methyl acyl coenzyme A racemase, and Stem Cells are promising molecules, both for the early diagnosis of PC, as well as for the prognosis and response to treatment. The importance of the discovery of new biomarkers with high sensitivity and specificity for early diagnosis of PC not only can reduce mortality from this disease, but will also foster new fields of research for more effective treatment in the same therapeutic targets.
En la actualidad, el antígeno prostático específico en conjunto con el tacto rectal constituyen los métodos de tamización principalmente usados en la clínica para detectar el cáncer de próstata, sin embargo, estos tienen bajo rendimiento diagnóstico, tanto individualmente como en conjunto.
La importancia de encontrar nuevos biomarcadores, que sean más sensibles y específicos para tamización y diagnóstico temprano del cáncer de próstata, se ha visto especialmente reforzada por la falencia del PSA. El hecho que este último se eleve en una condición benigna como la hiperplasia prostática y también en condiciones de malignidad1, ha generado que se soliciten biopsias costosas e innecesarias a pacientes que no lo requerían desde un comienzo1. Como consecuencia de esto, se han explorado otras técnicas y moléculas para hacer un diagnóstico más específico, tales como el PCA3, la microglobulina y las mucinas, entre otros.
El objetivo del presente trabajo fue describir algunos de los nuevos biomarcadores involucrados en la tamización y el diagnóstico temprano del cáncer de próstata.
EpidemiologíaEl cáncer de próstata (CP) es el segundo tipo de cáncer más común en la población masculina del mundo2. Se estima que uno de cada 7 hombres será diagnosticado a lo largo de su vida con CP, y uno de cada 38 hombres morirá como consecuencia de este. De igual manera, en Estados Unidos 6 de cada 10 hombres diagnosticados con cáncer de próstata son mayores de 65 años3. Es el tipo de cáncer que con mayor frecuencia se diagnostica como consecuencia de la introducción en 1980 del test de antígeno prostático específico (PSA) como herramienta diagnóstica3. Se estima que para el año 2030 haya 1,7 millones de casos nuevos de CP en el mundo, con una mortalidad esperada de 499.000 casos (29,3%)4.
Durante la última década se ha observado una notable disminución en la mortalidad por CP en países desarrollados. El estudio GLOBOCAN 2012 notifica que la incidencia del CP es variable en el contexto mundial: las tasas son más altas en países como Australia/Nueva Zelanda, América del Norte (ASR -—por sus siglas en inglés— 111,6 y 97,2 por 100.000 respectivamente) y en Europa Occidental y del Norte, debido a que la tamización con PSA y posterior biopsia se realizan de forma rutinaria5. En países de América del Norte (Estados Unidos y Canadá) la mortalidad por CP ha disminuido a 4,3% y 3,1% respectivamente, y en países como Dinamarca, Noruega y Suecia (Europa del Norte) las tasas de mortalidad han venido en descenso desde el año 2000 hasta 3,1% por año6; sin embargo, en países en vías de desarrollo la mortalidad por este se ha visto en aumento (aunque hay tendencias hacia el incremento en el diagnóstico, la mortalidad ha aumentado en países como Colombia —3,4% por año—, Costa Rica —3,4% por año—, Chile —2,8% por año— y Cuba —5,5% por año—)4,6. Con respecto al contexto mundial, Colombia cuenta con una de las incidencias de CP más bajas de Latinoamérica, y una proporción de 28% entre incidencia y mortalidad por el mismo, muy cercano al promedio mundial de 28,6% e inferior a países como Ecuador (40,41%), Perú (37,74%) y Cuba (46,65%)6.
Finalmente, en Colombia la tasa de mortalidad por CP ha disminuido en los últimos 4 años4 y el mayor número de casos reportados se origina en ciudades como Bogotá, Valle y Antioquia (las regiones más pobladas y con mayor cantidad de urólogos)4.
Biomarcadores en el diagnóstico del cáncer de próstata¿Qué teníamos?Antígeno prostático específicoLos antecedentes de uso del PSA (prostatic specific antigen) datan de la década de 1980, cuando era utilizado en el seguimiento de pacientes diagnosticados con CP7, posteriormente, para el año 1994 la Food and Drug Administration de Estados Unidos aprobó el uso del PSA junto con el tacto rectal como métodos de tamización para CP8.
El PSA, también llamado calicreína iii, es una glucoproteína de 34KDA producida casi exclusivamente por las células epiteliales de la glándula prostática, la cual circula unida a alfa-1-antiquimiotripsina y la alfa-2-macroglobulina, y su deber es la de dividir la semenogelina i y ii en polipéptidos de menor tamaño, evitando así formación del coágulo seminal8–12. En condiciones normales una pequeña cantidad, menos de 4ng/ml, es liberada al torrente sanguíneo, pero en un proceso neoplásico estos niveles se elevan8. Por tal motivo se considera realizar biopsia de próstata a aquellos hombres con un nivel de PSA sérico mayor a 4ng/ml8. Sin embargo, el PSA también se ha encontrado elevado en otras enfermedades como cáncer de mama, carcinoma de células renales, cáncer de ovario y neoplasia suprarrenal13. De igual forma, en hiperplasia prostática benigna (HPB), prostatitis, cistitis, traumatismo perineal y cirugía del tracto urinario reciente podría encontrarse elevada8,14.
El PSA puede transitar en el suero libremente (fPSA) o acompañado de inhibidores de proteasa (cPSA) con el fin de evitar proteólisis. Al sumar el fPSA y PSA acompañado de inhibidores de la proteasa se obtiene como resultado el PSA sérico total (tPSA), gran parte de este, alrededor del 70-90% puede estar ligado a alfa-1-antiquimiotripsina, en menor proporción a la alfa-2-macroglobulina, alfa-1 antitripsina o a un inhibidor de la proteína C12. Consecuentemente, cerca de un 10-30% del PSA total (tPSA) circula libremente (fPSA), esta forma libre del PSA se caracteriza por asumir 3 formas moleculares específicas15. Una de ellas se encuentra predominantemente en la zona de transición de la próstata en pacientes con HPB y se denomina BPSA16, la segunda representación se llama PSA intacto (iPSA) y por último se tiene el proPSA, hallado en su mayoría en la zona periférica de la glándula prostática, el cual se asocia a CP17.
Según la American Cancer Society, la sensibilidad del PSA para valores de referencia de 4ng/ml y 3ng/ml para el diagnóstico de cáncer es del 21% y 32% respectivamente. Una especificidad de 91% para valores de corte de 4ng/ml y de 85% para valores de 3ng/ml de PSA18.
En EE. UU. se llevó a cabo el estudio (PLCO) para evaluar la incidencia de cáncer de ovario, colorrectal, pulmonar y de próstata. En el caso de CP se evaluaron hombres entre los 55-74 años, a quienes se le realizó tamización anual con PSA durante 13 años, y como resultado se obtuvo que realizar tamización con PSA no lleva a disminución de la incidencia de CP (RR: 1,09, IC 95%: 0,87-1,36)19. Otro gran estudio fue el The European Randomized Study of Screening for Prostate Cancer (ERSPC), donde se realizó tamización con PSA durante 11 años a hombres de ciertos países europeos, evaluando la mortalidad por CP; los resultados indicaron una reducción relativa en las tasas de mortalidad de un 21% (RR: 0,79, IC 95%: 0,68 a 0,91)20.
Un metaanálisis de Cochrane realizado en 2011 resumió los resultados de 5 experimentos poblacionales, con un total de 341.351 participantes, y mostró que realizar tamización con PSA es efectivo para la detección de cáncer de próstata (RR: 1,35: IC 95%: 1,06-1,72), sin embargo esta prueba no disminuyó la mortalidad (RR: 0,95; IC 95%: 0,85-1,07)21. Otro metaanálisis del año 2010 obtuvo resultados similares; tenía como objetivo mostrar evidencia de los beneficios de la tamización con el PSA, para lo cual se tomaron resultados de 6 experimentos con un total de 387.286 participantes. Los resultados mostraron que la tamización con PSA se relaciona con una probabilidad aumentada de diagnosticar cáncer de próstata (RR: 1,46, IC 95%: 1,21-1,77), pero al igual que en el estudio anterior no se observa disminución en la mortalidad por CP (RR: 0,88, IC 95%: 0,71-1,09)22, de manera tal que en la actualidad no se recomienda realizar tamización poblacional de CP.
Lo anterior nos sugiere la importancia de determinar otros biomarcadores más específicos, que lleven a una disminución de biopsias innecesarias, al igual que a una detección precoz del CP, y así mejorar la supervivencia de los pacientes.
¿Qué hay más reciente?Gen de cáncer de próstata 3El Long non-coding RNA prostate cancer associated 3 gene test (PCA3) se ha visto implicado en un número importante de investigaciones que reflejan el fundamento para el estudio del CP23. Este se encuentra implicado en la supervivencia de la célula cancerígena; este efecto lo logra en parte modulando la señalización al receptor de andrógenos y ejerce su función principal en el núcleo y en la fracción microsómica de la célula24.
Tomar este test requiere que el proceso se divida en 2 grandes partes; primero debe realizarse un masaje prostático y luego se obtiene la muestra de orina, esto facilitará la aparición del biomarcador en la orina24.
Los estudios han mostrado resultados promisorios, pero controvertidos a la vez por distintas causas. Son promisorios porque se ha encontrado que la medición de este biomarcador puede diferenciar entre cáncer y prostatitis crónica/HPB1. En parte el motivo para que esto sea posible se relaciona con la alta expresión de la molécula en tejido cancerígeno de 60 a 100 veces más que en tejido inflamado, pero sin neoplasia, y cabe resaltar también que esto se observó en el 95% de los pacientes23. Christos et al.1 mencionan que este biomarcador es útil para diferenciar entre HBP del cáncer localizado, sin embargo, sugieren que el uso de la molécula para tamización no debe ser única, sino más bien debería ser un panel de nuevos biomarcadores que provean mayor precisión diagnóstica23. Se menciona además el uso de la beta 2 microglobulina (B2M) y mucina intestinal (MUC3) asociados al PCA31. Se conoció en este estudio que los valores tenidos en cuenta para decir si es relevante el aumento de PCA3 son: 195 DU (con este valor de referencia se mejora la precisión diagnóstica hasta en un 77%)1.
Si bien las ventajas del uso de PCA3 para el diagnóstico de CP han sido dilucidadas y se ha apoyado la idea de usarlo en programas terapéuticos como un apoyo23, hay una contraparte que discute la validez clínica de los hallazgos encontrados en los diferentes estudios. Esta controversia se basa en el hecho de que existan pocos estudios que provean un mayor conocimiento del biomarcador, y a los que existen actualmente se les critica que hayan usado muestras poblacionales pequeñas que hacen menos fidedigno el resultado final. Se necesitan más estudios que incluyan una proporción mayor de pacientes y a los cuales se les haga un seguimiento en el tiempo más prolongado23. Producto de lo mencionado anteriormente se ha encontrado que hay un fallo para demostrar que las asociaciones entre PCA3 y cáncer de próstata tienen alguna relevancia en el pronóstico del paciente24. De acuerdo a este estudio, usando de esta manera los biomarcadores, se incrementa el valor predictivo de la prueba y es posible diferenciar entre condiciones inflamatorias benignas de aquellas que requieren un seguimiento especial, como lo sería la neoplasia24.
β2-microglobulinaLa β2-microglobulina (B2M) es un polipéptido de bajo peso molecular (11.815D), sintetizado por células nucleadas y que forma complejos con el complejo mayor de histocompatibilidadI25 (por lo cual se asume que desempeña un rol en la respuesta inmune). Fue identificado inicialmente en la orina de pacientes con enfermedad tubular renal26 y posteriormente en pacientes con cáncer de mama27 y cáncer gástrico28.
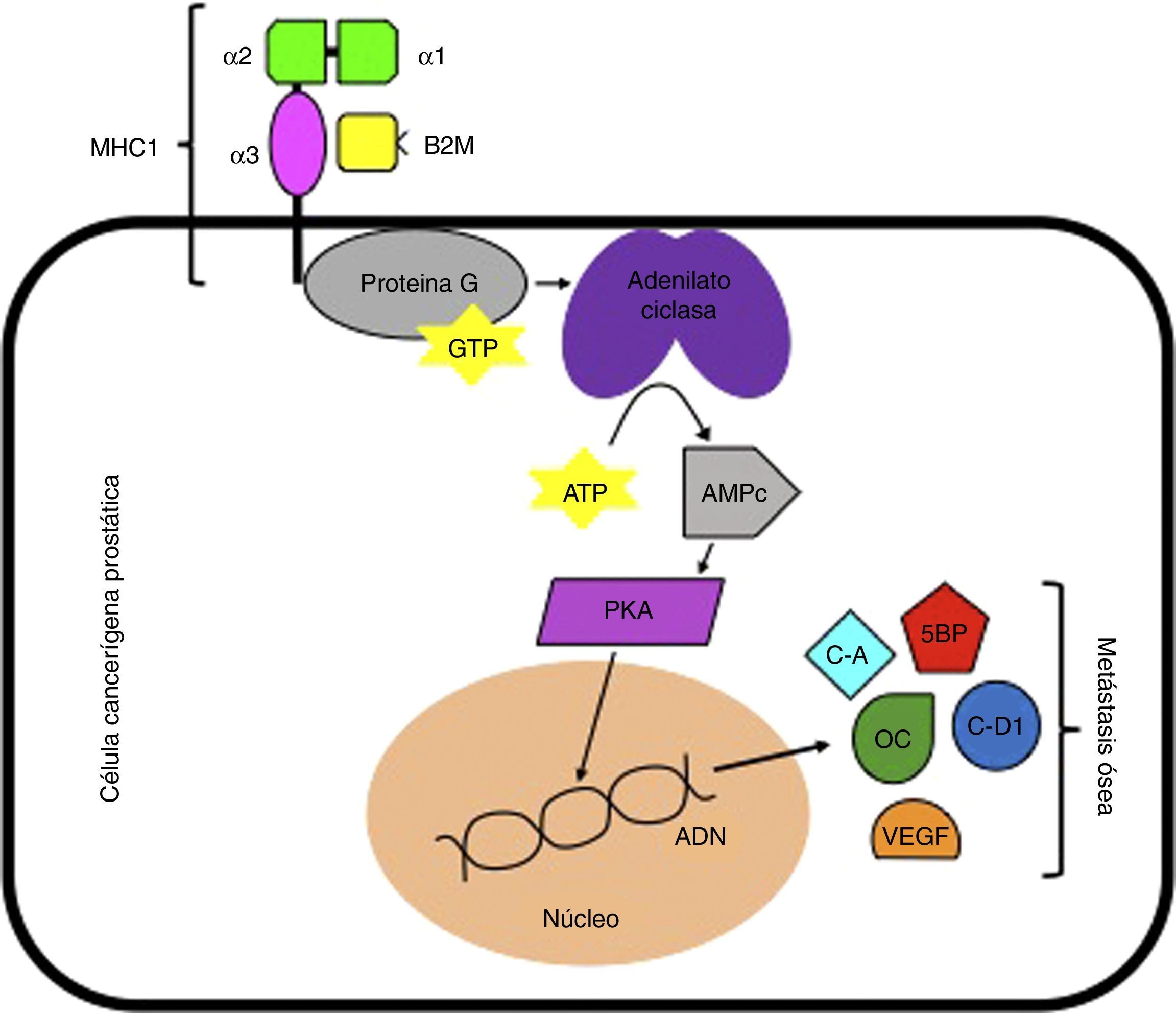
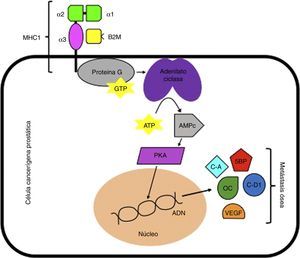
Se ha reportado que la B2M estimula el crecimiento e incrementa la expresión de genes que codifican para la osteocalcina y la sialoproteína ósea en las células cancerígenas del CP mediante la activación de la cascada enzimática de la proteín quinasa A dependiente de AMP cíclico. De este modo, cuando hay una sobreexpresión de B2M en células cancerígenas prostáticas, se genera un aumento en la codificación de genes que en última instancia serán los responsables de generar metástasis, tales como la osteocalcina, sialoproteína ósea, ciclina A, ciclina D1 y factor de crecimiento endotelial vascular. Estas vías génicas sugieren que la señalización mediada por B2M podría ser un target terapéutico para el tratamiento de CP con metástasis ósea (fig. 1)29–31. Igualmente, otra vía molecular en la que se ha visto involucrada la B2M es en la interacción con la homeostasis del hierro. Cuando la B2M interactúa con la proteína hemocromatosis (HFE) (que actúa como su receptor), se produce una modulación en la homeostasis del hierro y una posterior transdiferenciación epitelio-mesenquimal (EMT), que termina promoviendo el crecimiento, la invasión y la metástasis hacia huesos y tejidos blandos (fig. 2)32.
Señalización mediada por B2M. ADN: ácido desoxirribonucléico; AMPc: adenosín monofosfato c; ATP: adenosín trifosfato; B2M: beta 2 microglobulina; C-A: ciclina A; C-D1: ciclina D1; GTP: guanosín trifosfato; MHC I: complejo mayor de histocompatibilidad 1; OC: osteocalcina; PKA: proteína quinasa A; SBP: sialoproteína ósea; VEGF: factor de crecimiento endotelial vascular.
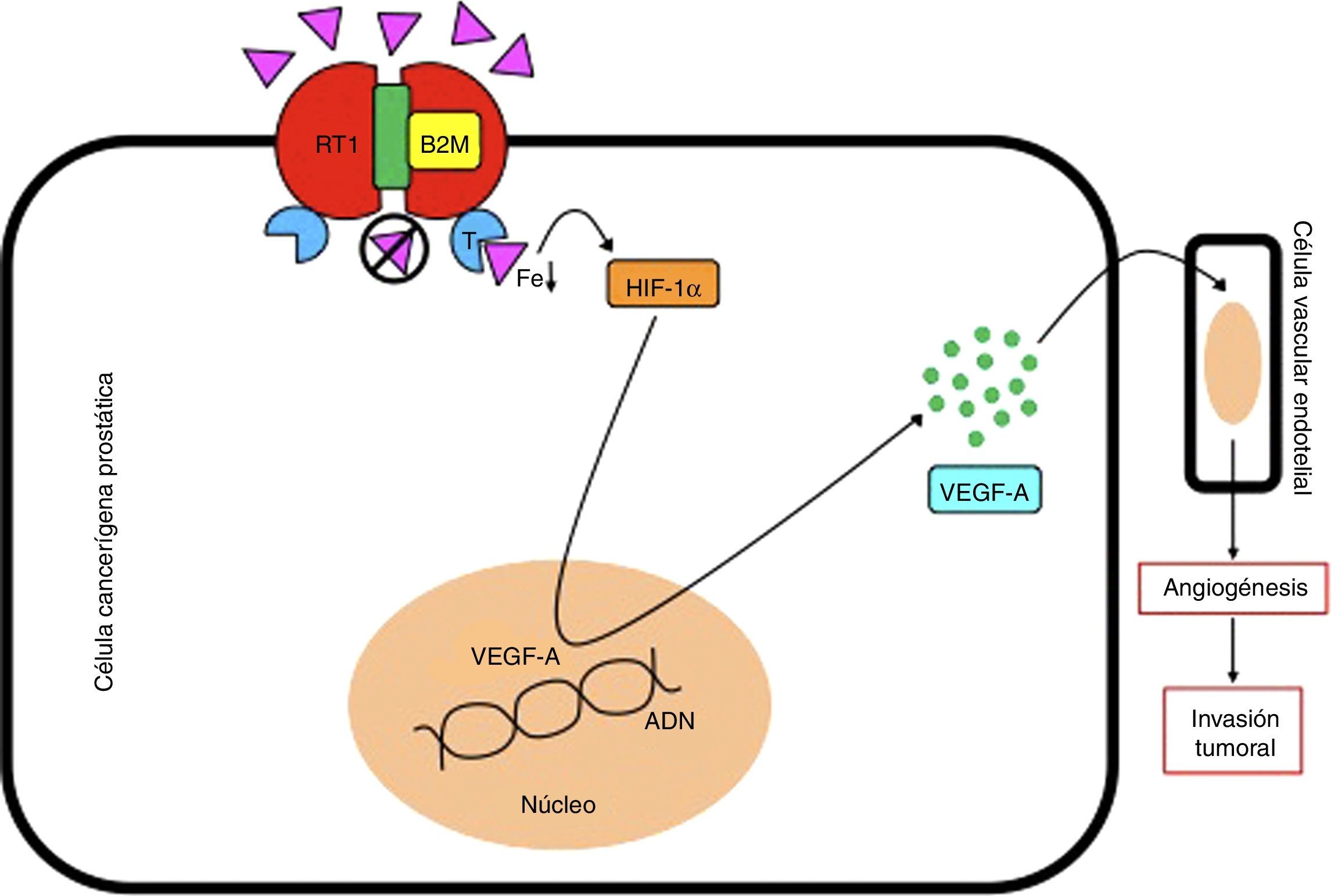
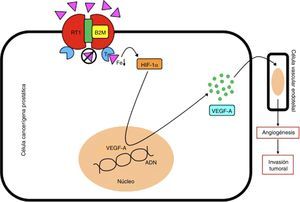
La beta 2 microglobulina (B2M) regula directamente los niveles de hierro (Fe) celular al formar complejos con la proteína hemocromatosis (HFE), que bloquean el receptor de transferrina 1 (RT1) y previenen la entrada de hierro a la célula, y como consecuencia una disminución de su concentración intracelular. Este fenómeno promueve la expresión del factor inductor de hipoxia 1α (HIF-1α), que actuará sobre el núcleo celular para generar la síntesis del factor de crecimiento vascular endotelial A (VEGF-A), que inducirá el proceso de angiogénesis en las células vasculares endoteliales, y como consecuencia un crecimiento, invasión y metástasis tumoral.
ADN: ácido desoxirribonucléico; T: transferrina.
En estudios realizados por Zhang et al. se demostró que el marcador B2M sérico podría ser usado como un marcador diagnóstico de CP y útil en la diferenciación entre procesos malignos e HPB al encontrar que los niveles en suero de B2M se notaban significativamente elevados en pacientes con CA de próstata, a diferencia de los niveles del mismo marcador en pacientes con HPB o de los pacientes del grupo control. Sin embargo, no se encontró una diferencia marcada entre los niveles del B2M entre los pacientes con HPB y los del grupo control.
Así mismo, pacientes con niveles de PSA mayores (≥20mg/ml) tienen niveles de B2M mayores y viceversa33. Por lo tanto, los niveles de B2M se asocian con mayor agresividad clínica33.
La B2M puede, por lo tanto, ser un biomarcador eficiente para el diagnóstico clínico, seguimiento y pronóstico del CP y a su vez un blanco terapéutico posiblemente eficaz para revertir la EMT y, de esta manera, evitar la progresión metastásica34.
Examen 4K (panel 4-calicreínas séricas)El 4K score test (por su descripción en inglés), como su nombre indica, combina los valores plasmáticos de 4 calicreínas usadas como marcadores prostáticos: PSA total (tPSA), PSA libre (fPSA), PSA intacto (iPSA) y la calicreína-2 (hK2)35. En su mayoría el PSA en plasma se encuentra unido a inhibidores de proteasas y una pequeña cantidad se encuentra libremente (fPSA), este PSA libre asume 3 formas moleculares: iPSA, pro-PSA y BPSA. Un menor valor de fPSA en proporción con tPSA se relaciona más con CP, mientras que un mayor valor se asocia con enfermedad benigna. La calicreína-2 se ha encontrado aumentada en pacientes con CP de alto grado. Adicionalmente, en el 4K test se toman datos como la edad de la persona, hallazgos al tacto rectal (nódulos) y antecedente de biopsia previa35.
En diferentes estudios: Gothenburg ERSPC36, ProtecT37, Rotterdam ERSPC38, Braun et al.39 y Parekh et al.40, entre otros, se ha concluido que el uso del 4K test reduce prácticamente a la mitad la práctica de biopsias en aquellos pacientes con PSA en zona gris (4-10ng/ml), ya que permite identificar a aquellos individuos susceptibles a desarrollar cáncer clínicamente relevante de aquellos con enfermedad no maligna.
En conclusión, el panel 4K permite individualizar la predicción de CP aun si previamente no se le ha realizado al paciente la prueba de tamización o una biopsia. Este panel disminuye alrededor de 41-71% de biopsias practicadas innecesariamente35. Sin embargo, existen limitaciones en cuanto a la disponibilidad del panel en el escenario clínico cotidiano. Actualmente solo se encuentra disponible en los Estados Unidos y el costo para los pacientes oscila alrededor de 1.185dólares americanos35.
MucinasLas mucinas son proteínas glucosiladas de elevado peso molecular, presentes en la mayoría de tejidos epiteliales, incluidos el tracto urinario y el aparato reproductor41.
En la actualidad se conocen un total de 21 genes codificantes de mucinas, estos han sido divididos en 2 grupos: MUC1, MUC3 y MUC4 codificantes para mucinas de membrana, siendo estas necesarias en la interacción célula-célula, mientras que los genes MUC2, MUC5AC, MUC5B y MUC6 codifican para mucinas secretoras de moco42.
La función de las mucinas en general es la de proteger e hidratar el epitelio. Sin embargo, en procesos neoplásicos se ha visto afectada su función43.
MUC1ha sido la más estudiada en el desarrollo de diferentes cánceres, entre ellos CP, donde se ha visto implicada en la angiogénesis, proliferación y transducción de señales tumorales, así como también en la invasión y metástasis del tumor43, ya que aminora la respuesta inmune y promueve la propagación tumoral a otros tejidos, al perderse las interacciones célula-célula y célula-matriz extracelular41.
En tejido prostático maligno, mediante microarreglos tisulares, se ha reportado una sobreproducción de MUC1, junto con una distribución aberrante y alteraciones en la glucosilación de esta mucina41,43. Adicionalmente, en estudios realizados por Cozzi et al., se demostró la sobreexpresión de MUC1 en el 58% de las muestras de tejido prostático neoplásico y en el 90% de los nodos linfáticos metastásicos, mientras que en tejido libre de cáncer no se evidenció lo anteriormente mencionado42.
Otros biomarcadoresRecientemente ha habido un interés sobre proteínas involucradas con la autofagia mitocondrial, pues estas pueden estar asociadas a carcinogénesis44. Dichas proteínas pueden ser vistas como nuevos biomarcadores diagnósticos y pronósticos en el cáncer de próstata. Sin embargo, no son los únicos biomarcadores nuevos sobre los cuales se ha centrado la atención, pues se ha visto que al realizar un perfilamiento genético del cáncer, y también al observar la presencia de células madre en el tejido neoplásico, se pueden obtener nuevos marcadores de la enfermedad. A continuación se mencionan 4 de ellos:
Leucine-rich pentatricopeptide repeat motif-containing proteinLa proteína leucine-rich pentatricopeptide repeat motif-containing (LRPPRC) estabiliza el oncogén BCL-2 y bloquea la autofagia, alterando así los mecanismos reguladores de muerte celular44. En la comparación de la inmunohistoquímica de la expresión de LRPPRC que realizan Mancini et al. entre tejido neoplásico y HBP se encuentra que esta proteína efectivamente se expresó más en el tejido con cáncer44. Este hallazgo confirma que la LRPPRC puede ser vista como un nuevo biomarcador diagnóstico y la mitocondria como un objetivo terapéutico44.
Perfilamiento genético del cáncer de próstata: ADN circulante del tumorEl análisis de fragmentos de ADN circulante del tumor supone la posibilidad de poder encontrar dichos pedazos de ADN libres en fluidos corporales y en el plasma de los pacientes con tumores sólidos44. La ventaja de estas secuencias es que contienen la información genética completa del tumo,; lo que permitiría analizarlo para determinar el pronóstico y la respuesta al tratamiento44. Además de los beneficios mencionados anteriormente, el ctDNA permite realizar análisis no invasivo, pues no sería necesario obtener una biopsia como tal44. Finalmente, el ctDNA permite identificar mutaciones de novo, lo que en último término impacta el curso del tratamiento.
Células madreEstudios recientes han demostrado la presencia de células madre en la próstata y su posible rol en la progresión de la enfermedad y la respuesta al tratamiento44. Lo que se ha observado es que a partir de estas células de originan algunas neoplasias, y su presencia podría constituir un factor predictor pronóstico44. Algunos biomarcadores asociados a células madre podrían en un futuro ser usados como ayuda en el enfoque a la terapia personalizada del CP44.
Alfa metilacil coenzima A racemasaLa alfa metilacil CoA racemasa, o también llamada P504S, es una enzima peroxisomal y mitocondrial necesaria para la producción de ácidos biliares y la beta-oxidación de los ácidos grasos de cadena ramificada45. En cáncer de próstata es usada como marcador molecular, puesto que mediante microarreglos de ADN se ha detectado una expresión elevada de alfa metilacil CoA racemasa en el tejido prostático afectado, comparado con tejido prostático benigno46,47.
Como se puede notar, existen diferentes biomarcadores que en la actualidad se encuentran en investigación para determinar su rendimiento diagnóstico en pacientes con CP. Cabe anotar que los descritos no son todos los biomarcadores en desarrollo en la actualidad, y aún es muy temprano para tomar estas herramientas, pues faltan estudios con mayor tamaño de muestra, validez y confiabilidad, que nos permitan trabajar con certeza sobre nuestra población masculina, sin embargo es claro que el presente y futuro debe estar enfocado en la investigación de éste tipo de biomarcadores en cáncer de próstata, así como en otros tipos de tumores.
Conflicto de interesesNo existe conflicto de intereses.