El trasplante renal se practica desde hace más de cuatro décadas en Colombia y actualmente se posiciona como la mejor opción terapéutica para personas con enfermedad renal crónica en fase terminal. A su vez, el trasplante renal con injerto de donante vivo presenta múltiples ventajas clínicas e inmunológicas que condicionan mejores resultados funcionales y de sobrevida a largo plazo respecto a los trasplantes renales con injerto de donante cadavérico. El objetivo de esta revisión es dilucidar a la luz de las investigaciones médicas recientes el roll del trasplante renal con injerto de donante vivo como opción terapéutica para pacientes con enfermedad renal crónica terminal, exponer los resultados clínicos obtenidos en donantes de riñón a largo plazo, y abrir una breve discusión respecto a las técnicas abierta vs laparoscópica para nefrectomía en el donante. Se realizó una revisión de la literatura en las bases de datos Embase y Medline incluyendo los términos MesH: “Kidney Failure, Chronic”, “Kidney Transplantation”, “Living Donors”, “Nephrectomy”; algunas publicaciones fueron incluidas dada su relevancia y significancia clínica.
© 2013 Sociedad Colombiana de Urología. Publicado por Elsevier España, S.L. Todos los derechos reservados.
Kidney transplantation is currently the best therapeutic option for patients with end stage renal disease, and has been performed for forty years in Colombia. Kidney transplantation from living donors has many advantages which lead to a better graft and long term outcomes for the patients than kidney transplantation from cadavers. This paper attempts to present the overall impact of the kidney transplantation from living donors, to describe the long term clinical outcomes that have been obtained from important series of living kidney donors. The reader will also be introduced to a general discussion related to the surgical nephrectomy techniques used on kidney donors, and on laparoscopic approach vs open surgery. Medline and Embase databases were searched. MesH terms were used as follows “Kidney Failure, Chronic”, “Kidney Transplantation”, “Living Donors”, “Nephrectomy”. Abstracts of retrieved citations were reviewed and prioritized by clinical relevance.
© 2013 Sociedad Colombiana de Urología. Published by Elsevier España, S.L. All rights reserved.
El trasplante renal (TxR) se ha constituido en las últimas décadas como la mejor opción terapéutica para personas que padecen enfermedad renal crónica en estado terminal (ERCT). El TxR mejora la calidad y expectativa de vida en los pacientes con ERCT, mejora el pronóstico clínico y tiene un gran impacto positivo dado por la reducción significativa en la morbi-mortalidad asociada a la enfermedad renal crónica y al uso de terapias de reemplazo de función renal (Diálisis peritoneal y hemodiálisis)1. Datos de investigaciones internacionales2 sugieren que los beneficios y bondades del TxR superan las expectativas clínicas y se involucran con la economía de los sistemas nacionales de salud, así entonces se considera actualmente que el TxR es la medida terapéutica con la mejor relación costo/beneficio y costo/efectivad para el tratamiento de la enfermedad renal crónica terminal y en comparación con las modalidades dialíticas resulta ser una opción de tratamiento que reduce de manera significativa el gasto económico en salud.
A pesar de los grandes beneficios obtenidos con el TxR, es este un procedimiento que en general tiene riesgos implícitos derivados del acto quirúrgico, de la terapia inmunosupresora utilizada en el receptor tras el trasplante de órgano, y de las complejas interacciones del sistema inmunológico que posee el ser humano.
Desde los inicios de las investigaciones en TxR a mediados de la década de 1930, ya se contaba con datos clínicos que sugerían la complejidad inherente a dicha modalidad terapéutica; Para ese entonces el Doctor Yu yu Voronoy, radicado en Ucrania, intentó dar tratamiento con un TxR a seis pacientes que presentaron insuficiencia renal aguda severa secundaria a una intoxicación exógena con mercurio, sin embargo, el conocimiento limitado para la época sobre el rol protagónico de la inmunobiología en el TxR, la ausencia de fármacos que permitieran la manipulación de la respuesta inmune natural contra el órgano trasplantado y el desconocimiento de la importancia clínica que tienen los tiempos de isquemia del injerto renal condicionaron un desenlace fatal en los seis casos3. Durante las décadas siguientes los investigadores utilizaron riñones con tiempos de isquemia cada vez menores y plantearon modelos hipotéticos sobre eventos inmunes relacionados con la pérdida del injerto renal, sin embargo, fue hasta 1954 cuando el Doctor Joseph Murray, en el Peter Bent Brigham Hospital en Boston, realizó el primer TxR exitoso en humanos4. El trasplante fue practicado entre los gemelos idénticos Richard (Receptor) y Ronald (Donante) Herrick. La primera serie de experiencias exitosas5,6 en TxR puso de manifiesto dos aspectos clínicos de vital importancia para obtener buenos resultados en trasplante, a saber: 1) la similitud genética entre el donante y el receptor determina en gran medida el éxito obtenido con el trasplante y 2) la reducción en los tiempos de isquemia del injerto renal es una medida coadyuvante para el éxito terapéutico en trasplante.
A partir de ese entonces, el TxR asumió un roll protagónico como opción terapéutica para personas con nefropatías que ponían en peligro su vida; El continuo mejoramiento de las técnicas quirúrgicas, la investigación dirigida a mejorar el entendimiento de los fenómenos inmunes relacionados con el trasplante y el desarrollo de medicamentos inmunosupresores7 (Azatioprina: 1962, Ciclosporina: 1978) constituyeron tres de los hechos más importantes que marcaron el buen camino del TxR.
En Colombia los doctores Enrique Carvajal y Fernando Gómez realizaron el primer TxR de donante cadavérico en 1963 en la ciudad de Bogotá, en el Hospital San Juan de Dios; años más tarde serían los doctores Jaime Borrero, Álvaro Velásquez y Gustavo Escobar quienes en 1973 realizarían en Medellín, en el Hospital Universitario San Vicente de Paul, el primer TxR de donante vivo en Colombia8. Actualmente nuestro país cuenta con más de veinte instituciones hospitalarias habilitadas para ofrecer el servicio de TxR9 y se estima que para 2012 el 13% (n: 89) del total del TxR realizados en el país utilizaron injertos renales provenientes de donantes vivos. Los avances clínico-quirúrgicos alcanzados en las últimas décadas han permitido que hoy en día el TxR sea un procedimiento de rutina que se practica en más de 80 países10 alrededor del mundo, con muy buenos resultados en sobrevida del receptor y del injerto11 (95%-90% en el primer año postrasplante y 80%-65% a los cinco años postrasplante) (fig. 1).
Trasplante renal con donante vivo: perspectiva del receptorDurante los últimos años la cantidad de personas que padecen enfermedad renal crónica alrededor del mundo ha aumentado sustancialmente12; Se estima que para el año 2007 en Estados Unidos cerca de 500.000 personas estaban recibiendo tratamiento para ERCT13. En Colombia para el año 2011, según cifras oficiales, existían 788.565 personas con enfermedad renal crónica, de las cuales 25.297 se encontraban en fase terminal14. A pesar del gran volumen de pacientes que en teoría se beneficiarían de un TxR en el país, en Colombia tan solo se realizaron 798 TxR durante el año 2011, de los cuales 71 fueron de donante vivo15. Este fenómeno deja en evidencia las limitaciones significativas para el acceso a un trasplante y la necesidad imperiosa que se tiene de promover, optimizar y perfeccionar el proceso de donación de vivo en nuestra nación.
El TxR de donante vivo no solo facilita el acceso de los pacientes con ERCT a la modalidad terapéutica que requieren para continuar viviendo sino que también supone ventajas biológicas respecto al TxR con injerto proveniente de donante cadavérico; entre las principales ventajas se encuentran16: 1) ausencia de las repercusiones hemodinámicas de la Muerte Encefálica sobre el injerto renal, 2) reducción significativa en los tiempos de isquemia fría del injerto renal, 3) mejor perfil de compatibilidad inmunológica HLA entre la pareja donante/receptor, 4) inicio de inmunosupresión en el receptor de forma anticipada, ya que se conoce la fecha y la hora del trasplante, 5) disminución de tiempo en lista de espera y 6) posibilidad de trasplante “preemptive”, es decir, acceso a un TxR evitando el paso por alguna modalidad dialítica (lo cual supone una reducción significativa en el riesgo cardiovascular del paciente que espera un trasplante). Los factores atrás mencionados determinan los mejores resultados obtenidos durante los últimos años con TxR de donante vivo comparados con los resultados obtenidos en TxR con injerto de donante cadavérico a nivel mundial. Estudios internacionales confirman mejores resultados con el TxR de donante vivo en virtud de una edad más temprana al momento de practicar el trasplante, mejor compatibilidad HLA y menor tiempo en lista de espera/diálisis17. Guirado et al.17 compararon en su estudio entre receptores de TxR de donante vivo vs donante cadavérico la supervivencia del paciente y del injerto luego del primer año y quinto año postrasplante; La sobrevida del receptor en el primer año postrasplante fue de 95% en receptores de injerto proveniente de donante cadavérico comparada con 100% en receptores de injerto proveniente de donante vivo, el análisis realizado a los cinco años postrasplante mostró una sobrevida de 89% para receptores de donante cadavérico vs 97% para receptores de donante vivo respectivamente. Respecto a la sobrevida del injerto, los datos obtenidos luego del primer y quinto año postrasplante respectivamente fueron: 88% para receptores de donante cadavérico vs 96% para receptores de donante vivo y 73% para receptores de donante cadavérico vs 81% para receptores de donante vivo.
Otros estudios evidencian mejores resultados a largo plazo con el TxR de donante vivo16 en comparación con los resultados obtenidos con el TxR de donante cadavérico; Se ha descrito una sobrevida a los 10 años postrasplante que oscila entre el 77-93% para receptores de donante vivo vs 64-80% para receptores de donante cadavérico. De forma similar los resultados funcionales favorecen el trasplante de donante vivo, así la supervivencia calculada del injerto renal proveniente de dónate vivo a los 10 años postrasplante oscila entre 55-58% vs 45-49% para injertos renales provenientes de donante cadavérico.
Se puede afirmar entonces a la luz de la información actual que el TxR de donante vivo ofrece mejores resultados clínicos y funcionales en comparación con el TxR de donante cadavérico.
Trasplante renal con donante vivo: perspectiva del donanteLa donación en vida de un riñón es una decisión que debe estar libre de cualquier tipo de presión (económica, familiar, emocional, etc.) o forma de coerción18, un acto enmarcado en el desapego de lo propio como manifestación de amor por un ser querido; en otros casos es este un acto altruista que solo busca hacer el bien a otros seres humanos. Por lo anterior, el TxR de donante vivo ofrece a los equipos médico-quirúrgicos de trasplante un reto adicional a los que usualmente se ven enfrentados en casos con injertos de donante cadavérico, ya que a diferencia de esta última modalidad, en el trasplante de donante vivo además de buscar el éxito clínico y quirúrgico en el receptor, se deben minimizar al máximo los riesgos para el donante10, quien en todos los casos es una persona sana.
Una de las principales limitantes para la introducción y optimización de programas con donante vivo en países en vías de desarrollo es la falta de conocimiento al respecto de la donación de vivo existente en la población general y la percepción social de un detrimento significativo en el grado de salud del donante, secundario al proceso de donación. Al respecto se debe dejar en claro que la adecuada selección y una rigurosa evaluación médica preoperatoria en el donante constituyen las principales medidas de seguridad perioperatorias19, mientras que un estricto y continuo seguimiento clínico post-donación es la principal herramienta para evitar desenlaces negativos a largo plazo en la salud del donante20.
El ejemplo con mayor connotación clínica de los buenos resultados obtenidos a largo plazo tras la donación en vida de un riñón con el que cuenta la historia de la Medicina es el caso de Ronald Herrick, quien en 1954 a los 23 años de edad donó uno de sus riñones para su hermano Richard Herrick; luego del procedimiento de donación, Ronald Herrick vivió sin inconvenientes durante 56 años más, finalmente Ronald, “el pionero de la donación en vida”, murió el 27 de diciembre de 2010 a sus 79 años de edad21.
Datos actuales revelan una mortalidad perioperatoria que oscila entre 0,01-0,03%22, lo cual permite inferir que en manos expertas la nefrectomía para donación renal es un procedimiento seguro; recientemente se ha descrito que la tasa de rehospitalización a los tres años del procedimiento quirúrgico resulta ser menor para la nefrectomía con fines de trasplante en donante vivo (1,43/10.000 pacientes año) comparada con la nefrectomía para tratamiento de cáncer renal (15,15/10.000 pacientes año), con la apendicectomía (3,00/10.000 pacientes año)y con la colecistectomía (8,41/10.000 pacientes año)23. Algunos autores sugieren que el riesgo de desarrollar enfermedad renal crónica luego de la donación de un riñón es similar al riesgo que tiene una persona de desarrollar dicha enfermedad en la población general (0,04%)24,25. La incidencia de enfermedad renal crónica estimada en donantes de riñón fue de 180 por millón de habitantes por año, cifra equiparable a la incidencia de enfermedad renal crónica en la población general de USA: 268 por millón de habitantes por año26. Ibrahim et al encontraron en el 85,5% de donantes evaluados una tasa de filtración glomerular mayor a 60 ml/min/1,73 m2, ninguno de los donantes evaluados tuvo una tasa de filtración glomerular menor a 30 ml/min/1,73 m2 y dentro del grupo de donantes se obtuvo en forma global mejores resultados en la evaluación de la calidad de vida. Otro estudio con seguimiento a largo plazo evidenció que la incidencia de hipertensión arterial y proteinuria en donantes de riñón no muestra diferencias significativas con la incidencia en la población general27; asimismo Fournier et al.28 encontraron en un estudio de seguimiento a muy largo plazo (más de 40 años) una sobrevida similar entre los donantes de riñón y la población general, y describen también que la donación no afectó de manera significativa el área psicológica y psicosocial de los donantes. Los avances obtenidos en el trasplante renal de donante vivo han alcanzado tal magnitud, que inclusive Klop et al. han descrito en una de sus investigaciones más recientes con población europea una mejor calidad de vida y un retorno funcional a la actividad cotidiana más temprano en donante añosos (mayores a 60 años) respecto a la población general y a donantes jóvenes29.
En función de los datos descritos se puede afirmar que la donación en vida de un riñón no aumenta los riesgos de morbi-mortalidad del donante respecto a la población general, que el riesgo quirúrgico en manos experimentadas no es elevado, sin embargo los resultados a largo plazo pueden ser influenciados por la adherencia al estricto seguimiento clínico que debe seguir el donante de riñón; en concordancia con el consenso de Ámsterdam es preciso hacer hincapié en que los centros hospitalarios que practican trasplante renal con donante vivo deben velar, procurar y garantizar un seguimiento clínico a largo plazo para el donante de riñón, por lo tanto el trasplante renal con donante vivo debe entenderse como un programa clínico/quirúrgico que debe superar las limitaciones derivadas de los modelos económicos/administrativos de salud y garantizar a los donantes un óptimo y continuo control médico post-donación18,20.
Nefrectomía en donante vivo: ¿cirugía abierta o laparoscópica?La nefrectomía en donante vivo es un procedimiento quirúrgico que hasta hace unos años era exclusivamente realizado en cirugía abierta a través de lumbotomías subcostales extensas las cuales implicaban resecciones costales o a través de abordajes medianos transperitoneales; este hecho sin duda condicionaba un periodo de recuperación lento y prolongado y una percepción elevada de dolor postoperatorio para el donante. Con el paso de los años, la evolución del armamentario y entrenamiento quirúrgico han hecho que la mayoría de nefrectomías en donante vivo en centros de referencia de trasplante a nivel mundial se realicen actualmente por técnica laparoscópica. Hoy en día son diversas las variantes laparoscópicas para nefrectomía en donante vivo a las cuales los cirujanos de trasplante se ven avocados, entre ellas la técnica laparoscópica pura, técnica laparoscópica mano asistida, técnica laparoscópica con puerto único e inclusive técnica laparo-endoscópica por orificios naturales30. La explicación de cada técnica se escapa del alcance de este texto, por tanto se plantea una breve aproximación sobre técnica quirúrgica abierta vs cirugía laparoscópica para nefrectomía en el donante de riñón.
Algunos autores31–33 refieren que las complicaciones derivadas de la nefrectomía en donante vivo no superan una incidencia del 10%; dentro de las principales complicaciones descritas se encuentran neumotórax (8-10%), lesión peritoneal o de asa intestinal (0,1-6,4%), sangrado (0,5-1,5%), infección urinaria/de la herida/pulmonar (2-17%), embolismo pulmonar (0,1-0,5%), reintervención quirúrgica por sangrado, colecciones o hernia (0,5-1%), trombosis venosa profunda (0,1%). Otras complicaciones descritas con técnica laparoscópica son: lesión hepática, lesión esplénica, lesión ureteral, linfocele (tabla 1).
Resumen de las principales complicaciones derivadas de la nefrectomía con fines de donación
| Complicaciones nefrectomía en donante vivo |
| Conversión a cirugía abierta* |
| Neumotórax POP |
| Lesión de asa intestinal o peritoneal |
| Lesión hepática, esplénica, ureteral |
| Sangrado intraoperatorio de difícil control |
| Laceración/desgarro aórtico - VCI |
| Embolismo pulmonar POP |
| Infección urinaria/de la herida/pulmonar POP |
| Colecciones intraabdominales-linfocele |
| Hernia de pared abdominal POP |
POP: postoperatorio; VCI: vena cava inferior.
Durante muchos años la corriente quirúrgica clásica utilizó procedimientos abiertos con el fin de obtener un campo quirúrgico adecuado, lo cual garantizaba una visibilidad óptima del lecho quirúrgico y una disección precisa, sin embargo el advenimiento de la laparoscopia ha cambiado radicalmente este concepto, ya que la evaluación sobre cuál técnica debe usar el cirujano de trasplante para realizar la nefrectomía en una persona “sana” trasciende la comodidad del equipo quirúrgico e introduce a los cirujanos en la evaluación de una técnica segura que ofrezca la menor morbilidad posible para el donante.
Así entonces, actualmente se sabe que las complicaciones derivadas de la nefrectomía en donante vivo se presentan con más frecuencia en pacientes con índices de masa corporal mayor a 35 34, cuando el riñón a donar es el derecho, cuando existen alteraciones/variantes anatómicas de la vasculatura renal, cuando se utiliza una aproximación laparoscópica32 (Relación directa con la curva de aprendizaje), cuando el centro hospitalario realiza un bajo volumen de nefrectomías/año (Menos de 50 procedimientos por año) y cuando el donante es fumador35; pese a lo anterior la literatura disponible a la fecha revela de forma contundente que la nefrectomía para donación con técnica laparoscópica se asocia con menor dolor y menor uso de analgésicos en el postoperatorio, menos días de estancia hospitalaria, menor cantidad de sangrado durante el acto quirúrgico, retorno temprano a la vida laboral y mejor función pulmonar postoperatoria36. De forma similar se sabe que dentro de las ventajas que ofrece la nefrectomía abierta en donante vivo se encuentran: tiempos quirúrgicos más cortos respecto a las técnicas laparoscópicas y un tiempo de isquemia caliente menor; al respecto, Greco et al.37 mencionan en su trabajo que no se encontró diferencia estadística significativa en los tiempos quirúrgicos, en el tiempo de isquemia caliente y en la función del injerto renal al comparar la nefrectomía en donante vivo por técnica abierta, laparoscópica pura y laparoscópica mano asistida. Los autores afirman que el beneficio de las técnicas quirúrgicas laparoscópicas radica en una menor estancia hospitalaria, una reducción en el dolor postoperatorio, una fase de convalecencia más corta, y un retorno a las actividades diarias más temprano respecto a la nefrectomía abierta (tabla 2).
Ventajas nefrectomía con fines de donación laparoscópica vs abierta
| Técnica laparoscópica | Técnica abierta |
|---|---|
| Mejores resultados estéticosDisminución de dolor POPMenor sangrado durante el acto quirúrgicoMenor uso de analgésicos POPDisminución estancia hospitalaria POPRetorno temprano a la vida laboralPeriodo de convalecencia corto | Disminución de la incidencia de función lenta/disfunción aguda del injertoCostos reducidos vs técnicas laparoscópicasTiempos de isquemia caliente más cortosCurva de aprendizaje más corta vs técnicas laparoscópicasMayor comodidad para el cirujano*Campo quirúrgico amplio* |
POP: postoperatorio.
Jamale et al.38 compararon los resultados funcionales tempranos y tras el primer año postrasplante de injertos renales obtenidos de donante vivo por medio de técnica laparoscópica mano asistida vs técnica abierta. En dicho estudio no hubo diferencia estadística entre los resultados funcionales medidos a través de los valores de creatinina sérica tras los primeros 3 y 12 meses postrasplante entre los receptores de injerto proveniente de donante vivo obtenidos por técnica laparoscópica mano asistida y técnica abierta, sin embargo si encontraron una mayor tasa de disfunción aguda del injerto secundaria a necrosis tubular aguda en aquellos pacientes a los que se les implantaron injertos obtenidos por técnica laparoscópica mano asistida (37,8% vs 12,1%, p: 0,014). Aunque en dicho trabajo no se menciona el índice de masa corporal de los donantes, el hallazgo relacionado con una mayor incidencia de disfunción aguda del injerto en los receptores de injerto renal extraído mediante técnica laparoscópica puede estar influenciado por el mayor peso corporal reportado en aquellos donantes a quienes se les practicó la nefrectomía laparoscópica mano asistida; se hace preciso resaltar que un exceso en el índice de masa corporal en los donantes de riñón puede generar dificultades técnicas en el acto operatorio mediante técnica laparoscópica, lo cual en el contexto del trasplante renal puede prolongar el tiempo de isquemia caliente y propiciar en el periodo temprano postrasplante la aparición de disfunción aguda del injerto renal.
A diferencia de Jamale et al.38, Simforoosh et al.39 no encontraron diferencias con significancia estadística en la sobrevida a 5 años (89,5% vs 84,3%) ni en la incidencia de función retardada del injerto (8% vs 11%) en receptores de injerto renal proveniente de donante vivo obtenido a través de técnica laparoscópica vs técnica abierta respectivamente; Los autores postulan en su trabajo, que a pesar de tener unos tiempos de isquemia caliente mayores con la técnica laparoscópica, la isquemia caliente no tuvo efectos en la funcionalidad del injerto renal a largo plazo.
Genc et al.40 encontraron diferencia significativa en los tiempos quirúrgicos para nefrectomía laparoscópica vs nefrectomía abierta, con una reducción de tiempo quirúrgico en la nefrectomía laparoscópica respecto a la cirugía abierta (80,35 ± 15,05 vs 98,38 ± 8,13, p < 0,001); En el estudio no hubo diferencia significativa en la función de los injertos renales.
En una revisión Cochrane41 realizada en 2010, se postula que los costos derivados de la nefrectomía laparoscópica pueden ser mayores que los derivados de la técnica abierta así como también son mayores los tiempos de isquemia caliente respecto a la técnica abierta, sin embargo se reafirman las bondades y beneficios ya mencionados de la nefrectomía laparoscópica en donante vivo en comparación con la cirugía abierta (Menor dolor, mejor funcionamiento físico postoperatorio para el donante, reducción en el uso de analgesia postoperatoria entre otras). Los autores afirman que en manos experimentadas la nefrectomía laparoscópica ofrece más ventajas para el donante renal que la técnica abierta.
Un reciente metaanálisis realizado por Yuan et al.42 describe como hallazgos principales un menor tiempo quirúrgico para la nefrectomía abierta respecto a las técnicas quirúrgicas laparoscópicas (no hubo diferencia estadísticamente significativa entre la técnica laparoscópica pura y la técnica mano asistida), un tiempo de isquemia caliente mayor en el grupo de nefrectomía laparoscópica, sin embargo tras un análisis por subgrupos no se encontró diferencia significativa entre la técnica abierta y la laparoscópica mano asistida; también se evidenció un menor tiempo de isquemia caliente para la técnica laparoscópica mano asistida respecto a la técnica laparoscópica pura (MD: −1,02; 95% CI: −1,30−−0,74; p < 0,0001). La pérdida de sangre durante el acto quirúrgico fue mayor para la nefrectomía abierta, no hubo diferencia en la pérdida de sangre entre la técnica laparoscópica pura y la técnica laparoscópica manoasistida; no se evidenciaron diferencias en la tasa de complicaciones intraoperatorias entre la técnica abierta vs técnicas laparoscópicas; se confirmó la menor estancia hospitalaria y el retorno temprano a la vida laboral en los donantes a quienes se les practicó la nefrectomía por vía laparoscópica, sin embargo la reducción de estancia hospitalaria fue mayor para la técnica laparoscópica pura respecto a la técnica laparoscópica manoasistida.
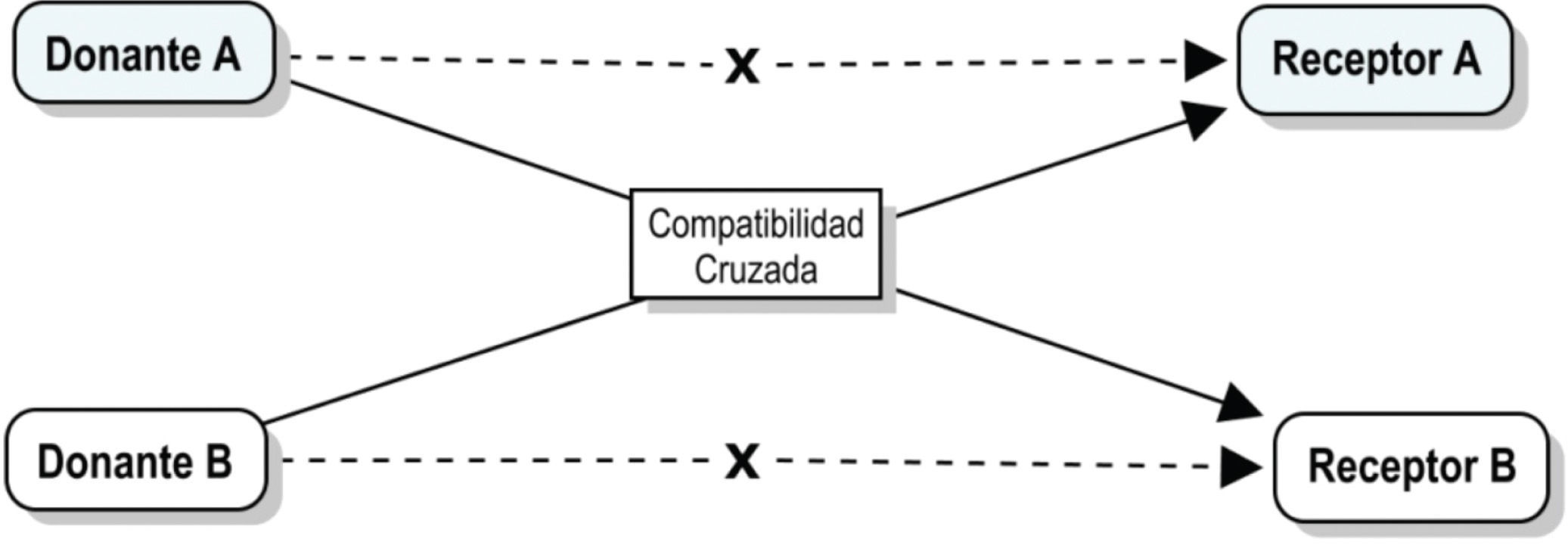
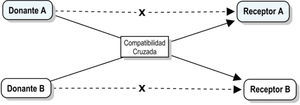
Trasplante renal con donación cruzadaDada la enorme y creciente cantidad de pacientes con ERCT en lista de espera altamente sensibilizados, el TxR de donante vivo ofrece innumerables ventajas para los receptores, entre ellas: disminución del tiempo de espera para obtener un trasplante y la obtención de un injerto que no ha sufrido las consecuencias hemodinámicas e inmunológicas de la muerte cerebral. Pese a lo anterior, alrededor del mundo son muchas las parejas receptor/donante vivo que se rechazan para trasplante por presentar incompatibilidad de serogrupo sanguíneo.
Desde 1986 Felix Rapapor43 había sugerido la opción de optimizar el uso de órganos provenientes de potenciales donantes vivos no compatibles con sus receptores (usualmente familiares o con algún tipo de relación de consanguinidad) mediante el intercambio con receptores compatibles de otras parejas donante/receptor, es decir, en el caso hipotético de abordar una pareja donante/receptor con incompatibilidad sanguínea, pero con compatibilidades cruzadas aceptables con otra pareja donante/receptor, el trasplante renal podría ejecutarse sin inconvenientes (fig. 2).
Sin embargo fue hasta 1991 cuando se llevo a cabo el primer TxR con donación cruzada en Corea del Sur, años más tarde en 1999 se realizó en Suiza el primer trasplante con donación cruzada en Europa y en el año 2000 se realizó el primer trasplante con donación cruzada en Estados Unidos44. En la actualidad los modelos para utilizar la donación y trasplante renal cruzado son complejos e inclusive, de acuerdo a la cantidad de parejas donante/receptor incluidas en la secuencia de trasplantes, se pueden beneficiar a más de dos receptores (modelo de intercambio en 3 o más vías, modelo en dominó45, modelo de intercambio en lista de espera, entre otros)46, sin embargo, pese a los potenciales beneficios que desde la teoría podría brindar este tipo de programas de trasplante renal (de forma especial a pacientes en lista de espera altamente sensibilizados), también existen innumerables controversias de índole logístico y ético que el mundo de la medicina de trasplantes deberá afrontar, dentro de las que se encuentran:
- •
Aspectos relacionados con los grandes desplazamientos que deben realizar los pacientes involucrados en programas nacionales de donación y trasplante renal cruzado para ejecutar el trasplante (cuando las parejas donante/ receptor viven en ciudades diferentes ¿quién debe viajar: los injertos, los donantes o los receptores?)47.
- •
Aspectos relacionados con desventajas presentadas para receptores de grupo sanguíneo O48 (Se estima que cerca del 60% de pacientes en espera para trasplante en programa de donación cruzada son grupo sanguíneo O, mientras que tan solo el 30% de donantes involucrados son grupo sanguíneo O).
- •
Aspectos derivados de la organización operativa y ética requerida para ejecutar programas de TxR con donación cruzada (Cuando se obtiene la donación en más de tres parejas donante/receptor: ¿se deben realizar todas las nefrectomías en simultáneo?, ¿qué hacer cuando en los modelos en domino uno de los donantes se retracta de su decisión al respecto de donar?, entre otros).
- •
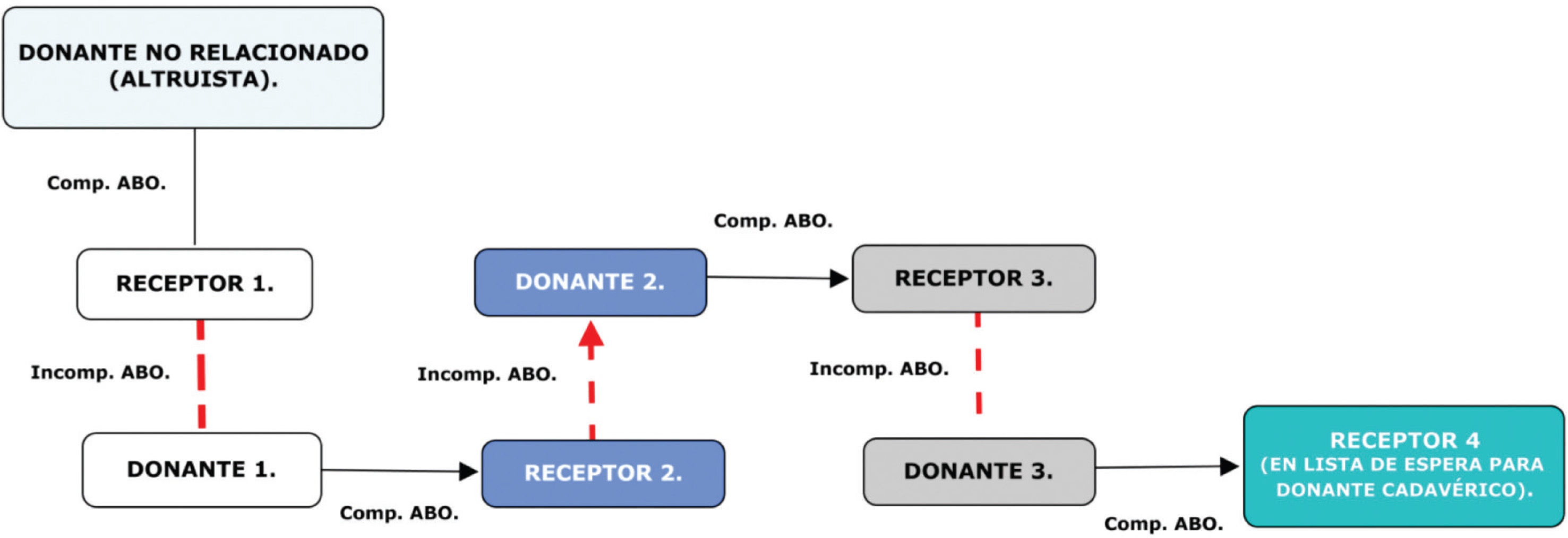
Estandarización del perfil de donante aceptado dentro de los programas de donación renal cruzada para garantizar justicia y equidad a todos los receptores involucrados; la justicia y equidad son medidas y reflejadas en parámetros de evaluación anatómica y funcional de los injertos renales, así se intenta garantizar un mínimo de calidad en todos los injertos que hacen parte de la cadena de trasplantes49 (fig. 3).
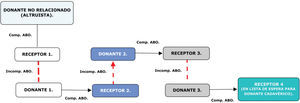
Figura 3.Esquema básico donación y trasplante renal cruzado en modelo domino. Nótese que en la cadena más de un receptor tiene la oportunidad de recibir el trasplante renal; los modelos en domino usualmente son iniciados por una donación no relacionada de carácter altruista. Comp. ABO: compatibilidad serogrupo ABO (flechas continuas negras - parejas de trasplantes ejecutados); Incomp. ABO: incompatibilidad serogrupo ABO (flechas discontinuas rojas).
A pesar de las discusiones que se han generado a nivel mundial dirigidas a optimizar el modelo de donación renal cruzada, no hay duda que este modelo ha ayudado a miles de personas con ERCT alrededor del mundo, y que en consecuencia con los datos obtenidos del TxR de donante vivo50, ha tenido grandes y favorables repercusiones económicas en los sistemas de salud de los países en los que se practica. A la fecha en Estados Unidos se han realizado más de 1600 trasplantes con donante vivo en programa de donación renal cruzada, en el año 2011 se realizaron 429 TxR51; así entonces, como medida útil para combatir y mitigar el efecto del crecimiento desmedido en la cantidad de personas registradas en lista de espera para trasplante con donante cadavérico y el descenso notorio de las tasas nacionales de donantes cadavéricos, se puede vislumbrar en las estrategias de donación renal cruzada un camino nuevo que busca facilitar/agilizar el acceso al trasplante para los pacientes con ERCT y una excelente opción para brindar los mejores injertos renales posibles.
Tras abrir un panorama amplio de la donación renal de vivo y debido a que en Colombia más del 88-90% de TxR son realizados con injertos provenientes de donantes cadavéricos se puede afirmar que nuestro país tiene enormes retos con el fin de forjar una cultura de trasplantes. Dentro de los grandes retos que tiene el país para mejorar las cifras en trasplante y la atención en salud para los pacientes con nefropatía en estado terminal se encuentran entre otros: fortalecer la atención primaria en salud (prevención, detección/intervención temprana y tratamiento oportuno de la enfermedad renal crónica), promover la educación en la población general y en el gremio médico sobre aspectos relevantes del proceso de donación y trasplante, superar los límites sociales que ha impuesto la desinformación y los mitos urbanos sobre la donación y los trasplantes, vigilar y regular el precio de los fármacos inmunosupresores así como promover y potenciar la figura de donante vivo en los servicios de trasplante con los que cuenta nuestra nación.
ConclusionesEl TxR de donante vivo constituye una opción terapéutica efectiva para disminuir el volumen de pacientes en lista de espera en el país y para mejorar el acceso al trasplante para aquellos pacientes con nefropatía crónica en fase terminal. El TxR de donante vivo ofrece muchas ventajas clínicas e inmunológicas para los pacientes con ERCT, los resultados obtenidos a largo plazo con el TxR de donante vivo han sido superiores a los obtenidos con donantes cadavéricos. La donación de un riñón en vida no aumenta significativamente la morbilidad o mortalidad de quién decide donar; la incidencia a largo plazo de enfermedad renal crónica, proteinuria e hipertensión arterial entre donantes de riñón es similar a la de la población general. La nefrectomía en donante vivo por técnicas laparoscópicas ofrece más ventajas para el donante e implica una menor morbilidad postoperatoria, por lo tanto se puede considerar actualmente como la técnica quirúrgica estándar para los donantes vivos de riñón. Actualmente la donación y trasplante renal cruzado constituyen una opción de acceso al trasplante para parejas donante/receptor con incompatibilidad de serogrupo sanguíneo y pacientes altamente sensibilizados.
Nivel de evidenciaIII.
Conflicto de interesesLos autores declaran que no tienen conflicto de intereses.
Diseño del estudio: reflexión.