El manejo estándar del carcinoma de próstata metastásico (CaPM) actualmente es el bloqueo hormonal. El uso de bloqueo con análogos y la orquiectomía bilateral (OQ) son reconocidos como manejos efectivos y comparables en resultados y pronóstico. En nuestro medio no contamos con estudios descriptivos en el comportamiento de los niveles de PSA en este grupo de pacientes al igual que la historia natural de la enfermedad en nuestro entorno.
Metodología: Se realizó un estudio de cohorte retrospectivo de pacientes con CaPM llevados a orquiectomía vs. bloqueo hormonal con análogos de la GnRH (BA). Se revisó el historial del seguimiento en el tiempo de los niveles de PSA y se tuvieron en cuenta variables asociadas como edad del paciente, Gleason, iPSA y TNM. Se realizó un análisis de t de Student y Chi cuadrado para las variables descritas.
ResultadosSe revisaron 124 historias clínicas en un periodo de 2 meses. Se dividió el análisis en dos grupos, OQ y BA. Se analizaron las tendencias en el tiempo del PSA encontrando que en cuanto a los niveles del PSA, los dos grupos tienen una tendencia similar. La progresión fue más temprana en el grupo de OQ siendo a los 27 vs. 32 meses del grupo de BA.
ConclusionesLas dos terapias logran un control similar de los niveles de PSA. En nuestra población aparentemente no se identificaron impactos administrativos y de administración de medicamentos por parte de las aseguradoras sobre los resultados de las terapias.
© 2014 Sociedad Colombiana de Urología. Publicado por Elsevier España, S.L. Todos los derechos reservados.
Current standard treatment for metastatic prostate carcinoma is hormone therapy.The two most commonly used treatments are orchiectomy and gonadotropin releasing hormone (GnRH) analogues, both being equivalent. There is no data regarding the PSA trends in our population. This is the first study that analyzes these issues, and will serve for future studies. Methods: A retrospective cohort study was performed on patients with metastatic prostate cancer (CaPM) who underwent orchiectomy or started treatment with GnRH analogues and were followed over time in order to evaluate the trends of PSA and other associated variables such as, patient age, initial PSA, Gleason score. and TNM.
ResultsA total of 124 patients were included in the study and divided into two groups; the Orchiectomy (OQ) and the GnRH analogues (BA) group. Monthly PSA records were analyzed and there were no differences in PSA levels over time in these two groups. Progression occurred earlier in the OQ group at 27 months vs 32 months in the BA group.
ConclusionsBoth treatments are equivalent. Progression occurred earlier in the OQ group. Further studies are needed to measure the specific impact of administrative and insurance issues in the treatment of these patients.
© 2014 Sociedad Colombiana de Urología. Published by Elsevier España, S.L. All rights reserved.
Desde los primeros trabajos de Hunter en 1840, se sabe que el tejido prostático presenta atrofia al no estar expuesto a la testosterona1. Los primeros intentos terapéuticos de la castración en el cáncer de próstata los hicieron Young y Huggins en los años 1936 y 1941, respectivamente2,3. Gracias a los logros de Huggins, en el año 1966 ganó el premio Nobel por sus resultados en esta área4. Para el año de 1973 se logró identificar el efecto de retroalimentación negativa de los estrógenos y la supresión de la LH y FSH, campo que dio inicio a la investigación del bloqueo farmacológico como opción terapéutica5. Las investigaciones en la producción de análogos sintéticos de la LH-RH lograron el reconocimiento el premio Nobel en el año de 1977 para Schally6.
La utilidad de la supresión de la testosterona como efecto terapéutico para el cáncer de próstata avanzado es un manejo estándar7. Las opciones de primera línea utilizadas en el tratamiento paliativo del adenocarcinoma de próstata son la realización de la orquiectomía bilateral (OQ), que es el “gold standard”, o el bloqueo farmacológico del eje hipotálamohipófisis, mediante el uso de análogos de la GnRH (por sus siglas en inglés para hormona estimuladora de gonadotrofinas).
Se reconoce que la supervivencia al comparar la OQ con el uso de análogos de GnRH (BA) es similar8. Con la realización de la OQ se ha identificado que la testosterona desciende en un 90% de los casos a niveles de castración (menos de 50ng/dL) en un periodo de 24 horas9. Resultados del descenso de la testosterona con el uso de antagonistas de la GnRH han mostrado descensos de la testosterona en un 98,1% a los 28 días de haber iniciado el tratamiento8.
Se sabe que hay factores pronósticos de supervivencia establecidos al momento de hacer el diagnóstico tales como el volumen tumoral, estadio de la enfermedad, niveles de PSA y el puntaje de Gleason10. Sin embargo esta información ha sido claramente establecida para estadios tempranos de la enfermedad con poca aplicabilidad para estadios metastásicos de la enfermedad11.
En la actualidad hay poca información sobre cuál es el comportamiento ideal del PSA esperado en pacientes con enfermedad metastásica que son llevados a OQ o BA. De igual forma aún falta conocimiento en cuanto a las fluctuaciones del PSA que ocurren con el uso de análogos y su impacto en el pronóstico. Por tal motivo el presente trabajo busca hacer una descripción de las tendencias del PSA en este grupo de pacientes en nuestra población.
MétodosSe realizó una revisión retrospectiva de las historias clínicas de los pacientes valorados en la consulta externa del Instituto Nacional de Cancerología con diagnóstico de adenocarcinoma de próstata cuyo estadio inicial fuera enfermedad metastásica. El periodo de recolección de los datos fue entre noviembre y diciembre del 2013.
PoblaciónLos individuos seleccionados fueron hombres mayores de edad cuyo diagnóstico inicial fuera enfermedad metastásica al momento de la primera valoración y confirmado mediante gammagrafía ósea con presencia de metástasis óseas. Para la inclusión en el estudio los pacientes debían haber sido llevados a OQ o habérseles iniciado BA con acetato de leuprolide, goserelina, triptorelina.
Se excluyeron los individuos que recibieron bloqueo adicional con antiandrógenos por más de un mes en la iniciación de la terapia con los análogos o durante cualquier parte del seguimiento , los individuos que no tuvieran registro de PSA inicial en la historia clínica y aquellos que hubieran recibido tratamientos previos de radioterapia y/o prostatectomía radical. De igual forma se excluyeron los casos que cambiaron de leuprolide a orquiectomía en el transcurso del seguimiento, si no tenían patología confirmatoria del adenocarcinoma prostático con el Gleason respectivo y los pacientes sin niveles de castración en los controles de testosterona (menores a 1,7nmol/L, a 50ng/dL o de los niveles sugeridos por el laboratorio de referencia).
Los datos evaluados fueron: edad, PSA inicial, niveles de PSA registrados en el seguimiento, TNM clínico (AJCC del 2010), Gleason de la biopsia.
SeguimientoSe incluyeron todos los niveles de PSA (ng/dl) registrados en la historia clínica hasta el último control registrado o hasta que presentará progresión y se iniciara un tratamiento hormonal complementario. La progresión se definió, según los criterios del South West Oncology Group, como un aumento del 25% del PSA en dos muestras separadas por al menos 3 semanas con un incremento de al menos 5ng/dL12. Debían cumplir un seguimiento de al menos 1 año con valores de PSA previos al inicio de la terapia.
AnálisisSe realizó el cálculo del tamaño de la muestra para definir el número de pacientes necesarios para incluir en el estudio teniendo en cuenta un poder el 80% y una seguridad de 1,96. Los datos fueron tabulados en Excel® 2012. El mínimo de pacientes para dicho estudio fue de 112. El análisis del PSA se realizó mediante el registro individual de cada paciente en el tiempo y posteriormente para cada grupo de realizó el promedio mensual para posteriormente realizar el análisis del comportamiento en el tiempo. Dicho comportamiento se hizo el análisis de tendencia. Para las variables continuas como edad, meses de seguimiento, niveles de PSA en el tiempo, se realizó el análisis de t de Student para evaluar la significancia de los resultados. Para las variables discontinuas el análisis se realizó con un Chi cuadrado.
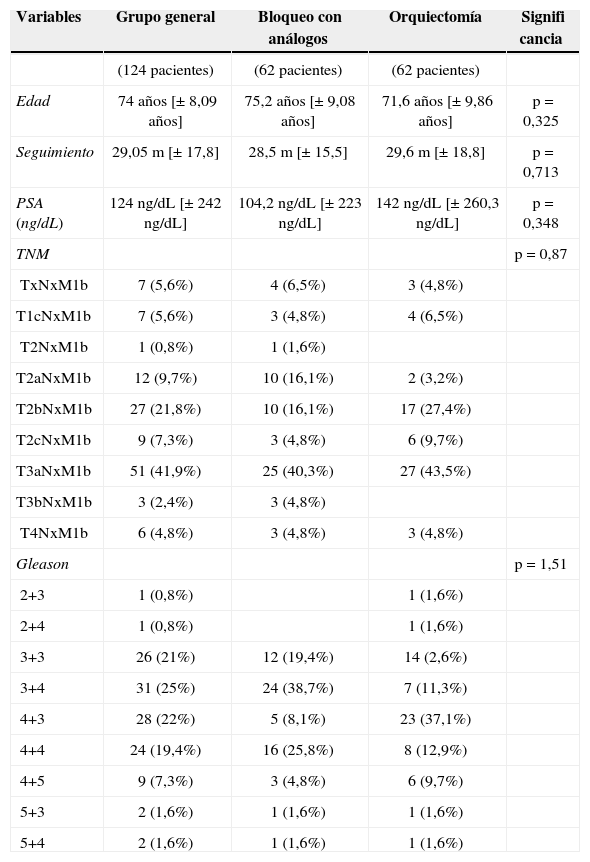
ResultadosSe incluyeron 124 pacientes en el análisis siendo 62 casos en el grupo de OQ y 62 casos en BA (tabla 1). La edad promedio de toda la población fue de 74 años ± 8,09 años. El PSA promedio de toda la población fue de 124ng/dL ± 242ng/dL.
Descripción demográfica de la población
| Variables | Grupo general | Bloqueo con análogos | Orquiectomía | Signifi cancia |
|---|---|---|---|---|
| (124 pacientes) | (62 pacientes) | (62 pacientes) | ||
| Edad | 74 años [±8,09 años] | 75,2 años [±9,08 años] | 71,6 años [±9,86 años] | p = 0,325 |
| Seguimiento | 29,05m [±17,8] | 28,5m [±15,5] | 29,6m [±18,8] | p = 0,713 |
| PSA (ng/dL) | 124ng/dL [±242ng/dL] | 104,2ng/dL [±223ng/dL] | 142ng/dL [±260,3ng/dL] | p = 0,348 |
| TNM | p = 0,87 | |||
| TxNxM1b | 7 (5,6%) | 4 (6,5%) | 3 (4,8%) | |
| T1cNxM1b | 7 (5,6%) | 3 (4,8%) | 4 (6,5%) | |
| T2NxM1b | 1 (0,8%) | 1 (1,6%) | ||
| T2aNxM1b | 12 (9,7%) | 10 (16,1%) | 2 (3,2%) | |
| T2bNxM1b | 27 (21,8%) | 10 (16,1%) | 17 (27,4%) | |
| T2cNxM1b | 9 (7,3%) | 3 (4,8%) | 6 (9,7%) | |
| T3aNxM1b | 51 (41,9%) | 25 (40,3%) | 27 (43,5%) | |
| T3bNxM1b | 3 (2,4%) | 3 (4,8%) | ||
| T4NxM1b | 6 (4,8%) | 3 (4,8%) | 3 (4,8%) | |
| Gleason | p = 1,51 | |||
| 2+3 | 1 (0,8%) | 1 (1,6%) | ||
| 2+4 | 1 (0,8%) | 1 (1,6%) | ||
| 3+3 | 26 (21%) | 12 (19,4%) | 14 (2,6%) | |
| 3+4 | 31 (25%) | 24 (38,7%) | 7 (11,3%) | |
| 4+3 | 28 (22%) | 5 (8,1%) | 23 (37,1%) | |
| 4+4 | 24 (19,4%) | 16 (25,8%) | 8 (12,9%) | |
| 4+5 | 9 (7,3%) | 3 (4,8%) | 6 (9,7%) | |
| 5+3 | 2 (1,6%) | 1 (1,6%) | 1 (1,6%) | |
| 5+4 | 2 (1,6%) | 1 (1,6%) | 1 (1,6%) |
El promedio de seguimiento para el grupo de OQ fue 29,6 meses [±18,8] y para el grupo de análogos fue de 28,5 meses [±15,5]. p = 0,7135.
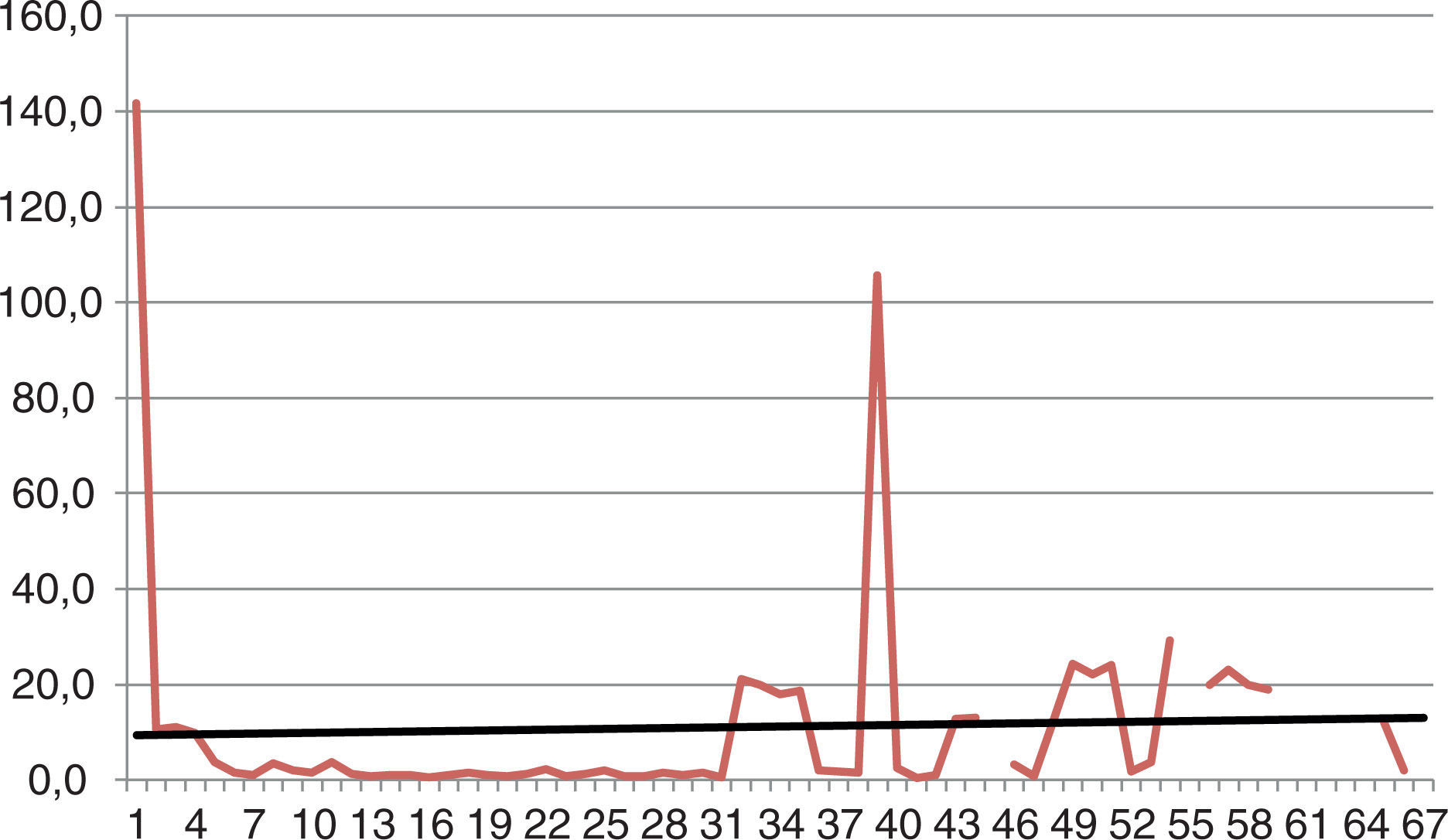
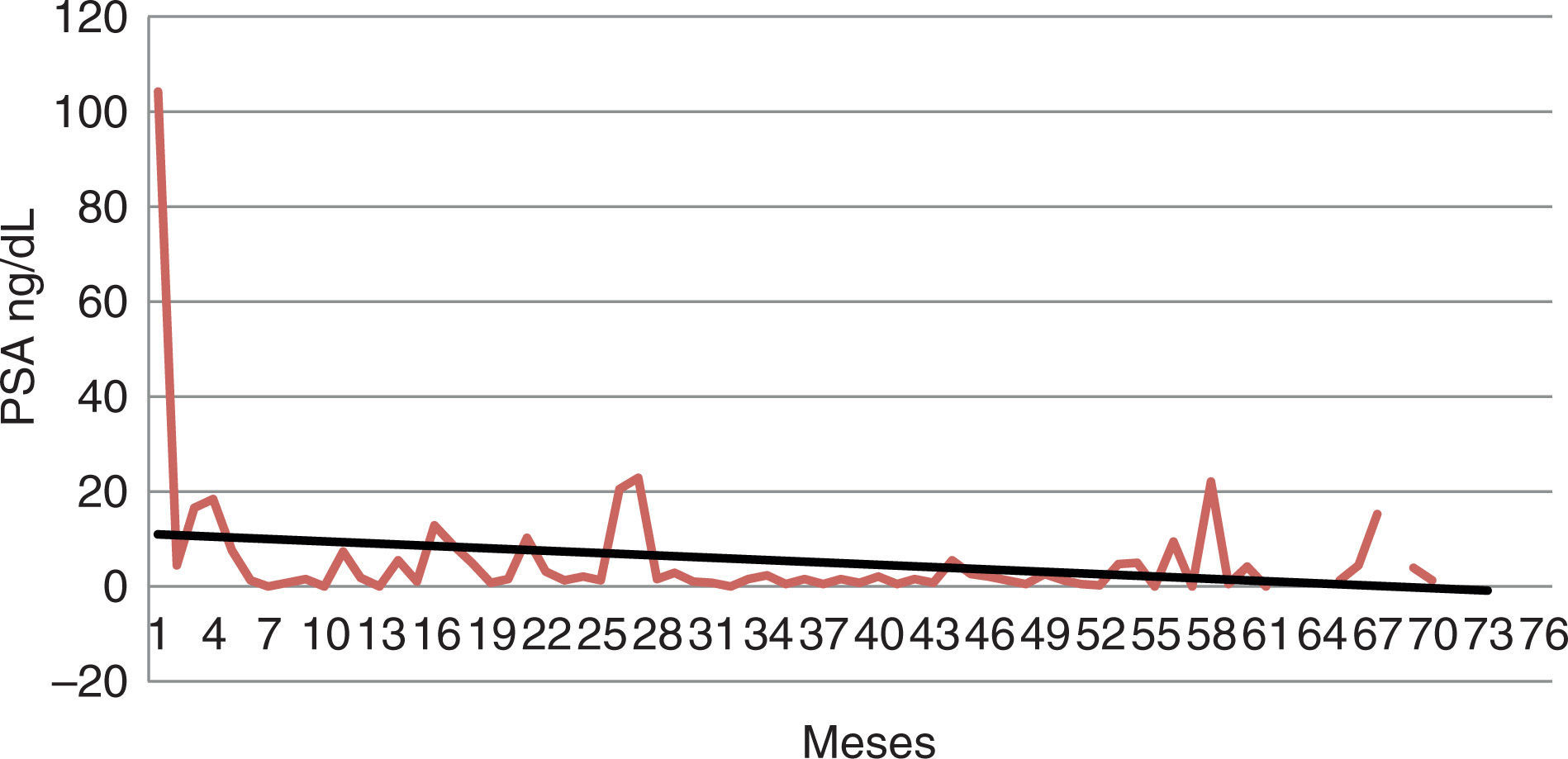
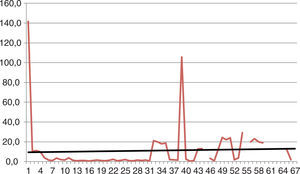
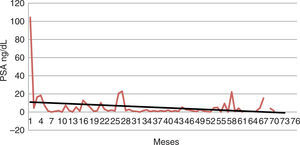
En el seguimiento del comportamiento del PSA hay descenso para cada grupo (figs. 1 y 2). Al hacer el análisis de tendencias se observa que la tendencia en el grupo de BA es con una tendencia al incremento en el tiempo mientras que en el grupo de la OQ es con una tendencia a la baja. Al analizar las tendencias de los dos grupos no se encontraron diferencias estadísticamente significativas. p = 0,081.
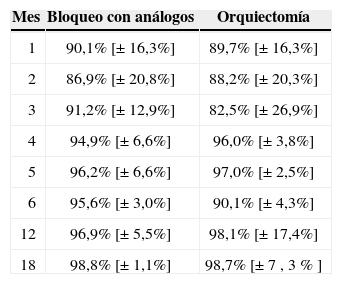
El porcentaje de disminución del PSA en el tiempo se observa en la tabla 2.
Tendencia de los porcentajes segúnel tratamiento
| Mes | Bloqueo con análogos | Orquiectomía |
|---|---|---|
| 1 | 90,1% [±16,3%] | 89,7% [±16,3%] |
| 2 | 86,9% [±20,8%] | 88,2% [±20,3%] |
| 3 | 91,2% [±12,9%] | 82,5% [±26,9%] |
| 4 | 94,9% [±6,6%] | 96,0% [±3,8%] |
| 5 | 96,2% [±6,6%] | 97,0% [±2,5%] |
| 6 | 95,6% [±3,0%] | 90,1% [±4,3%] |
| 12 | 96,9% [±5,5%] | 98,1% [±17,4%] |
| 18 | 98,8% [±1,1%] | 98,7% [±7 , 3 % ] |
En el grupo de OQ, durante el seguimiento se presentaron 9 (14,5%) casos que tuvieron progresión de la enfermedad mientras que en el grupo BA fueron 7 (11,3%) lo cual da un RR de 1,29 [0,51-3,24]. El tiempo promedio de la progresión ocurrió en el grupo de las OQ a los 27 meses y para el grupo BA fue a los 32 meses p = 0,041. Para este subgrupo de pacientes se encontró que el Gleason más frecuente fue el 4+4 y el iPSA promedio mayor de 20 en ambos grupos. El estadio de la enfermedad para este subgrupo de pacientes llevados a OQ fue principalmente estadios T3NxM1b mientras que para el grupo de análogos fue T4NxM1b. No se encontraron diferencias en estos subgrupos.
DiscusiónEl comportamiento del PSA demostró un descenso del 90,1 vs. 89,7% en el grupo de OQ al primer mes de haber iniciado el tratamiento. Al analizar la tendencia se observa que en el grupo de OQ hay unas fluctuaciones en los primeros 19 meses con un pico a los 27 meses aproximadamente que corresponde en su mayoría a las progresiones registradas. Las fluctuaciones registradas se deben a cifras extremas de algunos pacientes sin que haya una significancia clínica evidente. Al evaluar la tendencia general de los registros se observa un descenso progresivo, el cual no se identifica en el grupo de pacientes con bloqueo con análogos. En este grupo las fluctuaciones fueron menores con un pico alrededor de los 32 meses que corresponde principalmente a las progresiones registradas.
Al evaluar las tendencias generales no se encontraron diferencias estadísticamente significativas lo cual puede correlacionarse con el concepto ya conocido que ambas terapias son igualmente efectivas en la supresión del PSA7.
Aunque se tiene conocimiento del incremento de la testosterona con el inicio de los análogos7, incrementos iniciales en el PSA no fueron identificados en nuestro grupo.Quizá puede corresponder a registros tardíos más allá del primer mes del inicio de la terapia13. De todos modos se observa la tendencia en el manejo con OQ es que el PSA disminuye con el paso del tiempo y en BA va en ascenso.Si tuviéramos una muestra superior podríamos obtener una mayor claridad en este tópico.
Otro hallazgo interesante es que al comparar con la literatura, el promedio de tiempo que se ha descrito para la progresión de la enfermedad en pacientes metastásicos manejados con bloqueo hormonal es entre 18 y 24 meses, usando unos criterios de progresión diferentes a los usados por nuestro estudio14. Sin embargo, las progresiones registradas por nuestro estudio fueron a los 27 meses en el grupo de OQ y 32 meses para el grupo de análogos. Estos resultados requerirán de estudios adicionales con criterios comparables y definidos para permitir conclusiones aplicables en nuestro medio.
Algunos estudios han demostrado que fluctuaciones mayores de 1nmol/L o 32ng/dL en los niveles de testosterona en el seguimiento, luego de la supresión con análogos, tienen un peor pronóstico con mayor recaída bioquímica15. Resultaría importante hacer un estudio de correlación entre PSA y testosterona luego del inicio del bloqueo hormonal para evaluar su impacto en la progresión de la enfermedad. Dado que en nuestra población no contamos con estudios de seguimiento que nos permitan conocer cómo se comportan estos parámetros, afectados por situaciones como la no entrega oportuna de los medicamentos por parte de las aseguradoras, el objetivo de este artículo es tener el conocimiento base para futuros estudios de pronóstico y de correlación.
Con respecto a lo observado en otras regiones con respecto a la edad de presentación del cáncer de próstata metastásico es en promedio a los 71,5 años; en nuestra población fue de 74 años lo cual significa que la historia natural de la enfermedad es similar a lo descrito previamente16.
Reconocemos que los resultados del presente estudio están limitados por el diseño de cohorte sin aleatorización y sin un seguimiento estandarizado, lo cual puede tener impacto en los resultados. Sin embargo, los criterios estrictos de selección más un tiempo de seguimiento prolongado permiten que se puedan tener en cuentas las observaciones para aplicaciones clínicas y diseño de futuros estudios en este campo.
Por otro lado no se tienen en cuenta las dosis de análogos utilizadas lo cual en teoría no debe tener un impacto en el control de la enfermedad pero asegura una mejor caracterización de la población disminuyendo los sesgos.
ConclusionesAl ser el primer estudio en nuestro medio con resultados comparables con la literatura anglosajona, podemos concluir que es igualmente efectiva cualquiera de las dos terapias para ser ofrecidas en nuestro medio. A pesar del diseño del estudio, este permitirá ser la base para futuros estudios en esta área en nuestro medio.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.