El óxido nítrico es una molécula gaseosa producto de la conversión de L-arginina a L-citrulina por una familia de isoenzimas denominadas óxido nítrico sintasas presentes en diferentes partes del cuerpo, incluyendo los órganos reproductivos. En el espermatozoide las concentraciones de óxido nítrico bajas derivan en el mantenimiento de las funciones fisiológicas, mientras que las concentraciones altas repercuten negativamente sobre la calidad espermática.
Nitric oxide is a gas molecule, and a product of converting L-arginine to L-citrulline by a family of nitric oxide synthases, isoenzymes expressed in different parts of the body, including the reproductive organs. In the sperm cells, the lower concentrations of nitric oxide arise from maintaining physiological functions, while high concentrations have a negative impact on sperm quality.
El óxido nítrico (ON) fue reseñado por primera vez en 1980 en los trabajos de los profesores Furchgott y Zawasky, aunque con el nombre de factor relajante derivado del endotelio1. Fue en 1987 cuando se acuñó el nombre de ON2,3. El ON es un gas altamente reactivo y lipofílico con una vida media corta2, producto de la conversión de L-arginina a L-citrulina en presencia de oxígeno por la familia de isoenzimas ON sintasas (ONS)4. Las ONS incluyen las enzimas constitutivas dependientes del calcio, que se encuentran presentes en células endoteliales (ONSe)5 y neuronales (ONSn)6,7. Además, se ha reportado su presencia en el testículo, el epidídimo8, los espermatozoides9, el ovario10 y el útero de los mamíferos11. De manera similar, existe otro tipo de isoenzima, denominada ON sintasa inducible (ONSi), la cual produce mayores niveles de ON12, que es expresada en las células únicamente después de la estimulación inmunológica e inflamatoria13–18.
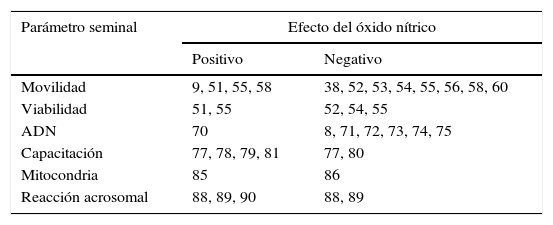
El ON está implicado en diversos procesos fisiológicos como la apoptosis19, la inhibición de la agregación plaquetaria20, la inflamación21–23, la respuesta inmune24, la diferenciación celular25, la producción de hormonas26, la regulación del tono vascular2, la neurotransmisión27, la erección del pene28–31 y la modulación de las funciones reproductivas32–35. Además, está involucrado en algunas funciones espermáticas que afectan tanto positiva como negativamente los parámetros seminales convencionales y funcionales de manera dependiente de las dosis y del tiempo de exposición36–38, y que cumplen, por lo tanto, un papel importante en la reproducción (tabla 1).
Evidencia de la asociación del efecto positivo o negativo del óxido nítrico sobre los parámetros seminales
| Parámetro seminal | Efecto del óxido nítrico | |
|---|---|---|
| Positivo | Negativo | |
| Movilidad | 9, 51, 55, 58 | 38, 52, 53, 54, 55, 56, 58, 60 |
| Viabilidad | 51, 55 | 52, 54, 55 |
| ADN | 70 | 8, 71, 72, 73, 74, 75 |
| Capacitación | 77, 78, 79, 81 | 77, 80 |
| Mitocondria | 85 | 86 |
| Reacción acrosomal | 88, 89, 90 | 88, 89 |
A pesar de los múltiples beneficios, los efectos perjudiciales del ON se originan al combinarse con el anión superóxido (O2-) formando peroxinitrito (ONOO-)39, una especie reactiva del nitrógeno que conduce a apoptosis, necrosis40, oxidación de proteínas41, además del daño del ADN42,43, de las mitocondrias44 y de los lípidos45. De otro lado, en algunas alteraciones médicas como las afecciones renales, disfunción inmune46, hipertensión arterial47 y disfunción endotelial48, los niveles de antagonistas competitivos de la ONS (N-monometil-L-arginina [L-NMMA] y N-N-dimetil-L-arginina asimétrica [L-ADMA]) aumentan y favorecen la disminución de la síntesis de ON49.
El objetivo de esta revisión es describir el efecto del ON sobre algunos parámetros espermáticos convencionales y funcionales.
El óxido nítrico: efectos sobre la movilidad y la viabilidad espermáticaLos espermatozoides son producidos en los testículos en un proceso celular que tarda alrededor de 64 días. Cuando son eyaculados, poseen un movimiento característico de desplazamiento, el cual les permite viajar en busca del oocito por el tracto reproductivo femenino, lugar en el que sufren una serie de modificaciones en las proteínas conocido como capacitación espermática50.
En las primeras investigaciones sobre la relación entre el ON, la movilidad y la viabilidad espermática se utilizaron compuestos liberadores de ON. Aunque los hallazgos reportados son contradictorios38,51,52, las discrepancias no repercuten en la calidad de los estudios, debido a que obedecen, más que a errores metodológicos, a diferencias en las condiciones experimentales. Hellstrom et al., en 1994, indicaron que los niveles bajos de nitroprusiato de sodio (NPS) eran beneficiosos para el mantenimiento de la movilidad y la viabilidad de los espermatozoides hasta 6h después de la descongelación. Las muestras de espermatozoides criopreservados tratadas con 50 y 100nM de NPS mantenían la velocidad curvilínea y reducían la lipoperoxidación de la membrana plasmática respecto al control51.
En contraste, Roselli et al.52 y Weinberg et al.38, un año después, concluyeron que los donantes de ON reducen el movimiento espermático. Roselli et al. evaluaron el efecto del NPS (0,25 a 2,5mM) y la S-nitroso-N-acetil-DL-penicilamina (SNAP, 0,012 a 0,6mM) sobre la movilidad celular, evidenciando un aumento de los espermatozoides inmóviles de manera dependiente de la concentración y una correlación positiva con el porcentaje de espermatozoides muertos. Además, lograron comprobar que la inhibición de ON mediante NG-nitro-L-arginina metil ester (L-NAME) conserva la movilidad y la viabilidad52. Por su parte, Weinberg et al. reportaron que el ON reduce el desplazamiento de los espermatozoides, quizás por un mecanismo que implica la inhibición de la respiración celular independiente de una elevación de guanosin monofosfato cíclico (GMPc) intracelular. La exposición de los espermatozoides con NPS (1mM), linsidomina (100 a 125μM) y ON puro (25 a 125μM) indujo la inhibición de la movilidad de forma dependiente de la dosis. Lo contrario ocurrió con la exposición a los agentes que elevan el GMPc38.
A partir de estos resultados discordantes sobre el papel fisiológico del ON en el movimiento del espermatozoide se realizaron otros interesantes estudios34-56. Por ejemplo, Nobunaga et al. trataron muestras de semen de 108 individuos infértiles y 15 hombres fértiles con NPS (10μM) en presencia o ausencia de oxihemoglobina y observaron que en los individuos infértiles las concentraciones de nitrito (NO-2), un producto final del ON, fueron mayores, especialmente en las muestras seminales con leucocitos. Además, observaron una correlación negativa entre los niveles de NO-2 y el movimiento espermático, y propusieron las elevadas concentraciones de ON como una posible causa de astenozoospermia53. De manera similar, en 2006, Amiri et al. ratificaron las conclusiones anteriores en ausencia de donantes de ON: en las muestras seminales de los pacientes infértiles, la producción de ON fue mayor (5,47±1,01μmol/l) que en el grupo control (3,88±0,53μmol/l), lo que corrobora el efecto perjudicial sobre la movilidad y la viabilidad en hombres infértiles. Sin embargo, no se encontró relación entre la presencia de leucocitos y la concentración de ON54.
Continuando con los experimentos en pacientes astenozoospérmicos, Zhang et al. investigaron los efectos de NPS en diferentes concentraciones (25-400nM). La concentración de 100nM fue más efectiva para la conservación de la movilidad, la viabilidad, la reducción de la lipoperoxidación y el aumento del GMPc, tanto en muestras de semen de hombres fértiles como infértiles. El efecto contrario fue observado con las concentraciones más altas (200-400nM), por lo tanto, el movimiento de los espermatozoides puede ser mediado por la reducción de la lipoperoxidación y el aumento de GMPc, lo que señala al ON como una molécula relevante en el tratamiento de los individuos astenozoospérmicos55.
Adicionalmente, se ha estudiado la implicación del ON con algunas alteraciones médicas reproductivas como el varicocele: se ha descubierto en el plasma seminal de voluntarios con varicocele mayor concentración de ON en comparación con los controles, concentración que repercute negativamente sobre la movilidad, la morfología y la concentración espermática. Es importante resaltar que dentro del grupo de pacientes con varicocele, los niveles de ON fueron similares en los individuos oligozoospérmicos (32μmol/l) y astenozoospérmicos (30,15μmol/l), lo que asocia el aumento de ON con una posible causa de daño en los espermatozoides de hombres con varicocele56. Incluso las concentraciones de ON en el plasma seminal de hombres infértiles antes de la varicocelectomía fueron más altas que después del procedimiento quirúrgico. Esto permite argumentar que el ON serviría junto con otros parámetros seminales para evaluar a hombres con varicocele y aplicar una posible respuesta terapéutica57.
De otro lado, Lewis et al. analizaron el comportamiento del ON endógeno y demostraron que los espermatozoides poseen las enzimas ONSe y ONSn debido a las concentraciones basales de ON encontradas en el plasma seminal sin ninguna estimulación (1,6-2,9μmol/106 espermatozoides viables). Esta enzima se localiza en la cabeza y en la pieza intermedia de los espermatozoides y regula la movilidad de manera autocrina. Además, evidenciaron que en los espermatozoides de hombres astenozoospérmicos, en comparación con hombres normozoospérmicos, la expresión de ONSe y ONSn y la concentración de ON eran más bajas, lo que justifica que el ON puede mejorar o preservar la movilidad espermática. No obstante, en presencia de FNT-α, la concentración de NO-2 fue menor en muestras de individuos normozospérmicos, aunque la viabilidad de los espermatozoides no se redujo en presencia de FNT-α y L-NAME9.
Posteriormente, el mismo grupo describió la estimulación e inhibición de la enzima ONS, la cual fue activada a través de la estimulación con ionóforo de calcio en espermatozoides seleccionados mediante la técnica de swim-up. Los resultados indicaron que existe un aumento del ON basal en los espermatozoides provenientes de hombres normozoospérmicos en comparación con astenozoospérmicos y que la estimulación con ionóforo de calcio produce un aumento del ON, lo cual es perjudicial para la movilidad, y confirma el papel beneficioso del ON en el desplazamiento del espermatozoide solo en concentraciones basales y la reducción de dicho parámetro al preincubar las muestras seminales con antagonistas competitivos de la ONS (L-NAME, L-NMMA y N-nitro-L-arginina [L-NNA])58.
Otro estudio que corrobora la presencia de la ONSe es el presentado por O’Bryan et al., quienes agregan a los trabajos anteriores la localización de la isoenzima en la zona posacrosomal y zona ecuatorial de la cabeza de los espermatozoides morfológicamente normales, mientras que los espermatozoides anormales exhiben una expresión aberrante de la ONSe, lo cual se relacionaba con una alta producción de ON y con la reducción de la movilidad espermática59.
La actividad de ONS también está aumentada en pacientes infértiles positivos para anticuerpos antiespermatozoides. Dichos anticuerpos pueden perjudicar la función espermática solo cuando el grado de unión es muy alto (>50%). La infertilidad causada por anticuerpos antiespermatozoides en el plasma seminal puede estar causada por cambios en la enzima acrosomal de los espermatozoides, la superóxido dismutasa (SOD) y la actividad de la ONS60.
Sin embargo, es interesante señalar la existencia de una investigación publicada en el 2001 en la cual no se demuestra relación entre la concentración de NO-2, la movilidad y la concentración de espermatozoides, ni tampoco, entre los niveles de NO-2 y los leucocitos en semen, independientemente de la contaminación microbiana. Por otra parte, las concentraciones de nitrito en el plasma seminal de hombres normozoospérmicos (17.092 nmol/mL) eran comparables con la concentración de nitrito de los individuos diagnosticados como oligozoospérmicos leves (17.006 nmol/mL) y graves (17.243 nmol/mL), lo que postula que los espermatozoides tal vez no son la fuente principal de ON en el plasma seminal, o que puede existir un inhibidor no competitivo insensible al calor, o un producto de la vía metabólica no detectable por la reacción de Griess (prueba indirecta para la detección de ON)61.
El óxido nítrico y la integridad del ácido desoxirribonucleicoDurante los últimos estadios de la espermatogénesis ocurre un remodelamiento y condensación nuclear62, lo cual involucra la substitución de una gran proporción de las histonas, proteínas encargadas del empaquetamiento de la cromatina en células somáticas, a proteínas de transición nuclear63. Posteriormente, estas son remplazadas por protaminas, un tipo característico de proteínas que favorecen la compactación y la estabilización del núcleo espermático64.
Los espermatozoides con ADN fragmentado son normalmente eliminados durante la espermatogénesis, sin embargo, pueden persistir en el eyaculado debido a una falla en el mecanismo de apoptosis65 o como resultado de daño oxidativo66. El daño en el ADN de los espermatozoides podría resultar en una incapacidad para embarazar a la pareja67 o en una anormal fecundación y desarrollo embrionario68,69.
Zini et al. publicaron el primer reporte sobre la expresión de ONSe en el citoplasma de las células de Sertoli y las células de Leydig en todas la etapas de la espermatogénesis, al igual que en los conductos deferentes y el epidídimo. Sin embargo, la enzima estaba ausente en las células germinales normales, pero presente en células germinales apoptóticas8. Los datos señalan un papel primordial de la ONSe en la espermatogénesis y en el daño de las células germinales8. No obstante, Roessner et al., en el 2010, encontraron que el aumento de la actividad de ONS se asociaba con madurez de los espermatozoides y la inactivación de señales apoptóticas, que las células presentaban menor porcentaje de fragmentación del ADN y alteración del potencial de la membrana mitocondrial y que las señales apoptóticas fueron correlacionadas negativamente con la producción de ON, por lo cual, el ON podría tener un efecto antiapoptótico de manera fisiológica70, pero la generación de ON exógeno en concentraciones altas (NPS>30μM) causaba un incremento en la apoptosis, incluso con la adición de L-NAME (0,7mM). Por lo tanto, las altas concentraciones de ON podrían estar relacionadas con la infertilidad71.
Previamente, Amiri et al. evidenciaron correlaciones positivas entre la concentraciones de ON y el daño en el ADN aunque solo para el grupo de individuos infértiles, lo que señala la sobreproducción de ON en el tracto genital de los hombres infértiles como un agente perjudicial en la reducción de la integridad del ADN espermático. Sin embargo, es importante aclarar que seguramente no es el único factor asociado al daño: deben de existir otros factores que están, en conjunto, afectando la calidad seminal y, por ende, la fertilidad72.
Recientemente, Kavita et al. informaron sobre los altos índices de fragmentación del ADN (IFA 46,12±12,21%) y las altas concentraciones de ON (7,33±2,8μmol/l), sumados a los bajos niveles de la capacidad antioxidante total (CAT 14,97±3,97mmol trolox Eq/l) en pacientes infértiles comparados con hombres fértiles. Los hallazgos demuestran una correlación positiva del ON con el IFA y la morfología anormal. Así mismo, demuestran una correlación negativa con la movilidad y la concentración73. El daño oxidativo al ADN medido mediante la formación de la 8-hidroxideoxiguanosina (8OHdG) en el plasma seminal de hombres diabéticos es elevado (4,86±0,67pg/mL) al igual que las concentraciones de nitrito/nitrato (6,16±1,93μM) en comparación con los niveles de 8OHdG y nitrito/nitrato del grupo control (3,75±0,54pg/mL y 4,2±1,4μM, respectivamente). Sin embargo, no hubo correlación entre las concentraciones de los metabolitos de ON y algunos parámetros seminales (concentración, movilidad y morfología). En contraste, una correlación positiva fue observada entre la concentración de nitrito/nitrato y la 8OHdG; por lo tanto, el daño celular elevado puede conducir a una baja fertilidad en hombres diabéticos con un análisis seminal normal74.
La asociación entre el ON y la infertilidad masculina involucra la participación de polimorfismos en el gen de la ONSe (cromosoma 7q36), como el T786C (región promotora), que está fuertemente vinculado en los casos de astenozoospermia, oligozoospermia y azoospermia, y afecta la estabilidad del ARN o la interacción del ARN con otras macromoléculas. Igualmente este gen junto con el 4a4b (número variable de repeticiones en tándem, intrón 4) podría contribuir al riesgo de infertilidad masculina en la población asiática y caucásica. Estos polimorfismos pueden influir en la expresión o actividad funcional de la enzima; sin embargo, otros estudios de polimorfismos de la ONSe y sus funciones biológicas son necesarios para comprender el papel en el desarrollo de la infertilidad masculina75.
Papel del óxido nítrico en la capacitación espermáticaDespués de ser depositados en la vagina y durante su viaje hasta el oocito, los espermatozoides sufren una serie de modificaciones celulares y bioquímicas conocidas como capacitación espermática, proceso que les permite adquirir la habilidad para interactuar con la zona pelúcida, fecundar y generar un nuevo individuo76.
Zini et al. analizaron los efectos del ON sobre la capacitación, mediante 2donadores de ON (esperminanonoato y dietilaminanonoato) y observaron un aumento de 2veces en la capacitación espermática comparada con el control en la concentración de 0,1mM, mientras que en las concentraciones de 0,3 y 1mM observaron una reducción de la movilidad espermática. Por otro lado, la incubación de los 2donadores en combinación con la enzima superóxido dismutasa (SOD) y catalasa por separado no mostró ningún efecto sobre la hiperactivación y la capacitación con SOD. Lo contrario ocurrió con la enzima catalasa, la cual aumentó la hiperactivación en presencia de esperminanonoato, aunque bloqueó la capacitación, lo que demostró que el peróxido de hidrógeno es necesario para la actividad biológica del ON. Los resultados sostienen que los compuestos liberadores de ON están involucrados en la capacitación espermática y se relacionan directamente con el ON, debido a que los productos finales de descomposición como la espermina, la dietalamina, los nitritos y nitratos no influyeron en la capacitación. De otro lado la adición de L-NAME no bloqueó la capacitación espermática inducida por el suero de cordón fetal ultrafiltrado, por lo cual concluyeron que el espermatozoide humano no poseía la enzima77.
Sin embargo, en los trabajos posteriores se demuestra la existencia de la ONS en espermatozoides capacitados y la influencia del ON en la modulación del AMPc intracelular. Herrero et al. realizaron la medición de ON con N-metil-D-glucamina ditiocarbamato de sodio (MGD) en presencia de Fe+2 para formar el complejo hidrosoluble (Fe+2-MGD2), el cual presenta gran afinidad por el ON, y obtuvieron un aumento de señal hasta 8veces mayor en condiciones capacitantes en forma dependiente del tiempo, mientras en condiciones no capacitantes la producción es baja y constante. También se realizaron experimentos para determinar la influencia del ON en la vía del AMPc intracelular y, por ende, en la capacitación, cuando los espermatozoides se incubaron en solución tyrode suplementada con albúmina sérica bovina y compuestos liberadores de ON: las concentraciones de AMPc intracelular fueron más elevadas que cuando los espermatozoides eran incubados sin donadores de ON, sumado a una reducción de la concentración de AMPc en los espermatozoides en presencia de antagonistas competitivos, L-NAME y L-NMMA.
La concentración de AMPc intracelular en espermatozoides aumentó cuando eran incubados con 3-isobutil-1-metilxantina (IBMX), un inhibidor de las enzimas fosfodiesterasas, y fue aún mayor la concentración en presencia de IBMX combinado con compuestos liberadores de ON. Estos resultados indirectamente señalan que el ON aumenta los niveles de AMPc espermático, probablemente por la modulación de la actividad de adenilato ciclasa78.
Durante la capacitación, el ON regula específicamente la doble fosforilación de los motivos de treonina, glutamato y tirosina en las proteínas de 80 y 105kDa del espermatozoide sin la mediación del anión superóxido o del peróxido de hidrógeno. La adición exógena de estos 2radicales no afectó los niveles de fosforilación bajo condiciones de capacitación, pero el ON generado por esperminanonoato incrementó significativamente la fosforilación (11,5±0,8 vs. 4,5±0,3%), al igual que la L-arginina que, además, invertía el proceso inhibitorio de la L-NAME sobre la fosforilación79. Sin embargo, el ON no es un importante inductor de S- glutationilación: los niveles mostrados en los espermatozoides tratados con un liberador de oxido nítrico (0,1-1mM) fueron similares a los del control y nunca superiores a los generados con peróxido de hidrógeno (0,25mM)80.
Wang et al. encuentran que los espermatozoides del grupo de hombres con parámetros seminales alterados comparados con el control necesitaban un tiempo basal más largo para alcanzar la concentración apropiada de ON para la capacitación in vitro y tenían un menor porcentaje de viabilidad y movilidad progresiva. Adicionalmente, en experimentos de muestras de semen con parámetros seminales anormales a las cuales se les agregaban SNP y L-NMMA de forma controlada y en función del tiempo, se logró observar un aumento en el porcentaje de espermatozoides progresivos, además de mejorar la capacitación espermática81.
El óxido nítrico y las mitocondriasLas mitocondrias son orgánicos celulares que poseen una morfología heterogénea y cantidad diversa de acuerdo con el estado funcional y el tipo de célula en que se encuentren82. En los espermatozoides, la funcionalidad de las mitocondrias está asociada positivamente con la movilidad, la viabilidad, la capacitación, la reacción acrosomal, la integridad de la cromatina y el potencial de fecundación83.
El ON está involucrado en la hiperpolarización de la membrana mitocondrial84, donde los altos niveles de ON conducen a un aumento de la expresión de componentes de la cadena transportadora de electrones (CTE) que se correlaciona positivamente con la movilidad espermática85.
De otro lado, el peroxinitrito disminuye el potencial de membrana mitocondrial entre 0,2 y 1mmol e inhibe la mayoría de los componentes de la CTE, debido a que causa oxidación de la cisteína, la nitración de tirosina y daño a las proteínas hierro-azufre, por lo cual la inhabilitación de la CTE podría estar implicada en el decrecimiento del potencial de la membrana mitocondrial86.
El óxido nítrico y la reacción acrosomalLa reacción acrosomal (RA) es un proceso especializado de fusión de la membrana citoplasmática con la membrana acrosomal externa en la zona apical de la cabeza espermática, que produce la liberación de enzimas almacenadas en esta vesícula y la exposición de la membrana acrosomal interna. Los anteriores mecanismos facilitan la adherencia del espermatozoide al oocito87.
El ON está involucrado en la habilidad del espermatozoide de fusionarse con el oocito, pero no tiene ningún efecto en la adhesión a la zona pelúcida. La incubación con diferentes concentraciones de L-NAME inhibió la fusión del espermatozoide con el oolema de manera dependiente de la dosis, condición restablecida con la adición de L-arginina88. En contraste, Sengoku et al. observaron que el tratamiento de espermatozoides con bajas concentraciones de NPS (10−7 y 10−8 M) en medio capacitante presentaba un mayor número de espermatozoides adheridos a la hemizona comparado con los espermatozoides expuestos a 10−5 M de NPS, sin mostrar un efecto dependiente de la dosis, mientras que, en la prueba de penetración a los oocitos de hámster libres de zona pelúcida, no se observaron diferencias89.
De otro lado, la reacción acrosomal de los espermatozoides inducida por fluido folicular disminuye significativamente con la administración de L-canavanina y de hemoglobina. Así mismo, la incubación con compuestos liberadores de ON aumenta el porcentaje de espermatozoides reactivos sin afectar la movilidad y la viabilidad, y la incubación de NPS aumentó el porcentaje de espermatozoides reactivos, con un mayor número en la concentración de 10μM90.
La RA inducida por ON requiere la presencia de calcio extracelular y es mediada por la síntesis de GMPc y la activación de las proteínas cinasas G y C, debido a que la incubación de los espermatozoides con NPS (100μM) aumenta el nivel de GMPc intracelular y el porcentaje de células positivas para la RA que, a su vez, es reducida por un inhibidor de guanilato ciclasa91.
ConclusionesLa comprensión de los mecanismos moleculares del ON en los procesos reproductivos posibilitará la intervención y tratamiento de la infertilidad masculina, una enfermedad que tiene múltiples causas y de la que, quizás, un protagonista central sea el ON, debido a que los bajos niveles mantienen las condiciones necesarias para el buen funcionamiento del espermatozoide y la normalidad en los procesos reproductivos, mientras que las concentraciones altas repercuten en una baja calidad seminal. Estos efectos son dependientes del tiempo de acción y de la concentración del gas, y también de la capacidad antioxidante de la célula, que altera los parámetros espermáticos convencionales y funcionales.
La conducta dual del ON permitirá su utilización como un biomarcador de la infertilidad y blanco terapéutico mediante la inhibición o estimulación de la ONS según el trastorno reproductivo específico, aunque aún falta por describir de forma detallada los procesos de señalización celular en las cuales el ON interviene, la concentración límite que define su papel y la relación entre factores externos y el comportamiento del gas a nivel reproductivo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Estrategia de Sostenibilidad de la Universidad de Antioquia y al Comité para el Desarrollo de la Investigación (CODI, 2014-862) de la Universidad de Antioquia.
CQQ fue joven investigadora de la Universidad de Antioquia.