Como resultado de la creciente controversia respecto a las características operativas del antígeno prostático específico (PSA), el valor del cribado de cáncer prostático y la posibilidad de sobretratamiento, se ha desarrollado este estudio, cuyo objetivo es comparar las características operativas del valor total de PSA y de la cinética del PSA para el diagnóstico del adenocarcinoma de próstata. Además, se busca determinar las características operativas de la cinética del PSA para predecir el grado de diferenciación tumoral.
Materiales y métodosSe realizó un estudio descriptivo, de corte transversal, para comparación de pruebas diagnósticas entre el valor total del PSA y la cinética del PSA, utilizando como referencia el informe patológico de una biopsia prostática. Se obtuvieron los registros desde enero de 2008 hasta diciembre de 2011, y se incluyó a los varones mayores de 40 años que ingresaron al programa de cribado de oportunidad de la Organización Sanitas Internacional (OSI), con tres valores de PSA y un lapso>1 año entre ellos. En todos los casos, la patología y las muestras sanguíneas se procesaron en el laboratorio central de la OSI. Se excluyó a los pacientes que utilizaron inhibidores de 5-alfarreductasa.
ResultadosSe determinó una prevalencia de adenocarcinoma prostático del 29%. Para PSA en 4ng/ml, se identificó sensibilidad del 95% y especificidad del 6%. Mediante el análisis comparativo por área bajo la curva (AUC) del valor total del PSA y nueve formas diferentes de calcular la cinética, no se encontró aporte al diagnóstico de adenocarcinoma. Según el análisis del AUC, se encuentra un aporte marginal y no significativo de la cinética para el diagnóstico de adenocarcinoma mal diferenciado. El análisis multivariable de la cinética permite describir un modelo para inferir la probabilidad de mala diferenciación.
ConclusionesEl PSA conserva su utilidad en nuestro medio. La cinética del PSA no aporta al diagnóstico inicial del carcinoma. El modelo multivariable con la cinética del PSA mejora la capacidad de predecir diferenciación tumoral.
© 2014 Sociedad Colombiana de Urología. Publicado por Elsevier España, S.L.
Todos los derechos reservados.
Due to the growing controversy of the operating characteristics of PSA, the value of screening for prostate cancer and the potential of overtreatment, this study was conducted to compare the operating characteristics of the absolute value of PSA and of PSA kinetics for the diagnosis of prostate adenocarcinoma. In addition, the aim was also to determine the operating characteristics of PSA kinetics for predicting tumor grade differentiation.
MethodsA descriptive, cross-sectional study was conducted to compare the diagnostic tests, between the absolute value of PSA and the PSA kinetics, using the pathology report of a prostate biopsy as reference. Records were collected between January 1st 2008 and December 31st 2011, including men older than 40years who entered the opportunistic screening program for prostate cancer of the Organización Sanitas Internacional (OSI), with at least three PSA samples and a period greater than 12months between them. All PSA samples and prostate biopsies were processed in the central laboratory of the OSI. Patients who received 5-alpha-reductase inhibitors were excluded.
ResultsA prevalence of 29% for prostate cancer was observed. The sensitivity and specificity for a PSA cutoff of 4ng/ml for the diagnosis of prostate cancer was 95% and 6%, respectively. Through a comparative analysis of the AUC between the absolute value of PSA and 9 different measurementsof the PSA kinetics, no additional benefit was found for diagnosing prostate cancer. According to the AUC analysis, there was a slight, non-significant advantage of PSA kinetics over PSA absolute value for the diagnosis of low grade prostate cancer. In a multivariate analysis of the PSA kinetics, a model for predicting the probability of low differentiation can be described.
ConclusionsPSA for screening is still useful in our population. PSA kinetics has no advantage for the initial diagnosis of prostate cancer. The multivariate model of the PSA kinetics improves the ability to predict tumor differentiation.
© 2014 Sociedad Colombiana de Urología. Published by Elsevier España, S.L. All rights reserved.
El adenocarcinoma de próstata es un problema de salud pública para la sociedad actual. Es el segundo tumor más frecuente en los países desarrollados, con una mortalidad importante, y consume buena parte de los recursos disponibles en salud. Colombia no es la excepción, y se puede notar un aumento de la prevalencia de la enfermedad en la medida en que mejoran las condiciones de vida y el acceso al sistema de salud1-3.
Como estrategia para el diagnóstico de esta enfermedad, se introdujo en la práctica clínica el antígeno prostático específico (PSA) a finales de los años ochenta. Por las características de la población en ese momento, esta prueba generó un cambio importante en el diagnóstico temprano. A partir del uso masivo del PSA, se empezó a detectar los casos en etapas tempranas y con mejores posibilidades terapéuticas. El PSA mostró su utilidad como prueba de tamización, gracias a sus características operativas4. La capacidad del PSA ha desplazado la evaluación física, dado que actualmente la mayoría de los casos son diagnosticados con volúmenes tumorales mínimos5.
Actualmente, tras una amplia utilización del PSA, empiezan a aparecer deficiencias operativas de esta prueba diagnóstica. Los valores de los diferentes puntos de corte son difíciles de determinar por la variabilidad en sensibilidad y especificidad: actualmente el punto de corte de 4ng/ml tiene una sensibilidad alrededor del 24,5% y una especificidad del 92,3%6, e incluso menores según otros reportes7. Además, al usar el punto de corte establecido inicialmente, se puede dejar de diagnosticar hasta la mitad de los casos, ya que en la literatura se encuentran reportes de falsos negativos hasta en un 75% de los casos diagnosticables con una biopsia prostática, y si se usa un punto de corte de 2ng/ml, se perdería alrededor del 45% de los casos6. Por otra parte, es claro que no todos los casos diagnosticados requieren tratamiento, ya que los pacientes pueden llegar a tener tumores indolentes o clínicamente no significativos, es decir, que pueden presentar mayor morbilidad por las conductas terapéuticas, sin encontrar una morbilidad asociada a la enfermedad misma. Se comienza a hablar entonces del sobrediagnóstico de la enfermedad, como consecuencia de la tamización con el PSA8.
En este escenario de una enfermedad con alta prevalencia, con una prueba diagnóstica con deficiencias operativas de sensibilidad y valor predictivo positivo, aplicada en una población sometida ampliamente a tamización, se requiere una alternativa diagnóstica que pueda mejorar la sensibilidad y el valor predictivo positivo y que a su vez permita diferenciar una enfermedad clínicamente significativa de otra que no lo es. Esto permitiría seleccionar con adecuada precisión a quiénes se debe practicar una biopsia de próstata y ayudar a seleccionar los casos positivos que realmente requieren manejo terapéutico.
La cinética del PSA surge entonces como una alternativa para el escenario planteado. Este estudio diagnóstico involucra la evolución del PSA en la tamización de los pacientes y permite una mejor aproximación al modelo exponencial de crecimiento tumoral, a diferencia del valor total del PSA, y asimismo podría ser reflejo de la agresividad de la enfermedad en cuanto a su representación del crecimiento tumoral9. En este estudio se busca comparar las características operativas del PSA total y de la cinética del PSA para el diagnóstico inicial del adenocarcinoma prostático y las características operativas para predecir el grado de diferenciación tumoral. De esta forma, se evaluó la cinética del PSA y su posible utilidad en la práctica clínica, para finalmente proponer criterios de selección en la toma de biopsias prostáticas y mejorar la identificación de los casos indolentes.
Materiales y métodosSe definió un diseño de tipo corte transversal para comparación de características operativas de pruebas diagnósticas, estableciendo como prueba de comparación el valor total del PSA, prueba de estudio la cinética del PSA y referencia del informe patológico de una biopsia de próstata. La variable de desenlace corresponde al diagnóstico histológico del adenocarcinoma prostático y a su grado de diferenciación tumoral. Se definió como tumor mal diferenciado aquel con Gleason score≥8.
Las muestras sanguíneas para la medición del PSA fueron tomadas por personal del laboratorio clínico de la Organización Sanitas Internacional (OSI), con entrenamiento específico. Todas son dirigidas y procesadas en un laboratorio central. La técnica de medición utilizada es la indicada por Laboratorios Roche en todos los casos. Se toma como el valor total del PSA el último valor reportado antes de la realización de la biopsia. Para la cinética del PSA, se calculan diferentes parámetros: la velocidad del PSA (PSAV), el tiempo de duplicación del PSA (PSA DT), aceleración del PSA, la velocidad relativa del PSA (PSA RV) y la determinación del riesgo de la PSAV (PSA RC), que se calcula tomando valores de PSAV de 0,35, 0,75, 1 y 2ng/ml/año9-24. Las fórmulas utilizadas en el presente estudio para el cálculo de cada uno de los parámetros de cinética de PSA se muestran en el anexo.
Las biopsias fueron realizadas en diferentes centros, pero todas fueron procesadas en el laboratorio central de la OSI por el Departamento de Patología, por un patólogo con entrenamiento especial en uropatología que procesa la mayoría de las muestras y asistió en la lectura de otras cuando no le fueron asignadas inicialmente.
La población de estudio es todos los varones mayores de 40 años afiliados al sistema de salud colombiano a través de la Organización Sanitas Internacional (OSI), de Bogotá, que asistían al programa de tamización por oportunidad del área de urología y a quienes se les había realizado por primera vez una biopsia transrectal de próstata dirigida por ecografía con 8-12 muestras (con énfasis en áreas periféricas y lesiones hipoecoicas cuando se detectaban), solicitada por urólogo tratante, basándose en valores de PSA>4ng/ml o hallazgos anormales en el examen físico prostático, procesada en el laboratorio central de la OSI (con informe de la presencia o ausencia de adenocarcinoma y, en los casos positivos, el grado de diferenciación usando la escala de Gleason). Todos los pacientes tenían medición de PSA en sangre, al menos tres valores previos a la realización de la biopsia, con un intervalo mínimo de 1 año entre la primera y la última muestra, procesados en el laboratorio central de la OSI. Con dichos valores se calcularon las diferentes formas de la cinética mostradas en el anexo.
Se excluyó a los pacientes que habían recibido manejo farmacológico con inhibidores de la 5-alfarreductasa o terapias hormonales asociadas con el eje hipotálamo-hipófiso-gonadal y se habían sometido a procedimientos que involucraran la próstata o pudieran alterar el valor del PSA en sangre en un intervalo<1 mes antes de la toma del PSA (p. ej., cateterismo uretral, cistoscopia, resección prostática abierta o endoscópica) o quienes cursaban con procesos infecciosos en el momento de tomarse la biopsia o la muestra del PSA, documentados con un reporte de urocultivo o uranálisis tomado en un lapso<1 mes de la realización del procedimiento.
Se obtuvo información de la base de datos del Departamento de Patología sobre identificación, edad y resultado histológico de los pacientes a quienes se practicó la biopsia prostática. En consecuencia, se ingresó esta información en la base de datos del laboratorio clínico para identificar a los pacientes que además tenían al menos tres valores de PSA que cumplieran los criterios citados. En una tercera etapa, posterior a la búsqueda individual, se complementaron los requisitos definidos por criterios de elegibilidad con las bases de datos de la farmacia central y con la historia clínica institucional.
Durante el análisis de los datos, se utilizaron los programas Excel y Stata versión 12. Se realizó una descripción general de las variables estadísticas mencionadas. En cuanto a las características operativas de las pruebas estudiadas, se calcularon sensibilidad, especificidad y razón de verosimilitud (LR) positiva y negativa para diferentes valores de cada una de las pruebas evaluadas, tanto para diagnóstico de adenocarcinoma de próstata como para predicción de tumores mal diferenciados (tablas formato digital). Además, se realizaron análisis bivariables de las variables descritas. Se realizó un análisis multivariable mediante un modelo de regresión logística ordinaria, ajustando el modelo por variables de confusión e interacción. Con estos resultados, se construyeron las curvas ROC para estimar los análisis de área bajo la curva (AUC). Para este estudio se tomaron como resultados estadísticamente significativos los valores de p<0,05 y se consideró un poder del 80%.
De acuerdo con los lineamientos científicos y éticos del país, según la resolución 8430 de 1993, el estudio se clasifica como investigación con riesgo mínimo. Se obtuvo aprobación del Instituto de Investigaciones OSI, la Comisión de Investigaciones OSI, el Comité de ética y publicaciones de la Clínica Universitaria Colombia y la Fundación Universitaria Sanitas.
ResultadosSe revisaron las bases de datos de Patología en busca de pacientes mayores de 40 años que fueron llevados a biopsia transrectal de próstata entre 2008 y 2011. Se encontraron 1.677 biopsias registradas; fue posible el acceso a los resultados de PSA de 1.197 pacientes en el sistema del laboratorio clínico (tabla 1).
De la población accesible, se obtuvo una muestra de 342 pacientes que cumplían los criterios de inclusión y exclusión. Se realizó muestreo estratificado por años, y se seleccionó aleatoriamente a 89 pacientes a quienes se tomó biopsia en 2008, 100 pacientes de 2009, 92 de 2010 y 61 de 2011. En la muestra seleccionada, 5 pacientes presentaron datos equívocos y no corroborables, por lo cual se analizó a 337, de los que 238 (70,6%) tuvieron un resultado negativo para malignidad en la biopsia y 99 (29,4%), una biopsia positiva para adenocarcinoma de próstata.
El promedio de edad de todos los pacientes incluidos en el estudio era 64,7 años. La de los pacientes con biopsia positiva para cáncer era 67,0 años, mientras que las de los pacientes con resultado negativo era 63,8 años (p=0,0018).
En cuanto a la distribución del grado de diferenciación tumoral en los pacientes con biopsias positivas, se encontró que el 15,2% (15 pacientes) tenía tumores mal diferenciados, con Gleason≥8, y el 84,8% (84 pacientes) tenía tumores bien o moderadamente diferenciados (Gleason<8). Al hacer un análisis por subgrupos, el promedio de edad de los pacientes con tumores mal diferenciados era 74,8 años, mientras el de los pacientes con tumores bien diferenciados era 65,6 años (tabla 2).
Se realizó un análisis bivariable —con edad, PSA total y los parámetros calculados de la cinética de PSA mencionados anteriormente— respecto al diagnóstico de cáncer en pacientes con biopsia positiva y negativa para neoplasia. El valor promedio de PSA total para los pacientes con biopsia negativa para adenocarcinoma fue 8,2ng/ml, mientras que en los pacientes con biopsia positiva fue 16,2ng/ml (p=0,01) (tabla 3). De forma similar, de los pacientes con biopsia positiva para adenocarcinoma, se realizó el análisis entre el grupo de pacientes con tumores bien diferenciados (Gleason<8) y el grupo con tumores mal diferenciados (Gleason≥8) comparando los valores medios de los diferentes parámetros en cada subgrupo. El valor total de PSA fue 32,6ng/ml en el grupo de tumores mal diferenciados, mientras que los pacientes con tumores bien diferenciados tuvieron un promedio de PSA total de 13,3ng/ml (p<0,001) (tabla 4).
Valores medios de los parámetros para diagnóstico de cáncer
| Variable | Negativos | Positivos | Total | p |
|---|---|---|---|---|
| Edad (años) | 63,8 | 67 | 64,7 | 0,0018 |
| PSA (ng/ml) | 8,2 | 16,2 | 10,5 | 0,01 |
| Aceleración (ng/ml/año) | 0,15 | 0,22 | 0,17 | 0,02 |
| Velocidad (ng/ml/año) | 0,95 | 3,65 | 1,75 | 0,2 |
| Tiempo de duplicación (años) | 53,5 | 18,2 | 43,1 | 0,96 |
| Velocidad relativa (1/mes) | −5,34 | −5,48 | −5,38 | 0,48 |
Valores medios de los parámetros para predicción de tumores mal diferenciados
| Mal diferenciados | Bien diferenciados | Total | p | |
|---|---|---|---|---|
| Pacientes, n | 15 | 84 | 99 | |
| Edad (años), media (intervalo) | 74,8 (61-89) | 65,6 (49-81) | 67 | 0,002 |
| PSA total (ng/ml) | 32,6 | 13,3 | 16,2 | < 0,001 |
| Aceleración (ng/ml/año) | 0,30 | 0,21 | 0,22 | 0,03 |
| Velocidad (ng/ml/año) | 5,6 | 3,3 | 3,65 | 0,03 |
| Tiempo de duplicación (años) | 40,1 | 14,4 | 18,2 | 0,02 |
| Velocidad relativa (1/mes) | −4,47 | −5,67 | −5,48 | 0,91 |
Se realizó un análisis del PSA RC con diferentes puntos de corte de PSAV tanto para diagnóstico inicial como para predicción del grado de diferenciación. La tabla 5 muestra la comparación de los diferentes valores de PSAV estudiados en los diferentes subgrupos.
Para cada una de las pruebas evaluadas, se calcularon sensibilidad, especificidad y razones de verosimilitud positiva y negativa, tanto para diagnóstico de adenocarcinoma de próstata como para predicción de grado de diferenciación. Estos valores se resumen en las curvas ROC. Los valores absolutos de las características operativas mencionadas están disponibles en formato digital a solicitud, por la extensión de los datos.
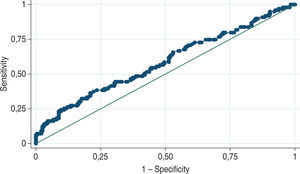
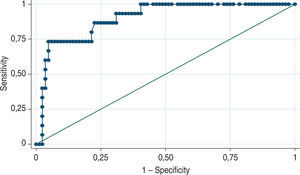
La curva ROC del valor total del PSA mostró un AUC de 0,58 (intervalo de confianza [IC], 0,51-0,65) en el diagnóstico inicial de cáncer (fig. 1). Se encontró que el punto de corte de PSA de 4ng/ml frecuentemente usado tiene una sensibilidad del 95,96% y una especificidad del 6,3%, con un LR+= 1,02, y clasifica correctamente al 32,6% de los casos. Para predecir tumores mal diferenciados, el AUC del PSA total es de 0,90 (fig. 2). Asimismo, se encontró que un punto de corte de PSA de 7,5ng/ml alcanza una sensibilidad del 90% para diagnosticar tumores mal diferenciados, con una especificidad del 59,5% y LR+= 2,3 y LR-=0,11, y clasifica correctamente un tumor como mal diferenciado el 64,6% de las veces.
De igual forma, se obtuvieron las curvas ROC para cada uno de los parámetros calculados de la cinética de PSA. En la tabla 6 se muestra el análisis del AUC de las pruebas evaluadas en el estudio.
Valores del área bajo la curva (AUC) para las pruebas de estudio y de comparación en el análisis bivariable
| Variable | AUC, diagnóstico | AUC, predicción diferenciación |
|---|---|---|
| PSA total | 0,58 | 0,90 |
| Aceleración | 0,57 | 0,67 |
| Velocidad | 0,59 | 0,76 |
| Tiempo de duplicación | 0,50 | 0,32 |
| Velocidad relativa | 0,52 | 0,50 |
| Determinación de riesgo | ||
| PSAV=0,35 | 0,51 | 0,48 |
| PSAV=0,75 | 0,53 | 0,55 |
| PSAV=1 | 0,53 | 0,60 |
| PSAV=2 | 0,54 | 0,66 |
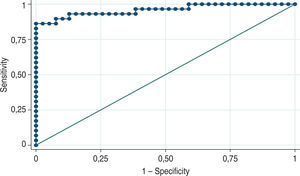
Teniendo en cuenta la distribución de los datos obtenidos, se desarrolló el análisis multivariable a través de una regresión logística para diagnóstico de cáncer. Las variables con relevancia son finalmente la edad y el valor total del PSA (AUC=0,61). Para la predicción de tumores mal diferenciados, el modelo de regresión logística encontró que las variables relevantes son la velocidad relativa del PSA y la determinación de riesgo con punto de corte de PSAV en 0,35ng/ml/año (AUC=0,95) (fig. 3).
DiscusiónEn el presente estudio, se encontró una prevalencia del 29,4% de cáncer de próstata entre los pacientes llevados a biopsia transrectal de próstata, lo cual es similar a la esta dística encontrada en la literatura mundial4,11. Se encontró que el promedio de edad de los pacientes con biopsia positiva era superior a la de los pacientes con biopsia negativa, 67.0 frente a 63,8 años respectivamente, con diferencia estadísticamente significativa, al igual que entre los pacientes con tumores bien y mal diferenciados, con promedios de edad de 65,6 y 74,8 años.
En la población estudiada, se encontró que los pacientes con resultado negativo de la biopsia tenían un valor promedio de PSA total de 8,2ng/ml, comparado con los 16,2 de los pacientes con biopsia positiva (p=0,01). El valor clásicamente establecido de 4ng/ml mostró sensibilidad y especificidad del 95,9 y el 6,3%, respectivamente, para diagnosticar los casos positivos; por lo tanto, dicho valor conserva utilidad en nuestro medio.
En este estudio, entre los pacientes con biopsia positiva para cáncer de próstata se encontró que los tumores mal diferenciados presentaron un valor promedio de PSA total mayor que el de los tumores bien diferenciados, 32,6 frente a 13,3ng/ml, con diferencia significativa, lo cual muestra correlación entre valores de PSA y agresividad tumoral, lo cual ya estaba establecido previamente en la literatura4.
Con estos resultados, se puede afirmar que en la población estudiada existe una diferencia significativa del valor total de PSA entre los casos positivos y negativos para cáncer de próstata, así como una diferencia en los valores de PSA entre tumores mal diferenciados y bien diferenciados.
Al realizar el análisis del AUC de cada uno de los parámetros estudiados de la cinética de PSA y compararlos con el del valor total de PSA, se encontró que únicamente la velocidad de PSA tiene una capacidad superior para diagnóstico de cáncer de próstata, pero con una diferencia marginal, por lo cual es discutible su uso en nuestra práctica clínica. En cuanto a la predicción de tumores mal diferenciados, ningún parámetro estudiado de la cinética de PSA logró superar la capacidad de predicción del valor total de PSA.
El análisis multivariable mediante regresión logística es una herramienta útil para predecir la ocurrencia de un evento. En este trabajo, se creó un modelo multivariable para la predicción de cáncer teniendo en cuenta diversas formas de calcular la cinética. Sin embargo, dichas variables no alcanzan significación estadística y el modelo se limita a considerar la edad y el PSA. Al calcular el valor del AUC de este modelo en el 61% y el del PSA total en el 59%, se encuentra una ganancia marginal. Como consecuencia, el uso de la cinética del PSA no aporta mayor utilidad para su uso en nuestra práctica clínica.
El segundo modelo creado muestra mediante regresión logística que las variables que tener en cuenta son la velocidad relativa y la determinación del riesgo, con punto de corte de PSAV en 0,35ng/ml/año. En este caso, el análisis del AUC del PSA total del 90% pasa al 95% con el modelo descrito. Así se mejora la capacidad de predicción del grado de diferenciación del PSA con relevancia clínica.
Al comparar estos hallazgos con los de la literatura, se encuentra que la PSAV se ha utilizado ampliamente, con resultados a favor que han descrito puntos de corte que podrían predecir el desarrollo de la enfermedad neoplásica y aumentar la especificidad10,13, así como algunos estudios europeos que no han demostrado su utilidad como criterio para llevar a un paciente a biopsia15. Al igual que en el presente estudio, al hacer un análisis general, se puede esta-blecer definitivamente que el incremento de los valores de PSA es mayor entre los casos con cáncer que en los controles sin la enfermedad, pero en la población estudiada no tiene utilidad para el diagnóstico inicial.
A diferencia del grupo de Benecchi et al11, se puede afirmar que en la población estudiada la aceleración del PSA no aporta mejoría en el rendimiento para el diagnóstico inicial de cáncer de próstata ni para predicción del grado de diferenciación al compararla con el valor absoluto de PSA, por lo cual no es útil para reemplazarlo como prueba de tamización.
El PSA DT también es una aproximación antigua, pero que introdujo el concepto del modelo exponencial a la evolución del PSA en el tiempo. Múltiples experiencias se han desarrollado con este principio y han determinado una clara utilidad en el pronóstico del tratamiento, el pronóstico posterior a recaída, el pronóstico de terapias de rescate y finalmente el manejo de terapias hormonales. Experiencias contrarias se encuentran en las aplicaciones para diagnóstico inicial y selección de pacientes para biopsia de próstata16, lo cual es comparable con los hallazgos en la población estudiada.
La determinación de riesgo de la velocidad del PSA es una aproximación nueva, que parte de las características predictivas de la PSAV sobre la biología tumoral. En una experiencia originada en Chicago, Estados Unidos, se encontró asociación entre algunos puntos de corte y el incremento del riesgo de cáncer, y además de encontrar un tumor mal diferenciado, por lo cual proponen que se podría utilizar para reducir el número de biopsias innecesarias y detectar casos de carcinoma de bajo riesgo22. En contraste, en el análisis bivariable de este estudio no se encontró su utilidad en ninguno de los dos casos pero, como ya se mencionó, el análisis multivariable mostró su capacidad de aportar a la predicción del grado de diferenciación, aunque aún se requieren más estudios.
Diferentes estudios han asociado la PSA RV con elementos pronósticos de la enfermedad23,24 pero, por ser un concepto relativamente nuevo, hay escasa experiencia y no se ha valorado en el contexto de diagnóstico inicial de adenocarcinoma.
ConclusionesEl PSA conserva su utilidad en nuestro medio para diagnóstico inicial de cáncer de próstata. Además, según el punto de corte, tiene utilidad en la predicción del grado de diferenciación, lo cual puede ayudar a guiar la decisión de realizar una biopsia de próstata en determinados casos para evitar el sobrediagnóstico de tumores clínicamente no significativos en cierto grupo de pacientes.
La cinética del PSA no logra superar en ningún caso el valor total de PSA, tanto en diagnóstico inicial como en predicción de diferenciación, por lo que no aporta mejor rendimiento como prueba de tamización.
En el presente estudio, la cinética del PSA no mejora la capacidad diagnóstica respecto al valor total del PSA. Sin embargo, permite mejorar la capacidad predictiva del grado de diferenciación tumoral considerando la velocidad relativa del PSA y la determinación de riesgo con punto de corte de PASV en 0,35ng/ml/año.
Nivel de evidenciaIII.
Conflicto de interesesLos autores declaran que no tienen conflicto de intereses.
Fórmulas para calcular parámetros de cinética del PSA
| Parámetro | Fórmulas | Unidades de medida |
|---|---|---|
| Velocidad del PSA (PSAV) | PSAV=(PSA final - PSA inicial) / tiempo en años o PSAV=PSA SLOPE | ng/ml/año10 |
| Tiempo de duplicación del PSA (PSA DT) | PSA DT=ln2 / log PSA SLOPE | Meses16 |
| Aceleración del PSA | = Ln PSA SLOPE Determinación de riesgo de la PSAV (PSA RC) | ng/ml/año11 |
| Velocidad relativa del PSA (PSA RV) | PSA RC=n veces la PSAVPSA RV=ln (y2 / y1) / t2 - t1PSA RV=Ln (1 - PD / 100) / t2 - t1En esta ecuación, y es PSA y t, tiempo | Número absoluto (0, 1 o 2)20Números absolutosPorcentaje de diferencia (PD)Unidades/mes23,24 |
Diseño del estudio: descriptivo de corte transversal.