Introducción
La aparición hace ya casi cincuenta años de los primeros neurolépticos clásicos, produjo una revolución sin precedentes en el tratamiento de la esquizofrenia. Además, su capacidad terapéutica implicaba la existencia de un lugar concreto sobre el que estos fármacos ejercerían su acción, lo que dio pie a plantearse la posibilidad de la existencia de una base biológica para la esquizofrenia. A partir de aquel momento las estrategias se centraron en tratar de encontrar el lugar específico de acción de los neurolépticos, y explorar la posible existencia de alteraciones del mismo en los pacientes esquizofrénicos. Es así como nace la teoría dopaminérgica de la esquizofrenia.
Una de las evidencias farmacológicas que sustentaba la teoría dopaminérgica de la esquizofrenia era que la administración crónica de sustancias dopamina-miméticas como la anfetamina puede conducir a la aparición de ciertos estados psicóticos similares a los descritos en pacientes esquizofrénicos. De este modo el sistema dopaminérgico se convertía en el lugar de acción común tanto de los fármacos neurolépticos como de diferentes sustancias de abuso como la cocaína o las anfetaminas.
Si diversas drogas de abuso actuaban principalmente sobre el sistema dopaminérgico, ¿estarían este sistema o alguna alteración del mismo implicados en los mecanismos de adicción a estas sustancias?. Y si los neurolépticos parecían efectivos en el tratamiento clínico de una disfunción del sistema dopaminérgico, como parecía existir en la esquizofrenia, ¿serían estos fármacos también efectivos en el tratamiento del abuso de algunas sustancias?
Dopamina y consumo de sustancias:La hipótesis dopaminérgica de la adicción
Uno de los factores principales en el desarrollo de las conductas adictivas es la capacidad de diferentes sustancias para actuar como refuerzo positivo sobre el mantenimiento de su administración. A través de este mecanismo fundamental, muchos fármacos son capaces de controlar el comportamiento impulsando a la búsqueda de la droga, que actúa así como recompensa. Diversos estudios han sugerido que el neurotransmisor que media las acciones de estas rutas de recompensa es la dopamina.
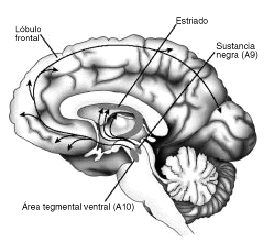
Las dos principales vías dopaminérgicas implicadas en estos circuitos de recompensa son la mesolímbica y la mesocortical (Fig. 1). La vía mesolímbica tiene su origen en el área del tegmento ventral y proyecta al núcleo accumbens, el septo y la amígdala. Por su parte la vía mesocortical partiría también del área del tegmento ventral para terminar en las cortezas prefrontal y entorrinal. La implicación de ambas vías en los procesos de adicción a diversos tipos de sustancias se basa en la existencia de varios hallazgos experimentales. Así, los fenómenos de autoadministración de drogas no se desarrollan o lo hacen en menor grado tras la administración de un neurotóxico como la 6-hidroxidopamina que destruye el sistema mesolímbicocortical. Por contra, la destrucción de otras vías nerviosas de carácter noradrenérgico o serotoninérgico, e incluso la destrucción de vías dopaminérgicas distintas a las anteriores tales como la vía nigroestriada no altera la autoadministración de drogas. Por otra parte, la administración de antagonistas dopaminérgicos como son los fármacos neurolépticos también elimina o disminuye los efectos reforzantes de drogas como la cocaína. Estos hallazgos sugieren la necesidad de que las vías de recompensa estén íntegras para que pueda desencadenarse el proceso adictivo (ver revisión en 1).
Figura 1. Principales vías dopaminérgicas en el cerebro humano.
A nivel celular se ha demostrado que tanto la actividad neurofisiológica de las neuronas dopaminérgicas del área del tegmento ventral como la liberación de dopamina en las áreas de proyección de las vías mesolímbicocorticales están reguladas por las drogas de abuso. Drogas como la cocaína y la anfetamina actúan a través de un efecto directo en los terminales nerviosos de las áreas de proyección. Los efectos reforzantes provocados por la administración de cocaína se deberían al bloqueo de la recaptación de dopamina. De acuerdo con esta hipótesis, la fijación de cocaína al transportador de la dopamina y el consiguiente bloqueo de la recaptación de este neurotrasmisor provocaría una potenciación de la neurotrasmisión en las vías dopaminérgicas de recompensa. Por su parte, tanto la anfetamina como varias drogas de diseño (MDA, MDMA...) también producen un aumento en las concentraciones sinápticas de dopamina, pero en este caso el aumento se debería a una mayor liberación del neurotrasmisor inducida por dichas sustancias.
Los efectos reforzantes de los opiáceos parecen mediarse igualmente a través del sistema mesolímbicocortical, a pesar de que estas sustancias no presentan una actividad farmacológica apreciable sobre los receptores dopaminérgicos. En este caso, la morfina ejercería su acción principalmente en la región somatodendrítica de las neuronas del área del tegmento ventral. En ratas, la administración directa de morfina en el área del tegmento ventral provocaría un aumento de la actividad de las neuronas dopaminérgicas de esta zona, lo que conllevaría un incremento de la liberación de dopamina en las áreas terminales del núcleo accumbens. Este efecto contribuiría a mantener un patrón de autoadministración de morfina por parte de la rata2.
Finalmente, otras sustancias capaces de generar conductas de abuso, como el etanol o la nicotina, provocarían también aumentos de los niveles de dopamina en áreas límbicas. Si bien ambas actúan sobre el área del tegmento ventral, en el caso de la nicotina su activación de las vías dopaminérgicas se produciría también a nivel del núcleo accumbens.
En resumen, las vías mesolímbicocorticales son el punto común para muchos fármacos y drogas de abuso, y desempeñan un papel relevante en los procesos de recompensa relacionados con la aparición de conductas adictivas. En este contexto, la dopamina se convierte en el intermediario funcional capaz de traducir la motivación en acción motora. Esta hipótesis permite explicar algunos fenómenos de interés, tales como la suma de efectos euforizantes de morfina y anfetamina, y desde una perspectiva terapéutica supone que el uso de fármacos que interfieren la transmisión dopaminérgica puede tener un papel importante en el tratamiento del abuso y adicción a drogas.
Hipótesis serotoninérgica de la adicción
Diversos estudios han destacado también el papel que juega la serotonina en la modulación de las rutas de recompensa. Esto ha dado lugar a la aparición de una hipótesis serotoninérgica de la adicción a drogas. Según esta teoría, el sistema de refuerzo positivo dopaminérgico estaría controlado de forma negativa por otro sistema distinto dependiente de la actividad serotoninérgica3. Este sistema serotoninérgico actuaría de forma fisiológica ante la aparición de estímulos de recompensa, tratando de compensar o contrarrestar una respuesta excesiva a los mismos. Así, se ha demostrado que la serotonina dificulta el establecimiento de mecanismos de refuerzo al modular el umbral de sensibilidad o el tiempo y el número de respuestas a los estímulos reforzadores. Por tanto, cualquier alteración que produjera una disminución de la neurotransmisión serotoninérgica, afectaría a este sistema, dando paso a una hiperactividad de las vías dopaminérgicas mesolímbicocorticales, y a la aparición de una conducta compulsiva. En animales de experimentación se ha demostrado que una función serotoninérgica disminuida incrementa la actividad locomotora inducida por la dopamina, aumenta la respuesta ante los estímulos estén o no recompensados, aumenta la ingesta de comida y el comportamiento sexual, y facilita la agresión. Muchos de estos comportamientos se revierten tras un incremento de la función serotoninérgica4.
La serotonina presenta probablemente un papel de neuromodulador de las vías dopaminérgicas mesolímbicocorticales. En este sentido, se ha demostrado la existencia tanto de terminales serotoninérgicos en el área del tegmento ventral, que forman sinapsis con las neuronas dopaminérgicas de proyección5, como de aferencias serotoninérgicas que llegan hasta el núcleo accumbens y la corteza frontal. Estas aferencias serotoninérgicas serían capaces de regular los propios terminales dopaminérgicos5. Este efecto regulador vendría avalado por el hecho de que diversos estímulos que producen un aumento de la actividad dopaminérgica en los circuitos de recompensa, inducen paralelamente una activación del sistema serotoninérgico. De hecho, se ha observado que diversas drogas de abuso como cocaína, anfetamina o etanol producen un incremento de la neurotransmisión serotoninérgica en diversas regiones del sistema mesolímbicocortical. En este sentido, se ha postulado que en el alcoholismo, un posible déficit serotoninérgico sería el responsable de la conducta de búsqueda de alcohol así como del comportamiento agresivo de ciertos alcohólicos. El etanol afectaría la función serotoninérgica en dos fases diferenciadas. Inicialmente, la ingesta aguda de etanol incrementaría la neurotransmisión y activaría las vías de recompensa cerebral. Por el contrario, en la fase de ingesta crónica, el etanol disminuiría la neurotransmisión serotoninérgica, alterando el funcionamiento del sistema de inhibición comportamental y produciendo la aparición de un comportamiento agresivo por parte del alcohólico. En este sentido se ha demostrado que los alcohólicos abstinentes presentan una función serotoninérgica disminuida3, por lo que las intervenciones terapéuticas que producen un incremento de la función serotoninérgica reducen la ingesta de alcohol.
Dentro del sistema serotoninérgico son varios los subtipos de receptores que han sido implicados en esta función de regulación de las rutas de recompensa. Entre ellos, los receptores 5-HT1A desempeñan un papel importante en el desencadenamiento de las conductas reforzadoras6. Estos receptores modulan la actividad de las neuronas dopaminérgicas presentes en zonas claves de las vías de recompensa como son el área del tegmento ventral y el núcleo accumbens. Además, la estimulación de los receptores 5-HT1A produce un aumento de los niveles extracelulares de dopamina en la corteza prefrontal7 así como una atenuación de la acción de la anfetamina sobre la dopamina sináptica8. Por su parte, los receptores 5-HT1B parecen tener una función inhibitoria sobre las conductas de tipo reforzador o impulsivo9.
Los receptores 5-HT2 parecen interaccionar también con el sistema dopaminérgico a distintos niveles. Estos receptores estarían involucrados en una acción inhibitoria de la serotonina sobre las neuronas dopaminérgicas del área del tegmento ventral10. Además la activación de este subtipo de receptores facilita el efecto inhibitorio de la dopamina y la anfetamina sobre estas mismas neuronas11,12, mientras que en el núcleo accumbens disminuirían los efectos de la morfina sobre los niveles de dopamina13.
Por último, diversos estudios han demostrado un claro papel modulador de los receptores 5-HT3 sobre la actividad dopaminérgica mesolímbicocortical14. Los agonistas de los receptores 5-HT3 estimulan la liberación de dopamina y potencian los comportamientos relacionados con la propia dopamina. Por el contrario, los antagonistas 5-HT3 revierten dichos efectos. Además estos antagonistas son capaces también de revertir el efecto de otros estimulantes, indicando la posible implicación de la activación de los receptores 5-HT3 en los estados de hiperactividad de estos sistemas. En este sentido, se ha demostrado que los fármacos antagonistas de los receptores 5-HT3 son capaces de bloquear la preferencia condicionada de lugar provocada por morfina o nicotina15, y que reducen específicamente la ingesta de alcohol en roedores condicionados a preferir esta sustancia16. Por otra parte los antagonistas 5-HT3 son también capaces de reducir el síndrome de abstinencia a opiáceos precipitado por naloxona17.
Neurolépticos clásicos frente a neurolépticos atípicos
Los neurolépticos clásicos antagonizan de manera selectiva y específica todo el espectro de acciones de la dopamina y de los agonistas dopaminérgicos directos o indirectos (apomorfina, anfetamina, etc.), tanto en su expresión conductual como motora. Este antagonismo es consecuencia del bloqueo selectivo, aunque de intensidad variable, de los receptores dopaminérgicos presinápticos y postsinápticos. Los neurolépticos clásicos bloquean todos los subtipos de receptores dopaminérgicos, pero su máxima afinidad se expresa en general por el receptor D2. De hecho se ha demostrado una correlación entre la afinidad de los neurolépticos clásicos por este subtipo y las concentraciones plasmáticas que demuestran eficacia clínica en los pacientes esquizofrénicos18. Esta correlación también se da entre el porcentaje de ocupación de receptores D2 y la aparición de efectos secundarios, particularmente los de tipo extrapiramidal.
Sin embargo, la utilización de los fármacos neurolépticos clásicos pronto empezó a generar problemas debido tanto a la aparición de severos efectos secundarios, principalmente de tipo neurológico, como a la refractariedad al tratamiento de muchos pacientes. Estas limitaciones incentivaron la búsqueda de fármacos alternativos que presentaran mayor eficacia y menos riesgo para el paciente. A partir de dicha investigación surgieron los denominados neurolépticos atípicos.
El primero de los neurolépticos atípicos fue la clozapina, cuyo desarrollo químico se completó en 1958 y que se usó en un ensayo clínico por primera vez en 1961. La propia calificación de «atípico» se debía a que frente al antagonismo principalmente D2 de los neurolépticos clásicos la clozapina presentaba un perfil farmacológico claramente diferente. Así, la clozapina presenta un antagonismo débil sobre los receptores D2, y una afinidad mucho mayor por los receptores D4. Además este fármaco presenta también una alta afinidad por otros receptores como los H1, *1, 5HT1C, 5HT2, o los muscarínicos M1 y M4. Pero la gran aportación de la clozapina era que, al contrario de los neurolépticos clásicos, producía a dosis terapéuticas en humanos una mejoría de los síntomas tanto negativos como positivos de la esquizofrenia produciendo unos mínimos efectos secundarios extrapiramidales. Esta disminución o ausencia de síntomas extrapiramidales durante el tratamiento con clozapina se podía deber al hecho de que a las dosis utilizadas este fármaco ocupa sólo un 65% de los receptores D2, frente a porcentajes superiores al 75% que se producen con los neurolépticos clásicos. Se ha postulado que porcentajes superiores al 75% de ocupación de los D2 podrían ocasionar la aparición de síntomas extrapiramidales lo que explicaría la ausencia de este tipo de síntomas en el tratamiento con clozapina19.
A partir del relativo éxito de la clozapina aparecieron nuevos neurolépticos atípicos (risperidona, sertindol, olanzapina...), y diversos estudios trataron de ahondar en el mecanismo de acción de estos nuevos antipsicóticos y en el porqué de sus ventajas sobre los neurolépticos clásicos. La propia definición de «atípico» se basa en la evidencia clínica de que existe en estos fármacos una amplia diferencia entre la dosis usada para el control de la psicosis y aquella que produce efectos secundarios extrapiramidales. Así mismo, se podría tomar en cuenta también una cierta superioridad clínica de los neurolépticos atípicos sobre los clásicos con relación a determinados aspectos como la eficacia en reducir los síntomas negativos de la esquizofrenia, o en pacientes resistentes al tratamiento20.
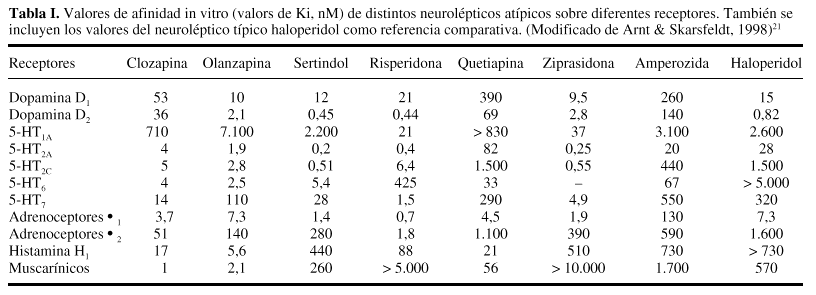
La mayoría de los neurolépticos atípicos comercializados en la actualidad presentan un efecto mixto sobre los receptores para dopamina de la familia D2, los receptores 5-HT2, y los adrenoceptores *1, siempre dentro de un amplio espectro de afinidades sobre el resto de receptores (tabla I)21. Esta característica común a la mayoría de los neurolépticos atípicos es consistente con las teorías que plantean que el balance entre las afinidades por estos receptores sería el responsable de la mejora, respecto a los neurolépticos clásicos, en el ratio entre dosis que producen actividad antipsicótica y las que originan efectos secundarios extrapiramidales21. En concreto, se ha descrito la existencia de una correlación significativa entre el ratio de afinidad por los receptores 5-HT2A/D2 y las propiedades «atípicas» de los nuevos neurolépticos22. Esta combinación de su efecto sobre los sistemas dopaminérgico y serotoninérgico puede, además de ser clave en su mecanismo de acción, convertirlos, al hilo de las teorías de la adicción descritas anteriormente, en fármacos importantes en el tratamiento del abuso de sustancias.
Pero aparte de sus características comunes, los neurolépticos atípicos presentan perfiles propios de afinidad por otros receptores. Así, se ha descrito la existencia de alta afinidad por los receptores D1 (clozapina y olanzapina), 5-HT2C (sertindol, clozapina, olanzapina y ziprasidona), 5-HT6 (clozapina, olanzapina y sertindol), 5-HT7 (clozapina y risperidona), *2 (risperidona), H1 (clozapina, olanzapina, risperidona y quetiapina) o muscarínicos (clozapina y olanzapina)21. Esto deja claro que no se puede hablar de un perfil de afinidades único para todos los neurolépticos atípicos. Además, estos efectos diferenciales de los distintos compuestos tendrán probablemente importancia a la hora de establecer sus propiedades farmacológicas y clínicas, y podrán determinar distintas eficacias e indicaciones en el tratamiento de las adicciones a drogas.
Pero además de la afinidad de los neurolépticos atípicos sobre diferentes receptores, no debe olvidarse la importancia del tipo de efecto que ejercen sobre ellos. Tradicionalmente se ha considerado que los neurolépticos se comportaban cómo antagonistas sobre aquellos receptores sobre los que presentaban alta afinidad. La aparición de los neurolépticos atípicos también ha introducido variaciones en este aspecto. Así se ha visto cómo clozapina y olanzapina presentan actividad como agonistas sobre los receptores muscarínicos M423, mientras que la propia clozapina y la ziprasidona presentan también cierta actividad agonista sobre los receptores 5-HT1A, aunque a concentraciones moderadas/altas24,25. Del mismo modo, se ha demostrado que mientras varios neurolépticos atípicos se comportaban como agonistas inversos sobre los receptores 5-HT2C, tanto humanos como de rata, los neurolépticos clásicos estudiados carecían de dicho efecto26. Esta capacidad como agonista inverso de los neurolépticos atípicos implica que éstos serían capaces no sólo de bloquear el efecto de los neurotransmisores endógenos sobre estos receptores, al modo de los antagonistas clásicos, sino incluso de reducir la propia hiperactividad de los receptores en situación basal.
Neurolépticos atípicos y abuso de sustancias
Esquizofrenia y abuso de sustancias
Uno de los principales puntos de confluencia del consumo de sustancias de abuso y la utilización de fármacos neurolépticos son los propios pacientes esquizofrénicos. Se calcula que la prevalencia del uso de sustancias de abuso entre los esquizofrénicos es del 47%, frente al 16% de la población general27. Además este abuso de sustancias está asociado a un importante aumento de la morbilidad de estos pacientes con frecuentes exacerbaciones de los síntomas, incrementos en la necesidad de hospitalización, peor repuesta al tratamiento e incluso mayor probabilidad de suicidio. Por otra parte, los enfoques terapéuticos clásicos han sido incapaces de modificar el curso de la enfermedad en la mayoría de estos pacientes, que además parecen presentar una pobre respuesta a los neurolépticos típicos28. Sin embargo, se ha demostrado que el uso del neuroléptico atípico clozapina es capaz de reducir el abuso de sustancias entre pacientes esquizofrénicos29.
Una de las explicaciones propuestas para esta gran prevalencia del abuso de sustancias entre los esquizofrénicos es que las drogas ayudarían al paciente a reducir su sintomatología, tanto la producida por la propia enfermedad como la originada como consecuencia de los efectos secundarios de los neurolépticos clásicos. Sustancias como el etanol o la cocaína podrían reducir los síntomas extrapiramidales originados por el antagonismo dopaminérgico de los neurolépticos clásicos. Por contra, los síndromes de abstinencia derivados del abandono del consumo de sustancias como nicotina, alcohol o cocaína, podrían incluso aumentar la vulnerabilidad a la aparición de síntomas extrapiramidales en pacientes esquizofrénicos tratados con neurolépticos clásicos. Es en este contexto donde la introducción de los nuevos neurolépticos atípicos pudiera jugar un papel interesante. De hecho, en el estudio de Zimmet y cols.29, ninguno de los 22 pacientes esquizofrénicos con un diagnóstico concomitante de abuso de sustancias que al inicio del tratamiento estaba en periodo de abstinencia, comenzó de nuevo el consumo durante el periodo de tratamiento con clozapina29.
El alcohol puede reducir la aparición de síntomas extrapiramidales independientemente de sus acciones sobre el sistema dopaminérgico. Este efecto sería producido a través de los receptores GABAérgicos y mediante un antagonismo de los receptores para el N-metil-D-aspartato (NMDA)30. Sin embargo, en los pacientes esquizofrénicos el antagonismo de los receptores de NMDA produce un empeoramiento de los síntomas tanto negativos como positivos. Esta exacerbación de la psicosis originada por los antagonistas NMDA responde mejor a la clozapina que a los neurolépticos típicos31. Del mismo modo, se ha demostrado que el etanol puede también empeorar la sintomatología de los pacientes esquizofrénicos a través de la estimulación de los receptores 5-HT2C32. El hecho de que neurolépticos atípicos como clozapina, sertindol, olanzapina o risperidona presenten una relativamente alta afinidad por los receptores 5-HT2C les hace particularmente beneficiosos en la prevención y el tratamiento de las exacerbaciones psicóticas mediadas por este mecanismo.
A pesar de no generar la misma alarma social que otras drogas de abuso, la cafeína y la nicotina son sustancias habitualmente utilizadas por los esquizofrénicos para tratar de controlar su sintomatología33. En este sentido, los pacientes esquizofrénicos son más propensos a fumar que otro tipo de pacientes psiquiátricos y que la población general. Además ciertos fumadores diagnosticados de esquizofrenia han reconocido utilizar el tabaco para tratar de compensar la aparición de diversa sintomatología como las alucinaciones auditivas o los síntomas extrapiramidales derivados del consumo de neurolépticos clásicos34. Así, se ha demostrado que el tratamiento con el neuroléptico típico haloperidol incrementa significativamente el consumo de nicotina en pacientes esquizofrénicos35, mientras que este consumo disminuye en pacientes tratados con clozapina36. Un estudio realizado sobre pacientes esquizofrénicos demostró que aquellos que eran fumadores experimentaban menos efectos secundarios extrapiramidales que los no fumadores, incluso a pesar de que las dosis de neurolépticos utilizadas en los pacientes fumadores fueron mayores que en los no fumadores37. Este hecho podría también estar relacionado con la constatación de que fumar cigarrillos incrementa el metabolismo de los neurolépticos y por tanto disminuye sus niveles plasmáticos38 pudiendo reducir así la aparición de la sintomatología extrapiramidal. Por otra parte, el consumo de cafeína es también muy elevado entre los pacientes esquizofrénicos33. El consumo de cafeína conjuntamente con la medicación neuroléptica puede producir una reducción en la absorción de ambas sustancias39. Este hecho provocaría que aquellos pacientes esquizofrénicos que consumen grandes cantidades de cafeína durante largos periodos de tiempo experimentaran en menor medida los efectos secundarios asociados a la medicación neuroléptica. Por otro lado, el mecanismo de acción principal de la cafeína parece residir en una interacción entre receptores adenosínicos y receptores dopaminérgicos a nivel de los ganglios basales. La cafeína, y el resto de las metilxantinas se comportarían como antagonistas de los receptores adenosínicos A240. Se ha demostrado que los antagonistas de los receptores de adenosina A2 potencian los efectos motores mediados por agonistas sobre los receptores D241. De este modo la interacción adenosina-dopamina podría ser responsable de que el consumo de cafeína revierta los síntomas extrapiramidales originados por el antagonismo D2 de los neurolépticos.
Otros de los posibles inductores del abuso de sustancias entre los pacientes esquizofrénicos son los estados disfóricos42. En este sentido se ha demostrado, por ejemplo, que el consumo de cafeína se incrementa en pacientes esquizofrénicos cuando el distrés acompañado de síntomas como la tensión y la depresión aumentan33. Por tanto, aquellos fármacos capaces de reducir la disforia serían serios candidatos a atenuar el abuso de sustancias entre los pacientes esquizofrénicos. Los neurolépticos atípicos pueden también jugar un papel importante en este terreno. Así, la clozapina no sólo parece tener también efectos de naturaleza ansiolítica43, si no que su probada eficacia en el tratamiento de pacientes esquizoafectivos sugiere la necesidad de evaluar con más detenimiento la posibilidad de alguna acción como antidepresivo44. En el mismo sentido, algunos datos sugieren que otros neurolépticos atípicos como la olanzapina, pudieran tener también efectos antidepresivos45. Concretamente, se ha demostrado que el tratamiento combinado de olanzapina y fluoxetina produce un incremento de los niveles de dopamina y noradrenalina extracelulares significativamente mayor que el de ambos fármacos por separado46. Por contra, la combinación de fluoxetina y haloperidol no produjo un incremento de monoaminas superior al de la fluoxetina sola46.
Otra de las teorías que trata de explicar la gran prevalencia del abuso de sustancias entre los esquizofrénicos plantea que ésta se debería a que los pacientes esquizofrénicos presentan una vulnerabilidad genética al abuso de sustancias. Diversas evidencias indican que la esquizofrenia está en mayor medida asociada con una historia familiar de abuso de sustancias, y que los pacientes que cuentan con dichos antecedentes familiares son más vulnerables a desarrollar una politoxicomanía47. Sin embargo, un estudio realizado en esquizofrénicos alcohólicos y sus gemelos demostró una falta de correlación entre ambos diagnósticos en los gemelos, a pesar de que la existencia de ambas patologías fue más común entre gemelos monocigóticos que entre dicigóticos48.
Otro rasgo que se ha postulado puede influir en la vulnerabilidad al abuso de sustancias en pacientes esquizofrénicos, es la personalidad antisocial42. La personalidad antisocial se ha asociado en los adictos, entre otras cosas, a un comienzo más temprano del abuso, a una mayor severidad de la adicción y a la existencia de comorbilidad psiquiátrica. En los pacientes alcohólicos que presentan rasgos de personalidad antisocial y un comienzo temprano de la adicción, el sistema serotoninérgico parece implicado en los problemas de autocontrol, déficits cognitivos y abuso de sustancias que presentan49. En estos pacientes diversas evidencias parecen sugerir que la estimulación de los receptores 5-HT2C contribuiría tanto al propio consumo como al deseo de beber50. La capacidad de varios neurolépticos atípicos para bloquear los receptores 5-HT2C podría ser de interés en el tratamiento de estos pacientes.
En pacientes esquizofrénicos la búsqueda de nuevas sensaciones se ha asociado con el uso de alcohol, cannabis y nicotina51. Así mismo, este rasgo se ha relacionado en pacientes alcohólicos con los alelos del receptor de dopamina D452. Dado que algunos neurolépticos atípicos presentan una alta afinidad por los receptores D4, y que en el caso de la clozapina ésta es claramente más potente sobre los receptores D4 que sobre los D253, estos fármacos podrían ser de utilidad en el tratamiento de la adicción en este tipo de pacientes.
En resumen, son muchos tanto los componentes asociados como los múltiples mecanismos neurobiológicos implicados en el abuso de sustancias en pacientes esquizofrénicos. En este contexto, diferentes datos avalan la posibilidad de que los neurolépticos atípicos puedan jugar un papel determinante en el tratamiento de estos pacientes, máxime cuando es indudable su ventaja sobre los neurolépticos clásicos desde la perspectiva de hipótesis como la de la automedicación.
Psicoestimulantes
Todos los psicoestimulantes comparten la diana de su acción farmacológica, la formación reticular del tronco del encéfalo, y más concretamente los sistemas de neurotransmisión de monoaminas. Es allí donde estas sustancias ejercen sus acciones principales y donde parecen localizarse los sistemas funcionales involucrados en su potencial adictivo. Como se ha comentado anteriormente, los sistemas dopaminérgicos mesolímbico y mesocortical son los considerados de mayor interés en cuanto al mecanismo de acción de los psicoestimulantes en relación con los fenómenos de dependencia motivacional54. En este sentido, tradicionalmente se ha considerado que psicoestimulantes como la cocaína o la anfetamina mediaban sus propiedades reforzadoras a través de un incremento de la dopamina en este circuito mesolímbicocortical. Dicho incremento produciría cambios bioquímicos dramáticos que llegarían a modificar el comportamiento del consumidor. Estudios realizados en animales knock-outs carentes de la proteína transportadora de la dopamina han demostrado la implicación de estos transportadores tanto en las propiedades reforzadoras como en los cambios bioquímicos y comportamentales inducidos por cocaína o anfetamina55. Sin embargo, a pesar de carecer del transportador de dopamina y de tener unos niveles extracelulares de la misma muy elevados, paradójicamente estos animales se siguen autoadministrando cocaína56. El mapeo de los lugares de unión de la cocaína y de la activación neuronal sugieren una implicación de regiones cerebrales serotoninérgicas en esta respuesta56. Es en este punto donde la capacidad de los neurolépticos atípicos de actuar no sólo sobre el sistema dopaminérgico, como en el caso de los clásicos, sino también sobre otros sistemas, como por ejemplo el serotoninérgico, pueden concederles ciertas ventajas en el tratamiento de la adicción a psicoestimulantes. De hecho, se ha demostrado que el tratamiento con neurolépticos clásicos es capaz de reducir la paranoia pero no la euforia producida por el consumo de cocaína57. Esta disociación entre la euforia y la paranoia producida por sustancias psicoestimulantes, implicaría quizás diferencias en los sustratos neurobiológicos que median ambos estados y podría explicar la aparente ventaja de los neurolépticos atípicos sobre los clásicos en el tratamiento de las adicciones a psicoestimulantes.
Los modelos de autoadministración o preferencia de plaza condicionada a sustancias en animales representan un abordaje válido para valorar los efectos reforzantes de diferentes tipos de drogas de abuso. En este contexto, mientras se ha demostrado repetidamente que la mayoría de los neurolépticos clásicos incrementan la autoadministración de sustancias psicoestimulantes en animales58, existen datos contradictorios respecto al efecto que los neurolépticos atípicos provocan sobre los efectos reforzantes de los psicoestimulantes. Mientras algunos autores han descrito que la clozapina aumenta la autoadministración de cocaína59, otros por el contrario mantienen que la disminuye58. Por otra parte, también se ha descrito que el tratamiento con clozapina atenúa el desarrollo de una preferencia de plaza condicionada a cocaína60, lo que indicaría que es capaz de disminuir los efectos reforzadores de la cocaína. Las bases farmacológicas de este efecto de la clozapina podrían ser atribuidas a uno o más de los siguientes efectos. En primer lugar la clozapina presenta afinidad por varios subtipos de receptores cerebrales de dopamina, aunque su afinidad por el subtipo D2 es relativamente baja. Dado que la clozapina atenúa los efectos sobre el comportamiento producidos por los fármacos agonistas de los receptores D1, es probable que sus efectos comportamentales sean mediados, en parte, a través de su acción sobre dichos receptores. En segundo lugar, la clozapina presenta afinidad por diversos receptores de serotonina. Su acción sobre los receptores 5-HT1C y 5-HT2, podría estar también relacionada con este efecto. Y finalmente, la clozapina posee acciones adrenérgicas, histaminérgicas y colinérgicas que pudieran contribuir de alguna manera a la atenuación del desarrollo de una preferencia condicionada a cocaína60.
La olanzapina, por su parte, parece ser capaz tanto de atenuar la preferencia de plaza condicionada a cocaína, como de disminuir, de una manera dosis dependiente, la autoadministración de cocaína en ratas61. Además, la olanzapina sería de tres a cuatro veces más potente que la clozapina bloqueando la preferencia de plaza condicionada a cocaína61. Estos datos sugieren que la olanzapina sería capaz de bloquear efectivamente las propiedades reforzadoras de la cocaína. Otro neuroléptico atípico, el sertindol, es también capaz de bloquear la preferencia de plaza condicionada a cocaína y metanfetamina62.
En conjunto, los resultados anteriores parecen sugerir que el antagonismo mixto sobre receptores de dopamina y serotonina que presentan ciertos neurolépticos atípicos podría resultar efectivo para reducir los efectos reforzantes de sustancias estimulantes como la cocaína. Sin embargo, mientras se ha descrito que el tratamiento con risperidona disminuye el deseo de cocaína en un grupo de pacientes en fase de abstinencia63, otro estudio no encontró una reducción en el uso de cocaína en adictos tratados también con risperidona64.
Etanol
El alcohol etílico o etanol constituye la segunda droga psicoactiva más utilizada en el mundo después del café. El etanol parece afectar a la transducción de señales activadas por hormonas o neurotransmisores, desarrollando cambios a corto plazo en la regulación de las funciones celulares y a largo plazo en la expresión génica. Los mecanismos implicados en los efectos del etanol en el ámbito central aún no han sido claramente determinados. Sin embargo, parece claro que esta sustancia interacciona de forma específica con los principales sistemas de neurotransmisión, incluyendo el dopaminérgico y el serotoninérgico.
Las psicosis alcohólicas representan una importante complicación en el alcoholismo crónico. Las dos psicosis alcohólicas más comunes son la alucinosis alcohólica y el delirium asociado al síndrome de abstinencia a alcohol. La psicopatología de la alucinosis alcohólica se asemeja a la de la esquizofrenia paranoide, y por ello en los casos agudos se recomienda habitualmente el tratamiento con neurolépticos65. Sin embargo, en el caso de los neurolépticos clásicos, la aparición de disquinesias, parkinsonismo o acatisia puede obligar a la suspensión del tratamiento, máxime cuando una historia de abuso o dependencia a alcohol se ha demostrado como factor de riesgo para la aparición de disquinesias tardías inducidas por neurolépticos66,67. De ahí que la utilización de neurolépticos atípicos pueda plantearse como una alternativa.
El neuroléptico atípico tiapride parece ser efectivo tanto en el manejo del síndrome de abstinencia en alcohólicos, como en el mantenimiento del paciente en el posterior periodo de rehabilitación68. Esta efectividad podría ser debida a la baja propensión a la aparición de síntomas extrapiramidales durante su empleo. Curiosamente, la incidencia de efectos secundarios de tipo extrapiramidal en pacientes tratados con tiapride es incluso menor en aquellos con una dependencia crónica a alcohol que en el resto68.
Opiáceos
Los opiáceos, al igual que otras drogas de abuso, son capaces de actuar sobre el sistema mesolímbicocortical, incrementando la liberación de dopamina en zonas como el núcleo accumbens. Sin embargo, hay razones para pensar que los efectos reforzadores de los opiáceos pueden ser mediados tanto por un mecanismo dependiente de dopamina como por otro mecanismo independiente de este neurotrasmisor1. Datos experimentales apuntan la posibilidad de que la manipulación del sistema serotoninérgico pudiera modificar el consumo de opiáceos.
El sertindol es capaz de abolir completamente la preferencia de plaza condicionada a morfina en ratas62. Este efecto del sertindol podría ser debido en parte a su potente acción antagonista sobre los receptores 5-HT2, dado que otro antagonista selectivo 5-HT2 como la ritanserina es también capaz de atenuar la preferencia de plaza condicionada producida por morfina y fentanilo69. Por otra parte se ha demostrado que, al igual que la mayoría de los neurolépticos atípicos, la administración crónica de sertindol es capaz de inactivar preferentemente las neuronas dopaminérgicas del área del tegmento ventral70. Además, su administración aguda no revierte, al contrario que clozapina y haloperidol, la inhibición de la frecuencia de descarga de las neuronas dopaminérgicas del área del tegmento ventral, inducida por d-anfetamina70.
Otro dato importante a tener en cuenta es la posibilidad de interacción entre los opiáceos y los neurolépticos atípicos. Se ha descrito que la administración de risperidona a pacientes con dependencia a opiáceos es capaz de desencadenar un síndrome de abstinencia71. Este efecto podría deberse a que la risperidona fuera capaz de acelerar el metabolismo de los opiáceos mediante la inducción del sistema enzimático microsomal. Sin embargo, el rápido comienzo de la sintomatología no apoyaría esta hipótesis. Alternativamente la risperidona podría también alterar la absorción de los opiáceos, su distribución, o incluso desplazarlos de su unión a proteínas plasmáticas. Pero aparte de estas interacciones de tipo farmacocinético también cabe la posibilidad de que los efectos serotoninérgicos de la risperidona contribuyan a este fenómeno. En este sentido, se ha observado que cambios en los niveles de serotonina podrían ser un factor implicado en las alteraciones fisiológicas y/o psicológicas asociadas al síndrome de abstinencia a opiáceos72.
Agradecimientos
Durante la realización de este trabajo, los autores han sido financiados, en parte, por la Universidad del País Vasco/Euskal Herriko Unibertsitatea (proyecto UPV/EHU G13/98). L.F. Callado desarrolla su actividad mediante una beca postdoctoral de investigación del Gobierno Vasco.