Introducción
Los estudios de neuroimagen estructural, sobre todo la tomografía cerebral (TC) y la resonancia magnética estructural (RME), han venido aportando información sobre el daño cerebral inducido por el alcoholismo y otras drogodependencias, desde los años 70.
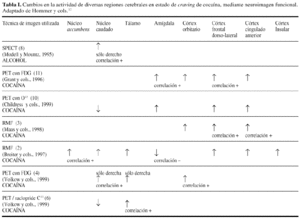
Durante la década de los 90, la irrupción de múltiples técnicas de neuroimagen funcional, como la tomografía por emisión de positrones (PET), o la de emisión de fotones (SPECT) y las nuevas técnicas de resonancia magnética, tanto la funcional (RMF), como la espectroscópica (RMS), han permitido un avance decisivo en el conocimiento de las respuestas de activación y desactivación de determinadas estructuras o regiones cerebrales, en situaciones características de las drogodependencias, como son los estados de administración aguda o de abstención continuada de alcohol o cocaína, que en general se acompañan de una disminución de la perfusión sanguínea y del metabolismo cerebral global. Así como también durante los estados de abstinencia aguda o de craving inducido por estímulos condicionados, que suelen estar asociados a un aumento de la perfusión sanguínea y del metabolismo cerebral, por lo menos en determinadas estructuras que componen el llamado circuito fronto-estriado-talámico, que parece estar implicado en el craving y la conducta de búsqueda de la sustancia, de la cual se tiene dependencia.
De esta manera podemos empezar a relacionar la activación de determinadas estructuras cerebrales con respuestas cognitivas, emocionales, motivacionales y conductuales; que son características de los estados de intoxicación aguda, abstiencia aguda, craving, urgencia por consumir, etc. Por ejemplo, los patrones de activación cerebral asociados a las respuestas de craving, que han sido provocadas mediante la exposición a estímulos condicionados, no son exactamente iguales que los que han sido inducidos por la administración de la propia sustancia psicotrópica. Por tanto se trata de dos estados de activación diferenciables que tal vez deberían ser identificados con una denominación distinta.
Por otro lado, la utilización de rediofármacos, marcadores específicos de determinados receptores o transportadores y la RM funcional permiten profundizar en el estudio del funcionalismo de determinados sistemas de neurotransmisión, de gran relevancia en las drogodependencias, como son los sistemas dopaminérgico, serotonérgico y gabérgico.
Finalmente, la RM espectroscópica, permite visualizar tanto la distribución del alcohol en el cerebro, como la presencia de determinadas moléculas que suelen aparecer en estados de lesión cerebral y representan un nuevo método para evaluar las lesiones inducidas por las sustancias psicotrópicas, mucho antes de que se manifiesten en forma de alteraciones estructurales del cerebro, pero en paralelo con las sutiles alteraciones neuropsicológicas que ya aparecen desde las primeras etapas de consumo de determinadas sustancias, como los psicoestimulantes.
Administración aguda de sustancias
Administración aguda de cocaína
La administración aguda de cocaína produce una disminución global del metabolismo de la glucosa cerebral, que podría estar relacionada con la activación del sistema dopaminérgico meso-telencefálico1. La magnitud del cambio metabólico en la amígdala derecha parece seguir una correlación negativa con lo agradable de su efecto y con la intensidad de la respuesta subjetiva.
La baja sensibilidad a los efectos euforizantes de la cocaína, en los abusadores que tienen los ventrículos agrandados, podría ser un reflejo de la patología de las regiones periventriculares, en las cuales se encuentran las estructuras y los circuitos neuroanatómicos mediadores de dichos efectos reforzadores.
Craving inducido por la administración de cocaína o metilfenidato
Tras la administración de cocaína, se ha detectado un aumento de la oxigenación hemática cerebral (BOLD) en los núcleos accumbens, caudado y córtex insular, y una disminución de dicha oxigenación hemática cerebral en la amígdala2.
La RMF permite obtener muchas imágenes durante un breve período de tiempo y hacer por tanto, un seguimiento paso a paso de los cambios en la actividad cerebral. La tasa de oxigenación hemática cerebral (BOLD), tras la administración de cocaína, correlaciona positivamente con un pico de activación y un rápido descenso a los niveles previos y va en paralelo con la sensación subjetiva de euforia. El craving correlaciona positivamente con una activación sostenida de los núcleos accumbens, caudado, tálamo, córtex frontal dorso-lateral y cingulado anterior y negativamente con la amígdala2.
Mediante RMF, Maas y cols.3 sólo han detectado activación de la parte anterior de la circunvolución del cíngulo y del córtex prefrontal dorso-lateral y sólo la activación de la circunvolución del cíngulo (anterior) alcanzó la significación estadística.
La administración intravenosa de metilfenidato induce una activación del metabolismo cerebral de la glucosa en la circunvolución del cíngulo anterior, tálamo derecho y cerebelo. Además, la activación del córtex fronto-orbitario derecho y búcleo caudado derecho correlacionaron positivamente con el craving de cocaína4.
Farmacocinética de la cocaína y metilfenidato. Efecto reforzador
La cocaína es una de las drogas de abuso que producen un mayor efecto reforzador, el cual parece estar relacionado con su capacidad para bloquear los transportadores de dopamina (TDA) y para aumentar las concentraciones de dopamina en las sinapsis del núcleo accumbens. Se requiere un bloqueo mínimo del 50% de los TDA para conseguir dicho efecto euforizante, pero además, si el bloqueo es lento, como sucede con el metilfenidato, no se acompaña del efecto euforizante.
La intensidad del efecto reforzador inducido por metilfenidato correlaciona con los niveles de dopamina liberada, lo cual ha sido medido de manera indirecta, a través de la captación de raclopride por parte de los receptores dopaminérgicos D2 en el estriado. Un antagonista competitivo de dichos receptores, que puede ser desplazado por el ligando endógeno, la dopamina, cuando su concentración en la sinapsis es elevada. De hecho, la ocupación de los receptores D2 es un mejor predictor de la intensidad del efecto euforizante que los niveles de bloqueo del transportador de dopamina. Tanto la cocaína como el metilfenidato serían más reforzadores en una persona con baja captación de raclopride, que podría ser debida a bajos niveles de receptores D2; mientras que las personas con elevada captación de raclopride pueden sentir un efecto desagradable de sobrestimulación por los psicoestimulantes5.
Administración aguda de alcohol o benzodiazepinas
Los pacientes alcohólicos presentan una disminución del flujo sanguíneo cerebral (FSC) y del metabolismo energético en el córtex cerebral y el cerebelo, tras la administración de tres consumiciones de alcohol, que puede ser más intensa en el cerebelo y acompañarse de un incremento del flujo sanguíneo regional en el córtex prefontal y temporal derecho, cuando la dosis es de siete consumiciones.
Los pacientes alcohólicos presentan una mayor respuesta metabólica tras la administración aguda de alcohol, pero la respuesta subjetiva de intoxicación está disminuida. Esta oposición entre la respuesta metabólica y conductual, en los alcohólicos podría ser el reflejo de la tolerancia del cerebro a los cambios metabólicos inducidos por el alcohol6.
La activación de los receptores GABA puede contribuir a los efectos de intoxicación aguda del alcohol y también al desarrollo de su dependencia. Los pacientes alcohólicos presentan un aplanamiento de la respuesta de reducción del metabolismo energético cerebral, tras la administración de Lorazepam, en el tálamo, ganglios basales y córtex órbito-frontal; que iría en paralelo con la disminución de la función del receptor GABA en pacientes alcohólicos. Puede ser consecuencia de cambios en el metabolismo del cerebelo, que afectarían al circuito que regula el inicio y finalización de las conductas, que se podrían manifestar como disminución del control inhibitorio sobre la conducta y que podrían estar relacionadas con la dificultad para controlar el consumo de alcohol, que caracteriza dicha conducta adictiva.
Esta respuesta aplanada a las benzodiazepinas podría ser consecuencia del alcoholismo, o también un rasgo genético asociado a una mayor vulnerabilidad para el desarrollo del alcoholismo, que podría discurrir en paralelo a la respuesta conductual y psicofisiológica aplanada al alcohol de las personas que tienen antecedentes familiares de alcoholismo y, por tanto, un mayor riesgo de desarrollar dicha enfermedad. Además, este grupo de población de riesgo para el alcoholismo presenta un menor metabolismo cerebeloso, en estado basal. Todo ello puede reflejar una disfunción de los receptores GABA del cerebelo que podría justificar una menor sensibilidad a los efectos del alcohol y las benzodiazepinas sobre la función motora, en las personas con antecedentes familiares de alcoholismo6.
Administración aguda de nicotina
La resonancia magnética funcional permite identificar las regiones neuroanatómicas que se activan por la nicotina. Tras la administración intravenosa de nicotina se produce una activación del córtex frontal (dorsolateral, orbitario y frontal medial) y también de la circunvolución del cíngulo. Se ha propuesto que dichas regiones podrían estar implicadas en los efectos conductuales y de alteración del ánimo que produce la nicotina7.
Administración aguda de cannabis
Durante la intoxicación por marihuana se ha encontrado una activación predominante de regiones cerebrales derechas, una imagen parecida a la que se produce durante el craving de alcohol, que se ha asociado con aumentos del FSC en el caudado del hemisferio derecho. Además, se produce una activación cerebelosa (mediante PET con FDG) que va en paralelo con las alteraciones en la coordinación motora y la propiocepción8 y que podría estar en relación con el hecho de que el cerebelo tiene una elevada concentración de receptores para el THC.
Craving inducido por estímulos condicionados
Activación y craving
La tomografía por emisión de fotones (SPECT) con HMPAO (99mTc), en nueve pacientes con dependencia del alcohol, a los que se les había inducido un estado de craving, ha encontrado un aumento del flujo sanguíneo cerebral (FSC) en la cabeza del núcleo caudado derecho, existiendo una correlación entre el grado de aumento del FSC y la intensidad del craving, lo cual sugiere un papel funcional del estriado límbico en la mediación del craving y de la pérdida de control sobre el consumo de alcohol. Sin embargo, los pacientes alcohólicos tenían la opción de ingerir pequeñas cantidades de su bebida preferida (hasta 0,03 g/Kg), con lo cual se podría considerar que además del efecto craving, debido a la exposición a su bebida preferida, podría estar jugando también algún papel un cierto efecto priming debido a la posibilidad de ingesta de una pequeña cantidad de alcohol.
Una explicación alternativa sería que el aumento del FSC en la cabeza del núcleo caudado derecho podría reflejar el intento del sujeto para inhibir el impulso a beber, que habría sido disparado por el craving, el cual podría ir acompañado de la sensación subjetiva de capacidad para resistirse a la bebida9.
Dado que el craving de alcohol, inducido por estímulos condicionados, se asocia a una activación de los córtex prefrontal dorso-lateral, temporal anterior, ínsula y órbito-frontal, además de las estructuras límbicas subcorticales, se ha postulado que dichas regiones podrían ser también correlatos neuroanatómicos del craving de alcohol.
Craving de cocaína
En los pacientes dependientes de cocaína, el nivel de craving subjetivo parece estar en relación con el grado de incremento del metabolismo en el córtex prefrontal dorso-lateral y temporal medial (mediante PET con FDG).
Mediante resonancia magnética funcional (RMF), mientras se hallaba contemplando un vídeo, los abusadores de cocaína presentaban un aumento del FSC en la amígdala, córtex cingulado anterior y disminución del FSC en los núcleos caudado y pálido, en comparación a los sujetos control.
Los estímulos condicionados al consumo de cocaína pueden disparar estados de craving, en los pacientes dependientes, que se acompañan de una activación límbica que se manifiesta por un aumento del FSC en la amígdala y la circunvolución cingulada anterior y de una disminución del FSC en los ganglios basales, mediante PET. Por tanto, la activación límbica sería un componente del craving de cocaína, inducido por estímulos condicionados10.
Los agentes anti-craving que ejerzan una acción de bloqueo de los receptores dopaminérgicos del sistema límbico, como los antagonistas dopaminérgicos, podrían reducir la respuesta de craving inducida por estímulos condicionados Pero el aplanamiento afectivo y motivacional que inducen algunos de ellos contribuye a un bajo cumplimiento, por parte del paciente.
En un estudio efectuado con PET se detectó un incremento de la actividad metabólica en el córtex prefrontal dorso-lateral y en región medial del lóbulo temporal, tras la exposición a estímulos condicionados, relacionados con cocaína11.
En otro estudio efectuado con la técnica de activación funcional dependiente del nivel de oxigenación de la sangre (DNOS), que pertenece a un tipo de resonancia magnética funcional, se ha comprobado que los niveles de craving auto-referidos por dependientes de cocaína, expuestos a estímulos condicionados, correlacionan con la activación del córtex cingulado anterior y prefrontal dorso-lateral izquierdo, en comparación a personas no drogodependientes. La resonancia magnética funcional (RMF) proporciona una elevada resolución espacial y temporal. Como ventajas sobre PET o SPECT, la RMF no requiere trazadores radiactivos, por tanto, resulta menos invasiva y se puede repetir varias veces en una misma persona, en diferentes momento evolutivos de su drogodependencia3.
Estructuras cerebrales implicadas en el craving de cocaína
Los estudios de neuroimagen con abusadores de cocaína han identificado estructuras cerebrales implicadas en el craving. Los que inducen craving mediante la administración de cocaína refieren una aumento de la actividad del tálamo, mientras que los que utilizan estímulos condicionados visuales reportan aumento de la actividad del córtex frontal dorso-lateral, que se suele activar con las tareas relacionadas con memoria de trabajo (almacenamiento de información a corto plazo) y memoria episódica (evocación de secuencias de acontecimientos pasados) debido a que el craving incentivo, basado en estímulos sensoriales, requiere la activación de determinados circuitos de memoria, lo cual no sucede con el craving inducido por la propia droga, que quizá sería más acertado llamar priming.
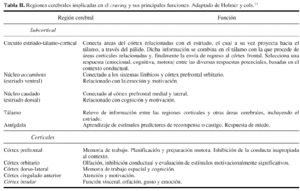
Las estructuras activadas por el craving, es decir, los núcleos caudado, accumbens, tálamo, amígdala, córtex orbitario, córtex frontal dorso-lateral, córtex cingulado anterior y córtex insular; forman parte del llamado circuito estriado-talámico-cortical, que estaría implicado en funciones emocionales, motivacionales y de conducta social.
El córtex insular está relacionado con las funciones viscerales, tales como alimentación y emoción. El córtex cinculado anterior está implicado en la regulación de la atención y emoción y puede ser especialmente importante para el prendizaje de asociaciones entre determinados estímulos y recompensas. La amígdala es un relevo de información sobre estímulos asociados a la recompensa que se dirigen hacia el córtex orbitario12 (tabla II).
La amígdala es una estructura que tiene una importancia decisiva para el aprendizaje de relaciones entre los estímulos biológicamente relevantes (comida, compañeros sexuales, dolor, etc.) y las señales relacionadas con ellos. En estudios animales se ha comprobado que juega un papel similar en el procesamiento de señales relacionadas con cocaína. La circunvolución cingulada anterior comparte conexiones recíprocas con la amígdala y juega un papel importante en la respuesta emocional y en la atención selectiva. Ambas estructuras están vinculadas anatómicamente con el núcleo accumbens, una región cerebral importante para las propiedades reforzadoras de la cocaína y para la recompensa natural en animales. Dichas estructuras permiten al organismo no sólo experimentar el placer de la recompensa, sino también aprender las señales anunciadoras que anticipan la recompensa y que pueden ser de gran importancia para la supervivencia individual o de la especie. Durante los estados de craving, inducidos por estímulos condicionados, el drogodependiente se siente apasionadamente arrastrado por un estado emocional visceral y experimenta un incentivo para actuar muy focalizado que en aquel momento no le permite recordar las consecuencias negativas del consumo de aquella droga10.
El cerebelo, aunque está implicado en la psicomotricidad, puede intervenir también en las propiedades reforzadoras de los reforzadores naturales y de las sustancias psicotrópicas. Tiene conexiones con regiones límbicas cerebrales y su activación podría estar directamente relacionada con la recompensa cerebral. Tanto los psicoestimulantes como el cannabis pueden producir activación del cerebelo, que ha sido asociada a estados de craving, inducidos por cocaína.
El córtex fronto-orbitario procesa información sobre estímulos reforzadores y aversivos y estaría implicado en los cambios de conducta, cuando se producen modificaciones de las características reforzadoras de dichos estímulos. También se ha relacionado con la expectación del estímulo condicionado, que puede ser percibida conscientemente como craving. Las lesiones en la región fronto-orbitaria comportan déficits conductuales parecidos a las lesiones del estriado, resultando en perseveración y resistencia a la extinción de las conductas asociadas a la recompensa. Se ha comprobado que dicha patología es patente en la región fronto-orbitaria y el estriado de los pacientes con trastorno obsesivo-compulsivo. La activación del córtex fronto-orbitario y del estriado por metilfenidato, en pacientes dependientes de cocaína, podría ser uno de los mecanismos por los cuales la cocaína elicita craving y la subsiguiente administración compulsiva de la sustancia (4), que pueden llevar a la recaída a un paciente en curso avanzado de recuperación.
Efectos de la naltrexona sobre la actividad cerebral
La manipulación farmacológica del sistema opioide endógeno, altera el consumo de alcohol en animales de laboratorio, de manera que los agonistas opioides, a dosis bajas, aumentan el consumo de etanol y a dosis elevadas lo disminuyen. Mientras que los antagonistas disminuyen el consumo de alcohol, a través de una disminución de su valor reforzador positivo.
El etanol, a través de un efecto indirecto de activación de determinados receptores opioides, produce liberación de dopamina en el núcleo accumbens, lo cual está implicado en el craving y la conducta de búsqueda de alcohol. Dicho efecto puede ser revertido por naltrexona, al igual que el fenómeno de la interrupción forzada, o el del estrés incontrolable, que producen un incremento del consumo de alcohol.
En un estudio efectuado en el Hospital de Sant Pau de Barcelona, se ha utilizado el SPECT de perfusión cerebral con HMPAO (99mTc), para evaluar los efectos de la naltrexona. Se han practicado un SPECT basal y otro tras haber tomado 150 mg de naltrexona a 16 pacientes dependientes del alcohol, una vez finalizado el tratamiento de desintoxicación, en régimen de hospitalización completa.
En el SPECT basal, los pacientes alcohólicos presentaban un menor flujo sanguíneo cerebral (FSC) en el córtex fronto-orbitario y prefrontal, que los sujetos control, lo cual podría estar en relación con el menor rendimiento cognitivo que presentan los pacientes alcohólicos durante la primera quincena, tras haber dejado de beber.
Tras la administración de naltrexona, los pacientes alcohólicos presentaban una disminución del FSC, en los ganglios basales (bilateral) y en la región temporal mesial izquierda; en comparación a su SPECT basal. Por tanto, tras la administración de naltrexona se produciría una reducción de la actividad metabólica, en regiones ricas en receptores opioides, que además están implicadas en la memoria emocional y en los aspectos obsesivo-compulsivos del craving13.
Es decir, que el efecto anti-craving de la naltrexona, en pacientes alcohólicos, podría estar asociado a una reducción del FSC en ganglios basales y estructuras límbicas (como la amígdala), situadas en la región temporal mesial, de manera parecida al efecto que produce el tratamiento con ISRS, o bien terapia cognitivo-conductual, en el paciente obsesivo-compulsivo.
Retirada de sustancias
Abstinencia aguda de cocaína
La abstinencia aguda de cocaína (menos de una semana), en pacientes dependientes, se ha asociado a un incremento de la tasa metabólica en el córtex orbito-frontal y en los ganglios basales, mientras que a las dos a las cuatro semanas después de la retirada de cocaína se produce una recuperación de la tasa metabólica normal, mediante PET con FDG. Se ha sugerido que estos elevados niveles de metabolismo cerebral en los ganglios basales y córtex fronto-orbitario pueden ser consecuencia de una menor actividad dopaminérgica cerebral14.
Otros estudios han confirmado que durante la abstinencia temprana (7-20 días después de la retirada de cocaína) se produce un aumento de la tasa metabólica en el córtex órbito-frontal y en ganglios basales. Dicho hipermetabolismo frontal tiende a disminuir en el córtex frontal a partir de las cuatro semanas de abstinencia de cocaína, aunque persiste elevado durante unos tres a cuatro meses después de haber dejado de tomar cocaína1.
Además, tras el consumo crónico de cocaína se produce una disminución de receptores dopaminérgicos D2 que está asociada a la disminución de metabolismo en la circunvolución del cíngulo y en el córtex órbito-frontal. Volkow y cols.5, postulan que este sería uno de los mecanismos de alteración dopaminérgica que conducirían al consumo compulsivo de cocaína y a su dependencia. La dopamina, en los circuitos frontales, está implicada en el control de las conductas repetitivas e impulsivas. Los dependientes de cocaína presentan cambios neuroquímicos que pueden ser el trasfondo neurobiológico de su incapacidad para controlar los impulsos que les arrastran a consumir la droga y que podrían explicar las recaídas.
Por otro lado, los abusadores de cocaína presentan una disminución de la liberación de dopamina, que asociada a la reducción de receptores D2 puede resultar en una disminución de la activación de los circuitos de recompensa cerebral por los reforzadores fisiológicos, contribuyendo a generar el estado de «necesidad» de administrarse cocaína para compensar dicho déficit5.
Abstención continuada de cocaína
Estudios efectuados con pacientes dependientes de cocaína han encontrado déficits en la perfusión sanguínea de los córtex parietal, temporal, frontal y de los ganglios basales, aunque ni la cantidad ni la frecuencia del consumo previo de cocaína estaban asociados al número ni al tamaño de dichos defectos focales de perfusión pero sí lo estaba el consumo de alcohol asociado15. Los déficits de perfusión serían más frecuentes en los pacientes con dependencia asociada de alcohol u opioides que en los que sólo presentaban dependencia de cocaína. El alcaloide cocaetileno, por asociación del metabolismo de ambas sustancias, potenciaría los efectos cardio-vasculares de la cocaína, alcanzando tasas más elevadas y persistentes de elevada frecuencia cardíaca y presión arterial. Por tanto el abuso de alcohol, en el contexto de la dependencia severa de cocaína puede predisponer al desarrollo de los citados déficits de perfusión.
Strickland y cols.,16 lo confirmaron hasta seis meses después del cese del consumo, lo cual sugiere una persistencia de dichos déficits en el FSC. Los tests neuropsicológicos reflejaron déficits de atención, memoria, formación de conceptos, flexibilidad mental y desinhibición, es decir, dificultades para inhibir conductas inapropiadas.
Diversos mecanismos podrían contribuir a los citados defectos de perfusión sanguínea. Dosis elevadas de cocaína pueden producir vasoconstricción cerebral severa y persistente, con déficits de perfusión que pueden incluso inducir muerte neuronal. Por otro lado las plaquetas de los consumidores crónicos de cocaína se encuentran parcialmente activadas y cualquier estímulo puede producir la liberación de gránulos que contribuyen a la agregación plaquetaria y a la formación de trombos en los vasos sanguíneos cerebrales de pequeño calibre17.
Retirada del alcohol
Tras la retirada del alcohol se ha detectado una disminución de la tasa metabólica cerebral y una reducción del flujo sanguíneo en diversas regiones cerebrales, que han sido relacionados con los déficits cognitivos asociados a esta primera etapa de la recuperación del alcoholismo y que tenderían a su renormalización durante la 3.ª y 4.ª semanas de abstención de alcohol. Además se produciría una reducción de receptores pero no de transportadores dopaminérgicos en el estriado y también de receptores GABA18.
Los efectos de la administración de alcohol o benzodiazepinas a pacientes dependientes del alcohol o poblaciones de riesgo de alcoholismo, han permitido progresar en el conocimiento del sustrato neurobiológico de la intoxicación y la tolerancia al alcohol y a las benzodiazepinas. Las personas con antecedentes familiares de alcoholismo presentan una mayor vulnerabilidad hacia el desarrollo de dependencia del alcohol y posiblemente también de benzodiazepinas. En el futuro, las alteraciones detectadas mediante neuroimagen con activación por fármacos, podrían ser utilizadas como marcadores biológicos de rasgo, para la identificación de población de riesgo, sobre la cual se podría efectuar una verdadera prevención primaria del alcoholismo5,19.
El funcionalismo de los receptores GABA también ha sido relacionado con una mayor vulnerabilidad para el desarrollo del alcoholismo, incluso con una posible correlación genética, dado que algunos estudios apuntan a una respuesta menos intensa de dichos receptores, tras la administración de benzodiazepinas, tanto en pacientes alcohólicos19, como en hijos e hijas de pacientes alcohólicos.
La resonancia magnética espectroscópica, que permite evaluar determinados neurotransmisores ampliamente distribuidos en el cerebro, como el GABA20, tendría la ventaja sobre las técnicas nucleares (PET o SPECT) que no requiere la administración de isótopos radiactivos, permitiendo repetir la exploración varias veces en un mismo paciente. Además, la resonancia magnética espectroscópica permite visualizar también el espectro del etanol en el cerebro, que permanece en forma libre, disuelto en los fluidos intra y extra-celulares, pero no de las moléculas de etanol, unidas a la membrana celular. Dado que la tolerancia al alcohol se asocia a una mayor cantidad de etanol libre, el espectro del etanol consigue un pico más elevado cuando la tolerancia está aumentada, permitiendo evaluar por tanto, no sólo la farmacocinética y la distribución del etanol en la sustancia gris o blanca, sino también, el grado de tolerancia al alcohol de la persona explorada.
También se ha utilizado la administración de fármacos, como naltrexona en pacientes alcohólicos13, para estudiar los cambios funcionales de regiones y estructuras cerebrales implicadas tanto en los efectos reforzadores de la administración de alcohol, como en los efectos terapéuticos de dichos fármacos.
Por otro lado, los estudios con radioligandos específicos, que enlazan con determinados receptores o transportadores cerebrales, han permitido evaluar el funcionalismo de determinados sistemas de neurotransmisión, como el dopaminérgico, serotonérgico o GABAérgico.
El funcionalismo del receptor dopaminérgico D2, que los estudios genéticos relacionaron inicialmente con la dependencia del alcohol y posteriormente también con la de otras sustancias y con un posible síndrome por déficit de recompensa; ha sido también estudiado por las técnicas de neuroimagen con radiofármacos. Algunos autores postulan que los pacientes alcohólicos podrían presentar menor densidad de receptores D2, en comparación a la población general21, o también que una mayor densidad de receptores D2 podría predecir un mayor riesgo de recaída precoz, en los pacientes que inician la recuperación de la dependencia del alcohol22.
Determinados indicadores de un posible déficit de serotonina cerebral han sido asociados a conducta impulsivo-agresiva y a un alcoholismo de inicio más precoz, tanto en humanos como también en primates que sufrieron un estrés ambiental en su desarrollo precoz y que presentaban rasgos conductuales de mayor agresividad y menor sensibilidad a la intoxicación inducida por alcohol23.
Mediante SPECT se ha detectado una reducción en la captación de ß-CIT (123I) por parte del transportador de serotonina, en el tronco cerebral, donde se encuentran los núcleos del rafe, ricos en cuerpos celulares y lugares de recaptación de serotonina. Todo ello apoyaría la hipótesis de la disfunción serotonérgica asociada al alcoholismo y a los trastornos afectivos y de ansiedad que suelen acompañarle23.
Tras la desintoxicación se produce una recuperación del metabolismo cerebral, sobre todo en córtex parietal y frontal, durante la segunda quincena después de la retirada del alcohol. Los pacientes de más edad y con una historia más prolongada de abuso de alcohol presentaron una tasa metabólica cerebral más baja, comparados a los sujetos control. A los 60 días puede persistir una baja tasa metabólica en los ganglios basales.
Parece, por tanto, que la renormalización del metabolismo cerebral se produce durante la segunda quincena de tratamiento; siendo el córtex frontal la región que presenta un mayor incremento del metabolismo, tras la desintoxicación; lo cual podría ir en paralelo con la recuperación neuropsicológica del paciente. La persistencia de una baja tasa metabólica en los ganglios basales, durante el 2.º mes de tratamiento, podría estar en relación con el llamado síndrome de abtinencia retardada, que cursa con trastorno del sueño y/o craving, y que ha sido relacionado con un riesgo aumentado de recaída, para determinados pacientes, sobre todo durante los tres primeros meses de recuperación24.
Exploración del funcionalismo de los receptores y transportadores cerebrales
Alcoholismo
Receptores dopaminérgicos D2 en el alcoholismo
Los pacientes alcohólicos presentan una menor captación de raclopride, tras abandonar el consumo de alcohol. Sin embargo, no presentaron diferencias en cuanto a la disponibilidad del transportador de dopamina21.
Mediante SPECT con yodobenzamida (IBZM) (123I), antagonista específico de los receptores D2, no se han encontrado diferencias en la captación de IBZM entre pacientes alcohólicos y los sujetos control, en el estriado; pero sí entre pacientes que recaen y los que no han recaído, durante los tres primeros meses de recuperación, una vez finalizada la desintoxicación del alcohol.
Al evaluar 21 pacientes dependientes del alcohol, (comparados con nueve sujetos control), se ha comprobado que los pacientes que tuvieron una recaída, a lo largo de los 3 primeros meses de recuperación, presentaban una mayor captación de IBZM (123I), en el estriado, que los pacientes que no recayeron durante dicho período.
Estos resultados sugieren que bajos niveles de dopamina en las sinapsis del estriado, o bien una mayor densidad de receptores dopaminérgicos D2, podrían estar relacionados con la recaída precoz en los pacientes alcohólicos. Por tanto, el SPECT con IBZM (123I) podría llegar a convertirse en un marcador biológico de vulnerabilidad hacia la recaída precoz, para los pacientes alcohólicos que se encuentran en recuperación22.
Descripción del SPECT
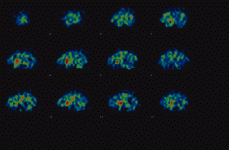
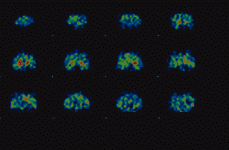
El SPECT, o Tomografía Computarizada por Emisión de Fotón Simple, es una técnica de neuroimagen funcional que utiliza la emisión de fotones gamma, similares a los utilizados en las gammagrafías convencionales. El trazador se fija en el tejido cerebral y se obtienen múltiples imágenes planares del cerebro, desde todos los ángulos posibles. El ordenador reconstruye las imágenes tomográficas, siguiendo los ejes (Fig. 1) sagital (Fig. 2), coronal (Fig. 3) y transversal, también llamada axial u oblicua.
Figura 1. SPECT con yodobenzamida. Sagital.
Figura 2. SPECT con yodobenzamida. Coronal.
Figura 3. SPECT con yodobenzamida. Oblicua.
Los tomógrafos que utilizan 2 ó 3 cabezales de gammacámara consiguen imágenes de mayor calidad, con una resolución morfológica de 8-10 mm.
SPECT con yodobenzamida IBZM [I123]
La iodobenzamida marcada con yodo123, un antagonista del receptor dopaminérgico D2, análogo del raclopride, se utiliza como ligando o trazador de los neurorreceptores dopaminérgicos D2.
El SPECT con IBZM [123I] se ha utilizado para evaluar la ocupación de receptores D2, en el tratamiento neuroléptico de la psicosis, en el tratamiento con L-DOPA de la enfermedad de Parkinson y en el diagnóstico diferencial de síndromes parkinsonianos, coreas y ataxias. El SPECT proporciona imágenes de hipocaptación en la enfermedad de Huntington y en los pacientes tratados con antipsicóticos; normocaptación en la enfermedad de Parkinson no tratada y ligera hipocaptación en el Parkinson tratado con L-DOPA. Además, con el aumento de la edad del sujeto explorado, se ha encontrado una disminución progresiva de la densidad de receptores D2, relacionada con el deterioro cognitivo y motor de la persona.
Tras la inyección endovenosa, el trazador o ligando se distribuye por todo el cerebro (fase de unión no específica) y las imágenes iniciales son similares a las del SPECT de perfusión, posteriormente el radiofármaco se fija al receptor, de manera específica. Cuando la proporción del ligando unido específicamente es igual a la que queda libre es el momento óptimo para la adquisición de las imágenes del SPECT, ya que la diferencia de captación específica/no específica será máxima. Finalmente se pasa a la fase de lavado en la que el ligando, tras disociarse del receptor, retorna al torrente circulatorio y será metabolizado y eliminado.
Las imágenes, recogidas durante 30 minutos (unos 90 minutos después de la administración del radiofármaco), permiten efectuar una valoración cualitativa y también cuantitativa, mediante un índice de captación que se obtiene al comparar la región de unión específica, el estriado, con alguna otra región de unión no específica.
La medición se efectúa mediante índices de captación comparativos de dos regiones de interés, como por ejemplo estriado/frontal, o bien estriado/occipital. Cuando se produce hipocaptación de IBZM, por parte de los receptores D2, el estriado aparece con colores menos vivos y se aprecia además captación difusa en otras regiones cerebrales. Sin embargo, cuando se produce hipercaptación, el radiofármaco yodobenzamida se concentra casi exclusivamente en el estriado, el cual aparece en colores más calientes como anaranjado y rojo, incluso con algún punto blanco de máxima captación del radiofármaco.
Receptores GABA en el alcoholismo
La administración crónica de etanol induce una disminución de la neurotransmisión GABAérgica y un incremento de la glutamatérgica, que contribuyen a la hiperexcitabilidad neuronal y a las crisis convulsivas, que pueden aparecer durante el síndrome de abstinencia del alcohol y que puede persistir durante las primeras semanas de recuperación del paciente, en forma de síndrome de abstinencia retardada o prolongada.
Mediante neuroimagen se han detectado bajos niveles de GABA en el córtex cerebral de pacientes alcohólicos desintoxicados, lo cual sugiere una posible alteración de los sistemas GABAérgicos en pacientes alcohólicos20. Los alcohólicos tipo II de Cloninger presentan una disminución del volumen de distribución de receptores GABA-benzodiazepínicos (BZD) en la región cingulada anterior, córtex prefrontal y cerebelo, probablemente debida a una disminución de la densidad de dichos receptores; lo cual estaría de acuerdo con estudios post-mortem y podría ser un indicador, tanto del efecto tóxico del alcoholismo sobre dichos receptores, como de una mayor vulnerabilidad para el desarrollo del alcoholismo.
Los hijos de padres alcohólicos presentan un mayor riesgo para el alcoholismo, una menor sensibilidad al alcohol y a las benzodiazepinas y también una respuesta menos intensa, de disminución del metabolismo cerebral de la glucosa, en regiones fronto-subcorticales y cerebelosas, después de la administración de 2 miligramos de lorazepam19.
También se ha detectado una disminución de la neurotransmisión inhibitoria, debido a una alteración del circuitos que enlazan el cerebelo con el tálamo, ganglios basales y córtex fronto-orbitario, que podría estar asociado a una alteración de la neurotransmisión GABA. Dicha disfunción inhibitoria podría estar relacionada con la dificultad en el inicio y la finalización de determinadas conductas y, por tanto, con las conductas compulsivas y la pérdida de control.
Todo ello sugiere una vulnerabilidad compartida tanto para la dependencia del alcohol, como de las benzodiazepinas, en hijos de pacientes alcohólicos que vendrían a confirmar los hallazgos genéticos recientes relacionan la menor sensibilidad al alcohol y también al diazepam, con un polimorfismo del gen de la subunidad *6 del receptor GABA-BZD, que podría estar relacionado con el abuso tanto de alcohol como de benzodiazepinas y que podría ser incluso transmitido genéticamente.
Transportador de dopamina en pacientes alcohólicos
Utilizando el SPECT con el radiofármaco ß-CIT (123I), que permite investigar la distribución y densidad de los lugares de recaptación de dopamina, se ha comprobado que la densidad del transportador de dopamina estaba disminuida en los alcohólicos no violentos y aumentada en los alcohólicos violentos, en comparación a los controles sanos. Parece, por tanto, que ambos tipos de alcohólicos presentan alteraciones en el sistema dopaminérgico estriatal, aunque en direcciones opuestas. Sin embargo Volkow y cols.21, mediante PET, no detectan alteraciones en la densidad del transportador de dopamina, aunque sí una disminución de receptores D2.
La captación de ß-CIT (123I) aparece también aumentada en el estriado, tanto en el síndrome de la Tourette, como durante la abstinencia aguda de cocaína, apoyando la hipótesis de una disregulación de la función dopaminérgica presináptica, en la misma dirección que la que podrían presentar también los alcohólicos violentos; mientras que en la enfermedad de Parkinson la función del transportador de dopamina aparece disminuida, debido a una reducción del número de neuronas dopaminérgicas.
Transportador de serotonina en el alcoholismo
Diversos estudios sugieren que una posible disfunción serotonérgica puede aumentar la vulnerabilidad biológica hacia la dependencia del alcohol. Entre los jóvenes varones, los rasgos de personalidad antisocial y una menor sensibilidad para la intoxicación alcohólica pueden predecir el subsiguiente abuso y dependencia del alcohol.
Un bajo nivel de ácido 5-hidroxi-indol-acético (5HIAA) en líquido cefalorraquídeo (LCR) ha sido asociado a conducta agresiva y alcoholismo de inicio precoz y se ha sugerido que el factor patogénico en la dependencia del alcohol sería la capacidad funcional disminuida de los transportadores de serotonina.
En pacientes alcohólicos recientemente desintoxicados, se ha encontrado una reducción de la captación de ß-CIT (123I) en la región dorsal del tronco cerebral, donde se encuentran situados los núcleos del rafe, ricos en cuerpos celulares y lugares de recaptación de serotonina23.
Abuso de cocaína
Receptores dopaminérgicos D2
La cocaína inhibe la función del transportador de dopamina, evitando su recaptación y facilitando su acumulación en el espacio sináptico, lo cual puede inducir una regulación descendente de los receptores dopaminérgicos, como neuroadaptación al estado de excesiva estimulación.
Los estudios con animales han confirmado la regulación descendente de los receptores post-sinápticos D1 pero no de los D2. Algún estudio de neuro imagen, mediante PET ha encontrado una reducción de los receptores D2, durante la abstinencia aguda de cocaína, pero no ha sido confirmado por otro estudio, mediante SPECT con yodobenzamida (IBZM), en pacientes dependientes de cocaína que habían permanecido abstinentes.
Transportador de dopamina
Los estudios de neuroimagen, mediante SPECT con ß-CIT, un análogo a la cocaína, han encontrado un aumento de los lugares de enlace al transportador de dopamina (TDA) del estriado, durante la abstinencia aguda de cocaína. No se trata de un aumento de la afinidad del transportador de dopamina sino de un incremento del número de lugares de enlace en las neuronas dopaminérgicas, a pesar del aparente menor número de terminales dopaminérgicos totales.
Otros autores han detectado una reducción del número de lugares de enlace para el transportador de dopamina en el córtex prefrontal de los abusadores de cocaína, sin embargo, el alcoholismo comórbido podría contribuir a dicha reducción de los lugares de enlace para el transportador de dopamina21.
Transportador de serotonina
Se ha encontrado un aumento de captación de ß-CIT (mediante SPECT) por parte del transportador de serotonina, en el tronco cerebral y diencéfalo, lo cual apoya el papel de la serotonina (además del de la dopamina), en los cambios neuroadaptativos, debidos al consumo de cocaína. Dicho aumento de lugares de enlace al transportador de serotonina parece tener correlación inversa con la edad, lo cual podría explicar la baja respuesta a los inhibidores de recaptación de serotonina de algunos pacientes ancianos que presentan depresión. El referido aumento de captación de ß-CIT, durante la abstinencia aguda de cocaína, no puede ser atribuible a un posible abuso de alcohol asociado, ya que los pacientes alcohólicos presentan más bien una disminución de la captación de ß-CIT25.
Alteraciones estructurales y lesión neuronal
Alteraciones estructurales en el alcoholismo
La atrofia cerebral es una posible consecuencia del abuso de alcohol, inhalantes, corticoesteroides y ácido valproico. Estudios efectuados con abusadores de múltiples drogas, mediante resonancia magnética estructural (RME), han encontrado una mayor amplitud del tercer ventrículo, y del vermis cerebeloso, pero únicamente la severidad del abuso de alcohol pudo ser correlacionada con dichos índices de atrofia cerebral, tras haber tenido en cuenta el efecto de la edad.
El consumo excesivo y continuado de alcohol puede inducir un deterioro cognitivo, que tiene una etiología multifactorial, ya que además de los propios efectos neurotóxicos del etanol, intervienen los déficits nutricionales y vitamínicos, las alteraciones electrolíticas, los estados de abstinencia aguda de alcohol, la hepatopatía alcohólica asociada, la edad y el sexo de la persona, determinados factores genéticos y las interacciones con otras drogas18.
El déficit cognitivo progresa lentamente y algunos estudios consideran que puede empezar a manifestarse cuando la persona ha ingerido más de 1.000 Kg de etanol, a lo largo de su vida. Se detecta mediante la evaluación neuropsicológica y puede estar asociado a una reducción del volumen del cerebro pero puede ser reversible, por lo menos de manera parcial. La resonancia magnética y la tomografía cerebral sugieren una ligera relación entre la intensidad del consumo de alcohol y la dilatación del tercer ventrículo26.
El grado de atrofia cerebral es mayor en función de la edad del paciente, pero no parece estar en relación con su grado de deterioro neuropsicológico, evaluado mediante la exploración psicométrica. Además, se ha comprobado que la intensidad de la atrofia cerebral puede revertir con la abstención continuada de bebidas alcohólicas. Parece, por tanto, que la atrofia cerebral de la TC es una medida poco sensible del grado de deterioro del paciente alcohólico, siendo más fiable la exploración psicométrica del rendimiento cognitivo del paciente.
Las técnicas de neuroimagen estructural coinciden en el hallazgo de una pérdida del tejido cerebral difusa. Los hombres ancianos parecen más vulnerables a los efectos tóxicos del alcohol sobre el cerebro, particularmente en los lóbulos frontales, en comparación a los jóvenes y las mujeres parecen más vulnerables que los hombres. Las crisis convulsivas por abstinencia, los déficits nutricionales y otros trastornos médicos asociados al alcoholismo (traumatismos cráneo-encefálico, alteraciones cerebro-vasculares, etc.) parecen agravar el daño cerebral inducido por el consumo excesivo de alcohol. Se han detectado alteraciones de los cuerpos mamilares, hipocampo y cuerpo calloso; así como reducción en el tamaño de determinadas estructuras cerebrales sin que el paciente presentara signos de encefalopatía. Los déficits estructurales en el cerebelo y en el tálamo, han sido relacionados con alteraciones del equilibrio y en el sentido del olfato, respectivamente.
Tras cuatro semanas de abstinencia de alcohol determinadas áreas del cerebro tienden a su recuperación. Períodos de abstinencia más prolongados (tres meses) se han asociado a una recuperación adicional, como la reducción del volumen del tercer ventrículo. La sustancia blanca parece ser especialmente vulnerable a la lesión, cuando el paciente recae y reinicia el consumo de alcohol, tras un período previo de abstención.
Entre los síntomas que pueden estar asociados a las diversas encefalopatías alcohólicas destacan la ataxia de extremidades inferiores y la alteración del equilibrio, que pueden estar asociadas a una atrofia cerebelosa y a la atrofia cerebral generalizada. En la encefalopatía de Wernicke se ha comprobado la atrofia de los cuerpos mamilares, mediante resonancia. La Mielinolisis central pontina, que afecta la sustancia blanca cerebral de la base de la protuberancia, y que parece estar asociada a malnutrición, alteraciones electrolíticas y una rápida corrección de la hiponatremia. La enfermedad de Marchiafava-Bignami, caracterizada por la desmielinización o necrosis del cuerpo calloso y de otras estructuras cerebrales, puede afectar también a pacientes no alcohólicos, al igual que ocurre con el síndrome de Wernicke-Korsakoff, debido a déficits vitamínicos18.
El ensanchamiento de los ventrículos laterales y del tercer ventrículo, así como de los surcos y cisuras cerebrales, signos indirectos de atrofia cerebral, secundarios al consumo excesivo de bebidas alcohólicas, parecen ser reversibles cuando el paciente deja de beber de manera continuada. Otras alteraciones estructurales asociadas al alcoholismo serían la atrofia cerebelosa, la reducción del tamaño de estructuras como el hipocampo o los cuerpos mamilares, implicadas en los trastornos amnésicos y la reducción del tamaño del cuerpo calloso, tanto en pacientes alcohólicos, como en el síndrome alcohólico fetal26.
Los cambios estructurales que se observan en los pacientes alcohólicos, del tipo disminución del tamaño del cerebro, debido a una atrofia cortical, y ensanchamiento de los ventrículos cerebrales, van en paralelo al grado de disminución del metabolismo energético. Pero sólo la disminución del metabolismo del lóbulo frontal, mediante PET, correlaciona con el rendimiento en los tests de planificación y de memoria a corto plazo y no en cambio los cambios estructurales que se aprecian en la resonancia magnética6.
Espectro del alcohol en el cerebro
El alcohol aparece en forma de un triple pico, a la derecha del espectro de la resonancia magnética, dejando a su izquierda los picos de otras moléculas, (como colina, creatinina, N-acetilaspartato); y se distribuye en dos compartimentos. El alcohol del compartimento libre se encuentra disuelto en los fluidos intra y extracelulares, presenta un tiempo de relajación más prolongado y es visible en el espectro como el pico más elevado. El alcohol del otro compartimento lo constituyen las moléculas de etanol que están unidas a las membranas celulares y tiene un tiempo de relajación más corto, no siendo visible en el espectro de la resonancia magnética.
Las personas que presentan una elevada tolerancia al alcohol, tienen menos moléculas de etanol ligadas a las membranas celulares, tal vez por una mayor rigidez de dichas membranas y más cantidad de etanol en el compartimento libre. Por ello su espectro presenta un pico del alcohol más elevado.
Además se puede estudiar también el efecto de tolerancia aguda, entre una y dos horas después del consumo de alcohol. De hecho los signos de intoxicación aguda son mayores durante la fase ascendente que durante la descendente de la curva de alcoholemia, debido al desarrollo de dicha tolerancia aguda al etanol.
Al comparar el espectro del alcohol en la sustancia blanca y gris se aprecia que el pico del espectro del alcohol es más elevado en la sustancia gris que en la blanca y cuando se utiliza la opción de imagen espectroscópica, la señal del alcohol es mayor a lo largo de la línea media, entre ambos hemisferios, entorno a la sustancia gris cortical.
Alteraciones estructurales en el abuso de cocaína
Se ha detectado una correlación entre la duración del abuso de cocaína y la amplitud máxima de las astas frontales de los ventrículos laterales, sugiriendo una relación dosis-efecto.
Los resultados preliminares del estudio BADACO, sobre la atrofia cerebral y sus consecuencias funcionales, apuntan a que el abuso crónico de cocaína induce atrofia cerebral que se asocia a disfunción cognitiva y electrofisiológica. Sugieren que la base patogénica para la atrofia sería la isquemia cerebral y sus consecuencias son parcialmente reversibles, mediante la abstinencia de cocaína. Los estudios con SPECT han encontrado déficits de perfusión cerebral en los abusadores de cocaína, pero con frecuencia, no aparecen asociados a la atrofia cerebral, detectada mediante RME o bien tomografía cerebral.
Los estudios efectuados en dependientes de cocaína, mediante resonancia magnética estructural (RME) y tomografía cerebral (TC), han reportado un aumento de la relación entre la anchura de los ventrículo y la de todo el cerebro (llamada tasa ventrículo-cerebral) (Pascual-Leone y cols., 1991; Morgan y cols., 1993). También se han encontrado lesiones cerebrales debidas a un accidente vascular cerebral que puede haber pasado desapercibido.
Cambios patológicos tisulares, debidos a neurotoxicidad del abuso de cocaína, pueden inducir un aumento del contenido de agua en los tejidos cerebrales que pueden hacerse evidentes mediante un enlentecimiento del tiempo de relajación transverso (T2) de la RME. También pueden aparecer pequeñas imágenes hiperintensas que corresponden a lesiones del estriado, en los cortes coronales, que corresponden al terriotorio de las ramas antero-laterales de las arterias cerebrales media y anterior, que con frecuencia presentan hemorragias en los pacientes dependientes de cocaína.
La neurotoxicidad del abuso de cocaína sobre los ganglios basales puede manifestarse a través de síntomas clínicos sutilies, como déficit de concentración o memoria27 o trastornos motores extrapiramidales persistentes, como los movimientos coreo-atetoides, conocidos entre los adictos como «baile del crack»28.
Lesión neuronal en el abuso de cocaína
Se han detectado alteraciones persistentes en los lóbulos frontales de cocainómanos abstinentes, con disminución de los compuestos N-acetilados en la sustancia gris, indicador de lesión neuronal en el córtex frontal, debido al consumo de cocaína y también aumento de la concentración de mioinositol en sus lóbulos frontales, que serían indicadores de proliferación glial. Dicho incremento de la actividad glial implica un proceso reactivo en el cerebro y ha sido detectado también en otras encefalopatías.
Es decir, que el consumo crónico de cocaína está asociado con lesión neuronal, que se caracteriza por una disminución de compuestos N-acetilados en el córtex frontal y por activación glial (aumento de mioinositol) tanto en la sustancia gris, como blanca frontales, que serían más acusados en los hombres; mientras que las mujeres presentaban un mayor incremento de mioinositol en la sustancia blanca frontal. Por tanto, existen diferencias regionales y entre sexos, con referencia a la concentración de los citados metabolitos cerebrales29.
Estos hallazgos estarían también en concordancia con la disminución de receptores dopaminérgicos, asociada a hipometabolismo en los lóbulos frontales, encontrada en otros estudios7.
Déficits neuropsicológicos en correlación con neuroimagen
Existen dos amplias categorías de alteraciones neuropsiquiátricas en la dependencia de cocaína. Por un lado están los trastornos afectivos y de ansiedad, como el trastorno por crisis de angustia, que puede persistir años después de haber dejado de tomar cocaína. Por otro lado están los déficits cognitivos, detectados hasta 18 meses después de retirar la cocaína, con dificultades en las tareas que requieren concentración y memoria reciente y alteraciones en tareas motoras, que sugieren síntomas parkinsonianos27.
Los pacientes que presentaban un déficit en la perfusión cerebral mostraron también un deterioro neuropsicológico en diversos tests, sobre todo en aprendizaje espacial y organización. Por tanto, no parece que exista una correlación precisa pero sí que se produce una asociación entre el deterioro psicológico en memoria y concentración y la presencia de múltiples déficits de perfusión cerebral. Además, la exploración neuropsicológica dio cuenta de déficit de atención, memoria, formación conceptual, flexibilidad mental y dificultades para inhibir las conductas inapropiadas, lo cual recibe el nombre de desinhibición conductual, asociado a déficits del FSC (SPECT), que persistían seis meses después de haber abandonado el consumo de cocaína, lo cual sugiere que dichos déficits pueden ser persistentes o permanentes16.
Conclusiones y orientaciones futuras
Los estudios de neuroimagen funcional, que evalúan el metabolismo cerebral de la glucosa, han comprobado que la administración aguda de sustancias psicotrópicas (como alcohol o cocaína), suelen producir una disminucióin global del metabolismo cerebral. Sin embargo, la administración aguda de cocaína o metilfenidato, en personas con dependencia de cocaína, puede inducir estados de craving, que pueden estar acompañados de la activación metabólica de la mayoría de estructuras subcorticales (como los núcleos caudado, accumbens, tálamo) y corticales (como el córtex prefrontal, orbitario, dorso-lateral y cingulado anterior), que constituyen el llamado circuito córtico-estriado-talámico.
El craving de cocaína inducido por estímulos condicionados, en pacientes dependientes de cocaína, se ha asociado a un aumento del flujo sanguíneo cerebral (FSC) en la amígdala y el córtex cingulado anterior, pero también a una disminución del FSC en ganglios basales.
Tras el cese del consumo continuado de cocaína, en abusadores de dicha sustancia, se produce un aumento del metabolismo en córtex frontal orbitario y ganglios basales, durante la fase de abstinencia aguda, que tiende a renormalizarse hacia las cuatro semanas de abstención de cocaína, asociado a una disminución de receptores dopaminérgicos D2 y a una disminución de la liberación de dopamina.
Una vez finalizado el tratamiento de desintoxicación, los pacientes dependientes del alcohol suelen presentar una disminución general del metabolismo y del FSC, asociados a déficits cognitivos característicos de la primera etapa de la recuperación, que tienden a renormalizarse durante la tercera y cuarta semanas de abstención de bebidas alcohólicas.
El abuso continuado de alcohol puede inducir déficits cognitivos, como dilatación de los ventrículos cerebrales, retracción del parénquima cerebral y atrofia cerebelosa; mientras que el abuso continuado de cocaína puede producir déficits de perfusión cerebral que persisten hasta 6 meses después de la retirada de cocaína; junto con signos de lesión cerebral, debidos a algún accidente vascular cerebral que puede haber pasado desapercibido y una correlación entre déficits neuropsicológicos y las áreas cerebrales que presentan una perfusión cerebral alterada.
En el futuro, la investigación sobre neuroimagen podría orientarse hacia las tecnologías de imagen funcional, que asociadas a mediciones conductuales (cuestionarios de craving, inventarios de estado de ánimo, reactividad a estímulos); o bien, paradigmas de auto-administración, o de activación (mediante la administración de fármacos); ayudarían a perfilar los circuitos neuroanatómicos y bioquímicos asociados al refuerzo o al craving inducidos por sustancias psicotrópicas. Tal vez determinados radiofármacos permitirán caracterizar los procesos neuroquímicos (de síntesis y liberación de neurotransmisores y densidad de receptores y transportadores), asociados al refuerzo o al craving inducidos por sustancias psicotrópicas.
Por otro lado, se podrían estudiar los circuitos cerebrales relacionados con los déficits cognitivos y conductuales que pueden estar relacionados con la dificultad para controlar su consumo. De esta manera se podrían identificar las estructuras relacionadas con el auto-control y la capacidad de resistencia al craving de sustancias, cuyo funcionamiento alterado podría ser un factor esencial en la dependencia de sustancias psicotrópicas y en la vulnerabilidad aumentada para las recaídas.
Finalmente, el descubrimiento de nuevos marcadores neuro-biológicos de vulnerabilidad hacia el abuso de sustancias, que permitieran detectar poblaciones de riesgo elevado para el desarrollo de alguna drogodependencia, en niños o adolescentes, podría facilitar el diseño de nuevas estrategias farmaco-terapéuticas, así como también de intervenciones específicas, dirigidas hacia la prevención primaria de las drogodependencias.