Introducción
En noviembre de 2001, el Laboratorio de Biopatología Medicolegal del departamento de Toxicología y Legislación Sanitaria de la Universidad Complutense de Madrid, dirigido por el Dr. Bandrés, nos ofreció la posibilidad de realizar extracciones de sangre a los pacientes del Programa de Mantenimiento con Metadona de Madrid, para determinar las concentraciones plasmáticas de dicha sustancia. Esto nos permitía valorar si las dosis de metadona que estábamos administrando a los pacientes eran las adecuadas, y si en pacientes que describían malestar, éste podía estar relacionado con unas concentraciones plasmáticas de metadona inadecuadas1,2.
La metadona es un compuesto de naturaleza opiácea que fue sintetizado al final de la Segunda Guerra Mundial y empezó a utilizarse posteriormente en clínica. Aunque su estructura química es diferente a la de la morfina, sus propiedades eran semejantes a las de ésta. La metadona es un potente agonista opiáceo que, al igual que la morfina y la heroína, actúa principalmente sobre los receptores para opiáceos del tipo mu3.
La vida media plasmática de la metadona tras la administración crónica es de 15 a 47 h, con una media de 25 h4.
Al ser captada por el hígado mediante la actuación de enzimas microsomales hepáticas, por N-demetilación seguida de ciclación, da lugar a sus principales metabolitos, los derivados de pirrolidina y de pirrolina (2-etileno-1,5 dimetil33-difenilpirrolidina [EDDP] y 2etil5metil33-difenilpirrolina [EMDP])3,4. Así, la metadona sufre una intensa metabolización hepática que permite su inactivación y eliminación del organismo. Según se ha establecido recientemente, el citocromo P450 3A4 es el sitio primario de desmetilación de la metadona y otros opiáceos en el hígado humano5,6, y se ha descrito la posibilidad de inhibición de este subsistema de inhibición del citocromo P450 por la propia metadona. A su vez, la metadona puede afectar al metabolismo de otros fármacos por inhibición del citocromo P450 2D6, sistema de biotransformación utilizado por numerosos fármacos7.
También la variación en las concentraciones de proteínas plasmáticas (p. ej., en hepatopatías) podría modificar la concentración de metadona activa circulante, dada su intensa unión a proteínas plasmáticas (90%)4.
La determinación de las concentraciones plasmáticas de esta sustancia, nos permitió analizar la relación que existe entre la dosis de metadona que reciben los pacientes y las concentraciones plasmáticas de dicha sustancia que presentan. Cuando observamos que distintos pacientes con la misma dosis de metadona alcanzaban concentraciones plasmáticas muy diferentes, decidimos analizar qué factores podrían estar influyendo en esas variaciones en la relación dosis-concentraciones plasmáticas de metadona8.
Dentro de estos factores, los que nos parecieron más significativos en este grupo de pacientes son las enfermedades asociadas y el consumo de otras sustancias de abuso9-11.
Las enfermedades asociadas más frecuentes en pacientes en tratamiento con metadona son la hepatitis B, la hepatitis C y el virus de la inmunodeficiencia humana (VIH)/síndrome de la inmunodeficiencia adquirida (sida)9; las sustancias de abuso más utilizadas por ellos son la heroína, la cocaína, el alcohol y las benzodiacepinas12,13.
Primero se analiza la relación entre las dosis de metadona y sus concentraciones plasmáticas en pacientes sanos (consideramos sanos para este estudio a los pacientes que no presentan hepatitis B, ni Hepatitis C, ni VIH).
A continuación se analiza si estas enfermedades, habitualmente relacionadas con el consumo de drogas, como son la hepatitis B, la hepatitis C y el VIH (tanto en pacientes con tratamiento antirretroviral como sin él), influyen en dicha relación.
Por último, se analiza la variación de las concentraciones plasmáticas de metadona en relación con las dosis prescritas en pacientes consumidores de otras sustancias como heroína, cocaína, alcohol y benzodiacepinas.
Pacientes y métodos
Decidimos realizar extracciones (ya que éstas se podían realizar en nuestro centro) a todos los pacientes que estaban --y a los que se iban incluyendo durante el año 2002-- en el Programa de Mantenimiento con Metadona. Durante el período de diciembre de 2001 a diciembre de 2002 se realizaron 134 extracciones de sangre a 99 pacientes escogidos al azar. En el caso de pacientes a los que se les realizó más de una extracción, hemos elegido para el estudio la primera muestra realizada en el tiempo.
De los 99 pacientes a los que se les realizaron extracciones de sangre para determinar las concentraciones plasmáticas de metadona, 28 fueron mujeres y 71 varones. Su edad osciló entre los 26 y los 63 años, con una edad media de 36,8 años. La media de estancia en el Programa de Mantenimiento con Metadona de estos pacientes fue de 2 años, y se incluyeron pacientes que estaban en el programa desde hace 5 años y otros que comenzaron el programa 3 meses antes de que se les realizase la extracción.
El método utilizados para analizar las concentraciones plasmáticas de metadona fue el enzimoinmunoanálisis (EIA) homogéneo con la tecnología CEDIA-DAU y autoanalizador Hitachi 911 de Mycrogenics.
Las dosis de metadona administradas a los pacientes objeto del estudio varían desde una dosis máxima de 305 mg/día a una dosis mínima de 2 mg/día, con una dosis media de 100,7 mg/día. Las concentraciones plasmáticas de metadona obtenidas oscilaron entre 0 y 875 ng/ml, con una media de 178,7 ng/ml.
Resultados
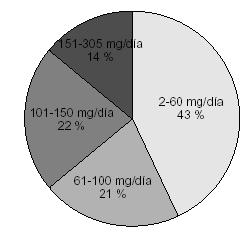
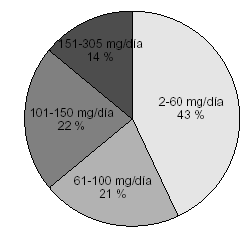
Como podemos observar en la figura 1, 42 pacientes tenían una dosis de metadona entre 2 y 60 mg/día, 21 entre 61 y 100 mg/día, 22 entre 101 y 150 mg/día y 14 una dosis mayor de 150 mg/día.
Figura 1. Porcentaje de pacientes según la dosis de metadona que reciben, agrupados en intervalos.
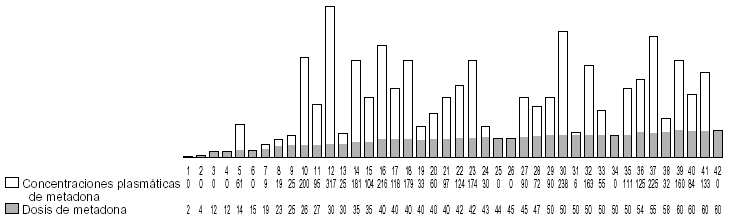
Hay que destacar que un 43% de los pacientes objeto del estudio estban en tratamiento con dosis menores de 60 mg/día, lo cual hasta ahora en muchas ocasiones no se ha considerado como dosis terapéutica13. Sin embargo, estos pacientes no se encontraban «peor» que otros con dosis mayores, y además la relación dosis-concentraciones plasmáticas de metadona no difería en exceso de las concentraciones que encontramos con dosis mayores,en este caso, las concentraciones plasmáticas oscilaron entre 0 y 290 ng/ml, con una media de 68,86 ng/ml (fig. 2).
Figura 2. Dosis de metadona entre 2 y 60 mg/día. Concentraciones plasmáticas expresadas en ng/ml; dosis de metadona expresada en mg/día.
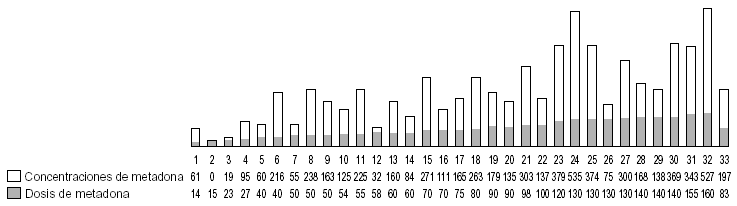
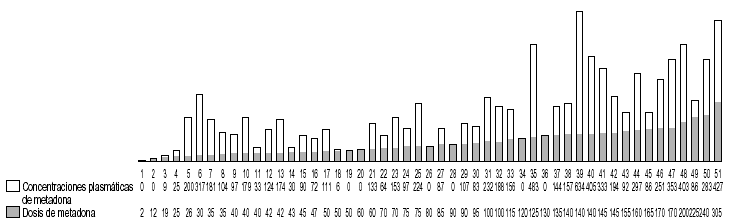
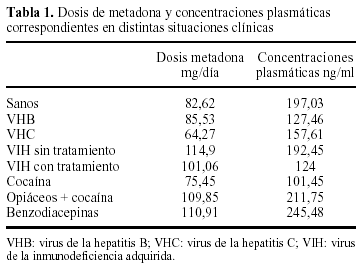
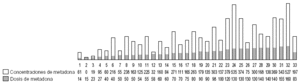
En primer lugar, vamos a estudiar la relación que existe entre las dosis de metadona y sus concentraciones plasmáticas en pacientes sanos (tal como se ha definido el concepto de «sano», es decir, no presentar hepatitis B, C o VIH). No tenían hepatitis B, ni C, ni VIH 33 pacientes. En ellos, las dosis de metadona oscilaron entre 14 y 220 mg/día, con una media de 82,62 mg/día y sus concentraciones plasmáticas fueron desde 0 hasta 544 ng/ml; con una media de 197,03 ng/ml (fig. 3).
Figura 3. Relación dosis/concentraciones de metadona en pacientes «sanos» (sin VHB, VHC ni VIH). Concentraciones plasmáticas expresadas en ng/ml; dosis de metadona expresada en mg/día. VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; VIH: virus de la inmunodeficiencia humana.
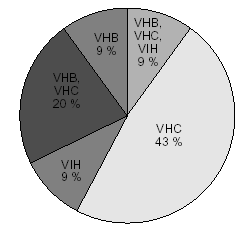
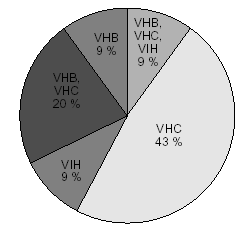
Nos centraremos ahora en estudiar a los 66 pacientes que presentaban alguna de las enfermedades a las que hemos hecho referencia anteriormente (hepatitis B, C y VIH). Hay que tener en cuenta, que la alteración en la concentración de proteínas plasmáticas que puede existir en el caso de las hepatopatías en principio nos hace pensar que podría modificar la concentración de metadona activa dada su intensa unión a proteínas plasmáticas4. En la figura 4 se puede ver la distribución de estos 66 pacientes de acuerdo a las distintas enfermedades asociadas que presentaban.
Figura 4. Porcentaje de pacientes con hepatitis B y/o hepatitis C y/o VIH. VIH: virus de la inmunodeficiencia humana.
Hay 29 pacientes con marcadores para hepatitis B positivos (independientemente de que además presenten alguna de las otras enfermedades a las que estamos haciendo referencia). La dosis media de metadona que recibieron estos pacientes fue de 85,53 mg/día, y osciló entre 4 y 225 mg/día. Las concentraciones plasmáticas de metadona variaron entre 0 y 483 ng/ml, con una media de 127,46 ng/ml. (fig. 5).
Figura 5. Relación dosis/concentraciones de metadona en pacientes con hepatitis B. Concentraciones plasmáticas expresadas en ng/ml; dosis de metadona expresada en mg/día.
Si lo comparamos con la dosis media y la media de concentraciones plasmáticas obtenida en los pacientes «sanos» estudiadas anteriormente, vemos que con una dosis media muy similar (85,53 frente a 82,62 mg/día), la media de las concentraciones plasmáticas varía en 70 ng/ml (127,46 frente a 197,03 ng/ml), lo cual nos hace pensar que esta hepatopatía podría influir de algún modo en el metabolismo de la metadona.
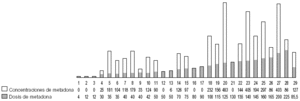
De la misma manera, a continuación nos centramos en los pacientes con marcadores de hepatitis C positivos, que fueron 52. Sus dosis de metadona oscilaron desde 2 a 170 mg/día, con una media de 64,27 mg/día. Las concentraciones plasmáticas variaron entre 0 y 634 ng/ml, con una media de 157,61 (fig. 6).
Figura 6. Relación dosis/concentraciones de metadona en pacientes con hepatitis C. Concentraciones plasmáticas expresadas en ng/ml; dosis de metadona expresada en mg/día.
En este caso, siendo la dosis media de metadona 18,35 mg/día menor que en pacientes sanos y la media de las concentraciones plasmáticas 39,42 ng/ml menor que en los pacientes sanos, la relación dosis media/concentraciones plasmáticas medias de metadona es prácticamente igual, lo que parece indicarnos que la hepatopatía por virus C no influye sobre las concentraciones plasmáticas de metadona a diferencia de la hepatopatía producida por virus B.
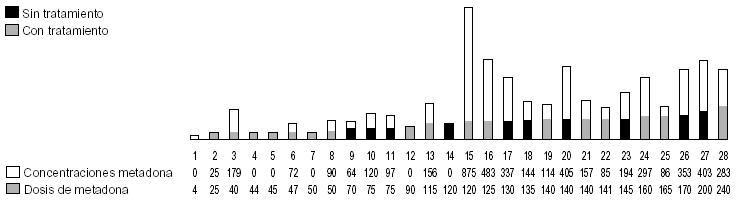
La relación entre dosis administrada y concentraciones plasmáticas en los pacientes VIH positivos, con y sin tratamiento con antirretrovirales, se muestra en la figura 7. Los pacientes sin tratamiento (12) recibieron una dosis de metadona entre 70 y 200 mg/día y las concentraciones plasmáticas oscilaron entre 0 y 875 ng/ml, la dosis media de metadona fue de 115 mg/día y la media de las concentraciones plasmáticas de 249,33 ng/ml. Esta media se ve aumentada significativamente dado que uno de estos pacientes alcanzaba unas concentraciones plasmáticas de metadona de 875 ng/ml, con una dosis administrada de 120 mg/día, lo que nos llevó a estudiar a este paciente y ver qué características tenía que no tuviesen los otros pacientes. Lo que encontramos fue el consumo abusivo de benzodiacepinas (alprazolam), tema que analizaremos más adelante. Si excluimos a este paciente, la dosis media de metadona de este grupo fue de 114,9 mg/día y la media de las concentraciones plasmáticas de 192,45 ng/ml. Estos pacientes recibieron una dosis más alta que los pacientes «sanos» y alcanzaron unas concentraciones plasmáticas más bajas en relación con esa dosis que las que existían en pacientes «sanos», lo que indica la probable influencia del VIH.
Figura 7. Relación dosis/concentraciones de metadona en pacientes con VIH. Concentraciones plasmáticas expresadas en ng/ml; dosis de metadona expresada en mg/día. VIH: virus de la inmunodeficiencia humana.
En cuanto a las dosis de los pacientes con VIH positivo que mantienen un tratamiento con antirretrovirales (16), osciló entre 4 y 240 mg/día y las concentraciones plasmáticas de 0 a 405 ng/ml, la dosis media de metadona fue de 101,06 mg/día y la media de las concentraciones plasmáticas de 124 ng/ml. En estos pacientes vemos que las concentraciones plasmáticas de metadona son un 50% más bajos que en el grupo anterior, con dosis sólo un 10% más bajas, lo cual parece lógico atribuirlo a varios de los fármacos utilizados en el tratamiento del VIH.
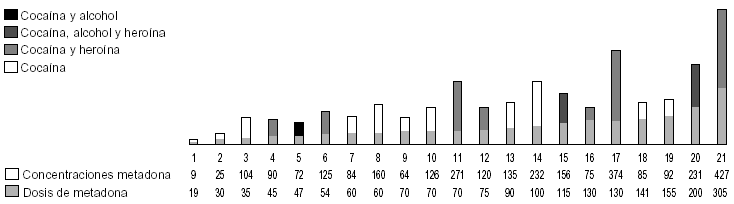
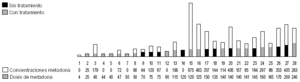
Por último, analizaremos las variaciones que sufren las concentraciones plasmáticas de metadona con relación a las dosis en personas consumidoras de otras sustancias de abuso, como son la heroína, la cocaína o el alcohol. Las benzodiacepinas como sustancias de abuso las trataremos de forma más extensa, al ser en este grupo de pacientes donde nos encontramos con las mayores variaciones en las concentraciones plasmáticas de metadona. Dentro de este grupo nos encontramos con 21 pacientes, todos consumidores de cocaína, 11 pacientes sólo consumían cocaína, 7 además de cocaína consumían heroína, 1 consumía cocaína y alcohol y 2 consumían a la vez todas estas sustancias (fig. 8).
Figura 8. Relación dosis/concentraciones en pacientes consumidores de cocaína, heroína y alcohol. Concentraciones plasmáticas expresadas en ng/ml; dosis de metadona expresada en mg/día.
La dosis media de metadona de estos pacientes fue de 95,28 mg/día y sus concentraciones plasmáticas medias fueron de 145,57 ng/ml. Los pacientes que consumían cocaína no asociada a heroína ni a alcohol tenían una dosis media de 75,45 mg/día, con unas concentraciones plasmáticas medias de 101,45 ng/ml. Los pacientes que además consumían heroína, tenían una dosis media de metadona bastante más alta que la del primer grupo (cocaína sin heroína), que fue de 109,85 mg/día y la media de las concentraciones plasmáticas de metadona de estos pacientes fue mucho mayor con relación a la dosis que la de aquellos, 211,75 ng/ml, lo que sugiere que la heroína de alguna manera influye en el metabolismo de la metadona.
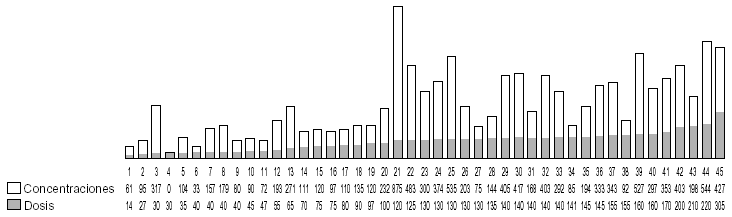
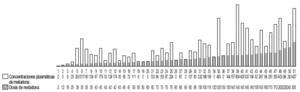
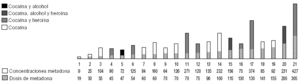
Por último, describir lo que ocurre con los pacientes consumidores de benzodiacepinas, ya sean pautadas desde el centro o no. De los 99 pacientes estudiados, 45 tenían consumos de benzodiacepinas (fig. 9).
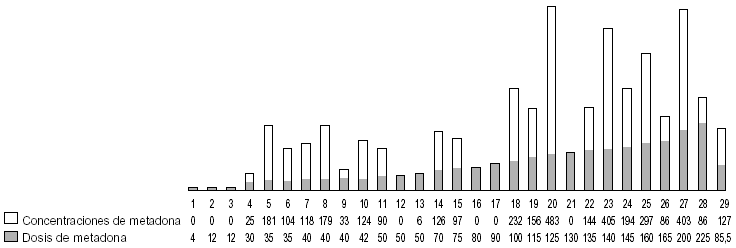
Figura 9. Relación dosis/concentraciones de metadona en pacientes consumidores de benzodiacepinas. Concentraciones plasmáticas expresadas en ng/ml; dosis de metadona expresada en mg/día.
Estos pacientes recibían una dosis media de metadona más alta que la media de otros grupos que ya hemos descrito (hay que tener en cuenta que estos pacientes no han sido excluidos en ninguno de los grupos preliminares), que fue de 110,91 mg/ día. Además, pudimos observar que hay un aumento importante de las concentraciones plasmáticas de metadona, la media fue de 245,48 ng/ml. Si tomamos como ejemplo alguno de estos pacientes, nos encontramos que pacientes con una dosis de 30 mg/día alcanzan concentraciones plasmáticas de 317 ng/ml; con 65 mg/día, 271 ng/ml; con 120 mg/día, 875 ng/ml; con 130 mg/ día, 535 ng/ml o con 180 mg/día, 527 ng/ml, éstas fueron las concentraciones plasmáticas de metadona más altas de todo el estudio, y en algunos casos llegaron a ser hasta 4 veces mas altas que en pacientes no consumidores de benzodiacepinas. Esto indica la probable influencia de las benzodiacepinas en el metabolismo de la metadona que es, de todos los parámetros analizados, el que más parece alterar en principio la relación dosis/concentraciones de metadona.
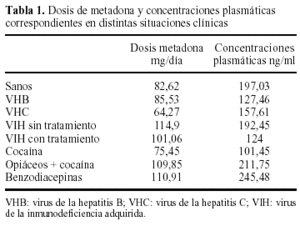
En la tabla 1 se presentan la media de dosis y las concentraciones plasmáticas de metadona alcanzadas en las distintas situaciones clínicas que se han analizado en el estudio.
Discusión
A partir de todo lo expuesto anteriormente, vamos a describir las conclusiones a las que hemos llegado y la discusión que a partir de algunas de ellas puede surgir entre todos los profesionales que nos dedicamos al campo de las adicciones.
En primer lugar, hay que destacar que un 42,4% de los pacientes estudiados están siendo tratados con una dosis diaria de metadona menor de 60 mg, lo cual se ha considerado en muchas ocasiones como una dosis no terapéuticamente útil13. En estos pacientes, no se aprecia malestar físico atribuible a un síndrome de abstinencia por opiáceos, ni ellos tienen esa percepción, por lo que hay que pensar que las dosis son terapéuticamente útiles en función de cada paciente. Entonces cabe preguntarnos: ¿es realmente la dosis administrada el mejor indicativo de utilidad terapéutica?, ¿en qué porcentaje influye la percepción de bienestar que tengan los pacientes?, ¿podría ser que con dosis bajas de metadona el organismo produzca opiáceos endógenos compensatorios en aquellos pacientes sin ninguna sintomatología de abstinencia?
Es preciso mencionar que un 66,6% de los pacientes presentan alguna enfermedad asociada al consumo, como son la hepatitis B, la C, y el VIH. ¿Es característico de nuestro centro o se podría extrapolar esta alta incidencia de enfermedades debidas al consumo a otros centros relacionados con las drogodependencias?
Asimismo, el presente estudio muestra que los pacientes que presentan hepatitis B, sola o asociada a otra de las enfermedades anteriormente mencionadas, se mantienen con una dosis media de metadona similar a la de los pacientes «sanos». Sin embargo, la media de sus concentraciones plasmáticas de metadona disminuye de forma considerable en comparación con la de los pacientes sanos, por lo que suponemos que esta hepatopatía interfiere en el metabolismo de la metadona disminuyendo la fracción de metadona libre circulante. Aún así, cabe la siguiente discusión: ¿influye realmente esta enfermedad en el metabolismo de la metadona disminuyendo sus concentraciones plasmáticas con relación a las dosis administradas? o ¿esta variación en la relación dosis/concentraciones de metadona es debida a la variación en la concentración plasmática de proteínas producida por el virus B, dada la alta afinidad que tiene la metadona por las proteínas plasmáticas? Serían precisos estudios posteriores para conocer con detalle el mecanismo exacto por el que se produce este efecto.
Otro dato a destacar es que un 52% de los pacientes estudiados presentan hepatopatía crónica por virus C, y esta enfermedad es la de mayor prevalencia. Los pacientes que presentan hepatitis C tienen una dosis media de metadona inferior a la de los pacientes sanos. Sus concentraciones plasmáticas se corresponden con ella y, por tanto, también son menores; en este caso, no parece que la hepatitis C altere la relación dosis/concentraciones plasmáticas de metadona. Nos preguntamos si esta enfermedad hepática está relacionada con la necesidad de una menor dosis de metadona para la estabilización del paciente, y por qué la hepatitis B parece influir en el metabolismo de la metadona y sin embargo no parece que suceda lo mismo con la hepatitis C.
Hay que señalar que los pacientes VIH positivos que no siguen ningún tratamiento antirretroviral (en la mayor parte de los casos porque el equipo de enfermedades infecciosas que los siguen no lo consideraba necesario, no por no controlar su enfermedad) tienen dosis medias de metadona más altas que los pacientes «sanos»14. Sin embargo, las concentraciones plasmáticas medias de metadona correspondientes a esas dosis medias más altas se asemejan a las de pacientes «sanos», lo que indica que dichas concentraciones están disminuidas con respecto a las de pacientes sanos. Esto significa que parece que la infección por VIH interfiere en el metabolismo de la metadona disminuyendo sus concentraciones plasmáticas. Cabe preguntarnos si es posible que el VIH interfiera per se en el metabolismo de la metadona, aun en pacientes que no necesitan tratamiento, disminuyendo las concentraciones plasmáticas de ésta en relación con la dosis administrada.
Observamos también que los pacientes VIH positivos con tratamiento antirretroviral tienen una dosis media de metadona más alta que los pacientes «sanos». Las concentraciones plasmáticas de metadona disminuyen de forma considerable en relación con las dosis si lo comparamos con lo que sucede en esta relación dosis/concentraciones en pacientes «sanos». También disminuyen en relación con los pacientes VIH positivos que no siguen tratamiento antirretroviral. Por lo tanto, el tratamiento para esta infección contribuye también a disminuir las concentraciones plasmáticas de metadona. Posteriores estudios deberán aclarar si esta disminución de las concentraciones plasmáticas de metadona con relación a la dosis administrada, se debe fundamentalmente a la infección por el VIH o tiene más que ver con el tratamiento antirretroviral que reciben los pacientes, y qué porcentaje de esta disminución de concentraciones es atribuible a la propia infección y cuál al tratamiento.
En el presente estudio destacamos que un 21% de los pacientes en Programa de Mantenimiento con Metadona consumen cocaína regularmente. De éstos, un 14,14% consumen cocaína pero no consumen heroína ni alcohol. Un 7% la consumen asociada a heroína. Estos pacientes que consumen también heroína tienen una dosis media de metadona bastante más alta que la del primer grupo (cocaína sin heroína). La media de las concentraciones plasmáticas de metadona de estos pacientes es mucho mayor con relación a la dosis que la de aquéllos. Esto indica que los pacientes que consumen heroína demandan una mayor cantidad de metadona y que la heroína parece aumentar las concentraciones plasmáticas de metadona. Aquellos pacientes que además consumen alcohol tienen una dosis de metadona mucho mayor todavía, pero sin embargo las concentraciones plasmáticas disminuyen con relación a la dosis. Llama la atención que tan sólo un 2% de los pacientes estudiados son consumidores de alcohol, y es por esto por lo que pueden no ser valorados los resultados descritos en ellos. Sobre la base de estos consumos de sustancias de abuso, surgen las siguientes cuestiones: ¿los pacientes que consumen además de cocaína heroína tienen una dosis más alta de metadona porque lo que buscan es realmente la sensación que les aporta el consumo de opiáceos?, ¿los pacientes que consumen heroína tienen unas concentraciones plasmáticas de metadona más altas porque esta sustancia interfiere en el metabolismo de la metadona al tener ambas sustancias una composición química parecida?
Finalmente, nuestros datos muestran que un 45,45% de los pacientes estudiados consumen benzodiacepinas15. Estos pacientes tienen una dosis media de metadona más alta que la descrita en otros grupos, lo que creemos puede interpretarse como una de las característica de este grupo de población que demanda aumento de la dosis de metadona, en un intento de conseguir un estado de sedación semejante al que obtenían cuando consumían heroína16. Si a esto se le suma el consumo de benzodiacepinas consiguen, de alguna manera, acercarse a ese estado. Es en estos pacientes donde nos encontramos concentraciones de metadona más altas en relación con las dosis administradas. Son estos pacientes los que presentan las concentraciones plasmáticas más altas de todos los estudiados. Estos datos tan llamativos, nos llevan a pensar que son realmente las benzodiacepinas lo que más interfiere en el metabolismo de la metadona, con el aumento de forma muy significativa de la metadona libre circulante con relación a la dosis administrada. En la actualidad, estamos estudiando si esta interferencia en el metabolismo de la metadona está relacionada sobre todo con la dosis de benzodiacepinas o con sus concentraciones plasmáticas, y si esta alteración en la relación dosis/concentraciones de metadona se da por igual en todas las benzodiacepinas17,18.