Notas preliminares
En 1971 Ficat et al3 fueron los primeros en describir la descompresión del núcleo para el tratamiento de la necrosis avascular de la cabeza femoral. Llamaron a este procedimiento forage. Hungerford5,6 acunó el término descompresión del núcleo, término que ha sido aceptado internacionalmente hasta hoy.
La clasificación de la necrosis avascular propuesta por la organización internaconal ARCO (Association Research Circulation Osseus) se acepta como patrón oro. Subdivide la necrosis idiopática en 5 estadios9 (tabla 1). Esta clasificación incluye hallazgos de la radiografía simple, tomografía computarizada, gammagrafía ósea y de la RNM y ha probado su valor para determinar la indicación de la descompresión del núcleo11,13.
Tabla 1
Clasificación del estadio clínico de la necrosis de la cabeza femoral según los criterios ARCO (Association Research Circulation Osseous)9
Estadio ARCOCaracterísticas
0La biopsia confirma necrosis avascular; los otros tests diagnósticos son negativos
IGammagrafía y/o RNM positivos; lesiones subdivididas en medial, central o lateral según localización
Subtipo I-A< 15% afectación cabeza femoralª
Subtipo I-B15-30% afectación cabeza femoralª
Subtipo I-C> 30% afectación cabeza femoralª
IIAlteraciones radiológicas (moteado de la cabeza femoral, osteosclerosis, formación quistes y osteopenia); no signos de colapso de la cabeza femoral en radiología simple o TC; gamma y RNM positivos; no cambios en acetábulo; lesiones subdivididas en medial, central o lateral según localización
Subtipo II-A< 15% afectación cabeza femoralª
Subtipo II-B15-30% afectación cabeza femoralª
Subtipo II-C> 30% afectación cabeza femoralª
IIISigno de la media luna; lesiones subdivididas en medial, central o lateral según localización
Subtipo III-A< 15% de signo de la semiluna o < 2 mm de hundimiento de la cabeza femoralb
Subtipo III-B15-30% de signo de la semiluna o de 2-4 mm de hundimiento de la cabeza femoralb
Subtipo III-C > 30% de signo de la semiluna o 4 mm de depresión de la cabeza femoralb
IV Aplanamiento de la superficie articular radiológicamente y estrechamiento de la interlinea articular; cambios en el acetábulo con presencia de esclerosis, quistes y osteofitosis marginal
aDeterminado por RNM. bDeterminado por radiología anteroposterior y lateral. El porcentaje de la semiluna es el visualizado en la radiografía anteroposterior y lateral. RNM: resonancia nuclear magnética; TC: tomografía computarizada.
Principios quirúrgicos y objetivos
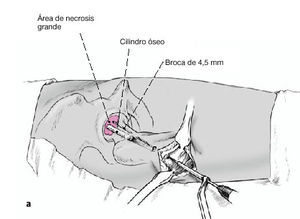
La descompresión transtrocantérica del canal medular hasta la zona de necrosis así como la retirada de un cilindro óseo de la cabeza y cuello. El objetivo es disminuir la presión intramedular aumentada, evitar la progresión de la necrosis, mejorar la capacidad de curación en el lugar de necrosis mediante la proliferación vascular así como la preservación y restauración de la función articular.
Ventajas
* Procedimiento que conserva la articulación.
* Técnica mínimamente invasiva.
* Posibilidad de realizar posteriormente otras técnicas como una osteotomía correctiva o la colocación de un injerto de cresta iliaca pediculado.
Inconvenientes
* El éxito depende del estadio1,2,9,12,13.
* En estadio I, la localización exacta del área necrótica no puede visualizarse radiológicamente durante la cirugía.
* Debido al riesgo de fractura en el postoperatorio, debe realizarse carga parcial durante 6 semanas obligatoriamente.
Indicaciones
* Síndrome de edema difuso de la médula ósea (especialmente estadio 0) acompañado de coxalgia persistente con un tratamiento conservador.
* Necrosis estadio I y II en adultos con < 30% de afectación cefálica (subtipos A y B).
* Indicación relativa en adultos: necrosis estadio II > 30% con captación de contraste iónico según RNM (subtipo C).
Contraindicaciones
* Sospecha de una necrosis estadio 0 en adultos (coxalgia persistente, factores de riesgo como el abuso de alcohol, tratamiento con corticosteroides, hiperlipoproteinemia, anemia de células falciformes, radioterapia/quimio- terapia) en presencia de una imagen negativa (incluyendo RNM): seleccionar un tratamiento conservador con carga parcial utilizando bastones durante 6 semanas. Repetir la RNM y/o la gammagrafía.
* Necrosis estadio en adultos con > 30% de afectación cefálica (subtipo C) y no captación de contraste iónico en el área necrótica.
* Necrosis cefálica estadios III y IV en adultos.
Información al paciente
* Riesgo quirúrgico habitual, como infección, tromboflebitis, embolismo, problemas de cicatrización de la herida quirúrgica, hemorragia, hematoma, lesión vasculonerviosa (incluyendo arteria, vena y nervio femoral y nervio ciático).
* Lesión cartílago articular si la broca perfora la articulación.
* Desarrollo de coxartrosis.
* Fractura femoral debido a la debilidad que provoca el brocado.
* Fallo en la revascularización del área necrótica, progresión del proceso patológico.
* Posibilidad de precisar cirugías posteriores.
* Posibilidad de restitución completa.
Estudio preoperatorio
Radiología simple: anteroposterior de pelvis (AP), proyección axial de ambas caderas (proyección de Lauenstein), radiología de contorno de cabeza femoral según Schneider10 con la cadera flexionada 30º (Schneider I) y con proyección centrada hacia la cabeza femoral angulado 30º hacia cefálico con la cadera extendida (Schneider II).
RNM potenciada en T1 y T2 de ambas caderas, administración intravenosa de 0,1 µmol/kg de peso de gadolinio-DTPA, y secuencia bidimensional eco-gradiente de supresión grasa, cortes coronales y sagitales; cortes de un grosor de 3-5 mm.
Instrumental quirúrgico
* Agujas de Kirchsner de 1,8 y 2,0 mm.
* Broca de 4,5 mm de diámetro y longitud de 130 mm.
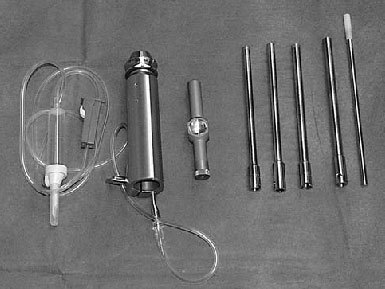
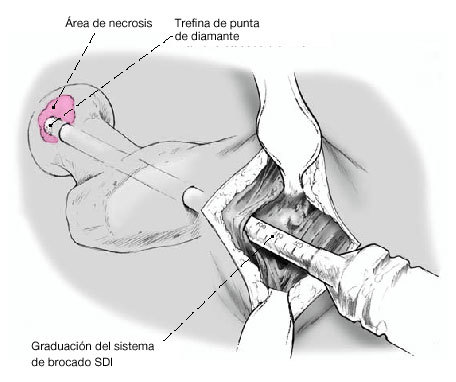
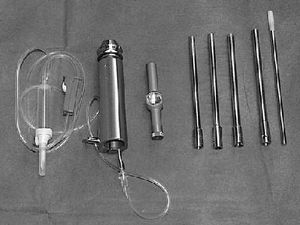
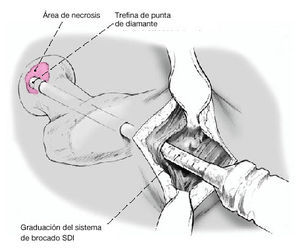
* Fresa de corona, de 6-12 mm de diámetro, de al menos 130 mm de largo (como el sistema de fresa de corona SDI [Surgical Diamond Instrument] de medArtis Co, Deisenhofen, Alemania [figs. 1 y 2]), u otros sistemas de fresado con corona.
Figura 1 Sistema de fresas en corona SDI (de izquierda a derecha): adaptador para la fresa con conexión para irrigación, mango extractor, fresas en corona diamantizadas y extractores de la misma talla, impactador de plástico.
Figura 2 Fresa en corona de diamante (arriba) y extractor (debajo), diámetro interior de 8,5 mm, graduación externa para determinar la profundidad.
* Motor neumático AO.
Anestesia y colocación del paciente
* Anestesia general o regional.
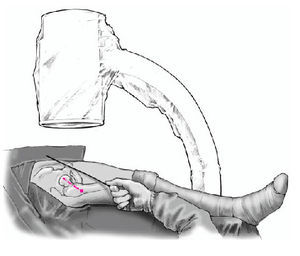
* Decúbito supino en mesa de cadera radiotransparente.
* Entallado libre de la extremidad inferior. La cadera debe colocarse en el borde de la mesa quirúrgica permitiendo que las partes blandas de la zona glútea queden suspendidas.
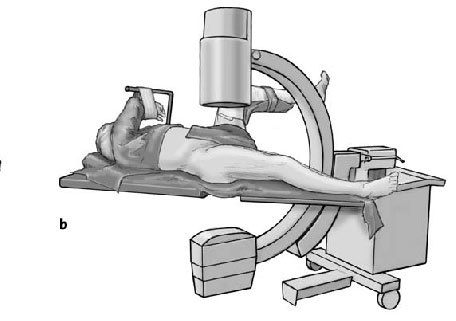
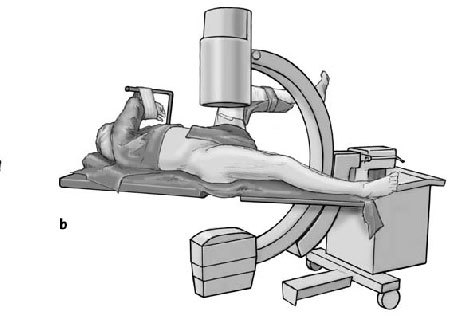
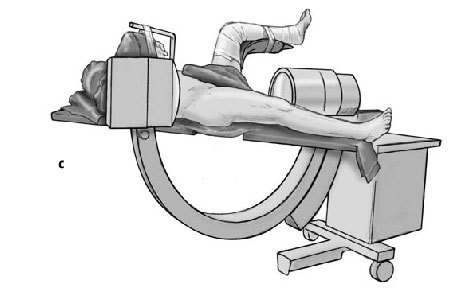
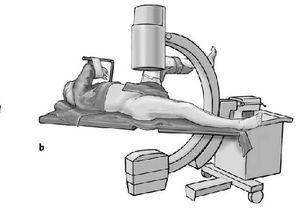
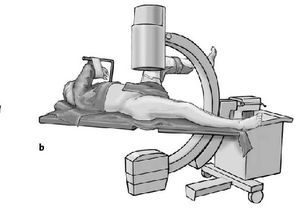
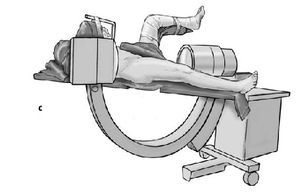
* Pierna contralateral colocada en posición ginecológica en una pernera con una abducción de 30º y flexión de 90º y entallado con una talla de Mayo (figs. 3a-c).
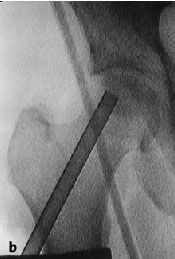
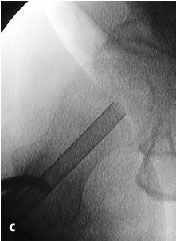
Figura 3a-c Posición del paciente en la mesa quirúrgica, entallado libre de la extremidad (a) y cobertura estéril del arco del intensificador de imágenes, permitiendo imágenes intraoperatorias en dos planos: AP (b) y axial (c).
Figura 3a-c Posición del paciente en la mesa quirúrgica, entallado libre de la extremidad (a) y cobertura estéril del arco del intensificador de imágenes, permitiendo imágenes intraoperatorias en dos planos: AP (b) y axial (c).
Figura 3a-c Posición del paciente en la mesa quirúrgica, entallado libre de la extremidad (a) y cobertura estéril del arco del intensificador de imágenes, permitiendo imágenes intraoperatorias en dos planos: AP (b) y axial (c).
* Forrado estéril del intensificador de imágenes.
Técnica quirúrgica
Figuras 4 a 13
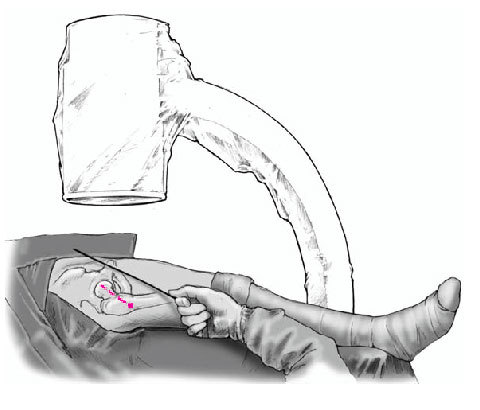
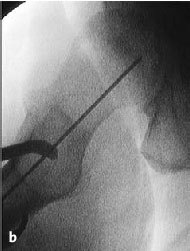
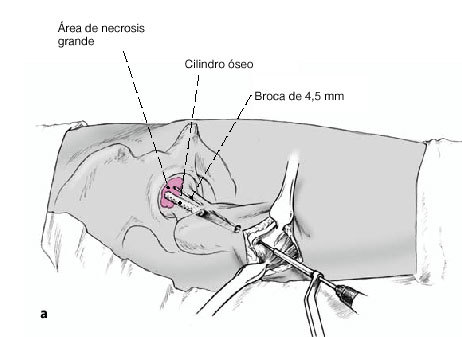
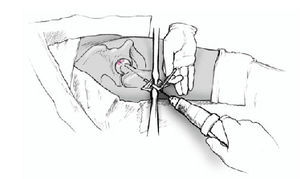
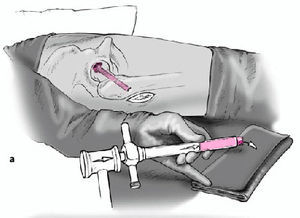
Figura 4 Bajo control por el intensificador de imágenes, se coloca una aguja de Kirchsner por delante de la cadera en dirección a la cabeza femoral; sirve para determinar la dirección de la broca. Debe apuntar hacia el área de necrosis y el punto de entrada es inmediatamente distal a la inserción del vasto lateral. Marcaje de la incisión adecuada con rotulador dermográfico.
Figura 5 Incisión longitudinal lateral de la piel y tejido subcutáneo de unos 5 cm de longitud. Incisión longitudinal de la fascia lata y del vasto lateral inmediatamente distal a su inserción. Inserción anterior y posterior con separadores tipo Hohmann romo para proteger las partes blandas. Introducción de una aguja de Kirchsner en dirección a la cabeza femoral montada
en un motor y con guía para protección de partes blandas.
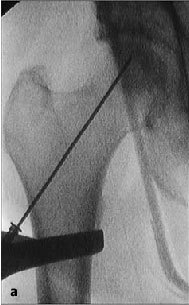
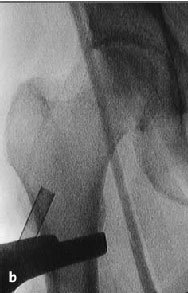
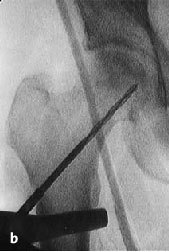
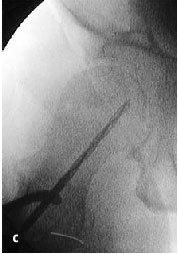
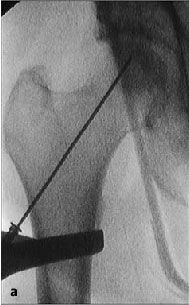
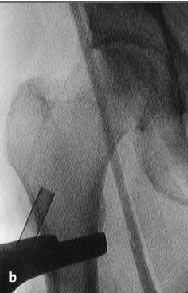
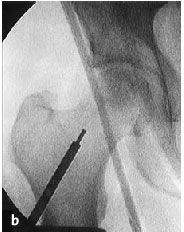
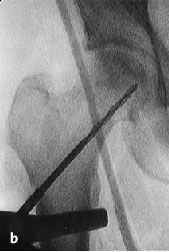
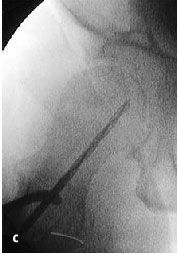
Figura 6a yb Inserción de una aguja de Kirchsner bajo control repetido con intensificador de imágenes en dos planos AP (a) y axial (b), hasta la posición final subcondral del área necrótica. La aguja de Kirchsner sirve de guía para el fresado posterior.
Figura 6a yb Inserción de una aguja de Kirchsner bajo control repetido con intensificador de imágenes en dos planos AP (a) y axial (b), hasta la posición final subcondral del área necrótica. La aguja de Kirchsner sirve de guía para el fresado posterior.
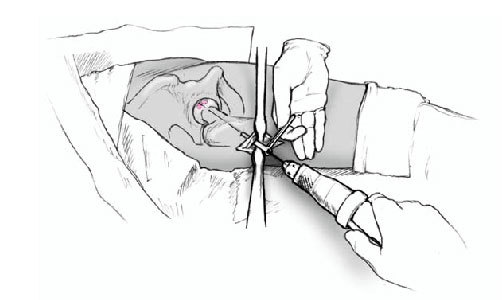
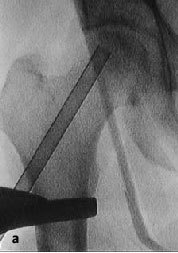
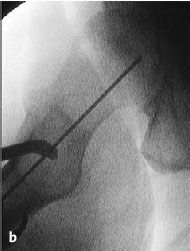
Figura 7a y b La aguja de Kirchsner debe retirarse antes del brocado con la fresa en corona diamantizada para evitar el riesgo de corte de ésta así como la posibilidad de rotura de la fina pared de la fresa canulada. La fresa debe seguir la misma dirección que la aguja de Kirchsner. Para evitar una entrada falsa con la fresa en corona podemos realizar una entrada inicial con una broca diferente. Se debe enfriar el sistema de brocado con suero salino para evitar necrosis térmica.
Figura 7a y b La aguja de Kirchsner debe retirarse antes del brocado con la fresa en corona diamantizada para evitar el riesgo de corte de ésta así como la posibilidad de rotura de la fina pared de la fresa canulada. La fresa debe seguir la misma dirección que la aguja de Kirchsner. Para evitar una entrada falsa con la fresa en corona podemos realizar una entrada inicial con una broca diferente. Se debe enfriar el sistema de brocado con suero salino para evitar necrosis térmica.
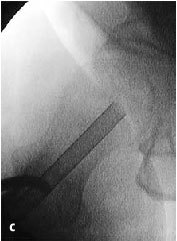
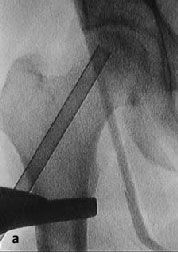
Figura 8a-c Se introduce la fresa en corona bajo control repetido con intensificador de imágenes en dos planos AP (a) y axial (b) en el área necrótica y hasta el hueso subcondral.
La profundidad del fresado puede determinarse gracias a la graduación de la trefina (c).
Figura 8a-c Se introduce la fresa en corona bajo control repetido con intensificador de imágenes en dos planos AP (a) y axial (b) en el área necrótica y hasta el hueso subcondral.
La profundidad del fresado puede determinarse gracias a la graduación de la trefina (c).
Figura 8a-c Se introduce la fresa en corona bajo control repetido con intensificador de imágenes en dos planos AP (a) y axial (b) en el área necrótica y hasta el hueso subcondral.
La profundidad del fresado puede determinarse gracias a la graduación de la trefina (c).
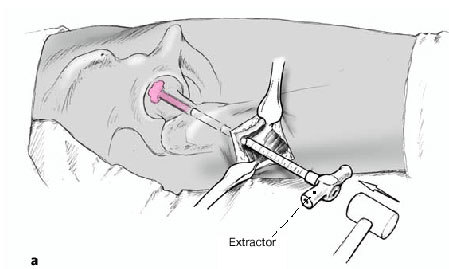
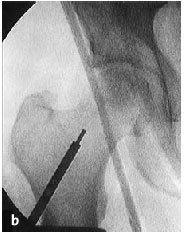
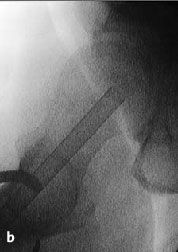
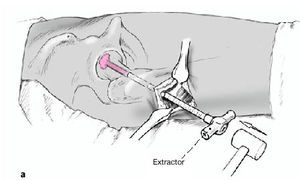
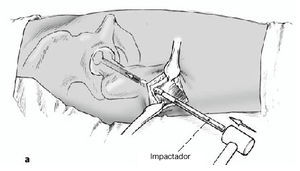
Figura 9a-c Retirada de la trefina. El cilindro óseo se extrae con el extractor del mismo diámetro; su extremo circular está afilado. El extractor se inserta cuidadosamente a través del fresado previo y se avanza con golpes suaves de martillo hasta la profundidad deseada, el hueso subcondral necrótico (a). El avance se controla en dos planos AP (b) y axial (c) con el intensificador de imágenes.
Figura 9a-c Retirada de la trefina. El cilindro óseo se extrae con el extractor del mismo diámetro; su extremo circular está afilado. El extractor se inserta cuidadosamente a través del fresado previo y se avanza con golpes suaves de martillo hasta la profundidad deseada, el hueso subcondral necrótico (a). El avance se controla en dos planos AP (b) y axial (c) con el intensificador de imágenes.
Figura 9a-c Retirada de la trefina. El cilindro óseo se extrae con el extractor del mismo diámetro; su extremo circular está afilado. El extractor se inserta cuidadosamente a través del fresado previo y se avanza con golpes suaves de martillo hasta la profundidad deseada, el hueso subcondral necrótico (a). El avance se controla en dos planos AP (b) y axial (c) con el intensificador de imágenes.
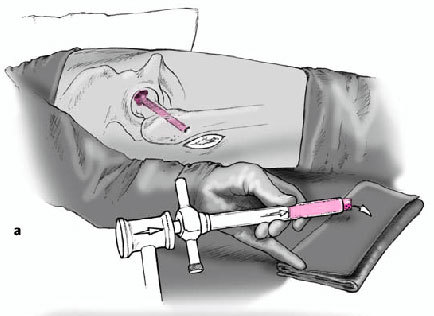
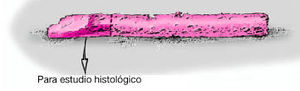
Figura 10a y b Con un movimiento rotacional rápido, el cilindro óseo se rompe por la base y se extrae fácilmente con el extractor. Se extrae el cilindro óseo con un impactador de plástico (a), la parte necrótica se retira y se analiza histológicamente.
Figura 10a y b Con un movimiento rotacional rápido, el cilindro óseo se rompe por la base y se extrae fácilmente con el extractor. Se extrae el cilindro óseo con un impactador de plástico (a), la parte necrótica se retira y se analiza histológicamente.
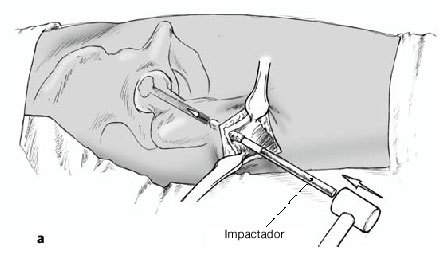
Figura 11a b Opcionalmente, la parte del cilindro óseo bien vascularizada de la región trocantérica (a) puede reintroducirse dentro del canal hasta la zona subcondral con un impactador y bajo control escópico [(b); introducción del cilindro de hueso esponjoso].
Figura 11a b Opcionalmente, la parte del cilindro óseo bien vascularizada de la región trocantérica (a) puede reintroducirse dentro del canal hasta la zona subcondral con un impactador y bajo control escópico [(b); introducción del cilindro de hueso esponjoso].
Figura 12a-c En presencia de áreas necróticas grandes (> 30% de la cabeza femoral), podemos utilizar una broca de 4,5 mm adicionalmente (a) entrando también por lateral y dirigiéndola hasta diferentes zonas del área necrótica bajo control de imagen en dos planos AP (b) y axial (c).
Figura 12a-c En presencia de áreas necróticas grandes (> 30% de la cabeza femoral), podemos utilizar una broca de 4,5 mm adicionalmente (a) entrando también por lateral y dirigiéndola hasta diferentes zonas del área necrótica bajo control de imagen en dos planos AP (b) y axial (c).
Figura 12a-c En presencia de áreas necróticas grandes (> 30% de la cabeza femoral), podemos utilizar una broca de 4,5 mm adicionalmente (a) entrando también por lateral y dirigiéndola hasta diferentes zonas del área necrótica bajo control de imagen en dos planos AP (b) y axial (c).
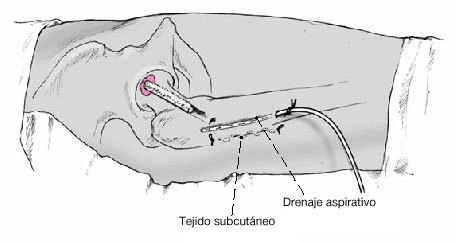
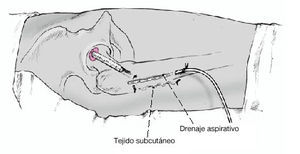
Figura 13 Drenaje aspirativo. Cierre por planos. Apósito estéril. Vendaje elástico desde los pies hasta la cresta iíaca.
Consideraciones especiales
Si no disponemos de una fresa en corona con punta de diamante podemos utilizar una fresa en corona común. En estos casos no es imprescindible retirar la aguja de Kirchsner previamente insertada. El grosor de la fresa es suficiente para evitar la rotura. No suele precisarse un extractor. Durante la retirada de la fresa, el cilindro se extrae juntamente con la aguja de Kirchsner11. El cilindro extraído puede utilizarse para rellenar el área necrótica y/o el canal fresado.
Cuidados postoperatorios
* Heparina de bajo peso molecular una vez al día para prevenir tromboflebitis hasta la carga total.
* Colocación de la extremidad intervenida en una férula de espuma con ligera abducción durante 2-3 días. Vendaje elástico durante 2 días, seguido de medias elásticas hasta el momento de carga total. Retirada de un drenaje aspirativo el día 1 y del otro el día 2. Control radiológico en dos planos.
* Utilización de bastones ingleses y carga parcial (20 kg). Aprendizaje de marcha en tres puntos. Subida de escaleras cuidadosamente y una a una al inicio.
* Ejercicios isométricos, activos-asistidos y contrarresistencia para recuperar la fuerza muscular.
* A partir de la sexta semana inicio carga progresivamente (10-20 kg/semana) hasta la carga total. Cambio a una marcha en 2 puntos y progresiva retirada de los bastones.
* Control radiológico y de RNM a las 12 semanas del post- operatorio para valorar la captación de gadolinio del área necrótica.
Errores, riesgos y complicaciones
* Desviación de la fresa en corona del trayecto planeado y perforación del cuello femoral: riesgo de lesión neurovascular (arteria, vena y nervio femorales así como nervio ciático).
* Fresado del hueso subcondral: riesgo de daño del cartílago articular con lesión irreversible. Artrosis progresiva.
* Carga total demasiado precoz: riesgo de fractura a nivel del agujero de fresado.
* Hematoma a nivel agujero de entrada del fresado: riesgo de infección secundaria.
Resultados
Entre enero 1991 y febrero de 1999, hemos realizado descompresión del núcleo por necrosis avascular de cadera confirmada por RNM en 51 pacientes (32 varones, 19 mujeres, edad media: 43 años). Se ha utilizado la clasificación ARCO (Association Research Circulation Osseous)9 (tabla 1) y la valoración funcional con la escala de Merle d'Aubigné (1-18 puntos)7 (tabla 2). Todos los pacientes se valoran con radiología preoperatoria y postoperatoria (anteroposterior de pelvis y proyecciones axiales según Lauenstein), y RNM de ambas caderas potenciadas en T1 y T2, incluyendo también la administración de contraste intravenoso con gadolinio-DTPA de 0,1 µmol/kg de peso (Magnevist®, Schering Co, Berlin, Germany) y secuencias eco-gradiente bidimensional con supresión grasa. La valoración del tipo de necrosis se basa en el método publicado por Mitchell et al (tipo A, B, C, D)9 (tabla 3). La extensión de la necrosis se evaluó con el estadio de Steinberg et al (extensión < 15%, 15-30%, > 30%)11. La duración del seguimiento varía entre 3 y 11 años (media de estadios: I = 7,3 años, para ARCO estadio II = 5,9 años).
Resultado clínico
5/25 pacientes (20%) con ARCO preoperatorio en estadio I precisó una prótesis total de cadera a los 3,5 años. Los otros 20 (80%) presentan una buena puntuación en la escala funcional de cadera (16 puntos en el postoperatorio y 9 puntos en el postoperatorio). 4/16 (25%) pacientes estadio ARCO II precisó una PTC a los 2,6 años. Dos pacientes fallecieron a los 3 y 3,5 años de la cirugía por causas desconocidas. Los restantes 10 pacientes (63%) presentaron un buen resultado clínico con una media de 5,9 años (puntuación postoperatoria 16, preoperatoria 8 puntos). 7/8 pacientes con ARCO estadio III (87%) precisaron una PTC a los 1,9 años del postoperatorio. El paciente restante presentó un buen resultado clínico (15 puntos). Los dos pacientes con ARCO IV precisaron una PTC a los 4,5 meses. Ninguno de estos pacientes había mejorado del dolor ni su función.
Resultados de resonancia nuclear magnética-tipo de necrosis
La valoración por RNM de los pacientes con ARCO estadios I y II preoperatorio mostraron todos los tipos de necrosis (Mitchell A-D). Un cambio hacia otro tipo en el postoperatorio solamente se ha observado en 6/41 (15%). Pacientes con ARCO III y IV en el preoperatorio sólo mostraron tipos C y D y sin signos de cambio en el postoperatorio. No hemos podido correlacionar tipo de necrosis según la clasificación de Mitchell et al8 y resultado clínico.
Resultados de resonancia nuclear magnética-extensión de necrosis
En estadio ARCO I, la extensión de la necrosis en el postoperatorio era < 30% en todos los pacientes (n = 30). Se evidenció, en el postoperatorio, una disminución de la extensión de la necrosis en todos. A pesar de todo parte de la necrosis persistió. Por lo tanto, una desaparición completa de la necrosis nunca ocurrió. En estadios de necrosis ARCO II no encontramos necrosis de < 15%. Los 12 casos de extensión entre 15-30% demostraron en 11 casos (92%) una disminución en el postoperatorio sin una desaparición completa. El paciente restante no presentó variación de la extensión de necrosis. La extensión de necrosis preoperatoria de > 30% en 4 pacientes no cambió en dos y progresó en los otros dos pacientes precisando una artroplastia total de cadera. Todas las necrosis en estadio III y IV progresaron en el postoperatorio exceptuando un paciente cuya necrosis no progresó en los 6 años de seguimiento. Incluso áreas pequeñas (< 30%) progresan con un hundimiento del área afectada.
Resultados de resonancia nuclear magnética-captación de gadolinio
Una captación en el postoperatorio se ha observado en todos los estadios ARCO con una extensión de necrosis de < 30%. Se acompaña con una disminución del área de necrosis o sin cambios de ésta. No hemos observado captación en el preoperatorio ni en el postoperatorio cuando la extensión era de > 30%. Se ha relacionado con progresión de la necrosis exceptuando dos casos.
Resultados de resonancia nuclear magnética-derrame articular
Las imágenes potenciadas en T2 muestran, en estadios I y II, la presencia de un derrame articular en 31/41 de los pacientes (76%). El derrame persistió en el postoperatorio sólo en 9 pacientes. En cinco de estos pacientes, la necrosis progresó en el postoperatorio, y en los otros cuatro permaneció inalterada. El derrame articular persistió, en el postoperatorio, en todos los pacientes con estadio ARCO III y IV.
Conclusión
El estadio y extensión de la necrosis son factores pronósticos importantes. En relación a la necrosis en los estadios I y II con una extensión de > 30%, puede esperarse una reducción de la extensión de la necrosis pero no una desaparición de ésta. La captación de gadolinio por el área necrótica se correlaciona con la extensión de la necrosis; es útil como criterio de viabilidad en el preoperatorio. Una captación en el postoperatorio es indicativa de remodelado, sugiriendo un crecimiento vascular. El derrame articular se suele visualizar preoperatoriamente por RNM y es indicativo de sinovitis. La regresión en el postoperatorio indica un pronóstico favorable; por el contrario su persistencia es un signo de progresión.
La revisión de la literatura respecto el valor de la RNM en el seguimiento después de la descompresión del núcleo se hace referencia en sólo un artículo publicado por Aigner et al1. Ellos realizaron un total de 45 descompresiones. 29/30 pacientes con estadio ARCO I presentaron una disminución de la extensión de la necrosis acompañado de un buen resultado clínico después de 5,7 años de seguimiento medio. En estadios ARCO II (n = 9), el resultado clínico postoperatorio fue definitivamente peor: La RNM evidenció progresión de la necrosis en 5 casos (56%).
El mayor metaanálisis que consiste en 552 resultados y está basado en la valoración clínica y radiológica muestra, con un seguimiento medio de 30 meses, una supervivencia de la cabeza femoral del 84% en estadio I, del 65% en estadio II, y del 47% en estadio III9.
Hasta la fecha, Fairbank et al2 han publicado los resultados con mayor seguimiento (n = 128, seguimiento medio de 11 años [4,5-19]). En estadio I buenos resultados hasta en un 88%, en estadios II hasta un 72% y en estadio III hasta un 26%.
Nuestros resultados (80% favorable en estadio I, 63% en estadio II, y 13% en estadio III) son comparables con los resultados publicados exceptuando el estadio III donde nuestros resultados son significativamente peores.