Notas preliminares
Las infecciones de las heridas, las infecciones óseas y las articulares tras la cirugía del aparato musculoesquelético causan serias complicaciones a pacientes, cirujanos y a la sociedad7,11,13,17,34,35.
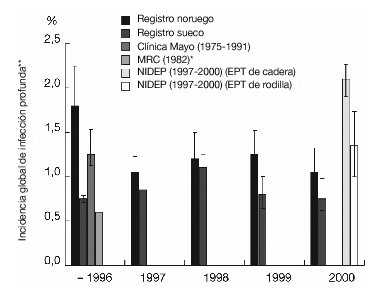
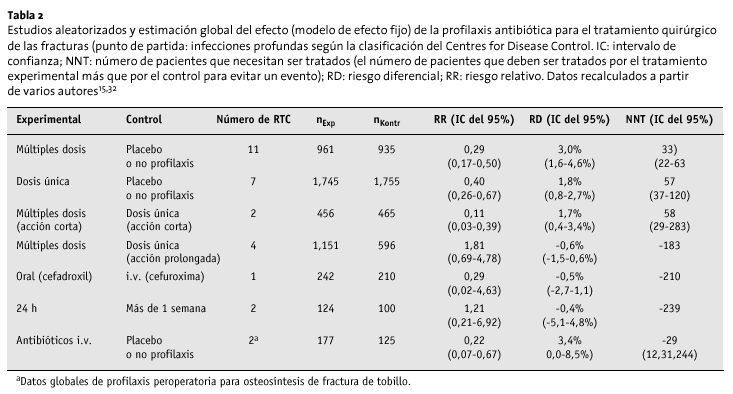
En los países escandinavos se ha recogido, de forma ejemplar, la incidencia de infección tras la cirugía de revisión de cadera. Permitiendo así conocer de forma exacta la epidemiología. La incidencia global de infección profunda (heridas, tejido blando e implantes) tras la cirugía electiva está alrededor del 1% (fig. 1)8,19,20,39. En un estudio realizado por una empresa externa en el contado de Westphalia-Lippe, la incidencia de infección tras la cirugía articular protésica y las fracturas proximales de fémur fue del 2,3% (intervalo de confianza [IC] del 95%: 1,8-2,8%). La incidencia tras la osteosíntesis interna de fracturas fue del 1,0% (IC del 95%: 0,7-1,3%)41.
Figura 1. Epidemiología de las infecciones protésicas. Cálculos según varios autores8,19,20,23,28. *Grupo: pacientes que reciben profilaxis antibiótica, quirófano convencional frente a quirófano con flujo laminar. **IC del 95%. EPT: endoprótesis total.
Existen pocos estudios epidemiológicos sobre la incidencia de infección de las fracturas cerradas y abiertas, así como de la reducción abierta y osteosíntesis interna de los huesos largos, de las articulaciones del hombro, del codo, de la mano y del tobillo. En estudios aleatorizados, la incidencia de infección tras la fijación intramedular de las fracturas cerradas de tibia llega al 1,3% (IC del 95%: 0,3-7,1%). Con meta-análisis, no se han observado diferencias entre los clavos fresados y no fresados (riesgo relativo [RR]: 0,98%, IC del 95%: 0,21-4,76%, riesgo diferencial [RD]: -0,4%; IC del 95%: -3-2%)1. Como es de esperar, la incidencia de infección en traumatismos abiertos es mayor (7,3%, IC del 95%: 5,4-9,7%)2.
El estudio realizado entre 1943 y 1979 sobre 23.538 pacientes describe una incidencia acumulativa entre el 0,2% (IC del 95%: 0,0-0,5%) y el 17,7% (IC del 95%: 0,0-35,8%)22. La varianza media fue del 1,7% (IC del 95%: 1,6-1,9%).
Pautas establecidas para la prevención de las infecciones
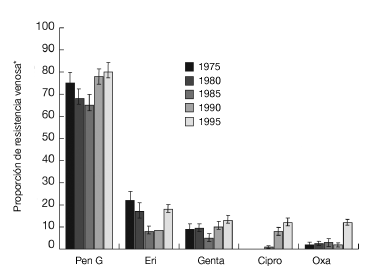
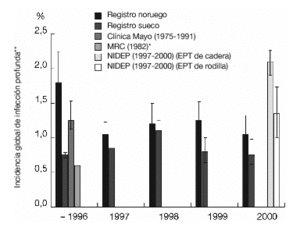
El germen responsable de la mayoría de las infecciones de las heridas, de las infecciones óseas y de las infecciones articulares es el Staphylococcus aureus (incluyendo las cepas resistentes a la meticilina y las resistentes a la oxacilina [MARSA]). El siguiente en frecuencia es el Staphylococcus coagulase-negative (en concreto, el Staphylococcus epidermidis). Ambos representan entre el 40 y el 50% de los gérmenes patógenos3,9,10,18,22,23,27,42,44. En Europa central, entre 1975 y 1995, se produjo un aumento rápido de las resistencias a la oxacilina y al ciprofloxacino (fig. 2)25.
Figura 2. Modelo de resistencia del Staphylococcus aureus en Europa occidental. Cálculos según autor25. Pen G: penicilina G; Eri: eritromicina; Genta: gentamicina; Cipro: ciprofloxacino; Oxa: oxacilina. *IC del 95%.
La eficacia del flujo laminar para la prevención de la infección quirúrgica está descrita en estudios controlados y meta-análisis. En un estudio aleatorizado del Medical Research Council (MRC) con 8.055 pacientes operados en quirófanos de flujo laminar, se detectó de forma significativa una menor incidencia de infección de las heridas (RR: 0,38; IC del 95%: 0,25-0,59%). El estudio de Lidwell et al28 continúa siendo uno de los más citados entre las investigaciones clásicas12, a pesar de algunas controversias relacionadas con el método. Cabe destacar que la reducción del RR esconde un riesgo diferencial de sólo 0,9% (IC del 95%: 0,4-1,4%).
Mantener la normotermia intraoperatoria como medida de prevención de la infección sólo es útil en cirugía colorrectal (RR: 0,31; IC del 95%: 0,15-0,65%)26. En cirugía de grandes articulaciones sólo actúa como guía para reducir la pérdida sanguínea intraoperatoria y la necesidad de transfusión peroperatoria47.
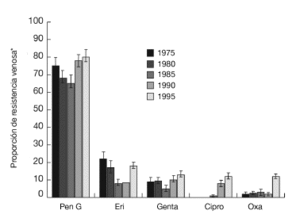
La efectividad de la profilaxis antibiótica, al contrario que la efectividad del tratamiento antibiótico, para cirugía electiva de artroplastias articulares y para fracturas cerradas de cadera está ampliamente documentada con estudios aleatorizados de largas series y meta-análisis. No obstante, existen pocos estudios sobre la administración peroperatoria de antibióticos en cirugía y fijación interna de articulaciones del miembro inferior15,32. Definimos como profilaxis antibiótica peroperatoria la administración de cualquier agente químico antimicrobiano iniciada antes de la incisión cutánea.
La incidencia de infección es mayor cuanto mayor es el intervalo de tiempo entre la incisión cutánea y la administración de la primera dosis de antibiótico6:
* Preoperatorio: 0,6% (IC del 95%: 0,2-0,9%; RR: 1,00 [nivel base de referencia].
* < 3 h: 1,4% (IC del 95%: 0,1-2,8%; RR: 2,42 (IC del 95%: 0,54-10,82%).
* > 3 h: 3,3% (IC del 95%: 1,7-4,9%; RR: 5,60 (IC del 95%: 2,23-14,04%).
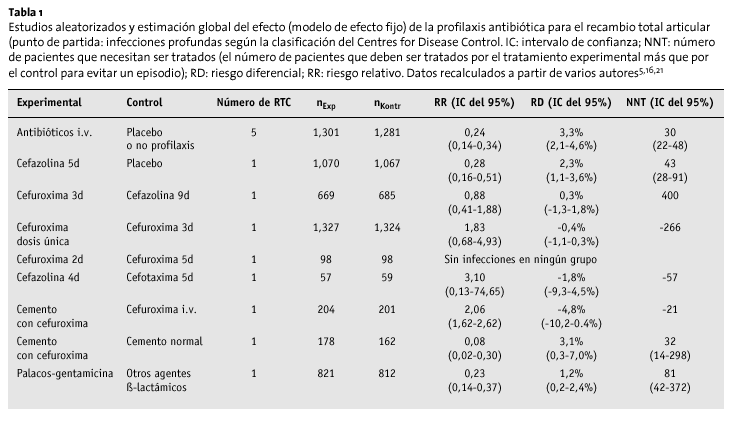
El análisis estadístico se ha realizado con datos publicados. Si no se especifica lo contrario, los cálculos realizados mediante un modelo de efectos fijos se relacionan con la estado final de la infección profunda de la herida, según la clasificación de Centres for Disease Control. Los datos son sobre infecciones de partes blandas (fascia, músculos) e infecciones alrededor de los implantes durante el primer año31.
Profilaxis antibiótica peroperatoria en cirugía electiva de artroplastias de cadera y rodilla
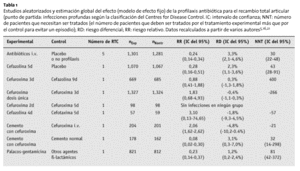
En 1999, el análisis del Health Technology Assessment (HTA) del National Health Service (NHS) Center for Reviews and Dissemination identificó, a través de una búsqueda sistemática, 25 estudios aleatorizados16. Pero no se incluyó un extenso estudio francés aleatorizado sobre 2.000 pacientes, publicado en 198121. No obstante, los resultados de un modelo fijo de efectos y el 95% de los IC del análisis del grupo son muy parecidos a los del estudio francés no incluido.
Este último estudio es importante, puesto que utiliza dos criterios más para valorar la eficacia de la profilaxis perioperatoria en disminuir la incidencia de complicaciones sépticas:
* La clasificación de los centros según tengan o no flujo laminar. El efecto preventivo sólo se observó en el grupo con flujo laminar:
Sistema de flujo laminar: RR, 1,55 (IC del 95%: 0,69-3,50%); RD, -0,5% (IC del 95%: -1,3-0,4%); p = 0,29.
Sistema convencional: RR, 0,13 (IC del 95%: 0,08- 0,21%); RD, 4,5% (IC del 95%: 3,1-5,9%); p < 0,0001.
* La profilaxis peroperatoria reduce significativamente la incidencia de infecciones nosocomiales del tracto urinario: RR, 0,59 (IC del 95%: 0,44-0,79%); RD, 3,9% (IC del 95%: 1,7-6,2%); p = 0,0006.
En otros dos estudios aleatorizados no citados, uno publicado en 1976 (dicloxacilina frente a ampicilina, n = 100) y el otro publicado en 1979 (cefaloridina frente a flucloxacilina, n = 297), no se encontraron diferencias entre los grupos de tratamiento38,45. Existe un estudio aleatorizado sobre el uso de cemento impregnado con cefuroxima publicado en el 20025. Se ha publicado un estudio cohorte sobre la erradicación del Staphylococcus aureus utilizando mupirocina nasal pomada14. Los resultados no son muy determinantes desde el punto de vista biológico: la incidencia global de infección de la herida disminuyó (porcentaje probable [PP]: 0,49 [IC del 95%: 0,26-0,91%]; RD: 1,4% [IC del 95%: 0,2-2,5%]), la incidencia acumulativa de las infecciones asociadas a Staphylococcus aureus, no obstante, no se observaron diferencias entre los dos grupos de tratamiento (PP: 0,60 [IC del 95%: 0,24-1,49%]; RD: 0,44% [IC del 95%: -0,4-1,3%]).
Por otro lado, el estudio aleatorizado, a doble ciego, placebo-control MARS, de 3.864 pacientes ("Grupo de estudio Mupirocina y riesgo de Staphylococcus aureus") publicado en 2002 demostró una reducción de las infecciones nosocomiales en 891 pacientes colonizados tratados mediante la aplicación de mupirocina nasal pomada (n = 891; PP: 0,49% [IC del 95%: 0,25-0,92%]; RD: 3,8% [IC del 95%: 0,6-7,0%]), pero no en todo el grupo36.
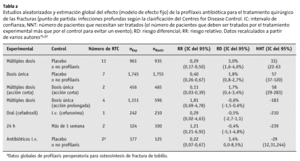
La tabla 1 muestra los resultados más relevantes del artículo del NHS-HTA de 1999 y los cálculos añadidos. Se limita a los antibióticos más frecuentemente utilizados en la profilaxis peroperatoria, es decir, las cefalosporinas de primera, segunda y tercera generación46.
El estudio del HTA no halló diferencias entre:
* La profilaxis con cefalosporinas de primera y segunda generación y teicoplanina, cefonicid, cefamandol, cefotaxima, cefradino, la cloxacilina o ticarcillino/ácido clavulánico y
* La profilaxis durante 24 h y la de mayor duración.
La eficacia del cemento óseo impregnado de antibiótico sólo se aleatorizó en 3 estudios, utilizando métodos que no permiten comparaciones, siendo los resultados inconsistentes (tabla 1). No se ha demostrado en estudios clínicos la validez de la profilaxis con antibiótico oral.
Profilaxis antibiótica peroperatoria en cirugía de fracturas de fémur proximal y fracturas cerradas de huesos largos del miembro inferior
Los resultados de la revisión de Cochrane publicados en el año 2000 son prácticamente iguales a los del estudio del HTA, en relación con el reemplazamiento articular total15. Se incluyeron 22 estudios aleatorizados, de los cuales trece sólo hacían referencia a las fracturas proximales de fémur. Se descartó un estudio placebo-control publicado en 1994 sobre la profilaxis antibiótica peroperatoria en la reducción abierta y osteosíntesis interna de las fracturas de maléolo lateral32.
Utilizando los mismos modelos de efectos fijos, la revisión de Cochrane, observó una reducción del riesgo significativa para:
* Profilaxis monodosis con cefazolina, meticilina, cefuroxima o ceftriaxona en comparación con el placebo o la no profilaxis.
* Administración múltiple peroperatoria de cefotiam, cloxacilina, cefuroxima, cefalotina, nafcilina, cefazolina, dicloxacilina o cefamandol en comparación con el placebo o la no profilaxis (tabla 2).
También se observó una significativa reducción del riesgo en infecciones secundarias en comparación con el placebo:
* Infecciones nosocomiales del tracto urinario: RR, 0,63 (IC del 95%: 0,53-0,76%); RD, 5,5% (IC del 95%: 3,2-7,8%); p < 0,0001.
* Neumonía nosocomial: RR, 0,46 (IC del 95%: 0,33-0,65%); RD, 3,5% (IC del 95%: 1,9-4,9%); p < 0,0001.
Los pacientes que recibieron fármacos efectivos, en dosis múltiples, presentaron mayor incidencia de efectos secundarios gastrointestinales, como era de esperar (RR: 1,83 [IC del 95%: 0,96-3,50%]; RD: 1,3% [IC del 95%: -1,5-3,9%]). En relación con las alergias cutáneas, no se encontraron diferencias entre el fármaco real y el placebo.
No se hallaron diferencias entre:
* Profilaxis peroperatoria únicamente el día de la intervención frente a terapia antibiótica durante una semana.
* Monodosis con una cefalosporina de acción prolongada (ceftriaxona, cefotaxima) en comparación con múltiples dosis con agentes de acción corta.
* Antibióticos orales o parenterales específicos.
A excepción de la cefalosporina de acción corta, cefazolina, la profilaxis con dosis múltiples es más eficaz que con un única dosis (tabla 2).
Resumen de las observaciones
Podemos establecer las siguientes ventajas e inconvenientes de la profilaxis antibiótica peroperatoria para la cirugía ósea limpia y la cirugía articular.
Ventajas
* Coste-efectividad. Las cefalosporinas de primera y segunda generación son asequibles como medicamentos genéricos.
* La reducción relativa del riesgo de infección profunda tras la cirugía electiva de recambio articular es del 75%. La diferencia del riesgo absoluto entre los agentes activos y el placebo se calcula en un 3%.
* La reducción relativa del riesgo de infección profunda tras la cirugía de las fracturas del miembro inferior es del 60% para la profilaxis con dosis única y del 70% para la profilaxis con dosis múltiples. La diferencia del riesgo absoluto entre los agentes activos y el placebo se calcula en un 2 y 3%, respectivamente.
* La reducción relativa del riesgo de infecciones nosocomiales del tracto urinario tras la cirugía de recambio articular es del 40%. La diferencia del riesgo absoluto entre los agentes activos y el placebo se calcula en un 4%.
Inconvenientes
* Existe un potencial alérgico de los derivados lactámicos utilizados en la profilaxis antibiótica. El riesgo en alergias demostradas a la penicilina es del 8,1% (IC del 95%: 6,1-10,2%), mientras que en pacientes con historia de sospecha de alergia el riesgo es del 1,9% (IC del 95%: 1,7-2,1%)29,37.
* Los antibióticos pueden provocar la aparición de una selección y proliferación de cepas bacterianas resistentes (enterocolitis causada por el Clostridium difficile).
La terapia antibiótica con cefalosporinas se considera un factor pronóstico independiente de:
Colitis por C. difficile: RR, 1,36 (IC del 95%: 1,02-1,82%)30.
Bacteriemia por E. faecalis: RR, 1,81 (IC del 95%: 1,45-2,62%)33.
Indicaciones
* Por su probada eficacia, se recomienda la profilaxis peroperatoria tanto en la cirugía de recambio articular como en la cirugía de la fijación de fracturas del miembro inferior. Este grado de recomendación está relacionado con el nivel de evidencia (meta-análisis de alta calidad de estudios control).
* Las cefalosporinas de primera y segunda generación son preferibles a los antibióticos de amplio espectro. Los datos actuales no justifican el uso de glucopéptidos potentes, como la teicoplanina para la profilaxis peroperatoria.
* La profilaxis antibiótica debería iniciarse antes de la incisión cutánea40.
* En un estudio control aleatorizado, no se observaron diferencias en la incidencia de infección entre la profilaxis monodosis y el tratamiento antibiótico mantenido varios días (nivel de evidencia Ib).
* En el tratamiento quirúrgico de las fracturas, las cefalosporinas de acción prolongada (ceftriaxona) se prefieren para la monodosis, mientras que las de acción corta (cefazolina) deberían utilizarse para el tratamiento de 24 h.
Otras recomendaciones
* Los datos actuales no permiten llevar a cabo una recomendación en relación con el uso rutinario de cemento impregnado con antibiótico.
* Existe poca información en relación con la profilaxis antibiótica para la cirugía del miembro superior, raquis, y pelvis24.
* La administración de antibióticos orales profilácticos dependerá de los estudios clínicos.
* Los efectos adversos relacionados con la profilaxis antibiótica deben comunicarse a los registros internacionales (Medwatch, Food and Drug Administration [FDA], http: //www.fda.gov/medwatch).
Correspondencia: Dr. Dirk Stengel. Arbeitsgruppe Methodik und Klinische Epidemiologie. Klinik für Unfall-und Wiederherstellungschirugie. Unfallkrankenhaus Berlin. Warener StraBe 7. D-12683 Berlín. Tel: (+49/30) 5681-0; Fax: -3003. Correo electrónico: dirk.stengel@ukb.de