Las infecciones postoperatorias representan una de las complicaciones más temidas en cirugía traumatológica y ortopédica. Las infecciones secundarias como la osteítis, osteomielitis, absceso intramedular, infección del lecho de la placa e infecciones que aparecen después de una osteosíntesis o de una implantación protésica juegan un papel cada vez más importante en la cirugía traumatológica y ortopédica.
Etiología
Se estima que la incidencia de infecciones que aparecen después de la implantación de materiales de osteosíntesis es del 5-10%, y del 1-3%10 -en algunos casos menor, del 0,25-2%40- tras una endoprótesis. En Alemania, la infección nosocomial en cirugía traumatológica y ortopédica es un problema que no se debe subestimar. En el aspecto socioeconómico, las infecciones postoperatorias suponen un enorme gasto en el presupuesto social del país5,34. Según el §23, art. 4 de la Ley de Protección contra Enfermedades Infecciosas (Infektionsschutzgesetz [IfSG]) alemana, estas infecciones nosocomiales y las infecciones por bacterias multirresistentes se deben registrar y hay que adoptar medidas especiales en el ámbito personal y organizativo14.
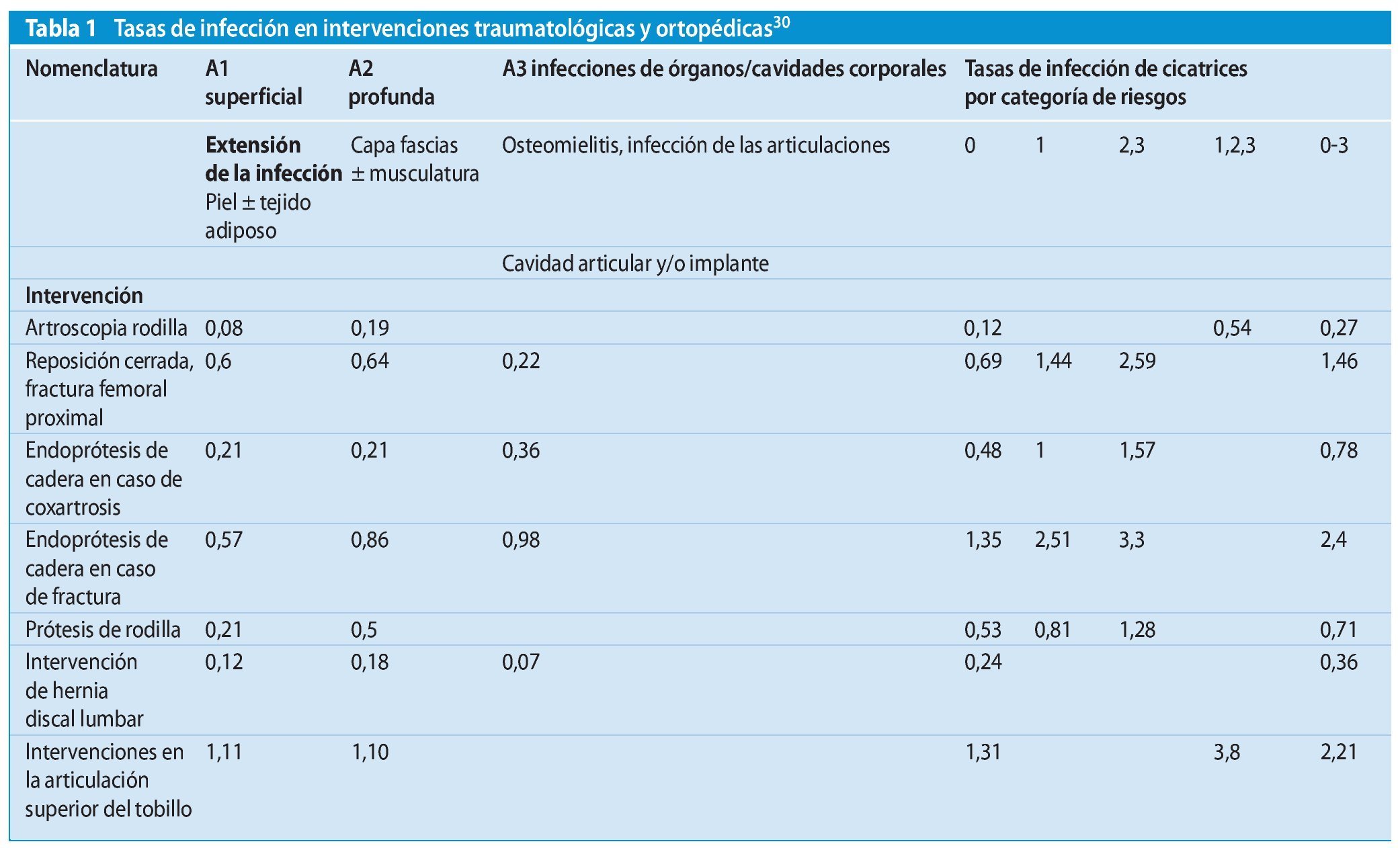
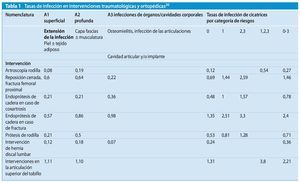
El Centro de Referencia Nacional de vigilancia de las infecciones nosocomiales (NRZ) del Instituto Robert Koch ha registrado las tasas de infección indicadas en la tabla 1 en las intervenciones traumatológicas y ortopédicas.
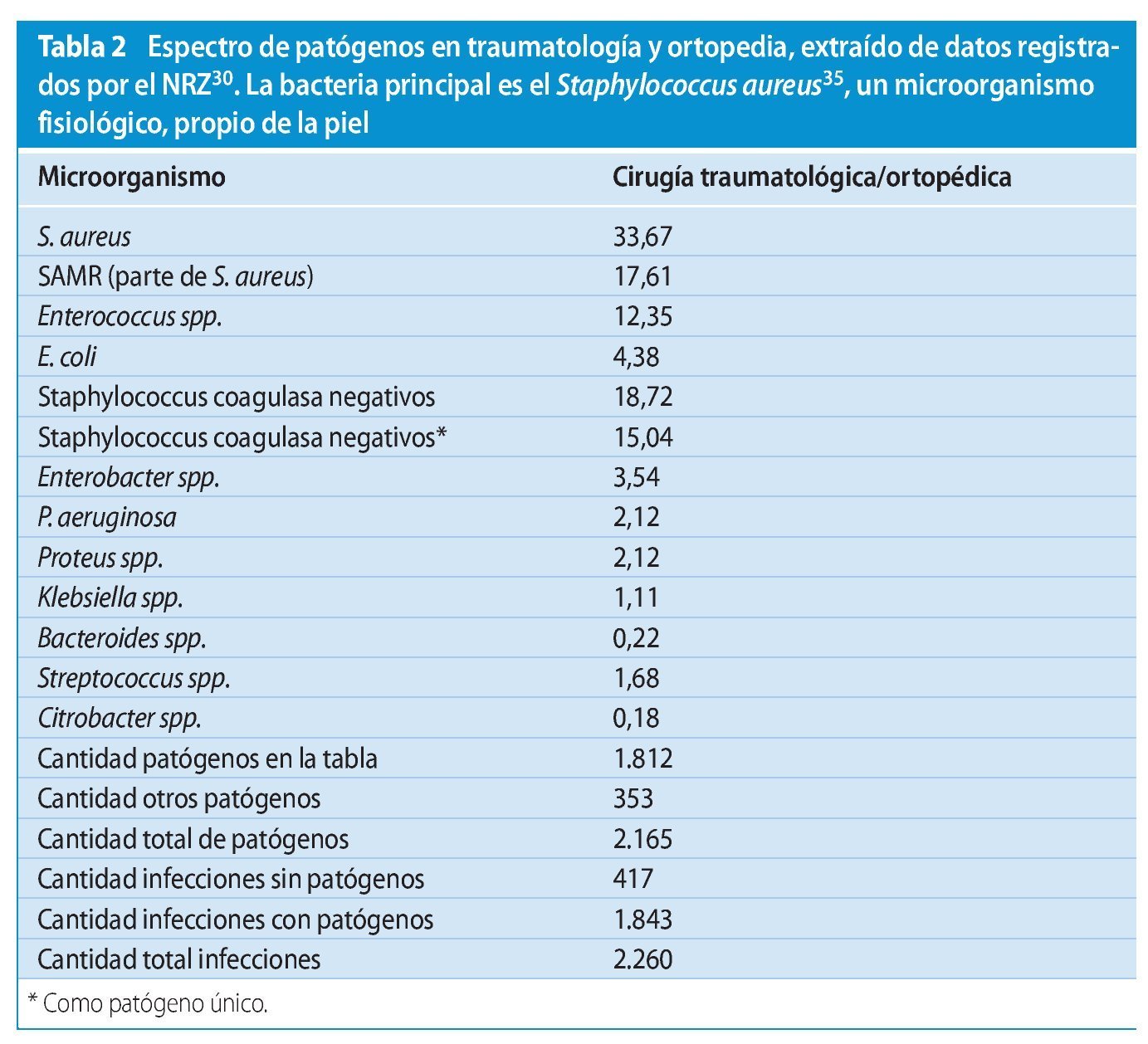
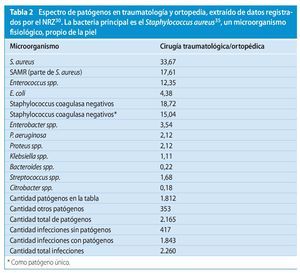
El espectro de agentes patógenos varía en comparación con otras disciplinas quirúrgicas. En el campo de la cirugía traumatológica y ortopédica, el NRZ indica el espectro bacteriológico representado en la tabla 231.
Prevención
Hay que considerar someter a los pacientes electivos a un cribado prehospitalario o preoperatorio teniendo en cuenta las ventajas que ello conlleva respecto a la reducción de las alteraciones en cicatrización postoperatorias35. Así mismo, se debe valorar someter a los grupos de riesgo (pacientes de residencias geriátricas, pacientes con múltiples estancias hospitalarias, etc.) a un cribado para la detección de SAMR31 (IA*). Desde hace muchos años, los Países Bajos han conseguido mantener la tasa de SAMR a un nivel admirablemente bajo con la aplicación de una política consecuente de «search-and-destroy» (buscar y destruir). Además, el tiempo del postoperatorio debería ser lo más corto posible31 (II).
* Los números entre paréntesis muestran el grado de evidencia.
Siempre que sea posible, antes de llevar a cabo una intervención electiva hay que identificar las infecciones manifiestas clínicamente dentro y fuera del área de intervención y terapiar adecuadamente31 (IA). El cirujano traumatológico y el cirujano ortopédico no deben hacer ninguna concesión respecto al tema de la higiene, tanto en la fase perioperatoria como en la intraoperatoria. Evidentemente, hay que seguir las recomendaciones sobre higiene de manos y sobre limpieza y desinfección de las salas de operaciones, especialmente de las superficies7,24, así como los requisitos sobre los productos médicos12. No obstante, varios estudios muestran que incluso en la cirugía ósea y protésica estas medidas no siempre se practican de manera consecuente2.
Las tareas de preparación de la zona a operar, como son el afeitado en la antesala y la depilación mecánica del vello, conviene realizarlas inmediatamente antes de la intervención31 (IB); así pues, se evitará efectuar la depilación mecánica el día anterior a la intervención. Se recomienda utilizar con preferencia cremas depilatorias31 (IA). Antes de la desinfección se procederá a eliminar cualquier suciedad de la piel intacta en el área a operar31 (IB). Se sobreentiende la necesidad de una desinfección cutánea suficiente, así como una técnica de cubrimiento adecuada21,41. Durante el tiempo de aplicación la piel deberá estar cubierta completamente y se mantendrá húmeda poniendo atención en que no exista ninguna parte del cuerpo sumergida en el líquido31.
» Se deben cumplir estrictamente las medidas de higiene
La profilaxis antibiótica es una medida estándar en la osteosíntesis y en la implantación de endoprótesis27. Hay que aplicar la profilaxis antibiótica perioperatoria segura y establecida indicada para cada tipo de intervención18,31 (IA); en el momento de la incisión se deberá haber alcanzado el grado de eficacia del antibiótico.
También es necesario realizar una técnica quirúrgica aséptica y llevar a cabo la intervención bajo protección de las partes blandas para obtener un resultado libre de infecciones tras la osteosíntesis y la artroplastia. Esto significa que al final de la intervención se debería extraer el tejido avital —por ejemplo, el tejido comprimido— para reducir el medio de cultivo del crecimiento bacteriano. La duración de la intervención debe ser lo más corta posible, puesto que se ha demostrado que tiempos de intervención largos pueden aumentar las tasas de infección9. Por este motivo, en la fase intraoperatoria hay que volver a desinfectar la piel alrededor de la zona de incisión y, en caso necesario, administrar una segunda dosis de antibiótico cuando la intervención es muy larga.
Se deberá evitar en todo momento la acumulación de líquidos en la zona de la herida evacuándolos mediante un sistema de drenaje cerrado31 (IB), que se dejará el menor tiempo posible y que no drenará los líquidos a través de la herida quirúrgica, sino por una vía separada31 (IB). A fin de evitar la aparición de infecciones, se evitarán sistemas de drenaje abiertos31 (IB).
» El cirujano tiene la tarea de controlar la cicatrización postoperatoria
Con frecuencia, el cierre de la herida al final de la osteosíntesis o de la implantación de la prótesis es realizado por los colegas más noveles. También en este caso se actuará con especial atención y se procederá siguiendo la técnica de cierre de heridas29 para prevenir alteraciones en la cicatrización de la misma.
Las comorbilidades y factores de riesgo como la diabetes mellitus, el tabaco, una alimentación deficitaria y la adiposidad, entre otros, influyen en la cicatrización postoperatoria y aumentan la posibilidad de que se produzcan alteraciones en la cicatrización de la herida20,31, especialmente cuando el implante se encuentra situado a poca profundidad debajo de la piel28.
El cambio de vendaje postoperatorio y, por consiguiente, el control postoperatorio de la cicatriz es tarea del cirujano y de su equipo. A fin de cuentas, el control de la herida y por tanto la evaluación del proceso de cicatrización postoperatorio son responsabilidad del cirujano, del mismo modo que lo son la preparación preoperatoria y la información al paciente. Ello permite al cirujano una detección temprana de cualquier irregularidad en el proceso de cicatrización y reaccionar en consecuencia. Una herida con cierre primario se considera clínicamente cerrada sin drenaje después de 24 horas. Desde el punto de vista higiénico, el primer cambio de vendaje de una herida quirúrgica cerrada no se debería realizar hasta pasadas 24-48 horas31.
En caso de que la cicatriz supure durante el postoperatorio o que el vendaje se suelte, se procederá al cambio aséptico del vendaje31 (IB). Cualquier manipulación en el lugar de extracción del drenaje se realizará bajo condiciones asépticas31 (IB). Para garantizar la protección de las personas, el cambio de los recipientes de recogida se realizará con guantes31 (asépticos) (IV). Los recipientes de recogida no se deben elevar por encima del nivel de salida del drenaje a fin de evitar el reflujo del líquido contaminado hacia la cicatriz31 (IB).
Infecciones
Los implantes aumentan el factor de inoculación, por ejemplo, del Staphylococcus aureus, en un factor mayor de 100.000 42.
Además del resultado clínico local, otros medios auxiliares de diagnóstico son los parámetros de laboratorio como la PCR y la cantidad de leucocitos, que pueden ser un factor de apoyo para la indicación de realizar una revisión. Con frecuencia, la PCR se mantiene en un nivel alto incluso semanas después de la intervención quirúrgica y muestra valores menores al 79% e incluso al 68% en cuanto a especificidad y sensibilidad33. El aumento del número de leucocitos no supone una distinción inequívoca entre infección y no-infección. La procalcitonina, la interleucina-6 y la TNF-α son marcadores potentes, pero también muy costosos.
Diagnóstico microbiológico
El diagnóstico microbiológico es codeterminante en caso de producirse una infección. El porcentaje de bacterias identificadas en una infección varía entre fracturas abiertas y cerradas. En fracturas cerradas se identifica un 55% de Staphylococcus aureus, un 26% de otras bacterias Gram positivas como estreptococos y un 8% de bacterias Gram negativas6. En una fractura abierta dominan bacterias como la Pseudomanas aeruginosa, la Enterobacteriaceae y la Acinetobacter6.
Toma de muestras
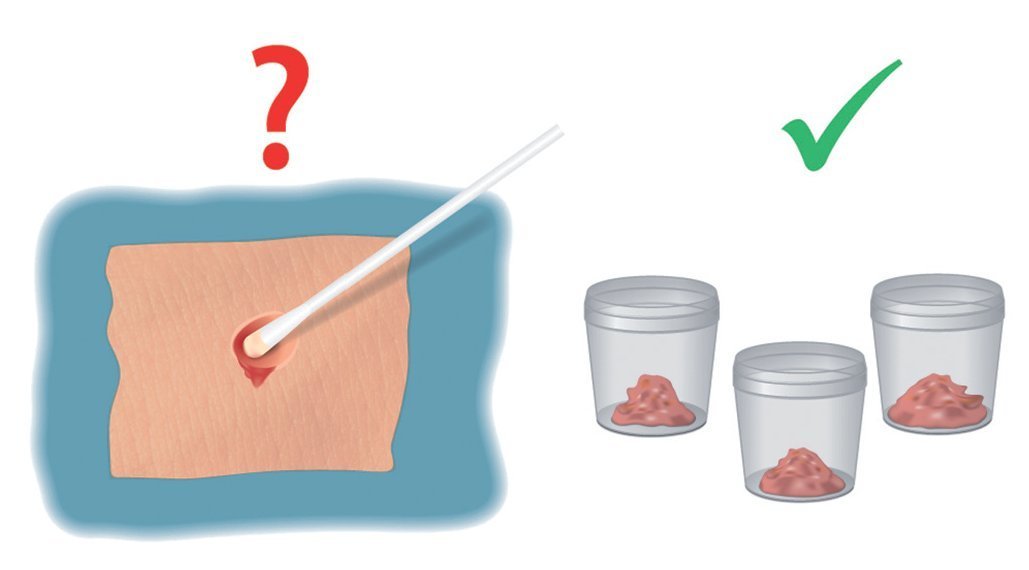
Las tomas de muestras de una herida infectada no suelen ser ni muy exactas ni sensitivas (figs. 1).
Fig. 1 Toma de muestras de una herida con fístula después de una osteosíntesis en el fémur proximal. Las tomas de muestras en si no son determinantes para la detección de microorganismos; las pruebas de tejidos se deberían someter a un análisis microscópico.
En caso de infecciones profundas, las tomas de muestra realizadas con hisopos a menudo no muestran las bacterias determinantes. Estas tomas de muestra con frecuencia identifican bacterias superficiales o planctónicas; el biofilm sobre el implante no se desprende, por lo que no es posible comprobar la existencia de bacterias en esta zona11,17,25.
En caso de que el resultado de presencia de bacterias sea negativo, se deberá cuestionar la toma de muestras. En lugar de tomas de muestras superficiales son preferibles las tomas de muestras de tejido del área infectada, cultivadas e incubadas durante un máximo de dos semanas22. Hay que extraer líquido sinovial de la articulación y someterlo a un análisis microbiológico e histológico32.
Para verificar la presencia de infecciones quirúrgicas el cirujano no debería limitarse a la toma de pruebas del exudado de la herida.
Biofilm
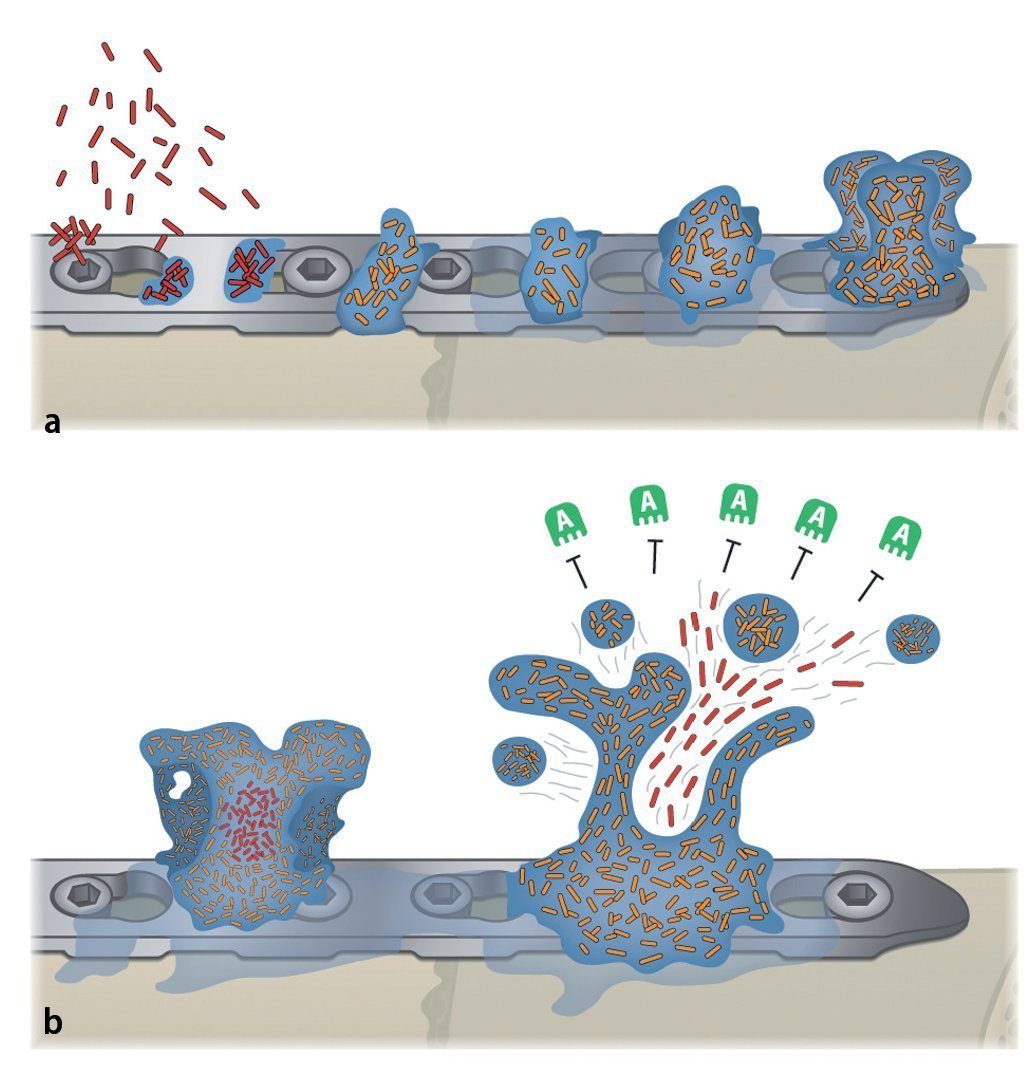
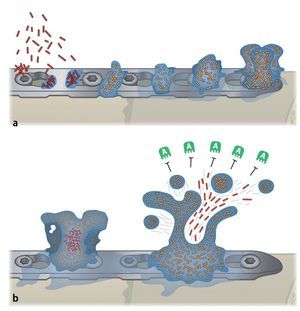
Ante una infección de la endoprótesis o del material osteosintético se deberá iniciar el tratamiento quirúrgico correspondiente combinado con una terapia antibiótica conforme al protocolo3 (de profilaxis antibiótica). Antes de administrar una terapia antibiótica conforme al protocolo hay que tener en cuenta que las bacterias sobre la superficie del implante, sea de titanio o de aleaciones de acero, forman un biofilm que protege las bacterias de los antibióticos4,8,36,37,39. También se ha identificado presencia de biofilm en infecciones del material de sustitución ósea y de esponjosa8. En compartimentos líquidos pueden existir bacterias planctónicas, de libre flotación, o bacterias sésiles (adherentes) en las superficies. Con frecuencia, los antibióticos consiguen llegar solo las bacterias planctónicas libres, ya que las bacterias que viven en el biofilm están protegidas, producen una capa extracelular polímera (EPS, «extracelular polymeric substances»26), resistente al ataque de los antibióticos (figs. 2).
Fig. 2a) Las bacterias (planctónicas) libres (rojo) entran en contacto con las superficies del implante, se adhieren inmediatamente y producen una matriz polímera extracelular y empiezan a colonizar (amarillo). b) El biofilm cubre rápidamente la superficie del implante con una estructura tridimensional. Se pueden soltar partículas de células y producir más biofilm multilocular. Los antibióticos (verde) no pueden atacar el biofilm. A anticuerpos.
Sonicación
El biofilm se desprende de la superficie del implante mediante la aplicación de ultrasonido. La vibración mecánica superior a 20 KHz provoca la implosión de los líquidos contenidos en el biofilm y, por consiguiente, su desprendimiento de la superficie del implante. Ello supone el crecimiento de la cantidad de cultivo y aumenta la identificación de bacterias38.
La sonicación puede aumentar notablemente la identificación de infecciones provocadas por el uso de implantes en el cultivo posterior19,23. Mediante la aplicación de técnicas de PCR especiales tras una sonicación, se puede obtener una mayor identificación bacteriana, incluso bajo tratamiento antibiótico en curso1,13]. En caso de presencia manifiesta de biofilm, la erradicación de las bacterias apenas es posible sin la eliminación del implante16. Sin embargo, ante un caso de infección, el objetivo debe ser erradicar radicalmente las bacterias y, por consiguiente, la infección.
Tratamiento antibiótico
La administración sistemática de antibióticos como tratamiento único no resulta muy eficaz a la hora de eliminar la infección. La aplicación de una terapia antibiótica únicamente tiene sentido tras realizar un desbridamiento quirúrgico radical. La administración local de antibióticos produce un claro aumento de la concentración del medio in situ15.
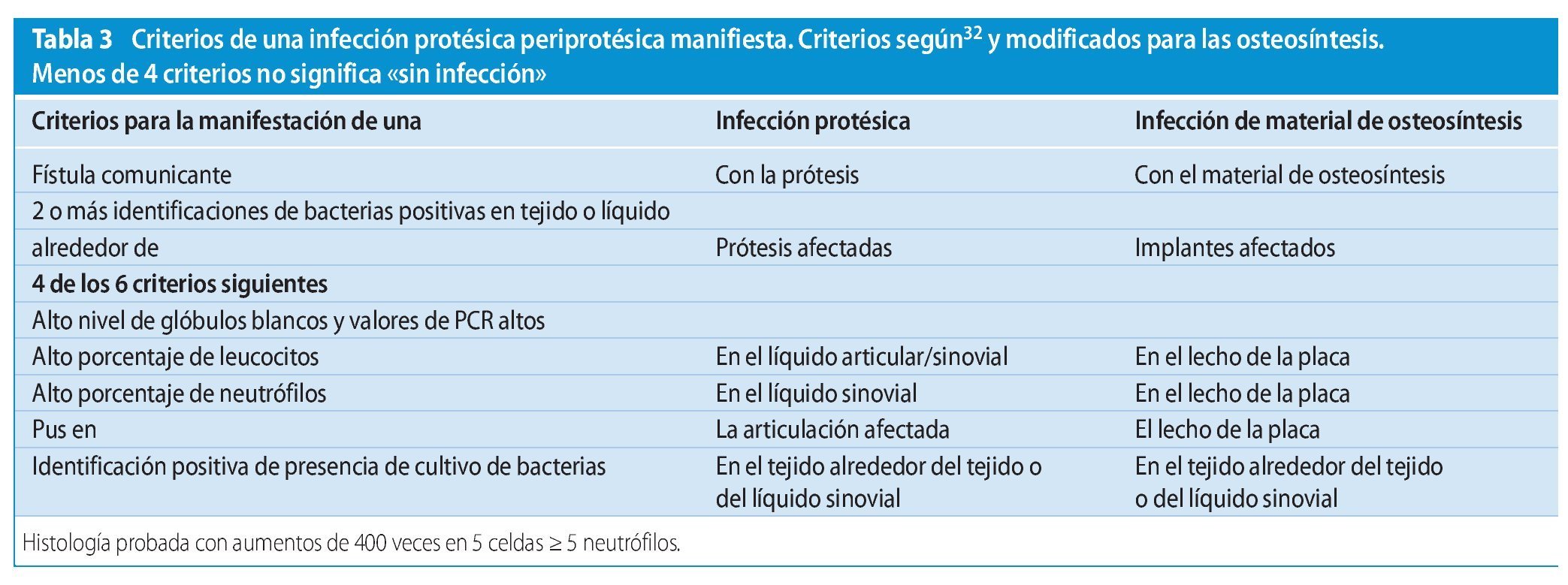
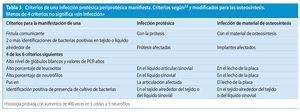
La Musculoskeletal Infection Society publicó en 2011 una nueva definición de las infecciones protésicas32, que en el presente trabajo presentamos modificada también para infecciones de osteosíntesis (tabla 3).
En este cuaderno se describen algunas de las múltiples infecciones que aparecen después de intervenciones quirúrgicas, osteosíntesis o implantes endoprotésicos y se presentan con detalle los conceptos de su eliminación. En este artículo no se han considerado las infecciones óseas ni de partes blandas.
La cirugía séptica constituye un gran reto. Las intervenciones sépticas son intervenciones que suponen un reto incluso para el cirujano experimentado y que no forman parte del temario de su formación, puesto que pueden conllevar graves consecuencias personales, sociales y laborales para el paciente en caso de convertirse en procesos crónicos.
En principio, se considera que el tratamiento de fracturas estables después de un desbridamiento radical, la cirugía endoprotésica de revisión y la terapia antibiótica local son los pilares del tratamiento quirúrgico.
K. Dresing
Correspondencia
Prof. Dr. K. Dresing
Klinik für Unfallchirurgie,
Universitätsklinik Göttingen Robert-Koch-Str. 40,
37075 Göttingen (Alemania)
klaus.dresing@med.uni-goettingen.de