Notas preliminares
Neer recomendó la hemiartroplastia primaria para las fracturas desplazadas en cuatro partes15,16. Argumentaba que la reducción abierta y fijación interna es difícil y con frecuencia asocia malos resultados. La principal dificultad radica en que los métodos de fijación interna pueden proporcionar una reducción adecuada, pero son insuficientes para mantenerla. Además, hay pocos implantes disponibles que aseguren un anclaje sólido en hueso osteoporótico. La mayoría de los resultados malos se deben a una reducción insuficiente de los fragmentos o a una pérdida de la reducción, así como a necrosis avascular postraumática8. Parece que los resultados tras una artroplastia secundaria son inferiores a los que se obtienen tras una implantación primaria5. Por todo ello, muchos cirujanos han recomendado una hemiartroplastia precoz para fracturas desplazadas en tres y cuatro partes, intentando mejorara los resultados6,8,11,12.
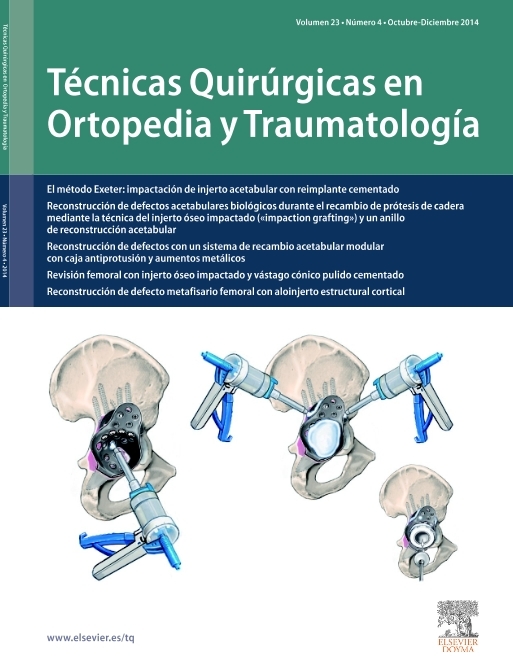
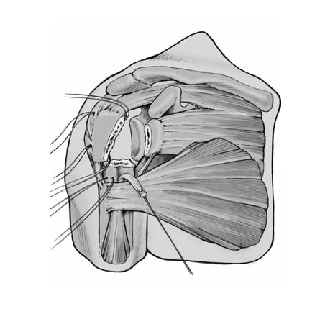
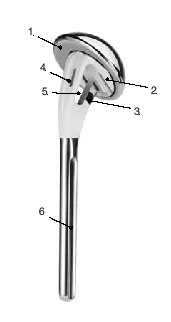
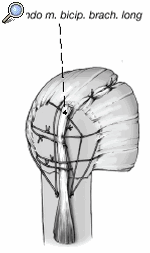
Tanto los implantes como la técnica y el instrumental quirúrgicos han experimentado mejorías constantes3. Esto llevó al diseño de prótesis para fracturas mucho mejores que los implantes estándar. La zona metafisaria de la prótesis para fractura actual es diferente de la de las prótesis convencionales. Su diseño permite la fijación de las tuberosidades fracturadas entre el vástago y la porción cefálica de la prótesis. Las características mejoradas del área de unión son las siguientes (fig. 1):
Figura 1. Prótesis para fracturas Aequalis. 1: cabeza humeral con "offset" posterocraneal; 2: parte que soporta la cabeza con dos surcos para facilitar la retirada en caso de ser necesaria; 3: porción no recubierta de hidroxiapatita para evitar el desgaste de las suturas; 4: parte lateral adelgazada de la sección metafisaria de la prótesis recubierta de hidroxiapatita; 5: ventana en la metáfisis de la prótesis para insertar tacos de hueso esponjoso(vástago de diseño abierto); 6: vástago.
* La parte proximal de la diáfisis está adelgazada lateralmente y fenestrada en su porción central (diseño de vástago abierto). Esto proporciona más espacio disponible para la colocación de las tuberosidades y de hueso esponjoso con el fin de mejorar la consolidación de las tuberosidades.
* La aleta perforada de la parte lateral del vástago proximal que sirve para la colocación de las suturas, se sitúa más anterior; esta parte con frecuencia es pequeña y a veces omitida. Estas variaciones permiten encajar mejor las tuberosidades sin lesionarlas.
* La fijación de las tuberosidades se logra con suturas resistentes que se pasan alrededor de la porción metafisaria del vástago. La superficie de la parte medial del vástago es redondeada para prevenir el desgaste de las suturas. El vástago dispone unos orificios laterales, como alternativa para pasar las suturas.
* El diseño de la porción proximal del vástago permite la fijación de las tuberosidades con tornillos o con agujas de Kirschner.
* La conexión entre el vástago y la cabeza está diseñada de tal manera que la posición de rotación de la cabeza protésica se puede modificar tras la colocación definitiva del vástago.
* Los vástagos no cementados pueden bloquearse, lo que evita la rotación.
Existe varios modelos de prótesis que incorporan estas ventajas en mayor o menor medida. El nuevo modelo desarrollado por Tornier Co (38330 St. Ismier, Francia; fig. 1) es un ejemplo de los avances en el desarrollo de este tipo de implantes.
Principios quirúrgicos y objetivos
Sustitución de la cabeza humeral por una prótesis que está anclada al canal medular y que permite ajustar adecuadamente la altura y la rotación. Restitución de la forma y de la función de la articulación glenohumeral.
Recuperación de la función del manguito de los rotadores gracias a la consolidación ósea de los fragmentos tuberositarios en posición anatómica.
Ventajas
* Restitución de la inclinación y de la rotación correctas de la cabeza humeral.
* Estabilidad y transmisión de fuerzas al húmero inmediatas a través del implante.
* Evita una reconstrucción complicada de la cabeza humeral fracturada, que en ocasiones precisa el aporte de hueso esponjoso.
* Evita las complicaciones secundarias a la fijación interna inestable.
* No existe riesgo de necrosis avascular postraumática.
Inconvenientes
* Riesgo de colocación de la prótesis en una posición incorrecta con respecto a la altura y la rotación.
* Riesgo de desplazamiento precoz y secundario, así como de seudoartrosis o reabsorción de las tuberosidades, que conllevaría a la pérdida de función del manguito de los rotadores, con una tendencia a la luxación anterosuperior de la prótesis.
Indicaciones
* Absoluta: fractura de la cabeza humeral con separación significativa o total del fragmento articular (fracturas conminutas o depresión de la superficie articular > 40º).
* Relativas: fracturas de la cabeza humeral en tres y en cuatro fragmentos desplazadas.
* Factores que aconsejan la colocación de una prótesis:
- Osteoporosis importante.
- Número de fragmentos (> 3).
- Nivel de la fractura (trazo de fractura que recorre el cuello anatómico, fragmentos articulares pequeños).
- Grado de desplazamiento entre el borde distal del fragmento articular y la diáfisis humeral (el desplazamiento mayor de 6 mm es indicativo de ruptura del periostio que une el fragmento articular con la porción medial de la diáfisis humeral, y, por tanto, de la ruptura de los vasos que nutren el fragmento articular17,18.
- Desplazamiento completo del fragmento articular hacia los tejidos circundantes, especialmente en los casos de fractura-luxación.
- Ausencia de sangrado del fragmento articular durante la cirugía.
- Imposibilidad de reconstruir anatómicamente la cabeza humeral durante la cirugía.
- Edad avanzada.
* No se puede establecer un límite máximo de edad; sin embargo, debería procurarse conservar la cabeza humeral en aquellos pacientes que están en activo.
Contraindicaciones
* Contraindicaciones habituales tales como el elevado riesgo de la anestesia, estado precario de las partes blandas, o infecciones locales.
* Reconstrucción estable de la fractura en una posición casi anatómica de las tuberosidades y aporte sanguíneo conservado al fragmento articular.
* Paciente no colaborador (alcoholismo, adicciones, enfermedades psiquiátricas)11.
Información para el paciente
* Complicaciones habituales tales como la infección, lesión de grandes vasos, y reducción del arco de movilidad.
* Lesión del nervio axilar o del plexo braquial.
* Riesgo de fracturas intraoperatorias de la diáfisis humeral.
* Mala-alineación primaria o secundaria, o aflojamiento del implante.
* Desplazamiento, seudoartrosis, o resorción de las tuberosidades.
* Artrosis de la fosa glenoidea que conlleva dolor y limitación de la movilidad.
* Necesidad de una nueva intervención quirúrgica de revisión debido a las complicaciones previamente mencionadas.
* Fisioterapia durante al menos 3 meses, preferiblemente en un centro de rehabilitación.
* Reincorporación laboral como mínimo a los 2 meses, y para los trabajadores manuales a los 4 meses.
* Las expectativas del paciente pueden incluir la función adecuada y no dolorosa para las actividades de la vida diaria que no precisen uso extremo del hombro.
Planificación preoperatoria
* Evaluación de la circulación periférica, movilidad y sensibilidad, en especial, en el área dependiente del nervio axilar.
* Radiografías del hombro afectado en tres proyecciones (anteroposterior verdadera [AP], proyección en Y y axial).
* Radiografías de Velpeau1 cuando el brazo no pueda ser abducido (evaluación en el plano axial). El número de fragmentos no puede ser determinado sólo con dos proyecciones.
* Radiografía anteroposterior del húmero contralateral para establecer su longitud.
* Tomografía computarizada (TC) de la cabeza humeral fracturada, si las radiografías en tres planos no se pueden realizar o bien si el estado del fragmento articular no puede ser evaluado de forma fiable.
* Plantillas para superponer sobre las radiografías para establecer el tamaño de la cabeza humeral y el diámetro de la diáfisis.
* Administración única de antibiótico, como una cefalosporina de segunda generación.
Instrumental quirúrgico
* Prótesis modular de la cabeza humeral tipo Aequalis (fig. 1) que incluye la guía para fracturas (Tornier Co, 38330 St. Ismier, Francia).
* El vástago está fabricado en titanio 130 mm; la parte proximal está recubierta de hidroxiapatita. Esta parte tiene dos surcos que facilitan, en caso de revisión, la retirada del vástago una vez ya está osteointegrado. Hay diez tamaños de cabeza humeral fabricada con cobalto-cromo (37 x 13,5 mm hasta 52 x 23 mm; talla estándar 46 x 17 mm).
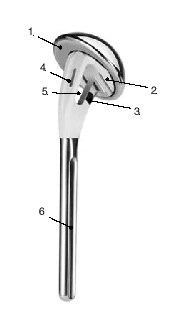
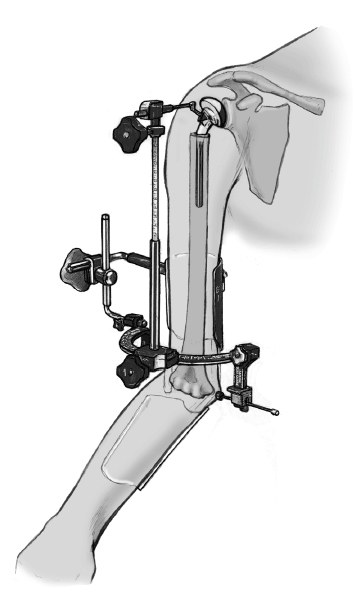
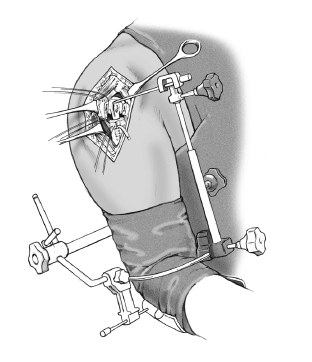
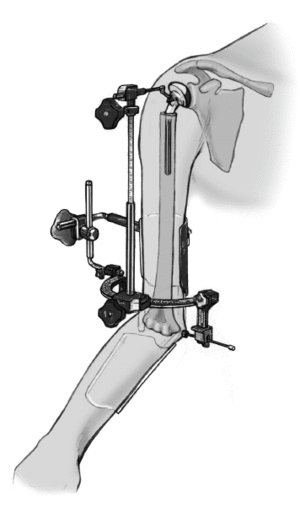
* La técnica quirúrgica descrita a continuación está basada en la utilización la guía para fracturas (fig. 2) que facilita la colocación correcta con respecto a la altura y a la rotación3,4.
Figura 2. Guía para la fractura. 1: soporte para la prótesis; 2: pieza angular; 3: escala de longitud; 4: arco de retroversión; 5: conector; 6: férula de antebrazo; 7: pinza para los epicóndilos.
* Muchos de los pasos quirúrgicos se pueden realizar independientemente del tipo de prótesis que se utilice, y son válidos para cualquier tipo de prótesis para fracturas.
* Suturas resistentes irreabsorbibles con agujas grandes para periostio, como el Ethibond® 6 (Ethicon Co, 22851 Norderstedt, Alemania).
Anestesia y colocación
* Anestesia orofaríngea, se puede complementar con una bloqueo de plexo braquial interescalénico según técnica de Winnie9.
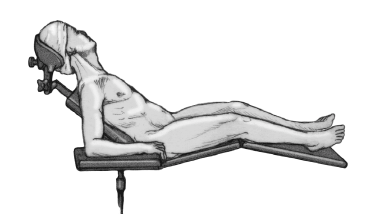
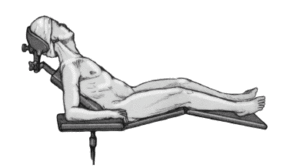
* Posición de tumbona de playa con la cabeza sobre un soporte en copa.
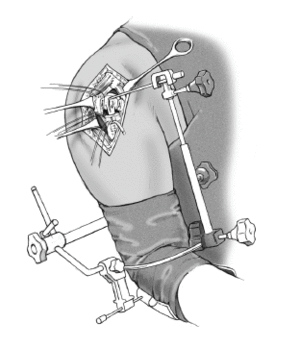
* El paciente debe quedar los suficientemente próximo al borde de la mesa para permitir la aducción libre de el brazo extendido (fig. 3).
Figura 3. Colocación del paciente en posición de tumbona de playa y colocación del antebrazo en un soporte de brazo.
* Colocación del antebrazo en un soporte de brazo de altura regulable recubierto con tallas estériles.
* Ajuste preoperatorio de la posición del aparato de escopia a la cabeza de la mesa de operaciones.
Técnica quirúrgica
Figuras 4 a 18
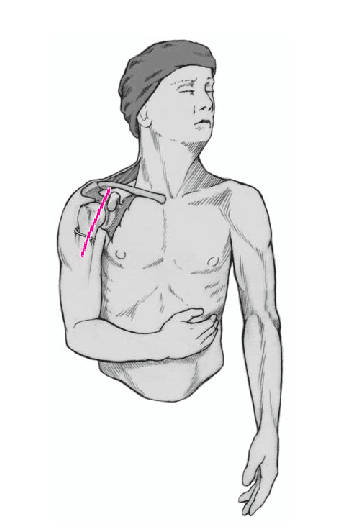
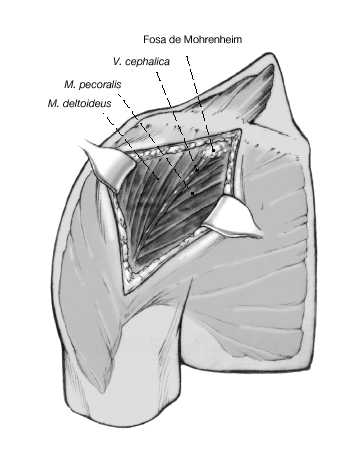
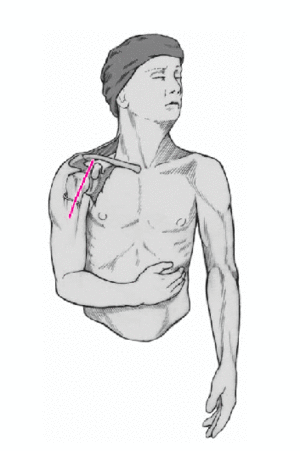
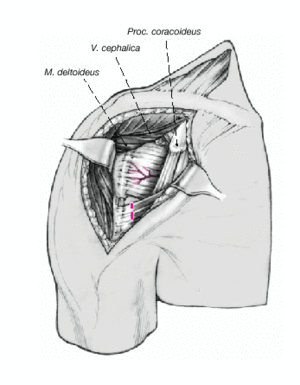
Figura 4. Incisión cutánea larga de 10 cm que empieza ligeramente medial y caudal a la articulación acromioclavicular y que se dirige hacia la inserción del deltoides. Debe quedar a unos 3 cm de distancia del pliegue axilar para evitar contracturas cicatriciales. Se incide el tejido celular subcutáneo hasta el plano muscular.
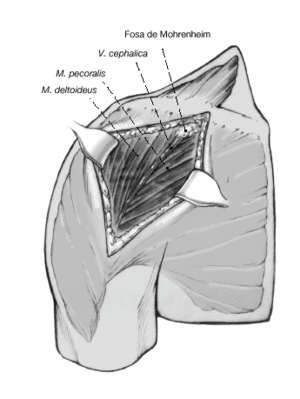
Figura 5. Se identifica el deltoides en dirección a la punta de la coracoides ("faro" del hombro). De esta manera se encuentra fácilmente el surco deltopectoral. Se puede reconocer por un filete fino de grasa en el que se aloja la vena cefálica.
Figura 6. Para profundizar en el surco, la vena cefálica se separa en sentido lateral preservando las ramas musculares que drenan el deltoides. Se puede seccionar parcialmente el músculo pectoralis major. Se expone la cabeza humeral mediante la disección roma y la liberación cuidadosa con tijeras por debajo de la superficie profunda del deltoides. Se puede abducir ligeramente el brazo elevando el soporte de brazo. La bursa subacromial equimótica se reseca parcialmente para mejorar el abordaje.
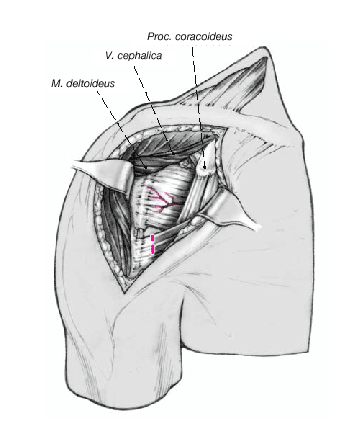
Figura 7. Se pueden palpar las dos tuberosidades siguiendo el tendón de la porción larga del bíceps. Cuando se trata de una fractura en cuatro partes, el trazo de fractura discurre entre las dos tuberosidades. El hueso que subyace al sulcus es muy duro habitualmente, por lo que es muy raro que se vea fracturado.
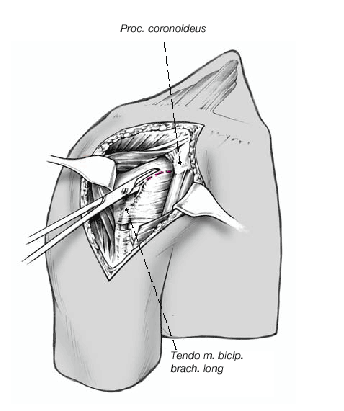
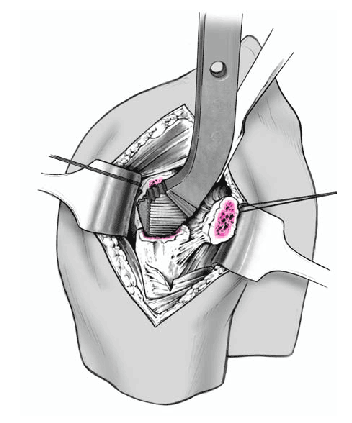
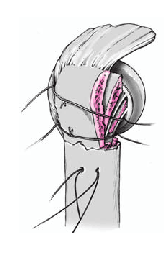
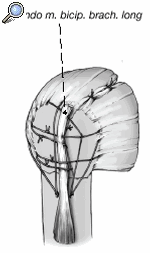
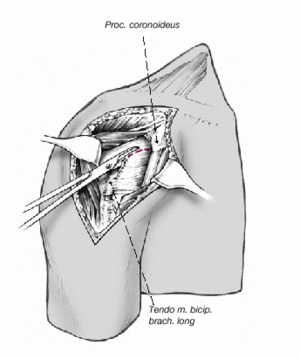
Así que lo más frecuente es que el sulcus esté en continuidad con la tuberosidad menor, es mucho menos frecuente que esté junto con la tuberosidad mayor. La separación entre las tuberosidades puede ser tan pequeña que impida la inspección del fragmento articular, y en estos casos se separan dichas tuberosidades. Esta separación ha de ser lo más cuidadosa posible, evitando la separación del periostio que une las tuberosidades con la diáfisis; la conexión perióstica es primordial para la vitalidad de las tuberosidades. Si fuere necesario, se puede abrir el manguito de los rotadores en el sentido de sus fibras. Se colocan suturas de tracción en los tendones del manguito, proximales a las tuberosidades mayor y menor. Permiten rechazar las tuberosidades exponiendo la porción larga del bíceps. Se desinserta este tendón del tubérculo supraglenoideo y se monta temporalmente con una sutura de tracción.
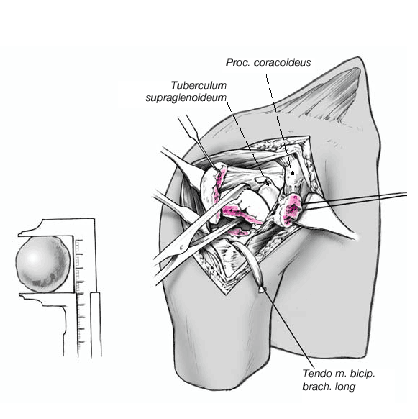
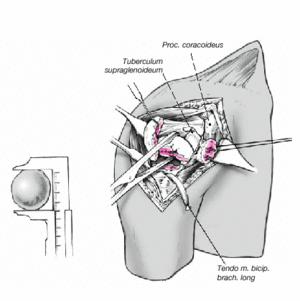
Figura 8. El fragmento articular se encuentra habitualmente entre las dos tuberosidades. La limpieza de las superficies de hueso esponjoso permite evaluar su aporte sanguíneo. Se extrae el fragmento articular con una pinza puntiaguda. Las resistencias que se puedan presentar durante esta extracción suelen deberse a puentes periósticos entre el fragmento articular y la diáfisis. Si en este momento se desestima la posibilidad de reconstrucción, las uniones periósticas se cortan a tijera. Se mide el fragmento articular y se compara su tamaño con las cabezas de prueba. En caso de duda, seleccionaremos el tamaño menor.
Figura 9. Retirada del soporte de brazo. El ayudante mantiene el brazo en aducción máxima, extensión, y una ligera rotación externa. La parte proximal de la diáfisis humeral queda expuesta. Entonces se pondrá de nuevo especial atención en conservar el periostio que conecta las tuberosidades con la diáfisis. Puede ser necesario fresar un poco el canal medular para crear un lecho para el vástago de la prótesis. En general, el vástago utilizado es el de 9 mm. En cambio, en varones se puede llegar a colocar un diámetro de 12 mm. El vástago de diámetro 6,5 mm se reserva para casos excepcionales.
Se monta la prótesis de prueba. La cabeza seleccionada se monta en posición de "R" en los hombros derechos, y en posición de "L" en los hombros izquierdos. De esta manera la cabeza queda unos milímetros posterior con respecto al eje de la diáfisis, reproduciendo la anatomía normal.
Figura 10 . El paso más difícil es decidir la posición adecuada de la prótesis (retroversión y altura); la mayoría de errores se producen en este paso. No debemos basarnos nunca en la evaluación "de visu". Boileau & Walch3 demostraron que dicha evaluación, aún hecha por cirujanos experimentados, conduce en el 30% de los casos a errores de colocación de la prótesis, causando obviamente un mal resultado.
Se ha desarrollado una guía para la fractura, para tratar de evitar este tipo de resultados desgraciados. Se sujeta la férula antebraquial al antebrazo con una venda estéril. Entonces
el cirujano fija el arco de retroversión a los epicóndilos con la pinza de sujeción, el ayudante lo aprieta, y lo fija a la férula antebraquial. La guía para fracturas tiene en su extremo proximal una pieza angular que conecta a la prótesis. Esta guía permite colocar la prótesis con 20º de retroversión en relación al eje transcondilar3,4. La altura de la prótesis, y en consecuencia, la longitud del húmero depende de la situación anatómica. La longitud del húmero contralateral se habrá determinado en una radiografía preoperatoriamente y nos da una referencia aproximada de la altura idónea.
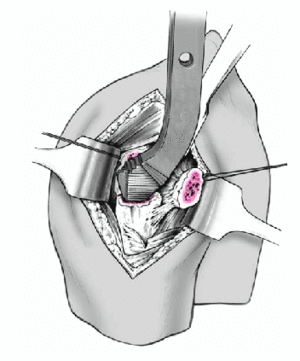
Se introduce la prótesis de prueba en el canal medular con ayuda de un introductor. Durante la introducción, se separan cuidadosamente las tuberosidades, para facilitar el paso.
Al mismo tiempo, se conecta el raíl vertical de la guía para fracturas al introductor de la prótesis. Se aproximan las tuberosidades y se reponen sobre la parte proximal de la prótesis. La posición de retroversión es la definitiva.
Figura 11
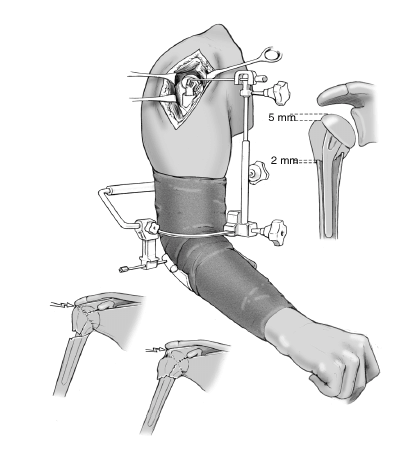
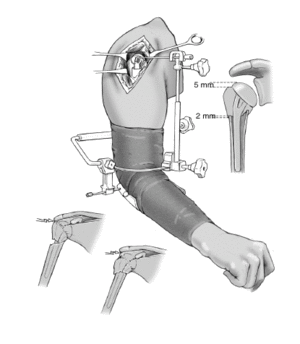
A continuación se comprueba la altura adecuada de la prótesis. Requisito imprescindible será la posición en íntimo contacto o con una superposición menor de 2 mm entre el borde caudal de las tuberosidades y el límite proximal de la diáfisis. Así se asegura la consolidación, ya que cualquier distracción entre los fragmentos llevaría a la seudoartrosis. En esta posición, el extremo proximal de las tuberosidades deberá quedar 5 mm por debajo del punto más alto de la cabeza. Si las inserciones del manguito de los rotadores protruyen por encima de la prótesis, significa que la cabeza se ha colocado demasiado alta. La guía para fracturas deberá de ajustarse en una posición más baja. Si el borde superior de las tuberosidades queda por encima o al mismo nivel de la cabeza, la cabeza de la prótesis ha quedado demasiado baja y debe ajustarse la guía en una posición más alta.
La ventaja de la guía radica en la posibilidad de mover el brazo del paciente junto con la prótesis de prueba en todas las direcciones incluida la rotación, sin provoca movilidad entre la prótesis y el canal medular del húmero. Estas comprobaciones permiten determinar si existe un pinzamiento durante la abducción entre cabeza y acromion, la tensión que sufren las tuberosidades durante las rotaciones interna y externa, y además si la prótesis tiene tendencia a la luxación. Se realizan tantos ajustes como sea necesario para corregir todos los puntos hasta que el cirujano esté satisfecho.
La colocación intraoperatoria apropiada de la prótesis se puede confirmar con el método descrito, o bien con el aparato de escopia. Así se comprueba la altura adecuada de las tuberosidades y de la cabeza de la prótesis. Es muy importante que la transición entre una metáfisis humeral con forma de embudo y la cabeza de la prótesis sea suave y sin escalones. Es un signo fiable de que la cabeza se ha colocado a una altura adecuada. En caso contrario, deberá corregirse. También se puede comprobar que se ha seleccionado el tamaño apropiado de la cabeza. En un estudio multicéntrico de prótesis Aequalis2 se solicitó a los cirujanos que evaluaran radiografías postoperatorias; un 49% consideró que los resultados eran subóptimos. Esto refuerza la necesidad de realizar un control radiológico durante la cirugía.
La evaluación de la colocación adecuada del implante durante la cirugía "de visu" y con escopia precisa una experiencia muy extensa. Por tanto, no debería descartarse el uso de la guía para fracturas sin una buena razón.
Figura 12
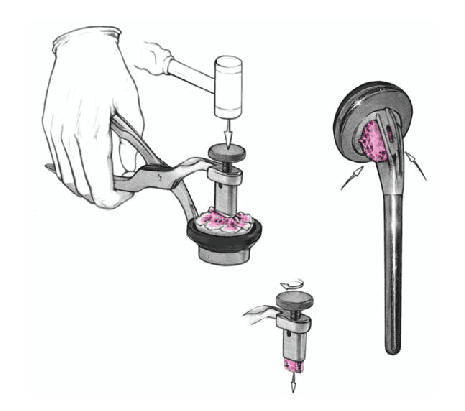
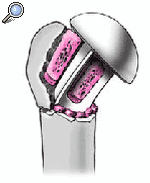
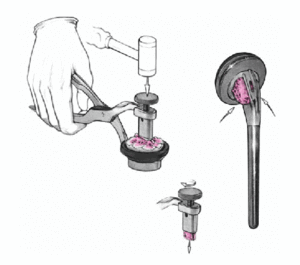
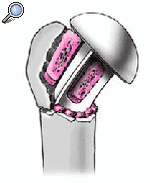
Se coloca el brazo en aducción, se separan las tuberosidades, se expone de nuevo la diáfisis humeral, y se retira la prótesis de prueba. Se monta el implante definitivo utilizando la de prueba como modelo. Se impacta la cabeza en el vástago con un buen golpe con el impactador específico. No se fija con el tornillo de bloqueo. Así se posibilita la retirada de la cabeza sin extraer un vástago cementado en el caso de una revisión posterior. El vástago abierto tiene la ventaja que da la colocación de un injerto de hueso esponjoso de forma cúbica obtenido de la cabeza resecada en la ventana metafisaria de la prótesis. Este taco mejora la consolidación de las tuberosidades.
Figura 13
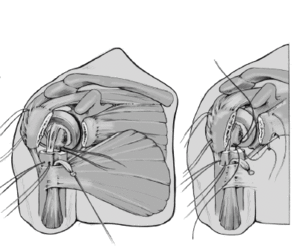
Antes de cementar el vástago de la prótesis definitiva, se perforan dos orificios de 2 mm en la parte lateral del húmero proximal laterales al surco bicipital. Se pasan dos suturas no reabsorbibles del 6 a través de estos agujeros. Se pasan 4 suturas proximalmente a la inserción del manguito en la tuberosidad mayor, dos de ellos caudales a través de la inserción del supraspinatus y del infraspinatus, y los otros dos caudales a través de la inserción del teres minor. Esas suturas se pasan de fuera a dentro.
Figura 14
A continuación se introduce un tapón que ocluya el canal medular y un drenaje. Se compacta el cemento dentro del canal, se retira el tubo de drenaje, y la prótesis definitiva se inserta montada en la guía. La ventaja más importante de la guía es que la prótesis se puede cementar garantizando una altura y rotación idénticas a las del implante de prueba. El cemento sobrante en el extremo proximal de la diáfisis se retira con cuidado de no lesionar el periostio de las tuberosidades. Se rellena todo el espacio entre la prótesis y la diáfisis humeral con injerto de hueso esponjosos de la cabeza humeral.
Figura 15
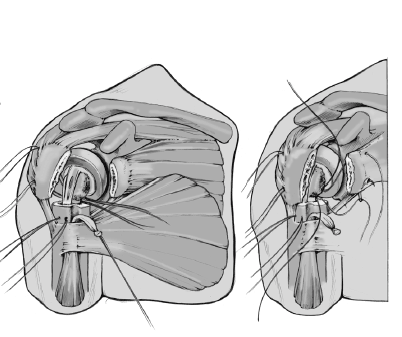
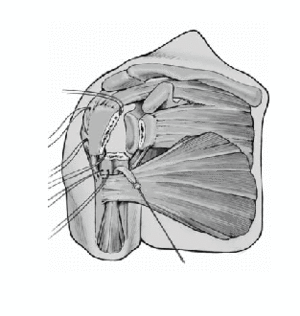
Se retira la guía una vez que el cemento ha fraguado. Los cuatro hilos colocados horizontalmente en la inserción del manguito rotador se pasan por delante del cuello de la prótesis. Además, se pasa una de las suturas craneales y una de las caudales, a través del tendón del subscapularis cerca de la tuberosidad menor de dentro afuera. Estos anclajes aseguran las tuberosidades avulsionadas al implante y evitan cualquier desprendimiento de las tuberosidades por tensión (aleteo).
Figura 16
Se reduce cuidadosamente la prótesis manteniendo el brazo en abducción, en este punto, se vuelve a colocar el soporte de brazo. Se extraen uno o dos bloques de hueso esponjoso
de la cabeza humeral y se colocan lateralmente entre la metáfisis de la prótesis y la superficie fracturada de la tuberosidad mayor. Esto es necesario para alcanzar la posición adecuada
de la tuberosidad mayor debido al diseño medializado de la prótesis. Todo el hueso esponjoso sobrante de la cabeza humeral se fragmenta y se coloca en las brechas restantes entre implante y tuberosidades.
Figura 17
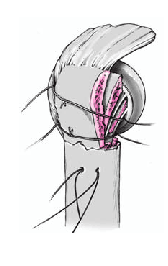
Se anudan las suturas de reinserción de las tuberosidades. Primero se fijan las dos suturas colocadas en el manguito de los rotadores y en la tuberosidad mayor. La superficie anterior del vástago no está recubierta de hidroxiapatita para prevenir el desgaste de las suturas. A continuación se anudan las suturas pasadas a través del subscapularis y de la tuberosidad menor. Si se ha abierto el manguito de los rotadores para facilitar el abordaje, se tiene que cerrar este defecto con dos suturas no reabsorbibles del número 2.
Figura 18
Las suturas que atraviesan la diáfisis humeral se pasan a continuación través de la inserción del manguito de los rotadores alrededor de las dos tuberosidades y se anudan. Se incluye
en la sutura el tendón de la porción larga del bíceps que se había desinsertado proximalmente (tenodesis). Estas suturas proporcionan un efecto de banda de tensión y aumentan la estabilidad rotacional.
Se coloca un drenaje aspirativo de calibre 14. cuando sea necesario, se aproximan las estructuras que delimitan el surco deltopectoral con suturas reabsorbibles de 2-0. Cierre del tejido celular subcutáneo con puntos invertidos de hilo 3-0, sutura intradérmica de la piel.
Consideraciones especiales
* En los casos de fractura-luxación, el fragmento articular puede haberse desplazado a través de la cápsula en dirección a la axila y quedar en la proximidad del plexo braquial y de los vasos. Su extracción puede resultar difícil. Se debe prestar especial atención al nervio axilar; debe localizarse mediante palpación antes de extraer el fragmento. Si se retira de manera poco cuidadosa, se puede romper la arteria circunfleja anterior humeral o bien se puede arrancar de la arteria axilar. El sangrado que se produciría en tal caso, es difícil de controlar y sólo se puede acceder ampliando el abordaje mediante la osteotomía de la coracoides.
* Si, cuando se extrae el fragmento articular, se identifica una afectación de tipo artrósico de la fosa glenoidea, deberá plantearse la colocación de una prótesis total de hombro. En este caso, se seleccionará un implante glenoideo de grosor especialmente fino, de manera que no se aumente la tensión sobre las tuberosidades reancladas. Esta es una situación extremadamente compleja desde un punto de vista técnico, se plantea de manera excepcional durante las hemiartroplastias primarias por fractura, y precisa una gran experiencia. Las lesiones por avulsión ósea del reborde anterior de la glenoides (lesión de Bankart ósea) no precisan fijación, pero si la precisan los fragmentos de Bankart grandes3.
Manejo postoperatorio
* Inmovilización de la extremidad en un vendaje de tipo Gilchrist durante 4-6 semanas. Un estudio multicéntrico sobre las prótesis Aequalis ha demostrado que la inmovilización prolongada reduce a la mitad la incidencia de desplazamiento secundario de las tuberosidades y, por tanto, mejora de manera considerable el resultado si se compara con la movilización pasiva precoz recomendada originalmente por Neer2,15,16. Los resultados finales también eran mejores con la inmovilización en aducción que en abducción.
* Los drenajes aspirativos se retiran entre las 24 y las 72 h postoperatorias, una vez que el volumen aspirado en las 24 h previas sea < 50 ml. No deberá retirarse más allá de las 72 h. La sutura intradérmica se retira a los 10-14 días. Se puede prolongar el bloqueo interescalénico de Winnie19 durante 3-5 días para aliviar el dolor.
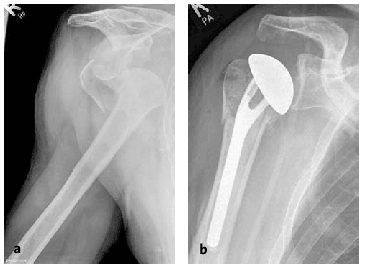
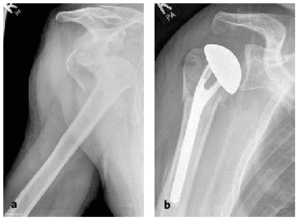
* Los pacientes son evaluados diariamente durante la primera semana o cada dos días, incrementando progresivamente el intervalo hasta la semana 12 postoperatoria. Después de la primera radiografía postoperatoria (fig. 19), las siguientes radiografías se hacen en las semanas 2, 6 y 12. Sólo será necesario obtener imágenes con mayor frecuencia cuando se observe un empeoramiento clínico.
Figura 19a y b. Paciente varón de 80 años que sufrió una fractura-luxación en cuatro partes.Radiografías AP pre-(a)y postoperatoria (b).
* Se empieza la rehabilitación durante los primeros días del postoperatorio. Una vez que se ha controlado el dolor, se empiezan los ejercicios activos asistidos de la muñeca y del codo durante las primeras 4 semanas, así como ejercicios escapulares y entrenamiento postural. Para evitar el edema y el dolor, recomendamos aplicar frío local y drenaje linfático.
* A partir de la semana 4 se pueden comenzar los ejercicios con elevación y abducción hasta 80º. Estos ejercicios serán siempre controlados por un fisioterapeuta y no deberán provocar dolor. No se autorizan los movimientos rotatorios del hombro y los ejercicios activos hasta que se ha confirmado la consolidación de las tuberosidades tanto clínica como radiológicamente.
* A partir de la semana 5, se retira el vendaje de Gilchrist progresivamente durante el día, pero dependiendo de la sintomatología, puede ser útil mantenerlo durante la noche. Entonces se empiezan los ejercicios activos asistidos de hombro, pero limitándolos a la elevación anterior y la abducción. A partir de la semana 7, se incrementa el rango de movilidad dependiendo de los síntomas, empezando por la movilización asistida de las rotaciones. En esta fase la fisioterapia está centrada en el programa de potenciación muscular y en ejercicios de estabilización y coordinación. La hidroterapia es altamente recomendable.
* La fisioterapia se hace intensiva tras mantener al menos 4 semanas de inmovilización. En ese momento, recomendamos que se ingrese al paciente en un centro de rehabilitación durante 3 semanas; los resultados de este enfoque terapéutico son superiores a los de la terapia ambulatoria2.
Errores, riesgos y complicaciones13,14,20
* Luxación o malposición significativa de la prótesis o de las tuberosidades en la radiografía postoperaroria: tanto la luxación, como la retroversión de más de 40º, como cualquier grado de anteversión, se toleran muy mal. Por tanto, recomendamos la revisión a pesar de tener que abordar un vástago cementado, especialmente cuando las tuberosidades están arrancadas (requisito para que se produzca un desplazamiento cuando la retroversión es correcta). Esto afecta sobre todo al desplazamiento posterosuperior de la tuberosidad mayor, que debe ser corregido. El éxito de esta operación depende de que se realice en las primeras 2 semanas postoperatorias ya que el manguito de los rotadores se va a retraer progresivamente. Si las tuberosidades ya se han reabsorbido, aunque se aporte injerto óseo esponjoso, el éxito de la revisión es poco probable. En los pacientes de más de 75 años recomendamos aceptar la situación y la limitación funcional que ésta supone (objetivo limitado)2. Soluciones alternativas: en los pacientes jubilados se puede hacer un recambio por una prótesis Delta de Grammont10 que funciona aún en ausencia de tuberosidades; en los pacientes jóvenes: artrodesis.
* Lesión nerviosa o del plexo: evaluación neurológica meticulosa, y comparación con la situación preoperatoria. ¿Estamos ante una lesión del nervio axilar? ¿Puede considerarse una lesión intraoperatoria? ¿Tracción excesiva? ¿Sección? ¿Contacto con el cemento durante la fase de fraguado? Si no se puede descartar la sección nerviosa, se deberá explorar dicho nervio y en caso de ser necesario se reparará según técnicas microquirúrgicas. Las lesiones secundarias del plexo suelen producirse por tracción y, por tanto, se enfocarán de manera conservadora.
* Fractura intraoperatoria de la diáfisis humeral: colocar un vástago más largo para alinear la fractura. A pesar de que este sistema de fijación interna no suele proporcionar estabilidad rotacional, suele ser aceptable, ya que siempre es necesario mantener una inmovilización postoperatoria.
* Infección: revisión inmediata, desbridamiento, y limpieza exhaustiva con un lavado tipo "Jet". Se retira la cabeza, se puede lavar y colocar de nuevo, o se cambia por un nuevo implante. Si las tuberosidades son viables todavía, deberán reducirse los fragmentos de nuevo una vez retiradas las suturas que generalmente están rotas. Se administran cefalosporinas de segunda generación hasta que se conozca el resultado del antibiograma, entonces se administrará la terapia específica. En función de la gravedad de la infección, se planea una nueva revisión quirúrgica al cabo de 2 días. Si la infección persiste a pesar de estas medidas, se retira el implante y se coloca un espaciador de ce mento Refobacin-Palacos. No se coloca de nuevo una prótesis hasta que la infección se haya curado definitivamente, a los 6-12 meses. También se pueden plantear las otras alternativas ya descritas.
* Hombro congelado: con frecuencia se debe a seudoartrosis, malposición o resorción de las tuberosidades, o malposición o luxación de la prótesis (véase más arriba). Si se excluyen todas estas causas, se puede plantear una artrólisis cerrada o abierta.
* Artrosis secundaria de la glenoides: cuando las tuberosidades estén consolidadas y el manguito rotador está indemne: recambio a una prótesis total de hombro. Las mismas alternativas ya descritas.
Resultados
En la Universidad Ludwig Maximilians de Munich, Alemania, se colocaron prótesis para fracturas en 72 pacientes, entre los años 1986 y 1996. se realizaron de manera primaria en 22 pacientes (grupo 1), y secundariamente en 50 pacientes (grupo 2). Se considera primaria la colocación cuando se realiza en los primeros 10 días del traumatismo sin que se haya realizado ninguna cirugía previa.
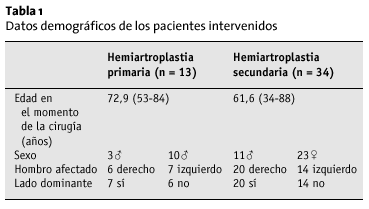
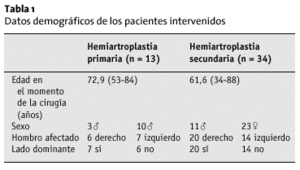
El seguimiento medio fue de 40 meses (15-70) en 13 pacientes del grupo 1, y de 44 meses (8-98) para 34 pacientes del grupo 2, 18 pacientes habían fallecido, y seis no pudieron localizarse o rechazaron acudir al control. En un caso, el implante se retiró por infección. Por tanto, el porcentaje de pacientes controlados fue del 59% en el grupo 1 y de 68% en el grupo 2. La edad media de los pacientes en el momento de la cirugía, el sexo, el lado afecto y la dominancia están recogidos en la tabla 1.
En los 13 pacientes del grupo 1 se colocó hemiartroplastia. Dos de los pacientes presentaban una fractura en tres fragmentos, y once de ellos fracturas en cuatro fragmentos. Según la clasificación AO, las fracturas eran de los tipos B3 en 2 pacientes, C2 en tres, y C3 en ocho. En cuanto al grupo 2, se colocaron prótesis totales en once de los 34 pacientes. El abordaje quirúrgico a través de las tuberosidades se utilizaba sólo cuando éstas no habían consolidado. En el resto de los casos se procedió igual que en los casos de artrosis glenohumeral.
Todos los pacientes fueron evaluados siguiendo la escala de Constant7. De un total de 100 puntos, se asignan 15 al dolor, 20 a las actividades de la vida diaria, 40 al rango de movilidad y 25 a la fuerza. La fuerza se midió con una balanza dinamométrica. La puntuación total se expresa en cifras absolutas y en parte en cifras relativas en comparación al hombro contralateral en el caso de que no se haya colocado prótesis en ese lado también. Además se realizaron radiografías en 3 proyecciones (AP verdadera, proyección en Y y axial). Por último, se les instaba a los pacientes a juzgar su grado de dolor, movilidad, fuerza y su valoración global mediante una escala visual analógica (1 = no satisfecho, 10 = muy satisfecho).
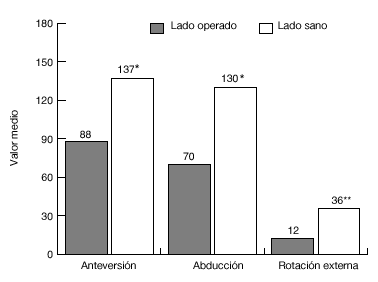
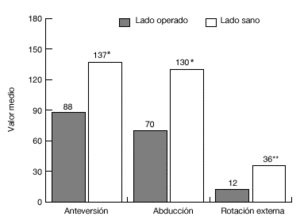
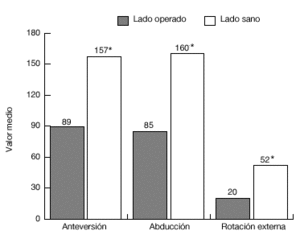
De los 13 pacientes del grupo 1, once estaban libres de dolor en reposo, ocho de ellos tenían dolor con el movimiento, y siete durante las actividades laborales. El grado de movilidad activa (fig. 20) y la fuerza eran significativamente menores que en el lado contralateral sano. Además, 11 pacientes eran capaces de llegarse a la boca, ocho llegaban al cuello, y siete podían atarse el delantal en la espalda. Sólo 2 pacientes eran capaces de realizar actividades por encima del nivel del hombro. Nueve pacientes tenían limitaciones para las actividades relacionadas con su trabajo o durante las actividades de la vida diaria.
Figura 20. Movilidad media de la paciente del grupo 1, en comparación con el hombro sano. *p <0,001; **p <0.01
La puntuación absoluta de la escala de Constant fue de 45 pun- tos (18-79, n = 11; en 2 pacientes inválidos no se pudo determinar dicha puntuación de manera fiable). La puntuación absoluta de la escala de Constant fue de 56% (35-100%, n = 11). Seis de los pacientes obtuvieron puntuaciones ¾ 50 puntos, cuatro puntuaron entre 51 y 75, y uno > 75.
Los factores que tuvieron una influencia negativa son:
* Fracturas conminutas (n = 5).
* Desplazamiento o reabsorción de las tuberosidades (n >= 8; determinado radiológicamente); al menos siete de estos pacientes sufrieron una migración ascendente de la prótesis.
* Atrofia muscular (n = 4).
* Pacientes crónicos (n = 4).
* Osificaciones heterotópicas(n >= 3).
* Lesiones traumáticas del plexo (n = 2).
A pesar de que el resultado objetivo sólo alcanzó un resultado satisfactorio, la evaluación global subjetiva fue buena, alcanzando 7,4 puntos (5-10) de 10. En la mayoría de los casos este resultado se debió a la desaparición o mejoría del dolor (media: 7,8)3-10. Los pacientes estaban menos satisfechos con el rango de movilidad (media: 5,9)2-10 pero discretamente más contentos de la fuerza (media: 6,5)2-10.
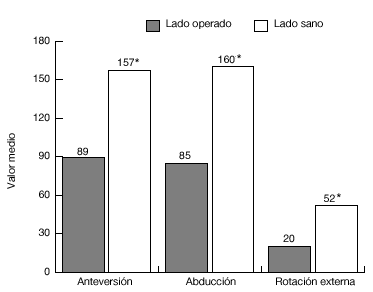
En los 34 pacientes del grupo 2, se podía comparar las puntuaciones pre y postoperatorias: postoperatoriamente, el dolor era significativamente menor (p < 0,001); 30 de los 34 pacientes afirmaron no tener dolor o bien tener un dolor leve ocasional. La intensidad del dolor durante el reposo, durante los movimientos y durante el esfuerzo y el dolor nocturno disminuyeron de forma significativa (p < 0,001). La antepulsión activa mejoró una media de 36º (n = 30; p < 0,001), y la rotación externa unos 15º (n = 28; p < 0,05). A pesar de dichas mejorías, el rango de movilidad del hombro afectado era menor que el del hombro sano (p < 0,001; fig. 21).
Figura 21. Movilidad media de los enfermos del grupo 2, en comparación con el hombro sano. *p <0,001; n=30, se excluyeron 2 pacientes operados bilateralmente.
La fuerza había disminuido en el postoperatorio en 32 pacientes. Siete de los pacientes no podían mantener el brazo en abducción de 90º contra la gravedad (signo de la caída del brazo). En cambio, 3 pacientes tenían una fuerza normal de abducción y de elevación anterior y cinco una fuerza normal en rotación externa. Las capacidades para las actividades de la vida diaria mejoraron significativamente. Ocho pacientes eran capaces de trabajar utilizando las manos por encima del nivel de los hombros. El número de pacientes que eran capaces de llegarse a la boca era significativamente mayor en el postoperatorio (p < 0,05), así como el número de aquellos que podían tocarse el cuello (p < 0,001), y de los que eran capaces de atarse el delantal en la espalda (p < 0,001).
El valor absoluto en la escala de Constant fue de 50 pun- tos (16,5-88, n = 33), y el relativo de 56% (18-96%, n = 31, sin contar 2 pacientes que fueron intervenidos de los dos hombros). Diecinueve pacientes (58%) tenían una puntuación ¾ 50, ocho (24%) entre 51 y 75 puntos, y seis (18%) > 75 puntos.
Los factores de mal pronóstico fueron:
* Intervenciones previas (no significativo, sólo una tendencia; p > 0,05).
* Atrofia muscular (p < 0,05).
* Una osificación heterotópica detectada de manera ocasional.
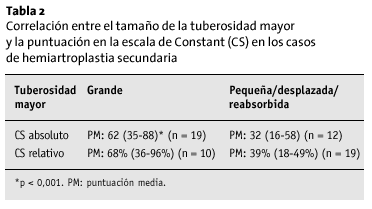
La influencia más determinante fue la del tamaño y posición de las tuberosidades. Los pacientes que tenían un fragmento grande de tuberosidad mayor tenían un resultado significativamente mejor que aquellos que tenían un fragmento pequeño (p < 0,001; tabla 2). El 65% de los pacientes con una puntuación de Constant ¾ 50 presentaba reabsorción o desplazamiento de la tuberosidad mayor, en el 47% de los casos ambas tuberosidades estaban reabsorbidas o ausentes. En 93% pacientes con una puntuación de Constant > 50 puntos, el fragmento tuberositario mayor era grande, una observación que se cumple en el 100% de los pacientes con una puntuación > 60 puntos (n = 31). La malposición de la tuberosidad mayor condujo a un resultado significativamente peor (p > 0,01); sin embargo, sólo se podía interpretar de manera apropiada la radiografía en 19 pacientes (tabla 3).
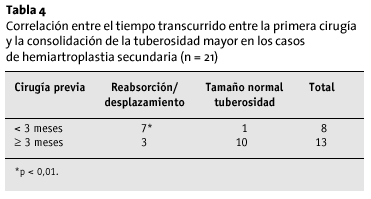
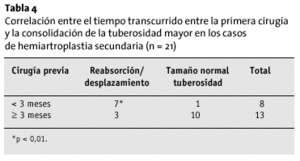
Ocho pacientes recibieron aporte de injerto óseo esponjoso en las tuberosidades. El injerto se reabsorbió en todos ellos, y, además, las tuberosidades perdieron su tamaño habitual. Las intervenciones previas fueron condicionantes de la vitalidad de las tuberosidades; en aquellos pacientes en los que no se había practicado ninguna intervención con anterioridad (n = 10), la incidencia de osteólisis y desplazamiento de las tuberosidades era significativamente menor (p < 0,05) que en los pacientes que ya habían sido operados (n = 21). Esto resulta interesante en tanto en cuanto establece un factor de tiempo-dependencia; cuando el intervalo entre el accidente, la cirugía previa y la colocación de la prótesis fue > 3 meses, las tuberosidades tenían una forma normal con más frecuencia (p < 0,05; tabla 4).
La satisfacción de los pacientes aumentó de manera significativa tras la cirugía (p > 0,001). Mejoró de 2,1 puntos en el preoperatorio a una media de 6,2 puntos (1-10) en el postoperatorio. El parámetro que reflejó más mejoría fue la reducción del dolor (media de 6,9 puntos1-10 en comparación con el valor preoperatorio de 2,8 puntos). El rango de movilidad y de fuerza alcanzaron 5,5 puntos (1-10) en comparación a los 2,3 y los 2,4 puntos respectivos en el preoperatorio.