El lupus eritematoso sistémico (LES) es una enfermedad autoinmune sistémica en cuyo mecanismo patogénico juega un papel fundamental la producción de autoanticuerpos. Por tanto, la terapia biológica dirigida contra el linfocito B es una opción lógica. En este artículo se revisan los últimos avances en el desarrollo de agentes biológicos contra el linfocito B en el tratamiento del LES. El rituximab ha sido utilizado en series abiertas que sugieren eficacia, pero dos recientes ensayos clínicos controlados han fracasado en demostrar eficacia frente a placebo. En cambio, belimumab ha demostrado eficacia estadísticamente significativa frente a placebo en condiciones de ensayo clínico aleatorizado. Atacicept, una proteína de fusión que bloquea citocinas imprescindibles para el trofismo de linfocitos B y células plasmáticas, produce una profunda reducción en los niveles de autoanticuerpos pero podría incrementar el riesgo de infección. Son necesarios más estudios para establecer el papel de la terapia biológica dirigida contra el linfocito B en el LES.
Systemic lupus erythematosus (SLE) is a systemic autoimmune disease. Autoantibody production plays a critical role in its pathogenic pathways. Thus, B-cell directed biologic therapy is a logical option. The present article reviews the latest advances in the development of B-cell directed biological agents in the treatment of SLE. Rituximab has been studied in a number of open series of patients that suggest efficacy but two recent controlled clinical trials have failed to show efficacy versus placebo. In contrast, a recent placebo-controlled, double-blind, randomized trial has reported that belimumab has statistically significant efficacy versus placebo. Atacicept, a fusion protein that blocks cytokines that play a critical role in the differentiation and survival of B-cells and plasma cells, markedly reduces autoantibody levels but could increase the risk of infection. Further studies are needed to establish the role of B-cell directed biologic therapy in SLE.
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune sistémica que afecta preferentemente a mujeres en edad fértil. Se desconoce su causa, aunque muy probablemente la responsable del desencadenamiento de la enfermedad es la interrelación entre factores genéticos poligénicos y determinados agentes ambientales. El tratamiento de las manifestaciones clínicas del LES se basa en la utilización de corticoides a diferentes dosis, antipalúdicos de síntesis e inmunosupresores como la ciclofosfamida, la azatioprina o el micofenolato. Por desgracia, los tratamientos disponibles en la actualidad no son capaces de controlar uniformemente las diferentes manifestaciones de la enfermedad en todos los pacientes ni de prevenir brotes futuros. Por ello, es de importancia crítica intentar desarrollar nuevas vías de tratamiento dirigidas a neutralizar las alteraciones inmunopatogénicas subyacentes de una forma más eficiente y selectiva.
La producción de autoanticuerpos juega un papel decisivo en la inmunopatogenia del LES1. Es más, los linfocitos B no sólo intervienen en la maduración hacia plasmoblastos y células plasmáticas productoras de autoanticuerpos, sino que desempeñan funciones de célula presentadora de antígeno, colaborando con el linfocito T en la generación de la respuesta inmune autoagresiva2. Es razonable, por tanto, pensar que la supresión de la función de los linfocitos B podría ser de utilidad terapéutica en el LES. En los últimos años diversos ensayos clínicos han explorado la seguridad y la eficacia de diferentes terapias anti-linfocito B en el LES.
RituximabEl rituximab es un anticuerpo monoclonal quimérico anti-CD20. La molécula CD20 se expresa selectivamente sobre los linfocitos B en sus diferentes etapas de maduración, incluyendo los linfocitos B de memoria, los linfocitos B vírgenes y los linfocitos B inmaduros, pero no se expresa en las células plasmáticas maduras. Aunque el tratamiento con rituximab produce una depleción profunda y prolongada de los linfocitos B de sangre periférica, los niveles séricos de inmunoglobulinas IgG e IgM no disminuyen de forma apreciable en la gran mayoría de los pacientes tratados, lo que pone de manifiesto que el rituximab es incapaz de eliminar las células plasmáticas maduras3. Se desconoce la función de CD20 y, de hecho, la unión de rituximab a CD20 no se traduce en señal específica intracelular alguna. Tras la unión de rituximab al CD20 de membrana se produce la muerte de la célula por lisis mediada por complemento, por citotoxicidad dependiente de anticuerpo o por apoptosis4. In vivo, la perfusión de rituximab produce una depleción rápida, profunda y mantenida de los linfocitos B circulantes. El rituximab ha demostrado su eficacia mediante ensayos clínicos controlados con placebo, aleatorizados, doble-ciego, en otras enfermedades autoinmunes, como la artritis reumatoide5,6, la esclerosis múltiple7 o la vasculitis asociada a anticuerpos anticitoplasma de neutrófilo8.
Diferentes comunicaciones de casos clínicos aislados y pequeñas series no controladas han sugerido la utilidad terapéutica del rituximab en el LES grave refractario a las medidas farmacológicas convencionales9–13. Estos esperanzadores datos condujeron a la realización de dos ensayos clínicos aleatorizados, doble-ciego, controlados con placebo de rituximab en el LES.
En el estudio EXPLORER14 se incluyeron pacientes de 18 a 65 años que cumplían los criterios de clasificación para LES del American College of Rheumatology (ACR) y que presentaban actividad moderada o grave, considerando como tal al menos un BILAG A (actividad grave en un órgano o sistema) o dos BILAG B (actividad moderada en dos órganos o sistemas). Los pacientes estaban recibiendo terapia concomitante con azatioprina, metotrexato o micofenolato a una dosis estable. Es interesante resaltar que se excluyeron los pacientes que presentaban afectación moderada o grave renal o del sistema nervioso central. Se incluyeron 169 pacientes en el grupo tratado con rituximab y 88 en el grupo placebo. Los fármacos inmunosupresores se mantuvieron a lo largo del estudio y los pacientes recibieron un curso de 10 semanas de duración de corticoides a dosis de 0,5 a 1mg/kg/día de prednisona, dependiendo de la dosis inicial del glucocorticoide y de la actividad de la enfermedad. Se administraron dos perfusiones de 1g de rituximab en los días 1 y 15, repitiéndose el mismo ciclo a los 6 meses. El estudio EXPLORER intentaba poner de manifiesto un efecto beneficioso del rituximab tanto en la inducción como en el mantenimiento de la respuesta clínica. Como medida de desenlace primaria se utilizó el índice BILAG15. Dicho índice gradúa la actividad lúpica en ocho órganos o sistemas, asignando una letra según la gravedad de la afectación: A es afectación grave, B es afectación moderada, C es afectación leve, D es inactivo actualmente pero activo con anterioridad y E es nunca activo. Se definió un brote grave como la aparición de un nuevo BILAG A o de dos BILAG B, mientras que el brote moderado se definió como la aparición de un BILAG B nuevo. Así mismo, una «respuesta clínica mayor» se definió como un BILAG C o mejor en todos los órganos o sistemas a la semana 24 de seguimiento, sin brotes graves a lo largo de 52 semanas y ningún brote moderado entre las semanas 24 y 52. Ambos grupos de tratamiento respondieron a la dosis inicial de glucocorticoides, con una mejoría significativa de la actividad clínica. No obstante, no se observaron diferencias entre rituximab y placebo en los criterios de valoración primarios o secundarios. En cambio, en un subanálisis por razas, especificado en el protocolo del ensayo, sí se demostró eficacia estadísticamente significativa del rituximab frente a placebo en pacientes de raza negra e hispanos, comparado con los demás individuos. El 20% de pacientes del grupo combinado de raza negra e hispanos presentó una «respuesta clínica mayor» con rituximab, frente al 9% con placebo. Los investigadores también realizaron un análisis post hoc analizando los resultados según el régimen de inmunosupresores que estaban recibiendo los pacientes. Encontraron que el rituximab era más eficaz que placebo en los pacientes tratados con metotrexato, con una mejoría significativa de la puntuación global del BILAG a la semana 52 (p=0,007). Aunque el rituximab no demostró efecto terapéutico sobre los criterios de valoración clínicos, sí se evidenció eficacia en deplecionar los linfocitos B circulantes, en reducir los niveles de anticuerpos anti-ADNn y en aumentar la concentración de los factores del complemento. Con respecto a los datos de seguridad, el 3,6% de los pacientes tratados con rituximab presentaron una neutropenia grave, frente al 0% del grupo placebo. Las infecciones por herpesvirus no serias aparecieron en el 15% del grupo tratado con rituximab, en comparación con el 8% del grupo tratado con placebo. Además, se evidenciaron cuatro episodios de enfermedad del suero en el grupo tratado con rituximab.
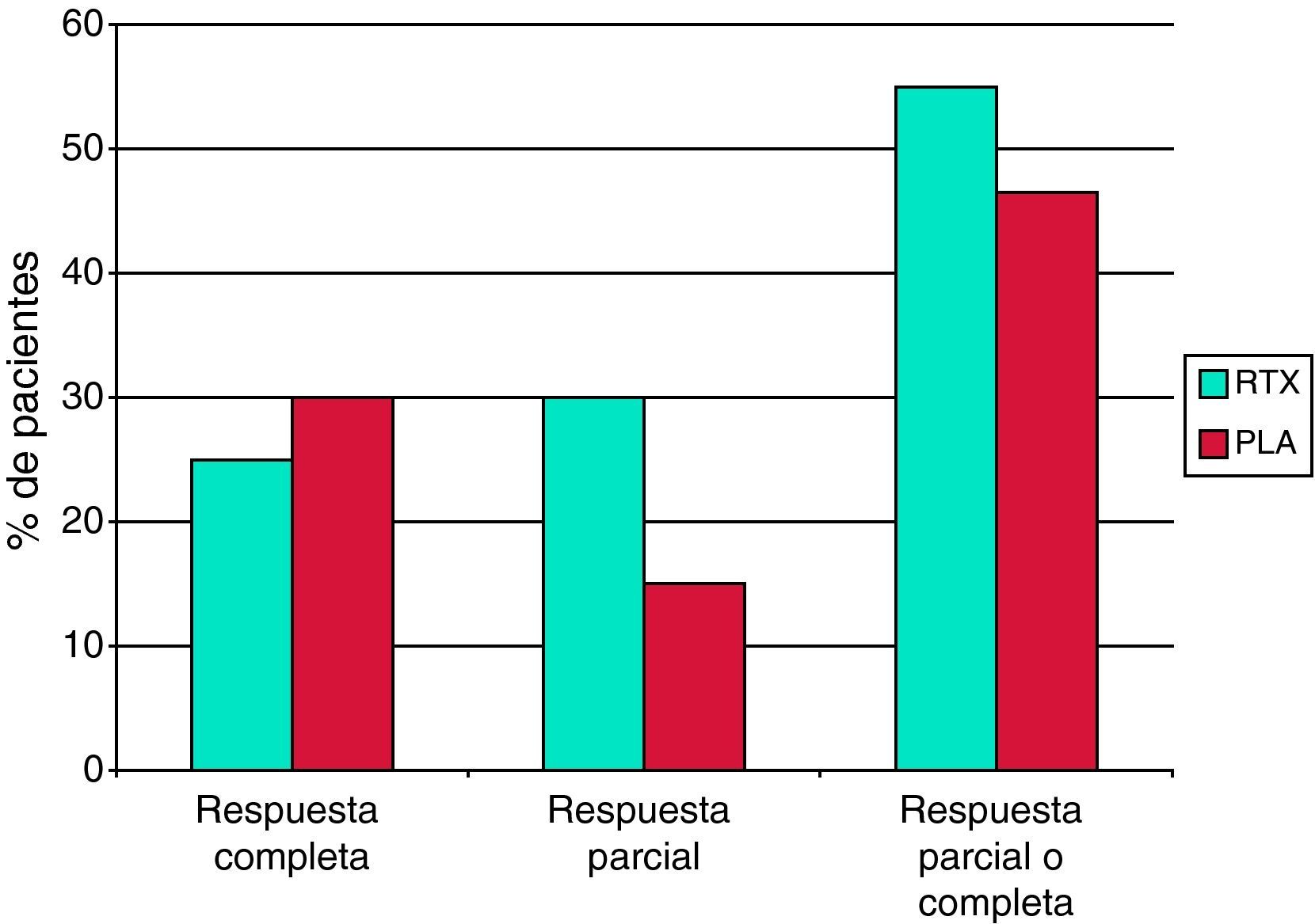
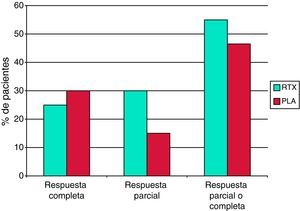
El estudio LUNAR es un ensayo clínico fase III, controlado con placebo, doble-ciego, aleatorizado, de rituximab en nefritis lúpica proliferativa16. Al igual que en el estudio EXPLORER, se añadió rituximab o placebo al tratamiento inmunosupresor convencional, consistente en micofenolato y dosis altas de glucocorticoides. Los criterios de inclusión eran cumplir los criterios ACR para LES, presentar una nefritis lúpica activa clase III o IV, una ratio proteína/creatinina en orina >1 y una edad de 18 a 75 años. Por otra parte, se excluyeron los pacientes que presentaban más de un 50% de glomérulos con esclerosis o fibrosis intersticial en la biopsia renal, un aclaramiento de creatinina estimado inferior a 25ml/min/1,73 m2, manifestaciones graves en el sistema nervioso central o trombocitopenia severa. El rituximab se administró, como en el estudio EXPLORER, a una dosis de 1g en los días 1 y 15, repitiéndose la misma pauta a los 6 meses. Además, se administraron dos dosis de 1g de metilprednisolona intravenosa al inicio del tratamiento, seguido de prednisona oral diaria a una dosis inicial de 0,75mg/kg, con una pauta de reducción posterior. Se intentó alcanzar una dosis máxima de micofenolato de 1,5g cada 12h.
El objetivo del estudio LUNAR era demostrar la superioridad del rituximab frente a placebo en la inducción de una respuesta renal. El criterio de valoración primario era la proporción de pacientes que alcanzaban una respuesta renal a la semana 52. Una «respuesta renal completa» se definió como la normalización de la creatinina sérica o, si la creatinina sérica basal era normal, un incremento igual o inferior a 15% con respecto al valor basal, junto con un sedimento urinario inactivo y una ratio proteína/creatinina en orina inferior a 0,5. Una «respuesta renal parcial» se definió como niveles de creatinina sérica con un incremento ≤15% sobre el valor basal, junto con un sedimento urinario sin deterioro significativo y una mejoría del 50% o superior en la ratio proteína/creatinina en orina o, si la ratio basal era ≤3, una ratio final <1 o, si la ratio inicial era >3, una ratio final <3. Se incluyeron 72 pacientes en el grupo rituximab y 72 pacientes en el grupo placebo. De nuevo, al igual que en el estudio EXPLORER, no se demostró superioridad del rituximab frente a placebo sobre ninguno de los criterios de valoración preestablecidos por protocolo (fig. 1). Se observó una tendencia a una mejor respuesta con rituximab frente a placebo en los 20 pacientes de raza negra tratados con rituximab. Al igual que en el estudio EXPLORER, se obtuvo una diferencia estadísticamente significativa a favor de rituximab en los datos serológicos de respuesta al tratamiento, con una mayor reducción de los niveles de anticuerpos anti-ADNn y un incremento significativamente mayor de los niveles de complemento. No se observaron diferencias con respecto a los efectos adversos graves ni a las infecciones entre el rituximab y el placebo.
Los resultados de los estudios EXPLORER y LUNAR han significado una profunda decepción para la comunidad médica, ya que existía una percepción de eficacia del rituximab en el LES muy generalizada sugerida por los estudios observacionales. Probablemente la utilización de rituximab añadido a un potente régimen de inmunosupresión convencional haya dificultado la posibilidad de demostrar eficacia frente a placebo en las condiciones experimentales establecidas en estos ensayos. Muchos expertos en LES continúan pensando que el rituximab es un fármaco eficaz y que un diseño diferente, como el utilizado en vasculitis asociada a ANCA en el estudio RAVE8, habría permitido demostrar la no inferioridad o incluso la superioridad del rituximab frente a un régimen activo convencional. Parece claro que no es deseable ni conveniente interrumpir los ensayos aleatorizados, doble-ciego, controlados con placebo, de rituximab en el LES moderado o grave.
OcrelizumabEl ocrelizumab es un anticuerpo monoclonal humanizado dirigido contra CD20. El estudio BELONG es un ensayo fase III aleatorizado, doble-ciego, controlado con placebo, en el que se estaban incluyendo pacientes con nefritis lúpica, con un diseño muy similar al estudio LUNAR. Pacientes con nefritis lúpica proliferativa eran aleatorizados a recibir ocrelizumab o placebo como terapia añadida a un régimen de inmunosupresores convencionales y un curso de glucocorticoide a altas dosis. En este estudio se ha utilizado como tratamiento inmunosupresor convencional el micofenolato de mofetilo o la ciclofosfamida intravenosa con una pauta de seis perfusiones quincenales de 500mg de ciclofosfamida. Por desgracia, en el momento de escribir este artículo la administración de ocrelizumab se ha suspendido temporalmente en el LES y en la artritis reumatoide por problemas de seguridad que están siendo minuciosamente analizados por los investigadores.
EpratuzumabEl epratuzumab es un anticuerpo monoclonal humanizado dirigido contra CD22, un antígeno de superficie específico de los linfocitos B. CD22 interviene en procesos de regulación de la señalización intracelular. Se han comunicado los resultados de un pequeño ensayo abierto en 14 pacientes con LES, tratados con una dosis de 360mg/m2 cada 15 días17. El fármaco fue bien tolerado y se observó mejoría del índice BILAG. El fármaco produce una disminución de los linfocitos B circulantes, menos profunda que la evidenciada con rituximab, y no se ha observado una modificación significativa de los niveles de inmunoglobulinas. La compañía farmacéutica que desarrolla el epratuzumab comunicó a la prensa durante el verano de 2009 resultados positivos preliminares de un ensayo fase IIb en LES, usando como criterio de valoración primario un índice combinado desarrollado para este estudio. Se incluyeron 227 pacientes, el 70% de los cuales presentaban una enfermedad con actividad grave. Los resultados a la semana 12 de seguimiento demostraron una diferencia del 25% entre los pacientes tratados con epratuzumab y placebo. Los datos disponibles sobre este agente son de momento muy limitados.
BelimumabEl belimumab es un anticuerpo monoclonal completamente humano dirigido contra el estimulador del linfocito B (BLyS). BLyS y el ligando inductor de proliferación del linfocito B (APRIL) pertenecen a la superfamilia del factor de necrosis tumoral y son producidos fundamentalmente por células del sistema inmune innato, como los neutrófilos, las células dendríticas o los macrófagos. Ambas moléculas se unen a receptores expresados por el linfocito B y las células plasmáticas maduras18–20. BLyS se une a tres tipos de receptores: al receptor tipo 3 de BLyS (BR3), al interactor ligando de ciclofilina y modulador de calcio (TACI) y al antígeno de maduración celular del linfocito B (BCMA). En cambio, APRIL solo se une a TACI y a BCMA pero no a BR3. El efecto biológico de BLyS y APRIL es promover la diferenciación y supervivencia de los linfocitos B. Es evidente que bloquear esta señal biológica podría ser de gran interés en el LES. De hecho, se han observado niveles elevados de BLyS en pacientes con LES y dichos niveles correlacionan con la actividad de la enfermedad21,22. Actualmente se está produciendo un desarrollo muy activo de belimumab en enfermedades autoinmunes, con 7 ensayos clínicos completados o en curso y 5 protocolos de seguimiento extendido abierto. De estos ensayos, 5 son en LES, uno en artritis reumatoide y uno en síndrome de Sjögren primario.
El belimumab fue estudiado inicialmente en un ensayo fase II, con escalada de dosis, doble-ciego y controlado con placebo23. Se incluyeron 449 pacientes con LES que cumplían los criterios de clasificación ACR, con una puntuación SELENA-SLEDAI ≥4. Los pacientes fueron aleatorizados a 4 grupos de tratamiento: placebo, belimumab 1mg/kg, 4mg/kg y 10mg/kg. Las dosis se administraron en los días 0, 14, y 28, y cada 28 días posteriormente, durante 52 semanas. El estudio no demostró diferencias significativas frente a placebo en ninguno de los criterios de valoración, como la mejoría en la puntuación del índice SELENA-SLEDAI o el tiempo transcurrido hasta un nuevo brote. Tampoco se observó un efecto dosis-respuesta. Sin embargo, el 28% de los pacientes no estaban serológicamente activos en el momento de la inclusión, considerando como tal la positividad de anticuerpos anti-ADNn o de anticuerpos antinucleares, lo que podría haber dificultado la demostración de eficacia de un agente dirigido contra los linfocitos B. Es interesante destacar que el análisis post hoc del grupo de pacientes serológicamente activos sí demostró diferencias estadísticamente significativas del belimumab frente a placebo, con una reducción un 28% mayor del índice SELENA-SLEDAI en los pacientes tratados con belimumab (p=0,044). En cuanto a la actividad biológica del belimumab, se observó una disminución del 71% en el número de linfocitos B vírgenes, del 70% en el número de linfocitos B activados, del 62% en el número de plasmoblastos y del 49% en el número total de linfocitos B, con una clara significación estadística frente a placebo (p<0,0001 para todas las comparaciones)24. También se observó una reducción significativa en los niveles de inmunoglobulinas circulantes y en los niveles de anticuerpos anti-ADN de doble cadena.
Quizás el mayor interés estratégico de este ensayo, fallido en cuanto a alcanzar sus objetivos primarios, consiste en que brindó los datos para desarrollar un nuevo índice de respuesta para ensayos futuros de fármacos activos frente a placebo en el LES, el índice de respuesta de lupus eritematoso sistémico (SRI)25. Para alcanzar este índice de respuesta se tienen que cumplir tres condiciones: presentar un SELENA-SLEDAI <4, no haber empeorado la valoración global por parte del médico y no presentar un nuevo brote según el índice BILAG. En este ensayo, el 46% de los pacientes serológicamente activos tratados con belimumab y el 29% de los pacientes tratados con placebo alcanzaron el SRI en el seguimiento a un año (p=0,0056). El desarrollo del SRI ha sido crucial para la demostración de la eficacia del belimumab frente a placebo en un ensayo de desarrollo posterior, el BLISS-52.
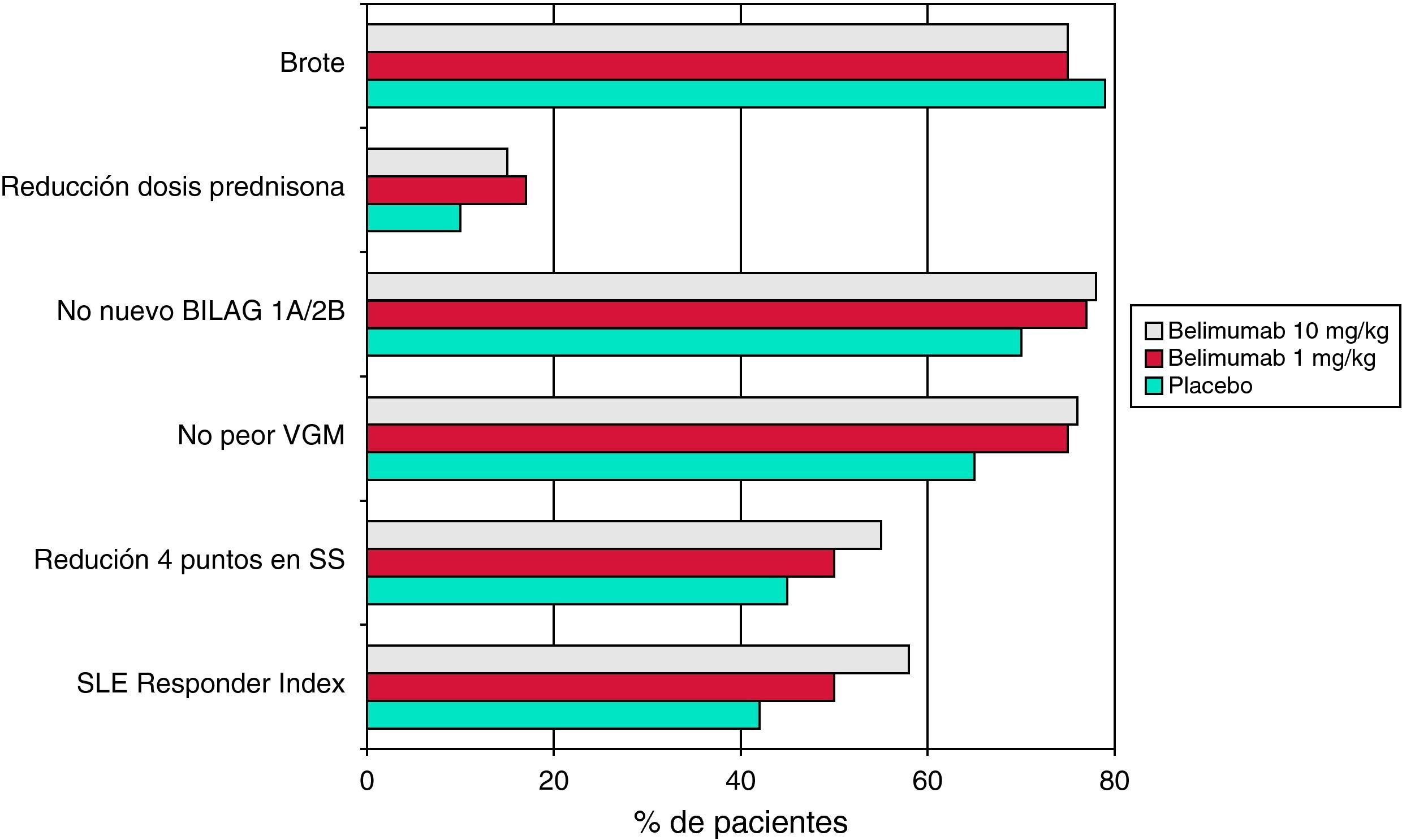
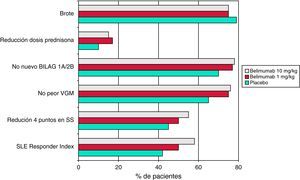
En el estudio BLISS-5226 se incluyeron 865 pacientes con lupus serológicamente activo (anticuerpos anti-ADNn y/o anticuerpos antinucleares positivos). Como criterio de valoración principal se utilizó el SRI, y para ser considerado un paciente respondedor hacía falta una reducción de cuatro o más puntos en el índice SELENA-SLEDAI. Además, los pacientes debían tener una actividad al menos moderada, con un SELENA-SLEDAI ≥6 en el momento de la inclusión. Como en el ensayo fase II, a los pacientes tratados con un régimen inmunosupresor convencional se les añadió con asignación aleatoria belimumab (dosis de 1mg/kg o 10mg/kg) o placebo. La media del índice SELENA-SLEDAI basal era de 9, y el 58% de los pacientes tenían al menos un BILAG A o dos BILAG B. Los agentes en estudio se administraron en los días 0, 14 y 28, y posteriormente cada 28 días. La proporción de pacientes que alcanzaron el SRI a la semana 52 fue estadísticamente mayor para ambas dosis de belimumab que en el grupo placebo (fig. 2). Además, otros criterios secundarios también mejoraron significativamente en los grupos tratados con belimumab, como una reducción ≥4 en el índice SELENA-SLEDAI, sin empeorar la valoración global por parte del médico y ningún nuevo BILAG A o dos BILAG B. Por otra parte, los datos de seguridad mostraron un perfil muy favorable.
El estudio BLISS-76 es el segundo ensayo fase III de belimumab en LES. La compañía farmacéutica que desarrolla el belimumab comunicó a la prensa resultados preliminares favorables en noviembre de 2009. El diseño es idéntico al estudio BLISS-52, con el mismo criterio de valoración principal: porcentaje de pacientes que alcanzan el SRI a la semana 52. La diferencia entre ambos estudios reside en que el BLISS-76 tendrá un seguimiento doble-ciego durante 24 semanas más, para comprobar si se produce un incremento de la respuesta con el tiempo. Aún se desconocen los datos a 76 semanas, pero el criterio de valoración primaria a la semana 52ha confirmado un efecto beneficioso estadísticamente significativo del belimumab frente a placebo a la dosis de 10mg/kg. Es pronto para establecer si este efecto estadísticamente significativo es clínicamente relevante.
AtaciceptEl atacicept es una proteína de fusión formada por el dominio extracelular de TACI (que se une tanto a BlyS como a APRIL) unido a la región Fc de la IgG1 humana. En voluntarios sanos, el atacicept produce una reducción intensa en el número de células plasmáticas27. En un ensayo con escalada de dosis en pacientes con artritis reumatoide, el atacicept a una dosis de 420mg cada 15 días produjo una disminución del 21% en los niveles de IgG, del 37% en los niveles de IgA y del 54% en los niveles de IgM. También se produjo una reducción significativa en los niveles de factor reumatoide y de anticuerpos anti-péptido cíclico citrulinado28. Estos cambios tan notables y rápidos en los niveles de inmunoglobulinas y de autoanticuerpos sólo pueden explicarse por un profundo efecto deplecionante de las células plasmáticas. Por desgracia, esta reducción en la función y número de las células plasmáticas puede acarrear importantes problemas de seguridad. De hecho, un estudio fase II de atacicept más micofenolato en pacientes con nefritis lúpica tuvo que interrumpirse por la elevada incidencia de infecciones29. Actualmente se está desarrollando un ensayo fase II/III de atacicept en LES sin afectación renal con un régimen inmunosupresor asociado menos intenso30.
ConclusionesLa terapia biológica dirigida contra el linfocito B probablemente ampliará nuestro arsenal terapéutico para el tratamiento de las manifestaciones moderadas y graves del LES en un futuro próximo. Los resultados frustrantes del rituximab en los estudios EXPLORER y LUNAR probablemente se explican por un diseño inadecuado de los ensayos. No obstante, el rituximab continúa siendo una alternativa razonable para los casos refractarios de afectación lúpica moderada o grave. Los resultados de los ensayos de desarrollo de belimumab sitúan a este agente en el centro de atención de la terapia anti-linfocito B en el LES y probablemente será el primer agente en décadas que va a conseguir indicación en ficha técnica para el LES. El atacicept parece ser un agente extraordinariamente eficaz en reducir los niveles de autoanticuerpos y de inmunoglobulinas circulantes, pero este hecho podría traducirse en una alta tasa de infecciones.
Es necesaria más investigación clínica de calidad para definir el papel y el posicionamiento de estos nuevos agentes en el tratamiento del LES.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.