Los aspectos éticos de los estudios clínicos suelen ser una parte poco elaborada al preparar los proyectos de investigación. Ello se debe frecuentemente a la premura en la preparación de los proyectos, a la consideración de este punto como un tema de menor importancia y a una sensación de autosuficiencia en ética por el propio investigador. La Comisión Europea ha endurecido considerablemente las exigencias éticas para las solicitudes de proyectos de investigación a raíz del actual Programa Marco 7. Ahora muchos proyectos, y especialmente todos aquellos que se aplican a seres humanos, deben pasar un proceso de evaluación ética para ser financiados una vez que han sido aceptados desde el punto de vista científico.
En este artículo se hace énfasis en diversos aspectos éticos que los comités de evaluación ética revisan cuando se presenta un proyecto de investigación y que frecuentemente son descuidados, resultando en retrasos de aceptación o incluso rechazo de las solicitudes. Estos puntos son fundamentales para solicitar proyectos europeos, pero también deberían ser contemplados en proyectos a nivel nacional y autonómico. En conjunto, los investigadores deberían prestar más atención a los detalles éticos en sus solicitudes a partir de ahora.
The ethical issues involved in clinical studies are usually an underprepared element in research proposals. This is often due to time pressures when designing projects, to insufficient importance being granted to these issues, or to an assumed self-sufficiency concerning ethical issues among researchers. The European Commission has considerably tightened up the ethical requirements for research applications to the 7th Framework Programme. Currently, once their scientific content has been approved, many proposals – and especially those involving human research – must be reviewed for ethics approval before gaining funding. The present article emphasizes the ethical aspects evaluated by Ethics Review Committees when assessing research projects and which are frequently overlooked, thus delaying approval of proposals or even resulting in their rejection. These points are crucial for European projects but should also be considered when applying for national and regional funding. In summary, researchers must pay greater attention to ethical issues from now on.
«Actúa de tal forma que los efectos de tus actos sean compatibles con la permanencia de una vida genuinamente humana» H. Jonas.
Toda investigación científica debe asumir unos principios básicos que garanticen no sólo que se realiza para beneficio del ser humano, sino que además no va a producir un perjuicio inaceptable para los sujetos en los que se realiza la investigación ni para la sociedad. Por tanto, la finalidad de un estudio y las consecuencias de sus resultados deben adaptarse a unas normas éticas fundamentales, que son objeto de este trabajo. La ética es una disciplina académica, el arte práctico de saber cómo aplicar principios morales en situaciones concretas. Según Göran Hermerén, Presidente del European Group on Ethics, la ética es el resultado del estudio sistemático, el análisis y el cuestionamiento de las normas que guían los actos humanos. La ética busca preservar la dignidad humana en el contexto de la investigación científica.
Las solicitudes de proyectos de investigación frecuentemente pasan por alto o tratan de forma ligera las cuestiones éticas concernientes a los estudios que proponen realizar. En tanto que las convocatorias españolas, tanto a nivel nacional como de las comunidades autónomas, siguen sin profundizar en este punto. La Unión Europea (UE) ha establecido un procedimiento sistemático para controlar de forma efectiva que los proyectos financiados por la Comisión Europea (CE) cumplan de la forma más estricta posible las normas éticas fundamentales.
Cuando se puso en marcha el Programa Marco 7 de Investigación (FP7)1 en vigencia para el período 2007–2013, el Parlamento Europeo estableció que las actividades de investigación patrocinadas por el FP7 debían respetar de forma rigurosa los principios éticos establecidos en la Carta de Derechos Fundamentales de la UE2 y las opiniones del Grupo Europeo de Ética en Ciencias y Nuevas Tecnologías. El Artículo 15 de la convocatoria del FP7 establece que «cualquier solicitud que contravenga los principios éticos fundamentales o incumpla las condiciones establecidas en el programa o sus convocatorias específicas no será seleccionada y puede ser excluida de la evaluación, selección y adjudicación en cualquier fase del proceso». Para su cumplimiento se establece un equipo de revisión ética (RE) compuesto por funcionarios del directorado de investigación de la CE y un procedimiento de RE basado en las valoraciones realizadas por expertos independientes, habitualmente investigadores de la UE y otros países asociados, como Israel.
En consecuencia, y mientras que las convocatorias de investigación en España (FIS, ANEP, etc.) no incluyan algún apartado específico para la valoración de los aspectos éticos del trabajo por realizar (ni tampoco está presente en los formularios de evaluación de los revisores de dichas solicitudes), en las convocatorias a nivel europeo este concepto está presente desde el principio y se toma muy seriamente.
A continuación expondré los elementos fundamentales en que se basan las RE de proyectos en la UE, esperando que este informe, basado en mis propias experiencias como revisor de proyectos (en la parte científica o en la parte ética) durante los últimos 15 años, pueda ser de utilidad para aquellos que desean presentar nuevos proyectos o participan como partners o colaboradores en algún multicéntrico. En general, estas normas y consideraciones también son aplicables a solicitudes para proyectos nacionales y autonómicos.
Proceso de evaluación de proyectos científicos europeosEl programa FP7, al igual que los seis anteriores, se compone de múltiples convocatorias que abarcan campos científicos muy dispares, desde alimentación hasta ciencias tecnológicas y, por supuesto, biomedicina. Existen manuales de instrucciones, formularios y plazos de presentación específicos para cada convocatoria. Habitualmente, en cada proyecto hay un grupo líder de alto prestigio científico, que se encarga de la gestión del proyecto, y una serie de grupos colaboradores (partners), que se encargan de tareas más especializadas. Los consorcios de investigación patrocinados por el FP7 son siempre multinacionales y aunque se exige al menos dos países, habitualmente son cinco o más los que intervienen. Los proyectos se plantean para un plazo de 2 a 5 años con presupuestos muy variables, pero que suelen totalizar entre 1 y 15 millones de euros.
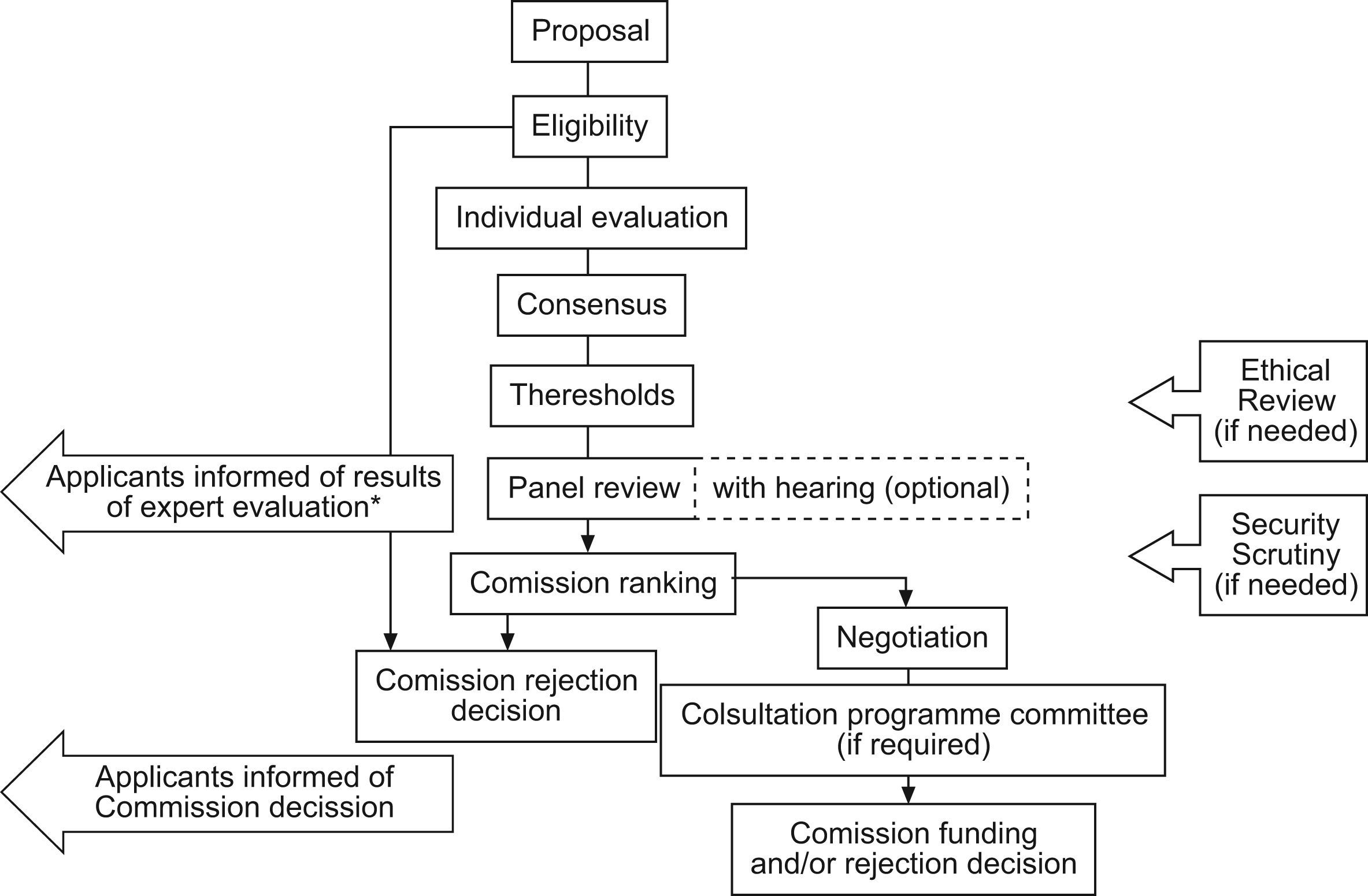
El proceso de evaluación se realiza siguiendo el esquema indicado en la figura 1. La parte científica de la evaluación es primordial y eliminatoria. Se valora especialmente la originalidad e interés científico y social del proyecto, la innovación técnica o metodológica que implica y el impacto que puede representar en el conjunto social de Europa (se pide que tenga dimensión europea). La evaluación científica se realiza en dos fases: primero se valora la calidad e interés científico del proyecto y luego la capacidad de gestión e instalaciones del consorcio para llevarlo a cabo. La primera parte es eliminatoria y debe superar 4 puntos sobre cinco, es decir, con nota de muy bueno a excelente. La segunda parte precisa 3,5 sobre cinco, y en ella se estudia el currículum de los investigadores, su experiencia en gestión de proyectos, publicaciones realizadas, etc. El presupuesto presentado se analiza en detalle, detectándose frecuentemente potenciales abusos que motivan a los revisores a solicitar correcciones tanto en importes económicos como en la composición de las partidas. Sólo aquellos proyectos que pasan ambos cortes son aprobados, pero ello no significa automáticamente que vayan a ser financiados. Los proyectos aprobados se ordenan según la nota total obtenida, y forman un ranquin de prioridad que luego será valorado por la CE. Cabe señalar, sin embargo, que la decisión final de financiar los proyectos depende también de acuerdos de mayor nivel entre los representantes políticos de los estados que conforman la UE, lo que puede alterar el ranquin establecido durante la evaluación, llegando incluso a otorgar financiación a proyectos de menor calidad.
Las RE son propuestas por los paneles de evaluación científica en caso de que el proyecto sugiera algún problema potencial ético y sólo en caso de que hayan aprobado la parte científica. La investigación sobre seres humanos, sobre aplicaciones con células embrionarias humanas y sobre experimentos con primates son remitidos automáticamente para RE. El objetivo es evitar que la UE financie proyectos de investigación que contravengan los derechos fundamentales establecidos en la legislación vigente.
Para asegurar una neutralidad real en la evaluación científica y ética de los proyectos, ésta no la realiza el propio personal de la CE, sino que se recurre a investigadores y a técnicos independientes ajenos a la comisión. El equipo de RE dispone de una base de datos con más de 50.000 expertos con los que conforma los paneles de RE y científica. En cada revisión participan de 15 a 60 expertos, que se dividen en paneles de 6–12 y a los que se asignan 12–15 proyectos para evaluar en cada panel. Estos paneles se forman procurando que exista un equilibrio de sexo y complementariedad entre sus campos de conocimiento. Así, pueden intervenir en un mismo panel médicos clínicos, investigadores básicos, abogados, economistas, filósofos, ingenieros informáticos, etc., dependiendo del dominio al que pertenecen los proyectos por evaluar. También se intenta que exista equilibrio en la representación de países dentro de la UE en la selección de expertos en los paneles (fig. 2).
El proceso de evaluación ética puede realizarse bien sea de forma remota, usando herramientas interactivas web específicas de la CE (sistema Sinapse), bien sea por presencia física de los expertos en las instalaciones de Bruselas o de forma mixta. Inicialmente, cada experto lee la propuesta completa de cada proyecto y elabora un informe personal: el individual report form. Cada proyecto de investigación es evaluado al menos por 4 expertos individualmente. En la siguiente fase, un experto adicional (rapporteur) revisa los individual report forms (4–6 por proyecto) y elabora un borrador de informe consensuado: el ethics review report (ERR). El paso final es una discusión del proyecto entre todos los revisores, incluido el rapporteur, con lo que se va refinando el texto del ERR hasta que se logra una versión satisfactoria para todo el panel, en cuyo momento la evaluación ética del proyecto se da por finalizada. A diferencia de la evaluación científica, en la evaluación ética no se otorga una puntuación, quedando el resultado como suficiente o bien como insuficiente en caso de deficiencias éticas graves. En este caso, la Comisión puede solicitar del proponente incluso que vuelva a enviar la memoria del proyecto, ampliando, corrigiendo o aclarando los puntos que el panel crea oportunos. En cualquier caso, la parte final del ERR suele incluir una serie de requerimientos éticos que se añaden como cláusulas obligatorias en el contrato que deberá firmar el consorcio con la CE para obtener la financiación solicitada. El proyecto no puede iniciarse antes de la firma de dicho contrato, por lo que la devolución de la propuesta implica siempre un considerable retraso para los investigadores, ya que luego necesita habitualmente una nueva evaluación ética. Por ello, es importante tener en mente los aspectos éticos desde el inicio de la preparación de la solicitud del proyecto.
Aspectos éticos por considerar al preparar una propuesta de investigaciónNo es posible detallar todos los puntos que pueden ser de interés ético en todo tipo de proyectos. La sensibilidad ética es una medida de la honestidad y claridad de una propuesta de investigación. La ética es un elemento central a la integridad científica. Lo que se pide al investigador es una actitud mental con una consideración completa de las implicaciones de su investigación y la intención franca de evitar perjudicar a los elementos objeto de investigación así como al resto de la sociedad. El investigador debería preguntarse cómo lo afectaría si un familiar suyo fuera objeto de una investigación del mismo tipo. Hay que destacar, sin embargo, que incluso en proyectos bien elaborados los revisores suelen detectar aspectos éticos que el investigador ha pasado por alto de forma involuntaria, por lo que resulta recomendable acudir a un asesoramiento externo sobre ética cuando se preparan las propuestas de proyectos de investigación.
A continuación revisaremos algunos aspectos importantes que suelen presentar carencias en las solicitudes de proyectos europeos, y que también son aplicables a las solicitudes que puedan realizarse a nivel nacional o de comunidad autónoma.
Consentimiento informadoTodos los proyectos en los que los seres humanos son sujetos de investigación, ya sea médico o de otro tipo (psicológico, tecnología de información, etc.), requieren que el sujeto sea plenamente informado y otorgue su libre consentimiento a participar. Este aspecto está basado en el código de Nuremberg3, la Declaración de Helsinki sobre investigaciones biomédicas4 y las normas de buenas prácticas clínicas para ensayos clínicos con medicamentos5.
Al presentar la solicitud de un proyecto de investigación, es muy recomendable incluir un modelo del formulario de consentimiento informado (CI) que se va a utilizar, de modo que pueda evaluarse su idoneidad. Algunos elementos fundamentales que deben constar en el CI y que deben contemplarse en la parte ética de las propuestas de investigación son los siguientes:
- 1.
Nombre del promotor y del investigador principal del proyecto así como teléfonos de contacto para aclarar dudas o informar de complicaciones.
- 2.
Descripción de los fundamentos, objetivos, duración del estudio y procedimientos por realizar. Debe realizarse en lenguaje sencillo, comprensible para un niño de 12 años.
- 3.
Descripción de los riesgos previsibles y de los inconvenientes y disconfort que pueden producirse durante el estudio así como de las medidas preventivas o actuaciones por realizar en tal caso.
- 4.
Descripción de los posibles beneficios que puede reportar el estudio al paciente y a la sociedad. Hay que señalar que según el principio de beneficencia, el sujeto de una investigación debe poder beneficiarse de la propia investigación en la que participa1. Esto incluye, por ejemplo, poder acceder de forma sencilla y económica al fármaco investigado cuando finaliza el estudio.
- 5.
Descripción de las medidas que se tomarán para asegurar la confidencialidad de la identidad del paciente y de los datos personales obtenidos durante la investigación.
- 6.
Debe explicitarse la duración precisa del almacenamiento de datos y muestras biológicas y su destino final, incluida la forma de destrucción.
- 7.
En caso de ensayos clínicos con fármacos, es obligatorio establecer un seguro de daños y perjuicios a los sujetos del estudio, según establece la legislación sobre ensayos clínicos con medicamentos6. Este tipo de seguros también es muy recomendable en todo tipo de estudios que apliquen una intervención directa sobre seres humanos.
- 8.
Declaración de que la participación en el estudio es voluntaria y que el participante puede dejarlo en cualquier momento, sin que ello repercuta en su posterior seguimiento clínico. En tal caso, el sujeto tiene derecho a destrucción de sus datos y de las muestras biológicas previamente obtenidas.
- 9.
En caso de otorgar una compensación económica por participar en un estudio, ésta debe ser de pequeña cantidad, suficiente para cubrir desplazamientos y compensar las molestias del estudio.
- 10.
No es ético reclutar voluntarios entre el personal subalterno directamente bajo las órdenes del investigador principal ni de estudiantes a cargo del departamento implicado. No es aceptable otorgar créditos de doctorado o académicos a los voluntarios de un estudio por el mero hecho de participar en él.
- 11.
Deben establecerse procedimientos (y citarlos en el CI) para comunicar al sujeto de una investigación sobre los hallazgos incidentales que puedan aparecer al realizarle pruebas durante la investigación. Debe también valorarse el derecho a no ser informado sobre dichos hallazgos incidentales si el sujeto lo elige así previamente.
La información sobre el estudio por realizar y la obtención de la firma del CI deberían estar a cargo de un médico independiente o personal no directamente involucrado con la propia investigación. La obtención de CI por parte del propio médico que lleva la asistencia habitual del paciente puede implicar una coacción sutil pero impropia. La información verbal suministrada durante la obtención del CI debe ser veraz, completa y debe incluir los posibles efectos secundarios así como potenciales beneficios para el sujeto tras la investigación. Se aconseja la presencia de un testigo al firmar el CI, preferiblemente familiar o allegado del paciente.
Sólo las personas legalmente capacitadas pueden firmar el CI. Los sujetos vulnerables (niños, prisioneros o reclusos, discapacitados mentales, sujetos en coma) deben ser excluidos del estudio, salvo que sea imprescindible su participación por ser ellos objeto de éste. En tal caso, debe firmar su representante legal y disponer de autorización expresa del comité ético local que incluya expertos en investigación con personas incapacitadas. En todo caso, es necesario explicar el objeto y procedimientos del estudio al sujeto siempre que sea posible (reclusos, niños mayores).
Privacidad y protección de datosLa cuestión de la privacidad aparece siempre que se recogen datos personales de tipo médico o por tendencias religiosas o políticas. También cuando se realiza un seguimiento físico o electrónico del sujeto o se gestiona información financiera, genética o judicial. El reto en la protección de datos es compartir datos entre investigadores al tiempo que se protege la información que identifica a las personas. Esto puede realizarse usando datos agregados o bien mediante codificación de datos o anonimización completa (como en las encuestas anónimas). Frecuentemente es necesario mantener un enlace entre los datos de la investigación y los datos personales del paciente para, por ejemplo, poder comunicarle la aparición de un evento inesperado (p. ej.: detección de un tumor al realizar un estudio de imagen). Esto puede lograrse utilizando un código identificativo del paciente para enlazar los datos personales y los de investigación, de modo que los clínicos pueden identificar al sujeto, mientras que los investigadores sólo conocen los códigos personales. Es también muy recomendable usar sistemas de encriptación para las bases de datos y limitar su acceso mediante contraseñas. Las muestras y los datos físicos así como los sistemas informáticos deben ser de acceso limitado a personal controlado y guardados en despachos y cajoneras bajo llave.
La Directiva 95/46/EC de la UE sobre protección de datos contiene unos principios clave que deben ser acatados7. La LOPD establece también condiciones para el tratamiento automatizado de datos personales, estableciendo la máxima seguridad para determinada información sensible, en particular la de tipo biomédico8. Los datos deben ser procesados de forma eficiente y legal para propósitos previamente establecidos y de alcance limitado. Los datos obtenidos deben ser precisos, apropiados y relevantes para la investigación propuesta, y no excesivos. No se debe guardar más tiempo del necesario para la investigación, salvo que se establezca lo contrario en el CI y el paciente sea convenientemente informado. No se deben transferir datos a países que carezcan de la protección legal adecuada.
La definición de procesamiento incluye los actos de obtener, almacenar y disponer la información. Es necesario un CI previo al inicio de toda investigación que implique procesamiento de datos personales. Si los datos o muestras se van a retener para investigaciones posteriores (p. ej.: para un biobanco), entonces este hecho debe quedar claramente reflejado en el CI. El sujeto debe dar su consentimiento explícito para utilizar sus datos o muestras en investigaciones ulteriores, quedando el control de éstas en manos del comité ético local o nacional.
Investigación animalLa investigación preclínica se realiza habitualmente con animales de laboratorio. Éste es un tópico muy sensible y contemplado en la Directiva 86/609 de la UE9. En ella se establece que en las propuestas de investigación debe demostrarse de forma convincente que se ha reflexionado y se han aplicado las llamadas normas de las 3R, que describimos a continuación.
Reemplazamiento. Es preferible realizar siempre que sea posible estudios in vitro antes que estudios con animales. En caso de ser éstos necesarios, es preferible utilizar animales del menor rango evolutivo posible (p. ej.: insectos en lugar de mamíferos, ratones en lugar de perros y éstos mejor que primates).
Refinamiento. Deben utilizarse métodos adecuados para evitar el sufrimiento o estrés de los animales. Utilizar anestesia en caso de procedimientos que causen dolor y eutanasia controlada para los sacrificios de animales. También es preciso vigilar su bienestar, evitando jaulas sobresaturadas y con alimentación apropiada.
Reducción. Debe utilizarse el menor número de animales posible que permita obtener resultados estadísticamente significativos. Es muy importante realizar estudios de potencia estadística y explicar en la propuesta los métodos utilizados para el cálculo.
Debe incluirse en la propuesta cuáles son las especies y cepas por utilizar así como su lugar o laboratorio de origen. Si se crea un animal transgénico, aparecen problemas éticos adicionales, como seguimiento de la segunda generación y capacidad de gestionar animales nacidos con problemas de salud.
Investigación en países en desarrolloLa investigación realizada en países extracomunitarios y en vías de desarrollo debe cumplir con los mismos altos estándares que la realizada en la UE. Debe justificarse siempre la participación de un país en vías de desarrollo. En tal caso, deben contemplarse al menos los siguientes aspectos: cultura y nivel de alfabetización, los mejores intereses de los participantes y uso de recursos locales (plantas, animales, muestras clínicas y datos personales).
Un aspecto importante es la forma de obtener el CI. Es fundamental evitar formas sutiles o evidentes de coacción en las poblaciones objeto del estudio así como evitar la sobreexplotación de recursos o violación de privacidad personal. En caso de analfabetismo, se han desarrollado técnicas que incluyen grabación en video de los sujetos o bien de sus representantes. La aprobación de los comités éticos locales y del país promotor europeo es fundamental. Otro aspecto muy importante es compartir los beneficios de la investigación con los sujetos que han intervenido: si se realiza un proyecto en África o Sudamérica, conviene asegurar que los nativos o población que participó en los estudios luego podrá obtener la medicación evaluada o los resultados del estudio. Hay que vigilar también que no se apliquen dobles estándares con exigencias éticas distintas en países de la UE y en países extracomunitarios.
Investigación con células madre embrionarias humanasEste es un punto extremadamente delicado, que habitualmente es revisado por un panel ético especializado y con normas rigurosas10. Dado que muchos proyectos son multinacionales, es fundamental comprobar que este tipo de experimentos está autorizado en cada uno de los países participantes.
En caso de que no sea posible utilizar otros métodos, el panel de RE valorará los siguientes puntos:
- 1.
La propuesta no incluye actividades de investigación que impliquen la destrucción de embriones humanos, incluyendo los casos en que fuesen necesarios para la obtención de las células madre.
- 2.
Se revisa si el consorcio ha tomado en cuenta la legislación, regulaciones, normas éticas y códigos de conducta establecidos en Europa y en cada uno de los países donde la investigación será realizada, incluyendo los procedimientos para obtener el CI.
- 3.
Deben especificarse las fuentes de células embrionarias humanas.
- 4.
Las medidas tomadas para proteger los datos personales, incluyendo privacidad y datos genéticos.
- 5.
La naturaleza de los estímulos económicos ofrecidos a los participantes si existen.
Este término se refiere a la tecnología que puede tener utilidad tanto civil como militar o que puede ser aprovechada con fines terroristas. Las aplicaciones con mayor potencial dual son aquéllas destinadas a actividades de vigilancia (cámaras en lugares públicos), con clara intrusión en la privacidad de las personas. Este tipo de investigaciones puede constituir una violación de los derechos humanos fundamentales y, por tanto, tiene implicaciones éticas graves.
Otro tipo de investigación con potencialidad dual es la manipulación genética de bacterias y otros seres vivos, que puede alterar su patogenicidad con fuertes implicaciones en la guerra biológica. Evidentemente, es necesario tener en cuenta el contexto en el que se desarrolla la investigación y considerar el principio de proporcionalidad. Todo laboratorio de Microbiología tiene potencial dual, pero sólo la investigación potencialmente peligrosa debe ser contemplada en las RE. En las propuestas deben especificarse los medios disponibles y sistemas de seguridad para el manejo y contención de nuevas cepas bacterianas o víricas así como los procedimientos para evitar el uso inapropiado de estas cepas.
ConclusiónAl preparar un proyecto, el investigador está fundamentalmente preocupado por los plazos de presentación, por buscar colaboradores, por desarrollar un proyecto atractivo desde la óptica científica y por elaborar un presupuesto adecuado a los fines propuestos. Los aspectos éticos son prácticamente siempre relegados a un segundo plano, bien sea por las prisas o porque damos por supuesto que nuestra investigación cumple las normas éticas básicas. Mi experiencia es que esto no es así. Casi todos los proyectos tienen defectos (a veces graves) en su dimensión ética, y pueden incluso ser rechazados por ello, al menos a nivel de la UE. Con frecuencia, los problemas éticos detectados en las propuestas implican la necesidad de introducir cláusulas de garantía contractuales o incluso pedir a los autores que presenten una nueva propuesta debidamente corregida. Todo ello implica siempre retrasos en la concesión de las ayudas y mayor trabajo burocrático, por lo que cuanto mejor se elaboren los temas éticos desde el inicio, mayor beneficio se obtendrá para todos.
No debe darse por sentado que nuestra institución garantiza la ética de nuestra investigación ni tampoco fiarnos en nuestra propia experiencia. Hay aspectos sutiles que suelen pasar desapercibidos, por lo que sería interesante contar con algún asesoramiento ético desde el momento en que se diseña un proyecto de investigación o, al menos, tener en mente estos aspectos y usar una lista de comprobación (tabla 1) para recordarnos lo que tenemos que tener presente desde el punto de vista ético. Al solicitar un proyecto europeo, es importante incluir una sección de ética y al menos un listado comentado de la normativa ética aplicable, nacional e internacional. En proyectos complejos es frecuente añadir un bloque de trabajo (workpackage) específico cuando el estudio puede tener implicaciones importantes, como en el caso de realizar intervenciones en seres humanos. Este aspecto es, pues, aplicable a todos los ensayos clínicos.
Tabla de revisión éticaa
| Research on Human Embryo/Foetus YES Page | |||
| Research Objectives | YES | Page | |
| Does the subject of the research or the proposed research objectives raise any particular ethical issues? | |||
| I CONFIRM THAT I DO NOT BELIEVE THAT THE RESEARCH OBJECTIVES RAISE PARTICULAR ETHICAL ISSUES. | |||
| Research on Human Embryo/Foetus | YES | Page |
| ||
| I CONFIRM THAT NONE OF THE ABOVE ISSUES APPLY TO MY PROPOSAL. | ||
| Research on Humans | YES | Page |
| ||
| I CONFIRM THAT NONE OF THE ABOVE ISSUES APPLY TO MY PROPOSAL. | ||
| Research involving vulnerable groups must be justified | ||
| Research on human tissue | YES | Page |
| Does the proposed research involve human genetic material? | ||
| Does the proposed research involve human biological samples? | ||
| Does the proposed research involve tissue previously collected for another purposes e.g. research, biobank or clinical? | ||
| Do ethics approvals and informed consent for tissue previously collected permit use for this proposed research? | ||
| I CONFIRM THAT NONE OF THE ABOVE ISSUES APPLY TO MY PROPOSAL. | ||
| Privacy | YES | Page |
| Does the proposed research involve human data collection? | ||
| Does the proposed research involve processing of genetic information? | ||
| Does the proposed research involve processing of personal health data | ||
| Does the proposed research involve processing of any other form of personal personal data (e.g. sexual lifestyle, ethnicity, political opinion, religious or philosophical conviction)? | ||
| Does the proposed research involve tracking the location or observation of people? | ||
| Does the research involve data collection in circumstances where the data subject is not aware or not fully informed that data is being collected or of the purpose of the research? | ||
| Was any of these data previously collected for another purpose? | ||
| Do ethics approvals and informed consent for data previously collected permit use for this proposed research | ||
| I CONFIRM THAT NONE OF THE ABOVE ISSUES APPLY TO MY PROPOSAL. | ||
| The applicant(s) should explain how the Data Protection Principles within the European Directive 95/46/EC will be met | ||
| Research on Animals | YES | Page |
| Does the proposed research involve research on animals? | ||
| Are those animals transgenic small laboratory animals? | ||
| Are those animals transgenic farm animals? | ||
| * Are those animals non-human primates? | ||
| Are those animals cloned farm animals? | ||
| I CONFIRM THAT NONE OF THE ABOVE ISSUES APPLY TO MY PROPOSAL | ||
| If the proposed research involves research on animals, the applicant should explain how the 3Rs principles will be met | ||
| Research involving Developing Countries | YES | Page |
| Will similar ethical standards and protection be used for research involving developing countries as would normally be expected within the European Union? | ||
| Does the proposed research involve the use of local resources (genetic, animal, plant, etc.)? | ||
| Is the proposed research of benefit to local communities (e.g. capacity building, access to healthcare, education, etc.)? | ||
| I CONFIRM THAT NONE OF THE ABOVE ISSUES APPLY TO MY PROPOSAL. | ||
| Dual Use | YES | Page |
| Does the research having direct military use? | ||
| Does the research having the potential for terrorist abuse? | ||
| I CONFIRM THAT NONE OF THE ABOVE ISSUES APPLY TO MY PROPOSAL. | ||
| Research implications | YES | Page |
| Could the research findings or the way they are exploited raise any particular ethical issues? | ||
| Does the research have potential for propaganda, political abuse? | ||
| I CONFIRM THAT I DO NOT BELIEVE THAT THE IMPACT OF THE RESEARCH RAISES PARTICULAR ETHICAL ISSUES. | ||
| Are there competent authorities who must approve the ethics of the research in all of the country(ies) where the research will be performed? | ||
| Are there competent authorities who must approve the use and protection of data in all of the country(ies) where the research will be performed? | ||
| If appropriate to your research, are there competent authorities who must approve clinical trials in all of the country(ies) where the research will be performed? | ||
| If appropriate to your research, are there competent authorities who must approve the use and protection of animals within research in all of the country(ies) where the research will be performed? | ||
| I CONFIRM THAT NO APPROVALS ARE REQUIRED OR THERE IS NO COMPETENT AUTHORITY IN ALL OF THE COUNTRY(IES) WHERE THE RESEARCH IS BEING PERFORMED. | ||
| “Copies of the approvals from the relevant competent authorities should be submitted to the European Commission before commencement for that element of the research as required by special clause 15 and 16 of the FP7 Grant Agreement. Please include a time frame for when these will be obtained.” | ||
| “Ethics review conducted as part of FP7, does not replace the requirement for ethics review by competent authorities within countries where the research is being conducted. Similarly, while it is helpful for the FP7 ethics review panel to see proposed information sheets and consent forms (ideally in English), this should not be interpreted as approval for their use.” | ||
Tabla original de comprobación utilizada en las solicitudes y revisión ética de la Comisión Europea. Los ítems marcados con asterisco en la columna izquierda son remitidos automáticamente a revisión ética. Es obligatorio marcar al menos un ítem en cada grupo. Además de cumplimentar esta tabla, los solicitantes deben incluir en la propuesta una justificación y discusión sobre acciones tomadas para preservar los aspectos éticos correspondientes. Tabla no traducida para mayor fidelidad de la original.
Naturalmente, la ética es ante todo una actitud mental. Es una formalización de nuestros principios morales básicos: evitar hacer daño y proteger al débil. Por tanto, las normas preestablecidas nunca podrán cubrir todas las posibilidades que pueden plantear los estudios de investigación. Aun así, los revisores de ética detectan habitualmente si en nuestra propuesta de investigación mantenemos una actitud mental positiva y proactiva hacia los derechos morales de los pacientes y de la sociedad.
Espero que este informe, que toca los aspectos éticos de investigación biomédica de forma no exhaustiva, contribuya a sensibilizar a los investigadores respecto a la necesidad de incluir de forma detallada las consideraciones éticas de su trabajo en las solicitudes de nuevos proyectos, y de esta forma la ética deje de ser la oveja negra de la investigación española.
Puede obtenerse más información sobre este tema en los puntos de contacto nacionales del FP7 para proyectos europeos11, disponibles en España en el CDTI, CIEMAT o bien en el Instituto de Salud Carlos III (oficina de proyectos europeos; C/ Sinesio Delgado, 6; 28029, Madrid). El sitio web de CORDIS también tiene información detallada sobre los aspectos éticos de los proyectos europeos12.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Panel de expertos de evaluación de proyectos de investigación de la Comisión Europea.