El metotrexato es considerado hoy en día como el fármaco antirreumático modificador de la enfermedad de primera elección en el tratamiento de la artritis reumatoide, en razón a su efectividad en el retraso del daño anatómico, bajo coste, seguridad y largo segmento terapéutico. Para su óptima utilización debemos tener en cuenta sus propiedades farmacológicas, la dosis empleada, la vía de administración y la administración conjunta con folatos, entre otros conceptos que veremos con más detalle a continuación.
Methotrexate is considered today as the modifying antirheumatic drugs of first choice in the treatment of rheumatoid arthritis, due to its effectiveness in delaying the anatomical damage, low cost, safety and long therapeutic segment. For optimal use we must consider its pharmacological properties, the dosage, route of administration and the administration with folate, among other items, we will see in more detail below.
El metotrexato (MTX) es un análogo estructural del ácido fólico que actúa inhibiendo competitivamente la enzima dihidrofolato reductasa (DHFR), la cual participa en la formación del ácido folínico que es necesario para la formación del nucleósido timidina, requerido para la síntesis de ADN, ARN, timidilatos y proteínas1. Teniendo en cuenta esto, cabe esperar que se localice fundamentalmente en los órganos con altos niveles de DHFR (pulmón, hígado, riñón y tubo digestivo) y con alto recambio celular (piel, células germinales y tumorales), de lo que derivan sus indicaciones y sus principales efectos secundarios.
El MTX actúa inhibiendo parcialmente el sistema inmunitario y, aunque no se conoce bien su mecanismo, reduce la inflamación articular autoinmunitaria a largo plazo2.
Es un fármaco que se ha empleado en el tratamiento del cáncer, de las enfermedades reumáticas y en la inducción de aborto terapéutico.
Su origen tiene lugar en el año 1948, cuando el doctor Sidney Farber lo emplea en el Hospital Infantil de Boston por primera vez en un grupo de niños con leucemia, demostrando su eficacia en esta enfermedad y suponiendo una revolución en el campo de la oncología3. Aprobado por la Food and Drug Administration (FDA) para su uso en la artritis reumatoide (AR) del adulto en el año 1988 y usado durante más de 25años en el tratamiento de esta enfermedad, es considerado hoy en día el fármaco antirreumático modificador de la enfermedad (FAME) de primera elección en el tratamiento de la AR, y de gran utilidad en el control de otras enfermedades reumáticas4.
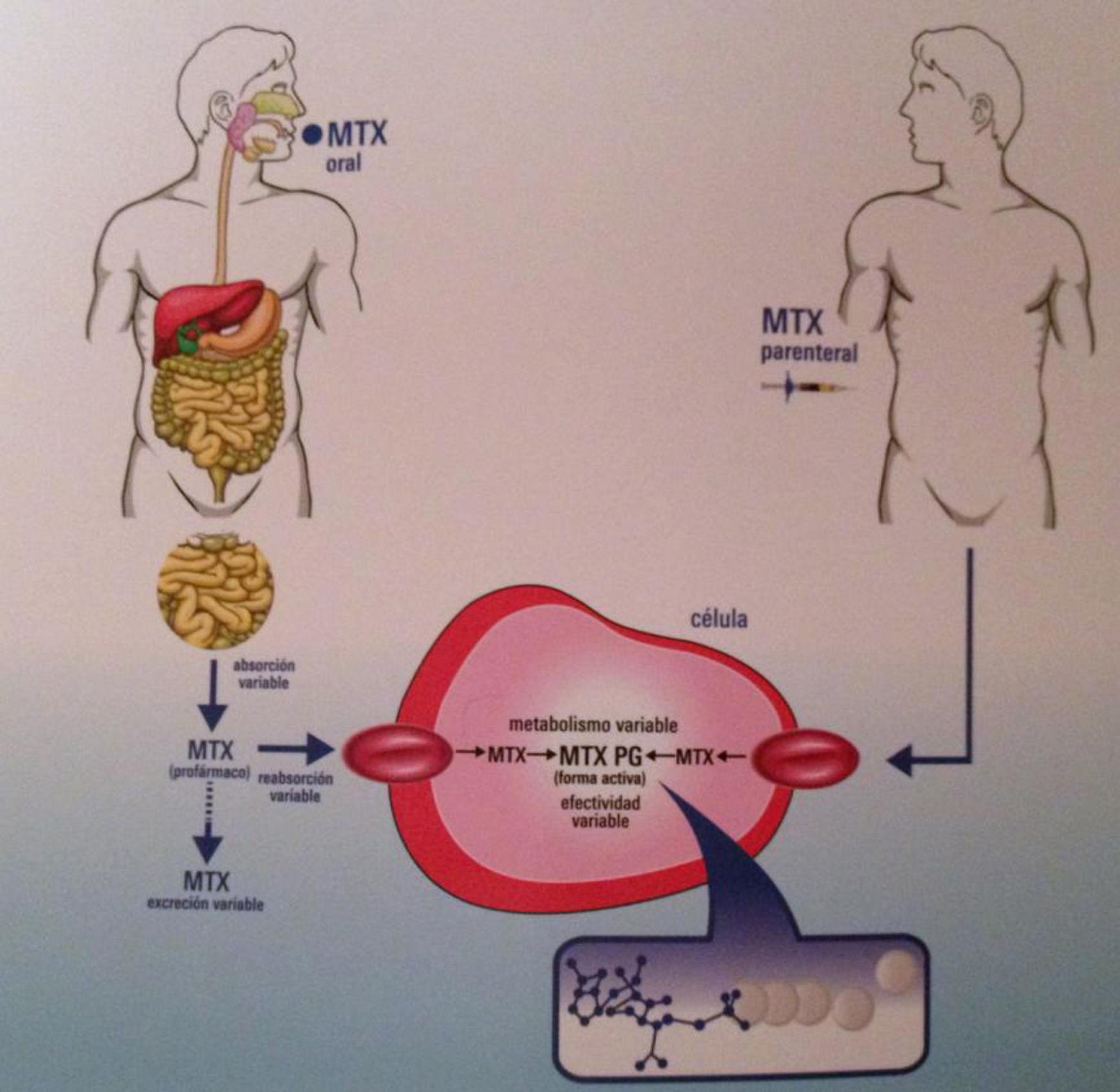
El metabolismo del MTX es intracelular: una vez dentro de la célula es transformado en poliglutamatos por la enzima poliglutamasa sintetasa (metabolitos de larga duración, responsables de su actividad antifolato).
La absorción oral del MTX es dependiente de la dosis y varía significativamente acorde al tránsito intestinal. La biodisponibilidad media oral es del 33% y la parenteral, del 77%. Una vez en suero, circula unido a proteínas en un porcentaje elevado, hasta del 50-70%, y su excreción se produce fundamentalmente por vía renal (90%)5.
Mecanismo de acciónEl mecanismo de acción del MTX varía según la dosis. A dosis bajas, que son las empleadas en los reumatismos inflamatorios, ejerce una acción dual, inmunosupresora y antiinflamatoria, ya que inhibe la proliferación e induce la «apoptosis» de los linfocitos T activados. Este efecto se basa, por un lado, en el efecto competitivo con los folatos, que son esenciales en la síntesis de novo del ADN y en la replicación celular. En segundo lugar, aumenta los niveles intracelulares de adenosina e inhibe la conversión de homocisteína a metionina, con la consiguiente reducción de síntesis de poliamidas que intervienen en la patogenia de muchos reumatismos inflamatorios1.
En qué casos debe suspenderse o está contraindicado su usoSe desaconseja administrar MTX en presencia de enfermedad renal significativa, hepatopatía, leucopenia de menos de 3.000/mm3, trombocitopenia de menos de 100.000/mm3, edad de más de 70años, neoplasia maligna, embarazo o problemas de fertilidad, historia de drogadicción o etilismo crónico, enfermedad pulmonar e infecciones sistémicas agudas o crónicas6. El MTX debe suspenderse al menos 3meses antes de la concepción en varones y mujeres en un embarazo programado. No debe usarse durante el embarazo ni durante la lactancia. Seis estudios han evaluado el uso de MTX durante el embarazo7–12, poniendo de manifiesto su potencial abortivo y malformativo. No hay estudios que hayan evaluado el uso de MTX en varones en cuanto a la tasa de abortos, defectos congénitos, fertilidad masculina y femenina, o en recién nacidos durante la lactancia. Sin embargo, la opinión experta recomienda suspender el fármaco al menos 3meses antes de un embarazo planificado y no usarlo durante el embarazo y la lactancia.
Monitorización antes de comenzar el tratamientoSe debe realizar un cribado incluyendo la valoración de posibles factores de riesgo de toxicidad (como la ingesta de alcohol), hemograma, proteína C reactiva (PCR) y velocidad de sedimentación globular (VSG), creatinina plasmática, transaminasas, albúmina, anticuerpos contra la hepatitis B y C, factor reumatoide, anticuerpos anticitrulina, perfil lipídico, prueba de embarazo y radiografía simple de tórax, manos y pies13,14. Se recomienda asimismo la aplicación de la vacuna contra el neumococo y el virus de la gripe estacional13, pues aunque no está contraindicada su administración durante el tratamiento, la respuesta obtenida (inmunicidad) es menor. (Sí estaría contraindicada la administración de virus vivos.) Se debe valorar la realización de serología frente al virus de la inmunodeficiencia humana (VIH) y la realización del estatus tuberculoso14. La biopsia hepática pretratamiento hoy en día solo se reserva para aquellos casos en los que exista una bioquímica hepática alterada (transaminasas de 2-3veces el límite superior, no atribuible a otras causas), historia de alcoholismo o hepatopatía previa (Kremer, 1992–1994)15–17. Es importante valorar la actividad inicial de la enfermedad para establecer la efectividad del tratamiento. En la práctica diaria habitual se suele realizar el DAS28 (que incluye el número de articulaciones dolorosas e inflamadas, la VSG y la evaluación global del paciente)18.
Cuándo iniciar el tratamiento y dosis empleadaEl tratamiento con FAME ha de ser precoz e intenso en el control de la actividad inflamatoria, antes del desarrollo de las temidas erosiones, dentro de la denominada «ventana de oportunidad terapéutica»19, con un control estrecho del curso clínico (tight control) que permita un tratamiento dinámico para conseguir nuestro objetivo, que debería ser la remisión clínica o, alternativamente, un estado de bajo nivel de actividad. En cada revisión clínica se debería medir y documentar la actividad de la enfermedad, y si el paciente no ha alcanzado la meta deseada, deberían hacerse los ajustes terapéuticos para lograrla (treat to target).
En condiciones de ensayo clínico controlado se ha demostrado que supervisar estrechamente la actividad de la enfermedad y la modificación dinámica del tratamiento hasta alcanzar la remisión reduce el daño estructural (Estudio TICORA)20. Aunque no fue diseñado con este objetivo, el estudio Best también lo pone de manifiesto21.
Además, se ha demostrado que el inicio con dosis de 12,5 a 20mg semanales, frente a dosis bajas de 5-10mg, tiene más eficacia sin aumentar toxicidad22 (a más de 20mg, como la toxicidad de MTX por vía oral es dependiente de la dosis, hay más eficacia, pero también hay mayor toxicidad).
Clásicamente se ha recomendado comenzar con 7,5-10mg a la semana y, en caso de no respuesta clínica, incrementar la dosis a razón de 2,5-5mg cada 4-6semanas.
Hoy día, basándose en el tight control, se debe comenzar con dosis más altas (10-15mg a la semana)14 y realizar una escalada rápida, aumentando 5mg cada 2-4semanas hasta la dosis máxima o el control de los síntomas. De esta forma se consigue un mejor control de los síntomas sin aumentar los efectos adversos.
Vía de administraciónLa vía parenteral ha demostrado ser más eficaz y con menos reacciones adversas gastrointestinales, probablemente por su mayor biodisponibilidad23. Los poliglutamatos de MTX de cadena larga son inhibidores más potentes (que los de cadena corta) de la síntesis de purinas, y la administración subcutánea se relaciona con más concentración, y por tanto con mayor eficacia y menos actividad de la enfermedad24 (fig. 1).
Administración conjunta con folatosTeniendo en cuenta que el principal mecanismo de toxicidad del MTX es la depleción de ácido fólico, basado en su mecanismo de acción como antifolato, uno de los pilares básicos para un correcto uso del MTX va a ser la administración conjunta con folatos.
Ortiz et al.25 demostraron en un metaanálisis que la suplementación con folatos se acompaña de una reducción de los efectos colaterales sobre las mucosas y el tubo digestivo sin disminuir su eficacia, cuando se usa en dosis de 5-10mg 24-48h después de la toma de MTX14,26.
Efectos adversosLa mayoría de los efectos adversos observados con MTX a las dosis comúnmente utilizadas en las enfermedades reumáticas, como manifestaciones gastrointestinales, mucocutáneas o neurológicas, no tienen carácter grave y suelen ocurrir en los primeros 6meses de tratamiento (O’Dell, 1997)27. Los efectos adversos más relevantes consisten en toxicidad pulmonar, hepática y hematológica. Algunos de estos (estomatitis, náuseas, mielosupresión) son dependientes de la dosis y pueden prevenirse mediante el tratamiento con folatos. El volumen corpuscular medio (VCM) puede ser predictor de toxicidad medular, por depleción de ácido fólico. El tratamiento de la pancitopenia requiere suspender el fármaco de inmediato y tratamiento intravenoso de rescate con ácido folínico (que es el neutralizador natural). Sin embargo, los folatos no previenen la toxicidad pulmonar y hepática (Goodman, 1994)28. La toxicidad hepática está relacionada con la acumulación intracelular de MTX en forma de poliglutamatos y con la disminución de folato en el tejido hepático. Aunque no se ha establecido una relación con la depleción de folatos, el suplemento de estos reduce la incidencia de elevación de transaminasas (Van Ede, 2001)29. Es relativamente frecuente observar un aumento reversible de las enzimas hepáticas(Songsiridej, 1990)30, pero la progresión a fibrosis y cirrosis es muy rara: solo acontece en uno de cada 1.000pacientes (West,1997)31. Por otro lado, la toxicidad pulmonar es poco frecuente y no depende de la dosis. La complicación no infecciosa más común es la neumonitis intersticial aguda, cuya mortalidad se estima en torno al 20% (Imokawa, 2000; Kinder, 2005)32,33. La mayoría de los casos se producen en los 2 primeros años de tratamiento. Los pacientes con enfermedad pulmonar previa tienen mayor riesgo de neumonitis (Imokawa, 2000; Alarcón, 1997; Golden, 1995)32,34,35. El tratamiento consiste en la retirada del MTX, la administración de corticoides y el manejo de la insuficiencia respiratoria. Dada la larga vida media del fármaco, puede considerarse el uso concomitante de ácido folínico (Saravanan, 2004; Saravanan, 2006)36,37. Se ha informado de casos de aparición de linfoma de tipo no Hogdkin que desaparece al retirar el fármaco.
Monitorización durante el tratamientoEs necesario realizar un control analítico periódico que incluya hemograma, perfil hepático, renal y proteínas. Al iniciar MTX e incrementar la dosificación, debe realizarse una vigilancia más estrecha, de forma mensual o cada mes y medio. Una vez alcanzada la dosis de mantenimiento, cada 1-3 meses38. Así mismo, hay que realizar una radiografía de tórax periódica y, si se sospecha toxicidad pulmonar, hay que suspender el tratamiento y realizar pruebas más específicas.
Metotrexato en combinaciónEl balance efectividad-toxicidad de MTX en monoterapia sobre la terapia combinada favorece su uso solo. En caso de respuesta insatisfactoria a MTX, alcanzadas las dosis máximas y asegurada la buena biodisponibilidad, debe considerarse el fármaco ancla para la terapia combinada14. Aunque el desarrollo de agentes biológicos ha revolucionado el tratamiento de la AR, no ha suplantado el papel de los FAME convencionales. El tocilizumab es el único agente biológico que ha demostrado superioridad frente al MTX en monoterapia (The Ambition Study, Ann Rheum Dis 2009)39.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.