La nefropatía lúpica silente (NLS) es una forma rara de presentación de la nefropatía lúpica (NL) o podría tratarse de una entidad poco diagnosticada.
La biopsia renal es el único medio diagnóstico, y por ser un método invasivo no está indicada en pacientes asintomáticos; por esta razón es difícil determinar su prevalencia.
Analizaremos los datos aportados por la literatura. Se han descrito más de 250 casos, en estudios prospectivos, ya sea con la descripción de casos aislados o con la recopilación de casos. De la casuística de 226 casos bien descritos de NLS desde la década de los setenta analizaremos 197. Los pacientes con lesiones histológicas tipo I (29 casos [15%]) fueron excluidos del estudio al no ser considerados por definición como NLS. Ciento siete pacientes tenían un tipo II (54,3%), 45 un tipo III (22,8%), 50 un tipo IV (25,4%), 9 un tipo V (4,6%) y un caso un tipo VI. El 40% de los casos fueron de tipo proliferativo (clase III y clase IV); estas formas son las más graves de NL.
Se realizó un seguimiento a 65 pacientes (33%) en 6 de los estudios. Con estos datos no podemos concluir que conocemos la epidemiología y el pronóstico de esta entidad, por lo que se requerirán nuevos estudios
Silent lupus nephritis (SLN) is an unusual clinical presentation of lupus nephritis (LN) and may be an underdiagnosed entity. Renal biopsy is the only diagnostic method but is invasive and is not indicated in asymptomatic patients. Consequently, the prevalence of this disease is difficult to determine. Data from more than 250 SLN cases published in the literature were analyzed from isolated cases, case studies and prospective studies. Of the 226 well-described cases, we selected 197 reported after the 1970s. Patients with class I lesions (n=29, 15%) were excluded as they fell outside the definition of SLN. Among included patients, there were 107 with class II (54.3), 45 with class III (22.8%), 50 with class IV (25.4%), 9 with class V (4.6%) and one with class VI. Forty percent had proliferative forms (classes III and IV), the most severe forms of LN.
Of the 197 patients, 65 patients (33%) from six publications were followed-up. The data did not allow conclusions to be drawn on the epidemiology or prognosis of this entity. Future studies are required to clarify these issues.
El lupus eritematoso sistémico (LES) es una enfermedad frecuente, con una incidencia de entre 2 y 5/100.000 habitantes y una prevalencia de entre 14 y 40/100.000 habitantes, según las series. Estas diferencias dependen fundamentalmente del grupo poblacional en el que se realice el estudio epidemiológico. Es más frecuente en mujeres, con una edad promedio entre los 29 y 32 años, aunque puede presentarse a cualquier edad1.
Esta enfermedad puede tener manifestaciones multiorgánicas graves. De estas manifestaciones la nefropatía lúpica (NL) sigue siendo la manifestación sistémica más frecuente, con una incidencia 4,4/100.000 habitantes, y aumenta a 7,1 cuando se estudia solamente a las mujeres. En los hombres la incidencia es de 1,4/100.0002. En los pacientes diagnosticados de lupus la prevalencia puede alcanzar entre el 30 y 55% de los casos. La gravedad de las manifestaciones renales son las que confieren peor pronóstico a esta enfermedad2.
El diagnostico precoz para un tratamiento adecuado de la NL es de gran importancia para el pronóstico global. El diagnóstico histológico más frecuente en las diferentes series continúa siendo la forma proliferativa (III y IV), y en los estudios de correlación clínico-patológica es frecuente encontrar la proteinuria de rango nefrótico como manifestación clínica inicial3. Cuando revisamos los estudios de biopsias seriadas o repetidas, queda de manifiesto el aumento del índice de cronicidad en las biopsias sucesivas, por lo que es imperativo mejorar la estrategia para el diagnóstico en pacientes poco sintomáticos3,4.
Hay pocos estudios que investiguen la evolución de la NL silente (NLS) de inicio y su relación con la terapia realizada. Esto nos plantea varias preguntas: ¿es tardío el diagnóstico de la NL, por lo que diagnosticamos nefropatías más graves? Las nefropatías menos graves, como las I-II no tratadas, ¿podrían evolucionar a formas más severas?
La literatura nos advierte que hay lesiones renales severas que no tienen traducción a nivel clínico, y a estas nos referimos como NLS. Su diagnóstico es difícil, ya que una biopsia renal en un paciente sin manifestaciones renales aparentes no está indicada en ningún protocolo de actuación publicado hasta el momento.
Diagnóstico clínico de la nefropatía lúpicaComo la expresión clínica de la NL es muy diversa, también el rango de frecuencia de la afectación renal en el momento de del diagnóstico de LES es amplio y se estima entre el 25 y el 50%, según las series. Durante el seguimiento de los pacientes con LES, esta frecuencia aumenta hasta el 60-80% de los casos5.
Las manifestaciones clínicas de la afectación renal no guardan relación con la gravedad de las lesiones histológicas, ni predicen el tipo lesión histológica ni su severidad, pero ayudan a monitorizar la respuesta al tratamiento y la posibilidad de evolución a la insuficiencia renal crónica (IRC)6.
La clínica de presentación de la NL clase IV en la mayoría de los casos es de síndrome nefrítico agudo con sedimento activo, proteinuria de rango nefrótico, hipertensión arterial e insuficiencia renal aguda en más del 50% de los casos7. En pacientes refractarios al tratamiento pueden evolucionar a la insuficiencia renal crónica (IRC).
Para el diagnóstico clínico de la afectación renal tenemos marcadores útiles en sangre y en orina, entre ellos:
Sedimento urinarioEl sedimento de orina se considera activo cuando presenta más de 5 hematíes por campo con o sin leucocituria en 2 muestras consecutivas, y siempre que ello no esté justificado por causas no renales, como infección del tracto urinario, litiasis, etc. Los cilindros son muy específicos de afectación del parénquima renal, pero no aparecen con frecuencia en esta enfermedad o no se determinan en muchos centros. Los cilindros hemáticos pueden diferenciar la hematuria renal de la hematuria de vías urinarias. Otros cilindros que pueden aparecer son cilindros leucocitarios y granulosos, hialinos y granulohialinos1. La microhematuria está presente en cerca del 80% de las nefropatías clínicamente evidentes5. En un estudio de seguimiento de 17 pacientes diagnosticados de NL clase IV en los que se realizó sedimento urinario sistemáticamente de forma prospectiva se detectó que la actividad del sedimento (cilindros hemáticos o leucocitarios) precedió el brote renal en 35 de 43 brotes con una sensibilidad del 81%7.
Estimación de la proteinuriaLa proteinuria es un marcador importante en el diagnóstico clínico y la monitorización evolutiva de las manifestaciones renales de la enfermedad. Existen diferentes métodos para realizar la cuantificación de la proteinuria. El más usado es el de recogida de orina de 24h, que en estudios realizados en pacientes con nefropatía lúpica tiene un alto nivel de concordancia con la ratio proteína/creatinina, siempre que la proteinuria esté en el rango entre 0,5-2g/24h. Esta correlación disminuye a medida que la cantidad de proteinuria aumenta, por lo que es un buen método de cribado y para monitorizar la respuesta al tratamiento, siempre que la proteinuria no sea de rango nefrótico7,8. El índice albúmina/creatinina es más sensible a la hora de valorar daño renal, pero no hay estudios realizados en pacientes con LES.
Estimación de la función renalEl método más usado en ensayos clínicos para valorar la insuficiencia renal ha sido la creatinina sérica. Aunque es una medida útil, tiene muchas limitaciones. Sus valores pueden estar influenciados por la edad, el sexo y la raza, entre otros. Actualmente se utilizan otros métodos de estimación de la función renal, como son las fórmulas del MDRD y de Cockcroft y Gault, y más recientemente la CKD-EPI. Todas ellas han resultado precisas y más fiables que la creatininemia a la hora de estimar la función renal. Otros métodos son más sensibles, precisos y fiables para detectar una disminución leve de la función renal, como es el caso del EDTA-GFR, pero es más caro y laborioso que los otros métodos.
El MDRD estima la función renal y clasifica la enfermedad renal crónica en 5 estadios. Cuando el filtrado glomerular calculado disminuye por debajo de 60ml/min/1,73m2, la estimación es menos precisa en el rango de la normalidad del filtrado y en pacientes con disminución de la masa corporal como en niños, ancianos o amputados7,9. En estos casos se deberá valorar el filtrado por otros métodos, como la cistatina C, métodos isotópicos, etc.
Es importante recordar que estos métodos de medición de filtrado glomerular calculado, muy útiles para clasificar el estadio de insuficiencia renal crónica, no lo son tanto para valorar el fallo renal agudo y su evolución. En este caso se debería determinar por aclaramiento de creatinina u otro gold estandard. Recientemente, un estudio en 86 pacientes con nefropatía lúpica determinó que el MDRD en el momento de la biopsia predecía la evolución renal a largo plazo con mayor eficacia que la creatinina sérica9.
Nefropatía lúpica y su relación con la actividad lúpica sistémicaTradicionalmente se han utilizado marcadores biológicos, como los niveles de complemento C3 y C4, y niveles de autoanticuerpos, como el anti-ADN, para determinar el grado de actividad lúpica y el riesgo de desarrollar brotes de nefropatía. Sin embargo, algunos estudios muestran que estas pruebas tienen una sensibilidad de detección de brotes del 50-70% y una especificidad menor del 75% para todas las pruebas. Es posible que la determinación de nuevos autoanticuerpos podría aumentar la sensibilidad de estas pruebas, como ocurre con el anti-C1q, que tiene un valor predictivo negativo del 97-100%, lo que hace poco probable sufrir un brote renal cuando este anticuerpo es negativo. Se están explorando nuevos marcadores en la vía de activación de los linfocitos B, y múltiples citocinas y quimosinas, con el inconveniente de que pueden ser activadas en otras patologías y enfermedades renales no lúpicas, con la pérdida de especificidad10.
La NL no es una entidad estática y tiene una gran capacidad de cambio de unos grados histológicos a otros, lo que plantea más dificultades a la hora de encontrar marcadores serológicos y urinarios útiles para determinar la gravedad de las lesiones renales11. No obstante, para algunos autores, en el pasado, la actividad serológica del LES prácticamente aseguraría la presencia de alteraciones en la biopsia renal, en ausencia de nefropatía clínica12. La biopsia renal continúa siendo el gold estandard del diagnóstico de la nefropatía lúpica, y seguimos sin disponer de ningún marcador suficientemente sensible para determinar la actividad de la NL y que sea idóneo para el seguimiento de estos pacientes.
Utilidad de la biopsia renal en el diagnóstico de la nefropatía en el LESLa biopsia renal, además de ser una herramienta diagnóstica esencial en la NL debido a que la correlación clínica con la severidad de las lesiones histológicas es muy baja, también es una herramienta eficaz para determinar el pronóstico a largo plazo3,13,14. Algunos estudios sugieren que las biopsias repetidas podrían ser más sensibles para establecer el pronóstico que las biopsias iniciales. Uno de los cambios histológicos que más influye en el pronóstico renal es el índice de cronicidad, que, como se ha demostrado, aumenta en las biopsias sucesivas13. Este hecho podría indicar que el tratamiento realizado en el primer brote no ha sido suficientemente efectivo para prevenir la evolución a la cicatrización de las lesiones o ha habido brotes sucesivos no diagnosticados ni tratados por ser clínicamente silentes o no haber sido reconocidos clínicamente.
La mayoría de los pacientes que entran en los ensayos clínicos tienen clínica renal severa, y en la mayoría de criterios de inclusión debe haber una proteinuria mayor de 1g/día cuando los criterios clínicos para la indicación de la biopsia renal en esta patología son muy leves, como la proteinuria entre 0,3-0,5g/día en los diferentes protocolos de actuación. Es posible que a estos pacientes les estemos realizando tarde la biopsia renal, por lo que las clases histológicas más frecuentes son las más severas.
Como en el trasplante renal, muchos grupos están de acuerdo en que en la NL se deberían realizar biopsia de seguimiento independientemente de sus manifestaciones clínicas, ya que puede predecir mejor el pronóstico3. Sin embargo, otros grupos afirman que son clínicamente irrelevantes, ya que en los casos en los que la primera biopsia es de tipo proliferativo, la segunda lo será, por lo que se debería realizar un tratamiento agresivo del brote sin necesidad de biopsia, ya que el esquema terapéutico no variará, y si la biopsia inicial no es proliferativa solo recomiendan la biopsia renal repetida en los casos en que podría darse un cambio a proliferativa, y solo la recomiendan en pacientes sintomáticos15.
Definición de nefropatía lúpica silente (NLS)Se define como la afectación renal en los pacientes diagnosticados de LES que no cumplen los criterios clínicos fijados por la ARA para afectación renal (1: >3hematíes por campo o presencia de cilindros de cualquier clase en el sedimento urinario, y/o 2: proteinuria de 24h >0,5g), a los que se les ha realizado una biopsia renal y cumplen los criterios de nefropatía según la clasificación de la nefropatía lúpica16.
Un alto porcentaje de pacientes con LES pueden tener alteraciones morfológicas renales sin manifestaciones clínicas, como se ha sugerido en estudios realizados en la década de los setenta12,17 y como se ha comprobado en estudios sucesivos18. Este subtipo de nefropatía, denominada NLS, podría aumentar considerablemente la prevalencia de la afectación renal del LES. Se estima en el 35 al 75%, y según la opinión de algunos autores podría estar presente en el 90-100% de los pacientes diagnosticados de LES si la muestra de la biopsia renal es representativa12.
Criterios diagnósticos de NLSPara realizar el diagnóstico de NLS se deberían cumplir los siguientes criterios: el paciente debe estar diagnosticado de LES según los criterios propuestos por el American College of Rheumatology (ACR). Para ello debe cumplir 4 o más criterios en cualquier momento de la evolución de la enfermedad. El hecho de no presentar ninguna manifestación clínica renal confiere una especificidad y una sensibilidad del 96%. Se considera que no hay afectación renal cuando los niveles de creatinina en plasma están entre 0,6-1,4mg/dl, el aclaramiento de creatinina es normal (70-120ml/min/m2), no existe proteinuria (<300mg/orina de 24h o la ratio proteína creatinina es de <2,5mg/mmol) y el sedimento de orina es normal (leucocitos <5/campo, eritrocitos <5/campo, ausencia de células y de cilindros de cualquier clase)16.
Los pacientes a los que se les haya realizado una biopsia renal en estas circunstancias clínicas deberán tener cambios morfológicos compatibles con los tipos II, III, IV, V, VI de la clasificación de la nefropatía lúpica de la Sociedad International de Nefrología y la Sociedad de Patología Renal (ISN/RPS)19,20.
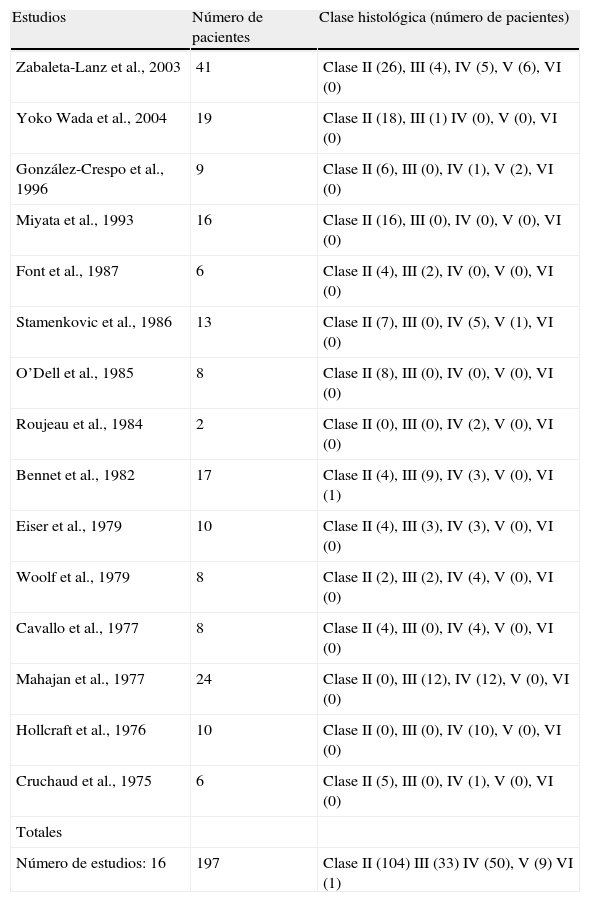
Características histológicas de la NLSLas características histológicas son las mismas de la clasificación de la NL, consensuadas por la Sociedad International de Nefrología y la Sociedad de Patología Renal (ISN/RPS)19,20 resumida en Tabla 1. En la Tabla 2 se resumen los casos mejor estudiados que aparecen en la literatura de dichos estudios. Se han excluido los casos diagnosticados de clase I. Como se explica anteriormente, en el diagnóstico histológico entre la NL y la NLS no hay diferencia, excepto que los pacientes clasificados como clase 1 no son considerados como una NLS.
Resumen estructurado de la clasificación de la nefritis lúpica del consenso de la Sociedad Internacional de Nefrología y la Sociedad de Patología Renal
| Clase I | Nefritis lúpica con cambios mesangialesGlomérulo normal en microscopia óptica pero con depósitos mesangiales por inmunofluorescencia |
| Clase II | Nefritis lúpica proliferativa mesangialHipercelularidad mesangial pura de cualquier grado o expansión de la matriz mesangial por microscopia óptica, con depósitos mesangiales. Puede haber algún depósito subendotelial visible por inmunofluorescencia o por microscopia electrónica, pero no por microscopia de luz |
| Clase III | Nefritis lúpica focalGlomerulonefritis endo o extracapilar segmentaria o global, activa o inactiva, que afecta menos del 50% de los glomérulos, típicamente con depósitos inmunes subendoteliales segmentarios con o sin afectación mesangialClase III (A) Lesiones activas: NL focal proliferativaClase III (A/C) Lesiones activas y crónicas: NL focal proliferativa y NL esclerosanteClase III (C) Lesiones inactivas y crónicas con cicatrices glomerulares y esclerosis focal |
| Clase IV | Nefritis lúpica difusaGlomerulonefritis endo o extracapilar segmentaria o global, activa o inactiva, que afecta más del 50% de los glomérulos, típicamente con depósitos inmunes subendoteliales difusos con o sin afectación mesangial. Esta clase se subdivide en NL segmentaria difusa (IV-S) cuando más de 50% de los glomérulos tienen lesiones segmentarias, y en difusa global cuando más del 50% de los glomérulos tienen afectación globalClase IV-S (A) Lesiones activas: NL proliferativa segmentaria y difusaClase IV-G (A) Lesiones activas: NL proliferativa global y difusaClase IV-S(A/C) Lesiones activas y crónicas: NL proliferativa segmentaria y difusa y NL esclerosanteClase IV-G(A/C) Lesiones activas y crónicas: NL proliferativa global y difusa y NL esclerosanteClase IV-S (C) Lesiones crónicas con cicatrices glomerulares y esclerosis segmentaria y difusaClase IV-G (C) Lesiones crónicas con cicatrices glomerulares y esclerosis global y difusaSe define como segmentaria la afectación de menos de la mitad del ovillo glomerular, y se incluyen cuando hay asas de alambre de forma difusa con poca o sin proliferación |
| Clase V | Nefritis lúpica membranosaDepósitos inmunes subepiteliales gomal o segmentario o su secuela morfológica por microscopia óptica por inmunofluorescencia o por microscopia electrónica con o sin alteraciones mesangialesLa nefropatía lúpica clase V puede presentarse combinada con lesiones proliferativas clase II, III o IV, en cuyo caso deben ser diagnosticadas ambas |
| Clase VI | Nefritis lúpica con esclerosis avanzada>90% de los glomérulos están globalmente esclerosados con actividad residual |
Debe indicarse la proporción de glomérulos con lesiones activas e inactivas, necrosis fibrinoide o semilunas.
También se indicará el grado (leve, moderado, severo) de la lesión tubulointersticial tanto inflamatoria con esclerosa, y la lesión vascular, incluyendo la arterioesclerosis.
Lesiones activas: hipercelularidad endocapilar, con o sin leucocitos y con reducción sustancial de la luz capilar, cariorrexis, necrosis fibrinoide, ruptura de la membrana basal glomerular, semilunas celulares o fibrocelulares, identificación de depósitos subendoteliales identificables por MO (asas de alambre), trombos hialinos (agregados intraluminales de complejos inmunes).
Lesiones crónicas: esclerosis glomerular (segmentaria o global), adhesión fibrosa y semilunas fibrosas.
Se deberá reportar el índice de actividad y conicidad.
De: Lupus nephritis reclassified20.
Resumen de los grupos de casos publicados de los que se han substraído los casos clasificados como clase I por no ajustarse a la definición de lupus silente y no se han incluido los casos publicados aisladamente. Se reflejan los autores de cada publicación con el número de casos que se ajustan a la definición
| Estudios | Número de pacientes | Clase histológica (número de pacientes) |
| Zabaleta-Lanz et al., 2003 | 41 | Clase II (26), III (4), IV (5), V (6), VI (0) |
| Yoko Wada et al., 2004 | 19 | Clase II (18), III (1) IV (0), V (0), VI (0) |
| González-Crespo et al., 1996 | 9 | Clase II (6), III (0), IV (1), V (2), VI (0) |
| Miyata et al., 1993 | 16 | Clase II (16), III (0), IV (0), V (0), VI (0) |
| Font et al., 1987 | 6 | Clase II (4), III (2), IV (0), V (0), VI (0) |
| Stamenkovic et al., 1986 | 13 | Clase II (7), III (0), IV (5), V (1), VI (0) |
| O’Dell et al., 1985 | 8 | Clase II (8), III (0), IV (0), V (0), VI (0) |
| Roujeau et al., 1984 | 2 | Clase II (0), III (0), IV (2), V (0), VI (0) |
| Bennet et al., 1982 | 17 | Clase II (4), III (9), IV (3), V (0), VI (1) |
| Eiser et al., 1979 | 10 | Clase II (4), III (3), IV (3), V (0), VI (0) |
| Woolf et al., 1979 | 8 | Clase II (2), III (2), IV (4), V (0), VI (0) |
| Cavallo et al., 1977 | 8 | Clase II (4), III (0), IV (4), V (0), VI (0) |
| Mahajan et al., 1977 | 24 | Clase II (0), III (12), IV (12), V (0), VI (0) |
| Hollcraft et al., 1976 | 10 | Clase II (0), III (0), IV (10), V (0), VI (0) |
| Cruchaud et al., 1975 | 6 | Clase II (5), III (0), IV (1), V (0), VI (0) |
| Totales | ||
| Número de estudios: 16 | 197 | Clase II (104) III (33) IV (50), V (9) VI (1) |
Con estos criterios clínicos se han publicado más de 200 casos en la literatura y se ha analizado su evolución en más de 70 casos. Bennett et al.21 estudiaron en 1982 20 casos de lupus clínicamente silente, y de estos solo 4 casos desarrollaron clínica renal, independientemente de la clase histológica, durante un seguimiento de 10 años. En 1985 se analizó la evolución de 11 pacientes diagnosticados de NLS, con seguimiento medio de 5 años. Ocho pacientes presentaron proliferación mesangial con depósitos inmunes que se clasificarían como clase II, y 3 tenían una clase I. Todos los pacientes permanecieron con función renal normal y sin proteinuria al final del seguimiento. La supervivencia actuarial fue del 90%, y un paciente murió por endocarditis bacteriana, con función renal normal y una proteinuria negativa22.
En 1982 se estudió la evolución de 10 de los 27 pacientes con nefropatía clínicamente silentes que había sido reportados por Soudesh. Siete de ellos permanecieron con función renal normal y 3 evolucionaron a ERC; uno murió por esta causa23.
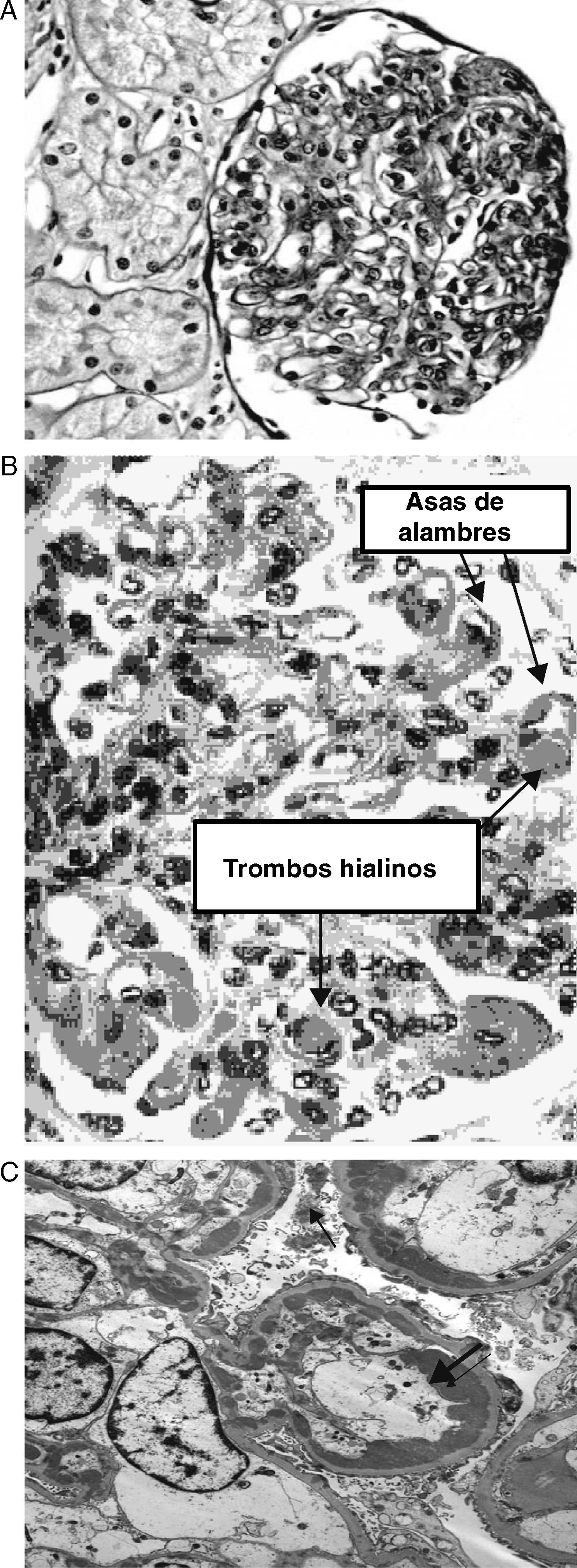
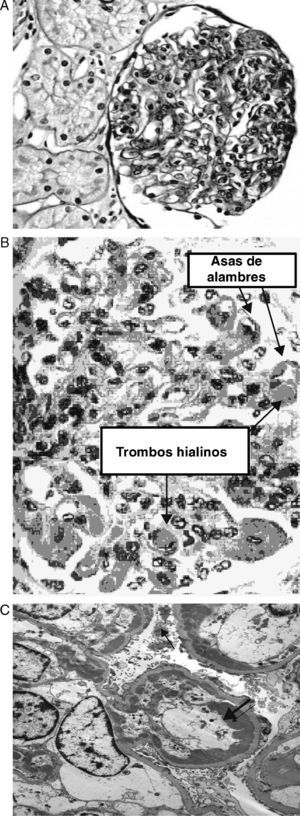
En 1986 se estudió la evolución a largo plazo de 6 pacientes con lupus silente, 5 de ellos con diagnóstico de NL clase IV y uno de clase V, con un seguimiento medio de 7 años (figs. 1A-C). Todos ellos fueron tratados y seguían con función renal normal al final del seguimiento24. Posteriormente, disponemos de 2 estudios realizados por grupos españoles. El primero, publicado en 1987, incluía 15 pacientes con un seguimiento medio de 2,2 años (rango: 1-6,3 años). Todos los pacientes recibieron prednisona (1-0,5mg/kg/día), y solo uno recibió tratamiento con ciclofosfamida oral. Todos los pacientes continuaron con función renal normal y sin proteinuria al final del seguimiento, excepto el paciente que requirió tratamiento con ciclofosfamida, que presentó una proteinuria de 448mg/24h durante el seguimiento25. El otro estudio incluyó 18 pacientes con NLS, con una media de seguimiento de 13 años (rango: 2-17 años). El diagnóstico histológico fue el siguiente: 9 pacientes con clase I, 6 con clase II, 1 con clase IV y 2 con clase V. Todos fueron tratados con corticoides tras la biopsia renal, y 2 recibieron ciclofosfamida. La evolución fue buena desde el punto de vista renal, permaneciendo con función renal normal (creatinina sérica media: 71μmol/l, aclaramiento de creatinina medio: 108ml/min y sedimento urinario normal)26. Más recientemente, también se ha reportado una buena evolución en un estudio que incluye 33 pacientes con NLS, de los cuales 8 desarrollaron clínica renal y los otros 23 permanecieron clínicamente silentes en un tiempo de evolución medio de 5 años. La mayoría de los pacientes recibieron algún tipo de tratamiento con corticoides y/o inmunosupresores27.
(A) Microscopia óptica: nefropatía lúpica IV con intensa proliferación mesangial y endocapilar. (Departamento de Patología, Fundación Puigvert.). (B) Microscopia óptica: nefropatía lúpica clase IV con trombos hialinos y asas de alambres (depósitos subendoteliales. Extraído de: http://www.med.niigatau.ac.jp/npa/Lectures/LupusNephritis.htm. (C) Microscopia electrónica: nefropatía lúpica IV. Depósitos subendoteliales grandes y extensos ocluyen parcialmente el lumen capilar glomerular. También pueden observarse depósitos mesangiales. (Universidad central de Venezuela, Departamento de Patología.).
Los marcadores clínicos de nefropatía de los que actualmente disponemos son poco sensibles a la hora de predecir la presencia de nefropatía y su gravedad. Por otro lado, no son buenos marcadores del pronóstico, a excepción de la función renal medida por filtrado glomerular o aclaramiento de creatinina. Sin embargo, la insuficiencia renal no es un buen marcador de NL, ya que puede estar ocasionada por otras causas ajenas al lupus, como puede ser la nefrotoxicidad farmacológica, entre otras.
La falta de marcadores clínicos y de correlación entre tipo histológico y pronóstico ha inducido a la comunidad científica a recomendar el diagnóstico precoz de la NL, estableciendo límites muy estrechos para la alteración de los marcadores clínicos que marcan la indicación del diagnóstico de la NL por biopsia renal.
La mayoría de los autores están de acuerdo en que la actitud a seguir es realizar la biopsia renal antes que la lesión renal producida por una enfermedad activa no diagnosticada ni tratada sea irreversible.
Son necesarios más estudios sobre nuevos marcadores diagnósticos, urinarios o plasmáticos, de afectación renal en el LES, con una sensibilidad y una especificidad superiores a las de los marcadores de los que disponemos en la actualidad y que nos permitan también realizar un seguimiento adecuado de la actividad de la NL.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses