INTRODUCCIÓN
La mejoría en el conocimiento de la etiopatogenia de las enfermedades autoinmunes, unido al impresionante desarrollo de la genética molecular, ha posibilitado la introducción de nuevas estrategias terapéuticas, conocidas como terapias biológicas.
La terapia biológica ha cambiado el panorama en el tratamiento de los pacientes con artropatías crónicas inflamatorias. El factor de necrosis tumoral alfa (TNF-α) es una citocina implicada en la patogenia de varias enfermedades inflamatorias (producción y perpetuación del proceso inflamatorio crónico) como la artritis reumatoide (AR), las espondiloartropatías (EA), la psoriasis y las enfermedades inflamatorias intestinales.
Entre los nuevos fármacos introducidos para el tratamiento de estas enfermedades, los comúnmente conocidos como anti-TNF intentan regular más finamente la actividad biológica de esta sustancia. Clínicamente se han diseñado 2 modos de bloquear el TNF-α: uno mediante el uso de su receptor soluble, el etanercept, lo que evita que el TNF-α se una al receptor de membrana celular, y el otro mediante la utilización de anticuerpos monoclonales contra el TNF-α. Éstos pueden ser quiméricos (humano 75% y murino 25%), como el infliximab, o humanos, como el adalimumab. Tienen una eficacia similar, y aunque se trata de tratamientos por lo general bien tolerados, conllevan un potencial de episodios adversos. Las infecciones leves del tracto respiratorio superior (rinitis, sinusitis) son los efectos secundarios más frecuentes. Las infecciones graves pueden aparecer hasta en el 0,9% de los pacientes tratados con anti-TNF-α, frente al 1,3% de los tratados con placebo. No se ha detectado un aumento significativo de la incidencia de neoplasias, y aunque se puede inducir la aparición de anticuerpos antinucleares y antifosfolípido, el desarrollo de cuadros clínicos de lupus eritematoso sistémico (LES) o de síndrome antifosfolípido es bajo.
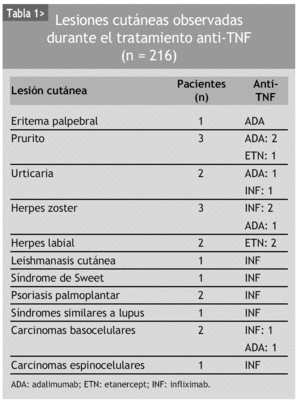
Las manifestaciones cutáneas asociadas al tratamiento anti-TNF no son excepcionales1. En algunos casos, como las reacciones en el punto de inyección, pueden llegar a afectar hasta al 40% de los pacientes. Menor incidencia tienen los cuadros de mayor gravedad, como los síndromes similares a lupus y la vasculitis necrosante, entre otros. En nuestra experiencia hemos observado afectación cutánea en el 8,79% de los pacientes que han recibido tratamiento anti-TNF (tabla 1).
MANIFESTACIONES CUTÁNEAS LEVES
Son las más frecuentes (1-10%). La sequedad cutánea, el prurito, el rash y la urticaria, entre otras, se han descrito con todos los tratamientos anti-TNF. En el caso particular de las terapias subcutáneas son más frecuentes las reacciones en el punto de inyección.
Rash y urticaria
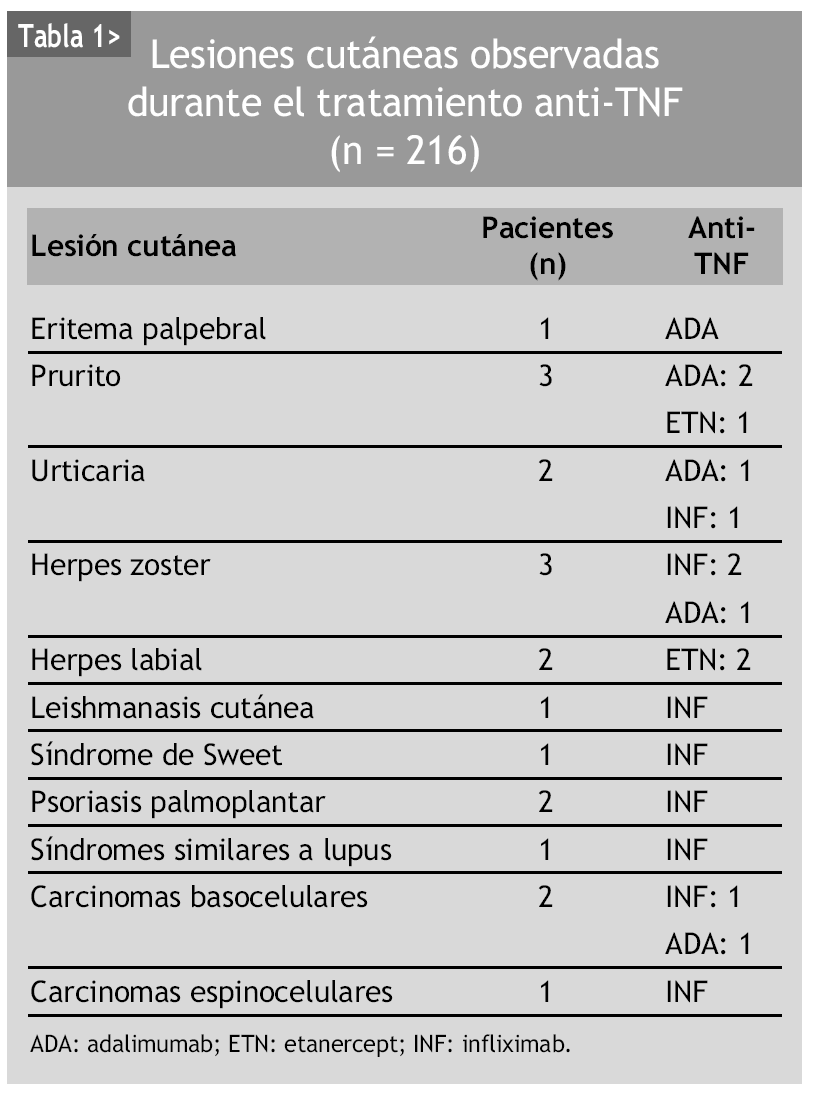
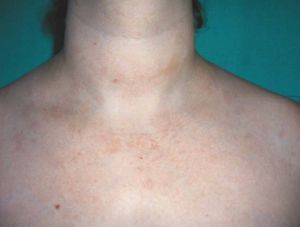
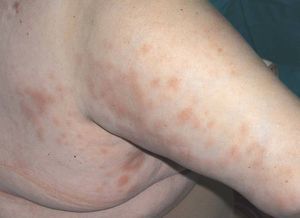
Las reacciones urticariformes con prurito se han descrito con la utilización de todos los anti-TNF2,3, y afectan al 1% de los pacientes (fig. 1). Se trata de reacciones de hipersensibilidad que pueden prevenirse mediante la administración previa de paracetamol y antihistamínicos H1 con o sin corticoides. La discontinuación del tratamiento viene determinada por la intensidad del cuadro clínico.
Figura 1> Urticaria en región cervical y torácica posterior.
Reacciones en el punto de inyección
Las reacciones en el punto de inyección (RPI) pueden aparecer entre el 20 y el 49% de los pacientes tratados con anti-TNF de administración subcutánea (adalimumab y etanercept)4,5, y su etiología es todavía desconocida. Clínicamente se manifiestan como lesiones eritematosas en el lugar de la inyección que pueden producir prurito y, ocasionalmente, edema cutáneo. Se han descrito 2 tipos de reacciones, según el momento de aparición:
RPI de aparición temprana (1 o 2 días postadministración). Ocurren más frecuentemente durante los 2 primeros meses de tratamiento, y generalmente desaparecen entre el tercer y el quinto día6. Se cree que representan reacciones de hipersensibilidad inmediata. La disminución en la frecuencia e intensidad de las RPI sugiere una tolerancia al tratamiento en la que podía estar implicada una respuesta de linfocitos T-CD4.
RPI de aparición tardía (después del quinto día de administración). Se trata de lesiones de las mismas características que las anteriores (eritema, prurito y edema), pero que aparecen en los lugares donde previamente se inyectó el tratamiento; este fenómeno, que puede afectar al 7% de los pacientes, se conoce como "rellamada" (recall injection site reactions)7. Se ha sugerido un mecanismo de hipersensibilidad retardada mediada por linfocitos T-CD8 tras observarse en la biopsia un infiltrado inflamatorio compuesto por linfocitos y eosinófilos8.
La aparición de las RPI es independiente de la mejoría observada a nivel articular. Por lo general se trata de reacciones transitorias y de intensidad leve que se resuelven de forma espontánea hasta en el 90% de los casos; sólo ocasionalmente son causa de discontinuación del tratamiento9. Si la intensidad de la reacción es importante puede utilizarse una crema de esteroides o antihistamínicos ora-les10. La disminución de la dosis de anti-TNF-α y la premedicación del paciente con antihistamínicos no suelen producir cambios en la gravedad de las lesiones de RPI.
MANIFESTACIONES CUTÁNEAS GRAVES
Son menos frecuentes que las anteriores, aunque su aparición no deja de ser preocupante puesto que, en la mayoría de los casos, lleva implícita una discontinuación del tratamiento anti-TNF.
Lesiones psoriasiformes
La psoriasis es una enfermedad cutánea crónica que afecta al 1-3% de la población y se caracteriza por una hiperproliferación y la anormal diferenciación de los queratinocitos, así como infiltración de células T activadas en la epidermis y la dermis papilar.
Aunque los mecanismos que subyacen al efecto beneficioso de los anti-TNF-α en pacientes con psoriasis cutánea permanecen poco claros, se ha postulado que el bloqueo de la acción del TNF-α disminuye la producción de otras citocinas proinflamatorias tales como IL-8, IL-6 y el factor estimulador de colonias, así como la expresión de moléculas de adhesión sobre células endoteliales y queratinocitos, dando lugar a una disminución de la inflamación y de la proliferación de queratinocitos.
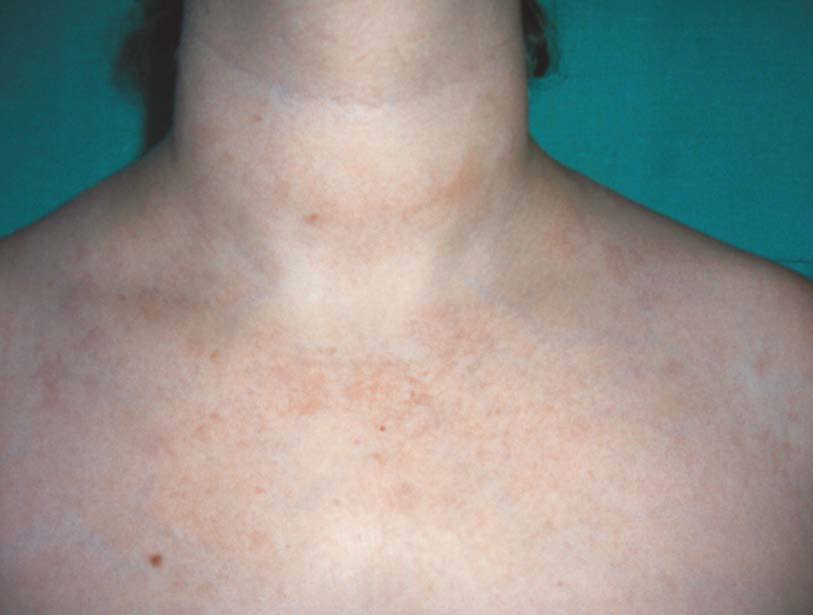
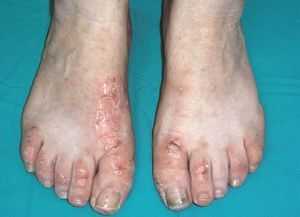
Tanto el receptor soluble del TNF-α como los anticuerpos monoclonales anti-TNF se han utilizado en el tratamiento de la psoriasis cutánea y de la artropatía psoriásica con resultados satisfactorios y pocos efectos secundarios. Estudios controlados han demostrado que el etanercept y el infliximab son eficaces para disminuir la actividad clínica de las lesiones cutáneas en pacientes con formas graves de psoriasis vulgar11. Tales resultados han supuesto un avance en el tratamiento de esta patología. Sin embargo, se han observado efectos secundarios inesperados, como la aparición de nuevas lesiones cutáneas y ungueales típicas de psoriasis (fig. 2) en pacientes con AR12,13 y enfermedad de Crohn14,15, o bien la exacerbación de una psoriasis previa16,17 durante los primeros meses del tratamiento, independientemente de la mejoría observada a nivel articular12 y del anti-TNF utilizado18. Las características histológicas son indistinguibles de la psoriasis vulgar (paraqueratosis, acantosis, hiperqueratosis, capilares tortuosos y dilatados, así como infiltración linfocitaria de la dermis). El mecanismo fisiopatológico que subyace a este fenómeno paradójico es todavía poco concluyente; se han postulado varias teorías como la que apunta la posibilidad de que pudiera tratarse de pacientes erróneamente diagnosticados de AR y el anti-TNF actuara como "revelador" de la enfermedad, si bien esto parece poco probable, puesto que este fenómeno se ha comunicado también en pacientes con AR bien definida clínica y radiológicamente. Otra explicación a este fenómeno paradójico podría ser que la inhibición de la actividad del TNF-α podría teóricamente empeorar o actuar como desencadenante de lesiones cutáneas de psoriasis en algunos pacientes.
Figura 2> Lesiones psoriáticas en ambos pies.
En algunos casos se ha observado también la aparición de una variante de la psoriasis, la pustulosis palmoplantar18. Este efecto negativo puede estar unido a la participación del TNF-α en la normal función glandular y en la alteración existente del TNF-α en la pustulosis palmoplantar, que empeora con el tratamiento.
Para el tratamiento pueden utilizarse esteroides tópicos y ácido salicílico, aunque si las lesiones son graves puede ser necesaria la discontinuación del tratamiento. Nosotros hemos observado 2 pacientes en tratamiento con infliximab que desarrollaron lesiones de pustulosis palmoplantar (1 AR y 1 EA); en ambos se discontinuó el tratamiento y se inició etanercept, con resolución total de las lesiones.
Síndromes similares a lupus (LES-like)
El papel del TNF-α en la patogénesis del LES es complejo. Está claro que es un componente de la respuesta inflamatoria y sus concentraciones están elevadas en el LES. El mecanismo de inducción de anticuerpos antinucleares (ANA) y, ocasionalmente, de enfermedades autoinmunes como el lupus cutáneo o los síndromes similares a lupus (LES-like) en algunos pacientes que reciben tratamiento anti-TNF todavía permanece poco claro. Varias líneas de evidencia sugieren que, bajo ciertas condiciones, el tratamiento anti-TNF promueve la activación de células T autorreactivas que conducen al daño tisular por mecanismos autoinmunes19. En un ensayo aleatorizado en el que se comparaba la eficacia de infliximab más metotrexato frente a metotrexato solo en 428 pacientes con AR, en el 53-68% de los pacientes con infliximab se detectaron títulos positivos de ANA, frente al 26% de los pacientes control; de ellos, el 7-10% tenían elevados los anti-ADN, frente a ninguno en el grupo control20. Resultados similares se han observado en los ensayos con etanercept y adalimumab. En el caso del etanercept, el 11% desarrollaron ANA, y el 15%, anti-ADN. Con adalimumab se observaron títulos positivos de ANA en el 12,6% de los pacientes, frente al 7,3% de los tratados con placebo.
A pesar de la alta tasa de desarrollo de ANA, la aparición de clínica de LES en estos pacientes es rara21,22 y ocurre preferentemente en la forma de LES-like o inducido por fármacos23, con positividad anticuerpos antihistona22,24. En el examen histológico de las lesiones pueden observarse depósitos lineales de IgG, IgM y C3 en la unión dermoepidérmica.
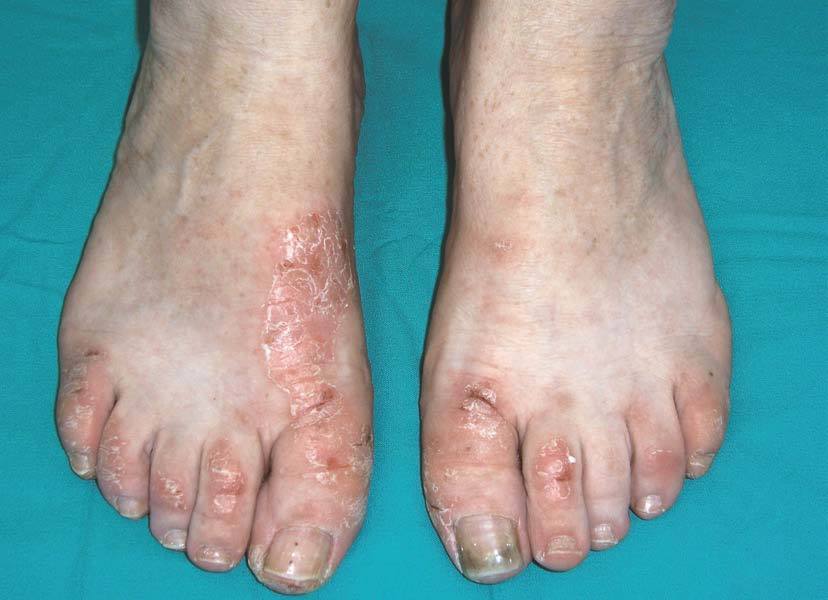
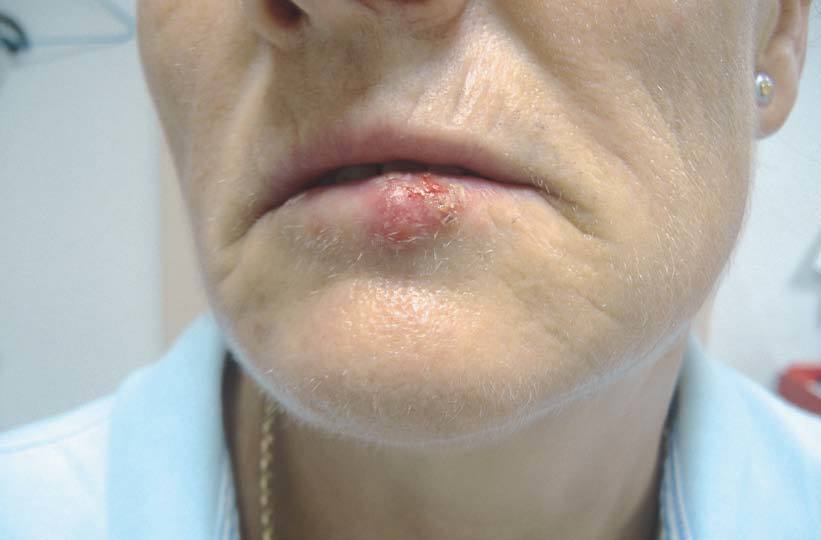
En 3 comunicaciones de LES-like25-27, en 5 pacientes con AR seropositiva tratados con etanercept sólo se observaron altos títulos de ANA, sin positividad de antiRo, antiLA, anti Sm o anti-RNP. En nuestra serie de pacientes tratados con anti-TNF, una paciente con AR seropositiva desarrolló lesiones cutáneas durante el tratamiento con infliximab tras 2 años de tratamiento (fig. 3); en la analítica se observó positividad de anticuerpos antihistona.
Figura 3> Lesiones similares a lupus en un paciente con artritis reumatoide tratado con infliximab.
Las lesiones suelen resolverse tras la discontinuación del tratamiento25-27, si bien el uso de corticoides orales y antimaláricos puede ser útil para acelerar la resolución de las lesiones o si la gravedad de la clínica lo requiere23.
Lesiones granulomatosas
Dermatosis granulomatosa instersticial
La dermatosis granulomatosa intersticial (DGI) se ha asociado a varias patologías sistémicas, más frecuentemente la AR, el LES y las enfermedades linfoproliferativas28. El desarrollo de lesiones papulonodulares en pacientes con AR ha recibido diferentes denominaciones, tales como pápulas reumatoides, dermatitis granulomatosa intersticial, granuloma necrosante extravascular cutáneo y dermatitis granulomatosa neutrofílica en empalizada. Según Ackerman29, los granulomas en empalizada son de 3 tipos básicos: a) granuloma anular (con depósitos centrales de mucina); b) necrobiosis lipoídica (con colágeno degenerado central), y c) nódulo reumatoideo (con fibrina central). Este último constituye la lesión cutánea más comúnmente asociada a AR. Clínicamente algunos pacientes desarrollan pápulas, placas y nódulos en áreas exten-soras y flexurales (tales como axilas), que ocasionalmente adquieren forma de cordones lineales. En el examen histológico puede observarse un infiltrado difuso de histiocitos en el intersticio, fragmentación del colágeno, formación de pequeños granulomas e infiltrado de polimorfonucleares.
Es probable que la DGI represente un fenómeno reactivo con un espectro histopatológico que resulta de la conjunción de varias alteraciones, incluyendo enfermedades autoinmunes, linfoproliferativas y exposición a fármacos.
Magro et al30 describen el primer grupo de pacientes con DGI inducida por fármacos, tales como antagonistas del calcio, hipolipemiantes, inhibidores de la enzima de conversión de la angiotensina, anticonvulsivantes y antihistamínicos. Bremner et al31 han comunicado 3 casos de DGI en pacientes que recibían infliximab.
Nodulosis acelerada
La manifestación cutánea más frecuente en pacientes con AR son los nódulos reumatoides. Se encuentran en el 20 al 35% de los pacientes y casi todos presentan factor reumatoide positivo. Generalmente se han considerado como un reflejo de la actividad de la enfermedad. Se localizan a nivel subcutáneo, en áreas sometidas a microtraumatismos: codos, dedos, tuberosidades isquiáticas, tendones de Aquiles, etc. En el examen histológico puede observarse colágeno degenerado, fibrina central, una corona de histiocitos y fibrosis externa.
Al igual que la sinovial inflamada, los nódulos presentan una producción similar de TNF-α. Sin embargo, en la sinovial la inflamación está dirigida por células T, se exhibe la presencia de agregados linfoides B y en las lesiones erosivas intervienen metaloproteinasas. Esto está ausente en los nódulos, cuya patogenia sería mediada por complejos inmunes y por una mayor exposición a moléculas de adhesión.
Los nódulos reumatoides suelen regresar con los tratamientos de fondo, cuando la actividad de la enfermedad mejora. No obstante, de forma paradójica, algunos de los tratamientos como el metotrexato32 pueden aumentar el tamaño y el número de los nódulos, sobre todo en las manos, a pesar de mejorar la actividad global de la enfermedad33. Existen 3 casos publicados de pacientes con AR tratados con etanercept, con mejoría de la artritis periférica pero con aparición de nódulos periféricos en 2 casos, y cavitación de nódulos pulmonares en uno. No se han publicado casos de nodulosis acelerada con los anticuerpos monoclonales anti-TNF.
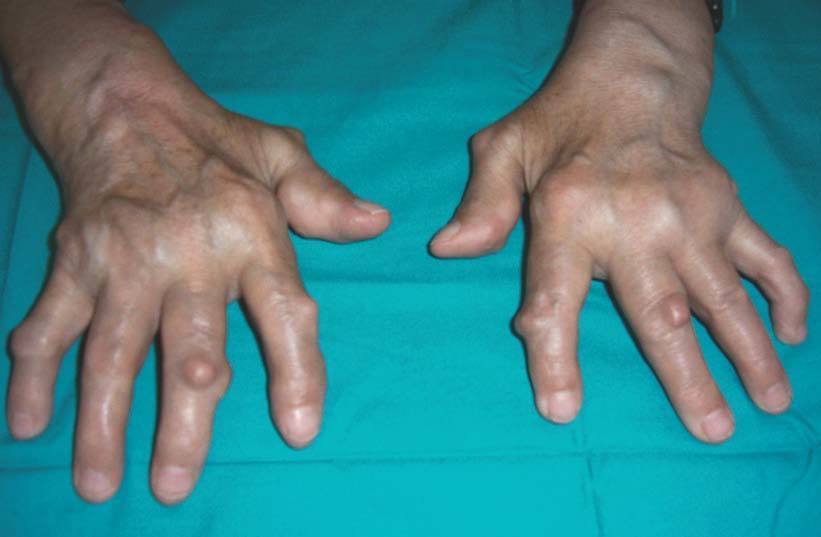
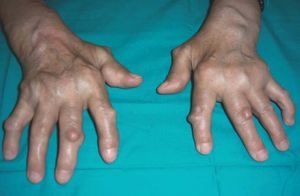
Nosotros tenemos una paciente con AR de larga evolución, en tratamiento con etanercept en monoterapia, que desarrolló nuevos nódulos en las manos con mejoría de la artritis y de los parámetros analíticos de actividad de la enfermedad (fig. 4).
Figura 4> Nódulos reumatoides aparecidos durante el tratamiento biológico.
Las diferencias en la fisiopatogenia de la sinovial inflamada y los nódulos podrían explicar, en parte, el desarrollo de nódulos en AR con artritis controlada, como también la falta de respuesta de la nodulosis, en algunos pacientes, a la terapéutica con anti-TNF. Se desconoce el tratamiento que debe seguirse en estos casos, y si la discontinuación del anti-TNF produce mejoría del tamaño y del número de nódulos. No obstante, dado que el arsenal terapéutico de terapias biológicas dispone de fármacos con otro mecanismo de acción diferente al bloqueo del TNF, ésta podría ser la opción más indicada.
Vasculitis
La vasculitis leucocitoclástica es una vasculitis de pequeño vaso que afecta a las vénulas poscapilares de la piel. Se han descrito varias causas desencadenantes de esta patología, como las infecciones, las neoplasias y la crioglobulinemia, y en el 10% de los casos se asocia al tratamiento farmacológico.
El cuadro clínico se caracteriza por una púrpura palpable que afecta principalmente a los miembros inferiores, acompañada a veces de dolor abdominal, artralgias y afectación renal.
El mecanismo patogénico probablemente incluye interacciones antígeno-anticuerpo, toxicidad directa sobre la pared de los vasos, autoanticuerpos dirigidos contra células endoteliales o reacciones mediadas por citocinas sobre el endotelio vascular o inducción de autoanticuerpos tales como los anticuerpos citoplasmáticos antineutrófilos (ANCA).
Es esencial confirmar el diagnóstico mediante una biopsia cutánea con inmunofluorescencia y cultivar las lesiones para excluir causas infecciosas.
Mohan et al34 han identificado un grupo de 35 pacientes (20 tratados con etanercept y 15 con infliximab) que desarrollaron manifestaciones clínicas de vasculitis. En 15 de los 35 las lesiones se iniciaron en los miembros inferiores y luego se diseminaron. En 3 pacientes tratados con etanercept las lesiones se iniciaron en el punto de inyección y posteriormente se diseminaron. El diagnóstico se confirmó con biopsia en 17 de los 35 casos. La discontinuación del tratamiento anti-TNF mejoró las lesiones cutáneas en 22 de los 35 pacientes. En 6 pacientes aparecieron nuevas lesiones después de reiniciar el tratamiento anti-TNF.
Se han comunicado pocos casos de vasculitis con adalimumab35, probablemente porque su comercialización es más reciente.
La discontinuación del tratamiento se acompaña de una resolución completa o parcial de las lesiones hasta en el 50% de los pacientes34-36. En los casos graves puede ser útil el tratamiento con corticoides. La reintroducción del tratamiento anti-TNF puede ocasionar recidiva de las lesiones.
Infecciones cutáneas
Aunque las infecciones cutáneas son frecuentes en pacientes con AR, los resultados de varios estudios1 sugieren que el tratamiento anti-TNF incrementa el riesgo de infecciones cutáneas, parti-cularmente infecciones fúngicas y foliculitis. Asimismo, se ha comprobado que el TNF-α es una citocina importante en la respuesta inmune frente a las infecciones virales37, por lo que la ausencia de la misma puede facilitar la infección primaria y las recurrencias del virus herpes simple (VHS) y de la varicela zoster (VVZ)38. La respuesta inmune del huésped ante la infección influye en la adquisición, en la gravedad y en la frecuencia de recidivas.
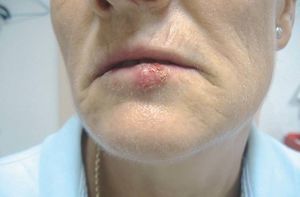
La infección por el VHS (fig. 5) y el VVZ afecta fundamentalmente a las superficies mucocutáneas. La utilización de terapias biológicas ha incrementado las formas graves de herpes zoster; de hecho ya se han comunicado casos de infecciones graves por VVZ en pacientes tratados con infliximab38.
Figura 5> Herpes labial en paciente en tratamiento biológico.
El tratamiento con aciclovir39 y otros antivirales puede acortar la duración de las lesiones y prevenir la neuralgia postherpética. La discontinuación del tratamiento no es necesaria en los casos leves.
En nuestra experiencia40 hemos observado la infección por VHS en 2 pacientes tratadas con etanercept y VVZ en 1 paciente tratado con infliximab y 1 paciente con adalimumab. Una de las pacientes tratadas con etanercept ha presentado varios episodios de herpes simple labial, pero dada la mejoría observada a nivel articular hemos decidido mantener el tratamiento y utilizar antivirales cuando aparecen las lesiones herpéticas.
Queratosis actínica y neoplasias cutáneas
Los efectos de los tratamientos prolongados con anti-TNF pueden ser diferentes, respecto al desarrollo de lesiones neoplásicas, cuando se utilizan en pacientes con daño solar mínimo y con daño actínico.
Smith et al41 describen 7 pacientes que desarrollaron uno o más carcinomas epiteliales de células escamosas, de rápido crecimiento, 4 meses después del inicio del tratamiento con etanercept. Clínicamente tenían evidencia de daño actínico y 4 tenían historia de carcinomas basocelulares. Todos ellos mejoraron desde el punto de vista articular con el tratamiento anti-TNF, sin otros efectos secundarios.
Esto concuerda con la evidencia que apoya una participación del TNF-α en la iniciación tumoral, aunque no se puede establecer una relación causal entre los anti-TNF y la aparición de neoplasias cutáneas.
En nuestro grupo de tratamiento biológico42, una paciente en tratamiento con infliximab y una con adalimumab han presentado carcinomas basocelulares; una de ellas desarrolló, además, carcinomas epidermoides múltiples. Ninguna tenía antecedente de otro tipo de neoplasia ni había recibido tratamiento previo con ciclosporina, aunque eran pacientes con piel y ojos claros.
CONCLUSIÓN
Las terapias biológicas han demostrado hasta el momento su eficacia y su seguridad, pero no dejan de estar exentas de efectos secundarios, que en su mayoría son de intensidad leve. Las manifestaciones cutáneas más frecuentes son las reacciones en el punto de inyección asociadas a los tratamientos de administración subcutánea. Menor incidencia tienen los cuadros de mayor gravedad, como los síndromes LES-like, las vasculitis o las neoplasias. En otros casos se ha observado el desarrollo de lesiones psoriasiformes como efecto paradójico. No se puede establecer si existen diferencias significativas entre los anti-TNF en este tipo de manifestaciones. En nuestro caso, las diferencias observadas se deben muy probablemente al número de pacientes asignados a cada tratamiento y al tiempo de exposición. La estimación de la incidencia real de estos acontecimientos adversos asociados al tratamiento anti-TNF es difícil, puesto que no se han diseñado ensayos clínicos encaminados a proporcionar más información sobre ellos, y los datos publicados al respecto se limitan a series cortas y casos clínicos.