Se ha estimado una mayor incidencia de infecciones severas en pacientes con artritis reumatoide, principalmente de tipo respiratorio, que son hasta 2veces más frecuentes que en la población general, lo que muchas veces deriva en un aumento de la mortalidad debido a trastornos inmunes causados por la propia enfermedad como por el tratamiento inmunosupresor. En la actualidad existen vacunas disponibles para prevenir algunas de estas infecciones, y constituyen una ventana de oportunidad para la profilaxis y una opción para prevenir complicaciones que se derivan de las infecciones.
En este contexto, las vacunas del neumococo y la influenza han sido las más evaluadas en los pacientes con enfermedades reumáticas y se recomienda su administración en las guías de vacunación. Los datos acumulados sobre la seguridad y la eficacia de estas vacunas garantizan su uso en los pacientes con enfermedades crónicas autoinmunes o inflamatorias. Es necesaria la aplicación de las recomendaciones sobre inmunización para esta población en nuestra práctica clínica diaria, y la evidencia disponible es suficiente para incentivar la vacunación general contra influenza, neumococo y hepatitisB, así como para aplicar esquemas de cribado de tuberculosis, con el uso de quimioprofilaxis, si se precisa, en pacientes con artritis reumatoide en tratamiento inmunosupresor.
The incidence of severe infections has been estimated to be higher in patients with rheumatoid arthritis. In particular, respiratory infections are up to twice as frequent in these patients as in the general population, which often increases mortality due to immune disorders related to the disease itself and to the immunosuppressive treatment. Nowadays, some of these infections can be prevented by vaccines, which provide a window of opportunity for prophylaxis and for the prevention of complications arising from infection.
The most widely used vaccines in rheumatic diseases are the pneumococcal and influenza vaccines, which are recommended in vaccination guidelines. The data accumulated on the safety and efficacy of these vaccines support their use in patients with chronic autoimmune or inflammatory diseases. Immunization recommendations for this population should be applied in our daily clinical practice, as the evidence is sufficiently strong to encourage general vaccination against influenza, pneumococcus and hepatitisB in patients with rheumatic diseases. Screening strategies for tuberculosis, with the use of chemoprophylaxis if required, should also be applied in rheumatoid arthritis patients receiving immunosuppressive therapy.
Los pacientes con enfermedades reumáticas autoinmunes o inflamatorias como la artritis reumatoide (AR) tienen un elevado riesgo de padecer infecciones1, principalmente de tipo respiratorio, lo que deriva en un aumento de la mortalidad, bastante superior a la de la población general2. Existen varios factores que contribuyen a este riesgo incrementado, y entre estos se encuentran los trastornos de la función del sistema inmune por la propia enfermedad, el tratamiento inmunosupresor y las comorbilidades asociadas3. Los fármacos inmunosupresores pueden interferir con la respuesta inmune a la vacunación de diferentes maneras: reduciendo la migración y maduración de las células dendríticas, inhibiendo la activación de la secreción de interferón gamma por las células T; ocasionando una disrupción de la arquitectura linfoide normal de los centros germinales y una menor supervivencia de las células de memoria, etc.
Dado que las infecciones causadas por el neumococo y la influenza se pueden prevenir con vacunas, está justificado introducir conductas preventivas como la inmunización en este grupo de pacientes. A pesar del conocimiento de la importancia de la inmunización en pacientes con enfermedades autoinmunes, esta es una práctica poco extendida en el ámbito clínico habitual, con bajas tasas de vacunación, que se sitúan en torno al 35-40%. Esto probablemente se deba a la preocupación existente en cuanto a la inmunogenicidad y a la seguridad de las vacunas, ya que algunas publicaciones mostraban que la vacunación podía causar un empeoramiento clínico o incluso desencadenar enfermedades autoinmunes o reumáticas, sin que finalmente se haya podido establecer una relación causal en estudios prospectivos controlados.
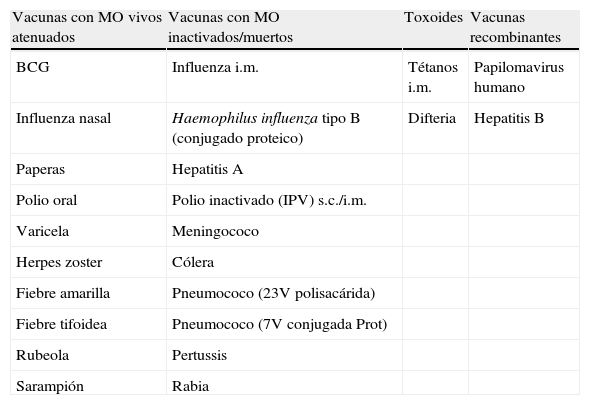
Las vacunas pueden estar constituidas por microorganismos (MO) inactivados, toxoides, MO vivos atenuados o ser de tipo recombinante. En la tabla 1 se presentan las principales vacunas disponibles actualmente.
Clasificación de las vacunas según el tipo de antígeno empleado
| Vacunas con MO vivos atenuados | Vacunas con MO inactivados/muertos | Toxoides | Vacunas recombinantes |
| BCG | Influenza i.m. | Tétanos i.m. | Papilomavirus humano |
| Influenza nasal | Haemophilus influenza tipo B (conjugado proteico) | Difteria | Hepatitis B |
| Paperas | Hepatitis A | ||
| Polio oral | Polio inactivado (IPV) s.c./i.m. | ||
| Varicela | Meningococo | ||
| Herpes zoster | Cólera | ||
| Fiebre amarilla | Pneumococo (23V polisacárida) | ||
| Fiebre tifoidea | Pneumococo (7V conjugada Prot) | ||
| Rubeola | Pertussis | ||
| Sarampión | Rabia |
El objetivo de la vacunación es reducir la morbilidad y la mortalidad provocadas directa o indirectamente por la infección contra la que está dirigida. En general los estudios muestran que cuando una vacuna es correctamente indicada, constituye una herramienta de protección de los pacientes inmunodeprimidos. Además no genera exacerbaciones clínicas de la enfermedad autoinmune y puede inducir una adecuada respuesta inmunológica, aunque puede ser subóptima en comparación con controles sanos. Los estudios que evalúan la eficacia de la inmunización idealmente deberían usar criterios clínicos de valoración, como serían reducción del número de infecciones por el agente, del número de admisiones hospitalarias o muertes relacionadas con la infección. Sin embargo, son muy pocos los estudios que utilizan endpoints clínicos, utilizando en su lugar otros parámetros, como las tasas de seroprotección o de serorrespuesta, para evaluar la eficacia.
En la práctica clínica es recomendable realizar una evaluación inicial del estado de inmunización del paciente, con el objetivo de valorar las vacunaciones administradas en la infancia y las que se recomiendan para la población general.
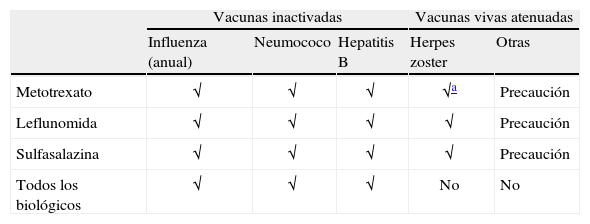
En las recomendaciones EULAR se aconseja administrar la vacuna de la influenza con un grado de recomendaciónA y las de neumococo y de hepatitisB con un grado de recomendaciónB; el resto de vacunas se indican siguiendo los mismos criterios que para la población sana. En la tabla 2 se resumen las recomendaciones ACR 2012, donde se señala que todas las vacunas con MO muertos (neumococo, influenza intramuscular), recombinantes como la del virus del papiloma humano (VPH) y el virus de la hepatitis B (VHB), y con MO vivos atenuados (herpes zoster) pueden administrarse antes de comenzar un fármaco modificador de la enfermedad (FAME) o un agente biológico.
Resumen de las recomendaciones de vacunación en pacientes con artritis reumatoide
| Vacunas inactivadas | Vacunas vivas atenuadas | ||||
| Influenza (anual) | Neumococo | Hepatitis B | Herpes zoster | Otras | |
| Metotrexato | √ | √ | √ | √a | Precaución |
| Leflunomida | √ | √ | √ | √ | Precaución |
| Sulfasalazina | √ | √ | √ | √ | Precaución |
| Todos los biológicos | √ | √ | √ | No | No |
√ Recomendadas idealmente antes de iniciar el tratamiento.
En general, las vacunas inactivadas pueden ser administradas en pacientes que ya están en tratamiento con fármacos modificadores de la enfermedad convencionales, como metotrexato (MTX), leflunomida o biológicos como los antagonistas del factor de necrosis tumoral (anti-TNF), aunque se señala que idealmente deberían administrarse antes de iniciar el tratamiento con depletores de célulasB (rituximab), porque se ha observado que provocan una disminución de la respuesta inmune a las vacunas.
Las vacunas con MO vivos pueden ocasionar infecciones severas o diseminadas en pacientes inmunodeprimidos (debido a replicación activa en el huésped), aunque no se conoce qué nivel de inmunosupresión hace más vulnerables a los pacientes a desarrollar infecciones tras la vacunación con MO atenuados.
EULAR recomienda de forma general evitar el uso de este tipo de vacunas en pacientes inmunosuprimidos. Las vacunas para las paperas, la rubeola y el sarampión, la varicela y el herpes zoster pueden ser excepciones a esta regla y pueden ser consideradas en pacientes medianamente inmunosuprimidos evaluando el caso individualmente. Las vacunas vivas en general deben evitarse en pacientes con AR durante el tratamiento con FAME biológicos, basado en el potencial mayor riesgo de infección, combinada con la escasez de estudios de investigación. Por otro lado, se podrían aplicar vacunas con MO vivos entre 2 y 4semanas antes de empezar con el fármaco biológico.
La decisión de administrar una vacuna viva, en particular en estos pacientes, debe valorarse caso por caso, equilibrando el riesgo potencial de desarrollar la infección por el agente para el que se busca protección con la vacuna, con el riesgo de infección por la propia vacuna.
No existen estudios que comparen la eficacia y los efectos adversos de la vacunación durante la enfermedad estable e inestable. La mayoría de reportes provienen de pacientes con datos de baja actividad de AR; sin embargo, los estudios que incluyeron pacientes con actividad moderada o severa no mostraron diferencias en cuanto a eficacia, frecuencia de efectos adversos o empeoramiento clínico, comparados con los controles. No obstante, según la opinión de expertos de EULAR es preferible vacunar a los pacientes durante la enfermedad estable.
A continuación describimos las características individuales de las principales vacunas recomendadas.
InfluenzaEs una vacuna constituida por componentes de hemaglutinina de las 3cepas virales más comunes: influenzaH3N2, influenzaH1N1 e influenzaB, y se actualiza anualmente. La infección por influenza es usualmente un proceso autolimitado y cursa de forma asintomática en el 30 al 50% de los casos, pero pueden aparecer complicaciones en particular en niños pequeños, ancianos y huéspedes inmunocomprometidos. Como complicaciones comunes se encuentran las exacerbaciones de patologías respiratorias o cardíacas de base. La última pandemia puso en evidencia la vulnerabilidad de este grupo de pacientes.
Se ha demostrado que la administración de la vacuna previene hospitalizaciones y reduce la mortalidad asociada a la infección, mientras que los efectos adversos que se producen tras la vacunación incluyen fiebre, tos, rinorrea, y son comparables a los que se presentan en controles sanos. La inmunización contra la influenza es la que ha sido más estudiada en pacientes con AR. Desde el año 1979 se han publicado gran número de estudios con el objetivo de evaluar la eficacia de la vacunación.
Es de importancia señalar que en la mayoría de estos estudios el término eficacia se ha sustituido por el de respuesta inmune, siendo muy pocos los estudios que evalúan la eficacia en términos clínicos, es decir, en número de infecciones u hospitalizaciones prevenidas. La eficacia evaluada según la respuesta inmunitaria se describe según las tasas de seroconversión o serorrespuesta (respuesta al antígeno formando anticuerpos específicos) o en tasas de seroprotección (producción de anticuerpos por encima de un límite teórico sobre el cual se considera que el paciente está protegido).
Uno de los parámetros subrogados más usados en los estudios es la respuesta humoral determinada por inhibición de hemaglutinación (HI), que ha mostrado que se correlaciona con protección contra la influenza. Una HI mayor o igual a 40U es protectora (seroprotección) en adultos sanos y se alcanza en el 90% de individuos tras la vacunación. No se ha demostrado qué título de HI debe ser considerado como protector en pacientes mayores o inmunocomprometidos.
Los estudios de Chalmers et al.4, Fomin et al.5 y Del Porto et al.6, que evaluaron respectivamente a 126, 82 y 48 pacientes con AR o LES en tratamiento con diferentes regímenes terapéuticos con inmunosupresores, no identificaron ninguna influencia del tratamiento con FAME, corticoides o de la actividad de la enfermedad sobre la respuesta inmune tras la vacunación de la influenza, en comparación con individuos sanos. Kapetanovic et al.7 evaluaron la vacunación contra el virus de la influenza en pacientes con diagnóstico de AR que recibían anti-TNF, etanercept (ETN) o infliximab (INF) en monoterapia, anti-TNF asociado a MTX y MTX en monoterapia. Se obtuvo una respuesta serológica en todos los grupos, aunque con mayores tasas de protección en el grupo de MTX en monoterapia en comparación con los pacientes tratados con anti-TNF.
Por otro lado, Kaine et al.8 condujeron un estudio aleatorizado, doble ciego, controlado con placebo para comparar la inmunogenicidad de las vacunas de la influenza y el neumococo en 99 pacientes con AR en tratamiento con adalimumab (ADA) y en 109 pacientes del grupo placebo. Una respuesta inmune satisfactoria frente a la vacuna de influenza se alcanzó en ambos grupos, aunque algo menor en el grupo de ADA, sin que se alcanzaran diferencias estadísticamente significativas. Estos datos sugieren que los anti-TNF tienen un bajo impacto sobre la respuesta inmune a esta vacuna.
En cuanto al estudio observacional que evaluó la eficacia con endpoints clínicos, objetivó una reducción en cuanto a neumonía, bronquitis aguda e infecciones virales en los pacientes con AR que recibieron la vacuna9. Dos estudios observacionales adicionales también encontraron una reducción en las admisiones hospitalarias y en la mortalidad por influenza y neumonía en pacientes mayores con enfermedades reumáticas que fueron vacunados.
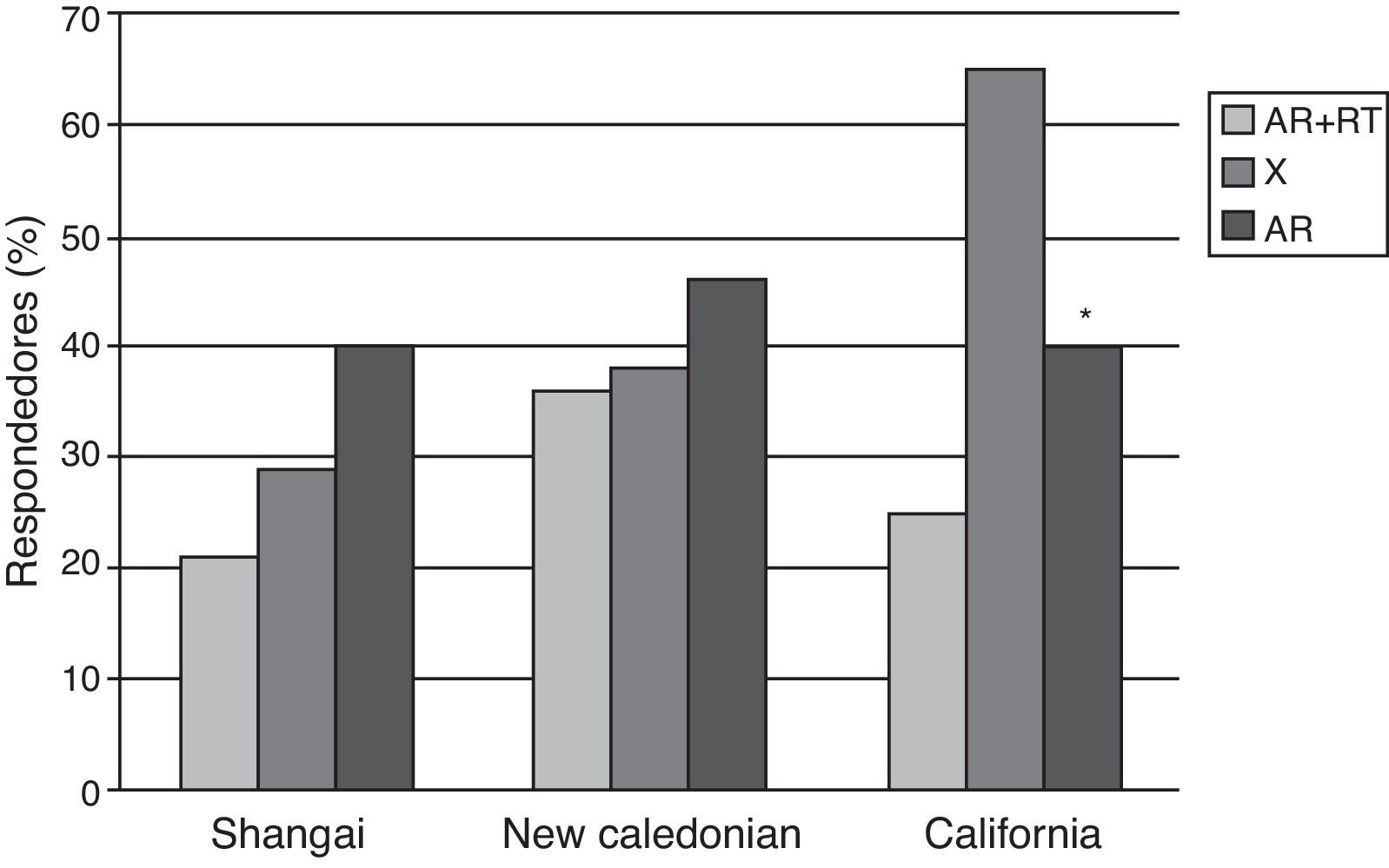
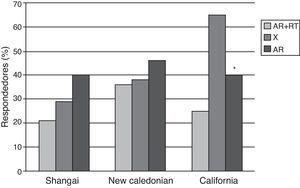
En el estudio de Gelinck et al.10, con pacientes tratados con rituximab (RTX) se observó un efecto deletéreo del fármaco sobre la respuesta inmune, con menores títulos de anticuerpos posvacunacionales en pacientes que habían sido vacunados de 8 a 12semanas después de la infusión; no se encontraron datos de aumento de la actividad de la enfermedad tras la vacunación. El efecto del RTX sobre la seguridad y la inmunogenicidad de la vacuna de la influenza también fue evaluado por Oren et al.11 en 14pacientes con AR comparados con 29pacientes en tratamiento con FAME, sin incluir anti-TNF ni otros fármacos biológicos. No se encontraron datos de empeoramiento en los parámetros clínicos ni de laboratorio de actividad de enfermedad en ambos grupos de pacientes en las 4 semanas de seguimiento tras la vacunación. Con respecto a la respuesta humoral, la proporción de respondedores fue significativamente menor en el grupo del RTX comparados con los controles (fig. 1).
En la ficha técnica se recomienda vacunar un mes antes o 6meses después de administrar el fármaco, ya que la respuesta parece recuperarse en los 6 a 10meses posteriores.
En un estudio publicado en 2012 por un grupo japonés, se encontró que la vacunación fue efectiva en todos los pacientes tratados con tocilizumab con o sin MTX y no se evidenció mayor frecuencia de efectos adversos ni brotes de actividad tras la vacunación12. Otro estudio reciente13 valoró a pacientes con AR en tratamiento con abatacept, en relación a la vacunación para influenza H1N1 durante la pandemia 2009, encontrando que el grupo de pacientes tratados con este fármaco presentaban tasas de seroprotección bastante disminuidas en comparación con los que llevaban MTX en monoterapia y con los controles, lo que sugiere la influencia de la modulación de la co-estimulación de células T en la respuesta humoral a esta vacuna.
NeumococoCon respecto al neumococo, sabemos que este germen es la causa bacteriana más común de neumonía adquirida en la comunidad en España. Existen 2tipos de vacunas: una proteica conjugada de 7 y 13valencias, que es más inmunogénica y se usa en menores de 5años; y otra polisacárida, que contiene antígenos capsulares de las 23cepas de neumococo más comunes y que son causantes del 88% de todas las infecciones neumocócicas. En general la vacuna es segura y bien ponderada. La protección suele ser de por vida, excepto en situaciones especiales, en que se recomienda administrar una dosis de recuerdo tras 5años. En este grupo, según las guías CDC, se incluyen pacientes con enfermedad renal crónica, esplenectomizados, trasplantados y, en general, pacientes que tengan mayor riesgo de infecciones neumocócicas graves (inmunosuprimidos). También se recomienda la revacunación en individuos mayores de 65años que recibieron la primera dosis antes de esta edad por alguna indicación especial14.
La eficacia de la vacuna del neumococo es difícil de determinar, ya que no existe un criterio de respuesta aceptado; además, hay disponibles vacunas diferentes (polisacáridas y conjugadas) que contienen antígenos con distinto número de serotipos neumocócicos.
Pocos estudios han investigado la seguridad e inmunogenicidad de la vacuna antineumocócica en pacientes con AR, y se han publicado tanto respuestas disminuidas como similares a los controles.
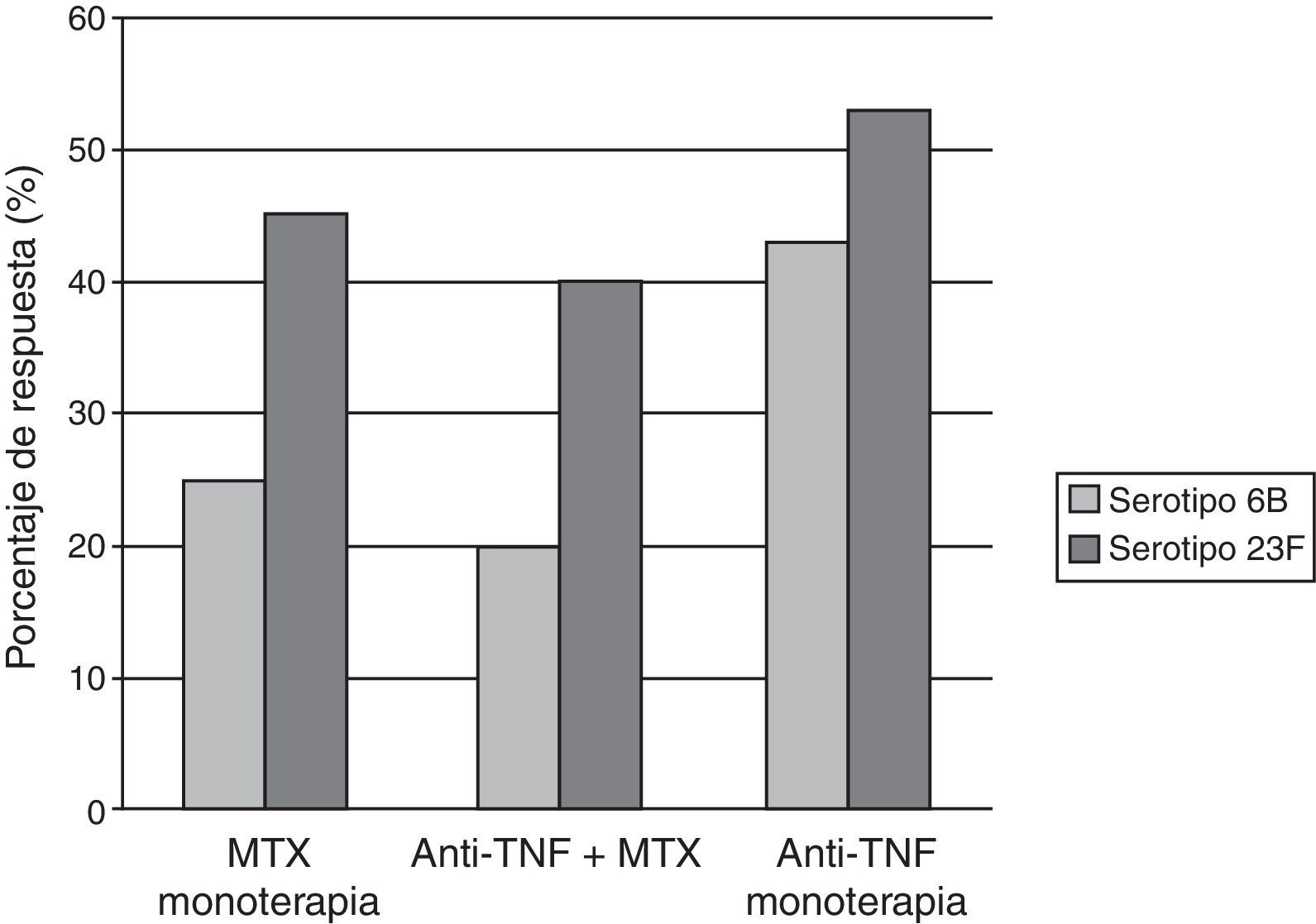
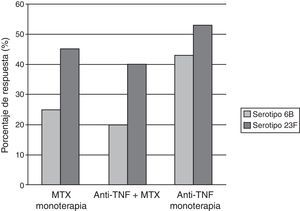
Elkayam et al.15,16 evaluaron la inmunogenicidad de la vacuna polisacárida en una pequeña población de pacientes con enfermedades reumáticas (11pacientes con AR y 5 con espondilitis anquilosante) en tratamiento con anti-TNF (12 con INF, 4 con ETN), y como grupo control, 17pacientes con AR tratados con FAME. Un mes después de la vacunación ambos grupos tenían un incremento significativo en los títulos de anticuerpos para los 7 serotipos evaluados, aunque el grupo con anti-TNF mostraba un menor aumento de los títulos. Kapetanovic et al.17 vacunaron a 149pacientes con AR y a 47controles sanos con la vacuna polisacárida de neumococo. Un total de 112pacientes estaban en tratamiento con fármacos anti-TNF (64 con INF y 48 con ETN), se dividieron en 3grupos (anti-TNF sin MTX, anti-TNF asociado a MTX y MTX en monoterapia). Los títulos de anticuerpos posvacunacionales contra los antígenos se elevaron significativamente en todos los grupos. Los pacientes tratados con anti-TNF y los controles sanos mostraron similares respuestas a la inmunización; por el contrario, la respuesta inmune se mostró reducida en el grupo tratado con MTX. Esta respuesta disminuida relacionada con MTX nuevamente fue descrita por el mismo autor en un estudio que incluyó 253 pacientes con AR tras la inmunización con la vacuna heptavalente de neumococo7 (fig. 2).
Visvanathan et al.18 reportaron los efectos de la administración de la vacuna neumocócica en 70pacientes con AR temprana; 20pacientes fueron tratados con INF 3mg/kg asociado a MTX, 36pacientes con INF 6mg/kg más MTX, y 14pacientes con placebo más MTX. Los pacientes fueron vacunados a las 34semanas del inicio del tratamiento; se midieron los títulos de anticuerpos específicos para 12serotipos 4semanas después. Un incremento mayor de 2veces en los títulos de anticuerpos en al menos 6 de los 12serotipos evaluados se consideró como una respuesta serológica. El porcentaje de pacientes con serorrespuesta fue similar en los 3grupos, aunque todos los grupos mostraron respuestas a la vacuna menores a las esperables en población sana.
En pacientes con AR tratados con RTX se ha objetivado una clara reducción en la respuesta humoral en los vacunados 28semanas tras la infusión para todos los serotipos del neumococo en comparación con el grupo que estaba tratado con MTX en monoterapia. En cuanto a seguridad, existen pocos estudios que la evalúan, 3 de ellos aleatorizados y un ensayo clínico controlado en los que no se encontró aumento de la actividad de la enfermedad tras la vacunación. Similares resultados se encontraron en estudios pre y posvacunacionales para la vacuna antineumocócica19.
En diversos ensayos se ha descrito que la respuesta a las vacunas polisacáridas implica la activación de célulasB específicas que responden independientemente de las célulasT; es por esto que en pacientes tratados con RTX es esperable que la respuesta tanto a antígenos T independientes (polisacárido del neumococo) como a neoantígenos esté disminuida, al ser ambos tipos de inmunidad relacionados con la rama humoral del sistema inmune (B dependientes)20.
HepatitisLa vacunación contra la hepatitis B es eficaz en la mayoría de los pacientes con enfermedades autoinmunes y está recomendada por varias guías de manejo. Es especialmente relevante determinar la serología de hepatitisB y C en el momento del diagnóstico del paciente con AR, antes de iniciar el tratamiento inmunosupresor, ya que conocemos que un efecto adverso de fármacos como el MTX y la leflunomida es la hepatotoxicidad; además, con el uso de fármacos como corticoides a altas dosis o anti-TNF podría producirse una reactivación fulminante de una hepatitisB crónica, por lo que estos fármacos estarían contraindicados en estos pacientes.
Las vacunas contra el VHB son de tipo recombinante y contienen partículas de antígeno de superficie (HBAgs) purificado. El esquema de vacunación para adolescentes y adultos consiste en 3dosis, administradas a los 0, 1 y 6meses, y se consideran como títulos protectores de anticuerpos frente al HBAgs (AcHBs) los iguales o superiores a 10mUI/ml, niveles que normalmente se encuentran a partir de las 2semanas de la segunda dosis. En los pacientes inmunodeprimidos se aconseja realizar la serología posvacunal (cuantificación de AcHBs) entre 1 y 3meses después de recibir la última dosis, y considerar la administración de una segunda pauta completa de vacunación si los niveles estuvieran por debajo de 10mUI/ml.
En la AR se ha evaluado la eficacia de la vacunación contra la hepatitis B por el grupo de Elkayam et al21. En este estudio de cohorte se incluyeron 44 pacientes con AR; 22 de ellos recibieron 3 dosis de la vacuna recombinante VHB, y los otros 22 se estudiaron como controles. Durante el período de observación de 7meses la vacuna no produjo efectos adversos importantes y no estuvo asociada con empeoramiento de ningún parámetro clínico o de laboratorio de actividad de la enfermedad. La seroconversión (títulos de anticuerpos >10UI/l tras la vacunación) se alcanzó en 15/22 (68%) pacientes con AR, y fue menor a la esperada en la población de adultos sanos (85%). El mayor limitante de esta investigación fue la ausencia de controles normales sanos contrastados por sexo y edad.
El grupo de expertos ACR recomienda no utilizar agentes biológicos en pacientes con AR y hepatitisB crónica no tratada y en los pacientes con AR y hepatitisB crónica con Child-Pugh claseB o superior.
Con respecto a la infección por el virus de la hepatitis C, no existen datos concluyentes en relación al tratamiento anti-TNF como causa de empeoramiento de la función hepática o aumento de la carga viral; tampoco hay información suficiente para el caso del abatacept o del rituximab. En las recomendaciones ACR se señala que el etanercept podría ser utilizado en pacientes con AR y hepatitisC que requieran tratamiento22.
Los pacientes con infección aguda o crónica activa por el VHB no deben recibir tratamiento inmunosupresor y requieren ser valorados por un hepatólogo para decidir el inicio del tratamiento antiviral, estando disponibles distintos fármacos como el interferón alfa (estándar y pegilado), análogos nucleótidos (adefovir, tenofovir) o nucleósidos (lamivudina, entecavir).
No existen recomendaciones específicas para el caso de infección crónica por el VHB inactiva o portadores ocultos (anticuerpo HBc+). En este grupo de pacientes es importante realizar pruebas de función hepática y determinar la carga viral, y en algunos casos los biológicos se usan por elevada actividad de AR. Es aconsejable monitorizar cada 2 o 3meses: serología hepática, carga de ADN viral y transaminasas para detectar tempranamente una reactivación de infección oculta y administrar el tratamiento antiviral apropiado si es necesario23.
En caso de que se requiera administrar tratamiento anti-TNF en un paciente con hepatitisB crónica inactiva, este podría iniciarse al menos un mes después del inicio del tratamiento con antivirales, los cuales deberían mantenerse mientras los pacientes reciban la terapia anti-TNF.
Existen reportes de casos aislados de reactivación del VHB en pacientes que reciben corticoides a dosis bajas o FAME como MTX. Sin embargo, si consideramos el amplio número de pacientes que han recibido estos tratamientos durante muchos años, se puede asumir que el riesgo de reactivación es bastante bajo. También se han descrito casos de reactivación de infección por VHB durante el tratamiento con ETN e INF, además de un caso en un paciente con AR tratado con RTX24. Con respecto a otros biológicos, los datos son limitados, y se ha descrito un caso de reactivación durante el tratamiento con abatacept; en relación con el tocilizumab, se ha usado en combinación con la terapia antiviral sin que se objetivaran datos de reactivación según algunos reportes de casos.
Herpes zosterLa propia enfermedad es un factor de riesgo para contraer esta infección. Según se observó en el análisis de 2grandes bases de datos, se encontró un hazard ratio de 1,9, en comparación con controles sanos. Además existen factores de riesgo adicionales, como el uso de corticoides, anti-TNF u otros inmunosupresores, como ciclofosfamida, azatioprina y leflunomida, mientras que el uso del MTX no parece incrementar el riesgo de esta infección.
El uso de vacunas vivas atenuadas implica una preocupación importante en los pacientes inmunocomprometidos. Sin embargo, los riesgos asociados con estas vacunas presumiblemente dependen del grado de inmunodepresión. Como ejemplo, la vacuna de la varicela-zoster ha demostrado ser inmunogénica, bien tolerada y efectiva en la prevención de episodios de herpes zoster en niños con infección por el VIH y después de un trasplante renal o de médula ósea25.
Esta vacuna ha demostrado reducir la incidencia de la infección y de la neuralgia postherpética en estudios con pacientes mayores de 60años26.
Teniendo en cuenta esto, el Comité Asesor sobre Prácticas de Inmunización (ACIP) aconseja administrar la vacuna del herpes zoster en pacientes con AR mayores de 60años que no estén inmunodeprimidos severamente, considerándose así a los pacientes en tratamiento con dosis de prednisona <20mg al día, MTX≤25mg a la semana y azatioprina ≤3mg/kg/día. Este planteamiento se ha incluido en las recomendaciones de la CDC 2011 y las de ACR 2012. También se señala que la vacuna puede administrarse a pacientes con uso de corticoides a corto plazo (<14días) y durante el tratamiento con esteroides tópicos, inhalados o inyectados (infiltraciones intraarticulares o de partes blandas)14. Hay que destacar que esta vacuna está contraindicada en pacientes que estén en tratamiento con fármacos biológicos27.
Toxoide tetánicoLa vacunación con el toxoide tetánico mostró ser eficaz en 2estudios prospectivos controlados en pacientes con AR28. El uso de esteroides o FAME no disminuyó la eficacia. Bingham et al.19 encontraron una respuesta comparable a la población general sana en 69 pacientes con AR, tras ser inmunizados con toxoide tetánico en la semana 24 después de la administración de RTX, sin que se encontraran datos de aumento del grado de actividad de la enfermedad. En las recomendaciones EULAR también se señala que los pacientes que no hayan sido vacunados con el toxoide y que hayan recibido la infusión de RTX en las 24semanas previas, deben ser inmunizados de forma pasiva con la inmunoglobulina antitetánica, en caso de que presentaran heridas contaminadas importantes22.
Papilomavirus humanoNo existen estudios sobre la prevalencia de esta infección en pacientes con AR, aunque se ha observado una mayor frecuencia en pacientes con LES en relación a controles sanos (24,6 vs. 10,4%), siendo el serotipo VPH-16 (oncogénico) el más frecuentemente encontrado en esta población. Los factores de riesgo para contraer esta infección serían los mismos que para la población general, entre los que se encuentran el tener relaciones sexuales antes de los 18años o las conductas sexuales de riesgo. Una revisión sistemática sugiere la seguridad de la vacuna contra el papilomavirus humano en pacientes con enfermedades reumáticas autoinmunes, aunque los datos sobre los episodios adversos se basan en muestras pequeñas20. En las recomendaciones ACR se propone administrar la vacuna a mujeres entre 14 y 26años de edad, igual que para la población general27.
Inmunización de viajeros en tratamiento con biológicosNo se conoce si los pacientes con enfermedades autoinmunes tienen mayor riesgo de contraer infecciones relacionadas con viajes, pero para mantenerlos protegidos, estos pacientes deben recibir las vacunaciones que se recomiendan para la población general.
La vacunación con vacunas inactivadas, indicada para los viajes a zonas endémicas de ciertas infecciones, es segura en pacientes en tratamiento con fármacos biológicos como los anti-TNF. Tras la vacunación primaria se recomienda determinar si se han alcanzado niveles protectores de anticuerpos a las 4semanas. No existen datos publicados sobre la respuesta inmune tras la inmunización con las vacunas polisacáridas capsulares de meningococo y Salmonella typhi durante el tratamiento con anti-TNF; tampoco hay información en relación al toxoide tetánico, la difteria o la vacuna de hepatitisA o la polio inactivada29.
La vacunación primaria contra la fiebre amarilla y otras vacunas vivas atenuadas (BCG, polio oral, fiebre tifoidea oral) deben evitarse en todo momento durante el tratamiento con biológicos. Si se requiere necesariamente vacunar contra la fiebre amarilla por un viaje futuro, idealmente esta vacuna debe administrarse de 3 a 4semanas antes de iniciar un tratamiento inmunosupresor. En caso de que se tenga que suspender el tratamiento con un biológico para administrar de forma segura esta vacuna, es importante tener en cuenta que la función del sistema inmune puede tardar varios meses antes de normalizarse, dependiendo de la dosis, de la duración y del tipo de fármaco utilizado (tabla 3). Los niveles protectores de anticuerpos neutralizantes contra la vacuna de la fiebre amarilla pueden persistir por más de 20años; por tanto, la revacunación podría evitarse determinando si el paciente todavía presenta niveles protectores de anticuerpos de una vacunación previa.
TuberculosisAntes de que se aplicaran las recomendaciones para el cribado de la tuberculosis (TBC) latente en pacientes con AR tratados con fármacos anti-TNF, España era el país europeo con mayor incidencia de esta infección, con alrededor de 18,9 casos por cada 1.000 pacientes-año. Este grupo de pacientes tiene un riesgo elevado de contraer TBC comparados con la población general, con un riesgo relativo (RR) de 2 a 10,9 en los tratados con FAME, y con valores de RR de 4 a 90,1 en pacientes en tratamiento con anti-TNF20.
En España la reducción del riesgo de la reactivación de la TBC se ha asociado con el cumplimiento de las recomendaciones para el cribado de infección latente, que incluye el tratamiento profiláctico30.
Es imperativo excluir en todo paciente que vaya a iniciar la terapia biológica la existencia de TBC activa o contacto reciente con enfermos con TBC, así como investigar la posibilidad de infección tuberculosa latente. Para ello se recomienda recoger en la historia clínica los antecedentes de TBC y de contacto con pacientes con TBC; realizar una radiografía de tórax para descartar TBC activa o signos radiográficos concordantes con una antigua infección tuberculosa, así como una prueba cutánea de la tuberculosis (PPD) según el método de Mantoux, que debe ser repetida (re-test) a las 1-2semanas si es <5mm. Otra prueba que está disponible en algunos centros es la del quantiferón, que consiste en un test inmunológico in vitro que mide la producción de interferón gamma que sigue a la exposición a antígenos de micobacterias. El uso de este test puede ser una opción en pacientes con enfermedades inflamatorias autoinmunes que hayan sido vacunados con BCG, donde se encuentran altas tasas de falsos positivos para el test de Mantoux, mientras que el test de quantiferón presenta una mayor especificidad y un bajo porcentaje de resultados indeterminados.
Las Guías británicas y las Normas canadienses para TBC2008, basadas en estudios observacionales, sugieren que dosis ≥15mg/día de prednisona pueden suprimir una respuesta al test de la tuberculina31, y algunos estudios han mostrado que hasta el 8% de los pacientes tratados con anti-TNF positivizan el Mantoux, por lo que se recomendaría una repetición periódica. Así, el panel de expertos de las recomendaciones ACR2012 recomienda un cribado anual mediante la realización del test de Mantoux en pacientes que tengan probable exposición a TBC (vivan, viajen o trabajen) mientras estén con tratamiento biológico.
Por tanto, es de importancia elaborar una adecuada historia clínica, valorando factores de riesgo para TBC, hacer un buen examen físico, el test de Mantoux con respuesta booster en 1 o 2semanas y una radiografía de tórax para descartar TBC latente. En caso de: a)contacto reciente con paciente con TBC; b)antecedentes de TBC tratada parcialmente; c)presencia de lesiones residuales en la radiografía de tórax, o d)Mantoux o booster con induración mayor o igual a 5mm (TBC latente), está indicado el tratamiento quimioprofiláctico con isoniazida 300mg/día asociada a vitamina B6 durante 9meses; en caso de intolerancia o efectos adversos, como segunda línea se encuentra la rifampicina, con una dosis máxima de 600mg/día durante 4meses32. Se considera que el tratamiento con fármacos biológicos puede iniciarse después de un mes de tratamiento profiláctico de la TBC latente o después de completar la fase inicial del tratamiento de la TBC activa.
ConclusionesDebemos tener presente que los pacientes con AR tienen el doble de riesgo de padecer infecciones, por lo que es responsabilidad nuestra empezar a adoptar medidas preventivas incentivando la vacunación para que estén más protegidos.
La evidencia actualmente disponible avala el uso de las vacunas con MO muertos o inactivados en los pacientes con AR por ser seguras y eficaces, aunque debe considerarse que un porcentaje de los pacientes que estén en tratamiento inmunosupresor no responderán de forma satisfactoria a la vacunación, sin que esto implique un deterioro clínico de los afectados.
Las vacunas recomendadas para este grupo de pacientes son la de la influenza intramuscular con periodicidad anual, la de la hepatitis B y la del neumococo.
Las vacunas con virus vivos atenuados están contraindicadas en los pacientes inmunosuprimidos, ya que pueden actuar como patógenos oportunistas y causar enfermedades asociadas a la vacuna.
Hay que recordar que el tratamiento inmunosupresor puede disminuir la eficacia de la vacunación, por lo que sería preferible administrar las vacunas previo a su inicio. Si los pacientes ya están siendo tratados con inmunosupresores, igualmente deben ser vacunados, ya que aunque la respuesta sea subóptima, esta sería suficiente para asegurar una inmunoprotección. Como ya hemos visto, existen pocos estudios de coste-eficacia utilizando endpoints clínicos, y en su lugar se utilizan parámetros inmunológicos.
Debemos continuar con las medidas para el cribado y la evaluación de factores de riesgo de TBC para que continúe la disminución de las tasas de reactivación de la infección latente, administrando tratamiento quimioprofiláctico en pacientes que así lo requieran.
Conflicto de interesesLa autora declara no tener ningún conflicto de intereses.
Doy las gracias de forma especial a toda la sección de Reumatología del Hospital General de Alicante por su gran calidad profesional y humana en la atención de nuestros pacientes, contribuyendo de forma muy positiva en mi formación, además de por el apoyo incondicional que brindan diariamente tanto en el ámbito laboral como en el personal; y de forma particular a la Dra. Vega Jovaní por su asesoramiento.