La osteoporosis es una de las manifestaciones sistémicas asociadas a la enfermedad pulmonar obstructiva crónica (EPOC). Entre los factores de riesgo de pérdida de masa ósea que se han descrito en estos pacientes destacan el tabaco, la debilidad muscular, el bajo índice de masa corporal, el déficit de vitamina D, el tratamiento con corticoides, el hipogonadismo y la inflamación sistémica. La presentación clínica más relevante en estos enfermos es la fractura vertebral por su importante morbimortalidad. El tratamiento de la osteoporosis incluye el calcio y la vitamina D, los bifosfonatos, los fármacos osteoformadores y la rehabilitación pulmonar. Son necesarios estudios prospectivos para conocer la prevalencia de la osteoporosis en el paciente con EPOC y definir un perfil de alto riesgo de fractura osteoporótica. El desarrollo de nuevos tratamientos encaminados al control de la inflamación sistémica puede contribuir, en el futuro, a estrategias terapéuticas específicas de la osteoporosis en el enfermo con EPOC.
Osteoporosis is one of the systemic effects associated with chronic obstructive pulmonary disease (COPD). Risk factors for bone loss include smoking, skeletal muscle weakness, low bone mass index (BMI), vitamin D deficiency, glucocorticoid use, hypogonadism and systemic inflammation. The most important clinical feature is vertebral fracture, due to its significant morbidity and mortality. The treatment of osteoporosis includes calcium and vitamin D, bisphosphonates, anabolic agents and pulmonary rehabilitation. Prospective studies are required to determine the prevalence of osteoporosis in COPD and to identify which patients are at high risk for osteoporotic fracture. The development of new drugs to control systemic inflammation may contribute to specific treatments for osteoporosis in COPD.
La enfermedad pulmonar obstructiva crónica (EPOC) se define como un proceso patológico caracterizado por una limitación del flujo aéreo que no es completamente reversible. La limitación del flujo aéreo suele ser progresiva y se acompaña de una respuesta inflamatoria pulmonar anormal a partículas o gases nocivos1. Actualmente constituye la cuarta causa de muerte global en los países industrializados y se preveé que en el año 2020 pase a ser la tercera causa mundial de mortalidad2. Además, es la única causa de mortalidad cuya prevalencia sigue aumentando3.
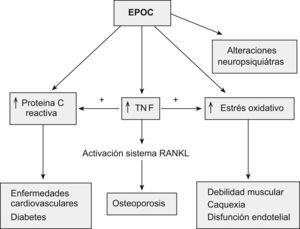
La EPOC en su progresión se asocia con frecuencia a otras enfermedades sistémicas o comorbilidades. Las manifestaciones sistémicas más relevantes incluyen debilidad muscular, enfermedad cardiovascular, diabetes, trastornos neurológicos y osteoporosis4. La relación que se establece entre la EPOC y las diferentes comorbilidades no está esclarecida con exactitud, aunque existe evidencia de que la inflamación sistémica participa en el desarrollo de estas enfermedades5 (fig. 1).
La prevalencia de osteoporosis en los pacientes con EPOC es mayor a la esperada en la población general para una misma edad y se ve incrementada en relación con la gravedad de la obstrucción aérea6. Dependiendo de las series, la prevalencia de osteoporosis oscila entre el 36–60%7–9.
En este artículo se revisan los diversos aspectos de la osteoporosis en los pacientes con EPOC: la etiopatogenia, las manifestaciones clínicas y su repercusión en la capacidad funcional y el tratamiento específico.
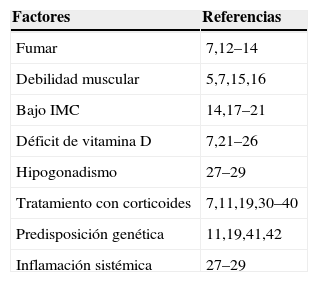
EtiopatogeniaLa patogénesis de la osteoporosis asociada a la EPOC tiene un origen multifactorial. Unos factores se atribuyen al estilo de vida de los pacientes como el fumar, otros a la progresión de la enfermedad, como la debilidad muscular y la inactividad, otros al tratamiento específico de la EPOC, como el uso de glucocorticoides, y a ellos se añadiría la predisposición genética y la inflamación sistémica10–11 (tabla 1).
Factores de riesgo de osteoporosis en pacientes con enfermedad pulmonar obstructiva crónica
| Factores | Referencias |
| Fumar | 7,12–14 |
| Debilidad muscular | 5,7,15,16 |
| Bajo IMC | 14,17–21 |
| Déficit de vitamina D | 7,21–26 |
| Hipogonadismo | 27–29 |
| Tratamiento con corticoides | 7,11,19,30–40 |
| Predisposición genética | 11,19,41,42 |
| Inflamación sistémica | 27–29 |
IMC: índice de masa corporal.
El fumar se considera un factor de riesgo independiente en la pérdida de masa ósea, tanto en hombres como en mujeres. Se conocen diversos efectos tóxicos del tabaco sobre el hueso, como el descenso de la absorción intestinal de calcio y la pérdida de peso; sin embargo, el mecanismo fisiopatológico que explica la disminución de masa ósea en los fumadores sigue siendo incierto.
La acción del tabaco sobre el metabolismo de los estrógenos en la mujer se basa en un descenso de los niveles séricos hormonales, una degradación exagerada de los estrógenos exógenos y un incremento de la hidroxilación del estradiol a metabolitos menos activos. En el hombre, el efecto sobre el metabolismo de los andrógenos parece ser más complejo y menos conocido7.
Un estudio prospectivo, realizado con voluntarios sanos fumadores, no fumadores y exfumadores, objetivó que los efectos más importantes sobre el hueso se traducían en las alteraciones del eje parathormona-vitamina D12. Otro estudio prospectivo relacionó el número de paquetes/año fumado con una masa ósea baja13 y sus autores especularon que un inicio precoz en el hábito tabáquico disminuiría el pico de masa ósea. En este mismo sentido Smith et al diseñaron un algoritmo para predecir una densidad mineral ósea (DMO) con un T score < −2 en el que se incluiría un hábito tabáquico superior a 80 paquetes/año14.
Debilidad muscularEntre las manifestaciones sistémicas de la EPOC destaca la disfunción musculoesquelética, especialmente en la musculatura de las piernas, que compromete la movilidad. Se han detectado diversas anormalidades en el tejido muscular de los pacientes con EPOC: el descenso de la actividad aeróbica, la pérdida de fibras tipo I, la presencia de células inflamatorias y un incremento de la apoptosis. Estas alteraciones conducen a una fatiga muscular precoz que limita la tolerancia al ejercicio15.
Estos cambios celulares comportan una disminución en la actividad física con consecuencias negativas para la masa ósea. La progresión de la obstrucción pulmonar conlleva a una atrofia muscular y ésta incrementa la inactividad. Ambos efectos producen un aumento en el riesgo de caídas y de fracturas por fragilidad5,7. Vrieze et al en un estudio reciente observaron que los pacientes con baja masa muscular tenían 4,9 veces más riesgo de baja DMO que los pacientes con masa muscular normal16.
Índice de masa corporalOtro aspecto del enfermo con EPOC, ligado a la disminución de la masa muscular, es la pérdida de peso y la pérdida de masa corporal. La causa de la caquexia se atribuye al descenso en la ingesta, al incremento en el trabajo respiratorio y al efecto de la inflamación sistémica crónica17. Estos efectos aparecen en estadios avanzados de la EPOC y comportan una disminución de la masa ósea18. Existe evidencia de que un índice de masa corporal (IMC) bajo es un factor predictor negativo e independiente de fractura por fragilidad en la población mayor de 65 años19. Diversos estudios en pacientes con EPOC también demuestran que el IMC es un factor de riesgo para la osteoporosis; en concreto, Incalzi et al observaron que un IMC <22kg/m2 tiene un riesgo 4,18 veces mayor de padecer osteoporosis20 y en el algoritmo publicado por Smith et al se incluyó un IMC inferior a 20kg/m2 como factor de riesgo de baja DMO14.
En un estudio realizado en nuestro centro también encontramos que el IMC era inferior en pacientes con EPOC y osteoporosis respecto a los pacientes sin osteoporosis, aunque el valor de corte observado quedó por encima de los 25kg/m220.
Déficit de vitamina DLa vitamina D en humanos procede de forma mayoritaria de la exposición solar y tras la activación cutánea se metaboliza en el hígado a 25-hidroxivitamina D y posteriormente en el riñón se convierte en 1,25-dihidroxivitamina D que es la forma activa. La producción renal de 1,25-dihidroxivitamina D es regulada por la hormona paratiroidea y los niveles de calcio y fósforo en sangre22.
La vitamina D activa participa en la absorción intestinal de calcio y fósforo e interviene en la mineralización de la matriz ósea. Su déficit puede conducir a una disminución de la mineralización y contribuir a una baja masa ósea7. Existen pocos trabajos que incluyan la determinación de vitamina D en los pacientes con EPOC y los publicados se han realizado con un número escaso de pacientes. Destaca el trabajo de Riancho et al que en un grupo de 44 pacientes con EPOC encontraron que el 27% presentaba niveles bajos de vitamina D respecto a los pacientes sanos, aunque no encontraron relación con otros marcadores de metabolismo mineral23. Resultados similares se encontraron en un estudio realizado con enfermos candidatos a trasplante pulmonar donde la hipovitaminosis D (<10ng/ml) estuvo presente en el 25% de los casos sin relacionarse con la DMO24. Nosotros, en un grupo de 79 pacientes con EPOC encontramos niveles por debajo de 15ng/ml en el 72% de los casos y en ellos el 69% se acompañaba de hiperparatiroidismo21.
Otro aspecto menos conocido de la vitamina D es su relación con la función respiratoria. Black y Scragg realizaron un estudio con pacientes sanos y encontraron una relación significativa entre los niveles de vitamina D y el volumen forzado en el primer segundo, sugiriendo que la vitamina D podría tener un papel en el remodelado y reparación del tejido pulmonar25. Más recientemente se ha publicado un artículo que sugiere el beneficio de la vitamina D como tratamiento coadyuvante en pacientes con EPOC, aceptando el potencial papel que la vitamina D tiene sobre el sistema inmunitario26.
HipogonadismoEl hipogonadismo se considera una causa secundaria de osteoporosis en el varón y en la mujer27,28. El mecanismo fisiopatológico del hipogonadismo en los pacientes con EPOC se basa en el efecto de los glucocortcoides sobre la hormona luteinizante y las gónadas. Se produciría un descenso en la producción de estrógenos y testosterona que se traduciría en un aumento de la reabsorción ósea.
Se ha publicado algún trabajo que demuestra niveles de testosterona por debajo de los límites de la normalidad en hombres con EPOC y que recibían corticosteroides orales, aunque no se ha podido demostrar que el hipogonadismo actúe como causa única de osteoporosis en los pacientes con EPOC29.
GlucocorticoidesLa osteoporosis inducida por corticoides está ampliamente documentada en la literatura médica y se considera la causa más frecuente de osteoporosis secundaria. No se ha consensuado con exactitud ni el tiempo ni la dosis mínima por debajo de la cual no se produce pérdida de masa ósea, pero se acepta que dosis superiores a 7,5mg de prednisona o equivalente provocan descensos en la DMO y que ésta se produce en los primeros 6 meses de tratamiento19. El mecanismo fisopatológico de la pérdida de hueso es doble, por un lado se produce un aumento en la reabsorción ósea y, por otro, la inhibición de la formación7. En el paciente con EPOC el tratamiento con corticoides se realiza, mayoritariamente, en forma inhalada o en pautas cortas de corticoides orales. En estas dos formas de administración no existe un consenso sobre el efecto tóxico en el hueso30,31. Se han publicado diversos estudios con resultados contradictorios y siempre con un número muy bajo de pacientes. Matsumoto et al valoraron el efecto sobre el hueso de tandas cortas de corticoides orales en relación con la dosis de corticoides inhalados. Tras cuatro años de seguimiento concluyeron que la dosis inhalada no tenía influencia significativa sobre la DMO, mientras que el número de tandas cortas de corticoides orales por año sí tenía efectos negativos y significativos sobre la masa ósea32.
Otros trabajos publicados han intentado calcular una dosis acumulada de corticoides sistémicos con efecto perjudicial en la DMO, pero sus resultados no permiten concretar ninguna dosis acumulada que sirva para establecer un alto riesgo de osteoporosis en pacientes con EPOC33,34. En este sentido también se han documentado múltiples estudios en relación con la dosis acumulada de corticoides inhalados y su efecto sobre el hueso. La mayoría de los trabajos se han hecho con pacientes asmáticos y las conclusiones que publican son contradictorias35. Hay autores que encuentran descensos en la DMO36,37, mientras que otros no demuestran cambios densitométricos significativos independientemente de la dosis acumulada38.
Más homogéneos son los resultados de los estudios que determinan los niveles de los marcadores bioquímicos óseos, como la osteocalcina, marcador de la formación ósea, que en la mayoría de los trabajos muestran descensos significativos entre los pacientes que han recibido corticoides, ya sea en administración oral o inhalada. Sin embargo, es controvertida su relevancia clínica11,30,39.
De Vries et al, en un estudio con casos y controles, encontraron un incremento del riesgo de fracturas en los pacientes que recibían corticoides inhalados u orales, aunque únicamente el uso de corticoides orales fue factor independiente de riesgo de fractura de fémur40.
Predisposición genéticaLos factores genéticos son determinantes del pico de masa ósea, según estudios hechos con gemelos. Entre los genes que se han encontrado con mayor determinismo en la DMO destacan los genes del colágeno tipo I (COLIA I) y los polimorfismos del receptor de la vitamina D41. Sin embargo, no está clara la contribución de estos factores genéticos en el desarrollo de la osteoporosis11. Se ha publicado recientemente que, en pacientes con EPOC, los hombres africanos y americanos tienen similar prevalencia de osteoporosis que las mujeres y los caucasianos42. Estos datos se contraponen con la evidencia de que en la población general, los hombres y la raza negra tienen menor riesgo de baja masa ósea19.
Inflamación sistemática crónicaSe ha sugerido que la inflamación sistémica que se produce en los enfermos con EPOC podría contribuir a la aparición de osteoporosis. En estos pacientes se han observado incrementos de niveles circulantes en sangre de la interleukina-6 y el factor de necrosis tumoral alfa. Estos marcadores inflamatorios intervienen en el remodelado óseo y más concretamente en la actividad osteoclástica a través del sistema RANK-L5,43. Pocos estudios demuestran una relación directa entre estas citocinas y el desarrollo de la osteoporosis; destaca el trabajo reciente de Sabit et al que encuentran una relación entre la rigidez arterial, los niveles elevados de citocinas y la osteoporosis44.
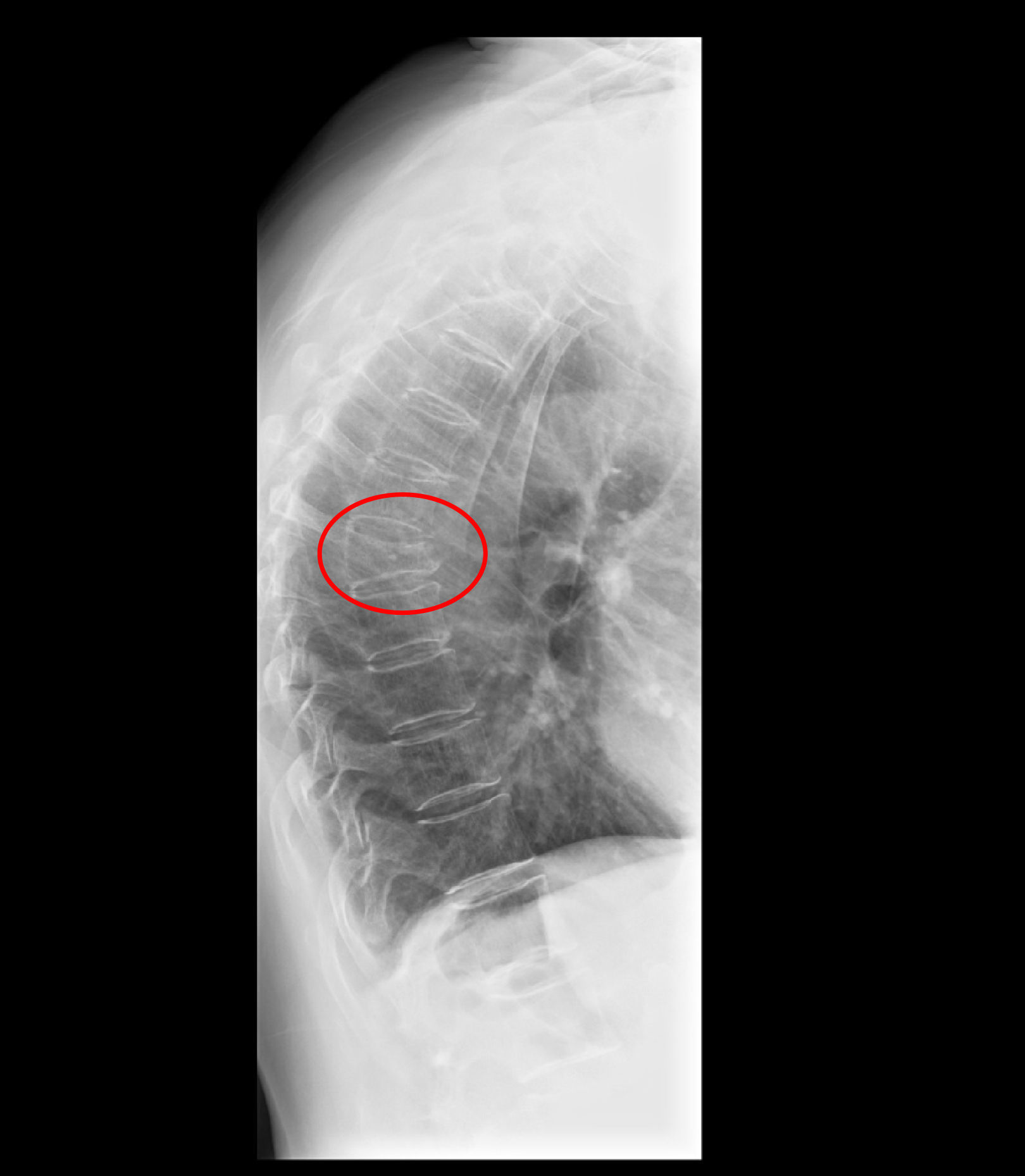
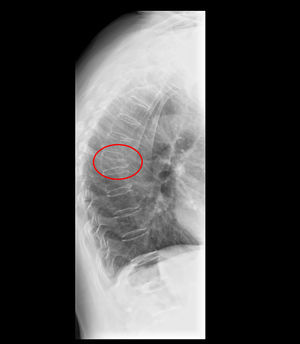
Manifestaciones clínicasLa osteoporosis es asintomática y sus manifestaciones clínicas vienen derivadas de las fracturas, es decir, dolor, impotencia funcional y deformidad, al igual que las fracturas de origen no osteoporótico45. La fractura vertebral es la forma de presentación clínica más frecuente de la osteoporosis, aunque en un porcentaje no despreciable puede ser asintomática (fig. 2). En estos casos, el diagnóstico se realiza de forma casual en la proyección de perfil de la radiografía simple de tórax o de columna. Este hecho dificulta el conocimiento exacto de la prevalencia de la fractura vertebral, tanto en pacientes con EPOC como sin ella. Papaioannou et al realizaron un estudio de prevalencia de fractura vertebral en pacientes con EPOC comparado con un grupo control. Los resultados publicados mostraron que ambos grupos presentaban similar porcentaje de presencia de fractura vertebral, entre el 23–26%, aunque en los pacientes con EPOC el grado de severidad de la fractura fue significativamente mayor46. En nuestra serie de pacientes con EPOC, la prevalencia de fractura vertebral encontrada también fue del 23% aunque no se incluyó ningún grupo control21.
Si la prevalencia de fractura vertebral en los enfermos con EPOC no difiere de forma significativa respecto a la población general, sí tiene una implicación clínica diferente ya que repercute en la morbimortalidad del paciente. Las fracturas vertebrales provocan una deformidad torácica y comprometen la función respiratoria. El incremento en el ángulo de la cifosis torácica ha demostrado una reducción de la capacidad vital forzada y del volumen espiratorio en el primer minuto que puede llegar a ser del 10%11,47. Al impacto negativo en la función respiratoria hay que añadir que la propia fractura vertebral es un factor de riesgo para la aparición de nuevas fracturas vertebrales, magnifica el problema de la osteoporosis en el paciente con EPOC y conduce a un círculo vicioso que tiene como final un rápido declive de la función pulmonar43,47.
No se debe despreciar el efecto desfavorable del dolor de espalda que se produce en el momento agudo de la fractura vertebral. El dolor limita la movilidad torácica y favorece la aparición de infecciones pulmonares. Las infecciones constituyen la causa más importante de descompensación respiratoria y de ingreso hospitalario en el paciente con EPOC43,48.
Otra fractura osteoporótica con impacto significativo sobre la morbimortalidad es la fractura de fémur. Está documentada la mortalidad de la fractura de fémur en la población general en un 20% en el primer año11 y se ha publicado que la mortalidad puede llegar hasta el 70% en los pacientes con EPOC49. Es decir, los enfermos con EPOC tienen aumentado el riesgo de morir de 3 a 5 veces en el primer año tras la fractura de fémur49.
No aparece documentada en la literatura médica el efecto de otras fracturas osteoporóticas sobre el paciente con EPOC ni la prevalencia ni su impacto en la evolución de la EPOC. Parece razonable pensar que el dolor y la impotencia funcional derivados de la fractura pueden afectar de forma desfavorable el curso de la enfermedad pulmonar.
TratamientoA pesar de las consecuencias desfavorables en la evolución de la enfermedad pulmonar, las recomendaciones de Global Iniciative for Chronic Disease (GOLD) sobre el manejo de la osteoporosis en la EPOC sólo especifican que deberían identificarse y tratar las comorbilidades de la EPOC a modo individual43. Tampoco existen estudios intervencionistas sobre la efectividad de los distintos tratamientos de la osteoporosis en los pacientes con EPOC, de ahí que la estrategia terapéutica en estos enfermos siga las mismas recomendaciones que las diseñadas para la osteoporosis corticoidea, del varón y posmenopáusica11 (tabla 2).
Recomendaciones en el tratamiento de la osteoporosis en el paciente con enfermedad pulmonar obstructiva crónica
| Aporte de calcio y vitamina D para conseguir la ingesta diaria recomendada |
| Bifosfonatos |
| Fármacos osteoformadores (ranelato de estroncio y parathormona) |
| Otros fármacos: calcitonina y terapia hormonal |
| Rehabilitación pulmonar para evitar caídas |
| Tratamiento quirúrgico: cirugía reductora y vertebroplastia |
| Valorar en un futuro las terapias con anticuerpos monoclonales |
La recomendación de ingesta diaria entre 1.000–1.500mg de calcio y 400–800U de vitamina D en la población general mayor de 50 años, también está vigente en los pacientes con EPOC. Respecto a esta terapéutica, encontramos publicado un estudio de Mirzaei et al realizado con un número reducido de pacientes con EPOC, que recibían corticoides sistémicos, y observaron que la administración de calcitriol aumentaba discretamente la masa ósea. Este estudio, sin embargo, no tiene la metodología adecuada que permita aconsejar esta medicación de forma generalizada en los pacientes con EPOC50. En relación con la ingesta de calcio, no se encuentra documentación concreta sobre el beneficio de la suplementación con calcio en los enfermos con EPOC sobre la masa ósea.
BifosfonatosLos bifosfonatos son el grupo terapéutico más ampliamente utilizado para el tratamiento de la osteoporosis. Su efecto se basa en la inhibición selectiva de la actividad osteoclástica y su eficacia ha sido ampliamente demostrada en los diferentes estudios publicados51. Actualmente dos de los aminobifosfonatos disponibles en el mercado, alendronato y risedronato, se consideran el tratamiento estándar de la osteoporosis en sus distintos subtipos19.
Smith et al realizaron un estudio aletorizado con alendronato en pacientes con EPOC en el que se demostraba que una dosis diaria de 10mg de ácido alendrónico mejoraba la DMO a nivel lumbar respecto a los pacientes que recibieron únicamente suplementos de calcio52.
No se han publicado estudios con otros bifosfonatos que permitan recomendar o desaconsejar su uso en el paciente con EPOC. Se aplicarían los mismos criterios que los especificados en las guías de la práctica clínica y en ese sentido el ibandronato y el zoledronato también podrían ser útiles en el tratamiento de la osteoporosis en el enfermo con EPOC.
Otros tratamientos farmacológicosTratamiento hormonal: en la actualidad, el uso de la terapia hormonal sustitutiva en la mujer se ha visto restringido debido a los efectos secundarios sobre la mama y la enfermedad cardiovascular. El tratamiento con testosterona en el hombre, aunque ha demostrado que aumenta la DMO, no ha probado su eficacia en la reducción de fracturas, por ello se desaconseja su prescripción en el tratamiento de la osteoporosis del varón19.
Calcitonina: este péptido hormonal, que actúa inhibiendo la actividad osteoclástica, fue evaluado como tratamiento de la osteoporosis en pacientes asmáticos y corticodependientes con resultados favorables respecto al aumento de la DMO53. Sin embargo, no se aportaron datos sobre la reducción de fractura y el exceso de efectos secundarios que se observaron en estos pacientes y se descartó el uso de la calcitonina como tratamiento de la osteoporosis en asmáticos. No hay datos publicados en los pacientes con EPOC sin corticodependencia. En los últimos años esta medicación ha caído en desuso a medida que se han desarrollado nuevas terapéuticas para la osteoporosis.
Fármacos con actividad osteoformadora: en este grupo de fármacos se incluirían el ranelato de estroncio, con su acción dual sobre el metabolismo óseo, y la parathormona, con acción osteoformadora pura. Ninguno de los dos fármacos tiene documentada su eficacia en los pacientes con EPOC y su uso se recomiendaría siguiendo las pautas generales indicadas en las guías.
Tratamiento no farmacológicoDentro de las medidas generales en el tratamiento de la osteoporosis se incluye el ejercicio físico dirigido a la prevención de las caídas. En el paciente con EPOC esta recomendación quedaría incluida en el programa de rehabilitación pulmonar. Este programa está diseñado para mejorar la tolerancia al ejercicio haciendo hincapié en la potenciación de la función muscular de las piernas y, de este modo, evitar caídas15.
Otras terapias que han sido documentadas en los pacientes con EPOC con efectos favorables para el hueso son las técnicas quirúrgicas. Mieno et al demostraron que la cirugía reductora del enfisema pulmonar severo mejoraba los parámetros de función pulmonar y, además, encontraron un aumento en la DMO al año de la cirugía54. La vertebroplastia, encaminada a aliviar el dolor y evitar la deformidad torácica de la fractura vertebral aguda, ha demostrado ser eficaz para mejorar los parámetros de función pulmonar en un estudio realizado en pacientes sin enfermedad pulmonar55. Estas técnicas no poseen la suficiente documentación para ser incluidas de forma protocolizada dentro del tratamiento de la osteoporosis en el paciente con EPOC, sin embargo, sí permiten abrir prespectivas de mejoría más allá del tratamiento farmacológico estándar.
Perspectivas futurasSon necesarios estudios prospectivos con el fin de determinar los factores de riesgo de la osteoporosis en el paciente con EPOC y conocer cuándo es adecuado iniciar el estudio de cribado de OP en estos pacientes9. La definición de un perfil de alto riesgo de padecer fractura osteoporótica permitiría evitar nuevas complicaciones a un enfermo ya limitado por su patología pulmonar.
La reciente aparición de tratamientos encaminados a controlar el sistema inflamatorio en la osteoporosis, como el denosumab, pueden abrir nuevas perspectivas terapéuticas en los pacientes con EPOC en los que este sistema se halla activado de forma crónica55,56.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.