Objetivos: Conocer la prevalencia de dolor neuropático y mixto de la población enferma de cáncer tratada en la consulta de oncología procedente de la zona de cobertura (Cádiz-San Fernando) del Hospital Universitario Puerta del Mar (HUPM), que refiere dolor, y que no ha recibido tratamiento oncológico previo potencialmente causante. Conocer las variables demográficas, clínicas y de comorbilidad psíquica asociadas a la presencia de dolor neuropático y mixto de estos pacientes.
Material y métodos: Diseño: estudio observacional, transversal. Ámbito del estudio: zona de cobertura del HUPM (Cádiz-San Fernando) que cubre a una población de 242.723 personas. Sujetos de estudio: pacientes diagnosticados de cáncer, con dolor y que no han recibido tratamiento oncológico previo potencialmente causante, atendidos en la Consulta Externa de Oncología del HUPM. Recogida de la información: escala LANSS de diagnóstico de dolor neuropático, versión validada española; escala HADS de depresión y ansiedad; cuestionario breve del dolor (edición corta BPI-SF); cuestionario para recogida de variables sociodemográficas y clínicas. Análisis: cálculo de la prevalencia de dolor neuropático y mixto (± intervalo de confianza del 95%) en la población que atiende la Consulta Externa de Oncología del HUPM.
© 2009 Sociedad Española del Dolor. Publicado por Elsevier España, S.L. Todos los derechos reservados.
Objectives:To determine the prevalence of neuropathic and mixed pain in the population treated in the Oncology Service of the catchment area (Cadiz-San Fernando) of the Puerta del Mar University Hospital. Patients with cancer reporting pain and who had not received prior oncological treatment that could have caused the pain were included. We also aimed to determine the demographic, clinical and psychiatric comorbidities associated with the presence of neuropathic and mixed pain in these patients.
Material and methods: Design: Observational, cross-sectional study. Setting: Catchment area of the Puerta del Mar University Hospital (Cadiz-S. Fernando), which attends a population of 242,723 people. Study subjects: Patients diagnosed with cancer who reported pain and who had not received prior oncological treatment that could potentially have caused the pain attended in the Outpatient Oncology Department of the Puerta del Mar University Hospital. Data collection: The following scales were used: the validated Spanish version of the Leeds Assessment of Neuropathic Symptoms and Signs (LANSS) scale for the diagnosis of neuropathic pain, the Hospital Anxiety and Depression Scale (HADS) and the Brief Pain Inventory Short Form (BPI-SF). Aquestionnaire was employed to collect sociodemographic and clinical variables.Analysis: The prevalence of neuropathic and mixed pain (± 95% CI) was calculated in the population attending the Outpatient Oncology Department of the Puerta del Mar University Hospital.
© 2009 Sociedad Española del Dolor. Published by Elsevier España, S.L. All rights reserved.
El cáncer es una enfermedad cuya incidencia está aumentando con el paso del tiempo y cuyo síntoma más frecuentemente registrado es el dolor, así como el más preocupante del enfermo oncológico en estado avanzado. Según la Organización Mundial de la Salud (OMS), al menos 3,5 millones de personas en todo el mundo tienen diariamente dolor asociado al cáncer. El 38% de los pacientes en todos los estadios experimenta dolor y el 80% de ellos en fase avanzada presenta dolor de moderado a severo.
Los pacientes con dolor recurren a sus médicos para obtener alivio y, para ello, a su vez el médico debe identificar el mecanismo responsable con la información clínica y ciertos conocimientos acerca de la clasificación del dolor. Woolf et al (1998) propusieron una clasificación del dolor más fundamental basada en esos mecanismos. Según estos autores, los síntomas, mecanismos y síndromes del dolor deben formar una nueva jerarquía que no recurra a las dicotomías tradicionales como maligno/no maligno o agudo/crónico. Es preciso identificar los mecanismos aplicables a todas las partes del cuerpo, obteniéndose 2 grandes categorías de dolor: dolor por daño tisular y dolor por daño neurológico, incluyendo cada una de ellas una serie de mecanismos universales. En el caso del dolor neuropático (DNP) es muy importante porque la eficacia de su tratamiento depende de su detección precoz, el conocimiento de los mecanismos responsables y el uso de estrategias terapéuticas alternativas1-3.
En este contexto, se define el DNP como el producido por la alteración de una función o un cambio patológico en un nervio. Es decir, el DNP está desencadenado o causado por una lesión o disfunción primaria del sistema nervioso (central o periférico). Antes denominado “dolor no nociceptivo” o “dolor por desaferentación” el DNP es un síndrome que engloba un conjunto de síntomas y signos que tienen como protagonista al sistema nervioso. Hay unos mecanismos fisiopatológicos perpetuadores de un estímulo álgico anómalo que puede tener un origen periférico (nociceptores y sistema nervioso periférico), como el caso de la neuropatía diabética, o central (sistema nervioso central) caso del dolor central postaccidente cerebrovascular.
Por tanto, el DNP se tratará como un síntoma, aunque también habrá que considerar que tiene signos derivados de la disfunción neurológica existente evidenciados sólo en la exploración del paciente como alteraciones de la coloración y temperatura de la piel o hipoestesias (disfunción autonómica o sensorial). Tradicionalmente, los pacientes con DNP se quejan de dolores espontáneos (los que surgen sin una estimulación detectable) y dolores provocados (respuestas anormales a estímulos). Los dolores espontáneos pueden ser continuos, constantes y permanentes, o pueden ser paroxísticos, episódicos e intermitentes. Los dolores provocados suelen describirse como alodinia, hiperalgesia o hiperpatía4.
Los pacientes con cáncer pueden desarrollar DNP por múltiples causas: compresión o infiltración directa del tumor de estructuras nerviosas, traumatismos directos nerviosos como consecuencia de procedimientos diagnósticos o quirúrgicos, y lesiones nerviosas secundarias a tratamientos como la radioterapia o la quimioterapia5-9.
El diagnóstico de DNP es clínico, pero hay dificultades en cuanto a la validez de los términos usados por los propios pacientes para poder llegar a él. Un diagnóstico clínico de DNP sólo debe establecerse cuando la distribución del dolor y las anomalías sensoriales asociadas, conjuntamente y en un contexto clínico, sugieran un problema neurológico. Otros insisten en que la característica más importante es la presencia de dolor en una zona con una sensibilidad anormal o ausente5,10. La disfunción neurológica en este contexto puede representarse como una disfunción sensorial, motora o autonómica atribuible a una lesión neurológica discreta. El diagnóstico precoz es la clave en el tratamiento eficaz del DNP. La capacidad de identificar mecanismos de DNP debería llevar a un tratamiento individualizado capaz de mejorar el control del dolor, permitir la comparación de tratamientos en pacientes con mecanismos similares generadores de dolor y ayudar a mejorar el desarrollo de nuevos tratamientos basados en mecanismos específicos del dolor11-15.
Dolor, cáncer y alteraciones psicopáticasHay abundante material ilustrativo acerca de la prevalencia de alteraciones psicopatológicas en enfermos de cáncer. De hecho, se han detectado en este tipo de pacientes frecuentes reacciones de ansiedad y depresión junto a problemas de sueño, alimentarios, sexuales, sociales, familiares, domésticos, etc. Nos centraremos en la prevalencia de los problemas psicológicos en enfermos de cáncer que además presentan dolor, y sobre todo si reúne las características de un DNP. Los diversos estudios comparativos que se han realizado en esta área han registrado niveles de ansiedad y depresión más elevados en los pacientes de cáncer con dolor que si no lo tienen16,17.
Objetivos- Conocer la prevalencia de DNP y mixto de la población enferma de cáncer tratada en la consulta de oncología procedente de la zona de cobertura (Cádiz-San Fernando) del Hospital Universitario Puerta del Mar (HUPM), que refiere dolor, y que no ha recibido tratamiento oncológico previo potencialmente causante.
- Conocer las variables demográficas, clínicas y de comorbilidad psíquica asociadas a la presencia de DNP y mixto de estos pacientes.
Se trata de un estudio observacional de diseño transversal con recogida prospectiva de la información. Se desarrolló en el HUPM, hospital de referencia del área hospitalaria de Cádiz-San Fernando, que cubre la población de estos 2 municipios con un total de 242.723 personas.
Fueron incluidos los pacientes mayores de edad y de cualquier sexo, diagnosticados de cáncer de cualquier tipo y vistos en la consulta externa de oncología del hospital, que dieron su consentimiento para su participación en el estudio y que reunían las aptitudes psicofísicas suficientes para rellenar los cuestionarios de recogida de los datos. Se calculó el tamaño muestral necesario para estimar la prevalencia poblacional a partir de la prevalencia de DNP en pacientes oncológicos descrita en la bibliografía (40-60%)18,19.
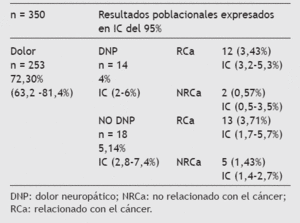
Tamaño muestral necesario n = 350 para una población de 4.500 pacientes/año atendidos en consulta con un nivel de confianza del 95% y un margen de error del 5%.
Criterios de inclusiónPacientes con diagnóstico de cáncer con dolor en cualquier localización y con cualquier intensidad. No haber recibido tratamiento oncológico previo potencialmente causante del dolor. Acudir a la consulta de oncología del HUPM al pertenecer al área sanitaria de Cádiz-San Fernando.
Criterios de exclusiónPacientes con alguna limitación para contestar, que no dieran su consentimiento o que hubieran recibido tratamiento oncológico (quimioterapia, cirugía o radioterapia) previamente potencialmente causante de su dolor. Pacientes que no pertenezcan al área sanitaria de Cádiz-San Fernando.
Fuente de recogida de datosSe utilizaron los siguientes instrumentos y variables:
Instrumentos (anexo 1).
- Escala de dolor de LANSS: mecanismo neuropático del dolor del paciente.
- Escala de depresión y ansiedad hospitalaria (HADS).
- Cuestionario breve del dolor (edición corta BPI-SF) que valora la interferencia del dolor con aspectos de la calidad de vida de los pacientes.
Variables. La selección de las variables a estudiar se ha realizado de acuerdo a la bibliografía existente respecto a los factores asociados a la evolución clínica de la enfermedad.
- Variables demográficas. Edad y sexo.
- Diagnóstico de la neoplasia actual.
- Neoplasias previas. Diagnóstico.
- Relación del dolor con la neoplasia.
- Tiempo, en meses, de evolución de la enfermedad oncológica actual desde el inicio de los síntomas.
- Tiempo, en meses, de evolución de la enfermedad oncológica primaria o anterior.
- Tiempo del dolor en meses.
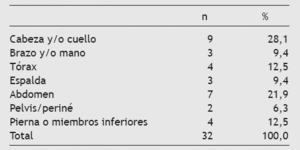
- Localización del dolor.
- Escala visual analógica.
- Mayor escalón de tratamiento analgésico previo según la OMS: antiinflamatorios no esteroideos, opiáceos débiles, opiáceos mayores, anticonvulsionantes, antidepresivos, técnicas invasivas.
- Tratamiento psiquiátrico/psicológico actual: antidepresivos, ansiolíticos, ambos, otros.
- Comorbilidad: otra enfermedad crónica diagnosticada (cardiopatía, hipertensión arterial, diabetes mellitus, vasculopatía periférica), depresión diagnosticada (sí/no), ansiedad diagnosticada (sí/no), otros diagnósticos psiquiátricos (sí/no).
El investigador principal acudió al archivo de historias clínicas de la planta de oncología y realizó una revisión de éstas, seleccionando a los pacientes que tenían criterios de inclusión y ninguno de exclusión, hasta completar un total de 350 historias revisadas. Se siguieron los listados de los pacientes atendidos durante la semana en las distintas consultas desde elmesdefebrerohastaelmesdejunio,oantessisecompletaba el número de revisiones necesario. Cada día de revisión escogía al azar el listado completo de una de las consultas de esa semana, ya que todas ellas mantenían una proporción casi constante de primeras visitas y revisiones. Se examinaron 381 historias hasta llegar a 350 y no se encontraron 31 historias que habían sido extraídas del archivo para consultas externas.Seguidamente,fuecitandoalospacientesquepresentaban dolor sin haber recibido antes tratamiento oncológico previo potencialmente causante del mismo en la clínica deldolor,yrealizólaentrevistapersonalconlaobtencióndel consentimiento informado y la elaboración de los cuestionarios seleccionados. El investigador anotó el número de pacientes que incumplía los criterios de inclusión y fue incluyéndo a todos en alguna de las siguientes categorías:
- Primeras visitas. Con tratamiento previo: con dolor, sin dolor; sin tratamiento previo: sin dolor, con dolor.
- Revisiones. Sin tratamiento previo: con dolor, sin dolor; con tratamiento previo: con dolor, sin dolor.
Se señala en cursiva a los pacientes derivados a la clínica del dolor. El resto de casos fue cuantificado por el investigador durante la revisión de las historias. Posteriormente a la entrevista los pacientes fueron clasificados en:
- DNP: relacionado con el cáncer; no relacionado con el cáncer.
- No DNP: relacionado con el cáncer; no relacionado con el cáncer.
Los pacientes que tenían antecedentes de neoplasia previa fueron incluidos como “sin tratamiento previo” si el mismo no era causa potencial de su dolor actual. Por ejemplo, pacientes con un cáncer de colon tratado con cirugía y que desarrolla con los años un segundo cáncer, esta vez de pulmón, con metástasis dolorosas.
Los pacientes cuyo dolor fue interpretado como relacionado potencialmente con un tratamiento oncológico previo fueron clasificados como “con tratamiento previo”. Por ejemplo, los casos de recidivas tumorales dolorosas de cáncer de mama sobre zonas previamente irradiadas.
Análisis de los datosSe ha utilizado el programa informático SPSS v.14 en español para Windows para la tabulación y análisis descriptivo de los datos. Se ha obtenido una estimación del valor poblacional (pacientes atendidos en la consulta externa pertenecientes al área sanitaria de Cádiz-San Fernando) con un intervalo de confianza (IC) del 95% a partir de la proporción muestral. La estimación de un porcentaje poblacional a partir del estudio de variables cualitativas sigue una distribución binomial, pero al ser n > 100 y teniendo en cuenta que np (proporción muestral) > 5 y n (1-p) > 5 la distribución binomial se puede aproximar a la normal y la estimación del porcentaje poblacional se ha calculado según la fórmula:
p ± 1,96 · eep
donde: eep2 = p (1-p)/n, y eep = error estándar del porcentaje.
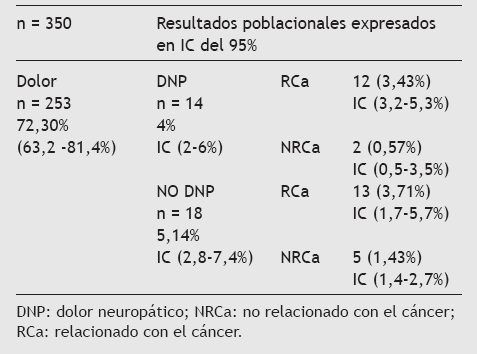
ResultadosA partir de la base de datos creada con la muestra de 350 pacientes y las 32 entrevistas a los que reunieron los criterios de selección (dolor sin relación con el tratamiento oncológico), se ha estimado la prevalencia de dolor en todos los que son atendidos en la consulta externa de oncología del HUPM, constituyendo la población objeto de estudio, para saber cuántos de ellos tienen un mecanismo neuropático. Sus características y la prevalencia de dolor se recoge en las tablas 1 a 3.
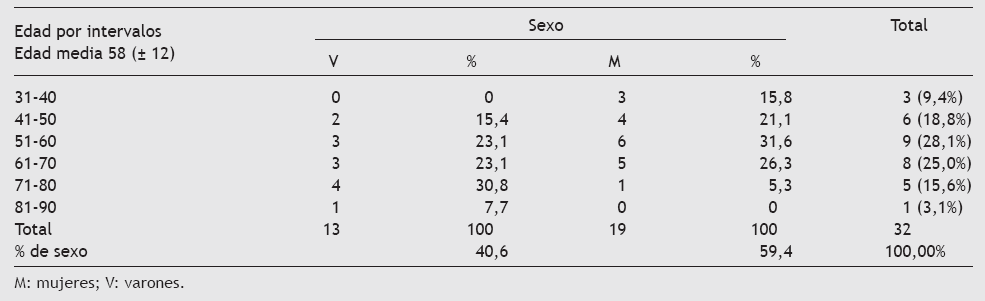
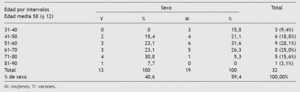
Tabla 1 Tabla de contingencia de la edad muestral por intervalos y sexo (n = 32)
Tabla 2 Localización del dolor
Tabla 3 Prevalencia de dolor oncológico sin tratamiento previo potencialmente causal
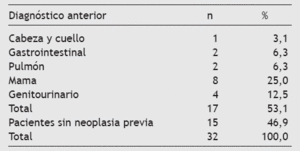
Este subgrupo de 32 pacientes incluye a mayores de edad con un predominio femenino en la edad media de la vida, debido a la mayor prevalencia de tumores de la esfera ginecológica que atienden estas consultas y que incluyen tumores de mama, útero y ovarios así como a los procesos metastáticos secundarios (tabla 4). La metástasis de primario conocido constituye el principal diagnóstico muestral (31,3%), seguido por el cáncer de mama y genitourinario (25%) (tabla 4). Además, el tumor que más metástasis ha originado es el de mama y el genitourinario de ambos sexos (37,5% entre ambos) (tabla 5).
Tabla 4 Diagnóstico de la neoplasia actual
Tabla 5 Pacientes con neoplasia previa cuyo tratamiento no se relaciona con el dolor actual
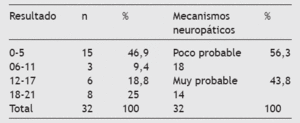
Los pacientes se clasificaron en función del mecanismo responsable del dolor para identificar a los que tuvieran relación con el origen neuropático (tabla 6). Además, la muestra obtenida se separó por intervalos de tiempo desde el inicio de los síntomas de la enfermedad oncológica actual. También se cuantificó a aquellos cuyo dolor tenía relación con el cáncer y aquellos otros en los que el dolor se debía a una causa no oncológica (tabla 7).
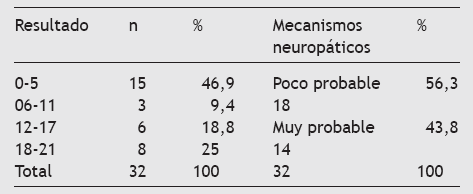
Tabla 6 Resultados muestrales por intervalos de la escala LANSS
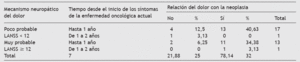
Tabla 7 Tabla de contingencia muestral que relaciona mecanismo del dolor con el tiempo desde la aparición de los síntomas de la enfermedad oncológica actual y la etiología oncológica (n = 32)
Al ser las metástasis el diagnóstico más frecuente de los 32 pacientes con dolor no relacionado con el tratamiento oncológico, se les clasificó por el mecanismo del dolor (neuropático o no) y por la más frecuente localización del dolor dependiendo del origen del primario conocido. De esta forma, se puede conocer el tumor primario origen de la metástasis, dónde produce dolor con más frecuencia y cuál es el mecanismo responsable (tabla 8).
Tabla 8 Tabla de contingencia entre la neoplasia primaria, su localización más frecuente y el mecanismo del dolor que ocasiona
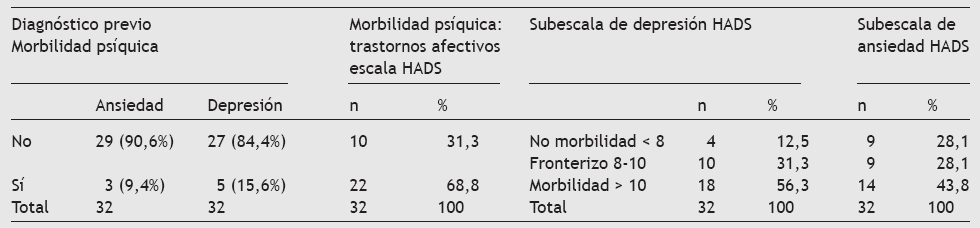
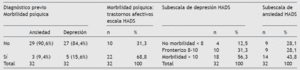
Por último, y no por ello menos importante, como objetivo secundario se intentó detectar la morbilidad psíquica descrita ampliamente en la bibliografía20. Se comparan los datos antes de usar la escala HADS en cuanto a diagnósticos previos de ansiedad o depresión, y después se describe la prevalencia muestral global con diferentes puntos de corte en la escala HADS y sus subescalas (tabla 9).
Tabla 9 Diagnóstico previo de la morbilidad de los pacientes con dolor oncológico no relacionado con el tratamiento previo. Resultados globales y desglose por subescalas después de la aplicación de la escala HADS
Se puede observar una menor prevalencia, al menos llamativa, de morbilidad psíquica antes de hacer la escala HADS con la que la cifra alcanza casi el 70% de los entrevistados. Aunque se sospecha la mayor relación con el dolor relacionado con el cáncer, se hace una selección para observar esto en la muestra con más detalle. Así, en el 53% de los casos la morbilidad psíquica se debe a un trastorno afectivo relacionado con el hecho de tener cáncer (tabla 10).
Tabla 10 Tabla de contingencia entre la relación del dolor con el cáncer y la morbilidad psíquica
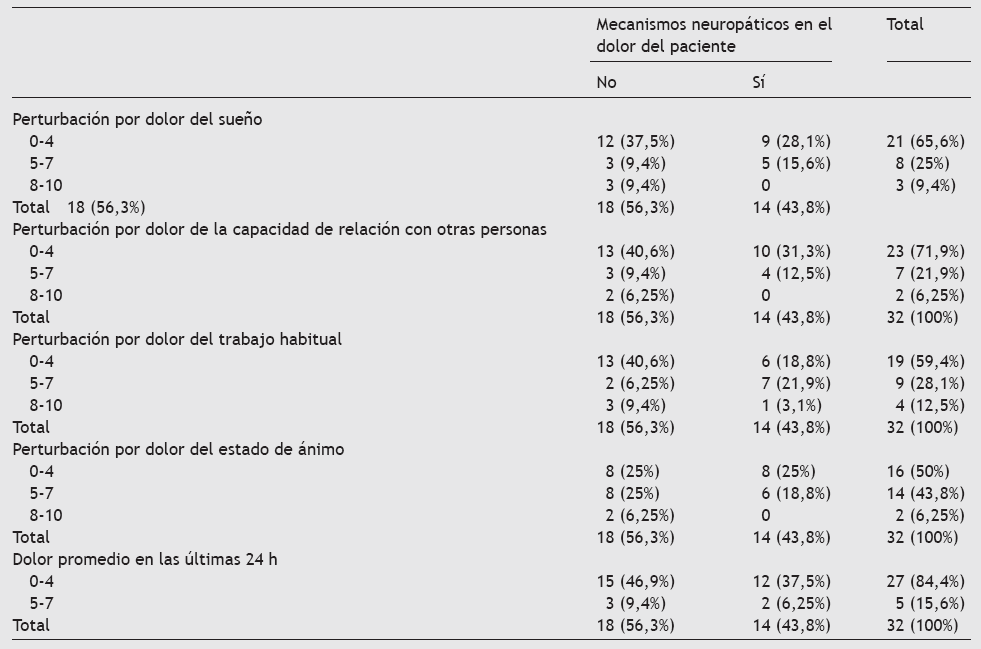
Esta alta prevalencia tiene también su reflejo en el DNP ocasionado por el cáncer. El DNP crónico ya ocasiona graves deterioros en la calidad de vida de los pacientes. Cuando se produce en el contexto de un cáncer la situación es vivida desde un prisma diferente. Se intentó recoger los principales aspectos de la vida cotidiana en los que influye este dolor (tabla 11).
Tabla 11 Tabla de contingencia entre diferentes parámetros de calidad de vida y el dolor neuropático
Los objetivos que se han planteado con el presente trabajo persiguen obtener los datos necesarios para poder diseñar posteriores estudios experimentales. Como todo estudio observacional, nos permite elaborar hipótesis respecto a potenciales asociaciones causales, si bien para alcanzar esta ambiciosa meta primero hay que conocer mejor a la población que se va a investigar.
En este caso, es conocida la relación que hay entre el DNP y el cáncer21,22. También hay numerosa bibliografía en cuanto a la morbilidad psíquica de estos pacientes20,23,24.
Planteamos que desde el punto de vista clínico el uso de herramientas sistemáticas como la escala LANSS y la escala HADS nos permitiría hacer un diagnóstico en las etapas incipientes del proceso y un seguimiento posterior de una intervención farmacológica precoz, obteniendo una mejoría sintomática en los pacientes debidamente diagnosticados y tratados.
El uso de cuestionarios breves validados en la consulta ha supuesto una herramienta muy útil para identificar a pacientes que pueden reunir las características suficientes para orientar una posible actitud diagnóstica y terapéutica. En el presente estudio se plantea el uso de la escala de dolor de LANSS (leeds assessment of neuropathic symptoms and signs) en su versión española validada. Se basa en el análisis de la descripción sensorial y la exploración de la disfunción sensorial en la cabecera del paciente, y facilita información inmediata en contextos clínicos. La escala del dolor de LANSS trata de estimar la probabilidad de que los mecanismos neuropáticos contribuyan a la experiencia del dolor crónico en un cierto paciente. Así pues, los evaluadores reciben instrucciones de que si la puntuación es < 12, la probabilidad de que mecanismos neuropáticos contribuyan al dolor del paciente es pequeña, y si la puntuación es ≥12, la probabilidad de que mecanismos neuropáticos contribuyen al dolor del paciente es grande. Hay una buena correlación entre el diagnóstico de DNP y una puntuación > 12 (r = 0,727) con una sensibilidad del 83% y una especificidad del 87%19.
También proponemos el uso de la HADS, que es un método de autovaloración que fue desarrollada por Zigmond y Snaith en 1983 con el fin de detectar estados de depresión y ansiedad en un ámbito extrahospitalario. Está compuesta por 2 subescalas de 7 ítems cada una, que diferencian perfectamente la depresión y la ansiedad como conceptos psicopatológicos independientes. El paciente tiene que completar la escala y reflejar en ella cómo se ha sentido la semana anterior. La escala ha demostrado tener las características psicométricas adecuadas y se ha utilizado extensamente en otros estudios. La HADS ha sido validada para la población oncológica española24. Las puntuaciones > 10 se consideran indicativas de morbilidad; una puntuación de 810 se interpreta como un caso fronterizo, y las puntuaciones < 8 indican ausencia de morbilidad significativa.
Siguiendo con nuestra propuesta experimental, se buscó un posible escenario clínico donde se pudiera desarrollar, y las consultas externas de oncología del HUPM de Cádiz se ofrecen como el ámbito físico idóneo donde reclutar a los pacientes.
Desde un primer momento, se planteó la necesidad de definir muy bien cuáles serían los sujetos de estudio intentando aislar cualquier posible factor de confusión. Esto es, habría que definir qué tipo de DNP sería válido y qué pacientes podían reunir las aptitudes psicofísicas para realizar los exámenes.
Partiendo del hecho de que los mecanismos responsables en el DNP son universales1,25,26, aunque no así su causa, se decidió excluir a todos los que pudieran tener una que no fuera el propio cáncer. Se excluyeron a todos los menores de edad o que su dolor pudiera estar causado por el propio tratamiento oncológico. Además, se excluyó a la población externa al área sanitaria de Cádiz-San Fernando para facilitar la adhesión posterior de los pacientes, al no tener que desplazarse de zonas muy lejanas ya que el HUPM es referencia provincial en determinados procesos oncológicos.
De este modo, se obtiene la muestra necesaria para calcular la prevalencia de la población que suponen todos los pacientes atendidos con estas características. No se excluyen los que tienen DNP mixto (neuropático y nociceptivo) o de posible etiología osteoarticular, ya que todavía no hay una escala que permita discernir la influencia en el dolor entre ambos y, además, estos dolores en ocasiones son manifestaciones de procesos metastásicos que como se ha expuesto en los resultados de nuestro estudio es uno de los más frecuentes causantes aislados. También resulta interesante poder considerar la opción de introducir como segundos controles a estos pacientes en el caso de realizar un ensayo farmacológico con respecto a los de etiología puramente oncológica.
Obteniendo esta prevalencia de una población en la que hemos tratado de separar en lo posible el DNP de origen oncológico, se calculará el tamaño muestral necesario para, con la potencia que se requiera, identificar diferencias después de un tratamiento precoz.
La prevalencia de la población que queremos obtener no representa a la de toda la población que atiende este hospital en sus consultas de oncología ni tampoco a la población global enferma de cáncer del área sanitaria. Hay procesos, como los oncohematológicos, que son tratados en otros servicios y procesos que lo son en otros centros, tanto públicos como privados, de la provincia, sin olvidarnos también de la oncología infantil27.
En última instancia, lo que se persigue es comprobar la eficacia de la actuación sobre los mecanismos comunes de una serie de manifestaciones clínicas que se engloban bajo el término de DNP28-30.
En cuanto a nuestros resultados, la prevalencia de dolor de cualquier causa en el paciente oncológico es semejante a la de otros estudios (72,3%; 253 de 350), pero cuando seleccionamos a los 32 candidatos propuestos con dolor no relacionado con el tratamiento oncológico previo, la cifra de éstos con DNP es muy inferior (4%; 14 de 350) respecto a la población general oncológica publicada en otros trabajos, y que varía entre el 40 y el 60%.
Esto se debe a que es una muestra con unos criterios de selección estrictos con los que descartamos a todos los que pudieran tener otra causa de DNP, como el tratamiento oncológico previo. Es decir, muy probablemente hay más de 32, entre los 350 pacientes, que hubieran sido objeto de estudio, ya que tendrían DNP, aunque por la razones ya desarrolladas no se contabilizaron. No obstante, al analizar a este subgrupo de 32 pacientes con dolor y sin tratamiento previo causante de éste, vemos que mantienen una proporción del 43,8% (14 de 32) de dolor con características neuropáticas que se aproxima a la cifra publicada en varios estudios. Por tanto, seleccionar a los pacientes por la ausencia de tratamiento previo no parece haber alterado o modificado significativamente la prevalencia de DNP.
Otro aspecto que hay que comentar, es que al excluir a todos los que pudieran tener un tratamiento previo potencialmente causante de DNP, los pacientes válidos para su estudio, en su mayoría, podían ser: revisiones de procesos metastásicos, segundos tumores, primarios inoperables, tratamientos neoadyuvantes y revisiones de tumores cuyo tratamiento no tuviera relación causal con su dolor actual. Se obtuvieron los datos de pacientes con dolor en función del tiempo de aparición de los síntomas, pues pudiera haber una mayor prevalencia en aquellos con más tiempo de evolución. Las cifras son muy parejas, sin mostrar claras diferencias, e indican que es en el primer año de evolución cuando aparece el DNP.
Se observa una mayor frecuencia de casos metastáticos en relación con la esfera ginecológica y de edad media. La posibilidad de que las metástasis pudieran constituir un sesgo en la selección de la muestra llevó a analizar con más detalle sus características, y se observó que hay casi tantas metástasis causantes de dolor no neuropático como neuropático.
Decidimos estudiar la morbilidad psíquica de estos pacientes al haber una clara relación entre ansiedad, depresión y dolor. Además, varios de los fármacos que se emplean para el tratamiento de la depresión están indicados en el tratamiento del DNP. Los datos nos indican la alta prevalencia del morbilidad entre los afectados, que es mayor entre los que tienen dolor por el cáncer. Sin embargo, es destacable que el porcentaje de pacientes que relataba este antecedente durante la encuesta preliminar era muy bajo, comparado con los resultados obtenidos después de hacer la escala HADS, más acorde con la bibliografía existente. Esta infranotificación por parte del paciente pudiera deberse a una actitud negativista de su enfermedad, a la no conciencia de su proceso de adaptación, o a otros factores que tendrían que ser investigados con mayor profundidad en posteriores estudios.
ConclusionesEl cáncer es una enfermedad que somete al individuo. La capacidad del clínico para identificar y tratar precozmente las 2 principales causas de morbilidad, dolor y trastornos afectivos, pueden conducirle hacia una terapia más integral y efectiva en estos terrenos. Las escalas LANSS y HADS se han mostrado como instrumentos válidos para ello. La prevalencia de DNP en los pacientes oncológicos sin tratamiento previo es muy inferior a la prevalencia que hay en los pacientes oncológicos en general. Esto se puede deber al tipo de paciente que es valorado en cada consulta de oncología, siendo muy difícil discernir la relación del tratamiento previo como causante del dolor. Este estudio es un primer paso para la elaboración de posteriores diseños experimentales que pueden incluir a todos los pacientes oncológicos con DNP, independientemente de la causa, o bien, estudiar aquellos con muy probable etiología oncológica exclusivamente cuya prevalencia hemos establecido en este trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónLos autores declaran no tener ninguna financiación en la realización de este trabajo.
*Autor para correspondencia.
Correo electrónico: rafaghernandez@yahoo.es (R. García-Hernández).
Recibido el 15 de enero de 2009; aceptado el 1 de junio de 2009
ANEXO 1