Evaluar las variables relacionadas con la diseminación metastásica axilar e intentar validar los diferentes modelos predictivos creados hasta la fecha.
Pacientes y métodoRealizamos un estudio retrospectivo a lo largo de 10 años. Fueron incluidas todas las pacientes intervenidas de cáncer de mama en nuestro hospital con ganglio centinela positivo. Se recogieron 27 variables clínico/histológicas del tumor y se realizó un análisis uni/multivariante para valorar la relación con la presencia de metástasis en ganglios axilares no centinelas. Se aplicaron los modelos predictivos a nuestra población: MSKCC, Stanford, Tenon, Meretoja unicéntrico y Meretoja multicéntrico y se calculó para cada uno de ellos el área bajo la curva de característica operativa de receptor (ROC).
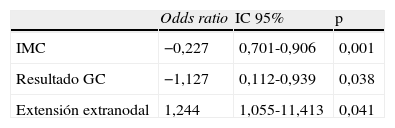
ResultadosLas variables significativas con la diseminación metastásica axilar fueron el IMC, la macrometástasis en el ganglio centinela, la unifocalidad y la extensión extranodal. Ningún modelo predictivo pudo ser validado, pues todos presentan una capacidad discriminativa diagnóstica baja, con áreas bajo la curva menores de 0,7.
ConclusionesLos modelos predictivos de diseminación metastásica axilar en caso de ganglio centinela positivo por sí solos no permiten discriminar aquellas pacientes con afectación metastásica axilar en el ganglio no centinela.
To evaluate factors related to metastatic axillary disease and to validate and update the predictive models created to date for metastatic axillary disease.
Patients and methodIn this retrospective study, we included all patients with a positive sentinel lymph node biopsy who underwent breast cancer surgery in our hospital in the last 10 years. We obtained 27 clinical/histopathological variables for each patient and univariate and multivariate statistical analyses were performed to evaluate the relationship between these variables and the presence of metastases in non-sentinel axillary nodes. We applied the main published predictive models (MSKCC, Stanford, Tenon, Meretoja single-center and multicenter models) to our population. The area under the receiver operating characteristic curve was calculated for each of the models.
ResultsThe variables significantly related to metastatic axillary disease were body mass index, macrometastases in the sentinel lymph node, single-focus, and extranodal spread. None of the predictive models was validated because all of them had low diagnostic discrimination, with areas below the curve lower than 0.7.
ConclusionsPredictive models for metastatic axillary disease in patients with a positive sentinel lymph node have low diagnostic accuracy in identifying low risk patients.
El 70% de las pacientes con ganglio centinela (GC) positivo no tendrán más metástasis en el resto de ganglios de la axila, lo que supone un porcentaje elevado de linfadenectomías innecesarias1–3. Para poder discriminar aquellas pacientes que podrían ahorrarse una cirugía axilar surgieron diferentes estudios aleatorizados.
Uno de ellos fue el encabezado por Giuliano4, que no encontró diferencias significativas en cuanto a supervivencia ni al intervalo libre de enfermedad entre 2 grupos aleatorizados de pacientes, uno al que se realizó linfadenectomía axilar y otro sin cirugía axilar. No obstante, este estudio incurrió en una serie de errores metodológicos importantes, por lo que ha sido ampliamente criticado5.
Sin embargo, otros autores decidieron investigar aquellas variables o factores de riesgo de diseminación metastásica axilar cuando el GC es positivo. Pero entre las diferentes poblaciones evaluadas no existía una variable de por sí independiente para la presencia de metástasis en los ganglios axilares no centinelas6–8. Por este motivo aparecieron los nomogramas.
Un nomograma es un modelo matemático que a partir de un análisis multivariante de las variables que son significativas en la población se construye una fórmula, cuyo resultado es la probabilidad de tener ganglios axilares metastásicos no centinelas. El primer nomograma construido para determinar la probabilidad de metástasis en ganglios axilares no centinelas siendo el GC positivo fue el desarrollado por el Memorial Sloan-Kettering Cancer Center (MSKCC)9. Posteriormente fueron construyéndose otros modelos predictivos como el modelo de Stanford10, Meretoja modelo unicéntrico11, Meretoja modelo multicéntrico12, Cambridge13 y Tenon14.
Estos modelos predictivos han obtenido resultados diversos al ser aplicados a diferentes poblaciones, encontrado estudios que los validan y otros que no. Este hecho nos llevó a cuestionarnos la utilidad de los nomogramas, es decir, no solo cuál de todos es el mejor, sino si realmente su resultado es aplicable sin tener en cuenta otros factores.
MétodosPacientesSe trata de un estudio retrospectivo llevado a cabo en un único centro, el Hospital Morales Meseguer (Murcia, España), con un área de referencia de 250.000 habitantes. Se registraron todas las pacientes atendidas consecutivamente tras diagnóstico de cáncer de mama (T1, T2) y estudio axilar clínico y radiológico±histológico negativo, a las que se les practicó biopsia selectiva de ganglio centinela (BSGC), de acuerdo a criterios de consenso de la Sociedad Española de Senología y Patología Mamaria (SESPM)15, desde octubre de 2002 hasta diciembre de 2011.
Se excluyeron aquellas pacientes con tamaño tumoral mayor de 5cm, afectación metastásica axilar ipsilateral confirmada (mediante técnica histológica), pacientes que recibieron neoadyuvancia, gestantes o en periodo de lactancia, con cirugía extensa previa sobre la mama/axila afecta y con contraindicación quirúrgica general.
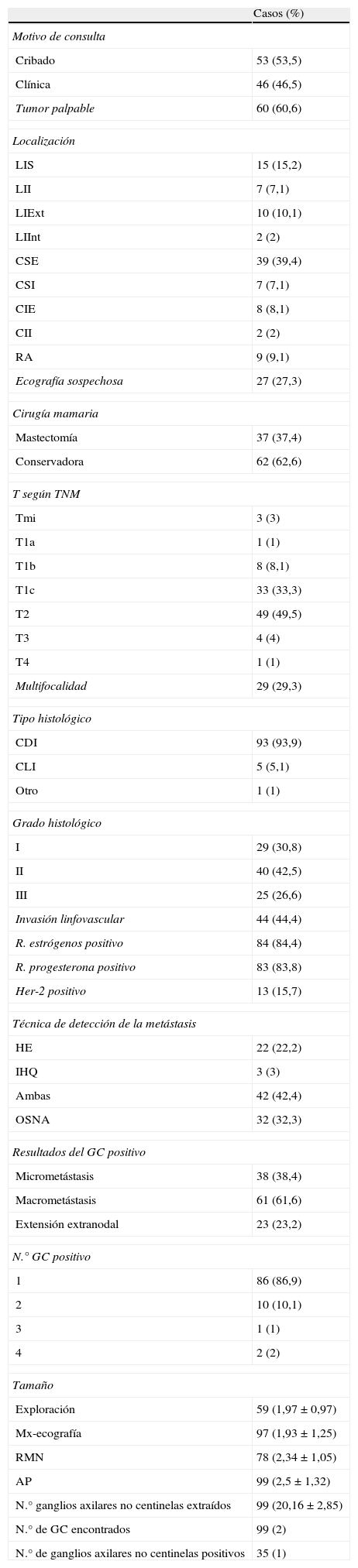
Las variables recogidas están descritas en la tabla 1.El estudio fue presentado en el Comité Ético del hospital.
Datos clínicos e histopatológicos de la serie
| Casos (%) | |
| Motivo de consulta | |
| Cribado | 53 (53,5) |
| Clínica | 46 (46,5) |
| Tumor palpable | 60 (60,6) |
| Localización | |
| LIS | 15 (15,2) |
| LII | 7 (7,1) |
| LIExt | 10 (10,1) |
| LIInt | 2 (2) |
| CSE | 39 (39,4) |
| CSI | 7 (7,1) |
| CIE | 8 (8,1) |
| CII | 2 (2) |
| RA | 9 (9,1) |
| Ecografía sospechosa | 27 (27,3) |
| Cirugía mamaria | |
| Mastectomía | 37 (37,4) |
| Conservadora | 62 (62,6) |
| T según TNM | |
| Tmi | 3 (3) |
| T1a | 1 (1) |
| T1b | 8 (8,1) |
| T1c | 33 (33,3) |
| T2 | 49 (49,5) |
| T3 | 4 (4) |
| T4 | 1 (1) |
| Multifocalidad | 29 (29,3) |
| Tipo histológico | |
| CDI | 93 (93,9) |
| CLI | 5 (5,1) |
| Otro | 1 (1) |
| Grado histológico | |
| I | 29 (30,8) |
| II | 40 (42,5) |
| III | 25 (26,6) |
| Invasión linfovascular | 44 (44,4) |
| R. estrógenos positivo | 84 (84,4) |
| R. progesterona positivo | 83 (83,8) |
| Her-2 positivo | 13 (15,7) |
| Técnica de detección de la metástasis | |
| HE | 22 (22,2) |
| IHQ | 3 (3) |
| Ambas | 42 (42,4) |
| OSNA | 32 (32,3) |
| Resultados del GC positivo | |
| Micrometástasis | 38 (38,4) |
| Macrometástasis | 61 (61,6) |
| Extensión extranodal | 23 (23,2) |
| N.° GC positivo | |
| 1 | 86 (86,9) |
| 2 | 10 (10,1) |
| 3 | 1 (1) |
| 4 | 2 (2) |
| Tamaño | |
| Exploración | 59 (1,97±0,97) |
| Mx-ecografía | 97 (1,93±1,25) |
| RMN | 78 (2,34±1,05) |
| AP | 99 (2,5±1,32) |
| N.° ganglios axilares no centinelas extraídos | 99 (20,16±2,85) |
| N.° de GC encontrados | 99 (2) |
| N.° de ganglios axilares no centinelas positivos | 35 (1) |
CIE: cuadrante inferoexterno; CII: cuadrante inferointerno; CSI: cuadrante superointerno; LIExt: línea intercuadrántica externa; LII: línea intercuadrántica inferior; LIInt: línea intercuadrántica interna; LIS: línea intercuadrántica superior; RA: retroareolar.
Las variables cualitativas se han expresado en número de casos y porcentaje. Las variables cuantitativas continuas se expresan como número de casos y entre paréntesis su media±desviación estándar. Las variables cuantitativas discretas se expresan como número de casos y entre paréntesis su mediana.
Los casos se obtuvieron a partir del cruce de datos perteneciente a 3 fuentes: del departamento de archivo e historias clínicas la base de datos (Winpat®) perteneciente al servicio de anatomía patológica y del archivo analógico e informático de los informes de alta del servicio de cirugía general y digestiva. Se obtuvieron los datos de cada variable a partir de la historia clínica de cada paciente.
- 1)
Diagnóstico y estadificación: Las pacientes fueron remitidas a la unidad de mama de nuestro hospital, bien desde atención primaria, por presentar clínica, bien desde el programa de cribado radiológico poblacional del cáncer de mama. Todas las pacientes fueron evaluadas por un radiólogo experto, que realizó un estudio diagnóstico completo (mamografía, ecografía±resonancia magnética y punción de la lesión). Una vez estadificada la neoplasia, y siendo el estudio axilar negativo, se procedió a la realización de la BSGC.
- 2)
Análisis del GC: Se realizó por 2 métodos equiparables entre sí16: a) diferido mediante tinción con hematoxilina-eosina e inmunohistoquímica para citoqueratinas (desde octubre de 2002 hasta mayo de 2009); y b) intraoperatorio con análisis mediante one-step nucleic acid amplification (OSNA) (a partir de mayo de 2009). A las pacientes con resultado de micro o macrometástasis en el GC se les realizó linfadenectomía axilar.
- 3)
Cirugía oncológica sobre la mama: Una vez extraído el GC se procedió a la cirugía sobre la mama afecta, bien conservadora, bien mastectomía. El espécimen se remitió al servicio de patología para su análisis (tamaño, infiltración linfovascular, grado nuclear según Bloom-Richardson17, tipo histológico, multifocalidad, receptores de estrógenos/progesterona positivo, HER-2 positivo/negativo, etc.). Definimos el HER-2 positivo cuando en su determinación obteníamos 3+ o FISH positivo; y HER-2 negativo cuando obteníamos 0, 1+ o FISH negativo.
- 4)
Aplicación de nomogramas y elaboración de receiver operating characteristic (característica operativa del receptor o curvas ROC): Una vez recogidas todas las variables se combinaron las mismas de forma que pudieran ser aplicadas a los principales nomogramas publicados.
- -
MSKCC9: las variables que en su población se asociaron de forma significativa con la presencia de metástasis en el resto de ganglios no centinelas axilares y, por tanto, con las que elaboraron el nomograma fueron invasión linfovascular, grado histológico nuclear17, método de detección de la metástasis, multifocalidad, positividad a receptores de estrógenos, número de GC positivos, número de GC negativos y tamaño histológico del tumor. A cada variable se le dio una puntuación, de forma que con el total de puntos que se obtienen de la suma de todas las variables se calculó la probabilidad de tener ganglios positivos en la axila. Para facilitar su uso los autores crearon una aplicación del nomograma en su página Web, que es la que hemos utilizado en nuestro estudio18.
- -
Stanford10: Modelo matemático compuesto por las siguientes variables: tamaño tumoral (TNM), invasión linfovascular y tamaño de la metástasis en el GC. El nomograma puede ser utilizado a través de su página Web19, como hicimos en nuestro trabajo.
- -
Tenon14: Las variables con las que obtuvieron mayor significación en su población y con las que construyeron el modelo fueron: el tamaño histológico tumoral, la macrometástasis en el GC y la proporción entre GC positivos frente al total de GC extraídos. Basados en los resultados del análisis multivariante, a cada variable se le otorgó una puntuación.
- -
Meretoja unicéntrico11: Empleando el modelo estadístico disponible en su artículo introdujimos las variables (diámetro tumoral y multifocalidad) específicas de cada paciente y obtuvimos el riesgo de metástasis individual en ganglios axilares no centinelas.
- -
Meretoja multicéntrico12: Aplicamos este nomograma a nuestra población, introduciendo, en el modelo disponible en su página Web20, las variables: significación del tamaño histológico del tumor, multifocalidad, prevalencia de metástasis en ganglios axilares no centinelas, invasión linfovascular, presencia de HER-2, tamaño de la metástasis en el GC, extensión extracapsular, número de GC positivos y negativos. Calculamos nuestra prevalencia de ganglios axilares no centinelas metastásicos.
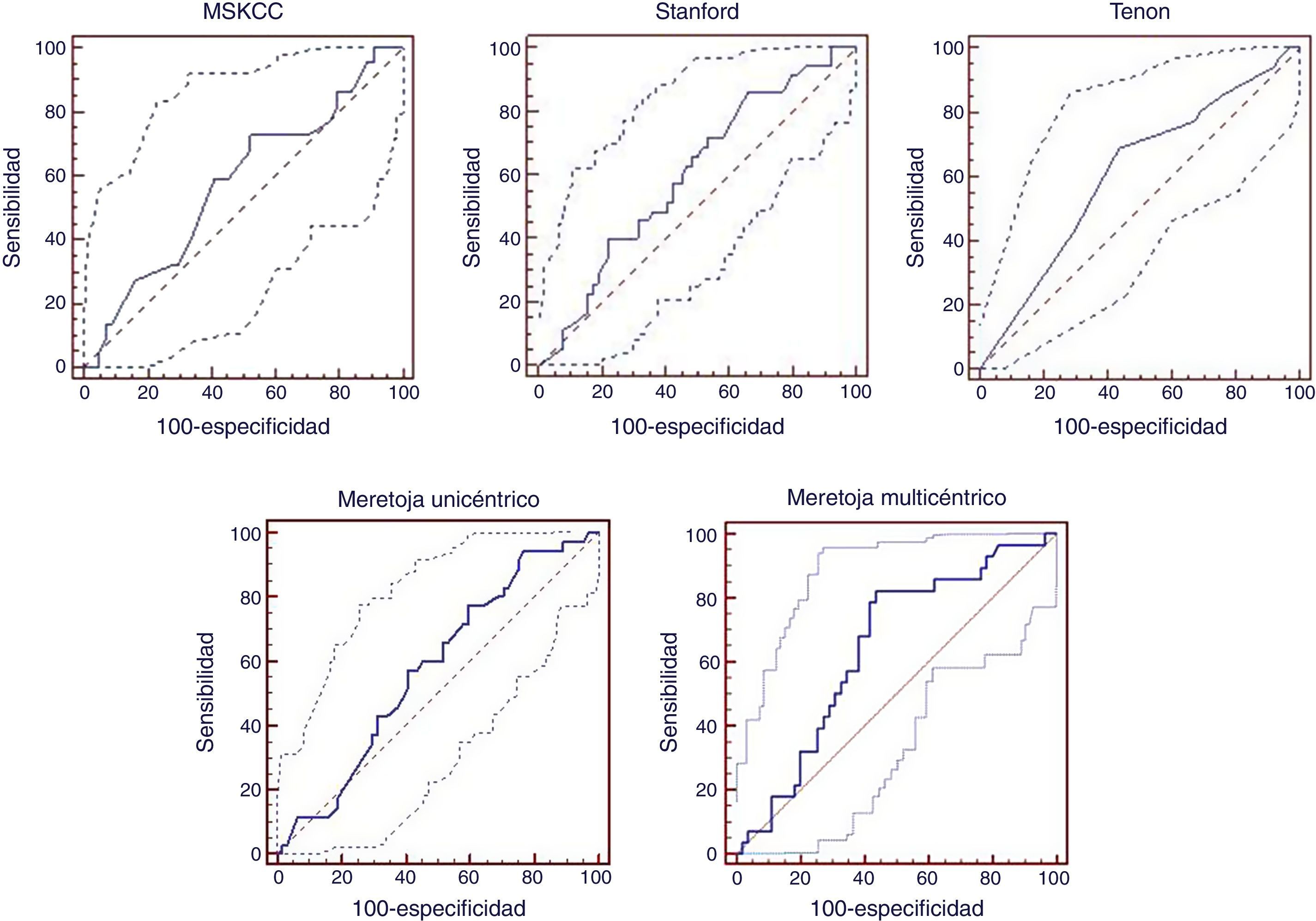
Se construyeron curvas ROC y se calculó al área bajo la curva (AUC) para cada uno de los nomogramas en nuestra población: una curva ROC es una representación gráfica de la sensibilidad frente a 1-especificidad de un test diagnóstico21. La curva ROC es independiente de la prevalencia de una enfermedad en la población. Recorriendo todo el rango de valores obtendremos una serie de pares sensibilidad-especificidad que definirán cada prueba diagnóstica. Se define el punto óptimo diagnóstico como el que tiene el mejor par sensibilidad-especificidad. La representación gráfica de todos estos puntos define la curva ROC. La elección del mejor modelo se realiza mediante la comparación del área bajo la curva (AUC) de ambos, en este caso, nomogramas. Esta área posee un valor comprendido entre 0,5 y 1, donde 1 representa un valor diagnóstico perfecto y 0,5 es una prueba sin capacidad discriminatoria diagnóstica (azar). Interpretaremos como un test con capacidad discriminativa diagnóstica aquel que tuviera un AUC>0,7.
5) Análisis estadístico: Las variables cuantitativas se expresaron como medias±desviación estándar y rango, y las cualitativas como frecuencias absolutas y relativas. Las comparaciones entre variables cualitativas se realizaron con el test de Chi cuadrado de Pearson o el test exacto de Fisher, y con el test de Chi cuadrado de tendencia lineal cuando una variable cualitativa de más de 2 opciones estaba ordenada. La comparación entre una variable cuantitativa y una cualitativa de 2 opciones se realizó mediante la prueba de «t» de Student o Mann Whitney según la distribución paramétrica o no de la variable cuantitativa. La selección de las variables predictores independientes de ganglios axilares no centinelas positivos fue realizada considerando la plausibilidad clínica, así como criterios estadísticos (valor p<0,1 en análisis univariante y teniendo en cuenta colinealidad). El valor predictivo de los diferentes nomogramas/modelos predictivos publicados fue analizado en nuestra población mediante la creación de curvas ROC con el cálculo del AUC y sus intervalos de confianza al 95%. Todos los contrastes se realizaron de forma bilateral. Se ha utilizado el paquete informático SPSS versión 17.0 para Windows.
ResultadosAnálisis descriptivoEntre 2002 y 2011 se realizaron 758 BSGC en nuestro hospital, de las que en 132 casos se obtuvo un resultado positivo (micro o macrometástasis). Se excluyeron 33 pacientes: 18 por neoadyuvancia previa, 13 por no realización de linfadenectomía axilar (comorbilidades del paciente), en un caso se realizó la cirugía en otro centro y otro caso no aceptó el tratamiento. Se realizó el estudio con 99 pacientes, con edad media de 55,48±18,3 años y un índice de masa corporal (IMC) medio de 27,05±4,3 (tabla 1). Nuestra prevalencia de metástasis en ganglios axilares no centinelas cuando el GC era positivo fue 35,35%.
Cabe destacar que la determinación de HER-2 no se realizó en los primeros 16 casos, pues no se contaba con la técnica en el hospital, por tanto, se parte de una población de 83 casos. A estas pacientes se procedió a la identificación convencional del HER-2 obteniendo 3+ (o positivo) en 9 casos, 0 o 1+ (o negativo) en 50 casos y 2+ (dudoso) en 24 casos. A estos 24 casos se les realizó la técnica FISH, encontrando que en 4 casos era positivo y en 20 la determinación de HER-2 era negativa. El total se encuentra representado en la tabla 1.
Hay 5 casos estadificados T3-T4 tras el estudio patológico de la pieza, que en el estudio radiológico preoperatorio fueron diagnosticados como T1-2.
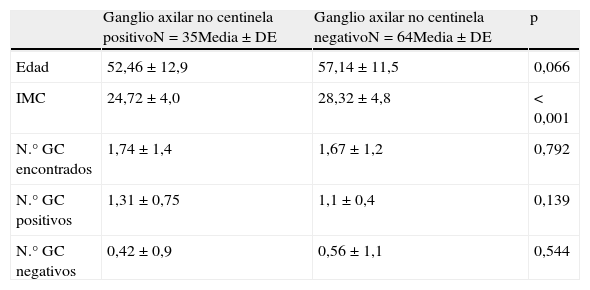
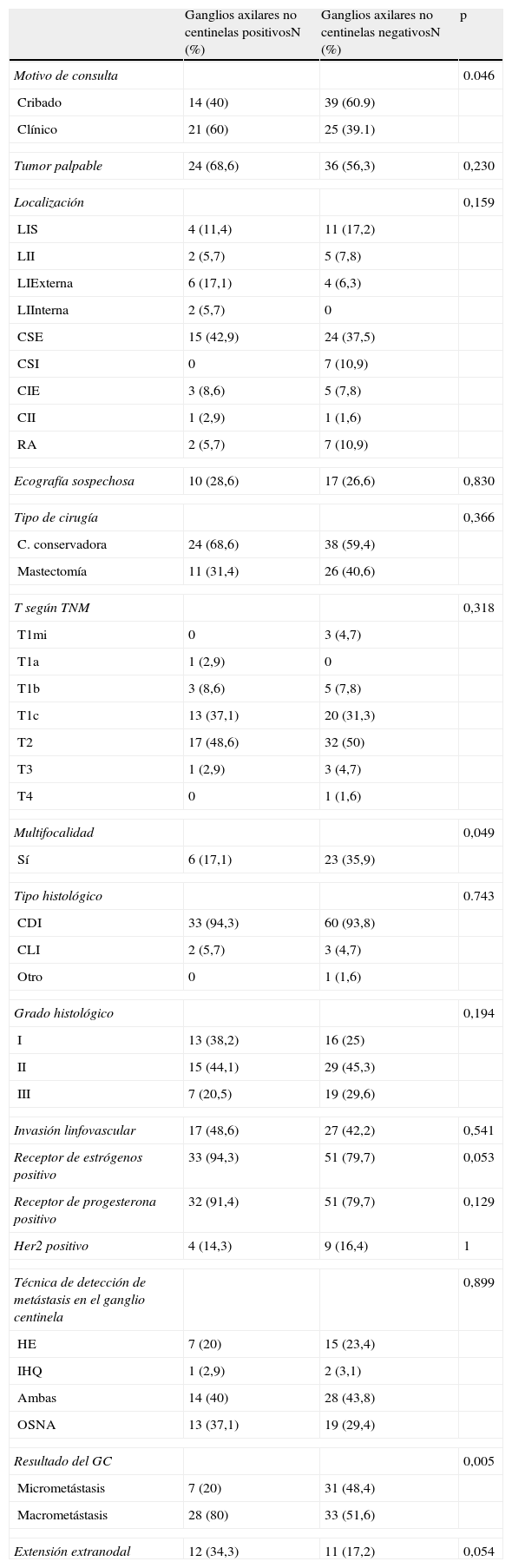
Análisis univarianteLa presencia de metástasis en los ganglios axilares no centinelas se relacionó de forma significativa con un menor IMC (tabla 2), con aquellas pacientes en las que el motivo de consulta fue la presencia de síntomas (tabla 3), con los tumores unifocales (tabla 3) y con la presencia de macrometástasis en el GC (tabla 3).
Análisis univariante de las variables cuantitativas
| Ganglio axilar no centinela positivoN=35Media±DE | Ganglio axilar no centinela negativoN=64Media±DE | p | |
| Edad | 52,46±12,9 | 57,14±11,5 | 0,066 |
| IMC | 24,72±4,0 | 28,32±4,8 | <0,001 |
| N.° GC encontrados | 1,74±1,4 | 1,67±1,2 | 0,792 |
| N.° GC positivos | 1,31±0,75 | 1,1±0,4 | 0,139 |
| N.° GC negativos | 0,42±0,9 | 0,56±1,1 | 0,544 |
GC: ganglio centinela: IMC: índice de masa corporal.
Análisis univariante de las variables cualitativas
| Ganglios axilares no centinelas positivosN (%) | Ganglios axilares no centinelas negativosN (%) | p | |
| Motivo de consulta | 0.046 | ||
| Cribado | 14 (40) | 39 (60.9) | |
| Clínico | 21 (60) | 25 (39.1) | |
| Tumor palpable | 24 (68,6) | 36 (56,3) | 0,230 |
| Localización | 0,159 | ||
| LIS | 4 (11,4) | 11 (17,2) | |
| LII | 2 (5,7) | 5 (7,8) | |
| LIExterna | 6 (17,1) | 4 (6,3) | |
| LIInterna | 2 (5,7) | 0 | |
| CSE | 15 (42,9) | 24 (37,5) | |
| CSI | 0 | 7 (10,9) | |
| CIE | 3 (8,6) | 5 (7,8) | |
| CII | 1 (2,9) | 1 (1,6) | |
| RA | 2 (5,7) | 7 (10,9) | |
| Ecografía sospechosa | 10 (28,6) | 17 (26,6) | 0,830 |
| Tipo de cirugía | 0,366 | ||
| C. conservadora | 24 (68,6) | 38 (59,4) | |
| Mastectomía | 11 (31,4) | 26 (40,6) | |
| T según TNM | 0,318 | ||
| T1mi | 0 | 3 (4,7) | |
| T1a | 1 (2,9) | 0 | |
| T1b | 3 (8,6) | 5 (7,8) | |
| T1c | 13 (37,1) | 20 (31,3) | |
| T2 | 17 (48,6) | 32 (50) | |
| T3 | 1 (2,9) | 3 (4,7) | |
| T4 | 0 | 1 (1,6) | |
| Multifocalidad | 0,049 | ||
| Sí | 6 (17,1) | 23 (35,9) | |
| Tipo histológico | 0.743 | ||
| CDI | 33 (94,3) | 60 (93,8) | |
| CLI | 2 (5,7) | 3 (4,7) | |
| Otro | 0 | 1 (1,6) | |
| Grado histológico | 0,194 | ||
| I | 13 (38,2) | 16 (25) | |
| II | 15 (44,1) | 29 (45,3) | |
| III | 7 (20,5) | 19 (29,6) | |
| Invasión linfovascular | 17 (48,6) | 27 (42,2) | 0,541 |
| Receptor de estrógenos positivo | 33 (94,3) | 51 (79,7) | 0,053 |
| Receptor de progesterona positivo | 32 (91,4) | 51 (79,7) | 0,129 |
| Her2 positivo | 4 (14,3) | 9 (16,4) | 1 |
| Técnica de detección de metástasis en el ganglio centinela | 0,899 | ||
| HE | 7 (20) | 15 (23,4) | |
| IHQ | 1 (2,9) | 2 (3,1) | |
| Ambas | 14 (40) | 28 (43,8) | |
| OSNA | 13 (37,1) | 19 (29,4) | |
| Resultado del GC | 0,005 | ||
| Micrometástasis | 7 (20) | 31 (48,4) | |
| Macrometástasis | 28 (80) | 33 (51,6) | |
| Extensión extranodal | 12 (34,3) | 11 (17,2) | 0,054 |
La asociación de un menor IMC, la presencia de macrometástasis y la extensión extranodal en el ganglio centinela se asoció significativamente con la presencia de metástasis en los ganglios axilares no centinelas (tabla 4).
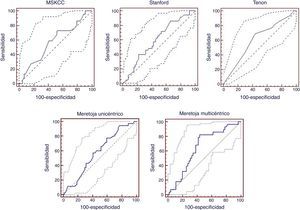
Aplicación de modelos predictivosLa aplicación del MSKCC obtuvo un AUC de 0,575 (IC 95%: 0,447-0,696). La aplicación del modelo de Stanford obtuvo un AUC de 0,601 (IC 95%: 0,497-0,698). El modelo de Tenon obtuvo un AUC de 0,607 (IC 95%: 0,504-0,704). El modelo de Meretoja unicéntrico obtuvo un AUC de 0,577 (IC 95%: 0,473-0,675). La aplicación del modelo de Meretoja multicéntrico obtuvo un AUC de 0,643 (IC 95%: 0,530-0,745) (fig. 1).
DiscusiónHasta un 70% de las pacientes con ganglio centinela (GC) positivo no presentarán otra metástasis en el resto de ganglios de la axila1–3. Por este motivo se han desarrollado nuevas herramientas (nomogramas y modelos predictivos) que ayuden a predecir qué pacientes se beneficiarían de una linfadenectomía axilar y cuáles no. Se han creado numerosos modelos predictivos y, sin embargo, hay divergencia en cuanto a sus resultados. Con nuestro estudio planteamos intentar validar los principales modelos y objetivar si realmente por sí solos podrían servir para la toma de decisiones.
Todo modelo predictivo es elaborado a partir de las variables que en el análisis multivariante son estadísticamente significativas en su población para la presencia de metástasis en ganglios axilares no centinelas. En nuestra población hemos obtenido como significativas un menor IMC, la presencia de macrometástasis en el GC y la extensión extranodal. Con respecto a la presencia de macrometástasis es una de las variables más estudiadas y la que presenta mayor concordancia entre los diferentes estudios para la presencia de ganglios no centinelas positivos6,8,22. La extensión extranodal de la metástasis en el GC es una variable que en general obtiene una relación significativa6–8,22, además parece lógico pensar que si la metástasis en el GC ha sobrepasado su cápsula, tiene mayor agresividad para producir una diseminación ganglionar. La asociación entre un menor IMC y la presencia de metástasis en ganglios axilares no centinelas podría haber sido importante hace unos años cuando el diagnóstico se realizaba en el momento en que la paciente acudía por síntomas, siendo neoplasias en estadios muy avanzados, con el síndrome constitucional que asociarían. No obstante, dados los métodos de diagnóstico actual consideramos un hecho casual la relación entre el IMC y la afectación axilar.
Al aplicar los modelos predictivos del MSKCC9, Stanford10, Tenon14 y el de Meretoja unicéntrico11 a nuestra población obtuvimos que ninguno de ellos podía ser validado, pues sus valores de AUC incluían el valor del azar en todos los casos. Nuestro estudio revela las discordancias que existen entre las diferentes publicaciones. Así, para el modelo del MSKCC hay trabajos que lo validan, obteniendo AUC>0,723–26, pero otros que no27–30. Para el modelo de Stanford podemos encontrar una situación similar con poblaciones donde es validado23,28,29,31 y poblaciones donde no27,30,32,33. Cabe destacar que el modelo de Tenon14, en general, los diferentes estudios no lo validan30,31,33, quizás porque contaron con una población pequeña o el propio modelo no realizó una validación en su propia población. Con respecto al modelo unicéntrico de Meretoja11 no hemos encontrado otras publicaciones que lo hayan aplicado, por lo que dados nuestros resultados no recomendamos su uso.
Esta divergencia en cuanto a resultados podría ser debida a que las variables significativas para la presencia de metástasis axilares cuando el GC es positivo son diferentes para cada población. Porque todo nomograma se elabora a partir de unas variables significativas obtenidas en el análisis multivariante. Si la población sobre la que se realiza la validación presenta esos mismos factores de riesgo, entonces, obtendrá buena capacidad discriminatoria diagnóstica; si por el contrario, son diferentes, se obtendrá un test con poca capacidad discriminatoria diagnóstica. Este hecho motivó a Meretoja para realizar un modelo multicéntrico e internacional que unificase dichas variables18. Así, este modelo presentaba las características necesarias para esclarecer los factores de riesgo de metástasis en ganglios no centinelas y, a su vez, ser el modelo predictivo definitivo. Sin embargo, a pesar de ser internacional, multicéntrico, de contar con 1.000 pacientes y de una correcta validación interna y externa, presenta unos amplios intervalos de confianza para la AUC, pudiendo variar desde un test con nula capacidad discriminatoria diagnóstica hasta un test muy bueno, según el hospital. Al aplicarlo a nuestra población observamos que el intervalo de confianza incluye el azar (AUC=0,5), por tanto, no tiene capacidad discrimatoria diagnóstica. Este resultado no es muy alentador, ya que no se diferencian del resto de AUC obtenidas con los modelos predictivos anteriores.
Se puede pensar que el modelo multicéntrico de Meretoja no ha podido ser validado en nuestro estudio, quizás porque nuestra población no sea lo suficientemente grande; pero esto es rebatible porque hay centros que realizaron la validez externa o interna contando con menos de 50 pacientes, y además, el reclutamiento es lento porque es una población muy seleccionada, no solo por las condiciones de la paciente, sino porque la prevalencia de GC positivo es baja (un 21,06% en nuestra población).
Por tanto, si sabemos que los modelos predictivos no tienen capacidad discrimatoria diagnóstica buena (es decir, su AUC menor de 0,7), y que además sus resultados varían según la población donde se realicen34, nos planteamos una nueva cuestión: ¿son realmente útiles los modelos matemáticos predictivos de metástasis en ganglios no centinelas? Consideramos que los modelos predictivos elaborados no son definitivos porque las variables relacionadas con la diseminación metastásica en ganglios no centinelas varían de una población a otra, a diferencia de lo que ocurre en otras enfermedades, como en el melanoma35. Ya hay grupos que consideran que los nomogramas no tienen suficiente valor predictivo por sí solos, y que son una herramienta más a tener en cuenta en el tratamiento individualizado de cada paciente36–39.
La principal limitación de este trabajo radica en que se trata de un estudio retrospectivo realizado sobre un tamaño muestral moderado, a pesar de un periodo de inclusión de 10 años. Hay que subrayar que en nuestra población se realiza el estudio axilar mediante ecografía±punción, lo que selecciona aún más a las pacientes.
Ante estos resultados concluimos que los diferentes modelos predictivos por sí solos no son una herramienta útil para la toma de decisiones, por lo que recomendamos evaluar los principales nomogramas en cada población y aplicar aquel que mejor se adapte, es decir, el que obtenga mejor AUC, y tomar una decisión basándose no solo en sus resultados, sino teniendo en cuenta otras características de la paciente/tumor.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autoría- 1.
Participación en la concepción y diseño, la adquisición de los datos, el análisis e interpretación de los datos del trabajo que ha dado como resultado el artículo en cuestión: Maria Pilar Guillén Paredes y Andrés Carrillo Alcaraz.
- 2.
Participación en la redacción del texto y en las posibles revisiones del mismo: Maria Pilar Guillén Paredes, Luis Carrasco González y Jose Luis Aguayo Albasini.
- 3.
Aprobación de la versión que finalmente va a ser publicada: Maria Pilar Guillén Paredes, Luis Carrasco González y Jose Luis Aguayo Albasini.
Los autores declaran no tener ningún conflicto de intereses.