La degeneración cerebelosa paraneoplásica (DCP) es un síndrome poco frecuente y de difícil diagnóstico. Suele presentarse meses o años antes de la aparición de una neoplasia curable y, menos frecuentemente, ocurre en pacientes con una neoplasia conocida o como forma de recidiva. Su asociación con el cáncer de mama es poco frecuente.
Presentamos el caso de una paciente de 59 años que desarrolló una DCP, sin identificación del tumor primario. Tras casi año y medio de seguimiento y estudio, se diagnosticó un carcinoma ductal infiltrante de mama, mediante pruebas de imagen, que hasta el momento habían sido rigurosamente normales.
Paraneoplastic cerebellar degeneration (PCD) is an uncommon and difficult-to-diagnose syndrome. This syndrome usually presents months or years before a curable neoplasm develops and, less frequently, in patients with a known or recurrent tumor. The association of PCD with breast cancer is very rare.
We present the case of a 59-year-old woman who developed a PCD, without identification of the primary tumor. After almost a year and a half of follow-up, an infiltrating ductal breast carcinoma was diagnosed with imaging tests, which had previously been strictly normal.
Los trastornos neurológicos paraneoplásicos (PND) son un grupo de entidades raras y poco frecuentes, asociados a cáncer, que pueden afectar a cualquier parte del sistema nervioso1. Sus causas y patogenia no están bien establecidas. No están causados por metástasis o invasión directa del tumor. Actualmente la hipótesis más aceptada es una alteración inmunológica originada por ciertos tumores al expresar antígenos similares o idénticos a proteínas de origen exclusivamente neuronal, por lo que reciben el nombre de antígenos onconeuronales1.
Los PND asociados a cáncer de mama son raros y suelen ocurrir meses o años antes del diagnóstico. Estos incluyen la degeneración cerebelar, neuropatía sensitiva y motora, encefalitis límbica, ataxia opsoclónica-mioclónica, el síndrome de miastenia Lambert-Eaton y el síndrome de stiff-man2.
La degeneración cerebelosa paraneoplásica (DCP) se caracteriza por un cuadro prodrómico de mareo, oscilopsia, visión borrosa o doble, náuseas y vómitos. Días o semanas después aparece disartria, ataxia de la marcha y de las extremidades y disfagia1,2. Esta clínica tiene una aparición y progresión rápidas, en semanas o meses, pudiendo causar una invalidez severa irreversible3–5.
De forma global, los PND clínicamente incapacitantes se observan en el 0,01 a 1% de todos los cánceres6 y, según algunas series, en el 1% de los cánceres de mama específicamente2,6.
El diagnóstico de DCP se realiza al excluir otras causas como invasión directa del tumor o metástasis, infección, alteraciones hidroelectrolíticas, alteraciones metabólicas y vasculares o efectos del tratamiento de tumores conocidos7. Entre los tumores asociados a DCP destacan el cáncer de células pequeñas de pulmón (el más frecuente), el timoma, el carcinoma y teratoma de ovario, el cáncer de mama, los tumores testiculares y el linfoma de Hodgkin1,4,6,8,9.
La presencia de un anticuerpo determinado en suero puede orientar sobre el origen de la neoplasia. Así, la presencia de anticuerpos anti-Yo se relaciona con neoplasia de origen mamario-ginecológico hasta en un 95%3,10–13; también se ha relacionado en menor medida con los anticuerpos anti-Ri y anti-Tr9,13,14.
El interés del caso que se presenta reside en que, aun siendo baja la incidencia de los PND, los tumores que con más frecuencia los producen (pulmón, mama, linfomas y ovario) tienen una alta prevalencia. Debemos conocerlos sabiendo que en muchas ocasiones el tipo de síndrome paraneoplásico sugiere la localización tumoral primaria. La presencia de determinados anticuerpos puede orientarnos sobre la neoplasia de base. La sospecha deber ser alta ante cualquier cuadro clínico compatible. Establecer un diagnóstico precoz del mismo puede cambiar el pronóstico de la paciente.
Caso clínicoPresentamos una mujer de 59 años sin antecedentes personales ni familiares de interés, que acudió a nuestro centro por un cuadro de 5 días de evolución caracterizado por cefalea, náuseas, visión borrosa de inicio agudo, sin diplopía, con inestabilidad de la marcha y lateralización a la derecha.
Exploración física: tensión arterial 173/100, afebril, rítmica a 94 latidos por minuto. Murmullo vesicular conservado. Consciente y orientada. Lenguaje normal. Campimetría normal. Pupilas isocóricas normorreactivas. Nistagmo horizontorrotatorio y vertical, más evidente con la mirada hacia la derecha. Leve dismetría en miembros derechos. Marcha atáxica con lateralización a la derecha. Romberg positivo. Resto de la exploración neurología, normal.
El hemograma, la bioquímica y la coagulación eran normales. Se realizaron serologías para lúes, Brucella, Mycoplasma, virus de las hepatitis B y C, que fueron negativas. Serología para CMV: IgM positivo con IgG (147U/ml en 2 determinaciones). TSH 0,04μU/ml. T4 2,1ng/dl. Urocultivo positivo para Proteus mirabillis. Los marcadores tumorales CA 125, CA 15,3, CA 19,9 y CEA fueron negativos. Se realizaron 3 punciones lumbares con 6 días de intervalo entre ellas, de las que se obtuvo un líquido cefalorraquídeo (LCR) claro con celularidad moderada (entre 17 y 49×106 células), aumento moderado de proteínas (entre 51,7 y 69mg/dl) y sin consumo de glucosa. Los cultivos de LCR fueron negativos. Bandas oligoclonales en suero y LCR negativas. PCR para Mycobacterium, Borrelia y Herpes simple tipo i en LCR negativa. PCR de virus neurotropos en LCR negativa. Citología para células tumorales malignas en LCR negativa. En el citospin de LCR se observaron linfocitos de aspecto inmaduro.
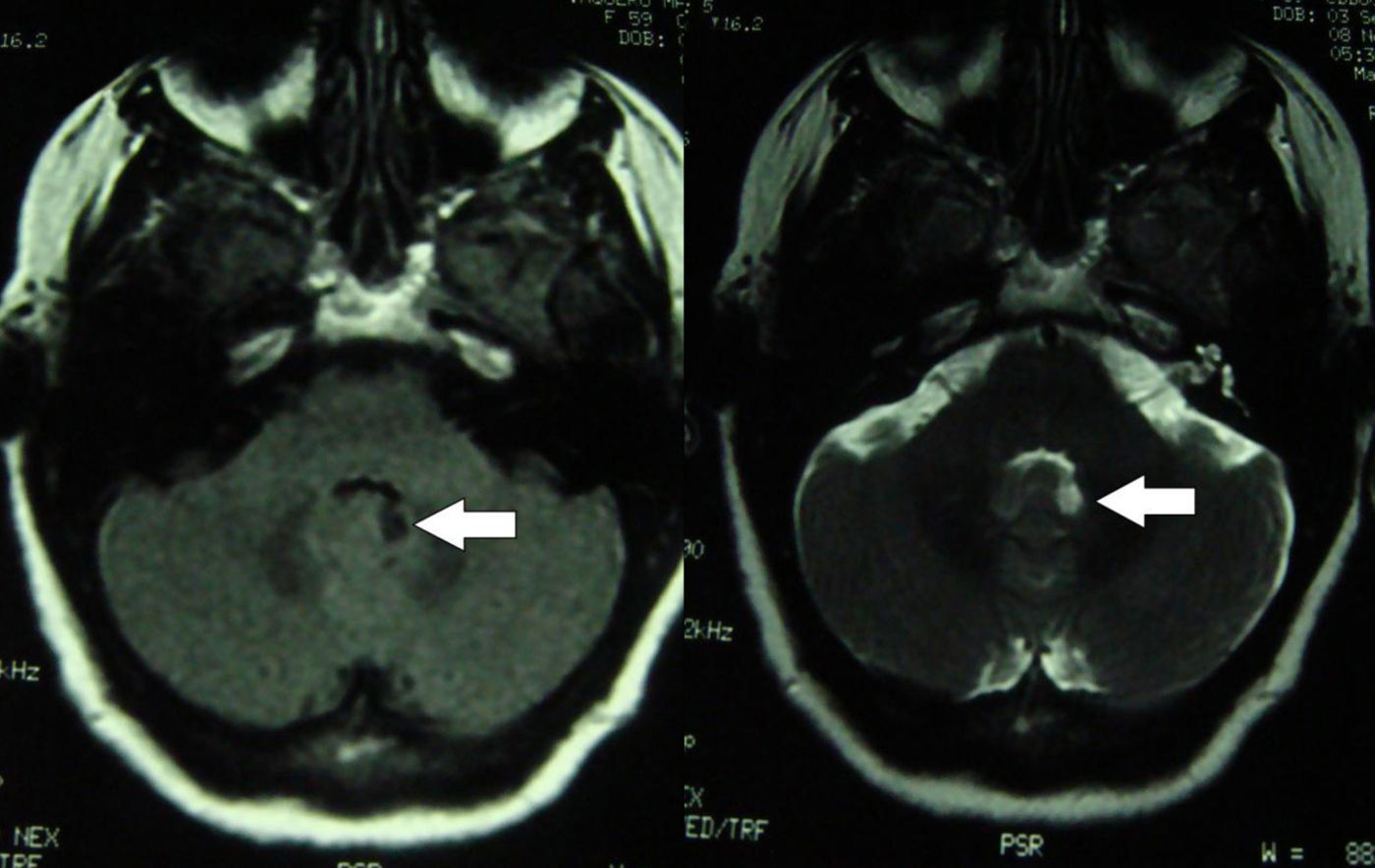
Se realizó estudio de neuroimagen con tomografía axial computarizada (TC) normal y resonancia magnética (RM) que objetivó dudosa lesión focal en el nódulo izquierdo del vérmix cerebeloso (fig. 1).
Ante la sospecha de DCP se determinaron anticuerpos anti-Hu y anti-Ri, que fueron negativos. Los anticuerpos anti-Yo fueron positivos en suero y LCR.
Se inició un estudio de neoplasia oculta con mamografía bilateral, sin objetivar alteraciones radiológicas de malignidad. La ecografía mamaria bilateral no mostró alteraciones. La ecografía intravaginal fue normal y la citología ginecológica fue negativa. La TC toracoabdominopélvica detectó un probable bocio multinodular y quistes simples en el lóbulo hepático izquierdo. Los ovarios y el útero eran normales. La tomografía por emisión de positrones (PET) mostró solo hipercaptación a nivel de L1.
Se instauró tratamiento con corticoides, plasmaféresis e inmunoglobulinas, sin mejoría clínica evidente. Presentó un rash cutáneo en región cervical anterior que se interpretó como cuadro alérgico y que cedió tras la administración de corticoides, produciendo una diabetes corticoidea. Durante el ingreso la paciente presentó un deterioro progresivo con somnolencia, disartria severa, disfagia a líquidos, limitación de ambas visiones laterales con diplopía y nistagmo vertical en todas las direcciones de la mirada, y dismetría de las 4 extremidades de predominio derecho. La ataxia era severa. Precisó sonda vesical por retención urinaria. Dado que el 95% de las DCP que presentan anticuerpos anti-Yo son de origen mamario o ginecológico, quedó a cargo de nuestro servicio para estudio de neoplasia oculta3,10–12.
Tras un año y medio de estudio, con todos los resultados negativos, se evidenció aumento de los marcadores tumorales CA 125: 64,4 (normal 0-35U/ml) y CA 15,3: 28,1 (normal 0-25U/ml). El CA 19,9 y el CEA 1,5 fueron normales.
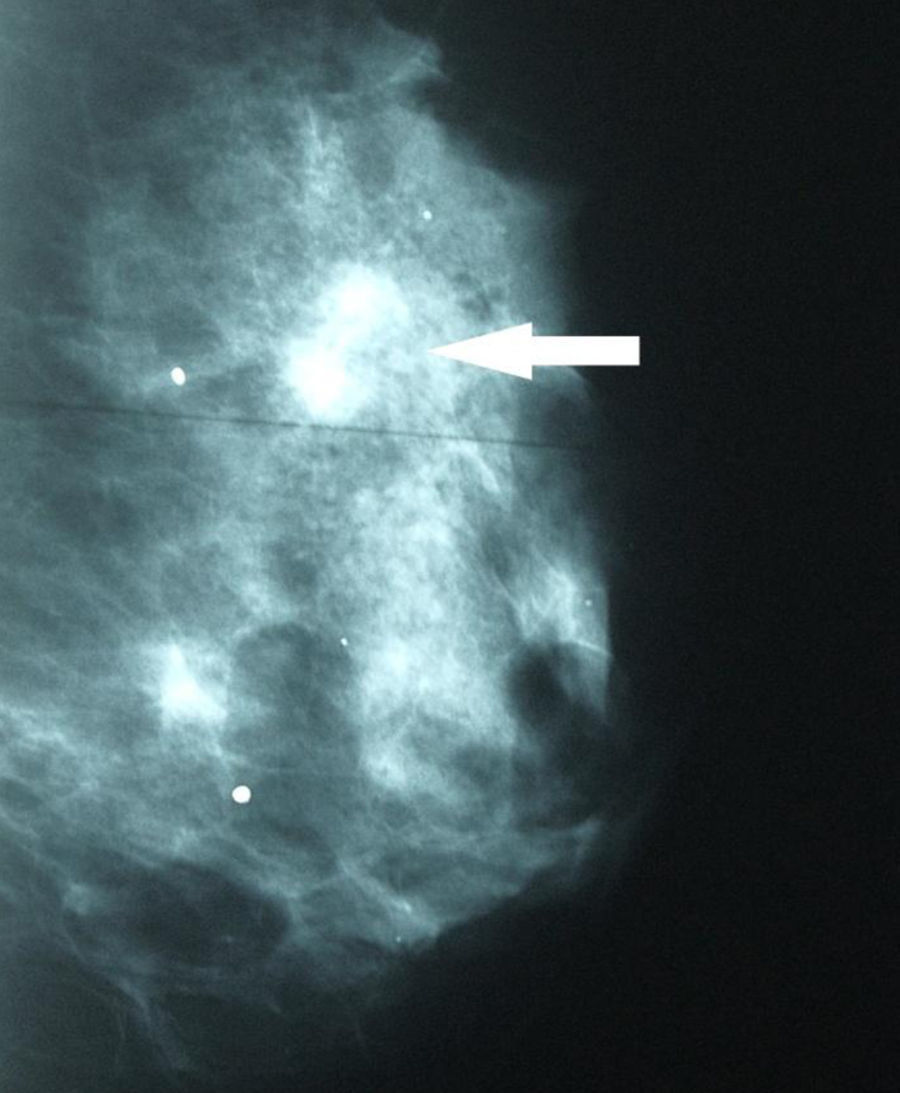
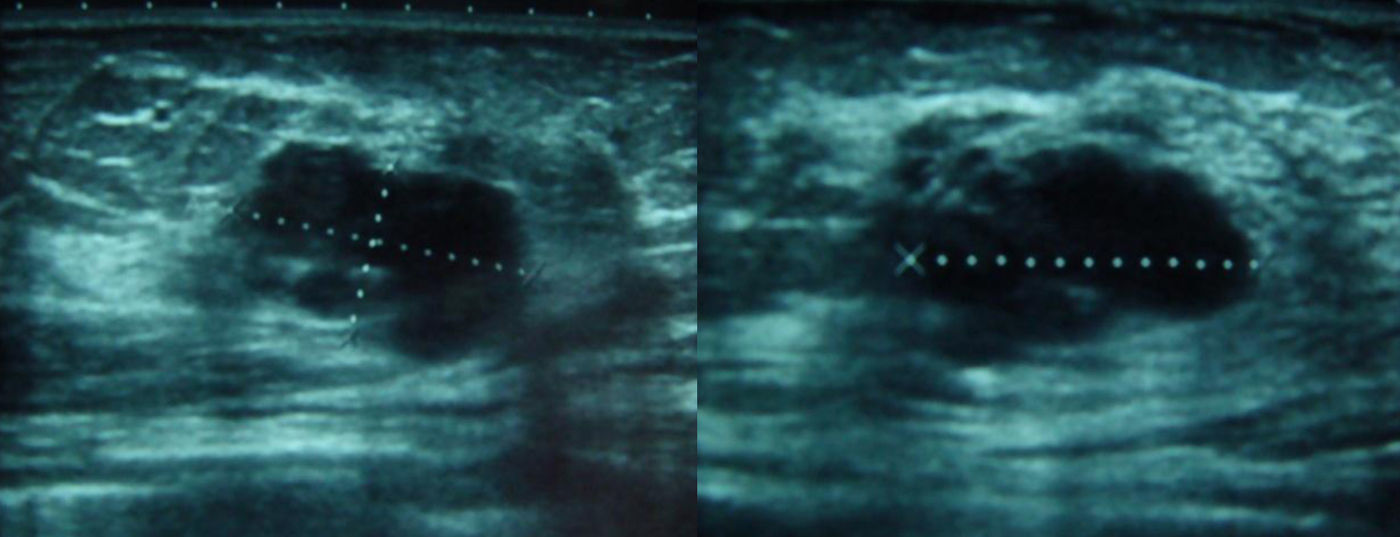
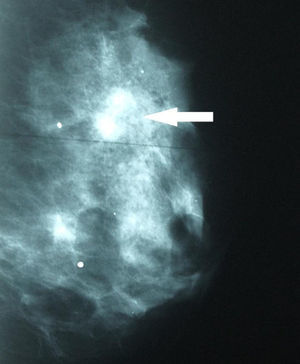
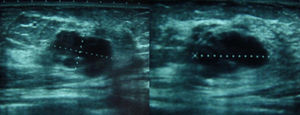
Se solicitaron nuevas pruebas de imagen. En la mamografía se observó un aumento de densidad mal definido en cuadrante superior externo (CSE) de la mama izquierda, con microcalcificaciones asociadas que no se habían visto en el estudio previo (fig. 2). La ecografía confirmó una masa en CSE de mama izquierda de 2,3×1,3x×2,2cm, sólida, hipoecoica, lobulada, compatible con neoplasia (fig. 3). En la axila izquierda se apreciaron 3 ganglios que no mostraron alteraciones ecográficas. Se completó el estudio mediante biopsia con aguja gruesa, con el resultado de carcinoma ductal infiltrante (CDI). La TC toracoabdominopélvica informó de lesión que superaba los 2cm de diámetro en CSE de mama izquierda.
Se decidió realizar tratamiento quirúrgico practicándose mastectomía radical tipo Madden. El estudio anatomopatológico demostró un CDI pobremente diferenciado de alto grado citológico con rasgos medulares incompletos. Un ganglio fue positivo de 8 aislados. Los receptores estrogénicos y de progesterona fueron negativos. La inmunotinción de proteína p53 fue positiva en un 80% de los núcleos de las células tumorales. El HercepTest® fue positivo y el Ki-67 positivo en un 67%.
Con el diagnóstico de CDI de mama izquierda G3 pT2 pN1 M0, triple negativo, se instaura tratamiento citostático con CAELYX 50mg/m2, ciclos de administración cada 28 días. La paciente presentó una ligera disminución de la estabilidad, permaneciendo con nistagmo, disartria, dismetría, ataxia severa y sin capacidad para realizar sola las actividades diarias.
DiscusiónLa DCP pertenece a un grupo de síndromes paraneoplásicos neurológicos causados por los efectos a distancia de un tumor. Puede afectar a cualquier parte del sistema nervioso, presentándose como cuadros neurológicos diversos1. Se presenta clínicamente con ataxia de las extremidades, incoordinación de la marcha, disartria y disfagia, usualmente acompañado de nistagmo, diplopía, vértigo, pérdida auditiva de tipo sensorial y alteraciones de los movimientos oculares1.
Debido a la dificultad de diagnosticar DCP y a la ausencia de estudios específicos, la incidencia y prevalencia exactas son desconocidas. No obstante es una complicación rara, apareciendo en menos del 0,01% de los pacientes diagnosticados con cáncer15. En un 70% de los casos los síndromes neurológicos preceden al diagnóstico oncológico16. En nuestro caso se trata de una paciente sin antecedentes, que comenzó con una DCP progresiva sin evidencias de tumor primario y que, tras año y medio de estudio, fue diagnosticada de carcinoma de mama.
La patogenia exacta de DCP no es del todo conocida. Se cree que está mediada por el sistema inmunitario. Anticuerpos identificados como causantes de DCP son el anti-Hu, anti-Yo, anti-PCA2, anti-Tr, anti-Ri, anti-mGluR1, anti-Zin4, anti-CV2/CRMP5, anti-VGCC y anti-ANNA3. Los anticuerpos anti-Yo, también conocidos como anticuerpos de células de Purkinje tipo 1 o PCA-1, son los que se identifican con mayor frecuencia en los cánceres ginecológicos y de mama, seguidos de anti-Hu, anti-Tr y anti- Ri9. Los anticuerpos anti-Yo se dirigen contra el antígeno CDR2, también conocido como proteína neuronal de Purkinje. Un 22% de los cánceres de mama y más del 50% de los de ovario expresan el antígeno CDR217. Los anticuerpos anti-Yo inhiben la proteína CDR2 llevando a las células de Purkinje a apoptosis celular no regulada5,13. Estos anticuerpos pueden encontrarse en suero o LCR, como ocurre en el caso que presentamos.
Para el diagnóstico de DCP necesitamos descartar previamente otras causas como invasión directa tumoral o metástasis, infección, alteraciones hidroelectrolíticas, alteraciones metabólicas o vasculares y efectos del tratamiento18. El diagnóstico se confirmaría, bien hallando el cáncer asociado, bien mediante la presencia en suero o LCR de anticuerpos contra antígenos onconeurales19. Estos últimos no son necesarios para el diagnóstico3, si bien la dificultad diagnóstica se incrementa cuando son negativos, como ocurre en más del 64% de los cánceres de mama-ginecológicos, bien por presentar anticuerpos contra otros epítopos, bien por niveles no detectables10,11.
Aunque la presencia de anticuerpos anti-Yo se asocia a cáncer de mama o ginecológico en más del 95% de los casos3,10–13, estos no son patognomónicos. Los títulos de anticuerpos en suero o LCR no se correlacionan con el curso de la enfermedad3,5.
En fases iniciales, la RM cerebral puede ser normal. En algunos pacientes se ha advertido un aumento de contraste, de tipo transitorio, de la corteza cerebelosa. Posteriormente, en la RM típicamente se observa atrofia del cerebelo. El trastorno es consecuencia de la degeneración extensa de las células de Purkinje, con ataque variable de otras neuronas de la corteza cerebelosa, núcleos profundos del cerebelo y haces espinocerebelosos6,20. En nuestro caso, la RM refleja una hipercaptación focal, más marcada en T2, en vérmix cerebeloso izquierdo, sin otras alteraciones. No fue repetida posteriormente por deseo de la familia.
El LCR suele mostrar pleocitosis, especialmente en fases iniciales, proteínas aumentadas y secreción intratecal de IgG con bandas oligoclonales hasta en el 83% de los casos, y pudiendo persistir a lo largo de la enfermedad20,21.
En nuestro caso, dada la presencia de anticuerpos anti-Yo, y su elevada asociación a cáncer ginecológico y de mama, se inició el estudio con mamografía y ecografía, que resultó negativo. Se solicitó PET-TC, que también fue negativa. Año y medio más tarde, se detectó una masa en CSE de mama izquierda. La mamografía revela el cáncer de mama o infiltrado de ganglios linfáticos en el 83% de las pacientes con DCP y cáncer de mama13.
Para el tratamiento de la DCP se han propuesto terapias con inmunosupresores, plasmaféresis y metilprednisolona, que no han demostrado mejoría del cuadro neurológico ya que, cuando se instauran, se han producido pérdidas neuronales masivas e irreversibles1,22. Algunas publicaciones proponen como única forma de estabilizar o mejorar clínicamente los síntomas neurológicos, el tratamiento antineoplásico mediante cirugía o quimioterapia23.
El diagnóstico precoz y la instauración de tratamiento con quimioterapia y plasmaféresis describen respuestas clínicas y mejoría del déficit neurológico hasta en un 30% de los casos11,22,24. Las situaciones asociadas con un déficit neurológico más grave fueron también las más refractarias al tratamiento16. En cualquier caso, la literatura no aporta datos suficientes como para instaurar tratamiento empírico a todas las pacientes. La supervivencia tras el diagnóstico fue significativamente peor en pacientes con anticuerpos anti-Yo (media de 13 meses) o anti-Hu (media de 7 meses), que en los pacientes con anticuerpos anti-Tr (media de 113 meses) o anti-Ri (media de 69 meses)16. Las pacientes que recibieron el tratamiento antitumoral, con o sin inmunoterapia, vivieron significativamente más tiempo que aquellas que no lo recibieron9.
En conclusión, la DCP es una entidad infrecuente, y de difícil diagnóstico. La presencia de este síndrome, y la detección de anticuerpos anti-Yo (en suero o LCR), nos harán sospechar una neoplasia de origen ovárico o mamario. Excepcionalmente se han encontrado anticuerpos anti-Ri y anti-Tr en el cáncer de mama. La evolución de este síndrome provoca pérdida neuronal irreversible siendo, por tanto, el diagnóstico precoz y el tratamiento fundamentales en el pronóstico. No hay terapias específicas para el DCP que demuestren mejoría clínica. El tratamiento consiste en tratar el tumor primario causante de la DCP.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.