Analizar las recidivas de las pacientes diagnosticadas, tratadas y seguidas en nuestro centro por carcinoma ductal in situ de mama, y establecer qué variables se asocian a un mayor riesgo de desarrollarlas.
Pacientes y métodosSe ha realizado un estudio descriptivo retrospectivo de los casos de carcinoma ductal in situ diagnosticados y tratados en nuestro centro desde enero de 1999 hasta enero de 2012. Se excluyeron los casos en que coexistía componente infiltrante y aquellos con antecedente de neoplasia y/o radioterapia previa en la mama afecta. Las variables que se analizaron fueron: la edad de la paciente, el tamaño tumoral, el grado nuclear, el estado de los márgenes quirúrgicos, el tipo de cirugía y el tratamiento complementario (radioterapia y hormonoterapia).
ResultadosSe estudiaron 162 casos de carcinomas in situ en el periodo 1999-2012. De estos, 117 (72,2%) fueron tratados con cirugía conservadora y 45 (27,7%) mediante mastectomía. Se produjeron 16 recidivas (9,9%) en el periodo estudiado. No se encuentran diferencias estadísticamente significativas en la tasa de recidivas en función del tamaño tumoral, la distancia quirúrgica al margen, el grado histológico ni la edad de la paciente. En el subgrupo de pacientes tratadas con tumorectomía, la supervivencia libre de enfermedad fue mayor en las que recibieron de forma complementaria radioterapia y hormonoterapia que en aquellas que solo recibieron uno o ninguno de los tratamientos (p=0,001).
ConclusiónEn el subgrupo de pacientes con carcinoma in situ tratadas con tumorectomía el riesgo de recidiva es 19 veces superior en los casos que no recibieron ningún tratamiento complementario que en aquellos tratados con tumorectomía, radioterapia y hormonoterapia (p=0,001).
To analyse recurrences in patients diagnosed, treated and followed up in our centre for ductal carcinoma in situ and to identify the variables associated with an increased risk of their development.
Patients and methodsWe performed a retrospective study of cases of ductal carcinoma in situ diagnosed and treated in our hospital from January 1999 to January 2012. We excluded cases with coexistence of an infiltrating component, a history of neoplasia, and/or prior radiation to the affected breast. The variables analysed were patient age, tumour size, nuclear grade, surgical margin status, type of surgery, and adjuvant therapy (radiation and hormone therapy).
ResultsWe studied 162 cases of ductal carcinoma in situ occurring between 1999 and 2012. Of these, 117 cases (72.2%) were treated with conservative surgery and 45 (27.7%) by mastectomy. In that period, we found 16 recurrences (9.9%). We found no statistically significant difference in the recurrence rate according to tumour size, surgical distance from the margin, histological grade, or patient age. In the subgroup of patients treated with lumpectomy, disease-free survival was higher in patients receiving radiation therapy and hormone therapy as a complementary treatment than in those who received only one or no treatment at all (P=.001).
ConclusionIn the subgroup of patients with ductal carcinoma in situ treated with lumpectomy, the recurrence risk was 19 times higher in patients who received no adjuvant treatment than in those treated with lumpectomy, radiation and hormone therapy (P=.001).
Las lesiones precursoras del cáncer de mama como el carcinoma ductal in situ, también llamado carcinoma intraductal (CID), son aquellos cambios epiteliales confirmados histológicamente que condicionan un mayor riesgo de desarrollar una lesión maligna1. En el caso del CID, la lesión se encuentra limitada por la membrana basal sin infiltrar el estroma y sin alcanzar los vasos2–4. Por su parte, el carcinoma lobulillar in situ, también considerado una lesión neoplásica intraepitelial, indica un riesgo de desarrollar un cáncer infiltrante, tanto en la mama ipsilateral como en la contralateral, estimado en un 25% a los 20 años aproximadamente1.
El CID representa el 20-30% de los casos de neoplasias detectadas por mamografía y el 10% del total de los carcinomas de mama, siendo la mortalidad global del 1-2%.
La base del tratamiento en el CID es la cirugía, aceptándose en nuestros días la posibilidad de tratamiento conservador si este no compromete la cosmética quirúrgica. Para ello, ha de existir una buena correlación entre el tamaño de la mama y de la pieza quirúrgica a extirpar, consiguiendo además unos márgenes quirúrgicos libres de lesión. Esto es debido a que los estudios más importantes hasta la fecha parecen evidenciar que la recurrencia tumoral está directamente asociada a la afectación o no de los márgenes de resección en la cirugía mamaria5–8. Respecto a la cirugía axilar, dado que las metástasis ganglionares en el CID puro son muy raras (0,39-1,9%)9, en pacientes con axilas clínicamente negativas, esta puede obviarse10,11.
Respecto a la terapia adyuvante, con el objetivo de sistematizar los tratamientos que se realizaban en el CID, surgieron múltiples sistemas de clasificación. El índice de Van Nuys fue uno de los más ampliamente utilizados y determinaba qué pacientes se beneficiarían de una radioterapia (RT) complementaria en función de la edad, los milímetros al margen quirúrgico, el tamaño tumoral, el grado tumoral y la presencia de necrosis12.
En términos generales se puede considerar que el riesgo de recurrencia global local para el CID es del 10-20%. En esta línea, diversos estudios han justificado el tratamiento quirúrgico conservador seguido de RT indicando una reducción de la incidencia de recurrencia local en aproximadamente el 50%13–18. Asimismo, respecto al tratamiento hormonal (HT) adyuvante en el carcinoma in situ, los estudios con mayor número de pacientes parecen demostrar el beneficio en la adición de tamoxifeno para la reducción de la recidiva local16,19,20.
El objetivo de este trabajo es el estudio de los CID diagnosticados, tratados y seguidos en nuestro centro de manera que podamos establecer qué variables (respecto al tumor, a la paciente y/o a los tratamientos recibidos) se asocian a un mayor riesgo de desarrollar recidivas.
Pacientes y métodosEstudio descriptivo retrospectivo de los 162 casos de CID diagnosticados y tratados en nuestro centro desde enero de 1999 a diciembre 2011 mediante revisión de las historias clínicas. Se incluyeron todos los CID que no presentaban componente infiltrante asociado. Se excluyeron las pacientes con antecedente de neoplasia y/o RT sobre la misma mama. Las variables que se analizaron fueron la edad de la paciente, el tamaño tumoral, la existencia de alto grado nuclear (determinado mediante la clasificación histopatológica de Van Nuys), el estado de los márgenes quirúrgicos, el tipo de cirugía y el tratamiento recibido (RT y HT).
Se indicó mastectomía en aquellas pacientes con lesiones extensas en que la cirugía conservadora con márgenes libres no garantizaba un resultado estético correcto. Tras la cirugía inicial, si la pieza quirúrgica dejaba un margen afecto, se indicaba ampliación en un segundo tiempo, aunque cada caso era valorado individualmente. Consideramos márgenes tumorales óptimos aquellos en que, tras completar todo el tratamiento quirúrgico (inicial y ampliaciones), el tumor se encontraba a 10mm o más; subóptimos, entre 0-9,9mm, y afectos, cuando el tumor contactaba con el límite resecado.
Previamente a la validación de la técnica del ganglio centinela en nuestro centro (año 2002) las pacientes con criterios de riesgo para tumor infiltrante subyacente (lesiones palpables, nódulos mamográficos, CID de alto grado, edad inferior a 35 años, lesiones extensas y en los casos en que se realizó mastectomía) fueron sometidas a una linfadenectomía axilar. A partir de 2002 en estas pacientes se realizó biopsia del ganglio centinela.
Para indicar la realización de RT, hasta el año 2002 el Comité de Ginecología Oncológica y Patología Mamaria tuvo en cuenta el riesgo teórico de recidiva utilizando los criterios de Van Nuys (márgenes de resección, tamaño tumoral, histopatología y edad). De esta forma, un 66% (20/30) de las pacientes tratadas con tumorectomía entre 1999 y 2003 recibieron RT complementaria. A partir del año 2003 se recomendaba RT de forma sistemática a todas las pacientes tratadas con tumorectomía.
Respecto a la HT, desde el 2001 en nuestro centro se ha recomendado en la mayor parte de los casos de CID el tratamiento hormonal preventivo con tamoxifeno. De esta forma, el 96,5% (85/88) de los casos tratados con este fármaco fueron a partir de 2001.
Para la valoración de la supervivencia, los datos se analizaron mediante Kaplan-Meier. Para el estudio de las recidivas en función de las variables estudiadas se utilizó la regresión de Cox para cada variable.
ResultadosSe estudiaron 162 casos de CID entre 1999-2011. La edad promedio fue de 52,8 años (32-83) y el tamaño tumoral medio fue de 13,8mm (2-65mm).
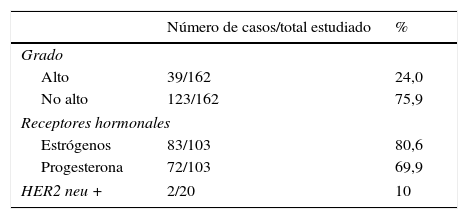
En un 24% (39/162) de los casos se detectó un alto grado, y en el 75,9% (123/162), no. De los CID que no tenían alto grado, 52 casos (42,2%) presentaban necrosis tumoral. En un 80,6% (83/103) de los tumores en que se conoce el estatus hormonal los receptores para estrógenos fueron positivos, y en un 69,9% (72/103) lo fueron los de progesterona. Un 10% de los tumores (2/20) fueron HER2 neu positivos, aunque solo se conoce su valor en 20 casos (tabla 1).
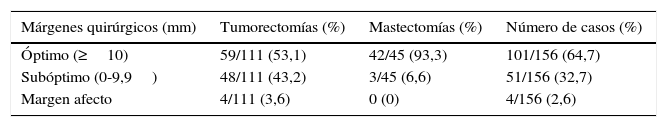
En referencia al tratamiento quirúrgico, se realizó tumorectomía en un 72,2% (117/162) de los casos y mastectomía en un 27,7% (45/162). En 6 casos tratados con tumorectomía no existía constancia de la distancia al margen tumoral. Tras el tratamiento quirúrgico (mastectomías y tumorectomías) se obtuvieron márgenes óptimos en un 64,7% (101/156) de los casos, subóptimos en un 32,7% (51/156) y se dejaron márgenes afectos en un 2,6% de los casos (tabla 2).
Características de la cirugía (distancia del tumor al margen quirúrgico)
| Márgenes quirúrgicos (mm) | Tumorectomías (%) | Mastectomías (%) | Número de casos (%) |
|---|---|---|---|
| Óptimo (≥10) | 59/111 (53,1) | 42/45 (93,3) | 101/156 (64,7) |
| Subóptimo (0-9,9) | 48/111 (43,2) | 3/45 (6,6) | 51/156 (32,7) |
| Margen afecto | 4/111 (3,6) | 0 (0) | 4/156 (2,6) |
Se realizó estudio axilar en un 38,8% de los casos (63/162); en 52 se realizó ganglio centinela (32,3%) y en 11, linfadenectomía (6,8%). Una de las pacientes presentó afectación ganglionar metastásica (2 de 19 ganglios). La anatomía patológica revisada fue de carcinoma ductal in situ, sin hallarse carcinoma infiltrante. Esta paciente llevó a cabo tratamiento adyuvante con quimioterapia, RT y HT. Con 6 años de seguimiento la paciente no ha desarrollado recidivas.
Como tratamientos complementarios se realizó RT a 96 pacientes (todas ellas tratadas con tumorectomía), lo que supone un 82,05% (96/117) de las tumorectomías. En cuanto a la HT, en un 54,5% (85/156) de las pacientes se realizó tratamiento con tamoxifeno: un 55,8% (62/111) de las tratadas con tumorectomía y un 51,1% (23/45) de las tratadas con mastectomía. En 6 pacientes tratadas con tumorectomía se desconocía si se realizó HT.
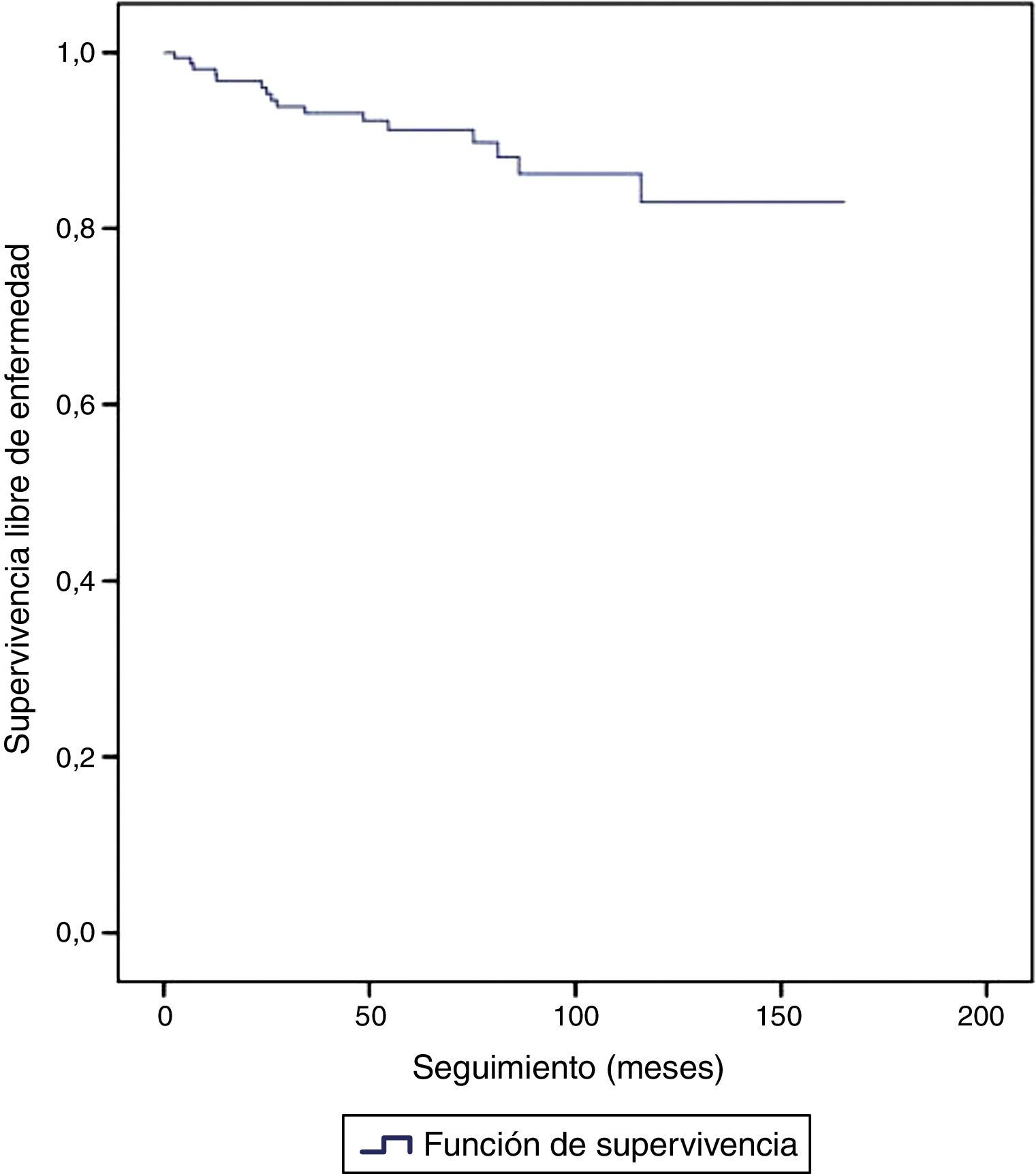
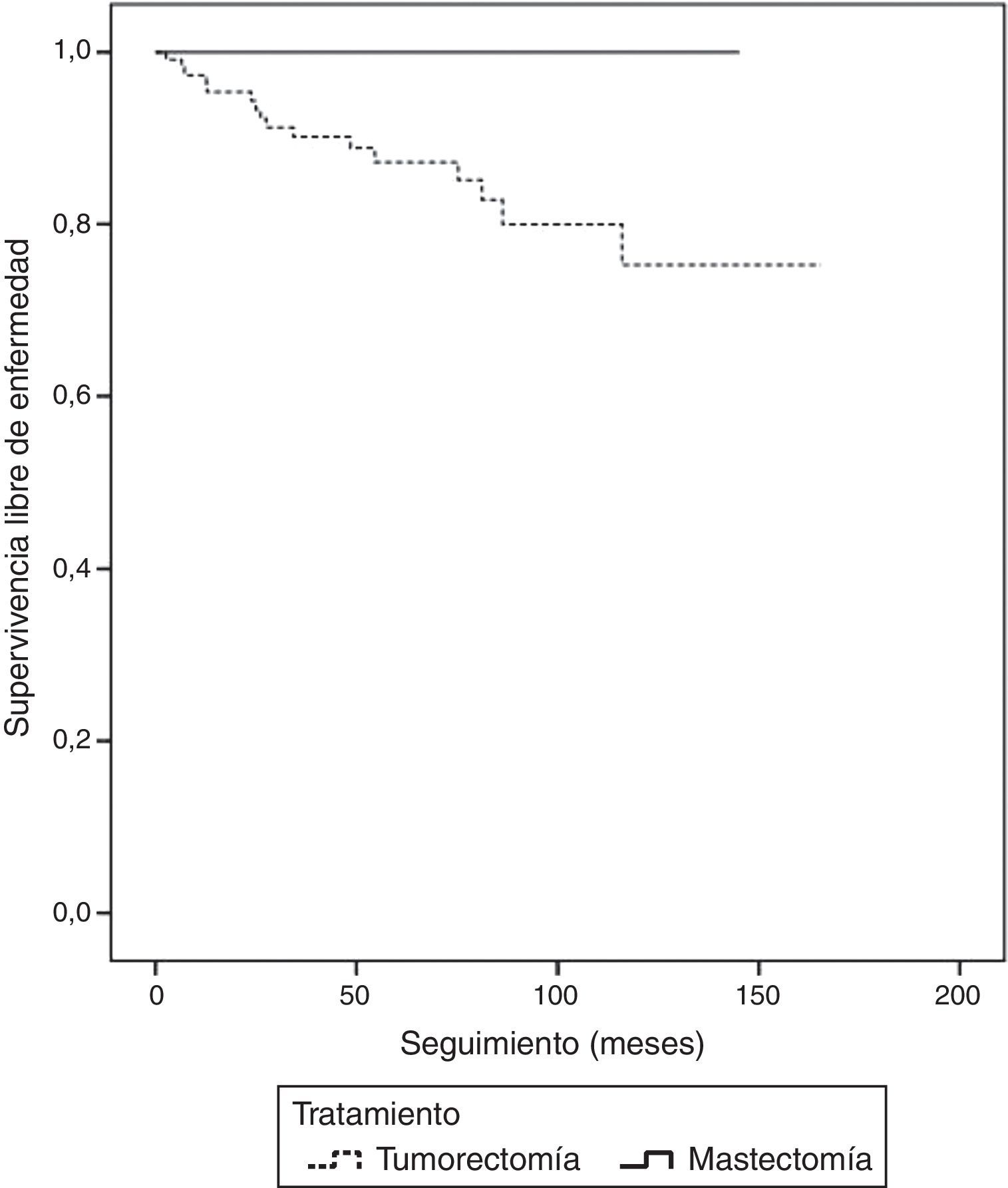
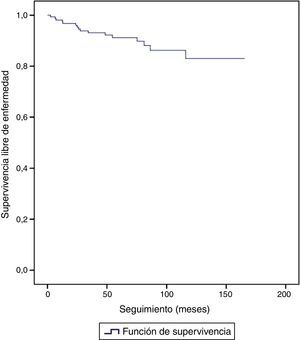
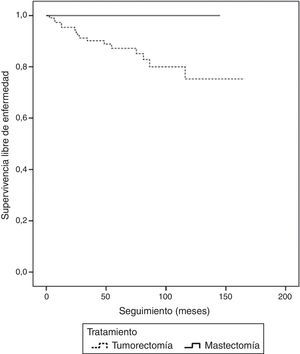
Con una mediana de seguimiento de 69 meses (IC 95% 60-77) fueron detectadas 16 recidivas, lo que significa un 10% del total de los CID. La supervivencia libre de enfermedad (SLE) fue del 83% (73,7-92,2) a los 10 años de seguimiento (fig. 1) y no hubo ningún caso de muerte por enfermedad. No se encontraron recidivas durante el periodo de estudio en el subgrupo de pacientes tratadas mediante mastectomía. La SLE a los 10 años fue del 75,3% (IC 95% 62,2-88,4) para el subgrupo tratado con tumorectomía, con diferencias estadísticamente significativas (p<0,001) respecto al grupo de mastectomía (fig. 2). La localización de la recidiva fue local en 15/16 casos (93,8%) y en 1/16 (6,3%) la recidiva fue a nivel axilar. El caso con recidiva axilar se trató de una paciente tratada con tumorectomía que no realizó RT ni HT. La paciente desarrolló una recidiva axilar a los 3 años del tratamiento y no existía recidiva mamaria asociada. Cabe destacar que no se trataba del caso en que había habido afectación axilar inicial.
El 66,7% de las recidivas locales (10/15) fueron en forma de CID, y un 33,3% (5/15) fueron en forma de carcinoma infiltrante.
El tratamiento de la recidiva se llevó a cabo mediante tumorectomía (todas ellas, pacientes que no habían recibido RT) en un 31% de los casos (5/16), mastectomía simple en un 50% (8/16), mastectomía con linfadenectomía axilar en un 12,5% (2/16) y solo linfadenectomía en un 6,2% (1/16). Las pacientes en que la recidiva se trató con tumorectomía recibieron todas ellas RT posterior.
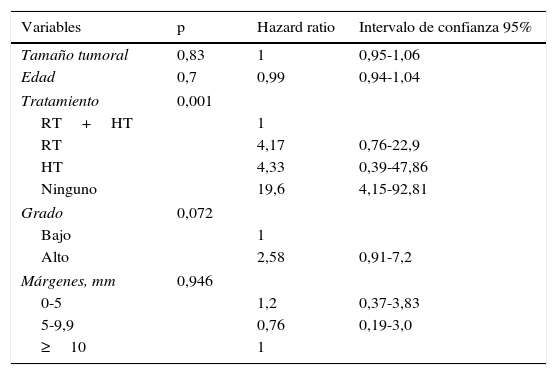
No encontramos diferencias estadísticamente significativas en la tasa de recidivas en función de ninguno de los clásicos criterios Van Nuys (tamaño tumoral, distancia al margen, grado histológico y edad de la paciente) (tabla 3).
Recidivas en función de las variables estudiadas
| Variables | p | Hazard ratio | Intervalo de confianza 95% |
|---|---|---|---|
| Tamaño tumoral | 0,83 | 1 | 0,95-1,06 |
| Edad | 0,7 | 0,99 | 0,94-1,04 |
| Tratamiento | 0,001 | ||
| RT+HT | 1 | ||
| RT | 4,17 | 0,76-22,9 | |
| HT | 4,33 | 0,39-47,86 | |
| Ninguno | 19,6 | 4,15-92,81 | |
| Grado | 0,072 | ||
| Bajo | 1 | ||
| Alto | 2,58 | 0,91-7,2 | |
| Márgenes, mm | 0,946 | ||
| 0-5 | 1,2 | 0,37-3,83 | |
| 5-9,9 | 0,76 | 0,19-3,0 | |
| ≥10 | 1 | ||
HT: hormonoterapia; RT: radioterapia.
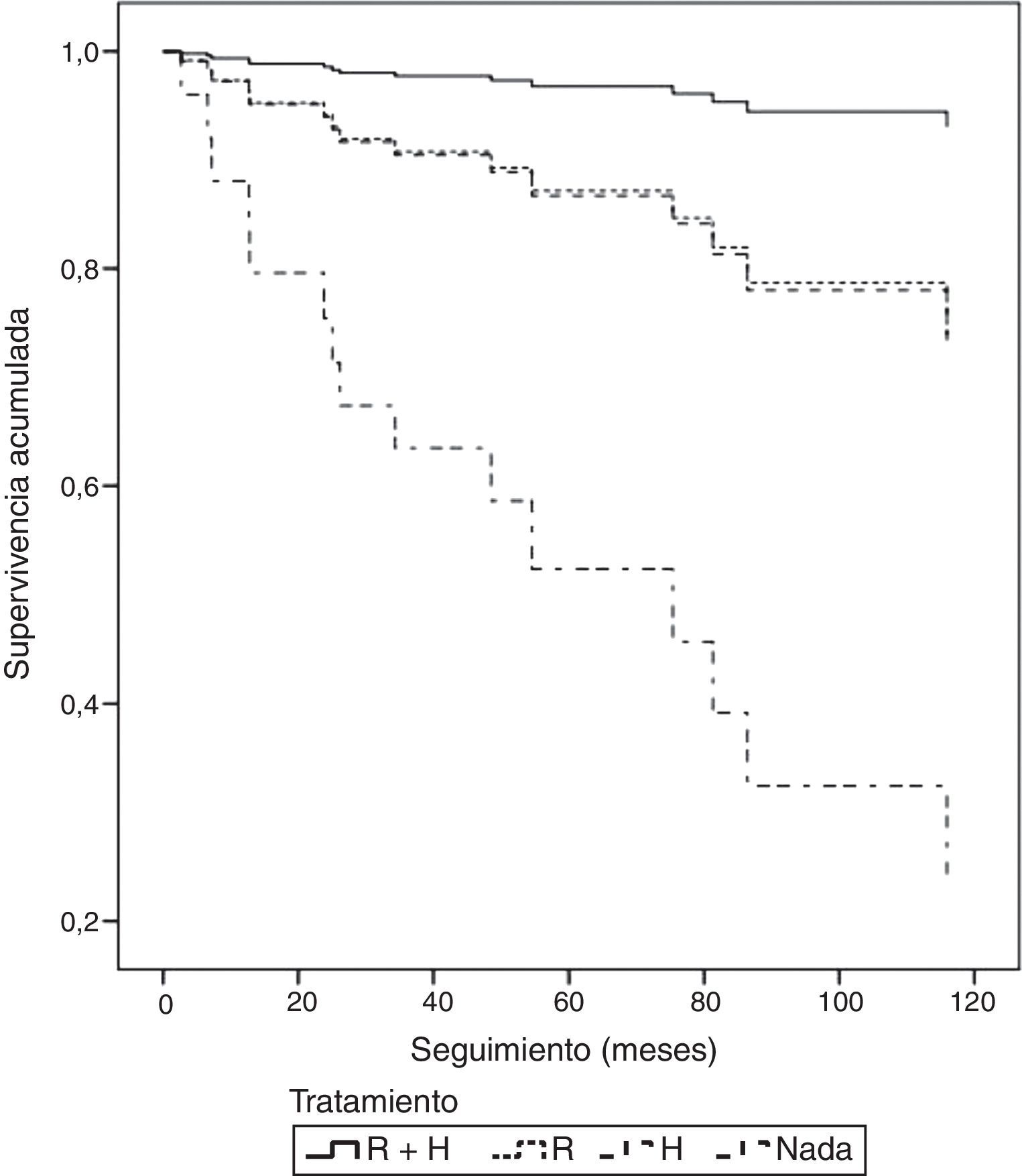
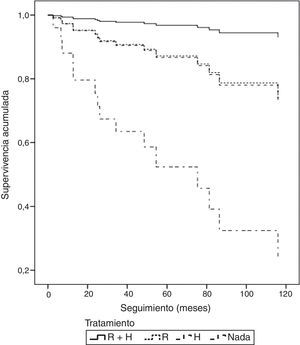
Seleccionando el grupo de pacientes a las que se les había realizado tumorectomía (117 pacientes), en 111 pudimos hacer seguimiento de todos los tratamientos adyuvantes llevados a cabo. Observamos que un 52,2% de los casos (58/111) recibieron RT y HT, un 27,9% (31/111) recibieron solamente RT, un 5,4% (6/111) recibieron solamente HT y un 14,4% (16/111) de pacientes no recibieron ningún tratamiento complementario. En este subgrupo de pacientes tratadas con tumorectomía encontramos diferencias estadísticamente significativas en la tasa de recidivas en función del tratamiento complementario recibido. De esta forma, la SLE a los 10 años en las pacientes tratadas con RT y HT fue del 91,9%, en las tratadas solo con RT del 61,5%, en las que recibieron solo HT del 66,7% y en las que no recibieron ningún tratamiento tras la tumorectomía fue del 36,4% (fig. 3). Esto supone un riesgo de recidiva 19 veces superior en los casos tratados únicamente con tumorectomía frente a aquellas pacientes tratadas con tumorectomía, RT y HT (p=0,001).
DiscusiónSe considera que la tasa de recidivas por año aproximadamente para el CID debería no superar el 1-2% tras tratamiento conservador y el 0,5-1% tras mastectomía. En global, no debería superar el 10% a 10 años, que es el porcentaje de recidiva descrito en nuestro centro en estos 13 años de revisión. Creemos que el hecho de no encontrar recidivas en el subgrupo de pacientes tratadas con mastectomía es debido, probablemente, al tiempo de seguimiento y al número de pacientes (n=47).
Según la literatura, la mitad de las recidivas en el CID se manifiestan como carcinomas infiltrantes. En nuestro centro, la recidiva fue como cáncer invasivo en un 33,3% de los casos, algo inferior a lo descrito en la literatura, posiblemente por el tiempo de seguimiento.
Algunos de los principales factores descritos en la literatura que pueden incrementar el riesgo de recidiva en el CID, como el alto grado, el tamaño tumoral y la edad, en nuestro centro no se han asociado a mayor riesgo de recidiva. Posiblemente, los tratamientos adyuvantes recibidos y el número de casos hacen que no se hayan podido encontrar diferencias.
Respecto al tratamiento adyuvante con RT en el CID, el grupo NSABP B-17 demostró una reducción de la recaída local por tumor invasivo (del 17 al 8%) y no invasivo (del 15 al 8%), sin diferencias en la supervivencia global con la adición de RT14. El ensayo EORTC 10853 también demostró una disminución de la recurrencia local (del 16 al 9%), sin diferencias en la supervivencia15. Datos similares también son reportados por los grupos UK/ANZ16. Por todo esto, la revisión Cochrane17 y el grupo EBCG18 concluyeron en el beneficio de asociar RT en el CID tras tratamiento conservador. En nuestra serie, el hecho de añadir RT comportó pasar de una SLE del 36,4 al 61,5%.
En referencia a la HT, los 2 estudios más importantes publicados hasta la fecha, el UK/ANZ16 (1.700 pacientes incluidas y 52 meses de seguimiento) y el NSABP B-2419 (1.800 pacientes y 12 años de seguimiento) demuestran un beneficio de tamoxifeno en la prevención de eventos mamarios homo y contralaterales en CID tratados con tumorectomía. El estudio UK/ANZ detectó una reducción del 11 al 7% de las recidivas no invasivas homolaterales o primarios contralaterales con tamoxifeno (diferencias estadísticamente significativas), con una reducción del riesgo de recidiva en un 32%. En el estudio B-24, la incidencia de recidivas fue del 16,6% en las tratadas con tumorectomía más RT más placebo, y del 13,2% en las tratadas con tumorectomía más RT más tamoxifeno (diferencias estadísticamente significativas), con una reducción del riesgo de recidiva de un 31%. No se demostró, en ningún caso, efecto en la supervivencia global. En 2012 se publicó un subestudio de NSABP B-2420 (723 pacientes y 10 años de seguimiento) en que con 10 años de seguimiento el subgrupo de pacientes con CID con receptores de estrógeno y progesterona negativos no presentaron ninguna reducción en el riesgo de recidiva. En nuestra serie, el hecho de añadir HT comportó pasar de una SLE del 36,4 al 66,7%.
Está en discusión, aunque no existen estudios aleatorizados que lo avalen, la omisión del tratamiento con RT en pacientes de edad avanzada, con tumores pequeños, de bajo grado y con márgenes libres de resección.
Por otro lado, las últimas guías de consenso en nuestro país solo indican la realización de biopsia del ganglio centinela en CID en caso de realizar mastectomía21.
Actualmente, la valoración de HER2 se incorpora a los informes patológicos y su sobreexpresión se considera un factor pronóstico, aunque no altera la estrategia de tratamiento22,23. Estudios en curso pretenden incrementar el número de cirugías conservadoras utilizando fármacos con diana en HER2 como neoadyuvancia. En nuestro trabajo, el bajo número de casos en que se conoce HER2 no hace posible sacar conclusiones.
De la misma forma, el ensayo ECOG E519424 observó que los perfiles genéticos (Oncotype DX® CDIS score) pueden ser utilizados como factor pronóstico de recidiva, aunque en la actualidad un resultado de bajo riesgo por sí solo no debe condicionar el tipo de tratamiento adyuvante a realizar. Sí pensamos que en un futuro estos perfiles podrán ayudarnos a seleccionar mejor a las pacientes candidatas a beneficiarse del tratamiento sistémico adyuvante.
Nuestros datos, por tanto, apoyan la literatura actual respecto a la indicación de tratamiento adyuvante en el CID. Con una mediana de seguimiento de 69 meses, hemos constatado la ventaja en SLE de combinar la RT con el tratamiento con tamoxifeno en pacientes tratadas con tumorectomía. Otros factores clásicos asociados a riesgo de recidiva, como el tamaño tumoral, el grado histopatológico y el margen quirúrgico, no se han visto asociados en nuestro trabajo al riesgo de recidiva posiblemente por el tamaño muestral. Los nuevos indicadores pronóstico, como la sobreexpresión de HER2 o la clasificación por perfiles genéticos, nos podrían ayudar en el futuro a reconocer con más precisión aquellos CID con más riesgo de recidiva y así personalizar la terapia adyuvante.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Comisión de Docencia por la aceptación del presente trabajo y a la Dra. Cusidó por el apoyo para llevar este proyecto adelante.