Actualmente, la cirugía conservadora es el estándar quirúrgico en el tratamiento del cáncer de mama, pero en un 15-35% de los casos, debe ofrecerse la mastectomía. Hasta no hace mucho tiempo, si estas pacientes necesitaban radioterapia, la opción de la reconstrucción se retrasaba o incluso se rechazaba. Actualmente, los avances técnicos permiten poder ofrecer reconstrucción e irradiación.
En el presente artículo se revisan los diferentes tipos de cirugía reconstructiva y su relación con la irradiación, de forma que se incluyen: reconstrucción inmediata con técnica heteróloga, prótesis definitivas, expansores tisulares, reconstrucción diferida con técnica heteróloga y/o autóloga, reconstrucción del complejo aréola-pezón y lipoinfiltración. Se revisan las complicaciones de la combinación de cirugía reconstructiva y radioterapia, y se establecen unas recomendaciones prácticas.
Currently, conservative surgery is the standard management in breast cancer. However, in 15-35% of patients, mastectomy should be offered. Until recently, if these patients needed radiotherapy, the option of reconstruction was delayed or even rejected. Current technical advances allow both reconstruction and irradiation to be offered.
This article reviews the different types of reconstructive surgery and their relationship with irradiation, including immediate heterologous reconstruction techniques, definitive prostheses, tissue expanders, delayed reconstruction with heterologous and/or autologous techniques, nipple-areola complex reconstruction, and lipofilling. We review the complications of combining radiotherapy and reconstructive surgery, and establish practical recommendations.
Aunque actualmente la cirugía conservadora es el estándar quirúrgico en el tratamiento del cáncer de mama, todavía en un 15-35% de las ocasiones debe ofrecerse la mastectomía. Hasta no hace mucho tiempo, si estas pacientes necesitaban radioterapia, la opción de reconstrucción mamaria se demoraba, o incluso se rechazaba. En concreto, aquellas pacientes portadoras de prótesis mamarias por indicación de aumento estético, eran rechazadas por los oncólogos radioterápicos para recibir irradiación. Actualmente, las mejoras en las técnicas quirúrgicas y en la tecnología desarrollada en el ámbito de la radioterapia, junto con la demanda por parte de las enfermas, hacen que se les ofrezca la reconstrucción mamaria inmediata con unos resultados oncológicos y estéticos comparables a los de la cirugía conservadora1,2.
A pesar de que la estética juega un papel primordial en el manejo del cáncer de mama, no debemos olvidar que la intención primaria de su tratamiento es el control de la enfermedad. Por ello, se plantean algunas cuestiones en relación con la seguridad de la reconstrucción como inductora de la inhibición de la respuesta inmune por culpa de una cirugía más larga, la posibilidad de una mastectomía menos radical pensando en la reconstrucción, la eventual diseminación de las células tumorales en el campo quirúrgico abierto para acomodar la reconstrucción o la limitación o el retraso del tratamiento adyuvante que pueda suponer su realización, así como el potencial retraso en el diagnóstico de la recidiva. De forma general, los datos actuales indican que la reconstrucción no tiene impacto en el riesgo de recidiva locorregional ni en el pronóstico global3, ni tampoco interfiere ni retrasa la administración de tratamiento sistémico adyuvante. En relación con la radioterapia y la reconstrucción mamaria nos encontramos con diferentes escenarios con aspectos controvertidos, que se revisan a continuación.
Cirugía oncoplástica e irradiaciónLa cirugía conservadora debe establecer una buena relación entre una cirugía oncológica correcta y un buen resultado estético. En ocasiones, estas 2 necesidades entran en conflicto y aquí surgen las técnicas oncoplásticas, que permiten realizar cirugías conservadoras con resección oncológica segura (márgenes amplios) obteniendo unos resultados estéticos muy satisfactorios, incluso en pacientes con mamas pequeñas, disminuyendo la necesidad de mastectomías4. En sentido estricto, el término «oncoplástico» hace simplemente referencia a la aplicación de técnicas reconstructivas propias de la cirugía plástica tras exéresis oncológica. Las diferentes técnicas quirúrgicas que pueden emplearse dependen del tamaño de la mama y de la localización de la lesión. En la mayoría de los casos se basan en la movilización y redistribución de la glándula mamaria para reconstruir el volumen y la forma. Entre las técnicas más frecuentes están la reinserción del complejo aréola-pezón (CAP) en tumores centrales y la reconstrucción con colgajo cutaneoglandular de avance inferolateral en mamas grandes y ptósicas, la mamoplastia en T invertida con posterior confección de la neoaréola, la técnica de round-block o variaciones de la mamoplastia en T invertida, colgajos cutáneos laterales o incluso colgajos miocutáneos, y otras muchas variaciones5. La selección de estas técnicas de reconstrucción debe ir acompañada de un riguroso análisis de la paciente, de un estudio de sus necesidades y de una detallada planificación quirúrgica. Es básico recordar que el fin de la reconstrucción «oncoplástica» es mantener la simetría mamaria en la paciente y mejorar su autopercepción corporal. Resultados asimétricos, aunque sean satisfactorios para el cirujano, pueden resultar inaceptables para la paciente.
La irradiación tras una cirugía oncoplástica es una opción viable y no implica un aumento de la complejidad, ya que el volumen a irradiar es tejido mamario. Por tanto, las técnicas actuales con fotones de un acelerador lineal no provocarán problemas importantes. La dificultad está en la definición del volumen de sobredosificación y si esta es precisa, ya que la remodelación del volumen mamario la complica y provoca que no siempre coincida con su situación inicial ni con zonas cercanas a la cicatriz quirúrgica6. Por ello, en estos casos se hace imprescindible la necesidad de referenciar esta área de forma intraoperatoria mediante marcas radioopacas en esta zona7, e incluso hay autores que se cuestionan la necesidad de sobredosificación6. El esquema de tratamiento debe ser el habitual: 46-50Gy a 1,8-2Gy/día sobre toda la mama8. En la actualidad, no existe suficiente experiencia para plantear esquemas hipofraccionados en estas pacientes.
Cirugía reconstructiva e irradiaciónLa cirugía reconstructiva consiste en la creación de novo de la silueta y el volumen de la mama9. Cuando se conoce la necesidad de irradiación se prefiere realizar primero esta y diferir la reconstrucción. En los demás casos es preferible la reconstrucción inmediata, ya que presenta la ventaja de realizarse en el mismo acto quirúrgico que la mastectomía, tiene menor impacto psicológico sobre las pacientes y mejora su calidad de vida. Sin embargo, es necesario conocer al máximo las características del tumor y los tratamientos adyuvantes que precisará posteriormente, en especial la radioterapia.
La reconstrucción puede realizarse mediante 3 tipos de técnicas: aquellas que emplean materiales autólogos (tejidos de la propia paciente), las que utilizan materiales heterólogos (prótesis, ya sean de gel de silicona o de suero salino, o expansores) y los procedimientos mixtos (técnicas que asocian tejidos de la propia paciente, habitualmente colgajo musculocutáneo de dorsal ancho, con el empleo de prótesis/expansores).
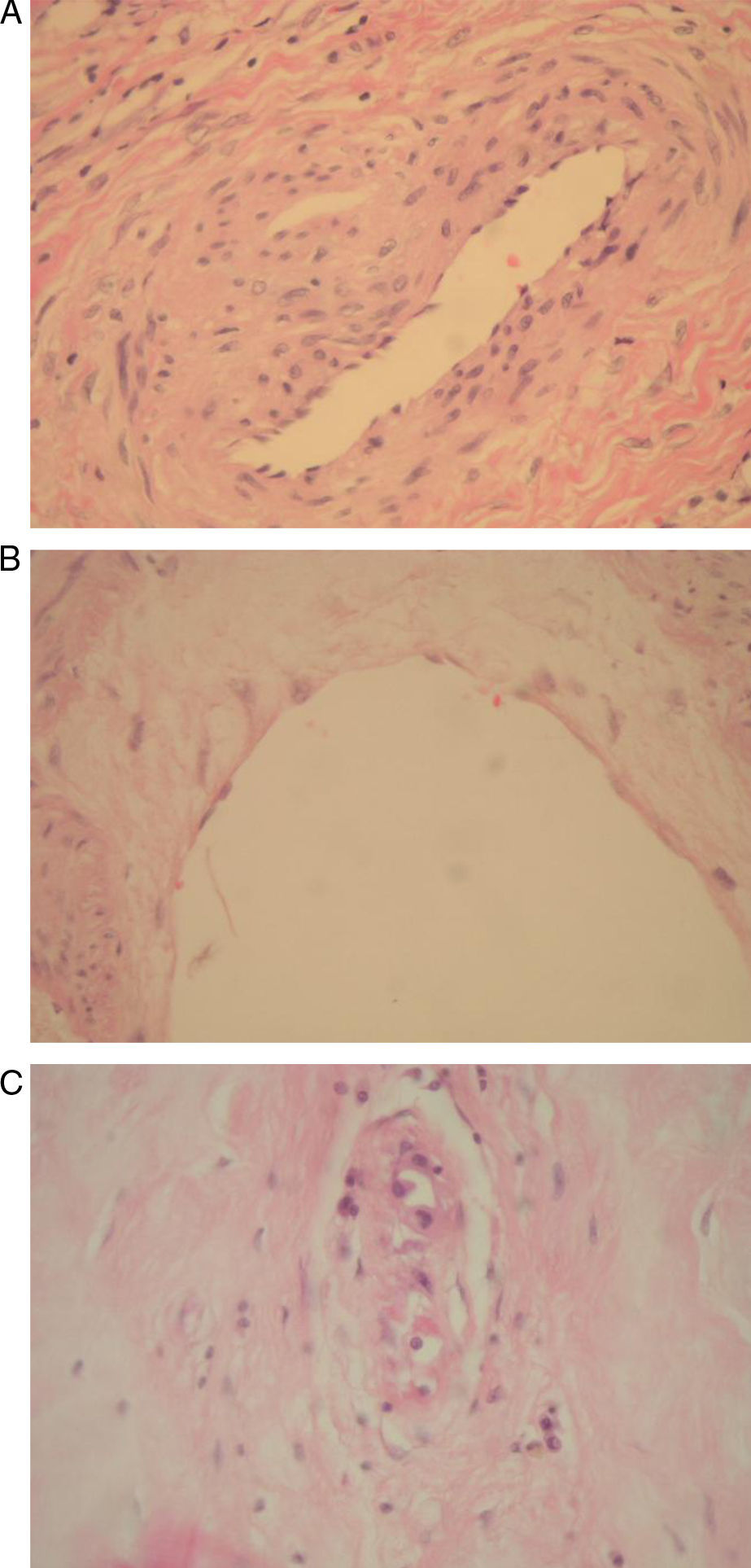
Los daños tisulares producidos por la irradiación que pueden interferir con la cirugía reconstructiva son los tardíos, siendo especialmente relevantes los que se producen en las células endoteliales y el trastorno sobre la microcirculación. Esta agresión puede incluir la trombosis masiva de pequeños vasos, la fibrosis periadventicia y subíntima, la proliferación endotelial y del tejido conjuntivo subendotelial, la disrupción de la lámina elástica, el acúmulo de sustancias fibrinoides, la degeneración del músculo liso, la agregación de histiocitos, la obliteración del vasa vasorum, la estenosis y ruptura de vasos, y la arterioesclerosis10 (fig. 1). Otros efectos menos importantes son la atrofia parcial de anejos cutáneos, incluidos folículos pilosos, y la fibrosis subcutánea.
La lesión producida es importante tanto en el lecho quirúrgico como en el colgajo a transferir. Los vasos irradiados son más difíciles de disecar y aumentan las complicaciones. En relación con los daños en el colgajo, puede evidenciarse una disminución del flujo que genera un aumento del riesgo de necrosis, así como una inhibición de los fibroblastos que implicará un retraso de la curación de la herida, un aumento del riesgo de infecciones y la interferencia con el desarrollo de la circulación colateral, haciendo que el colgajo sea dependiente del pedículo durante mucho más tiempo. A nivel de los vasos del pedículo, los daños serán variables en función del origen y características del mismo (pediculados o libres, pared abdominal o regiones a distancia, etc.). Otros factores que pueden influir en las complicaciones de la radioterapia son las enfermedades sistémicas que afectan la microvascularización, como la diabetes o el tabaquismo, y factores como la obesidad, la edad avanzada, la higiene inadecuada o la combinación con quimioterapia y/u hormonoterapia11.
Reconstrucción inmediataTécnicas heterólogas (materiales aloplásticos)Dentro de este grupo se encontrarían las que implantan prótesis definitivas (de gel de silicona o de suero salino) empleadas tanto para la reconstrucción tras una mastectomía, como las implantadas para aumento estético del volumen mamario o reconstrucción por anomalía congénita. También estarían incluidos los expansores tisulares.
Prótesis definitivasTodas las prótesis, ya sean las empleadas con fines reconstructivos como aquellas implantadas por motivaciones estéticas, dificultan la irradiación externa y prácticamente contraindican la braquiterapia por el riesgo de perforación y extrusión protésica. La reconstrucción distorsiona la anatomía de la pared torácica, dificulta la óptima cobertura y, en ocasiones, precisa la irradiación de un volumen mayor de corazón y pulmón, especialmente en los tumores del lado izquierdo12,13. El material de las prótesis que contienen gel de silicona tiene un alto número atómico que puede afectar la distribución de las dosis, principalmente en la interfase prótesis/tejido. Estas alteraciones explican, en parte, la contractura capsular alrededor del implante14, ya que se produce una zona de incremento de dosis que puede llegar al 7-10%. La técnica de irradiación y las dosis a administrar serán las clásicas. Sin embargo, es imprescindible realizar la simulación basándose en imágenes de TC y un cálculo de dosis tridimensional con corrección por heterogeneidades tisulares. Ello permitirá conocer la dosis recibida en cualquier punto y optimizar la dosimetría, utilizando filtros en cuña, segmentando el campo o, incluso, técnicas de modulación de intensidad. La irradiación de las áreas, especialmente de la cadena mamaria interna, es complicada. En una revisión de Motwani et al.7 del MDACC, el plan de tratamiento no fue óptimo en el 52% de las pacientes con prótesis versus el 7% en controles. A pesar de las alteraciones dosimétricas, hay que destacar que la eficacia de la irradiación no está alterada por la presencia de prótesis o de expansores tisulares15. Incluso los estudios con dosimetrías in vivo repetidas no revelan cambios significativos con la dosis prescrita16. También se ha observado un mayor número de infecciones del implante en pacientes que recibieron quimioterapia adyuvante17.
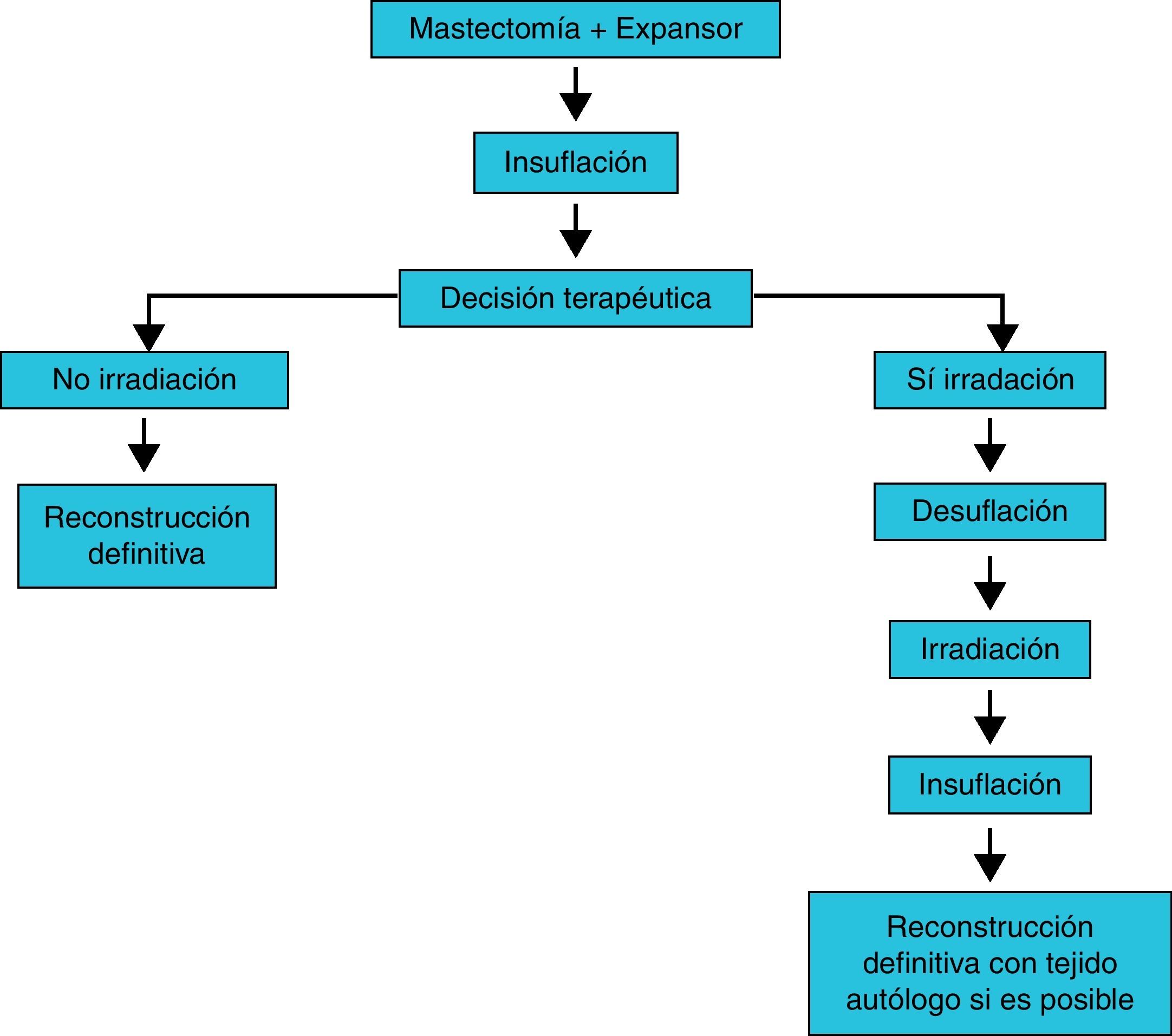
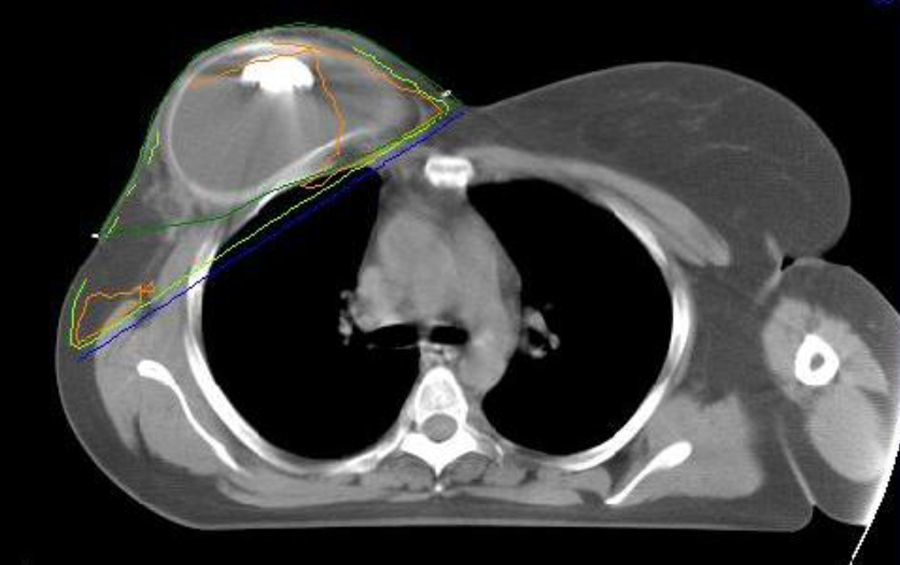
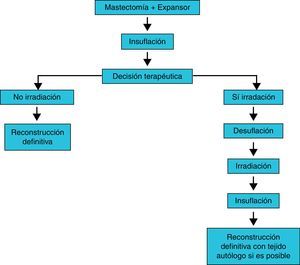
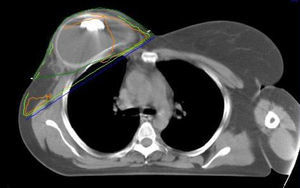
Expansores tisularesLa irradiación de expansores tisulares es la que implica mayor controversia, ya que el expansor contiene una o varias válvulas de sellado metálicas, útiles para su insuflación. Hasta hace poco tiempo se proponía sustituir el expansor por una prótesis definitiva antes de iniciar la irradiación. Se han publicado diversos protocolos que describen la secuencia de las distintas fases de la reconstrucción mamaria con expansores tisulares en pacientes que precisan radioterapia. Uno de los protocolos que más se ha utilizado es el algoritmo de toma de decisiones del Memorial Sloan-Kettering Cancer Center18, que se describe resumido en la figura 2. En él se propone la mastectomía con colocación de expansor, posteriormente se rellena, y en caso de no precisar irradiación se realiza la reconstrucción en un segundo tiempo. En caso de precisar irradiación se realiza una desuflación del expansor con posteriores irradiación y reconstrucción, a poder ser con tejido autólogo. Esta opción está ganando muchos seguidores, quienes describen buenos resultados19. En la misma línea, Ascherman et al.20 publicaron los resultados de un estudio casos-control que incluía 27 pacientes con irradiación y 96 sin ella, con un seguimiento medio de 14 meses. En todos los casos se empleó expansor y siempre se colocó el implante definitivo después de la irradiación. A pesar de presentar un índice de extrusión superior en el grupo irradiado, la mayoría de las pacientes con radioterapia tuvieron un resultado satisfactorio. Las conclusiones de este estudio fueron que la reconstrucción con prótesis en 2 etapas (expansor-implante permanente) y las técnicas de irradiación modernas mejoran los resultados frente al implante directo. Actualmente no es imprescindible la retirada del expansor para la irradiación, pero sí que lo es realizarla con un volumen constante. Los estudios dosimétricos (fig. 3) revelan un mínimo aumento de la dosis alrededor de la parte metálica (radiación dispersa), que no parece contribuir de forma significativa en la alteración de la estética21. Estas pequeñas variaciones de dosis disminuyen con el aumento de la energía utilizada22. Autores como Hazard et al.23 concluyen que la irradiación de prótesis y expansores es aceptable dado el bajo número de contracciones capsulares graves que se encuentran.
Algoritmo de decisión tras la colocación de expansor. Fuente: Jugenburg et al.18.
La reconstrucción autóloga es aquella que utiliza tejidos de la misma paciente mediante diversos procedimientos consistentes en la traslación de piel, grasa, fascias y masa muscular con el fin de reconstruir el defecto posmastectomía de la forma más simétrica y natural posible. Las trasposiciones más comúnmente empleadas son: la trasposición de la pared abdominal con músculo recto abdominal anterior (TRAM pediculado y libre), la trasposición del músculo dorsal ancho (LD) con o sin isla de piel asociada, y las trasposiciones que precisan técnicas de microcirugía basadas en colgajos de perforantes y el concepto de angiosomas cutáneos tales como DIEP, SIEA y el colgajo del músculo gracilis libre con isla cutánea transversa18. Existe, asimismo, controversia en lo referente al momento de llevar a cabo este tipo de reconstrucción, existiendo quien aboga por la reconstrucción inmediata previa a la radioterapia y aquellos que promueven diferir este tipo de reconstrucción a la finalización de la misma. El cuidado postoperatorio es complejo por la necesidad de controlar el adecuado funcionamiento de las suturas microvasculares. No obstante, y aunque puede precisar de diversos retoques a corto, medio y largo plazo, incluso en la mama contralateral (simetrización), para conseguir una estética óptima, es la opción habitualmente más satisfactoria. Estas técnicas poseen la ventaja de que el envejecimiento tisular es simétrico al tratarse de tejidos de la paciente, que siente como propios. Adicionalmente, la durabilidad del resultado es mayor que en la reconstrucción con técnicas de expansión y prótesis. Actualmente a las pacientes con tumores en estadios iniciales que no desean una cirugía conservadora, o en las que la misma está contraindicada, se les ofrece la reconstrucción inmediata con unos resultados oncológicos y estéticos comparables o incluso superiores en términos de simetría a los de la cirugía conservadora.
La irradiación de este tipo de reconstrucción no comporta excesivos problemas y es la técnica reconstructiva de elección cuando se conoce la necesidad de radioterapia posterior24. La reconstrucción distorsiona la anatomía de la pared torácica precisando la modificación de las puertas de entrada de la radiación y puede aumentar la complejidad del tratamiento13. Estos aspectos han mejorado con el empleo de la planificación tridimensional y con las nuevas técnicas de irradiación como la intensidad modulada. La técnica de irradiación clásica y la dosis habitual de 45-50Gy a 1,8-2Gy/día suelen ser bien toleradas, y uno de los mayores problemas es la localización, por parte del oncólogo radioterápico, del lecho tumoral.
Reconstrucción diferidaLa técnica de irradiación utilizada suele ser la habitual, es decir irradiación de la pared torácica con electrones o fotones, o una combinación de ambas, y las áreas ganglionares con fotones, con un fraccionamiento convencional de 1,8-2Gy/día hasta llegar a una dosis de 50Gy. En ocasiones puede administrarse un complemento de dosis en cicatriz de mastectomía que puede llegar a los 10-20Gy. Tras un periodo de 12-24 meses (aunque puede variar, en función de la afectación tisular posradioterapia), se procede a la reconstrucción, siendo heteróloga o autóloga en función de cada caso, aunque habitualmente se opta por la autóloga. En el caso de emplear prótesis, lo habitual será utilizar colgajos musculocutáneos de dorsal ancho que aporten tejido sano no sometido a los efectos deletéreos de la radiación.
En las pacientes en las que se prevea la indicación de radioterapia postoperatoria, se recomienda la realización de una reconstrucción diferida preferentemente con tejido autólogo, y en las pacientes que claramente no van a precisar radioterapia sí que estaría indicada la reconstrucción inmediata. Sin embargo, hay un grupo de pacientes en el que habrá que esperar al resultado final de la anatomía patológica para saber la indicación de irradiación. En este grupo, Kronowitz et al.25 proponen la llamada reconstrucción inmediata-diferida, que estaría indicada en aquellas pacientes con tumores en estadios precoces pero con probabilidades de necesitar irradiación (T2, ganglios afectos, microcalcificaciones extensas, multicentricidad). En estos casos, recomiendan la realización de una mastectomía ahorradora de piel con colocación de expansor. Una vez recibido el informe anatomopatológico definitivo, si la paciente no precisa radioterapia, se realiza en un segundo tiempo la reconstrucción definitiva, bien con tejido autólogo, bien con prótesis o con una técnica mixta. En el caso de necesitar radioterapia adyuvante, los autores proponen el vaciado del expansor antes de la radioterapia (para producir menos interferencias con la planificación), que se vuelve a rellenar una vez finalizada la irradiación y, posteriormente, en un segundo tiempo, se realiza la reconstrucción definitiva. En estos casos se utilizará preferentemente una técnica con tejido autólogo o mixta. Existen 2 situaciones especiales que requieren especial mención, como son: la reconstrucción del CAP y la lipoinfiltración.
Reconstrucción del complejo aréola-pezónLa reconstrucción del CAP es una técnica completamente integrada en el proceso de reconstrucción de la mama. La tasa de satisfacción con esta fase reconstructiva es elevada, alcanzando globalmente valores por encima del 80%26. No obstante, la radioterapia ha sido considerada, en determinados entornos, una contraindicación para la reconstrucción del CAP, especialmente en aquellas pacientes que han sido reconstruidas mediante el empleo de expansor y prótesis. Un estudio retrospectivo sobre pacientes sometidas a reconstrucción mediante el empleo de expansores y prótesis con irradiación de la pared torácica (tanto pre como postoperatoria) fue desarrollado por Draper et al.27. Los datos aportados por estos autores mostraron que solo el 13% de las pacientes con historia previa de irradiación eran sometidas a reconstrucción del CAP frente al 36% de pacientes no radiadas. De ellas, el 64% fue sometida a reconstrucción mediante colgajos locales. El 36% restante asociaron colgajos locales con injertos cutáneos de piel total. En el 53,5% de las pacientes se tatuó el pezón y en el 32% se tatuó la aréola. Hubo un caso de pérdida total del pezón (3,5%), otro de pérdida total del injerto (3,5%) y otro de pérdida parcial (3,5%), y un 14% de pérdidas parciales del pezón reconstruido.
A la luz de estos resultados, resulta evidente que la selección de pacientes susceptibles de reconstrucción del CAP tras ser sometidas a radioterapia debe ser cuidadosa. Las candidatas ideales serían aquellas pacientes en las que los signos de radiodermitis aguda han desaparecido, no existe evidencia de cambios importantes de radiotoxicidad tardía y los colgajos de la piel de la mastectomía poseen un grosor mínimamente aceptable para evitar riesgos de extrusión protésica. Una vez tenidas en cuenta estas consideraciones, la reconstrucción del CAP es un paso final en el proceso de normalización reconstructiva de la paciente mastectomizada.
LipoinfiltraciónLas alteraciones morfológicas y estéticas asociadas a la reconstrucción mamaria mediante expansor y prótesis en pacientes irradiadas ya han sido expuestas con anterioridad. En aras de mejorar los resultados, durante la última década se ha venido preconizando y utilizando de forma progresiva el empleo de grasa autóloga para conseguir no solo mejoras morfológicas y estéticas, sino que también se han apreciado cambios favorables en los signos de radiodermitis de la piel28,29. Dos son los beneficios asociados al empleo de grasa autóloga: por un lado, las correcciones volumétricas inherentes al aporte de adipocitos, y por otro, la promoción de fenómenos regenerativos inducidos por el aporte de células progenitoras contenidas en el tejido graso infiltrado. El momento para comenzar las múltiples sesiones de lipoinfiltración, cuyo número variará en función de las necesidades de cada paciente, es variable. Habitualmente, se estima oportuno comenzar una vez que los trastornos agudos motivados por la radioterapia han desaparecido, y de forma previa a la aparición de los trastornos crónicos. No obstante, incluso tras la aparición de estos, la transferencia de grasa autóloga ha mostrado beneficios indudables para las pacientes.
Resultados con la reconstrucción heterólogaA pesar de poder administrar una dosis correcta con unos buenos resultados de curación, debe aceptarse que la irradiación de prótesis mamarias empeora los resultados30. Las complicaciones de la reconstrucción con técnicas heterólogas, tanto de forma inmediata como diferida, en pacientes con radioterapia, no han sido estudiadas en ensayos prospectivos aleatorizados; por tanto, la mayoría de los resultados son series de casos, emparejados o casos-control, con un número insuficiente de pacientes, con tiempos de seguimientos dispares y con criterios de evaluación de la estética y de las complicaciones no siempre homogéneos. La ausencia de ensayos prospectivos aleatorizados puede entenderse, hasta cierto punto, lógica si se considera que las opciones reconstructivas deben ser individualizadas y analizadas en función de las características clínicas y personales de cada paciente. En este contexto, la aleatorización de procedimientos en estas pacientes dista mucho de ser una práctica mínimamente recomendable y éticamente aceptable. A pesar de ello, la evidencia acumulada muestra que el resultado estético disminuye y la tasa de complicaciones aumenta con la utilización de radioterapia. Recientemente ha sido publicado que la utilización de radioterapia de forma previa a la reconstrucción se asocia a un 43,8% de tasa de complicaciones, la radioterapia durante la reconstrucción a un 41,2% y la no irradiación a un 13,8%31.
Se han publicado también resultados de series, alguna prospectivas, que evalúan el impacto de la radioterapia en la tasa de formación de cápsula en la reconstrucción inmediata con prótesis32,33. En ellas la contractura capsular pasa del 14% en pacientes no irradiadas al 34% en las que precisan radioterapia32. En este contexto debe remarcarse que Whitfield et al.33 utilizaron un fraccionamiento no recomendable de 40Gy en 3 semanas, y que en el resto de las series no hay diferencias significativas en la incidencia de contractura capsular.
Estos resultados obligan, cuando menos, a una correcta información de la paciente, con descripción de la técnica, de los posibles resultados estéticos, de las complicaciones, así como de las posibles soluciones34,35. Sin embargo, pese a este riesgo de disminución del resultado estético, las pacientes se muestran satisfechas de los resultados. Así, el 77% de las pacientes irradiadas tras la colocación de la prótesis definitiva se muestran satisfechas, frente al 88% de las no irradiadas36. No obstante, esta satisfacción cambia con el paso del tiempo, disminuyendo considerablemente. La explicación más plausible a esta pérdida de la satisfacción inicial parece relacionarse con la pérdida de la simetría motivada por el descenso asimétrico de ambas mamas, mínimo o nulo en la reconstruida con prótesis y sometido al paso del tiempo y al efecto gravitacional en la mama no sometida a mastectomía.
Resultados con la reconstrucción autólogaTampoco aquí existen estudios prospectivos aleatorizados. En este contexto, es importante definir la secuencia reconstrucción/radioterapia. Si la radioterapia se aplica de forma previa a la reconstrucción el posible daño será exclusivamente en el lecho a reconstruir; por el contrario, si la radioterapia se administra sobre el colgajo transferido, el daño se genera sobre el lecho y el colgajo. Si la reconstrucción es microquirúrgica, los daños pueden afectar a los vasos receptores, más comúnmente a los toracodorsales que a la mamaria interna18. Algunos autores no encuentran diferencias utilizando técnicas de irradiación con acelerador lineal y dosimetría tridimensional. Así, Soong et al.37, en una serie retrospectiva de 25 pacientes, no encontraron relación entre la radioterapia y el aumento de las complicaciones posquirúrgicas después de TRAM. No obstante, la relativa impredecibilidad de la respuesta tisular a la radioterapia, así como la evidencia de efectos directos sobre este tipo de colgajos, tales como necrosis grasa y retracción tisular con fibrosis asociada, hacen que el resultado estético deba ser siempre valorado con cautela y que requiera una adecuada y meticulosa información prequirúrgica a la paciente. De manera global, y tal como se menciona en el único metaanálisis publicado38, la reconstrucción autóloga proporciona mejores resultados que la reconstrucción con prótesis en pacientes con radioterapia, con un resultado estético satisfactorio en un alto porcentaje de los casos y con una menor tasa de complicaciones, aunque superior a la de las pacientes no irradiadas Se han encontrado diferencias entre las distintas técnicas quirúrgicas empleadas, siendo actualmente aquellos colgajos que emplean la pared abdominal como fuente donante de tejidos los que proporcionan unos mejores resultados: TRAM libre, DIEP o SIEA, ya que suelen tener una mejor vascularización39. Por el equilibrio entre versatilidad, predictibilidad tras el estudio con modernas técnicas de imagen y escasa morbilidad de la zona donante, el colgajo DIEP es, en el momento actual, la opción quirúrgica más comúnmente recomendada, con una excelente relación coste-beneficio40.
Spear et al.41 evaluaron 171 colgajos tipo TRAM observando peores resultados estéticos en las pacientes con radioterapia administrada después de la reconstrucción. Tran et al.42 publicaron los resultados obtenidos con reconstrucción realizada con colgajo TRAM libre inmediato (n=32) versus diferido (n=70) en pacientes que recibieron radioterapia. Tras más de 3 años de seguimiento, la tasa de complicaciones (necrosis grasa, pérdida de volumen y contractura del colgajo) fue significativamente mayor en los casos con reconstrucción inmediata (87,5 vs 8,6%).
Complicaciones y recomendaciones prácticasAdemás de una técnica radioterápica muy optimizada, tal y como se ha mencionado, debe realizarse con dosimetría tridimensional y altas energías (el cobalto debe ser desestimado), y se deben extremar las medidas preventivas.
Durante la irradiación es importante una hidratación de la piel con cremas y son especialmente útiles aquellas con aloe. Si aparece la dermitis, las cremas con urea facilitan el control de los síntomas. Los fenómenos tóxicos precoces asociados a la irradiación de la mama fundamentalmente son la inflamación y el edema, seguidos de la sequedad y la descamación e hiperpigmentación de la piel, pudiendo asociarse a prurito e hipersensibilidad local. Todos ellos son dependientes de la dosis y, generalmente, reversibles43.
En cuanto a la toxicidad tardía, la complicación más importante, desde el punto de vista de la estética, es la fibrosis. Esta se caracteriza por un oscurecimiento de la piel con endurecimiento de todo el tejido y, en ocasiones, dolor acompañante. Esta complicación no suele ser muy grave, pero suele ser irreversible. Algunas mamas reconstruidas tendrán una consistencia firme y dura, siendo la complicación tardía más frecuente la encapsulación o contractura capsular. Esta complicación cursa con dolor, fijación de la prótesis a los planos subyacentes y apariencia esférica de la mama, perdiendo la morfología típica y deseable del perfil mamario. Existen múltiples clasificaciones de las contracturas capsulares, aunque la más comúnmente empleada es la de Spear y Baker basada en el grado de dureza y el efecto estético44 (tabla 1). La contractura capsular es la manifestación clínica exacerbada del fenómeno fisiológico consistente en la formación de una cápsula fibrosa en torno a la prótesis. Histológicamente se compone de diferentes capas de colágeno con miofibroblastos entre ellas.
Clasificación de Spear y Baker para la valoración de la contractura capsular
| Clase IA | Mama reconstruída absolutamente natural |
| Clase IB | El implante puede ser detectable mediante examen físico o inspección |
| Clase II | El implante es detectado mediante inspección o examen físico, mama reconstruída ligeramente firme |
| Clase III | El implante es francamente detectable, pero el resultado es aceptable, mama reconstruída moderadamente firme |
| Clase IV | Contractura capsular periprotésica severa con resultado estético inaceptable y/o presencia de síntomas significativos, que requieren reintervención quirúrgica |
Fuente: Spear y Baker44.
Otras complicaciones incluyen pérdida de elasticidad de la piel, infecciones, dolor en el lugar del implante, rotura del mismo, dehiscencia de la herida y migración de la prótesis. Estas complicaciones pueden obligar a retirar la prótesis. Otro de los signos que pueden magnificarse con la aplicación de radioterapia tras la reconstrucción con prótesis es el rippling, o aparición y sensación de «arrugas» en la superficie de la mama, especialmente en los casos en los que la cobertura de la prótesis con un tejido musculoaponeurótico adecuado ha sido incompleta.
ConclusionesLos resultados de la reconstrucción mamaria son, en general, muy satisfactorios. Sin embargo, al asociar radioterapia estos resultados pueden empeorar, especialmente al administrar la irradiación tras la cirugía reconstructora. Por ello, si conocemos previamente la necesidad de irradiar, es mejor plantear a la paciente una reconstrucción diferida. Sin embargo, existen pacientes que no aceptan la mastectomía sin reconstrucción inmediata o bien existen casos en los que no se preveía la irradiación. En estos casos en los que se realiza una reconstrucción inmediata, los mejores resultados se obtienen con el empleo de tejido autólogo. Debe destacarse que la irradiación de prótesis, ya se hayan implantado directamente o en asociación con tejidos autólogos (colgajo dorsal ancho más prótesis), no comporta una disminución de la eficacia de la irradiación, sino un empeoramiento del resultado estético, especialmente en relación con la aparición de contractura capsular. Las dosis a administrar serán las habituales en neoplasias de mama y la técnica de irradiación deberá estar basada en dosimetría tridimensional con imágenes de TC. La irradiación se realizará con fotones de alta energía de un acelerador lineal.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.