la resonancia magnética es el método diagnóstico más preciso en la evaluación de la enfermedad residual en el cáncer de mama tratado con quimioterapia neoadyuvante. La mamografía con contraste puede ser una alternativa eficaz a la resonancia en la evaluación de tumor residual. Esta técnica disminuiría los costes significativamente, mejoraría el flujo de pacientes y apenas tiene contraindicaciones.
Métodoshemos realizado un estudio observacional y prospectivo en 43 pacientes con cáncer de mama tratadas con quimioterapia neoadyuvante. El estudio prequirúrgico incluyó tanto la mamografía con inyección de contraste como la resonancia magnética. Se correlacionó el tamaño tumoral residual por imagen con el estudio anatomopatológico posquirúrgico.
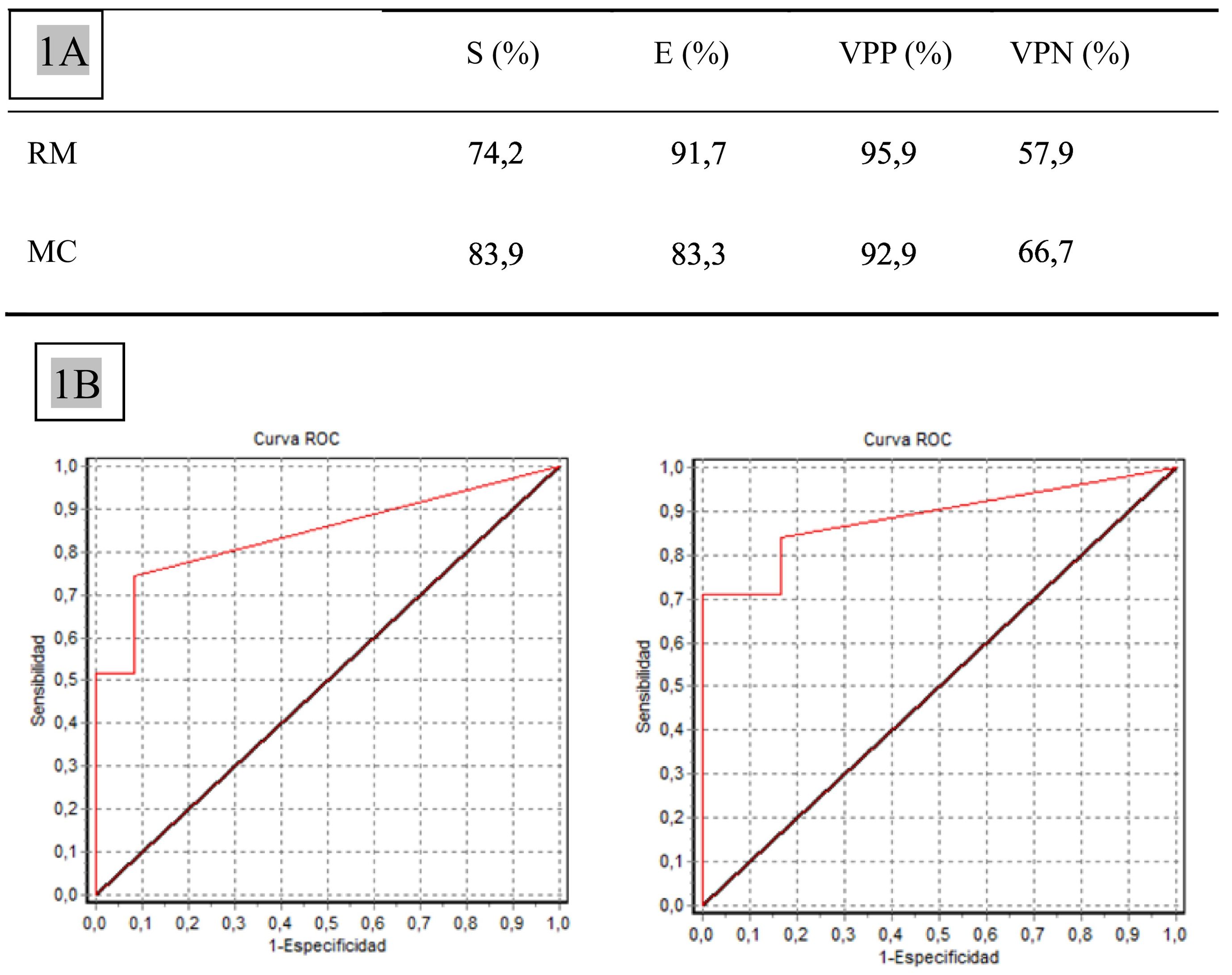
Resultadosla MC presenta un coeficiente de correlación interclase superior al de la RM (0,9 vs. 0,7). Los valores de sensibilidad y especificidad de la MC (83,9 y 83,3%) son altos y equiparables a los de la RM (74,2 y 91,6%). Además, el valor predictivo negativo de la MC es mayor que el de la RM (66,7 vs. 57,9%) y VPP es muy similar (92,9 vs. 95,8%).
Conclusiónla mamografía con contraste es una prueba equiparable a la resonancia magnética para la evaluación de la respuesta tumoral posneoadyuvancia en las pacientes con cáncer de mama. También es una prueba válida para la visualización de lesiones adicionales en la misma mama o en la contralateral.
Magnetic resonance imaging is the most accurate diagnostic method for evaluating residual disease in breast cancer treated with neoadjuvant chemotherapy. Contrast-enhanced mammography can be an effective alternative to MRI in the evaluation of residual tumor. This technique would significantly reduce costs, improve patient flow and hardly has any contraindications.
MethodsWe have carried out an observational and prospective study in 43 patients with breast cancer treated with neoadjuvant chemotherapy. The pre-surgical study included both mammography with contrast injection and magnetic resonance imaging. Residual tumor size by imaging was correlated with the postoperative pathology study.
ResultsThe CM presents a higher interclass correlation coefficient than the RM (0.9 vs. 0.7). The sensitivity and specificity values of CM (83.9% and 83.3%) are high and comparable to those of MRI (74.2% and 91.6%). Furthermore, the negative predictive value of CM is greater than that of MRI (66.7% vs 57.9%) and PPV is very similar (92.9% vs 95.8%).
ConclusionContrast-enhanced mammography is a test comparable to magnetic resonance imaging for the evaluation of post-neoadjuvant tumor response in patients with breast cancer. It is also a valid test in visualizing additional lesions in the same or contralateral breast.
La utilización de la quimioterapia neoadyuvante (QTNA) permite reducir o eliminar la carga tumoral en un porcentaje significativo de pacientes con cáncer de mama1 y aumentar la proporción de cirugías conservadoras2. Su objetivo principal consiste en lograr una respuesta patológica completa (RCP), que se consigue entre el 10 y el 25% de las ocasiones3, lo que se traduce en un pronóstico más favorable. Además, esta estrategia terapéutica permite valorar la quimiosensibilidad tumoral.
Una evaluación precisa de la respuesta tumoral a la QTNA proporciona una información imprescindible para una correcta planificación quirúrgica del cáncer de mama.
La resonancia magnética (RM) valora el tamaño tumoral y la presencia de focos adicionales (multifocalidad o multicentricidad). Se ha determinado que en el 16% de las RM prequirúrgicas se detecta enfermedad adicional4. Es además una técnica muy sensible para la identificación de tumor residual tras la QTNA5, siendo actualmente una prueba fundamental para la planificación quirúrgica de las pacientes con cáncer de mama tratadas con QTNA6.
Una nueva técnica a tener en cuenta es la mamografía con contraste (MC). Consiste en realizar una imagen de baja energía (26–32 kV), similar a la obtenida a la mamografía digital usual7, que aporta información sobre el tejido glandular y las microcalcificaciones8, y otra imagen de alta energía (45–49 kV), que permite mejor detección de las áreas que captan contraste iodado9. Ambas se usan para generar una imagen denominada «combinada», que consiste en una sustracción digital para poner de manifiesto las lesiones que captan contraste. La precisión diagnóstica de la MC en el cáncer de mama es significativamente superior a la mamografía digital simple10.
La mamografía con contraste permite obtener de forma fácil y con bajo coste una mamografía con alta sensibilidad, similar a la RM8.
El objetivo de nuestro trabajo es comparar la precisión diagnóstica de la RM y la MC, para detectar la presencia de enfermedad residual y para determinar el tamaño tumoral residual, en las pacientes con cáncer de mama tratadas con QTNA.
Material y métodosPoblación a estudioRealizamos un estudio observacional y prospectivo entre marzo y diciembre de 2017 que incluyó 43 pacientes con cáncer de mama tratado con QTNA. El estudio prequirúrgico incluyó tanto la MC como RM posneoadyuvancia.
Los criterios de inclusión fueron: pacientes con diagnóstico histopatológico de cáncer de mama invasivo mediante biopsia con aguja gruesa tratadas con QTNA, edad comprendida entre 18 y 75 años y estudio prequirúrgico post-QTNA para valorar respuesta realizado con MC y RM.
Protocolo de estudio de la mamografía con contrasteEl estudio se llevó a cabo con un equipo Selenia® Dimensions® (Hologic, Holanda). Se obtuvieron 2 imágenes de cada mama comenzando por la mama patológica, en proyecciones craneocaudal y oblicuo-mediolateral lateral. Todo el estudio se realizó a los 2 minutos de la inyección de iopramida (Ultravist®, Bayer), con una concentración de 1,5 ml/kg de peso por paciente, máximo de 100 ml, a un flujo de 2,5–3 ml/seg.
Protocolo de estudio de resonancia de mamaEn nuestro hospital disponemos de 2 resonancias de 1,5 T y una de 3 T Philips (Best, Holanda), si bien la mayoría de los estudios se realizaron en la máquina de 1,5 T, empleando la de 3 T únicamente en las pacientes obesas.
Se comenzó el estudio con 2 secuencias turbo spin eco (TSE) en axial, potenciada en T1 (TR: 494 ms, TE: 8 ms, número señales adquiridas: 2, grosor de corte: 3 mm con intervalo de 0,3 mm) y potenciada en T2 con supresión grasa (TR: 5.000 ms, TE: 120 ms, número de señales: 2, con grosor de corte de 3 mm a un intervalo de 0,3 mm), seguido de imágenes potenciadas en difusión con valores B = 0 y B = 1.000, para terminar con una serie dinámica turbo eco de gradiente 3D potenciada en T1 con supresión grasa (TR: 23 ms, TE: 5,7 ms, ángulo inclinación de 20°, grosor de corte de 2 mm). Como medio de contraste se utilizó gadoterato de meglumina (Dotarem®, Guerbet), con una concentración de 0,1 mmol/kg, inyectado a un flujo de 2 ml/s, seguido de un bolo de suero fisiológico. En total se adquirieron 6 series, la primera previa a la inyección de contraste, seguida de 5–7 series tras la administración del mismo.
Quimioterapia neoadyuvanteTodas las pacientes recibieron un esquema de quimioterapia que combinaba antraciclinas y taxanos, salvo una paciente tratada con régimen de taxanos. Las pacientes HER2+ recibieron bloqueo anti-Her2 en combinación con quimioterapia.
Anatomía patológicaTodos los especímenes quirúrgicos se fijaron en formalina 10% neutra tamponada durante 24 horas. Posteriormente se realizaron cortes en secciones de 5 mm de espesor.
Para el examen histológico se utilizó la tinción de hematoxilina y eosina. Cuando el tumor residual era claramente visible se hizo una medición grosera, mientras que si el tumor no era evidente, se localizó el marcador de clip colocado antes de la QTNA, y se examinaron microscópicamente diapositivas desde el bloque que contiene el marcador, así como los bloques adyacentes. El mayor diámetro tumoral proporcionado por el patólogo se utilizó en el estudio comparativo.
Se consideró la respuesta completa si no se encontró cáncer invasivo en el espécimen quirúrgico después de la QTNA, independientemente de la presencia de carcinoma in situ.
Análisis estadísticoSe estudió la validez diagnóstica de la MC y de la RM en la detección de enfermedad residual tras la QTNA mediante el cálculo de la sensibilidad, especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN). Se define el VPP (VP/VP + FP) como la precisión de la prueba para detectar enfermedad residual y el VPN (VN/VN + FN) como la precisión de la prueba para predecir una respuesta completa.
Se realizaron curvas ROC y se calculó el AUC de ambas pruebas diagnósticas. Además, se determinó la discrepancia, coeficiente de correlación intraclase.
Mediante los métodos de Pearson y Rho de Spearman analizamos la correlación entre el tamaño tumoral medido con las pruebas de imagen y el estudio anatomo-patológico.
El análisis estadístico se realizó utilizando la versión 23 del programa estadístico IBM SPSS y epidat 4.0.
ResultadosEn el presente estudio se incluyeron 43 pacientes diagnosticadas de cáncer de mama tratadas con QTNA, realizándose un estudio prequirúrgico con MC y RM para la valoración de la respuesta tumoral.
La tabla 1 resume las características clínico-patológicas de las pacientes. La edad media fue de 53, 4 años, presentando el 30% de las pacientes una edad inferior a los 45 años.
Características clínico-patológicas de las pacientes
| VARIABLES | Media | DE | Rango |
|---|---|---|---|
| Edad (años) | 53,4 | 13,3 | 34–76 |
| n | % | ||
| Tamaño tumoral inicial | ≤ 5 cm | 29 | 67,4 |
| > 5cm | 14 | 32,6 | |
| Grado histologico | Bajo | 1 | 2,3 |
| Intermedio | 11 | 25,6 | |
| Alto | 31 | 72,1 | |
| Tipo histológico | Ductal | 42 | 97,7 |
| Lobulillar | 1 | 2,3 | |
| Estatus HER-2 | Positivo | 18 | 41,9 |
| Negativo | 25 | 58,1 | |
| Estatus RE | Positivo | 25 | 58,1 |
| Negativo | 18 | 41,9 |
DE: desviación estándar; HER-2: receptor 2 del factor de crecimiento epidérmico humano; RE: receptor de estrógenos.
El 97,7% de los casos fueron carcinomas ductales infiltrantes, mostrando el 72% alto grado histológico.
Los subtipos moleculares de los tumores incluidos en el estudio fueron: 1 luminal A (2,3%), 11 luminal B HER2- (25,6%), 13 luminal B HER2+ (30,2%), 5 HER2+ puro (11,6%) y 13 triple negativo (30,2%).
El diámetro tumoral residual máximo medido con MC fue de 8 cm, por RM de 7 cm y en el informe anatomo-patológico de la pieza quirúrgica fue 10 cm. La media del tamaño tumoral posneoadyuvancia fue de 1,69 cm en RM, 1,82 cm en MC y de 1,87 cm en el estudio anatomo-patológico. La diferencia de medias entre MC y RM con el tamaño del tumor residual real fue de 0,97 y 0,98 cm, respectivamente.
Los valores de sensibilidad y especificidad de la MC (83,9 y 83,3%, respectivamente) fueron altos y totalmente equiparables a los de la RM (74,2 y 91%, respectivamente). Además, el VPN de la MC fue mayor que el de la RM (66,7 vs. 57,9%) y el VPP fue muy similar (92,9 vs. 95,9%) (fig. 1A).
Mediante la realización de curvas ROC se calculó el área bajo la curva: 0,88 para MC y 0,84 para RM, indicando el buen rendimiento diagnóstico de ambas pruebas (fig. 1B).
De las 43 pacientes incluidas en nuestro estudio, 12 (27,9%) presentaron respuesta patológica completa, mientras que en 31 (72,1%) persistía tumor residual. De todas las respuestas patológicas no completas, 24 (77,4%) fueron detectadas como tal por RM y 28 (90,3%) por MC.
Se realizaron determinaciones del tamaño tumoral residual (diámetro máximo) tanto en MC como en RM y se comparó con el tamaño valorado en anatomía patológica (AP), no existiendo diferencias significativas entre la RM y la MC tomando como referencia la AP. Además, la MC presentó un coeficiente de correlación intraclase superior al de la RM (0,9 vs. 0,7).
Mediante los métodos de correlación de Pearson y Rho de Spearman se confirma una correlación positiva alta entre el tamaño tumoral medido mediante MC y el determinado por RM y AP, con valores de 0,7 y 0,83 respectivamente.
Asimismo, si comparamos ambos modelos, RM y MC, observamos que no existe una diferencia significativa en discrepancia ni valores anómalos, aunque comparando cada uno de los modelos con el gold standard, la anatomía patológica, se observa menor dispersión de los resultados con MC comparando con la RM (fig. 2) .
Menor dispersión de los resultados de tamaño tumoral determinados por la mamografía con contraste (diagrama de la izquierda), con respecto a la resonancia magnética (diagrama de la derecha), comparando con la anatomía patológica. Observamos mayor variabilidad en los valores de la resonancia magnética.
En este estudio prospectivo, al comparar la precisión de la mamografía con inyección con contraste con el estudio de RM de mama, hemos demostrado que los resultados son equiparables con ambas técnicas en la medición del tamaño tumoral residual tras la QTNA (figs. 3 y 4).
Mujer de 37 años con múltiples nódulos hipercaptantes. A) Afectación a la práctica totalidad del cuadrante súpero-interno de la mama izquierda, en estudio de mamografía convencional (izquierda) y en estudio de mamografía con contraste (derecha). B) Área total aproximada de 9,7 x 4,5 x 8 cm, que se correlaciona correctamente con la imagen de resonancia. Se realizó biopsia con aguja gruesa de 2 nódulos con resultado de carcinoma ductal infiltrante.
En la actualidad, toda paciente con cáncer de mama tratada con QTNA requiere la realización de un estudio de estadificación local antes y después del mismo. En función de la respuesta, la paciente se podrá beneficiar de una cirugía conservadora. Es por ello que los cirujanos necesitan una técnica precisa para valorar el tamaño tumoral residual, permitiéndoles realizar una cirugía que garantice unos márgenes quirúrgicos libres de enfermedad.
Al igual que en nuestro trabajo, se ha demostrado en varios estudios5,11–13 una adecuada correlación del tamaño tumoral residual de la MC con el análisis anatomo-patológico en comparación con la RM, si bien ambas técnicas pueden sobreestimar el tamaño tumoral en algunos casos.
Es posible una sobreestimación del tamaño tumoral debido a distintas variables, como un gran tamaño tumoral basal, el edema circundante que genera una lesión o la necrosis central. También es sabido que los taxanos tienen mayor actividad antiangiogénica comparados con las antraciclinas, que unido a la menor respuesta inflamatoria pueden producir menor realce del tumor14.
Por otra parte, la pérdida de celularidad no siempre se traduce en disminución de tamaño del tumor, pues puede existir fibrosis, que no captaría gadolinio, y pequeños focos celulares tumorales seguirían nutriéndose por difusión, no por perfusión vascular15, que se podrían demostrar en la MC. Fallenberg et al.3 comprobaron que puede existir mayor realce y mejor visualización en la MC comparada con la resonancia, ya que a diferencia del lavado rápido del gadolinio, el realce en la MC puede persistir más de 10 minutos, secundario a que el contraste iodado se mueve entre los ductos por difusión, permaneciendo durante más tiempo16. Las diferencias en la estructura y el mecanismo del gadolinio y los agentes iodados también pueden contribuir a la variabilidad en la visibilidad de las lesiones17.
Otra ventaja de la MC sobre la RM es el bajo coste y el menor tiempo de exploración18.
Patel describió en 2016 que una RM tiene un coste aproximado de US$775, mientras que una mamografía con inyección de contraste únicamente cuesta US$196, diferencia muy significativa, que es más importante si tenemos en cuenta el coste del equipamiento y su mantenimiento19.
El tiempo de adquisición de la MC es de 7–10 minutos, mucho más corto que la RM, que necesita 20–30 minutos. Además se adquieren muchas menos imágenes en la MC. Todo ello resulta en una mejor tolerancia por el paciente y menor inversión en el tiempo de lectura del radiólogo17.
Se ha demostrado la preferencia de las pacientes por el uso de la MC frente a la RM (p < 0,001), por ser un procedimiento más rápido, más confortable, con menor nivel de ruido y que produce menores tasas de ansiedad20. Entre el 1–15% de las pacientes a las que se realiza RM requieren sedación para evitar la claustrofobia18.
Además, la MC es accesible en más áreas, necesitando únicamente una modificación en el software y hardware en los aparatos compatibles, que pueden estar presentes en hospitales de menor tamaño o clínicas pequeñas21.
Es necesario destacar que algunas lesiones mamarias detectadas por mamografía pueden pasar desapercibidas en la RM. La MC permite visualizar, además de las estructuras vascularizadas (imagen recombinada), las microcalcificaciones en la imagen generada con baja energía22, las cuales tienen limitación en la RM, que pueden corresponder a carcinoma in situ23. Esto es importante, ya que aunque el carcinoma in situ residual tras la quimioterapia se considera respuesta patológica completa, su delimitación es importante para una planificación quirúrgica correcta9.
Otra ventaja clara de la MC es que sirve como alternativa en las contraindicaciones de RM, como los pacientes portadores de dispositivos metálicos, con sobrepeso o claustrofobia.
En contraposición, la MC tiene también inconvenientes: no puede utilizarse en los pacientes con insuficiencia renal (en relación con la nefrotoxicidad del contraste iodado), requiere comprimir la mama y el hecho de que algunas pacientes manifiesten molestias durante la inyección de contraste iodado24.
En cuanto a las reacciones por contraste, son más frecuentes con el contraste iodado, un 0,2–0,4%25, similares a las que ocurren en TC, mientras que al gadolinio son mucho menores, 0,001–0,01%26, si bien se ha descrito un efecto adverso significativo del gadolinio, que es el depósito en los ganglios basales cerebrales27.
Es cierto que existe incremento en la dosis de radiación, si bien este es muy ligero, pues la dosis administrada a un paciente por cada par de mamografía de alta y baja energía es de 0,7–3,6 mGy, según el grosor y porcentaje de tejido glandular de la mama, es decir, el nivel de dosis es 1,2 veces al de la mamografía convencional28,22.
Como limitaciones del estudio, mencionar el pequeño tamaño muestral y que se trata de un estudio realizado en un único centro.
ConclusiónLa MC es una prueba comparable a la RM para la evaluación de la respuesta tumoral posneoadyuvancia en las pacientes con cáncer de mama.
Hemos demostrado una alta precisión de la MC, con valores de sensibilidad, especificidad y valores predictivos totalmente equiparables a la RM.
Esto supone una ventaja en múltiples aspectos. La MC podría emplearse en las pacientes con contraindicación de RM o claustrofobia. La MC asocia un menor coste y mayor disponibilidad, y permite la evaluación de hallazgos que pueden pasar desapercibidos en la RM, tales como las microcalcificaciones.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses
Consideraciones éticasLos autores declaran que se han seguido los protocolos estándar sobre la publicación de datos e imágenes de pacientes, y se ha obtenido el correspondiente consentimiento informado del paciente. Este trabajo fue aprobado por el Comité Autonómico de Ética de Investigación de Galicia Código Registro CAEI Galicia: 2017/062.