La inyección de gel de ácido hialurónico estabilizado (NASHA®-based gel) se utilizó en Europa para el aumento de volumen mamario entre 2006 y 2012. Fue un relleno biodegradable, que requería de un proceso mínimamente invasivo para su administración, manteniendo el volumen mamario durante 12-24 meses. Presentamos el caso de una paciente con diagnóstico de sospecha de lesión mixoide mamaria. Tras la exéresis quirúrgica del tumor y el análisis histopatológico se insiste a la paciente sobre sus antecedentes. Esta refiere que hace 13 años se sometió a un aumento de volumen mamario mediante la inyección de gel de ácido hialurónico. Los tumores mixoides de mama requieren de exéresis quirúrgica para su tratamiento. Su presentación más frecuente es como parte del síndrome de Carney. Por ello, la inyección de gel de ácido hialurónico debe ser tenida en cuenta en el diagnóstico diferencial de estas lesiones ya que, a pesar de considerarse biodegradable puede persistir radiológicamente hasta 13 años después de su administración.
Injection of stabilised hyaluronic gel (NASHA-based gel) was used in Europe to increase breast volume between 2006 and 2012. It was a biodegradable filler, requiring a minimally-invasive procedure for its administration, with breast volume being maintained for 12-24 months. We report the case of a female patient with a putative diagnosis of myxoid breast tumour. After surgical resection of the tumour and histopathological analysis, the patient was asked about her history. She reported that she had undergone breast augmentation 13 years previously through hyaluronic gel infection. Myxyoid breast tumours require sugical excision. Their most frequent presentation is as part of Carney syndrome. Consequently, hyaluronic acid infection should be included in the differential diagnosis between these lesions, since, although the gel is biodegradable, it can persist radiologically for up to 13 years after its administration.
Los tumores mixoides de mama son neoplasias mesenquimales benignas de presentación infrecuente. El diagnóstico diferencial se suele realizar con el neurofibroma mixoide, mixomatosis en pacientes con síndrome de Carney y con el fibroadenoma o tumor phyllodes con cambios estromales mixoides1.
La inyección en la mama de agentes externos como el Macrolane VRF®, un gel de ácido hialurónico estabilizado y biodegradable utilizado entre 2006-2012 para aumentar el volumen mamario, puede generar lesiones encapsuladas de apariencia similar a una lesión mixoide, por lo que se debería tener en cuenta al realizar la historia clínica e incluir en el diagnóstico diferencial2.
Caso clínicoPresentamos el caso de una mujer de 55 años, natural de Inglaterra, remitida a consultas ante el hallazgo de una lesión de baja sospecha en mama derecha durante el screening. Al no residir en España previamente, no se disponía de estudios de cribado previos para comparar. La paciente no refería antecedentes familiares ni personales de interés ni intervenciones quirúrgicas previas.
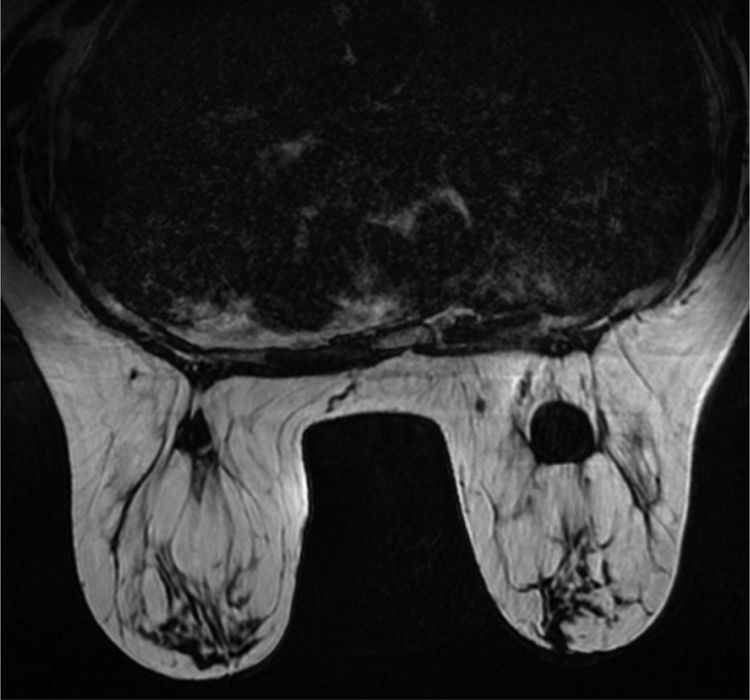
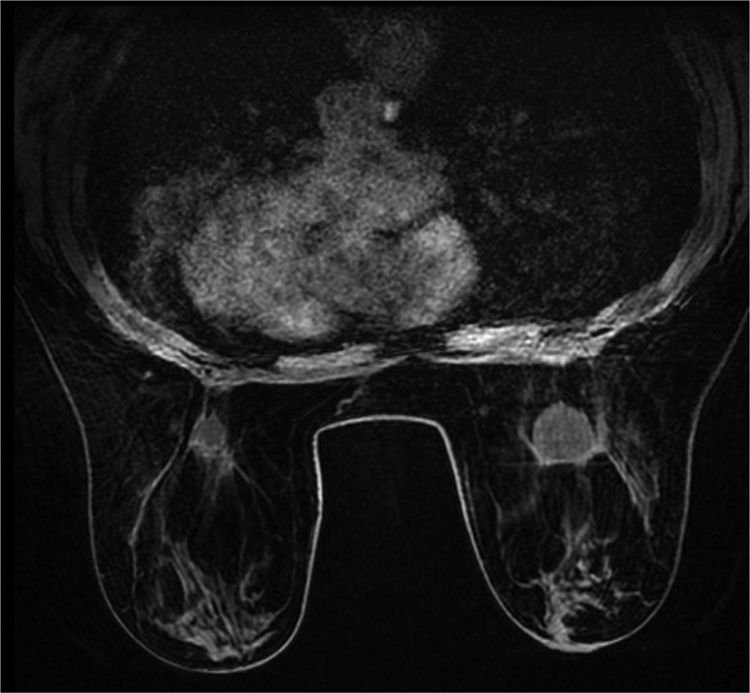
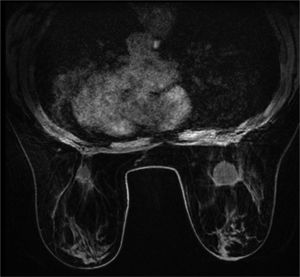
En la ecografía y mamografía se evidenció un nódulo sólido-quístico en región centromamaria profunda derecha de 2,8cm, BIRADS 3. En mama izquierda se observó un quiste simple centromamario profundo, BIRADS 2. Se realizó PAAF de la lesión de mama derecha que informó de «lesión mixoide». Los 3 cilindros de tejido tomados por BAG fueron compatibles con tejido fibroadiposo, sin identificar parénquima mamario. Se completó el estudio con resonancia magnética (RM) que informó de nódulo en mama derecha de bordes definidos retroareolar profundo de 2,4cm hipointenso en T1 e hiperintenso en T2, sin realce interno ni de pared (figs. 1 y 2). Se observaron a su vez, 2 lesiones quísticas de 5 y 9mm adyacentes. En mama izquierda se objetivó un nódulo de aspecto benigno retroareolar izquierdo de 1,3cm, categoría BIRADS 2.
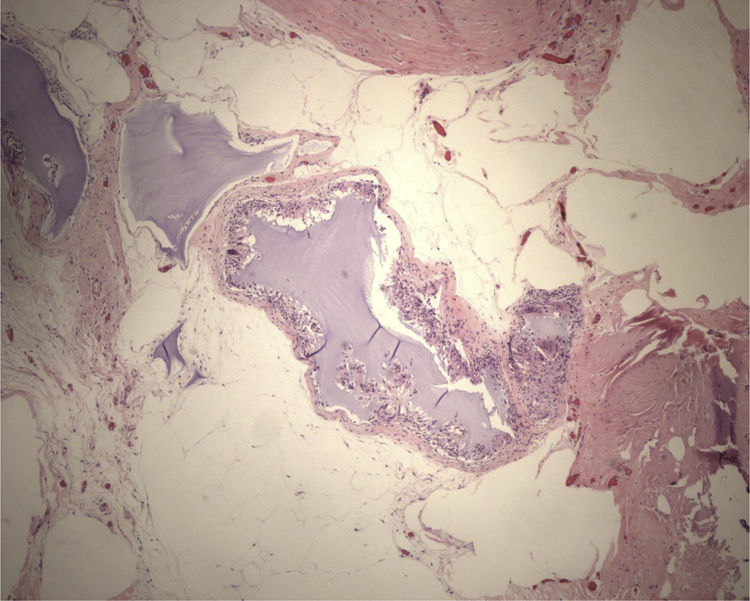
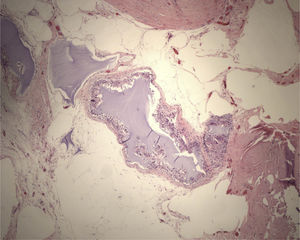
Ante la sospecha de lesión mixoide, tanto por los resultados de la PAAF, como por sus características radiológicas, se indicó intervención quirúrgica programada realizando tumorectomía guiada con arpón. Macroscópicamente la tumoración presentaba un aspecto sólido-quístico y a la sección presentaba material de aspecto mucoide en su interior. El examen microscópico demostró la presencia de agregados de material mixoide intersticial con reacción a cuerpo extraño y formación de seudoquistes (fig. 3). La paciente evolucionó favorablemente, siendo alta a las 24h de la intervención.
Al volver a preguntar a la paciente sobre sus antecedentes, había omitido el hecho de que 13 años atrás se sometió a un aumento de pecho mediante la inyección de gel de ácido hialurónico.
DiscusiónComo respuesta a los requerimientos estéticos de la sociedad actual sobre el aumento de volumen mamario, surgen múltiples alternativas al tratamiento quirúrgico convencional de implantes protésicos, como el lipofilling o el gel inyectable de ácido hialurónico estabilizado (NASHA®-based gel) como Macrolane VRF® (Q-Med, Uppsala, Suecia)2,3.
La inyección de NASHA®-based gel empezó a utilizarse en Europa para el aumento de volumen mamario en 2006. Se caracterizó por ser un relleno biodegradable, que requería una inyección bajo anestesia local para la colocación de uno o varios depósitos de gel entre la fascia pectoral y el tejido glandular mamario mediante un proceso mínimamente invasivo. Se estimaba que su duración era de 12-24 meses pudiendo requerir de nuevas inyecciones para mantener el volumen mamario deseado. Su complicación más frecuente fue la contractura capsular3.
Estudios posteriores demostraron que generaba distorsiones de la arquitectura mamaria dificultando la detección radiológica de neoplasias. Scaperrotta et al. publicaron las características radiológicas del gel hialurónico en la mama tales como el aumento de densidad en la mamografía, anecogenicidad en la ecografía e hipointensidad en T1 e hiperintensidad en T2 en la RM sin mostrar realce. Concluyen que, a pesar de que estas imágenes se pueden diferenciar con facilidad de una imagen compatible con neoplasia, sí que puede enmascarar otras lesiones subyacentes. Además, evidenciaron que mediante ecografía o RM se pueden observar pequeñas cantidades de este gel hasta pasados 4 años de la inyección y simular radiológicamente un tumor benigno de mama. De esta forma, el Macrolane VRF®, fue retirado por sus distribuidores del mercado mundial para el aumento del volumen mamario al interferir con las imágenes de la mama y la detección del cáncer de mama4.
La mama supone una localización infrecuente del tumor mixoide, y han sido comunicados hasta la fecha unos pocos casos. La presentación más frecuente de los tumores mixoides mamarios es como parte del complejo de Carney. Este síndrome descrito en 1985 consiste en una afección multisistémica, de transmisión autosómica dominante originada por una alteración en el cromosoma 7 (17q22-24) o 2 (2p16) que cursa con la presencia de mixomas cardíacos, cutáneos y mamarios, asociados a lentiginosis cutánea, y tumores endocrinos de origen adrenal más frecuentemente o gonadales, tiroideos o hipofisarios5,6.
Los tumores mixoides de la mama tienen como origen el tejido mesenquimático. Histopatológicamente aparecen como lesiones bien circunscritas, hipocelulares con núcleos picnóticos pequeños dispersos en una matriz extracelular mixoide7. En general son tumores de comportamiento benigno, aunque se han descrito casos de degeneración maligna.
Clínica y radiológicamente se asemejan a tumoraciones benignas, si bien su diagnóstico preoperatorio es difícil. La PAAF ha diagnosticado algunos casos8, pero lo habitual, es que no se sospeche la naturaleza del proceso. La BAG contribuye a filiar histológicamente la lesión, pudiendo requerir BAV en aquellos casos en los que la primera no sea diagnóstica o exista discordancia entre la histología y la radiología. Esto se debe a que la BAV permite extraer numerosas muestras y de mayor calibre que la BAG, siendo de mayor utilidad en el diagnóstico de lesiones complejas, como las microcalcificaciones, densidades asimétricas amplias o quistes complejos9. Como tratamiento se recomienda su exéresis quirúrgica con márgenes libres ya que tienden a recurrir en caso de resecciones incompletas10.
Clásicamente, el diagnóstico diferencial se establece entre el mixoma solitario de mama, el fibroadenoma o el tumor phyllodes con cambios mixoides estromales, y con el complejo de Carney1. A partir de nuestra experiencia, incluimos un diagnóstico diferencial añadido, el de la encapsulación secundaria a reacción a cuerpo extraño tras la inyección de gel hialurónico.
Como conclusión, la inyección de gel de ácido hialurónico debe ser tenida en cuenta en el diagnóstico diferencial de las lesiones mixoides de mama ya que, a pesar de considerarse biodegradable puede persistir radiológicamente hasta 13 años después de su administración. Además, se debe insistir durante la anamnesis al realizar la historia clínica, pues al utilizar una técnica mínimamente invasiva los pacientes pueden no considerarlo un antecedente médico-quirúrgico de interés.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Consideraciones éticasLa publicación de estos datos fue aprobada por el Comité de Ética e Investigación del centro y la paciente firmó un consentimiento informado.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.