La European Society of Mastology (EUSOMA) propone criterios de calidad en el diagnóstico y tratamiento del cáncer de mama y recomienda la evaluación de las Unidades de Mama aplicando dichos criterios. En nuestro centro, coincidiendo con la acreditación de la Unidad de Mama por la Sociedad Española de Senología y Patología Mamaria (SESPM) en el año 2000, se asignaron 2 cirujanos a dedicación preferente a la misma. El objetivo es evaluar la repercusión en parámetros quirúrgicos y los criterios de calidad relacionados con el tratamiento quirúrgico tras la adscripción de los cirujanos a la patología mamaria.
Material y métodosEstudio retrospectivo de pacientes tratadas de cáncer de mama entre 1990 y 2010, distribuidas en dos periodos, A; 1990-1999 y B; 2000-2010. Se evalúan datos demográficos, diagnósticos, el tratamiento aplicado, las complicaciones postoperatorias, el seguimiento, la recidiva y 10 criterios de calidad propuestos por EUSOMA.
ResultadosLa serie se compone de 1.881 mujeres intervenidas por cáncer de mama, 671 en el periodo A y 1.210 en el B. Se han encontrado diferencias significativas entre ambos periodos en la estancia (9,8 días vs. 2,7 días) y complicaciones postoperatorias (17,4% vs. 10%). Existe mejoría significativa en el periodo B en 6 de los 10 criterios evaluados.
ConclusionesLa dedicación preferente de los cirujanos a la patología de la mama dentro de una Unidad de Mama ha conseguido reducir las complicaciones y la estancia hospitalaria postoperatoria, se ha obtenido mejoría en los criterios de calidad que evalúan el diagnóstico completo, la indicación y el tratamiento de los ganglios axilares y el seguimiento postoperatorio.
The European Society of Mastology (EUSOMA) has proposed quality criteria in the diagnosis and treatment of breast cancer and recommends the evaluation of breast units applying these criteria. In our centre, coinciding with the accreditation of the breast unit by the Spanish Society of Senology and Breast Pathology in 2000, two surgeons were assigned to work full-time in breast cancer. The objective of this study was to evaluate the effects of the surgeons’ secondment to breast disease on the surgical parameters and the quality criteria related to surgical treatment.
Material and methodsWe performed a retrospective study that included patients treated for breast cancer between 1990 and 2010, divided into two periods, A; 1990-1999 and B; 2000-2010. We evaluated demographic data, diagnoses, treatment, postoperative complications, follow-up, recurrence, and the 10 quality criteria related to surgical treatment proposed by EUSOMA.
ResultsThe series consisted of 1,881 women who underwent surgery for breast cancer: 671 in period A and 1210 in B. There were significant differences between the two periods in postoperative stay (9.8 vs. 2.7 days) and postoperative complications (17.4% vs. 10%). Significant improvement was found in period B in 6 of the 10 criteria evaluated.
ConclusionsAssigning two surgeons to work full-time in a breast unit reduced complications and postoperative hospital stay, and improved the quality criteria that assess complete diagnosis, indication and treatment of axillary lymph nodes and postoperative follow-up.
El cáncer de mama es el tumor más frecuente y la primera causa de mortalidad por cáncer en las mujeres1. Las principales sociedades de patología de mama2,3 y la Comisión Europea4 recomiendan que el tratamiento de esta enfermedad se realice en Unidades de Mama (UM). Las UM son unidades asistenciales, multidisciplinares, relacionadas con la patología de la mama, atendidas por profesionales con especial formación y dedicación preferente o exclusiva, en perfecta conjunción y en las que se obtienen los mejores resultados para las pacientes5.
La sociedad europea de especialistas en cáncer de mama (European Society of Mastology [EUSOMA]) establece que la UM debe abordar íntegramente el cáncer de mama y el equipo central de las UM debe estar formado por especialistas en Radiología, Cirugía, Anatomía Patológica, Oncología Médica, Radioterapia y Enfermería, todos con dedicación preferente y formación continua en Senología2,6.
El tratamiento del cáncer de mama es complejo e implica a múltiples especialistas, por lo que los indicadores de calidad son esenciales para monitorizar la eficacia y garantizar un tratamiento de óptimo nivel. Se han definido criterios de calidad (CdC) con amplia aceptación para evaluar el proceso de manera global7-9. Prestigiosas sociedades de Senología recomiendan evaluaciones periódicas de los CdC en las UM10,11. En 1997, la Sociedad Española de Senología y Patología Mamaria (SESPM) fijó unas condiciones mínimas para la acreditación de UM en España12.
En 1990 se creó en Navarra la Unidad de Detección Precoz de Cáncer de Mama (UDPCM) y comenzó a abordarse la patología de la mama por Unidades Interdisciplinares compuestas por radiólogos, patólogos, oncólogos, radioterapeutas y cirujanos generales. En nuestro centro 3 cirujanos trataban la patología de la mama con dedicación parcial. En el año 2000, coincidiendo con la acreditación de la UM por la SESPM, se designan 2 cirujanos con dedicación preferente a la patología mamaria, lo que supone que dedican la totalidad de su labor asistencial ordinaria a la patología de la mama.
El objetivo de este trabajo es evaluar la repercusión de la adscripción de cirujanos con dedicación preferente a la patología mamaria en el tratamiento quirúrgico y en los CdC de EUSOMA referidos a dicho tratamiento.
Material y métodosSe trata de un estudio observacional retrospectivo sobre una base de datos creada de forma prospectiva. La recogida de datos ha sido realizada por los cirujanos en la consulta preoperatoria, durante la hospitalización y en las posteriores revisiones. Todos los casos de este estudio han sido evaluados y discutidos en el comité multidisciplinar de patología mamaria. Se incluyeron mujeres intervenidas de carcinoma (infiltrante y ductal in situ) de mama en nuestro centro, entre los años 1990 y 2010. La recogida de datos sobre seguimiento se cerró en octubre de 2016. Este estudio ha sido aprobado por el comité de ética del Complejo Hospitalario de Navarra.
El estudio analiza dos periodos, atendiendo a la dedicación de cirujanos a la patología mamaria: periodo A, pacientes intervenidas entre 1990 y 1999 (sin dedicación preferente) y periodo B, entre 2000 y 2010 (con dedicación preferente). Se han valorado y comparado datos demográficos (edad y procedencia de las pacientes), número de pacientes tratadas en los dos periodos, procedimientos diagnósticos (mamografía, ecografía, resonancia magnética y biopsia previa a la intervención), tratamiento quirúrgico aplicado en la mama (radical o conservador), tratamiento de la axila, estancia hospitalaria dependiendo del tipo de cirugía, complicaciones postoperatorias inmediatas y tardías, características del tumor en el momento del tratamiento quirúrgico (tamaño, infiltrante o no infiltrante, grado histológico y receptores hormonales), seguimiento y recidiva local.
Las complicaciones postoperatorias inmediatas son hematoma, seroma, infección de herida quirúrgica, dehiscencia y/o necrosis cutánea en el plazo de 30 días posteriores a la intervención. El linfedema crónico se diagnosticó al constatar en la exploración física un aumento en 1,5cm o más en el diámetro de la extremidad afecta respecto a la otra extremidad en el periodo de 90 días posteriores a la intervención.
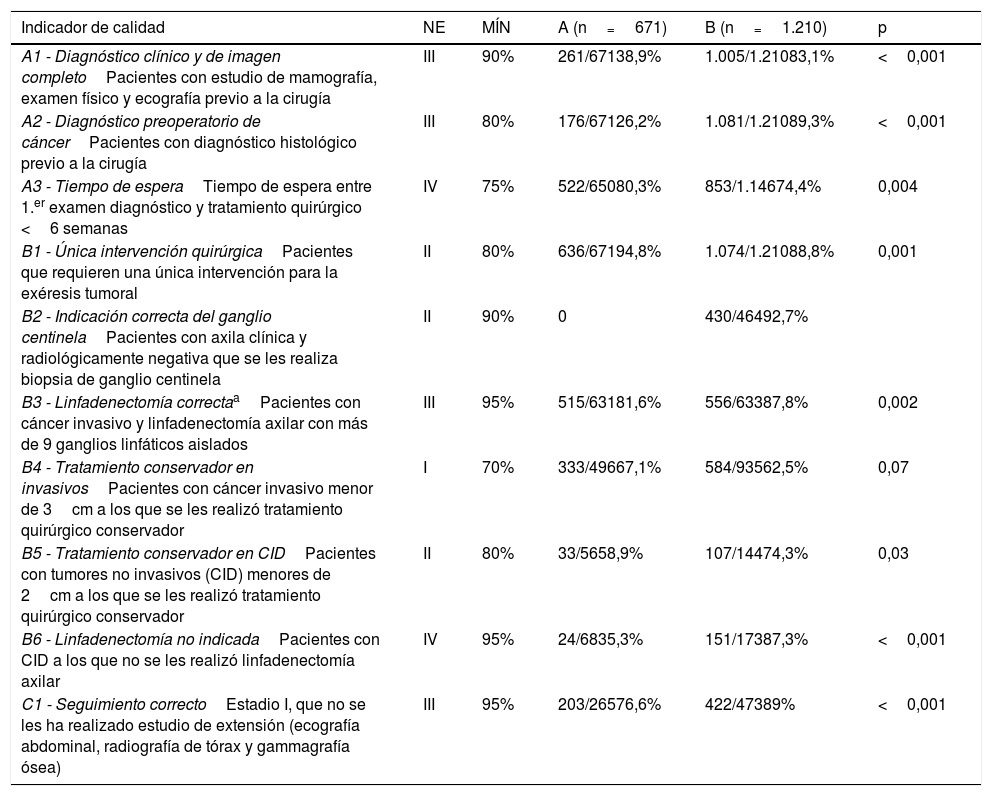
De los CdC propuestos por EUSOMA se han analizado 10, en los que influye o puede influir el trabajo de los cirujanos. Tres criterios evalúan el estudio diagnóstico y periodo preoperatorio (A1: diagnóstico clínico y de imagen completo; A2: diagnóstico histológico previo a la cirugía, y A3: tiempo de espera hasta la intervención). Seis criterios valoran la calidad del tratamiento quirúrgico aplicado: 3 la idoneidad de la cirugía (B1: única intervención quirúrgica para la exéresis tumoral; B2: indicación correcta de la biopsia del ganglio centinela —solamente realizada en el segundo periodo—, y B3: linfadenectomía axilar con más de 9 ganglios) y otros 3 valoran el sobretratamiento quirúrgico (B4: cirugía conservadora en tumores infiltrantes menores de 3cm; B5: cirugía conservadora en tumores no infiltrantes menores de 2cm, y B6: no realizar linfadenectomía en tumores no infiltrantes). Por último, un CdC evalúa el seguimiento postoperatorio (C1: no realización de estudios de extensión en estadio I). Los CdC evaluados se muestran en la tabla 1.
Cumplimiento de los criterios de calidad en los dos periodos evaluados; periodo A: 1990-1999 y periodo B: 2000-2010
| Indicador de calidad | NE | MÍN | A (n=671) | B (n=1.210) | p |
|---|---|---|---|---|---|
| A1 - Diagnóstico clínico y de imagen completoPacientes con estudio de mamografía, examen físico y ecografía previo a la cirugía | III | 90% | 261/67138,9% | 1.005/1.21083,1% | <0,001 |
| A2 - Diagnóstico preoperatorio de cáncerPacientes con diagnóstico histológico previo a la cirugía | III | 80% | 176/67126,2% | 1.081/1.21089,3% | <0,001 |
| A3 - Tiempo de esperaTiempo de espera entre 1.er examen diagnóstico y tratamiento quirúrgico <6 semanas | IV | 75% | 522/65080,3% | 853/1.14674,4% | 0,004 |
| B1 - Única intervención quirúrgicaPacientes que requieren una única intervención para la exéresis tumoral | II | 80% | 636/67194,8% | 1.074/1.21088,8% | 0,001 |
| B2 - Indicación correcta del ganglio centinelaPacientes con axila clínica y radiológicamente negativa que se les realiza biopsia de ganglio centinela | II | 90% | 0 | 430/46492,7% | |
| B3 - Linfadenectomía correctaaPacientes con cáncer invasivo y linfadenectomía axilar con más de 9 ganglios linfáticos aislados | III | 95% | 515/63181,6% | 556/63387,8% | 0,002 |
| B4 - Tratamiento conservador en invasivosPacientes con cáncer invasivo menor de 3cm a los que se les realizó tratamiento quirúrgico conservador | I | 70% | 333/49667,1% | 584/93562,5% | 0,07 |
| B5 - Tratamiento conservador en CIDPacientes con tumores no invasivos (CID) menores de 2cm a los que se les realizó tratamiento quirúrgico conservador | II | 80% | 33/5658,9% | 107/14474,3% | 0,03 |
| B6 - Linfadenectomía no indicadaPacientes con CID a los que no se les realizó linfadenectomía axilar | IV | 95% | 24/6835,3% | 151/17387,3% | <0,001 |
| C1 - Seguimiento correctoEstadio I, que no se les ha realizado estudio de extensión (ecografía abdominal, radiografía de tórax y gammagrafía ósea) | III | 95% | 203/26576,6% | 422/47389% | <0,001 |
Mínimo recomendado y nivel de evidencia científica según EUSOMA8,9.
CID: carcinoma intraductal; EUSOMA: European Society of Mastology; MÍN: mínimo estándar recomendado por EUSOMA; NE: nivel de evidencia; RT: radioterapia.
El análisis estadístico se ha realizado mediante el programa SPSS Statistics de IBM versión 22. Se comprobaron los criterios de normalidad mediante la prueba de Kolmogorov-Smirnov. Se compararon las diferencias de variables cuantitativas entre los dos periodos con la prueba t de Student o su equivalente no paramétrico, la prueba U de Mann-Witney. Se ha empleado la prueba de Ji-cuadrado de Pearson para el análisis de tablas de contingencia en variables categóricas.
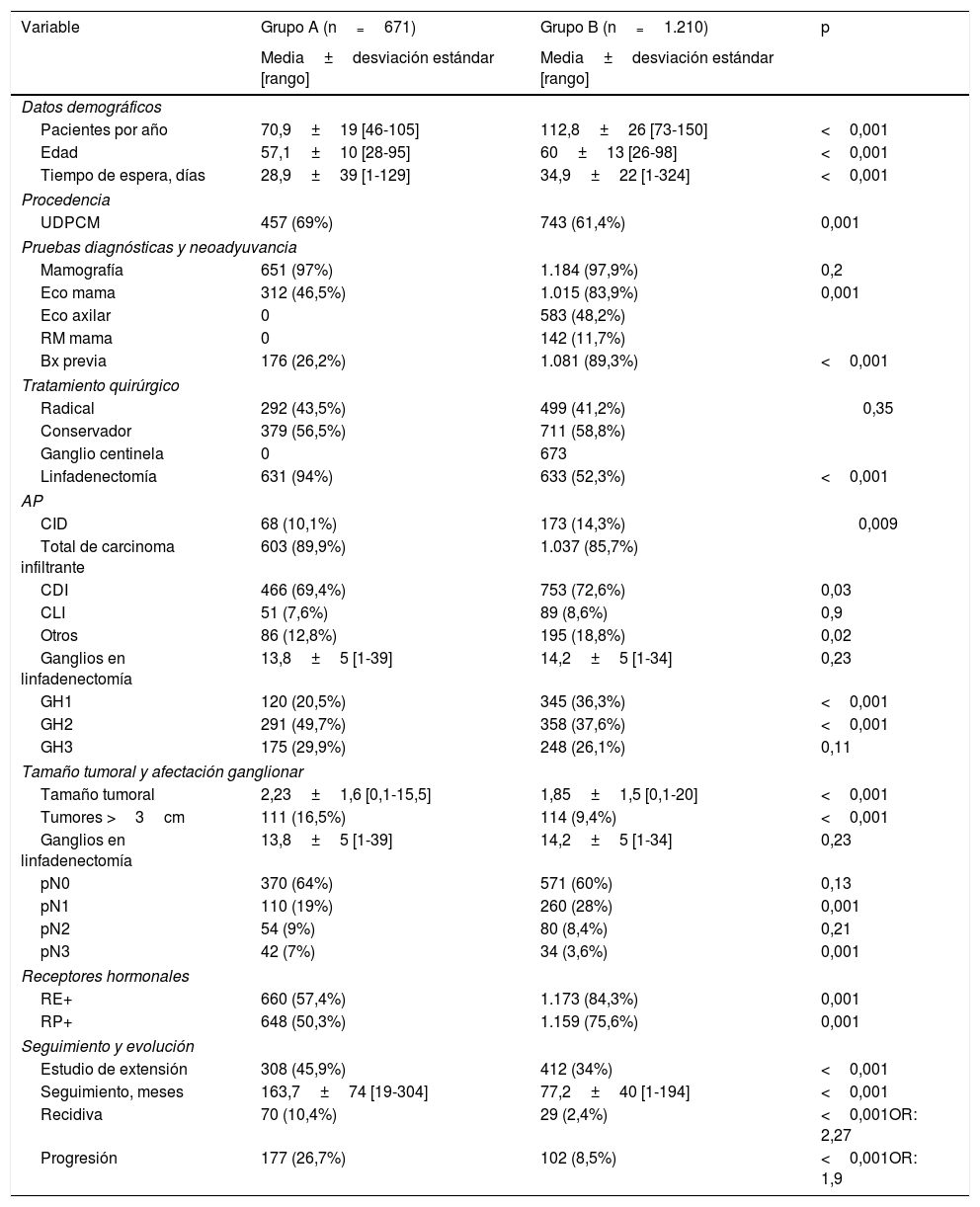
ResultadosNuestra serie la componen 1.881 mujeres que fueron intervenidas quirúrgicamente por cáncer de mama en los 20 años estudiados, 671 en el periodo A y 1.210 en el B. En latabla 2 se recogen los datos demográficos, diagnósticos, el tratamiento aplicado, los resultados anatomopatológicos, el seguimiento y la recidiva.
Datos demográficos, pruebas diagnósticas realizadas, tratamiento administrado, resultados anatomopatológicos, TNM, receptores hormonales, tratamiento postoperatorio, seguimiento y evolución
| Variable | Grupo A (n=671) | Grupo B (n=1.210) | p |
|---|---|---|---|
| Media±desviación estándar [rango] | Media±desviación estándar [rango] | ||
| Datos demográficos | |||
| Pacientes por año | 70,9±19 [46-105] | 112,8±26 [73-150] | <0,001 |
| Edad | 57,1±10 [28-95] | 60±13 [26-98] | <0,001 |
| Tiempo de espera, días | 28,9±39 [1-129] | 34,9±22 [1-324] | <0,001 |
| Procedencia | |||
| UDPCM | 457 (69%) | 743 (61,4%) | 0,001 |
| Pruebas diagnósticas y neoadyuvancia | |||
| Mamografía | 651 (97%) | 1.184 (97,9%) | 0,2 |
| Eco mama | 312 (46,5%) | 1.015 (83,9%) | 0,001 |
| Eco axilar | 0 | 583 (48,2%) | |
| RM mama | 0 | 142 (11,7%) | |
| Bx previa | 176 (26,2%) | 1.081 (89,3%) | <0,001 |
| Tratamiento quirúrgico | |||
| Radical | 292 (43,5%) | 499 (41,2%) | 0,35 |
| Conservador | 379 (56,5%) | 711 (58,8%) | |
| Ganglio centinela | 0 | 673 | |
| Linfadenectomía | 631 (94%) | 633 (52,3%) | <0,001 |
| AP | |||
| CID | 68 (10,1%) | 173 (14,3%) | 0,009 |
| Total de carcinoma infiltrante | 603 (89,9%) | 1.037 (85,7%) | |
| CDI | 466 (69,4%) | 753 (72,6%) | 0,03 |
| CLI | 51 (7,6%) | 89 (8,6%) | 0,9 |
| Otros | 86 (12,8%) | 195 (18,8%) | 0,02 |
| Ganglios en linfadenectomía | 13,8±5 [1-39] | 14,2±5 [1-34] | 0,23 |
| GH1 | 120 (20,5%) | 345 (36,3%) | <0,001 |
| GH2 | 291 (49,7%) | 358 (37,6%) | <0,001 |
| GH3 | 175 (29,9%) | 248 (26,1%) | 0,11 |
| Tamaño tumoral y afectación ganglionar | |||
| Tamaño tumoral | 2,23±1,6 [0,1-15,5] | 1,85±1,5 [0,1-20] | <0,001 |
| Tumores >3cm | 111 (16,5%) | 114 (9,4%) | <0,001 |
| Ganglios en linfadenectomía | 13,8±5 [1-39] | 14,2±5 [1-34] | 0,23 |
| pN0 | 370 (64%) | 571 (60%) | 0,13 |
| pN1 | 110 (19%) | 260 (28%) | 0,001 |
| pN2 | 54 (9%) | 80 (8,4%) | 0,21 |
| pN3 | 42 (7%) | 34 (3,6%) | 0,001 |
| Receptores hormonales | |||
| RE+ | 660 (57,4%) | 1.173 (84,3%) | 0,001 |
| RP+ | 648 (50,3%) | 1.159 (75,6%) | 0,001 |
| Seguimiento y evolución | |||
| Estudio de extensión | 308 (45,9%) | 412 (34%) | <0,001 |
| Seguimiento, meses | 163,7±74 [19-304] | 77,2±40 [1-194] | <0,001 |
| Recidiva | 70 (10,4%) | 29 (2,4%) | <0,001OR: 2,27 |
| Progresión | 177 (26,7%) | 102 (8,5%) | <0,001OR: 1,9 |
AP: anatomía patológica; Bx: biopsia; CDI: carcinoma ductal infiltrante; CID: carcinoma intraductal; CLI: carcinoma lobulillar infiltrante; GH: grado histológico; OR: odds ratio; RE: receptores estrogénicos; RM: resonancia magnética; RP: receptores de progesterona; UDPCM: Unidad de Detección Precoz de Cáncer de Mama.
En el segundo periodo se ha producido un incremento significativo de la media de pacientes tratadas por año (70,9 casos/año en el periodo A vs. 112,8 casos/año en el B). Aunque se ha observado un aumento en el número absoluto de pacientes tratadas procedentes del programa de Detección Precoz de Cáncer de Mama (UDPCM), porcentualmente han disminuido con respecto al primer periodo (A: 69%; B: 61,4%; p=0,001). La edad media de las pacientes tratadas en el periodo B se ha incrementado significativamente (60 vs. 57,1; p<0,001).
Salvo en el estudio mamográfico, realizado en ambos grupos y en el que no hay diferencias (p=0,2), en el resto de procedimientos diagnósticos, las diferencias encontradas se deben a la incorporación de técnicas en distintos momentos del estudio.
El tratamiento quirúrgico conservador de la mama se ha realizado en 1.090 pacientes, el 57,9% del total, 379 pacientes (56,5%) en el periodo A y 711 pacientes (58,8%) en el periodo B, sin hallar diferencias significativas entre ambos periodos (p=0,35).
Con respecto al tratamiento quirúrgico de la axila (linfadenectomía), entre 1990 y 1999 se realizó en el 94% de las pacientes, reduciéndose al 52% entre el 2000 y 2010, coincidiendo con la introducción progresiva de la técnica de ganglio centinela desde el año 2001. El número medio de ganglios extraídos en las pacientes a las que se practicó linfadenectomía axilar en el primer periodo fue de 13,8, y de 14,2 ganglios en el segundo, no habiendo diferencias significativas entre ambos periodos (p=0,23).
Desde el punto de vista histológico, en el primer periodo del estudio las mujeres presentan tumores con factores pronóstico menos favorables: mayor porcentaje de tipo histológico infiltrante, mayor tamaño tumoral, menor frecuencia de bajo grado histológico, mayor porcentaje de pN3 (afectación ganglionar severa) y receptores hormonales negativos (tabla 2).
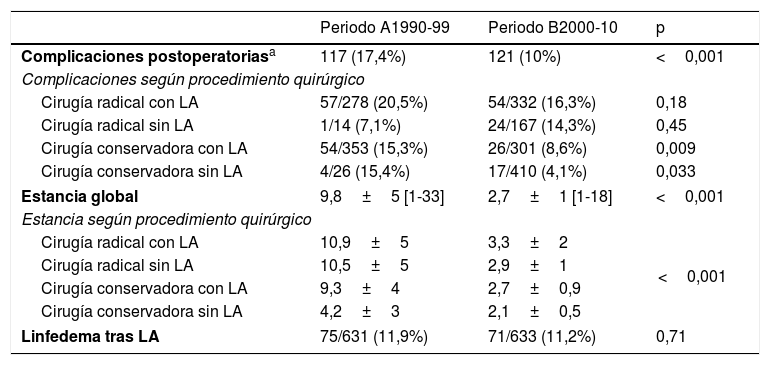
Las complicaciones postoperatorias inmediatas (seroma, hematoma o complicaciones de la herida) se produjeron en 117 pacientes (17,4%) en el periodo A y en 121 pacientes (10%) en el periodo B (p<0,001). Al desglosar las complicaciones inmediatas por tipos de cirugía se observa una reducción significativa durante el segundo periodo tanto en cirugía conservadora sin linfadenectomía (A: 15% vs. B: 4%; p=0,009) como al asociar la linfadenectomía (A: 15% vs. B: 8%; p=0,03). Las diferencias en las complicaciones inmediatas entre ambos periodos en cirugía radical no son significativas.
El linfedema se presentó en 75 casos del periodo A (11,9%) y en 71 del periodo B (11,2%), sin diferencias significativas entre ambos periodos (p=0,7). En todos los casos se había realizado linfadenectomía axilar previa.
Se ha evidenciado una disminución significativa en el segundo periodo de estudio en la estancia media de ingreso postoperatorio (2,7 días vs. 9,3 días; p<0,001). Esta reducción se produjo tanto en cirugía radical como conservadora. Los datos de las complicaciones y la estancia postoperatoria se muestran en la tabla 3.
Complicaciones postoperatorias inmediatas, linfedema y estancia postoperatoria antes y después de la dedicación preferente de cirujanos a la mama
| Periodo A1990-99 | Periodo B2000-10 | p | |
|---|---|---|---|
| Complicaciones postoperatoriasa | 117 (17,4%) | 121 (10%) | <0,001 |
| Complicaciones según procedimiento quirúrgico | |||
| Cirugía radical con LA | 57/278 (20,5%) | 54/332 (16,3%) | 0,18 |
| Cirugía radical sin LA | 1/14 (7,1%) | 24/167 (14,3%) | 0,45 |
| Cirugía conservadora con LA | 54/353 (15,3%) | 26/301 (8,6%) | 0,009 |
| Cirugía conservadora sin LA | 4/26 (15,4%) | 17/410 (4,1%) | 0,033 |
| Estancia global | 9,8±5 [1-33] | 2,7±1 [1-18] | <0,001 |
| Estancia según procedimiento quirúrgico | |||
| Cirugía radical con LA | 10,9±5 | 3,3±2 | <0,001 |
| Cirugía radical sin LA | 10,5±5 | 2,9±1 | |
| Cirugía conservadora con LA | 9,3±4 | 2,7±0,9 | |
| Cirugía conservadora sin LA | 4,2±3 | 2,1±0,5 | |
| Linfedema tras LA | 75/631 (11,9%) | 71/633 (11,2%) | 0,71 |
LA: linfadenectomía axilar.
Los resultados de los CdC evaluados se recogen en la tabla 1. Existe mejoría significativa en el periodo B en los 2 criterios que analizan el diagnóstico preoperatorio completo; el CdC A1 (pacientes con estudio de mamografía, examen físico y ecografía previo a la cirugía) se cumple en el 38,9% en el periodo A y pasa al 83,1% en el periodo B (p<0,001). El CdC A2 (diagnóstico histológico preoperatorio) se cumple en el 26,2% de los casos del primer periodo y alcanza el 89,3% en el periodo B (p<0,001).
En el CdC A3, que evalúa el tiempo de espera entre la primera consulta y la cirugía menor de 6 semanas, existe un peor cumplimiento en el segundo periodo alcanzando el 74,4% de los casos frente al 80,3% en el periodo A (p=0,004).
En ambos periodos se consigue alcanzar el estándar recomendado por EUSOMA en el CdC B1 (resección de toda la lesión tumoral en un único procedimiento en el 80% de los pacientes), aunque se ha evidenciado un ligero retroceso en su cumplimiento pasando del 94,8% en el primer periodo al 88,8% en el segundo (p<0,001).
La introducción en nuestro medio de la biopsia del ganglio centinela fue en el año 2001, por este motivo el CdC B2, que evalúa la correcta indicación de la biopsia del ganglio centinela, con axila clínica y radiológicamente negativa, es únicamente evaluable en el periodo 2000-2010; el cumplimiento es del 92,7% en este periodo (objetivo de EUSOMA 90%).
Con respecto al CdC B3, que analiza la correcta realización de la linfadenectomía axilar (>9 ganglios aislados), se observa una mejoría significativa en el segundo periodo con respecto al primer periodo, A: 81,6% (515/631 casos) vs. B: 87,8% (556/633 casos) (p=0,002).
En los dos CdC que evalúan la opción de cirugía conservadora, el CdC B4, mujeres con carcinomas tipo infiltrante menor de 3cm, se ha situado por debajo del mínimo propuesto (70%) en ambos periodos (65,3% y del 63,7% en los periodos A y B, respectivamente) sin diferencias significativas. En cambio, en el CdC B5, que evalúa el porcentaje de cirugía conservadora en carcinomas no infiltantes o intraductales (CID), se ha observado una mejoría significativa en el periodo B (A: 58,9% vs. B: 74,3%; p=0,03), aproximándose al mínimo que se establece en el 80%.
El CdC B6 analiza el sobretratamiento quirúrgico de la axila (abstención de linfadenectomía en pacientes con CID), que se cumplió en el 35,3% de los 68 casos de CID en el periodo A y en el 87,3% de los 173 casos en el periodo B, p<0,001.
El CdC C1, que analiza la abstención de realización de estudio de extensión en pacientes con estadio I, ha presentado una mejoría significativa en el segundo periodo (A: 76,6% vs. B: 90%, p<0,001).
Las diferencias entre ambos periodos en recidivas locales y progresión a distancia (tabla 2) son poco valorables por la diferencia en los tratamientos complementarios y el tiempo de seguimiento en ambos grupos.
DiscusiónSe ha seleccionado un grupo de criterios de calidad de los propuestos por EUSOMA, debido al amplio reconocimiento que tiene esta sociedad europea de mastología y al sentido científico que aplica al tratamiento multidisciplinar del cáncer de mama en las UM. En nuestro trabajo nos hemos decantado por evaluar la actividad quirúrgica y los criterios que analizan sus resultados.
La evaluación del cumplimiento de los CdC en una UM es una recomendación de primer nivel y requisito para la inclusión en las sociedades de mama de mayor importancia tanto en España5,12 y Europa2,8,9 como en Estados Unidos13. Los resultados obtenidos en estas evaluaciones son de gran importancia tanto para las UM como para comparar los resultados con otros grupos de referencia en cáncer de mama a nivel nacional12 o internacional14. Mediante este análisis es posible encontrar puntos de mejora y diseñar estrategias para optimizar el cumplimiento de los CdC.
En consonancia con los datos epidemiológicos de Europa15 y España16, en el periodo de tiempo analizado ha aumentado la incidencia del cáncer de mama y han mejorado factores pronóstico, como el tamaño tumoral y la afectación ganglionar severa (pN3)13,17. Estos cambios se atribuyen en gran medida a los programas de detección precoz de cáncer de mama18,19 que se inician y desarrollan desde los años 90.
La cirugía de la mama se considera un procedimiento de bajo riesgo de morbilidad, sin embargo, las complicaciones postoperatorias empeoran la calidad de vida de las pacientes y su opinión sobre la calidad del tratamiento quirúrgico20. En la literatura revisada el índice de complicaciones tempranas descritas, aunque es muy variable, se estima entre el 3 y el 15% de las intervenciones de mama20,21. En nuestro estudio se presenta una cifra similar, observándose una reducción significativa de las mismas en el segundo periodo de estudio.
Varios autores relacionan la reducción de la estancia hospitalaria con tumores detectados en programas de screening, mayor porcentaje de cirugía conservadora, realización de biopsia de ganglio centinela y tendencia al alta temprana, aunque se reconocen diferencias entre los distintos grupos de trabajo en la cirugía mamaria22,23. En nuestro análisis, en los últimos 10 años se ha constatado una reducción significativa de la estancia hospitalaria, tanto en las intervenciones de mayor entidad (mastectomía con linfadenectomía) como en las menos agresivas.
El abordaje multidisciplinar en el diagnóstico del cáncer de mama y el desarrollo, mejora y precisión en las pruebas diagnósticas que permiten un mejor conocimiento del estado de la enfermedad antes de la cirugía (ecografía mamaria y axilar, resonancia magnética, biopsia preoperatoria), así como el incremento en las pacientes atendidas en el segundo periodo, pueden ser la causa del alargamiento del tiempo de espera para la intervención (CdC A3), si bien es reconocido que no tiene impacto en el pronóstico siempre que sea dentro de un periodo razonable24.
Con respecto al CdC B1, que evalúa la realización de una única intervención quirúrgica para el tratamiento del tumor, hemos obtenido resultados similares a los de un estudio publicado en 2015, que incluía más de 20.000 pacientes de 22 centros y que describió también un descenso en el cumplimiento de este CdC (única intervención quirúrgica para el tratamiento del tumor) tras la acreditación de las UM por EUSOMA25, permaneciendo su cumplimiento por encima del estándar propuesto, justificándolo con la mayor intención de cirugía conservadora. Según nuestro registro tras la creación de la UM, con cirujanos especializados, la proporción de tratamiento quirúrgico conservador se ha incrementado en un 2,3% (A: 56,5% vs. B: 58,8%). Estos datos muestran un considerable margen de mejora tanto en los resultados globales de tratamiento conservador como en los tumores infiltrantes de menor tamaño (<3cm, analizados en el CdC B4), lo cual ratifica el valor del análisis de la calidad del tratamiento aplicado y obliga a plantear medidas a los cirujanos para mejorar los resultados en el futuro.
La realización de la biopsia del ganglio centinela obliga a desarrollar un entorno multidisciplinar donde los cirujanos de mama interactúan con radiólogos, patólogos y especialistas en Medicina Nuclear. Los cirujanos dedicados a la mama han incorporado la técnica del ganglio centinela a sus recursos y con ello se ha conseguido disminuir la morbilidad que supone una linfadenectomía axilar sin repercutir en la calidad del tratamiento oncológico. A su vez, la mejora de las habilidades quirúrgicas queda patente al considerar el CdC B3, que evalúa la linfadenectomía con obtención de más de 9 ganglios, cuyo cumplimiento pasa del 81,6 al 87,8% tras la dedicación preferente de los cirujanos a la patología de la mama.
Existen publicaciones con similares resultados de mejora en los criterios evaluados tras intervenciones que suponen cirujanos con mayor volumen y especializados en la mama en el seno de una UM12,13,19,26-29.
ConclusionesLas pacientes intervenidas por cirujanos con dedicación preferente a patología mamaria han presentado menor número de complicaciones y una estancia hospitalaria postoperatoria más breve. La incorporación a una Unidad Multidisciplinar de Mama de cirujanos con dedicación preferente a la patología mamaria ha producido mejoría en los CdC que evalúan la idoneidad del diagnóstico, la correcta indicación y realización del tratamiento de los ganglios axilares y el adecuado seguimiento postoperatorio.
Mediante la evaluación de los CdC se han detectado puntos de mejora en el tiempo de espera para la intervención y en el porcentaje de tratamiento quirúrgico conservador aplicado a las pacientes.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.