El carcinoma sebáceo de mama (CSM) es una neoplasia muy poco frecuente. De acuerdo con la clasificación actual de la OMS, el CSM se define como un carcinoma de la mama en el que sus células presentan diferenciación sebácea en al menos el 50% de las mismas y no existe ninguna relación con las glándulas sebáceas de los anejos de la piel. Acorde con esta definición tan solo encontramos 21 casos descritos en la literatura. Presentamos un nuevo caso de CSM junto a una revisión de características clínicas, anatomopatológicas y terapéuticas de esta rara estirpe tumoral de mama.
Sebaceous gland carcinoma (SGC) is an exceedingly rare neoplasm. According to the WHO, SGC is defined as a breast carcinoma in which at least 50% of cells show sebaceous differentiation and there is no relationship with the sebaceous glands of the skin annexes. Only 21 reported cases in the literature fit this definition. We present a new case of this rare breast tumour, as well as a review of its clinical, histological and therapeutic features.
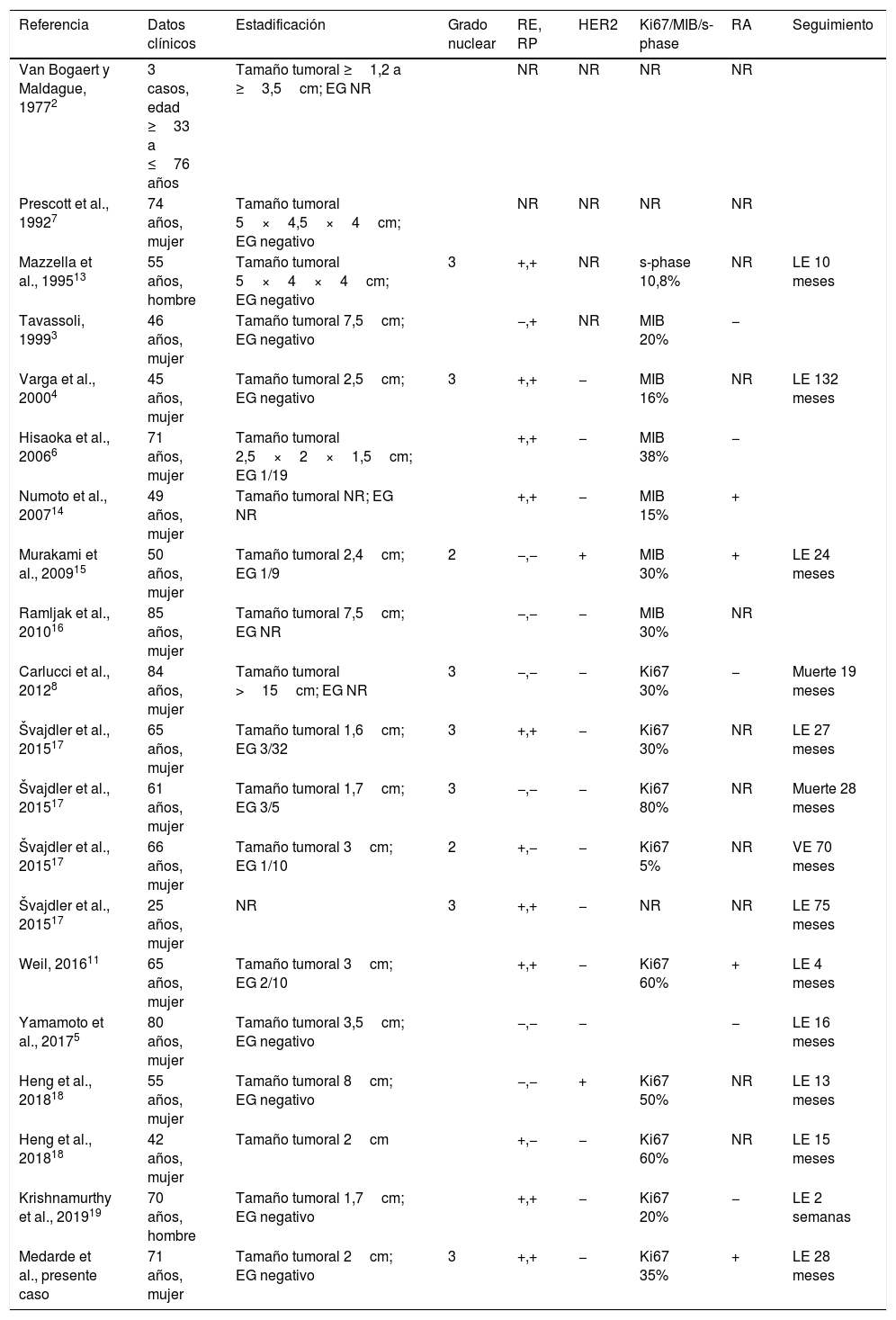
Dentro del carcinoma mamario, un fenómeno relativamente poco frecuente es la diferenciación sebácea. De acuerdo con la clasificación actual de la OMS, el carcinoma sebáceo de mama (CSM) debe mostrar diferenciación sebácea en al menos el 50% de las células y no tener evidencia de origen en los anexos cutáneos1. La lista de casos documentados en la literatura inglesa es escasa2–8,10–19. Presentamos un nuevo caso de carcinoma sebáceo de mama y discutimos algunos dilemas diagnósticos a través de la revisión de casos publicados (tabla 1).
Casos de carcinoma sebáceo descritos en la literatura y características clinicopatológicas
| Referencia | Datos clínicos | Estadificación | Grado nuclear | RE, RP | HER2 | Ki67/MIB/s-phase | RA | Seguimiento |
|---|---|---|---|---|---|---|---|---|
| Van Bogaert y Maldague, 19772 | 3 casos, edad ≥33 a ≤76 años | Tamaño tumoral ≥1,2 a ≥3,5cm; EG NR | NR | NR | NR | NR | ||
| Prescott et al., 19927 | 74 años, mujer | Tamaño tumoral 5×4,5×4cm; EG negativo | NR | NR | NR | NR | ||
| Mazzella et al., 199513 | 55 años, hombre | Tamaño tumoral 5×4×4cm; EG negativo | 3 | +,+ | NR | s-phase 10,8% | NR | LE 10 meses |
| Tavassoli, 19993 | 46 años, mujer | Tamaño tumoral 7,5cm; EG negativo | −,+ | NR | MIB 20% | − | ||
| Varga et al., 20004 | 45 años, mujer | Tamaño tumoral 2,5cm; EG negativo | 3 | +,+ | − | MIB 16% | NR | LE 132 meses |
| Hisaoka et al., 20066 | 71 años, mujer | Tamaño tumoral 2,5×2×1,5cm; EG 1/19 | +,+ | − | MIB 38% | − | ||
| Numoto et al., 200714 | 49 años, mujer | Tamaño tumoral NR; EG NR | +,+ | − | MIB 15% | + | ||
| Murakami et al., 200915 | 50 años, mujer | Tamaño tumoral 2,4cm; EG 1/9 | 2 | −,− | + | MIB 30% | + | LE 24 meses |
| Ramljak et al., 201016 | 85 años, mujer | Tamaño tumoral 7,5cm; EG NR | −,− | − | MIB 30% | NR | ||
| Carlucci et al., 20128 | 84 años, mujer | Tamaño tumoral >15cm; EG NR | 3 | −,− | − | Ki67 30% | − | Muerte 19 meses |
| Švajdler et al., 201517 | 65 años, mujer | Tamaño tumoral 1,6cm; EG 3/32 | 3 | +,+ | − | Ki67 30% | NR | LE 27 meses |
| Švajdler et al., 201517 | 61 años, mujer | Tamaño tumoral 1,7cm; EG 3/5 | 3 | −,− | − | Ki67 80% | NR | Muerte 28 meses |
| Švajdler et al., 201517 | 66 años, mujer | Tamaño tumoral 3cm; EG 1/10 | 2 | +,− | − | Ki67 5% | NR | VE 70 meses |
| Švajdler et al., 201517 | 25 años, mujer | NR | 3 | +,+ | − | NR | NR | LE 75 meses |
| Weil, 201611 | 65 años, mujer | Tamaño tumoral 3cm; EG 2/10 | +,+ | − | Ki67 60% | + | LE 4 meses | |
| Yamamoto et al., 20175 | 80 años, mujer | Tamaño tumoral 3,5cm; EG negativo | −,− | − | − | LE 16 meses | ||
| Heng et al., 201818 | 55 años, mujer | Tamaño tumoral 8cm; EG negativo | −,− | + | Ki67 50% | NR | LE 13 meses | |
| Heng et al., 201818 | 42 años, mujer | Tamaño tumoral 2cm | +,− | − | Ki67 60% | NR | LE 15 meses | |
| Krishnamurthy et al., 201919 | 70 años, hombre | Tamaño tumoral 1,7cm; EG negativo | +,+ | − | Ki67 20% | − | LE 2 semanas | |
| Medarde et al., presente caso | 71 años, mujer | Tamaño tumoral 2cm; EG negativo | 3 | +,+ | − | Ki67 35% | + | LE 28 meses |
EG: estado ganglionar; LE: libre de enfermedad; NR: no reportado; RA: receptor de andrógeno; RE: receptor estrógeno; RP: receptor progesterona; VE: vivo con enfermedad.
Mujer de 71 años que consultó por un nódulo en el seno derecho. En la exploración física se palpó un nódulo de aproximadamente 2cm en el cuadrante externo de la mama derecha, sin ganglios linfáticos axilares, supraclaviculares o cervicales.
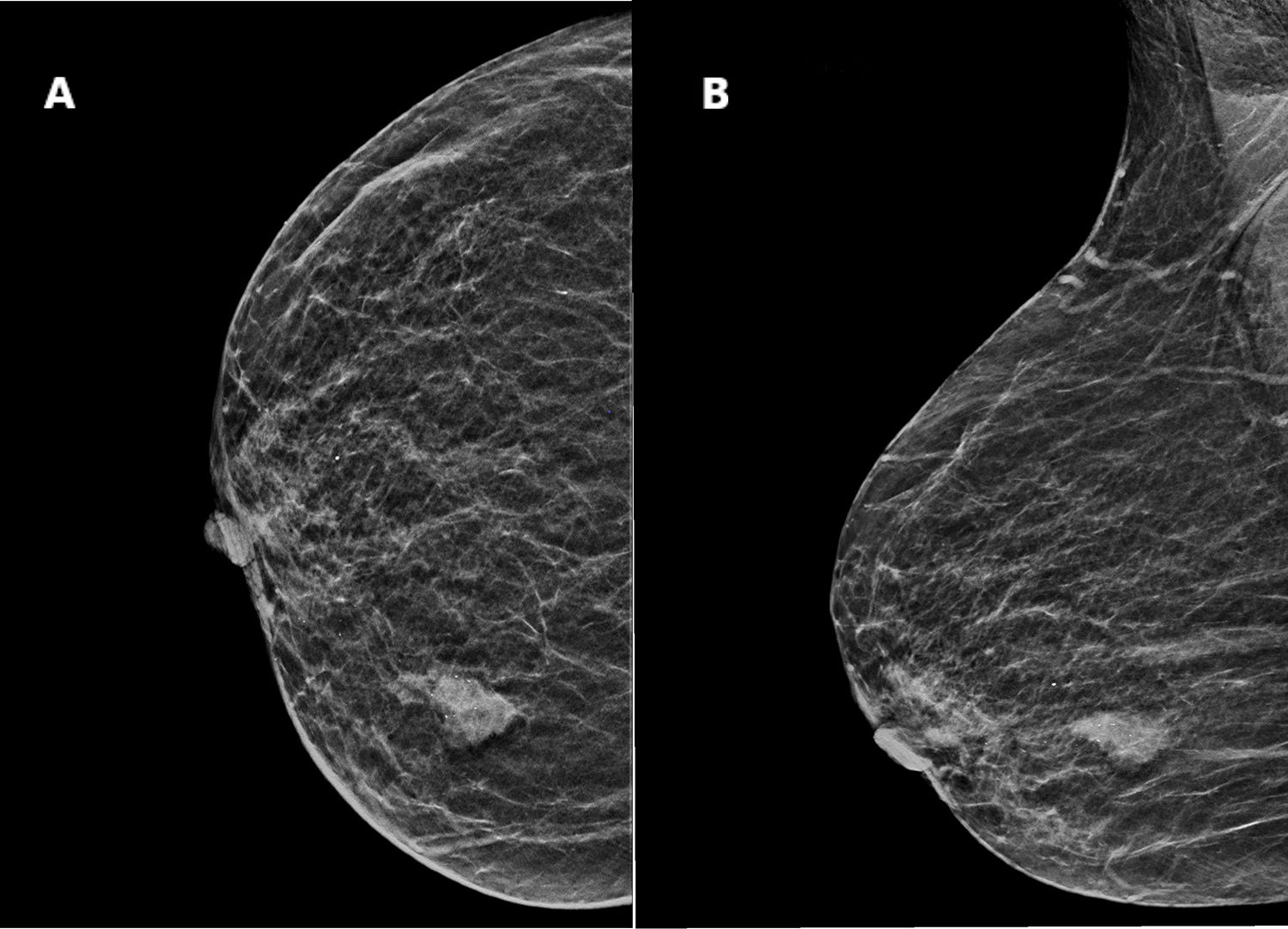
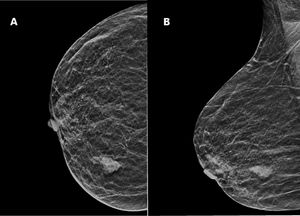
Se realizó una mamografía y ecografía, mostrando una masa irregular de 18mm sin conexión con la piel o el pezón (BIRADS5) (fig. 1A y B).
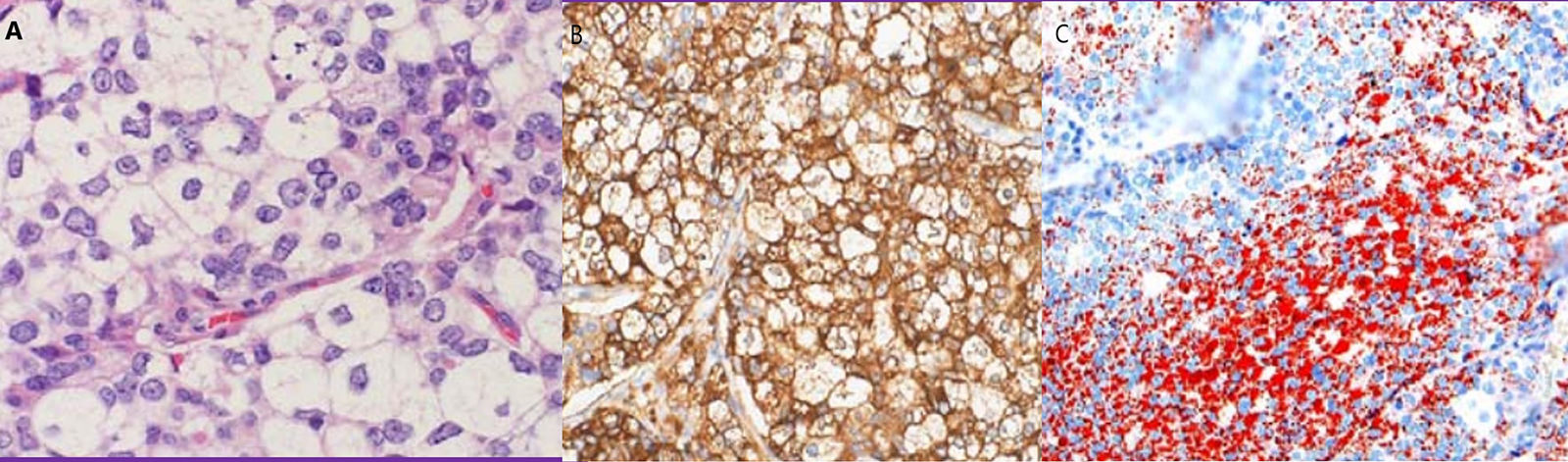
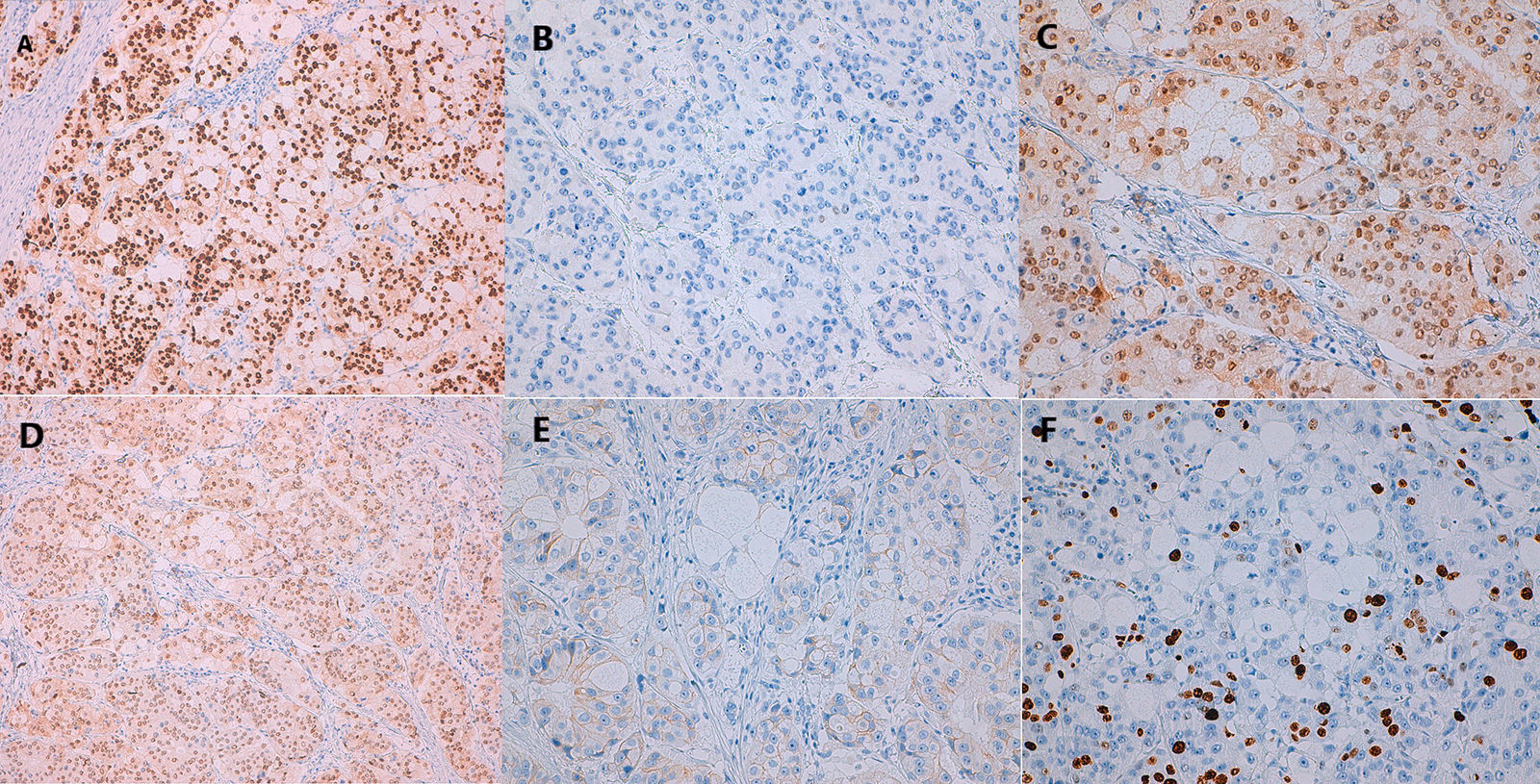
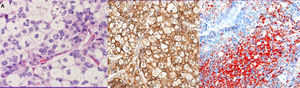
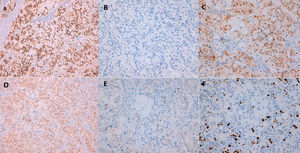
Se practicó biopsia con aguja gruesa guiada por ecografía con el resultado de carcinoma infiltrante de tipo común, grado histológico II (B5b). Se indicó cirugía y, de acuerdo con el paciente, se realizó una mastectomía derecha simple con biopsia selectiva del ganglio centinela axilar. Macroscópicamente el tumor era blanquecino de 1,4cm, nodular, no conectado con la piel o el pezón suprayacente. Microscópicamente, el tumor estaba constituido por células pequeñas, con núcleos redondos y nucléolos generalmente únicos, con amplios citoplasmas claros microvacuolados (fig. 2A). La inmunotinción del antígeno de membrana epitelial (EMA) fue positiva (fig. 2B). El tejido fresco contenía citoplasma lipídico que fue positivo para el rojo oleoso (fig. 2C). El componente sebáceo representaba más del 50% del tumor. La inmunohistoquímica de células tumorales reveló positividad para los receptores de estrógeno (RE) (fig. 3A), los receptores de progesterona (RP) (fig. 3B) y los receptores de andrógeno (RA) (fig. 3C y D). La proliferación de Ki67 fue del 30-35% (fig. 3F) y el HER2 fue negativo (fig. 3E).
El diagnóstico patológico definitivo fue de CSM, grado histológico III, con márgenes libres y un ganglio linfático centinela negativo, pT1c pN0 (sn) (mol-). Se inició el tratamiento adyuvante con letrozol. La paciente se encuentra actualmente libre de enfermedad después de 28 meses de seguimiento.
DiscusiónEL CSM es una entidad extremadamente rara, con tan solo 22 casos descritos en la literatura, incluyendo el nuestro. Suele presentarse de manera esporádica y no parece tener ninguna relación con el síndrome Muir-Torre. El síndrome Muir-Torre es una variante fenotípica del síndrome de Lynch (cáncer colorrectal no polipósico) y está causado por una mutación en la línea germinal de los genes reparadores del ADN, lo que conlleva la pérdida de expresión para MSH2 y MSH6, así como inestabilidad de microsatélites (IMS). Para su diagnóstico es necesaria la presencia de un carcinoma sebáceo y un carcinoma visceral. Los carcinomas sebáceos de anejos y/o piel suelen asociarse a dicha entidad, por el contrario, el CSM parece no tener ninguna asociación con el síndrome Muir-Torre. Ningún caso presenta una neoplasia visceral asociada y diferentes artículos muestran que no existe pérdida de la expresión de dichas proteínas reparadoras del ADN9,17,19.
En cuanto al origen de las células sebáceas en el carcinoma de mama es desconocido. Una hipótesis teoriza sobre un posible desplazamiento de células embriogénicas al parénquima mamario, así como la existencia de células ductales pluripotenciales con capacidad de diferenciación sebácea4.
Los primeros en describir 3 casos de CSM fueron van Bogaert y Maldague, aunque en esa descripción se referían al tumor como carcinoma secretor de lípidos. El primero en usar el término de CSM como un subtipo diferente de carcinoma de mama y describir sus características histológicas fue Tavassoli3.
El CSM es más frecuente en mujeres. Tan solo existen 2 casos masculinos descritos en la literatura13,19, de los cuales solo uno cumple con claridad los criterios para el diagnóstico19. La forma de presentación clínica en la mayoría de los casos es como tumoración palpable en la glándula mamaria. Las pruebas complementarias (mamografía, ecografía y resonancia nuclear magnética) muestran lesiones nodulares, espiculadas, sugestivas de malignidad y nos son de utilidad para descartar afectación de la piel y/o pezón.
Macroscópicamente se trata de tumores blanquecinos, nodulares y de consistencia dura. Microscópicamente son neoplasias constituidas por lóbulos celulares que contienen células redondas con grandes citoplasmas vacuolados y nucléolos únicos. La constatación de un componente graso citoplasmático se realiza mediante la tinción con rojo oleoso o negro Sudán en extensiones en fresco o mediante la demostración por técnicas de inmunohistoquímica de adipofilina. El criterio diagnóstico histológico se basa en la presencia de un porcentaje de diferenciación sebácea de al menos el 50% de las células neoplásicas, según fue descrito por la OMS en 2012. En la revisión de los casos publicados únicamente en 2 casos, incluido el que describimos en este artículo, el porcentaje de diferenciación sebácea es del 100%. Acompañando a esta diferenciación sebácea pueden existir otros tipos de diferenciación histológica (escamosa, presencia de comedonecrosis, metaplasia). La variedad en celularidades y sus porcentajes provocó que algún autor publicara CSM, que actualmente no cumplirían los criterios8. Otro de los criterios diagnósticos se refiere a que esta diferenciación sebácea no ha de depender ni de la piel ni de los anexos.
Es importante realizar el diagnóstico diferencial con el carcinoma rico en lípidos y el carcinoma rico en glucógeno. El primero se caracteriza por unas vacuolas menos visibles, un comportamiento más infiltrativo y suelen expresar RE y RP negativos y HER2 positivo5,18,20. El segundo no presenta vacuolas tan espumosas y la tinción PAS es positiva.
El CSM expresa citoqueratina y el EMA igual que los carcinomas sebáceos de piel y anejos. En cuanto a la positividad para los RA, típico de los carcinomas sebáceos de piel y anejos, nuestra revisión constata que más de la mitad de los casos presentan el RA positivo, con lo que diferimos de Hisaoka et al.6 quienes publicaron que el CSM no expresa dicho receptor.
De los CSM descritos podemos observar que la gran mayoría expresan RE y RP positivos y HER2 negativo y que casi todos, excepto un caso17, presentan un índice de proliferación medio-alto. Si lo extrapolamos a la biología molecular, el CSM suele ser un carcinoma luminal B11. Esto nos permitirá adecuar el tratamiento, donde el bloqueo hormonal y la quimioterapia pueden tener un papel relevante.
En cuanto al estadio tumoral en el momento del diagnóstico, los casos descritos se presentan con tamaño tumoral variable entre T1-T2 y prácticamente la mitad de los casos presentan afectación ganglionar, lo que induce a pensar en una mayor agresividad que el carcinoma de mama convencional y que puede ser atribuido a los altos índices de proliferación. A pesar de esto, las tasas de supervivencia del CSM son mucho mejores que las de los carcinomas sebáceos de piel y anejos.
Se pone de manifiesto que el CSM es una entidad clínica diferente del carcinoma de mama y del carcinoma sebáceo de piel y anejos y que por su extraordinaria rareza plantea un desafío diagnóstico y terapéutico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.