El carcinoma medular de la mama es un subtipo poco común de carcinoma invasivo que representa cerca de 3 al 5% de todos los casos de cáncer de mama. El objetivo fue caracterizar una serie de casos con diagnóstico anatomopatológico de carcinoma medular de la mama, del Hospital Clínico Quirúrgico Docente Joaquín Albarrán, en el periodo 2010 al 2019.
MétodoSe realizó un estudio retrospectivo, descriptivo y observacional, en el cual se revisaron los registros de biopsias recolectándose variables como, edad y características macroscópicas e histológicas.
ResultadosEn el periodo de 2010 a 2019 se realizó el diagnóstico histopatológicamente de 9 casos de carcinoma medular de la mama, de los cuales el 77,8% fueron carcinoma medular de la mama típico y 22,2%, atípico. Solo un 33,3% de las lesiones presentaban necrosis intratumoral; la permeación linfática estaba presente en el 100% de los casos; la metástasis ganglionar se confirmó en el 33,3% de los casos. El estudio por inmunohistoquímica, reveló que el 88,9% de los tumores no expresaron receptores hormonales y Her-2, por lo cual fueron clasificados como subtipo molecular triple negativo o basal.
ConclusiónPara el diagnóstico histopatológico de CMM es fundamental la presencia de infiltrado linfoplasmocítico, considerando siempre la intensidad y el patrón de distribución de los linfocitos y células plasmáticas en relación con las características de las células tumorales (disposición y características individuales). El subtipo molecular triple negativo fue la más frecuente.
Medullary carcinoma of the breast is a rare subtype of invasive carcinoma that accounts for about 3-5% of all cases of breast cancer. The aim of this study was to characterize a series of cases with anatomopathological diagnosis of medullary carcinoma of the mother, from Hospital Clínico Quirúrgico Docente Joaquín Albarrán, in the period 2010 to 2019.
MethodA retrospective, descriptive and observational study was conducted, in which the biopsy records were reviewed, collecting variables such as age and macroscopic and histological characteristics.
ResultsIn the period from 2010 to 2019, the histopathological diagnosis of 9 cases of medullary carcinoma of the breast was made, of which 77.8% were typical medullary carcinoma of the breast and 22.2%, atypical. Only 33.3% of the lesions presented intratumoral necrosis; lymphatic permeation was present in 100% of cases; lymph node metastasis was confirmed in 33.3% of cases; The immunohistochemical study revealed that 88.9% of the tumors did not express hormonal and Her-2 receptors, so they were classified as triple negative or basal molecular subtype.
ConclusionFor the histopathological diagnosis of CMM, the presence of lymphoplasmocytic infiltrate is essential, always detecting the intensity and distribution pattern of lymphocytes and plasma cells in relation to the characteristics of tumor cells (individual disposition and characteristics). The triple negative molecular subtype was the most frequent.
El cáncer de mama es el tumor maligno más frecuente en las mujeres y una de las principales causas de muerte por cáncer, ya que alrededor del 30% desarrolla metástasis tras el tratamiento de tumores aparentemente localizados1. Las principales variedades histológicas del carcinoma de mama incluyen: ductal (79%), lobulillar (10%), tubular (6%), mucinoso (2%), papilar (1%), metaplásico (1%)2, y medular, el cual es un tumor raro, que representa de 3 al 5% de los carcinomas de mama invasivos3,4.
La edad promedio de presentación del carcinoma medular de mama (CMM) es de 45 a 52 años5; y se conoce una particular alta frecuencia en mujeres japonesas y afroamericanas en comparación con mujeres de raza blanca6.
El CMM fue descrito por primera vez por Moore y Foote en un reporte publicado en 19497. Geschickter lo denominó carcinoma neomamario quístico8; y en el Memorial Hospital, estos tumores fueron llamados durante mucho tiempo, «adenocarcinomas protuberantes»9. Por su aspecto al examen clínico, de bulto suave a la palpación se le llegó a denominar tumores encefaloides10. Según Geschickter8, Ewing se refería a algunos carcinomas como medulares, pero no fue hasta 1940 cuando este término se aplicó a una entidad patológica específica.
En 1977 Ridolfi et al. propusieron cinco criterios histopatológicos específicos para su diagnóstico: tumor bien circunscrito, una arquitectura sincitial en al menos el 75% de las áreas examinadas, infiltración estromal difusa con linfocitos y células plasmáticas, ausencia de diferenciación tubular y/o componente intraductal, es decir, formas de patrones glandulares, y anisonucleosis moderada o marcada11.
En correspondencia a esos criterios la Organización Mundial de la Salud define al CMM, como un tumor invasivo bien circunscrito, compuesto por células poco diferenciadas, dispuestas en láminas, sin formación de glándulas. El estroma de colágeno suele ser escaso con presencia de un infiltrado linfoplasmocitario muy prominente5; el cual tiene un pronóstico relativamente favorable a pesar de su alto grado nuclear12.
Clínica y radiológicamente a menudo el CMM se diagnostica erróneamente como un fibroadenoma lo cual enfatiza la necesidad del diagnóstico microscópico13.
Considerando que el CMM es uno de los raros subtipos de carcinoma invasivo de la mama y que existen algunas controversias sobre su histopatología y supervivencia, es oportuno contribuir con datos generados por el análisis de un grupo de casos; por lo cual en este estudio se describirán las características histomorfológicas del CMM de una serie de casos diagnosticados.
MétodoSe realizó un estudio retrospectivo, descriptivo y observacional, comprendido en el periodo de 2010 al 2019, en el cual se revisaron los registros de biopsias para identificar los casos con diagnóstico histológico de carcinoma medular de la mama diagnosticados en el Hospital Clínico Quirúrgico Docente Joaquín Albarrán, en el periodo 2010 al 2019.
De los informe de biopsia se obtuvieron los siguientes: las variables, edad y características macroscópicas e histológicas tales como tamaño de tumor, grado nuclear, presencia de necrosis, permeación vasculo-linfática, infiltración perineural, calcificación y metástasis ganglionar, además de las características inmunohistoquímicas del tumor. Una vez obtenidos los datos se procedió al procesamiento estadístico el cual consistió en el cálculo de frecuencias y la búsqueda de relación entre las variables.
Para la obtención las imágenes al microscopio, se procedió a extraer de la histoteca las láminas correspondientes de cada caso.
ResultadosEn el periodo del 1.° de enero de 2010 al 29 de junio de 2019, fueron diagnosticados histopatológicamente 9 casos de carcinoma medular de la mama, lo cual representó 2,5% de las neoplasias malignas de la mama diagnosticadas en el Hospital Clínico Quirúrgico Docente Joaquín Albarrán en el mencionado periodo (tabla 1).
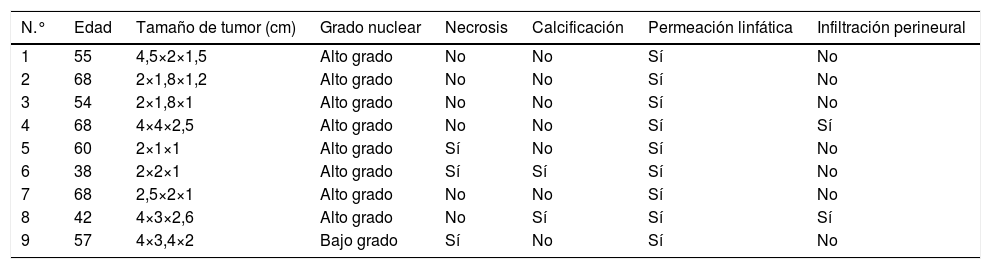
Distribución de pacientes según variables
| N.° | Edad | Tamaño de tumor (cm) | Grado nuclear | Necrosis | Calcificación | Permeación linfática | Infiltración perineural |
|---|---|---|---|---|---|---|---|
| 1 | 55 | 4,5×2×1,5 | Alto grado | No | No | Sí | No |
| 2 | 68 | 2×1,8×1,2 | Alto grado | No | No | Sí | No |
| 3 | 54 | 2×1,8×1 | Alto grado | No | No | Sí | No |
| 4 | 68 | 4×4×2,5 | Alto grado | No | No | Sí | Sí |
| 5 | 60 | 2×1×1 | Alto grado | Sí | No | Sí | No |
| 6 | 38 | 2×2×1 | Alto grado | Sí | Sí | Sí | No |
| 7 | 68 | 2,5×2×1 | Alto grado | No | No | Sí | No |
| 8 | 42 | 4×3×2,6 | Alto grado | No | Sí | Sí | Sí |
| 9 | 57 | 4×3,4×2 | Bajo grado | Sí | No | Sí | No |
Las pacientes se encontraban en un rango de edad de 38 a 68 años, con una media de 55,6 años, siendo siete de ellas de 50 años o más.
Macroscópicamente, se realizaron las mediciones del tumor, siendo la mínima, 2 x 1 x 1cm y el de mayor tamaño fue de 4 x 3 x 2,6cm; en 55,6% de los casos, el tamaño del tumor en su eje mayor fue de 2 cm. Independientemente del tamaño, el tumor en cada caso se observaba, bien circunscrito, blando, con superficie de corte friable, con aspecto encapsulado.
En el estudio histológico se pudo observar en todos los casos, la presencia de patrón de crecimiento predominantemente sólido sincitial, en forma de cordones dispuestos en varias direcciones uniéndose entre sí con formación de masas plexiformes. Las células tumorales se observaron predominantemente grandes, con márgenes citoplasmáticos poco definidos, con núcleos redondos u ovales, algunos vesiculares con nucléolos visibles. Aun cuando las células gigantes tumorales son frecuentes en el CMM, en el presente estudio no se mostraron dichas células.
La cantidad de figuras mitóticas definidas en 10 campos de gran aumento, o índice mitótico fue reportado por encima de 15, de acuerdo a los parámetros establecidos en la clasificación de Scarff-Bloom-Richardson, clasificándose el 88,9% de los casos como de alto grado nuclear y el 11,1% de bajo grado.
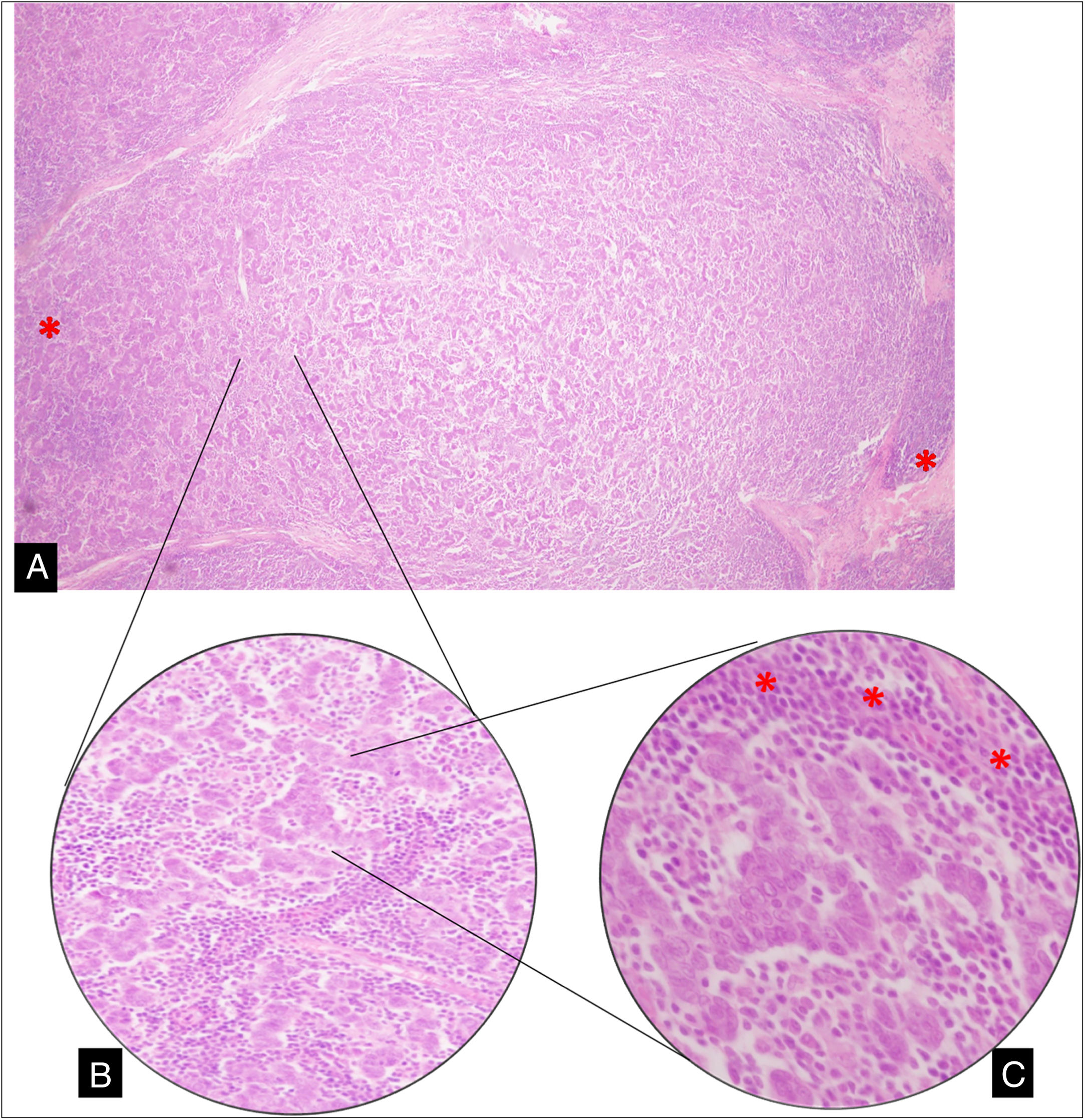
Entremezcladas y rodeando dichas células malignas se observó un prominente infiltrado estromal difuso de linfocitos y células plasmáticas (fig. 1).
A) Sección de tumor de mama en el que se observa formación nodular de células anaplásicas, entremezcladas y rodeadas (*) por un prominente componente linfoplasmocitario (10X). B) Disposición en cordones de células que se anastomosan (20X). C) Células anaplásicas con márgenes citoplasmáticos poco definidos con patrón de crecimiento predominantemente sincitial, rodeadas de linfocitos (*) y escasas formaciones tubulares (40X).
La presencia de estructuras con diferenciación tubular, es decir, patrones glandulares, solo se observó en el 22,2% (2 casos), lo cual permitió establecer el diagnóstico de carcinoma medular de la mama atípico (CMMA), correspondiendo entonces al 77,8% los casos de carcinoma medular de la mama típico (CMMT).
Solo el 33,3% de las lesiones presentaban necrosis intratumoral, dos de ellas en tumores de tamaño pequeño (2 x 1 x 1 cm). La presencia de calcificación solo se observó en dos caos (22,2%).
La permeación linfática estaba presente en el 100% de los casos, sin embargo solo 2 de ellos tenían infiltración perineural.
La metástasis ganglionar se presentó en el 33,3% de los casos, asociados dos de estos tumores con necrosis intratumoral (tabla 2).
Distribución de pacientes según metástasis ganglionar e inmunohistoquímica
| N.° | Metástasis ganglionar | Inmunohistoquímica |
|---|---|---|
| 1 | No | RE (-) RP (-) Her-2 (-) |
| 2 | No | RE (-) RP (-) Her-2 (-) |
| 3 | No | RE (-) RP (-) Her-2 (-) |
| 4 | (17/18) | RE (-) RP (-) Her-2 (-) |
| 5 | (18/19) | RE (-) RP (-) Her-2 (-) |
| 6 | (4/23) | RE (-) RP (-) Her-2 (-) |
| 7 | No | RE (-) RP (-) Her2 (-) |
| 8 | No | RE (-) RP (-) Her-2 (-) |
| 9 | No | RE(+) RP (+) Her-2 (-) |
Her-2: factor de crecimiento epidérmico humano; RE: receptor de estrógeno; RP: receptor de progesterona.
El estudio por inmunohistoquímica reveló que el 88,9% de los tumores no expresaron marcadores tales como: receptores de estrógeno, receptores de progesterona (RP) y Her-2, por lo cual fueron clasificados como subtipo molecular triple negativo o basal, existiendo solo un caso (11,1%), en el cual los receptores hormonales fueron intensamente positivos y Her-2 negativo, correspondiéndose ello con el subtipo luminal A.
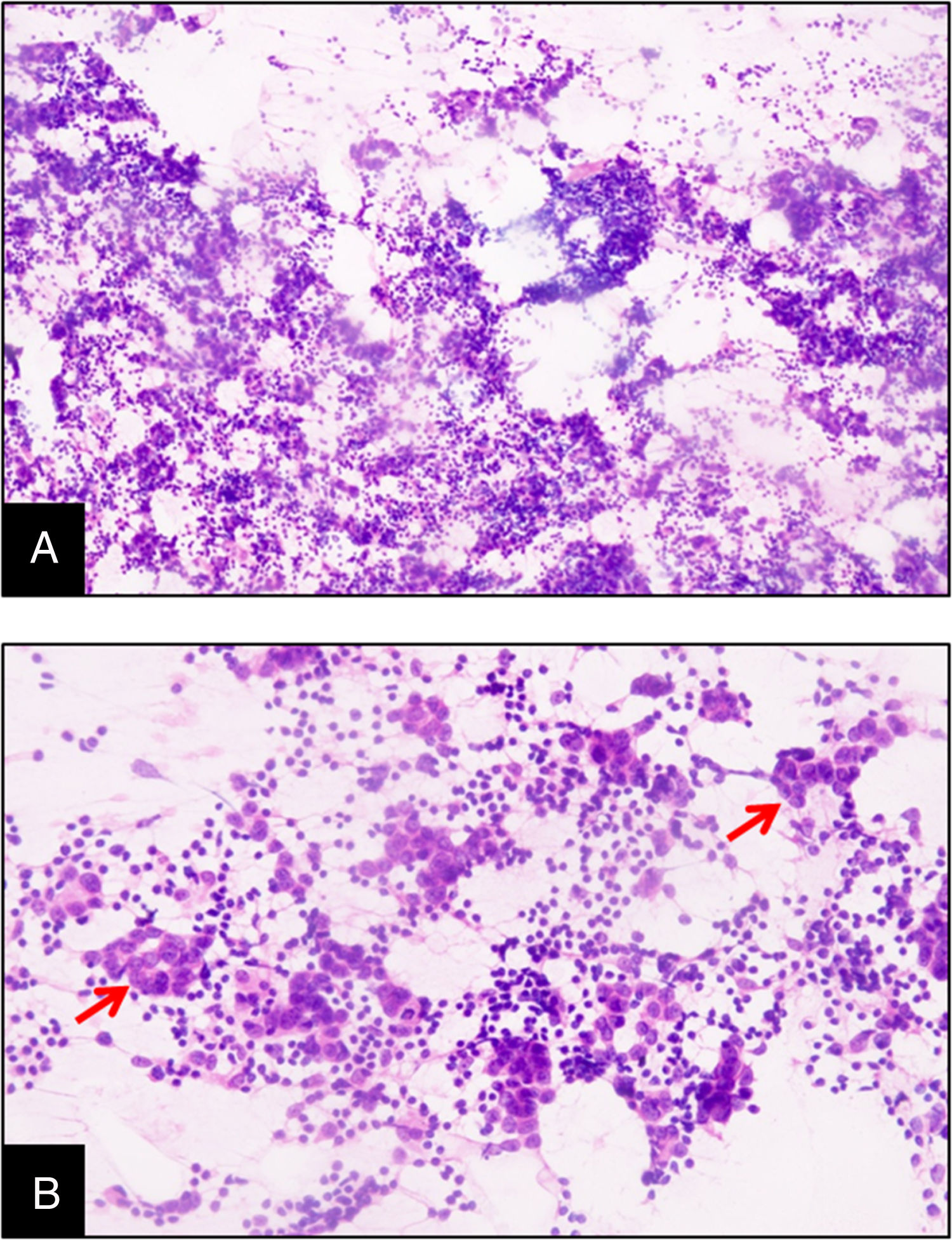
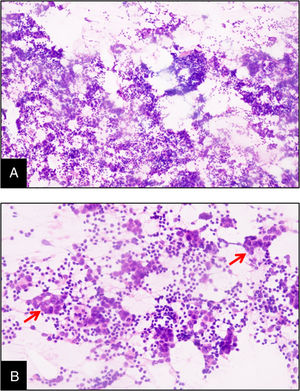
En uno de los casos el diagnóstico fue sospechado desde la realización de la biopsia aspirativa con aguja fina (BAAF), en cuya extensión eran apreciables los diferentes componentes de la variedad medular del carcinoma de mama (fig. 2).
DiscusiónEl CMM es una de las variantes poco frecuentes de carcinoma de mama13; es uno de los subtipos que generalmente tiene características demográficas y clínico-patológicas únicas14; y representa el 3% de las variantes de carcinoma infiltrante15, no obstante se han reportado frecuencias tan altas como 7%16, y en las mujeres con mutación del gen BRCA-1 alcanza una frecuencia de 13%15.
En la experiencia de Prince et al.4, la frecuencia fue bastante baja con un 1,28% del total de pacientes con diagnóstico de tumores malignos de la mama. En el presente estudio la frecuencia fue de 2,5% del total de tumores malignos de la mama diagnosticados durante 9 años; lo cual es similar a lo reportado por Jiménez et al.17, cuya frecuencia reportada fue de 3,04%; y con el estudio de Netra et al.18 donde hallaron una prevalencia de CMM de 3,1%, con un predominio de edades entre 40 a 49 años, al respecto se halló en esta investigación un promedio de edad de 56,7 años; siendo el 22,2% menores de 50 años de edad, incluyendo un caso de 32 años, esto último destaca al igual que lo reportado por Wang et al.19 quienes informaron que el CMM se presenta a una edad más temprana en el momento del diagnóstico (p <0,001); Aksoy et al.20 obtuvieron en una tasa del 13,5% de pacientes menores de 35 años; y Park et al.21 en 2013 concluyeron que el CMM ocurre a una edad más temprana en comparación con carcinoma ductal infiltrante (CDI).
Si bien las primeras descripciones del CMM destacaban por el tamaño grande, en la actualidad ello no es apreciablemente diferente al de los carcinomas ductales infiltrantes, sin embargo, Vo et al.22 demostraron que el grupo de CMM presenta tumores más grandes en comparación con el CDI. En la presente investigación el tamaño promedio del tumor fue de 4,8cm; similar a lo hallado por Jiménez et al.17, de 5,8cm, localizado en 63% de los casos en la mama izquierda.
En cuanto a los elementos microscópicos, se observó que criterios tales como el infiltrado linfoplasmocitario y el pleomorfismo nuclear se cumplieron en la totalidad de las biopsias, incluyendo un alto grado nuclear en 88,9%; lo cual contrasta con lo hallado por Prince et al.4, donde en relación con la tasa mitótica, un 87,5% de los casos mostraron un índice bajo de acuerdo al escore de Scarff-Bloom-Richardson. Características histológicas no observadas en ninguno de los cortes de tumores fueron las células manchadas y la presencia de células tumorales multinucleadas5.
Dadas las dificultades de reproductividad se creó la distinción de CMMT y CMMA según los siguientes cinco criterios: predominantemente (> 75%) patrón de crecimiento sincitial, microscópicamente completamente circunscrito, moderado a marcado difuso mononuclear infiltrado estromal, ausencia de características microglandulares y componentes intraductales, y pleomorfismo nuclear moderado o marcado23. Un diagnóstico de CMMT requiere que se cumplan los cinco criterios anteriores, mientras que CMMA se desvía ligeramente de CMMT, al exigir que se cumplan todos los criterios excepto uno (patrón de crecimiento sincitial del 75%)3. En el presente reporte se hallaron 7 casos (77,8%) de CMM típicos.
Sin embargo, la Organización Mundial de la Salud no favorece ese término. En la práctica se recomienda utilizar la designación de carcinoma con características medulares cuando se encuentran tumores con algunas, pero no todas, las características histológicas de los carcinomas medulares.
Para muchos patólogos resulta difícil y controvertido cumplir con los criterios histológicos, lo que probablemente refleja la baja incidencia y superposición morfológica con lesiones medulares atípicas. La terminología tiene su impacto en el sentido que algunos oncólogos asumen determinadas conductas en dependencia del informe anatomopatológico.
Por lo anteriormente descrito, queda claro que el diagnóstico de carcinoma medular tiene importantes implicaciones en la decisión del tratamiento. Por lo tanto, se debe reservar ese término para los pocos casos que son histológicamente clásicos, con lo cual se evita el subtratamiento de tumores agresivos triples negativos que carecen de algunas características de diagnóstico del carcinoma medular.
El diagnóstico de CMM se puede sospechar a través de la realización de una BAAF, tal como ocurrió en uno de los casos de esta serie. Mediante la BAAF se obtiene un frotis con células malignas dispuestas en grupos sincitiales y también como muchas células grandes aisladas. Además, el infiltrado de células plasmáticas y linfocíticas se observa de manera visible en el fondo24. La citología de CDI se diferencia de la de CMM porque las células tumorales de CDI presentan una disposición tridimensional, adhesiva, patrón acinar y exhiben diátesis tumoral con necrosis en el fondo25. Sin embargo, el hallazgo de infiltrado linfoplasmocítico es mínimo en CDI y otros carcinomas de mama en comparación con CMM18. El aspirado frecuentemente es opaco y se extiende uniformemente como un aspirado linfomatoso de un ganglio linfático25.
De acuerdo a la clasificación molecular, el CMM es frecuentemente basal, también denominado como triple negativo26. Este criterio se cumple en el presente estudio, excepto en un solo caso, el cual presentó positividad para receptores hormonales, dicho hallazgo es reflejo de lo descrito en múltiples trabajos (Prince et al.4; Netra et al.18; Kouhen et al.27; Martínez et al.28; Cao et al.29; Flucke et al.30).
Similar resultado a la presente investigación lo obtuvo Zangouri et al.14 quienes comunicaron sobre una tasa de triple negativo en CMM del 57,5% y llama la atención que en ese mismo estudio existió un 24,5% de casos luminal A; y 10,4% Her-2 (HR-/ Her-2+). Al igual que en la serie estudiada por Chu et al.31 los subtipos triple negativo, luminal y de sobreexpresión de Her-2 constituyeron el 44,4%; el 31,6% y el 15,4%, respectivamente.
Huober et al.32 informaron que solo el 19% de los pacientes incluidos en su serie presentaron RE (+), y Martínez et al.28 en un estudio con 3 348 pacientes con CMM realizado en los
EE. UU. describió tasas bajas similares de RE y RP positivas (16,3% y 14%, respectivamente).
En la serie de Netra et al.18 la triple negatividad fue del 75% de los casos de CMM que comprenden el 80% en el caso típico y el 50% en el CMM atípico.
Curiosamente, los análisis basados en micromatrices han mostrado que los carcinomas medulares y los tumores ductales invasivos con un fenotipo basal tienen características moleculares distintas, aunque comparten características biológicas similares. En el CMM, los genes implicados en la respuesta inmune Th1, incluidas las interleucinas, los factores reguladores del interferón y las citocinas Th1 y los genes relacionados con la vía de la apoptosis, estaban regulados al alza. Por el contrario, los genes implicados en la remodelación del citoesqueleto y los genes asociados con la invasión celular se regulan a la baja en los carcinomas medulares. Estas diferentes características moleculares pueden explicar el resultado favorable de los carcinomas medulares y sugieren que el grupo de tumores de tipo basal constituye un grupo heterogéneo de carcinomas32.
El subtipo molecular es uno de los factores más importantes que afectan el resultado clínico del cáncer de mama. Se ha aceptado ampliamente que el subtipo triple negativo y el subtipo de sobreexpresión Her-2 predicen un resultado clínico deficiente31.
El hecho de que los carcinomas medulares sean pobres en RE, constituye una contradicción, pues al tener mejor pronóstico deberían ser receptores de estrógenos positivos33.
Con respecto a las metástasis, en la presente investigación de los 9 casos estudiados, solo en el 33,3% de ellos ocurrió metástasis ganglionar, lo cual es similar a lo reportado en el estudio de Jiménez et al.17, en el cual de 41 pacientes con CMM atendidas entre 1993 y 2011, 47% tenían ganglios linfáticos axilares positivos al momento del diagnóstico. Sin embargo, Chu et al.31 encontraron que la probabilidad de metástasis en los ganglios linfáticos en el CMM es < 30%. Al igual que Aksoy et al.20 que hallaron que la mayoría de los pacientes (65,7%) no tenían afectación de los ganglios linfáticos.
Este estudio presentó como limitaciones, la no determinación de proteína CK 5/6 la cual es un miembro de la familia de citoqueratinas basales/mioepiteliales, y se detecta con frecuencia en el cáncer de mama invasivo triple negativo34. Otra limitante fue no contar con datos referentes al resultado terapéutico y la sobrevida, ya que las pacientes aunque fueron diagnosticadas en el centro de salud donde se realizó esta investigación, su seguimiento y tratamiento fue realizado en un centro oncológico de referencia.
En conclusión, durante un periodo estudiado de 9 años se demostró que el carcinoma medular de la mama es poco frecuente, ya que representó solo el 2,5% de las neoplasias malignas de la mama, siendo el 77,8% de ello carcinoma medular de la mama típico. El estudio inmunohistoquímico, reveló que el 88,9% de los tumores no expresan receptores de hormona (estrógeno y progesterona) y Her-2, por lo cual son clasificados como subtipo molecular triple negativo o basal.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes, y han obtenido los permisos correspondientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.