El objetivo de este estudio fue estimar la validez de la técnica de biopsia selectiva del ganglio centinela (BSGC) para el diagnóstico del estado de la axila en pacientes con cáncer de mama tras recibir tratamiento neoadyuvante.
Material y métodosSe realizó un estudio transversal de validación durante 2005-2011. Las pacientes fueron sometidas a tratamiento neoadyuvante, posteriormente se realizó la cirugía sobre la mama, BSGC y disección axilar. El ganglio centinela se detectó 24h antes de la intervención.
ResultadosSe incluyeron 66 pacientes con una edad media de 56 años. El 86% fueron carcinomas ductales infiltrantes. El 33,3% de las pacientes tenían axilas afectas al diagnóstico (cN1). La migración del Tc99m fue del 90%, y la no migración en la linfogammagrafía se relacionó en un 77,8% con afectación axilar. La tasa de identificación del ganglio centinela en quirófano fue del 98,3%, con un porcentaje de falsos negativos del 9,7%, y un área bajo la curva de 0,95. En las pacientes con axila sana al diagnóstico (cN0), se detectó el ganglio centinela en el 94%, (5,6% falsos negativos), con un área bajo la curva de 0,97; en cN1 la detección descendió al 87% (9% falsos negativos), con un área bajo la curva de 0,92.
ConclusionesLa estadificación de la axila después de tratamiento neoadyuvante es posible con la BSGC, pudiendo evitar disecciones axilares innecesarias. En las pacientes con cN0 la técnica de la BSGC es similar a la de las pacientes con cánceres precoces. Si bien existe una disminución de la identificación en las pacientes con cN1, la exactitud de la prueba es adecuada.
To estimate the validity of sentinel lymph node biopsy (SLNB) in the diagnosis of axillary status in patients with breast cancer after neoadjuvant therapy.
Material and methodsWe carried out a cross sectional validation study from 2005 to 2011. Patients were treated with neoadjuvant therapy with subsequent breast surgery, SLNB, and axillary dissection. Twenty four hours before the intervention, the sentinel lymph node was detected with radiocolloid injected through subareolar and peritumoral tissue.
ResultsWe included 66 patients with a mean age of 56 years. A total of 86% had infiltrating ductal carcinoma, while 33.3% had axillary involvement at diagnosis (cN1). Migration of Tc99m was nearly 90%, and non-migration was related to axillary involvement in 77.8%. The sentinel lymph node identification rate was 98.3% in the operating room, with a false negative rate of 9.7%, and an area under the curve of 0.95. In patients with healthy axilla at diagnosis (cN0), the sentinel lymph node was detected in nearly 94% (false negative, 5.6%; area under the curve, 0.97); in cN1, sentinel lymph node detection decreased to 87% (false negative 9%; area under the curve of 0.92).
ConclusionsAxillary staging with SLNB is feasible after neoadjuvant therapy and can avoid unnecessary axillary dissection. In patients with cN0, the SLNB technique is similar to that in patients with early breast cancer. Although sentinel lymph node identification decreases in patients with cN1, the accuracy of the technique is adequate.
Actualmente la biopsia selectiva del ganglio centinela (BSGC) es la técnica estándar para la valoración axilar en pacientes con cáncer de mama precoz1, ya que la recidiva a este nivel es muy inferior a la esperada2, permitiendo, además, obviar linfadenectomías axilares (VA) en un subgrupo de pacientes a las cuales no aporta ningún beneficio, y evitar la morbilidad que esto conlleva.
Existe mucha variabilidad en la validación de esta técnica para cánceres precoces, pues se han publicado estudios que aceptan hasta el 10% de falsos negativos (FN)1,3–5, siendo este factor el más importante para valorar la fiabilidad de la técnica. Sin embargo, en las guías españolas6 es necesaria la obtención de menos de un 5% de FN y más de un 90% de éxitos en la detección en el período de validación.
El tratamiento neoadyuvante (NA) ha sido el procedimiento estándar en tumores avanzados, existiendo en la actualidad evidencias que apoyan este tratamiento en cánceres precoces7,8. Clásicamente se ha considerado que el NA era una contraindicación para la realización de la BSGC, ya que existían cambios fibróticos o émbolos metastásicos que podían provocar una obstrucción del flujo linfático, pudiendo no ser el ganglio centinela (GC) obtenido una buena valoración del estadio axilar. No obstante, existen numerosos estudios publicados que recogen la experiencia de la BSGC en el NA, aunque algunos de ellos presentan resultados contradictorios9–13.
En la literatura surge la posibilidad de realizar la BSGC antes o después del NA, con sus ventajas e inconvenientes12–16.
El objetivo de este estudio es estimar la validez de la técnica de BSGC para la estadificación axilar en pacientes con cáncer de mama operable que inicialmente se ha tratado con quimioterapia neoadyuvante.
Material y métodoDiseño del estudioSe ha realizado un estudio transversal de validez de prueba diagnóstica.
El método seguido para la acreditación del procedimiento es la validación estadística a partir de un registro consecutivo de casos.
PacientesEntre los años 2005 y 2011 se estudió de forma prospectiva a 66 mujeres seleccionadas de forma consecutiva en nuestra consulta que cumplían los siguientes criterios de inclusión: cáncer de mama confirmado histológicamente mediante biopsia por aguja gruesa y haber recibido tratamiento preoperatorio con quimioterapia sistémica primaria. Tras ser informadas del estudio, decidieron voluntariamente someterse a la cirugía mamaria correspondiente, a la BSGC y VA en el mismo acto quirúrgico. Se excluyeron las mujeres con carcinoma inflamatorio y todas las que, una vez informadas, no quisieron incluirse en el estudio. Este fue aprobado por el Comité de Investigación de nuestro hospital. En todas las pacientes se obtuvo el consentimiento informado por escrito.
A todas las enfermas se les realizó exploración física de la mama y la axila, y diagnóstico anatomopatológico del tumor mediante biopsia por aguja gruesa en la consulta de Cirugía o de forma radioguiada. Asimismo, se realizó la valoración axilar ecográfica, y si existían datos de sospecha de afectación ganglionar se hizo punción con aguja fina o biopsia por aguja gruesa. Se practicó resonancia magnética pre-NA y pos–NA, y marcaje ecodirigido de la lesión antes de iniciar el NA. No se realizó nueva valoración ecográfica pos-NA.
El tipo de respuesta tumoral se clasificó en: respuesta completa (RC), cuando existía una lisis clínica y por imagen en el tumor y la axila; respuesta parcial, cuando existía más del 50% de reducción a nivel tumoral; respuesta nula, y progresión de la enfermedad.
A todas las pacientes se les realizó en el Servicio de Medicina Nuclear el marcaje del GC el día anterior al de la cirugía. El radiofármaco utilizado fue nanocoloide de albúmina humana marcada con Tc99m, y la dosis administrada fue de 3mCi en un volumen total de 0,8ml, que se dividió en 2 zonas de inyección: intratumoral/peritumoral (0,4ml) e intradérmica/subdérmica periareolar, en el cuadrante de localización del tumor (0,4ml). Posteriormente, se realizó la adquisición de imágenes estáticas precoces a los 30min, en proyección anterior y lateral, y estáticas tardías a las 2h. En caso de ser necesario, se adquirieron imágenes más tardías hasta visualizar el/los GC, así como proyecciones oblicuas o mediante «hanging» (mama colgante) cuando fue preciso. Posteriormente, se marcaba su localización en la piel mediante tinta indeleble en la postura de la paciente más similar a la quirúrgica.
Una vez en el quirófano se extirpó selectivamente la «zona caliente» axilar, objetivando el ganglio «ex vivo». En el caso de no existir migración del nanocoloide se valoró igualmente en el quirófano, y en el caso de no evidenciar «zona caliente» se procedió directamente a realizar VA.
El estudio anatomopatológico se dividió en 2 tiempos. En el peroperatorio se realizaron cortes múltiples para hematoxilina-eosina (cada 2mm en el GC mayor a 5cm, o por bisección si era menor) y cortes para inmunohistoquímica intraoperatorios. En el posoperatorio se realizaron cortes seriados para tinciones con hematoxilina-eosina y se reservaron cortes para estudios inmunohistoquímicos con citoqueratinas, que se realizaron cuando los previos con hematoxilina-eosina fueron negativos.
Análisis estadísticoPara el análisis estadístico descriptivo se determinaron variables cuantitativas como media, desviación estándar, mínimo y máximo; en relación con las variables cualitativas, se calcularon su frecuencia y porcentaje relativo en la población. Se calcularon también la sensibilidad, la especificidad, el valor predictivo positivo, el valor predictivo negativo y la precisión diagnóstica de la técnica de la BSGC, acompañados de la estimación del intervalo de confianza del 95%, curvas ROC y áreas bajo la curva. Para el análisis de las diferencias en las variables categóricas se utilizó la prueba de Chi cuadrado de Pearson, y para las diferencias en los valores medios de las variables continuas se utilizó la prueba de la t de Student. Se consideró como estadísticamente significativo al valor de p menor de 0,05. Los programas informáticos utilizados fueron la calculadora CASPe y el SPSS versión 19.
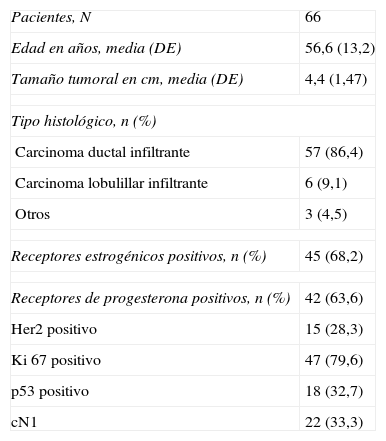
ResultadosLas principales características de las pacientes incluidas en el estudio se detallan en la tabla 1.
Características generales de las pacientes antes del tratamiento neoadyuvante
| Pacientes, N | 66 |
| Edad en años, media (DE) | 56,6 (13,2) |
| Tamaño tumoral en cm, media (DE) | 4,4 (1,47) |
| Tipo histológico, n (%) | |
| Carcinoma ductal infiltrante | 57 (86,4) |
| Carcinoma lobulillar infiltrante | 6 (9,1) |
| Otros | 3 (4,5) |
| Receptores estrogénicos positivos, n (%) | 45 (68,2) |
| Receptores de progesterona positivos, n (%) | 42 (63,6) |
| Her2 positivo | 15 (28,3) |
| Ki 67 positivo | 47 (79,6) |
| p53 positivo | 18 (32,7) |
| cN1 | 22 (33,3) |
cN1: afectación axilar en el momento del diagnóstico (clínico/ecográfico); DE: desviación estándar.
Tras el NA se obtuvo RC clínica del tumor en 26 pacientes (39,4%); en el estudio mediante resonancia magnética la RC se observó en 17 pacientes (25,7%), y solo en 2 (3%) se confirmó mediante estudio anatomopatológico.
Se realizó cirugía conservadora (CC) en el 60,7% de las pacientes.
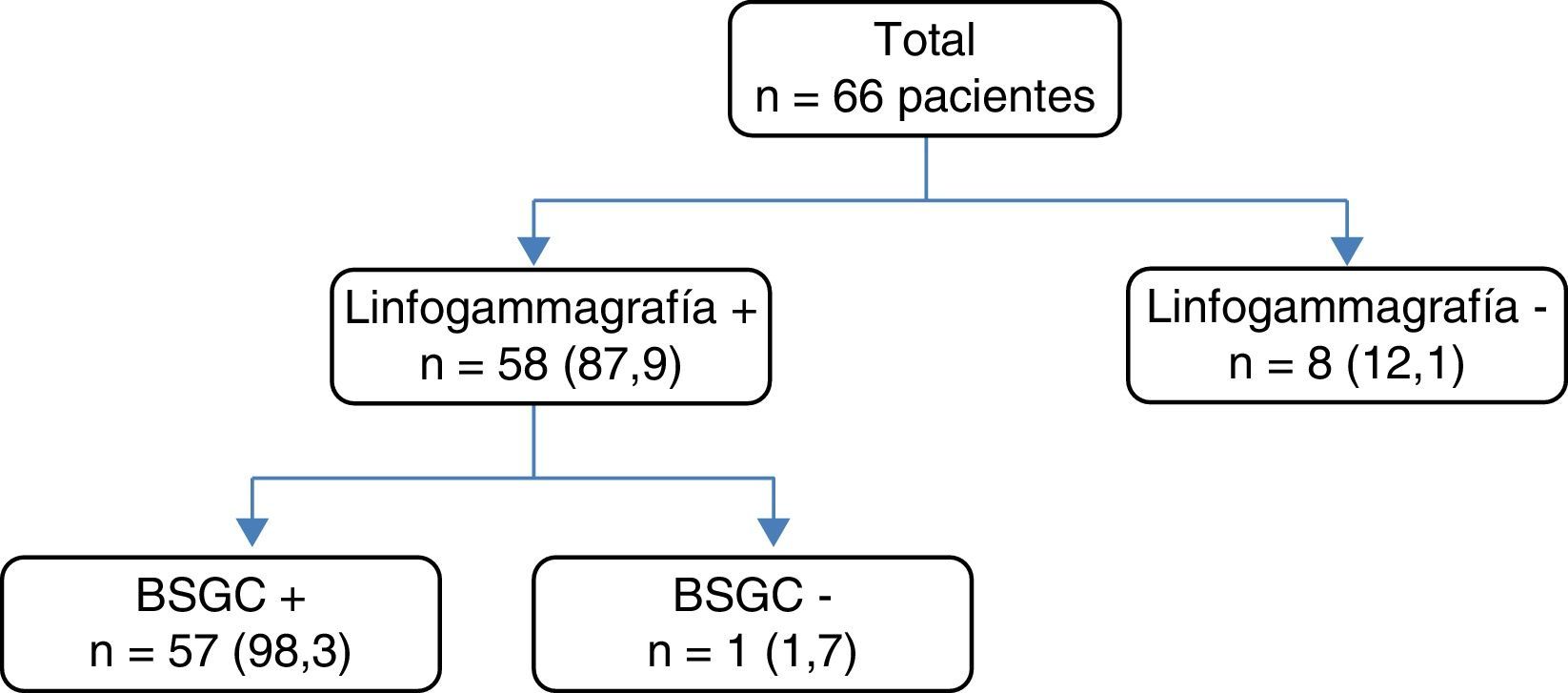
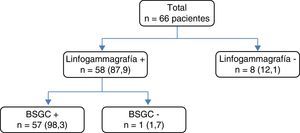
Resultados de la linfogammagrafíaLa linfogammagrafía se realizó en todos los casos, con los resultados que se recogen en la figura 1, obteniendo una tasa de identificación del 87,9% (n=58).
Características de la detección por linfogammagrafía del ganglio centinela.
BSGC +: detección de «zona caliente» en el quirófano y extracción para su estudio; BSGC−: no existe detección de «zona caliente», no obteniendo ganglio centinela; Linfogammagrafía +: existe detección del ganglio centinela mediante la linfogammagrafía. Linfogammagrafía −: no existe migración del Tc99m en la linfogammagrafía.
La migración del Tc99m no se relacionó con la edad de la paciente, los RE, RP o Her2, ni con el tipo de respuesta al NA. En cambio, sí lo hizo con el estado clínico de la axila en el momento del diagnóstico: no hubo migración del radiofármaco en el 23,8% de las pacientes cuando en la axila se evidenció enfermedad al diagnóstico, disminuyendo de forma significativa este porcentaje al 5,1% en las pacientes sin enfermedad axilar inicial (p=0,03). En todas las mujeres con remisión total clínica tras NA la linfogammagrafía fue efectiva.
Al valorar a las pacientes sin identificación del GC por linfogammagrafía se comprobó que en el 77,8% de los casos existía afectación axilar en la VA.
Detección del ganglio centinelaEl número de GC obtenidos durante la intervención fue de 2,5±1,4, mientras que el número de ganglios obtenidos en la VA fue de 12,3±5,6.
El porcentaje de identificación del GC fue del 98,3%, con un porcentaje de falsos negativos (FN) del 9,7%. En las pacientes cN0 su detección fue significativamente superior a la de las mujeres cN1 (93,2 vs. 72,7%, respectivamente, p=0,02). El porcentaje de identificación en las pacientes cN1 en que existió RC fue del 66,7% (4/6).
Las mujeres con cN1 (n=22) triplicaron el riesgo de que la axila fuera positiva después de NA respecto de las mujeres con cN0 en el momento del diagnóstico (intervalo de confianza del 95% 1,1-11,1; RR=3.389).
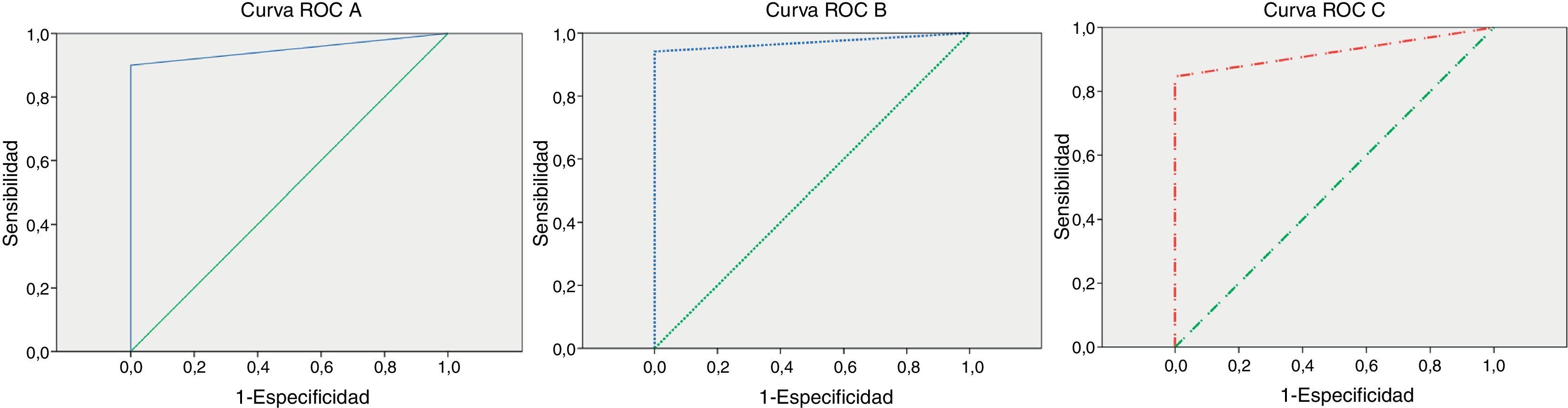
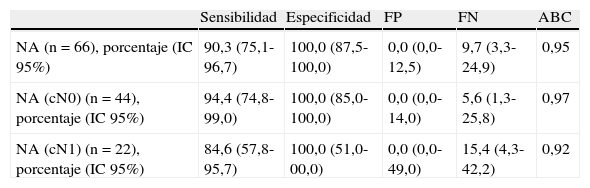
La valoración de la BSGC como prueba diagnóstica se detalla en la tabla 2 y la figura 2, en que se analiza gráficamente el área bajo la curva, según las curvas ROC.
Descripción de las características de las pruebas diagnósticas
| Sensibilidad | Especificidad | FP | FN | ABC | |
| NA (n=66), porcentaje (IC 95%) | 90,3 (75,1-96,7) | 100,0 (87,5-100,0) | 0,0 (0,0-12,5) | 9,7 (3,3-24,9) | 0,95 |
| NA (cN0) (n=44), porcentaje (IC 95%) | 94,4 (74,8-99,0) | 100,0 (85,0-100,0) | 0,0 (0,0-14,0) | 5,6 (1,3-25,8) | 0,97 |
| NA (cN1) (n=22), porcentaje (IC 95%) | 84,6 (57,8-95,7) | 100,0 (51,0-00,0) | 0,0 (0,0-49,0) | 15,4 (4,3-42,2) | 0,92 |
ABC: área bajo la curva; cN0: no afectación de la axila en el momento del diagnóstico (clínico/ecográfico); cN1: axila clínico/ecográfica afecta; FN: falso negativo; FP: falso positivo; IC 95%: intervalo de confianza del 95%; NA: neoadyuvancia.
Análisis gráfico de las diferentes curvas ROC. Curva ROC A: para el total de las pacientes que han recibido tratamiento neoadyuvante. Curva ROC B: para las pacientes que han recibido tratamiento adyuvante con axila clínicamente negativa en el momento del diagnóstico. Curvas ROC C: para las pacientes que han recibido tratamiento neoadyuvante con axila clínicamente positiva en el momento del diagnóstico.
La BSGC es el procedimiento de elección en la estadificación axilar del cáncer de mama precoz. La ausencia de enfermedad en el GC permite no realizar la VA y, con ello, disminuir la morbilidad que conlleva, sin modificar la supervivencia de la paciente ni incrementar las recidivas locorregionales ni a distancia1,5,17.
El NA es el procedimiento inicial de los cánceres avanzados y actualmente se indica cada vez más en casos más precoces18. Puesto que a menor tamaño tumoral la frecuencia de afectación axilar disminuye19, se podría considerar que se están realizando VA innecesarias en un número elevado de pacientes. Filippakis y Zografos20, en su artículo de revisión, valoraron que entre el 40 y el 48% de las mujeres que recibían NA tenían la axila negativa, y que en ellas la realización de la VA era innecesaria. En nuestro estudio, casi el 42% de las mujeres no hubieran necesitado VA.
Durante los últimos años se ha estado planteando el papel de la BSGC en el NA y, además, en qué momento realizarla.
El NA tiene la ventaja de permitir valorar «in vivo» la respuesta a la quimioterapia de los tumores mamarios13. Por otro lado, la disminución que produce del tamaño tumoral puede ofrecer, en estos casos, la realización de CC con seguridad, como se describe en el estudio NSABP B-1821, donde se muestra que tras NA es posible realizar CC en el 59% de las pacientes, mientras que en aquellas sin NA la CC asciende al 67,8%. A este respecto, en nuestro estudio se consiguió realizar el 60% de CC en mujeres con NA. Tal vez podrían extrapolarse estos resultados y sus conclusiones a la valoración axilar tras NA.
Al analizar el total de las pacientes, observamos que tanto el porcentaje de identificación como la tasa de FN no alcanzaban los valores clásicamente recomendados en los procesos de validación de la BSGC6. En nuestro grupo a estudio se identificó el GC en el 87% de los casos, y una tasa de FN de 9,7%. En la valoración del área bajo la curva se observa una exactitud diagnóstica del 0,95, expresada gráficamente en las curvas ROC (fig. 2). No obstante, estas cifras son semejantes a las referidas en la literatura, en la que se estima una detección del GC entre 84,4 y 91%, con una elevada tasa de FN (del 10,7 al 35%)10,21–26. Sin embargo, en el subgrupo de pacientes que en el momento del diagnóstico no presentaba enfermedad en la axila la identificación del GC ascendió al 93,2% y la tasa de FN disminuyó al 5,6%. El área bajo la curva obtenida fue cercana a 1 (0,97), como se puede observar gráficamente en la figura 2. En la literatura se avala esta actitud ante pacientes con cáncer de mama y cN010,25–28. La ventaja principal sería poder valorar en un único acto quirúrgico, tras el NA, la progresión de la enfermedad a nivel axilar, evitando así VA innecesarias en las mujeres con cánceres avanzados que tras NA mantienen su axila sin enfermedad. Se ha de tener en cuenta que cerca del 60% de las pacientes que reciben NA son tratadas con CC, por lo que posteriormente recibirán radioterapia, y esta contribuirá al control local de la enfermedad axilar29.
La valoración axilar mediante BSGC en las pacientes cN1 mantiene mayores controversias10,12,24–26,28–31, fundamentalmente por la variabilidad en los datos de detección, desde el 98% de Newman et al.30 al 87,3% de Takahashi et al.23, y los valores de los FN, que pueden ascender hasta un 35,5%5. Takei et al.31 además plantean que la técnica de BSGC tras NA es válida, pero existe una necesidad de ser mucho más cautelosos en la detección del GC, incluyendo como GC todo aquel ganglio que se oiga, toque y vea. Lee et al.24 concluyeron que aunque existe una menor detección del GC en los pacientes con axila positiva en el momento del diagnóstico, la precisión de la BSGC no difirió de las pacientes sin NA. En la figura 2 se muestra cómo la BSGC mantiene una exactitud diagnóstica en axilas cN1, ascendiendo su área bajo la curva al 0,92.
En el estudio ACOSOG Z107132 se incluyen pacientes con estadio avanzado y axilas cN1, y se alcanzan valores de FN cercanos al 31% cuando obtienen un GC, y tasas inferiores al 10% extrayendo 3 o más GC, mostrando una clara relación entre el número de ganglios extraídos y la tasa de FN. En el estudio ACOSOG Z001127 el 27% mantenían cáncer residual en los ganglios axilares, muy cercano al 31% de FN del ACOSOG Z107132, evidenciando solo un 0,9% de recidivas en ganglios axilares y no experimentando un exceso de metástasis a distancia.
En el estudio SENTINA33 se obtienen resultados similares, sin embargo, en él se seleccionan las pacientes realizando BSGC en aquellas que tienen axilas negativas después del NA, correlacionando una tasa menor de FN cuando se extraen 3 o más GC, sin que exista una mejoría de los resultados con la selección de las pacientes.
El subgrupo de RC (tumoral y axilar) en la literatura asciende a valores entre el 13 y 26%34, llegando hasta un 50% en el trabajo de Mamounas13, pudiendo convertirse este grupo de pacientes en subsidiario de la valoración axilar mediante BSGC35. En nuestro estudio, el 27% obtuvo RC, siendo su tasa de detección del 66,7%.
En conclusión, la detección del GC en pacientes que inicialmente no tenían enfermedad en la axila es similar a los resultados necesarios en los períodos de validación de BSGC sin NA. En las pacientes con axila metastásica en el momento del diagnóstico la detección del GC es menor, manteniendo una buena exactitud y precisión. Creemos que la BSGC tiene lugar como técnica clave para evaluar el estado axilar tras la quimioterapia, sobre todo en pacientes sin enfermedad clínica al diagnóstico, disminuyendo con ello la morbilidad de la VA y aumentando, indirectamente, la calidad de vida de las pacientes con cáncer de mama avanzado
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autoría- -
Participación en la creación de la base de datos y el diseño del estudio, realización de estudio estadístico, redacción del artículo y de las modificaciones siguientes: Elvira Buch.
- -
Participación en la recogida de datos y redacción del artículo: Sandra Díaz.
- -
Participación en la redacción del apartado relativo a material y método para la determinación del ganglio centinela: Marcos Tajahuerce.
- -
Participación en la recogida de datos: Carlos Castañer y Osama Aburedwan.
- -
Aprobación de la versión que finalmente se remite a publicación: Elvira Buch, Sandra Díaz, Marcos Tajahuerce, Antonio Galán, Carlos Castañer, Osama Aburedwan y Félix Checa.
Los autores declaran no tener ningún conflicto de intereses.