Hay evidencias que sugieren la existencia de alteraciones de algunas citocinas en pacientes con esquizofrenia, pero su asociación con la psicopatología aún no está clara. El objetivo de este estudio es determinar si los niveles de citocinas proinflamatorias (factor de necrosis tumoral-α, interleucina [IL]-6, IL-2, IL-1β, IL-1RA) están aumentados en pacientes ambulatorios clínicamente estables en comparación con individuos sanos, y analizar si podrían ser biomarcadores específicos de las diferentes dimensiones clínicas de la esquizofrenia.
MétodosSe evaluaron 73 pacientes con esquizofrenia en sus primeros 10 años de evolución de la enfermedad y 73 controles sanos pareados por edad y sexo. Se realizó una evaluación precisa de las dimensiones clínicas (positiva, negativa, depresiva y cognitiva) en estos pacientes.
ResultadosSolo los niveles de IL-6 están significativamente elevados en los pacientes tras controlar por índice de masa corporal, perímetro abdominal, tabaquismo y tratamiento psicofarmacológico en comparación con sus controles sanos. Tras ajustar por varios factores de confusión, los modelos de regresión lineal múltiple identificaron cómo las concentraciones de IL-1β predicen los síntomas negativos, psicopatología general y gravedad global de la Escala del Síndrome Positivo y Negativo, mientras los niveles de IL-2 predicen el dominio motivación y placer de la Entrevista de Evaluación Clínica para Síntomas Negativos y la puntuación global en la Escala de Funcionamiento Personal y Social. Sin embargo, el rendimiento cognitivo, la gravedad de los síntomas depresivos y positivos no correlacionaron con ninguna de las citocinas.
ConclusionesNuestros hallazgos sugieren que las concentraciones de IL-6 permanecen elevadas en pacientes estables con esquizofrenia. Mientras que la IL-2 marca específicamente la gravedad en el dominio motivación y placer de la sintomatología negativa, la IL-1β no es específica para esta dimensión, ya que también predice la gravedad de la sintomatología general y global.
Evidence suggests the existence of cytokine disturbances in patients with schizophrenia but their association with psychopathology is still unclear. The aim of the current study was to determine if pro-inflammatory cytokine levels (tumor necrosis factor-α, interleukin (IL)-6, IL-2, IL-1β, IL-1RA) are increased in stable outpatients compared with healthy subjects, and to analyze if they could be specific biomarkers of clinical dimensions in schizophrenia.
MethodsWe studied 73 stable outpatients with schizophrenia in their first 10 years of illness and 73 age- and sex-matched healthy controls. An accurate assessment of clinical dimensions (positive, negative, depressive, cognitive) was performed in patients.
ResultsOnly IL-6 levels were significantly increased in patients after controlling for body mass index, waist circumference, smoking, and psychopharmacological treatment, compared with healthy subjects. After adjusting for several confounders, multiple linear regression models identified that Positive and Negative Syndrome Scale negative symptoms, general psychopathology, and global severity are predicted by IL-1β concentrations, while motivation and pleasure domain of Clinical Assessment Interview for Negative Symptoms and Personal and Social Performance global functioning scores are predicted by IL-2 levels. Cognitive performance, positive, and depressive symptom severity did not correlate with any cytokine.
ConclusionsOur findings suggested that IL-6 concentrations are elevated in stable patients with schizophrenia. Whereas IL-2 specifically marks severity of the motivation and pleasure domain of negative symptoms, IL-1β is not specific to this dimension as it also predicts severity of general and global symptomatology.
Existen evidencias que sugieren que la inflamación desempeña un papel importante en la fisiopatología de la esquizofrenia1,2. Así, se han descrito en diversos estudios cambios en los niveles de citocinas periféricas, que son proteínas involucradas en la regulación de los procesos inflamatorios, aunque su utilidad como biomarcadores fiables es aún incierta3. El metanálisis de Miller et al. (2011) observa elevación de las citocinas séricas, entre las que se encuentran la interleucina (IL)-6, IL-1β y el factor de crecimiento tumoral (TGF)-β en pacientes con un primer episodio psicótico y en aquellos con esquizofrenia que presentan una recaída aguda, normalizándose estos niveles después del tratamiento (marcadores de estado). Sin embargo, otras citocinas como el factor de necrosis tumoral (TNF)-α, IL-12, interferón (INF)-γ y el receptor de IL-2 soluble (sIL-2r) permanecen elevadas en pacientes crónicos (marcadores de rasgo)4. Además, se han descrito aumentos de IL-1β, IL-6, TNF-α y sIL-2r en pacientes con psicosis sin tratamiento previo5 y disminuciones significativas de IL-2 e IL-6 después del tratamiento antipsicótico6. Por el contrario, estudios realizados con pacientes crónicos con esquizofrenia identifican una concentración de IL-6 sérica más elevada, y niveles de TNF-α inferiores o similares en comparación con controles sanos (CS)7,8. Asimismo, un metaanálisis reciente encuentra cómo las concentraciones de IL-1β e IL-6, si bien disminuyen tras el tratamiento, también aparecen incrementadas en pacientes crónicos9.
También se han reportado resultados discordantes en estudios que tratan de identificar asociaciones entre las citocinas y las dimensiones clínicas10. En varios estudios realizados con pacientes con diagnóstico de esquizofrenia (SZ), el TNF-α, la IL-6 y/o el antagonista del receptor de IL-1 (IL-1RA) mostraban una relación significativa con las dimensiones positiva11,12, negativa o cognitiva13–15. Sin embargo, otros estudios no pudieron replicar estos hallazgos. La relación entre los niveles de IL-2 y el funcionamiento cognitivo se ha observado en algunos16,17, pero no en todos los estudios15. Recientemente, una revisión sistemática de Misiak et al. (2017) concluía que los cambios en algunas citocinas podrían contribuir al deterioro cognitivo, especialmente del TNF-α, con menor evidencia de la implicación de la IL-2 e IL-618.
Una posible explicación para estos hallazgos inconsistentes puede ser el hecho de que no todos los estudios han controlado factores confusores como la edad, el sexo, el índice de masa corporal (IMC), el tabaquismo, las comorbilidades físicas o el estrés durante la fase aguda de la psicosis19. Además, las muestras de pacientes con esquizofrenia estables no suelen ser homogéneas, ya que los pacientes se encuentran en diferentes fases de la enfermedad o en un estadio crónico tardío (>10 años)7,20. Debido a las limitaciones metodológicas observadas realizamos el presente estudio controlando los factores de confusión mencionados y seleccionando una población homogénea, esto es, pacientes cuya evolución de la enfermedad fuese inferior o igual a 10 años. Además, debido a las conocidas limitaciones de los instrumentos psicométricos que evalúan los síntomas negativos y cognitivos, y la funcionalidad, empleamos la Entrevista de Evaluación Clínica para Síntomas Negativos (CAINS), la Batería Cognitiva del Consenso MATRICS (MCCB) y la Escala de Funcionamiento Personal y Social (PSP).
El objetivo principal de este estudio ha sido determinar si los niveles de citocinas proinflamatorias en sangre periférica (TNF-α, IL-6, IL-2, IL-1β e IL-1RA) en pacientes con SZ estables, durante los primeros 10 años tras el inicio, difieren de aquellos observados en sus CS pareados, y analizar si podrían ser biomarcadores específicos de las dimensiones clínicas en estos pacientes. Otro objetivo ha sido explorar las posibles diferencias entre una fase inicial tras el primer episodio de psicosis (PEP) (0-5 años) y una etapa crónica temprana (ECT) (6-10 años).
MétodosParticipantesSetenta y tres pacientes ambulatorios con esquizofrenia y 73 CS pareados por edad y sexo, procedentes de Asturias (España), participaron en este estudio. Los diagnósticos de esquizofrenia se confirmaron mediante entrevista clínica estructurada para DSM-5 (SCID-5) administrada por los clínicos. Los pacientes (de entre 18-45 años de edad) se encontraban en los primeros 10 años de evolución de la enfermedad y con el mismo tratamiento de mantenimiento durante al menos los 3 meses previos, exceptuando un subgrupo de 5 pacientes que no tomaban ningún antipsicótico en ese período. Se analizaron por separado los subgrupos de pacientes con PEP (n=44) y con una ECT (n=29). Los criterios de exclusión para todos los participantes fueron: comorbilidades somáticas, tanto agudas (infección, fiebre, procesos alérgicos) como crónicas (cáncer, trastorno autoinmune) que podrían interferir con los parámetros inflamatorios y tratamiento con inmunosupresores o vacunas durante los 6 meses previos a la inclusión o con fármacos antiinflamatorios 2 días antes de la extracción de sangre. Los CS no tenían antecedentes de trastornos psiquiátricos. Todos los sujetos negaron tener antecedentes de diabetes o enfermedades cardiovasculares. En la muestra global, tanto de pacientes como de CS, el 94,5% era de raza caucásica, mientras que 4 pacientes y 4 controles no (en su mayoría de etnia hispana). Todos los participantes recibieron información sobre los propósitos y el protocolo del estudio y firmaron el consentimiento informado antes de llevar a cabo cualquier procedimiento del mismo. El estudio fue aprobado por el comité de ética local, Comité Regional de Ética en Investigación Clínica del Principado de Asturias (Ref. 25/2014).
Evaluación clínicaLos pacientes fueron evaluados con las versiones validadas al español de la PANSS21, la CAINS22, la Escala de Depresión de Calgary23, la MCCB24 y la PSP25. La CAINS se compone de 2 subescalas: «motivación/placer» (CAINS-MAP, cuyos ítems incluyen placer anticipatorio y motivación relacionada con las actividades recreativas, sociales, laborales y escolares) y «expresividad» (CAINS-EXP, cuyos ítems incluyen la expresión facial y verbal, los gestos expresivos y el habla).
Las variables sociodemográficas y otras variables clínicas se evaluaron mediante entrevista semiestructurada e incluyeron: número de años de estudio, duración de la enfermedad, tratamiento psicofarmacológico, consumo de sustancias (tabaco, medido como cigarrillos/día) y número de ingresos psiquiátricos. Las dosis de cada antipsicótico se convirtió en dosis equivalentes de clorpromazina en mg/día26. Además, se recogieron los siguientes datos antropométricos: peso (kg), altura (m), IMC (kg/m2) y perímetro abdominal (cm).
Recogida de muestras sanguíneas y análisis de citocinasLas muestras de sangre se obtuvieron por venopunción en ayunas entre las 8:00 y las 10:00 de la mañana, el mismo día de la evaluación clínica.
Los biomarcadores inflamatorios se midieron por duplicado a partir de plasma congelado y muestras de suero mediante ensayos inmunoabsorbentes ligados a enzimas (ELISA) disponibles comercialmente, y de acuerdo con las recomendaciones del fabricante. Para el análisis se utilizó el promedio de las 2 mediciones. Los niveles de TNF-α (Invitrogen Corp., CA, EE. UU.) se analizaron en muestras de suero. Los niveles de IL-6 (Gen-Probe Diaclone SAS, Besancon Cedex, Francia), IL-2, IL-1β e IL-1RA (RayBiotech Inc., GA, EE. UU.) se midieron en muestras de plasma. La sensibilidad de los test fue de 1,7pg/ml, 2pg/ml, 4pg/ml, 0,3pg/ml y 0,1ng/ml, respectivamente.
Análisis estadísticoLas variables en los grupos de SZ y CS, y entre los subgrupos de pacientes, se compararon usando la prueba de Chi-cuadrado, la prueba «t» de Student para muestras independientes y la prueba no paramétrica U de Mann-Whitney para las variables continuas con una distribución no normal. Debido a que los niveles de citocinas presentaban una distribución muy irregular, fueron transformados logarítmicamente (ln). Puesto que se encontraron diferencias entre los distintos grupos en el IMC, perímetro abdominal y tabaquismo, estas se incluyeron como covariables en los análisis de regresión lineal múltiple (método de pasos sucesivos) para los niveles de citocinas, como variables dependientes, y el diagnóstico de esquizofrenia como predictor. También se incluyeron los psicofármacos como covariables, agrupados por clase como antipsicóticos atípicos (risperidona, clozapina, paliperidona, aripiprazol, amisulprida, olanzapina, quetiapina), antidepresivos (citalopram, escitalopram, sertralina, mirtazapina, desvenlafaxina, clomipramina), benzodiazepinas y estabilizantes (litio, valproato). Solo un paciente recibía un antipsicótico típico (haloperidol) en combinación con un antipsicótico atípico, por lo que esta clase no se analizó de forma independiente. Las diferencias se consideraron estadísticamente significativas cuando p<0,05.
La asociación entre las citocinas y las variables clínicas en el grupo de pacientes se identificó mediante las correlaciones de Pearson con corrección de Bonferroni para comparaciones múltiples (5 pruebas, ajustado el valor p<0,01). Finalmente, se realizaron los análisis de regresión múltiple con el método de pasos sucesivos para explorar el efecto de las citocinas seleccionadas y otras covariables en las puntuaciones de las diferentes dimensiones clínicas. Las covariables se seleccionaron mediante correlaciones de Pearson, encontrando únicamente asociaciones positivas entre las dosis equivalentes de clorpromazina y las concentraciones de IL-1β (r=0,31, p=0,006) y entre el IMC y el TNF-α y la IL-6 (r=0.361, p=0,002; r=0,304, p=0,009). Basándonos en lo publicado en la literatura, y por criterio experto, también incluimos la edad, el sexo, los años de estudio, la duración de la enfermedad, el tabaquismo, el perímetro abdominal y el tratamiento con antidepresivos, benzodiazepinas o eutimizantes como potenciales factores de confusión.
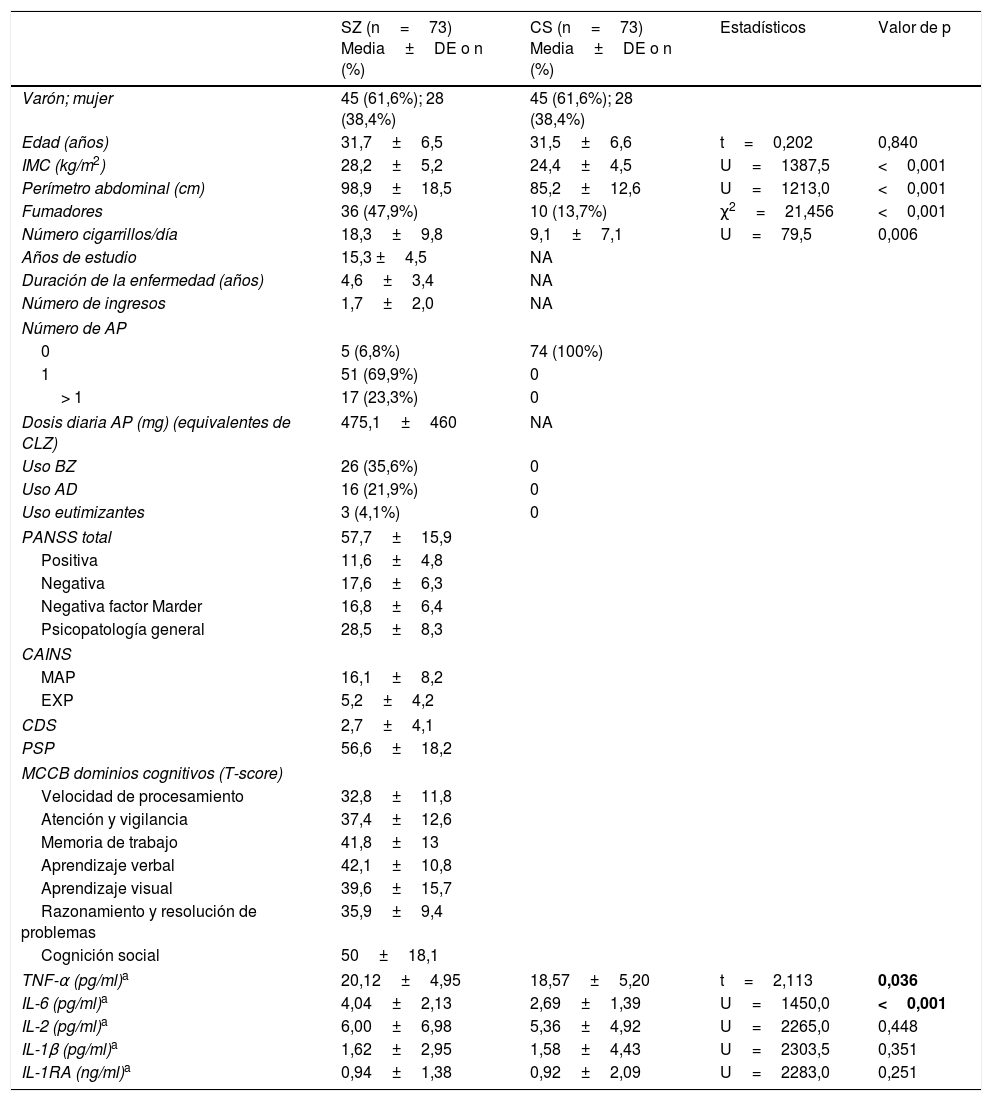
ResultadosCaracterísticas demográficas y clínicasEsquizofrenia y controles sanosLas características demográficas y clínicas de los sujetos se muestran en la tabla 1. Tal como era de esperar los 2 grupos no diferían en edad o sexo. Sin embargo, el grupo de SZ presentó un mayor IMC y perímetro abdominal, y una mayor proporción de fumadores que los CS, como se ha descrito ampliamente en la literatura.
Características demográficas y concentraciones de citocinas en pacientes con esquizofrenia (SZ) y controles sanos (CS)
| SZ (n=73) Media±DE o n (%) | CS (n=73) Media±DE o n (%) | Estadísticos | Valor de p | |
|---|---|---|---|---|
| Varón; mujer | 45 (61,6%); 28 (38,4%) | 45 (61,6%); 28 (38,4%) | ||
| Edad (años) | 31,7±6,5 | 31,5±6,6 | t=0,202 | 0,840 |
| IMC (kg/m2) | 28,2±5,2 | 24,4±4,5 | U=1387,5 | <0,001 |
| Perímetro abdominal (cm) | 98,9±18,5 | 85,2±12,6 | U=1213,0 | <0,001 |
| Fumadores | 36 (47,9%) | 10 (13,7%) | χ2=21,456 | <0,001 |
| Número cigarrillos/día | 18,3±9,8 | 9,1±7,1 | U=79,5 | 0,006 |
| Años de estudio | 15,3 ±4,5 | NA | ||
| Duración de la enfermedad (años) | 4,6±3,4 | NA | ||
| Número de ingresos | 1,7±2,0 | NA | ||
| Número de AP | ||||
| 0 | 5 (6,8%) | 74 (100%) | ||
| 1 | 51 (69,9%) | 0 | ||
| > 1 | 17 (23,3%) | 0 | ||
| Dosis diaria AP (mg) (equivalentes de CLZ) | 475,1±460 | NA | ||
| Uso BZ | 26 (35,6%) | 0 | ||
| Uso AD | 16 (21,9%) | 0 | ||
| Uso eutimizantes | 3 (4,1%) | 0 | ||
| PANSS total | 57,7±15,9 | |||
| Positiva | 11,6±4,8 | |||
| Negativa | 17,6±6,3 | |||
| Negativa factor Marder | 16,8±6,4 | |||
| Psicopatología general | 28,5±8,3 | |||
| CAINS | ||||
| MAP | 16,1±8,2 | |||
| EXP | 5,2±4,2 | |||
| CDS | 2,7±4,1 | |||
| PSP | 56,6±18,2 | |||
| MCCB dominios cognitivos (T-score) | ||||
| Velocidad de procesamiento | 32,8±11,8 | |||
| Atención y vigilancia | 37,4±12,6 | |||
| Memoria de trabajo | 41,8±13 | |||
| Aprendizaje verbal | 42,1±10,8 | |||
| Aprendizaje visual | 39,6±15,7 | |||
| Razonamiento y resolución de problemas | 35,9±9,4 | |||
| Cognición social | 50±18,1 | |||
| TNF-α (pg/ml)a | 20,12±4,95 | 18,57±5,20 | t=2,113 | 0,036 |
| IL-6 (pg/ml)a | 4,04±2,13 | 2,69±1,39 | U=1450,0 | <0,001 |
| IL-2 (pg/ml)a | 6,00±6,98 | 5,36±4,92 | U=2265,0 | 0,448 |
| IL-1β (pg/ml)a | 1,62±2,95 | 1,58±4,43 | U=2303,5 | 0,351 |
| IL-1RA (ng/ml)a | 0,94±1,38 | 0,92±2,09 | U=2283,0 | 0,251 |
Las diferencias fueron analizadas mediante la prueba de Chi-cuadrado para variables categoriales y «t» de Student para muestras independientes, o la prueba no paramétrica U de Mann-Whitney para variables continuas. Las citocinas fueron transformadas logarítmicamente para los análisis, pero en la tabla se presentan en el valor original.
AD: antidepresivos; AP: antipsicóticos; BZ: benzodiazepinas; CAINS: Entrevista de evaluación clínica para el síndrome negativo; CDS: Escala de depresión de Calgary; CLZ: clorpromazina; DE: desviación estándar; EXP: expresión; MAP: motivación y placer; MCCB: Batería cognitiva del consenso MATRICS; PANSS: Escala del síndrome positivo y negativo; PSP: Escala del funcionamiento personal y social.
Los pacientes en diferentes etapas de la enfermedad (0-5 vs. 6-10 años) no se diferenciaron significativamente en las puntuaciones psicopatológicas ni en los dominios cognitivos (todas las pruebas «t» de Student con p>0,05). Además, no se encontraron diferencias estadísticamente significativas respecto al sexo (63,3% vs. 58,6% eran varones, respectivamente, Chi cuadrado=0,186, p=0,666) o el consumo de tabaco (45,5% vs. 55,2%; Chi cuadrado=0,660, p=0,416). Los pacientes con PEP tenían un IMC y perímetro abdominal inferiores a los pacientes con ECT (27,2±4,5 vs. 29,8±5,9kg/m2, U=462,5, p=0,048; 95,1±12,6 vs. 104,8±24,1cm, U=463,5, p=0,049).
Diferencias en los niveles de citocinasEsquizofrenia y controles sanosLos niveles de citocinas en ambos grupos se presentan en la tabla 1. Las concentraciones de TNF-α e IL-6 en SZ están significativamente aumentadas respecto a las concentraciones en sus CS, mientras que no se detectaron diferencias en otras citocinas. En el modelo de regresión lineal múltiple se identificó que tanto el diagnóstico de esquizofrenia (β=0,286, p=0,001) como el IMC (β=0,268, p=0,001) fueron factores que tuvieron un efecto predictivo significativo sobre los niveles de IL-6, y representaron el 21% de la varianza (modelo dF=2, F=18,718, p<0,001). Sin embargo, solo el IMC (β=0,269, p=0,001) y el tabaquismo (β=0,165, p=0,04), pero no el diagnóstico, fueron factores predictivos en el modelo de regresión para las concentraciones de TNF-α (modelo dF=2, F=8,874, p<0,001).
Primer episodio de psicosis y etapa crónica tempranaNo encontramos diferencias significativas en los niveles de citocinas entre PEP y ECT.
Asociaciones entre citocinas y dimensiones clínicasBiomarcadores de las dimensiones clínicas en la esquizofreniaLos análisis de correlaciones mostraron asociaciones positivas significativas entre las concentraciones de IL-2 y la PANSS-total (r=0,345, p=0,003) y las subescalas PANSS-general (r=0,315, p=0,007), PANSS-negativa factor Marder (PANSS-MN) (r=0,315, p=0,007) y CAINS-MAP (r=0,310, p=0,008). Los niveles de IL-1β se relacionaron positivamente con la PANSS-total (r=0,375, p=0,001) y las subescalas PANSS-general (r=0,314, p=0,008), PANSS-negativa (r=0,337, p=0,004) y PANSS-MN (r=0,386, p=0,001). El rendimiento cognitivo y la gravedad de los síntomas positivos y depresivos no se correlacionaron significativamente con ninguna de las citocinas tras el ajuste de Bonferroni (p≥0,029). En relación con la funcionalidad tanto la IL-2 como la IL-1β se asociaron de forma inversa con las puntuaciones de la PSP (r=–0,448, p<0,001; r=–0,392, p=0,001, respectivamente). En el material suplementario se incluyen los datos sobre correlaciones segmentadas por subgrupos en función del estadio de la enfermedad.
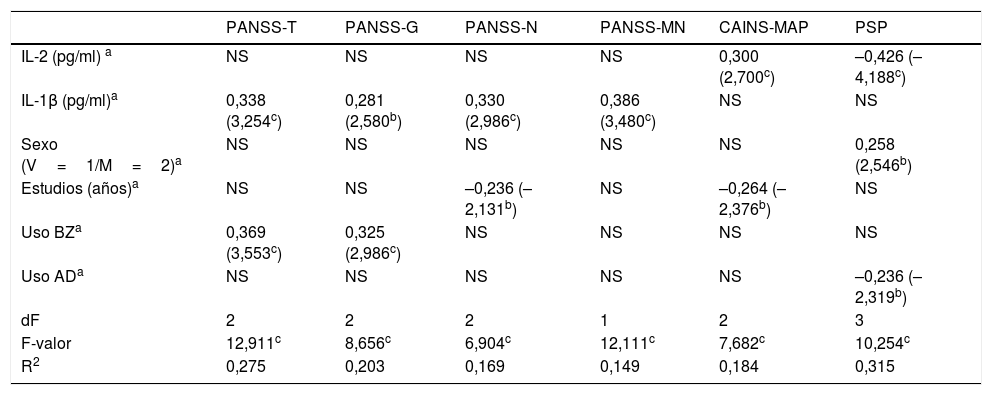
Para evaluar el efecto de la IL-2 e IL-1β sobre las dimensiones clínicas y el nivel funcionamiento, controlando factores de confusión, realizamos un análisis de regresión lineal múltiple en el que se incluyeron las covariables mencionadas. Los modelos finales se presentan en la tabla 2, mostrando solo aquellos factores independientes que explican un efecto sobre dimensiones clínicas específicas o la funcionalidad. Mientras que los niveles de IL-2 predicen específicamente una mayor gravedad de la subescala de motivación/placer y peores puntuaciones en la PSP, las concentraciones de IL-1β predicen una mayor gravedad en las puntuaciones de la PANSS-total, PANSS-general, PANSS-negativa y PANSS-MN.
Resumen de los modelos de regresión lineal de la relación entre citocinas y las puntuaciones clínicas en pacientes
| PANSS-T | PANSS-G | PANSS-N | PANSS-MN | CAINS-MAP | PSP | |
|---|---|---|---|---|---|---|
| IL-2 (pg/ml) a | NS | NS | NS | NS | 0,300 (2,700c) | –0,426 (–4,188c) |
| IL-1β (pg/ml)a | 0,338 (3,254c) | 0,281 (2,580b) | 0,330 (2,986c) | 0,386 (3,480c) | NS | NS |
| Sexo (V=1/M=2)a | NS | NS | NS | NS | NS | 0,258 (2,546b) |
| Estudios (años)a | NS | NS | –0,236 (–2,131b) | NS | –0,264 (–2,376b) | NS |
| Uso BZa | 0,369 (3,553c) | 0,325 (2,986c) | NS | NS | NS | NS |
| Uso ADa | NS | NS | NS | NS | NS | –0,236 (–2,319b) |
| dF | 2 | 2 | 2 | 1 | 2 | 3 |
| F-valor | 12,911c | 8,656c | 6,904c | 12,111c | 7,682c | 10,254c |
| R2 | 0,275 | 0,203 | 0,169 | 0,149 | 0,184 | 0,315 |
AD: antidepresivos; BZ: benzodiazepinas; CAINS: Entrevista de evaluación clínica para el síndrome negativo; EXP: expresión; -G: general; IL: interleucina; M: mujer; MAP: motivación y placer; -MN: negativa factor Marder; -N: negativa; NS: variables excluidas en el modelo final; PANSS, Escala del síndrome positivo y negativo; PSP: Escala del funcionamiento personal y social; -T: total; V: varón.
Encontramos niveles elevados de IL-6 y TNF-α en pacientes con SZ, clínicamente estables, en sus primeros 10 años de evolución de la enfermedad, en comparación con sus CS de la misma edad y sexo. Cuando se incluyeron otros factores de confusión en los análisis (tabaquismo, IMC, perímetro abdominal, tratamientos psicofarmacológicos), el diagnóstico de esquizofrenia fue predictor de concentraciones más elevadas de IL-6, pero no de TNF-α. Además, no hay diferencias estadísticamente significativas en ninguna de las citocinas entre PEP y pacientes con ECT.
La hipótesis previa de que la IL-6 es un marcador de estado4 es contraria a nuestros resultados, al igual que a diversos estudios posteriores que encuentran cómo los niveles de IL-6 permanecen elevados en pacientes estabilizados después de las recaídas7–9,27.
Menos numerosos son los estudios que investigan la vía inflamatoria de la IL-1 en la esquizofrenia, incluyendo marcadores como la IL-1RA e IL-1β. En una muestra amplia de pacientes con SZ se han detectado niveles elevados de IL-1RA28, y en otro estudio estos permanecían aumentados después de un año de seguimiento29. No obstante, un estudio anterior identificaba niveles elevados de IL-1RA en las fases agudas, pero más bajos después del tratamiento30. También se han encontrado resultados inconsistentes para otras citocinas proinflamatorias como la IL-27,17,31,32 y el metanálisis de Potvin et al. (2008), que describe niveles disminuidos de IL-2 in vitro, pero incrementados en condiciones in vivo en la esquizofrenia33. Nuestro estudio no identifica niveles significativamente distintos de IL-2, IL-1β o IL-1RA en pacientes estables respecto a los CS.
Por otro lado, nuestros hallazgos sugieren cómo niveles más elevados de IL-1β tendrían una influencia en la gravedad de la sintomatología global, y más particularmente en la sintomatología general y negativa, medida por las subescalas PANSS-negativa y PANSS-MN. Además, los niveles de IL-2 predicen la gravedad de un dominio específico de la dimensión negativa (motivación y placer) medido por la CAINS-MAP. Cabe mencionar que la IL-1β es uno de los principales reguladores de la respuesta inflamatoria y está estrechamente relacionada con la IL-2, que es inducida por la propia IL-1β34. Ambas citocinas muestran también una moderada correlación positiva en nuestro estudio (r=0,655, p<0,001). Puede resultar sorprendente que 2 escalas que evalúan la sintomatología negativa muestren una relación independiente con 2 citocinas diferentes. Sin embargo, creemos que se debe a que la subescala negativa de la PANSS mide diferentes constructos que la CAINS, dado que la CAINS-MAP se centra en el factor nuclear de la dimensión negativa constituida por los síntomas de abulia y anhedonia35.
Nuestros resultados contrastan con los estudios escasos que han encontrado una correlación inversa entre la IL-2 y la gravedad de los síntomas negativos en pacientes con SZ crónicos o resistentes al tratamiento17,36. Además, la dimensión negativa también se ha relacionado con niveles elevados de IL-1RA, IL-6 y TNF-α11,13,37, mientras que otros estudios no han replicado estos hallazgos. Hasta donde sabemos, este es el primer estudio en describir una asociación positiva entre la IL-1β y la puntuación de la subescala negativa de la PANSS. Sin embargo, es importante señalar que la subescala negativa de la PANSS tiene varias limitaciones de validez, ya que no incorpora síntomas relevantes como abulia y anhedonia, e incluye síntomas cognitivos, como dificultades en el pensamiento abstracto38,39, si bien esta última limitación fue eliminada por el factor negativo de Marder de la PANSS.
Por otro lado, Liu et al. (2010) ya reportaron una correlación positiva entre la subescala de psicopatología general de la PANSS y los niveles de ARNm de IL-1β, de manera similar a nuestros resultados40.
Ninguna otra citocina mostró una correlación significativa con las dimensiones clínicas en nuestra muestra. Aunque en algún estudio se describe una influencia de las citocinas sobre el deterioro cognitivo en pacientes con diagnóstico de esquizofrenia41, nuestros resultados no permiten apoyar estos hallazgos.
Finalmente, encontramos cómo la IL-2 predice la funcionalidad global. Sin embargo, pocos estudios han descrito una asociación entre las citocinas y la funcionalidad en la esquizofrenia. Por ejemplo, Hope et al. (2013) describieron un peor nivel de funcionamiento relacionado con los niveles de IL-1RA y TNF-R111, pero utilizaron la escala de Evaluación global del funcionamiento, que ha sido superada por la PSP, con una evaluación más precisa de la funcionalidad. Es importante destacar que la abulia y la anhedonia son algunos de los síntomas con mayor impacto en el funcionamiento global42, lo que respalda nuestros resultados.
Una de las principales limitaciones de nuestro estudio es la naturaleza transversal de los datos presentados. En segundo lugar disponíamos de un grupo de CS, pero no otro grupo de pacientes con diferente trastorno mental grave, como el trastorno bipolar, para poder contrastar estos resultados. Por lo tanto, no podemos concluir que la IL-6 sea específica para la esquizofrenia. Otra posible limitación es que la mayoría de los pacientes recibían tratamiento psicofarmacológico, lo que podría influir en los resultados. Sin embargo, mientras algunos estudios describen un efecto antiinflamatorio de los antipsicóticos43, Morch et al. (2016), en una muestra amplia, no encontraron ninguna influencia de los psicofármacos sobre la inflamación, y sugieren que «la asociación entre los marcadores inflamatorios y los antipsicóticos estaría causada por el propio trastorno»28. En nuestro estudio solo la IL-1β mostró una correlación positiva con las dosis equivalentes de antipsicótico, lo que probablemente refleja pacientes con una mayor gravedad clínica. Además, en nuestros análisis hemos considerado el tratamiento psicofarmacológico como un potencial factor de confusión.
Una fortaleza de este estudio es que se utilizaron instrumentos psicométricos adecuados y precisos para una evaluación clínica detallada, especialmente de los síntomas negativos, la cognición y el nivel de funcionamiento global. Hasta donde sabemos, ningún estudio previo sobre citocinas en la esquizofrenia ha empleado la CAINS, la MCCB o la PSP.
En conjunto, las alteraciones de citocinas en la SZ se describen ampliamente en las fases agudas, mientras que los resultados son menos consistentes en las fases de estabilidad. Además, existen datos publicados contradictorios sobre las citocinas y su relación con la psicopatología, que sugieren que este tema aún no está aclarado. En este sentido, creemos que el presente estudio ofrece resultados novedosos sobre posibles trastornos inflamatorios específicos del factor nuclear de la dimensión negativa (motivación y placer) asociados con la IL-2. Por tanto, la potencial implicación de IL-2 en la fisiopatología de los síntomas negativos, abulia y anhedonia, se presenta como una posible diana para el desarrollo de nuevas moléculas terapéuticas.
FinanciaciónEste estudio está financiado por una beca del Ministerio de Economía y Competitividad, Instituto de Salud Carlos III (PI13/02263) y el Fondo Europeo de Desarrollo Regional (FEDER).
Conflicto de interesesLGB ha recibido una beca de la Fundación de Psiquiatría y Salud Mental. Además, este autor ha recibido honorarios como ponente y soporte logístico para asistir a Congresos de Janssen-Cilag, Otsuka, Lundbeck y Pfizer.
MPGPG ha sido consultor y ha recibido honorarios/becas de Alianza Otsuka-Lundbeck, CIBERSAM, European Commission, Instituto de Salud Carlos III, Janssen-Cilag, Lilly, Lundbeck, Otsuka, Pfizer, Servier, Roche y Rovi.
LGA ha recibido honorarios de 7th Framework Program European Union.
PAMS ha sido consultor y ha recibido honorarios/becas de Adamed, AstraZeneca, Brainpharma, Bristol-Myers Squibb, CIBERSAM, Esteve, European Commission, Ferrer inCode, GlaxoSmithKline, Instituto de Salud Carlos III, Janssen-Cilag, Lilly, Lundbeck, Otsuka, Pfizer, Plan Nacional Sobre Drogas, Rovi y Servier.
JBG ha recibido becas de investigación y ha sido consultor/ponente en los últimos 5 años de: AB-Biotics, Adamed, Almirall, AstraZeneca, Bristol-Myers Squibb, Ferrer, GlaxoSmithKline, Hoffman La Roche, Janssen-Cilag, Indivior, Lilly, Lundbeck, Merck, Novartis, Organon, Otsuka, Pfizer, Pierre-Fabre, Reckitt-Benckiser, Sanofi-Aventis, Servier, Shering-Plough y Shire, fondos de investigación del Ministerio de Economía y Competitividad–Centro de Investigación Biomédica en Red Área de Salud Mental (CIBERSAM) e Instituto de Salud Carlos III, Spanish Ministry of Health, Social Services and Equality —Plan Nacional sobre Drogas— y el 7th Framework Program of the European Union.
LFT, CIG, SRG, y ACM no tienen conflicto de intereses.