En este trabajo se analiza la utilidad de diferentes intervenciones psicológicas y farmacológicas empleadas en el abordaje de pacientes con trastorno bipolar y abuso de sustancias. Se realizó una búsqueda bibliográfica en las bases de datos Medline y PsycINFO (2005-2015). Un total de 30 estudios experimentales se describen agrupados según el tipo de modalidad terapéutica (farmacológica 19; psicológica 11). La quetiapina y el valproato han demostrado superioridad en la mejora de los síntomas psiquiátricos y en la reducción del consumo de alcohol, respectivamente. Las terapias psicológicas grupales con psicoeducación, prevención de recaídas e inclusión de la familia han resultado favorables para reducir la sintomatología y favorecer la abstinencia y la adherencia al tratamiento. La abundancia de terapias multicomponente, la falta de especificación de las características clínicas de los participantes durante la intervención, la elevada tasa de abandono o la falta de control experimental de algunos estudios comprometen la posibilidad de considerar las actuales pautas de intervención recomendadas como tratamientos bien establecidos.
The aim of this study was to provide a descriptive overview of different psychological and pharmacological interventions used in the treatment of patients with bipolar disorder and substance abuse, in order to determine their efficacy. A review of the current literature was performed using the databases Medline and PsycINFO (2005-2015). A total of 30 experimental studies were grouped according to the type of therapeutic modality described (pharmacological 19; psychological 11). Quetiapine and valproate have demonstrated superiority on psychiatric symptoms and a reduction in alcohol consumption, respectively. Group psychological therapies with education, relapse prevention and family inclusion have also been shown to reduce the symptomatology and prevent alcohol consumption and dropouts. Although there seems to be some recommended interventions, the multicomponent base, the lack of information related to participants during treatment, experimental control or the number of dropouts of these studies suggest that it would be irresponsible to assume that there are well established treatments.
Los casos de trastorno bipolar (TB) con trastorno por uso de sustancias (TUS) han recibido una escasa atención en la investigación de los últimos años, en particular en lo referente a su tratamiento. Sin embargo, la prevalencia de esta afección, los costes asistenciales y sociales que genera esta población, además del sufrimiento personal, ponen de relieve la importancia de un manejo eficaz de este trastorno. En el caso del TUS en pacientes con TB tipo i se calcula una prevalencia vital de en torno al 52,3-60,7%, y al 36,5-48,1% en el TB tipo ii1–3. Esta tipología de trastorno dual se asocia también a una mayor presencia de enfermedades médicas, hospitalizaciones de larga duración e intentos de suicidio4,5. Además, presenta una alta comorbilidad con trastornos de ansiedad6 y síntomas como la agitación psicomotora7, lo que a su vez empeora el pronóstico del TB y acusa un incremento del consumo de sustancias.
Por su parte, el consumo de sustancias ha demostrado empeorar la sintomatología psiquiátrica del TB haciendo, por ejemplo, más frecuente el cambio de un episodio –maníaco, depresivo o mixto– a otro8. Algunos estudios muestran cómo el consumo de alcohol en estos sujetos se asocia a mayores déficits cognitivos, especialmente en memoria visual y verbal y en funcionamiento ejecutivo y habilidades de razonamiento9,10, mientras que el consumo de tabaco o cannabis parece asociarse a un empeoramiento de la sintomatología en el TB11,12. Alternativamente, varios trabajos señalan la abstinencia temprana de cualquier consumo como predictor favorable de una mejor evolución de la persona con TB13. En todo caso, las personas con diagnósticos concomitantes de TB y TUS suelen tener mayor actividad criminal y peor funcionamiento en la vida social que aquellas que solo cursan con bipolaridad, llegando a equipararse a las personas con un diagnóstico de esquizofrenia sin TUS14,15.
En el abordaje de esta afección se han planteado una serie de tratamientos farmacológicos, como el litio16, la carbamazepina17, la quetiapina18,19 o la lamotrigina20, así como algunos psicológicos, tales como las terapias de grupo, familiar, cognitivo-conductual, de prevención de recaídas, etc.21–24. Aun así, no parece haber un tratamiento de eficacia probada para esta clase de pacientes. Esto, junto con la típica división dicotómica de los sistemas atencionales –para trastornos mentales o para drogadicciones–, así como de los acercamientos terapéuticos –farmacológico o psicológico–, señala la conveniencia de analizar en profundidad las diferentes intervenciones actualmente disponibles para abordar estas situaciones. El presente estudio tiene como objetivo la descripción de los procedimientos que han demostrado ser útiles en el tratamiento del TB en comorbilidad con el consumo de sustancias y ofrecer así una perspectiva general del estado de la investigación actual a este respecto.
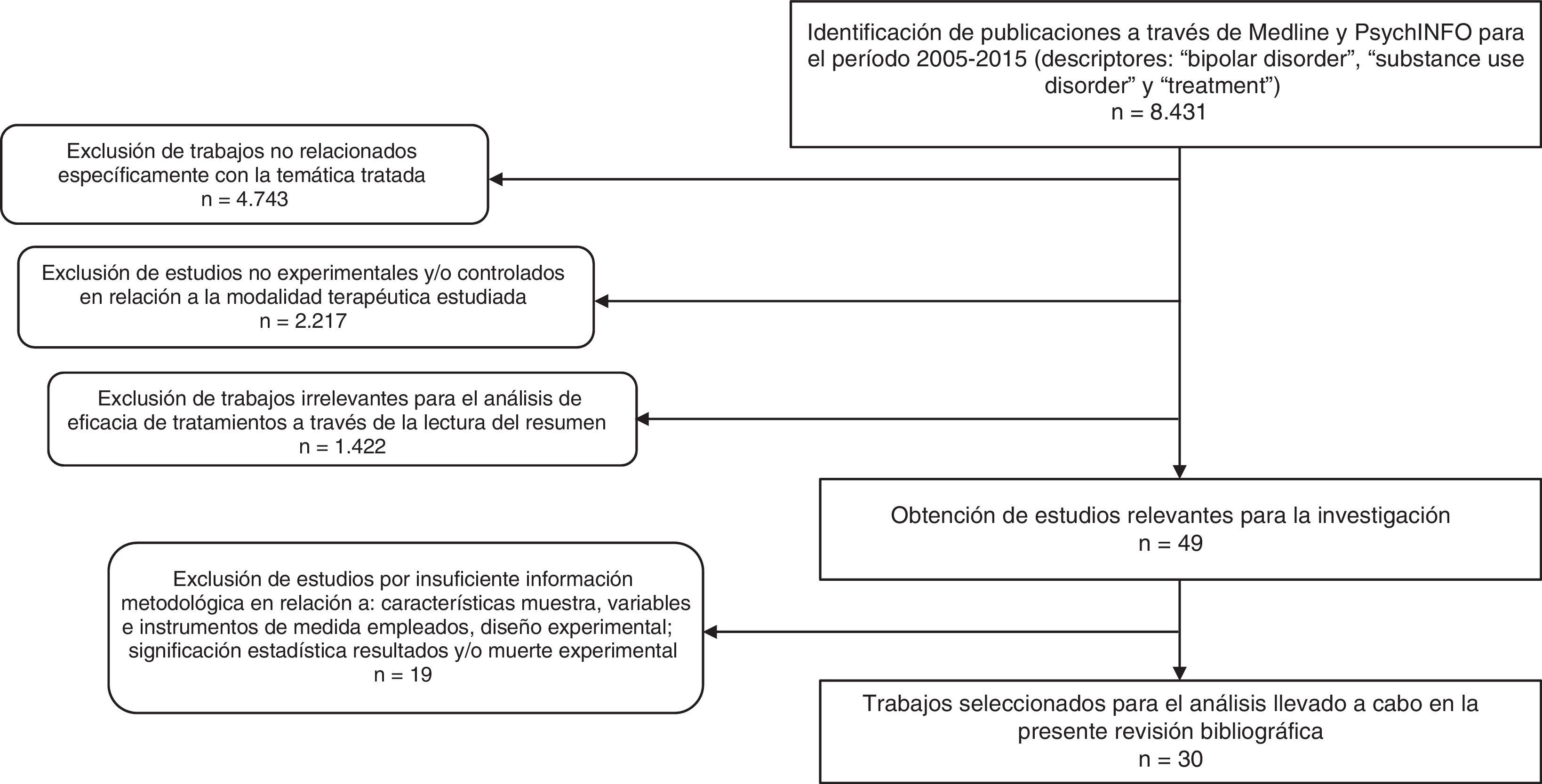
MétodoSe realizó una búsqueda general (2005-2015) en las bases de datos Medline y PsycINFO utilizando como descriptores los términos: («bipolar disorder» AND «substance use disorder» AND «treatment»). Se han delimitado los últimos 10 años por considerarse un período de tiempo adecuado para ofrecer una visión actualizada sobre la temática que trata el presente trabajo.
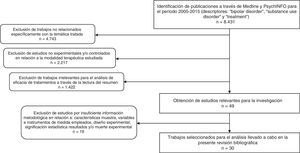
Como resultado, se obtuvieron 8.431 artículos. A partir de estos documentos, se realizó una criba en la que se seleccionaron investigaciones con base en los siguientes criterios de inclusión: 1) trabajos cuyo objetivo de estudio fuese la evaluación de alguna modalidad de tratamiento para el TB y el TUS; 2) que, en relación con la modalidad terapéutica estudiada, empleasen el método experimental y/o controlado para determinar el beneficio terapéutico; 3) que informaran de forma clara de las características de la muestra, las variables y los instrumentos utilizados en su medición, el diseño experimental y la significación estadística de los resultados, así como de la muerte experimental; 4) escritos en inglés, español, italiano, francés o alemán. Delimitando los criterios comentados, se identificaron un total de 30 estudios experimentales, que se analizan en el presente trabajo. En la figura 1 se describe el proceso de selección y exclusión de los estudios.
ResultadosDe los 30 estudios experimentales que cumplían los criterios metodológicos exigidos, 19 se refieren a tratamientos farmacológicos y 11 a tratamientos psicológicos. En ellos, se realiza una evaluación pre-pos con un seguimiento de entre 2 meses y 5 años, siendo la droga más frecuentemente consumida el alcohol, seguida de la cocaína, el cannabis y la metanfetamina. No obstante, la mayoría de los sujetos que conforman las muestras analizadas no se limitan a consumir una sola droga, sino que son politoxicómanos.
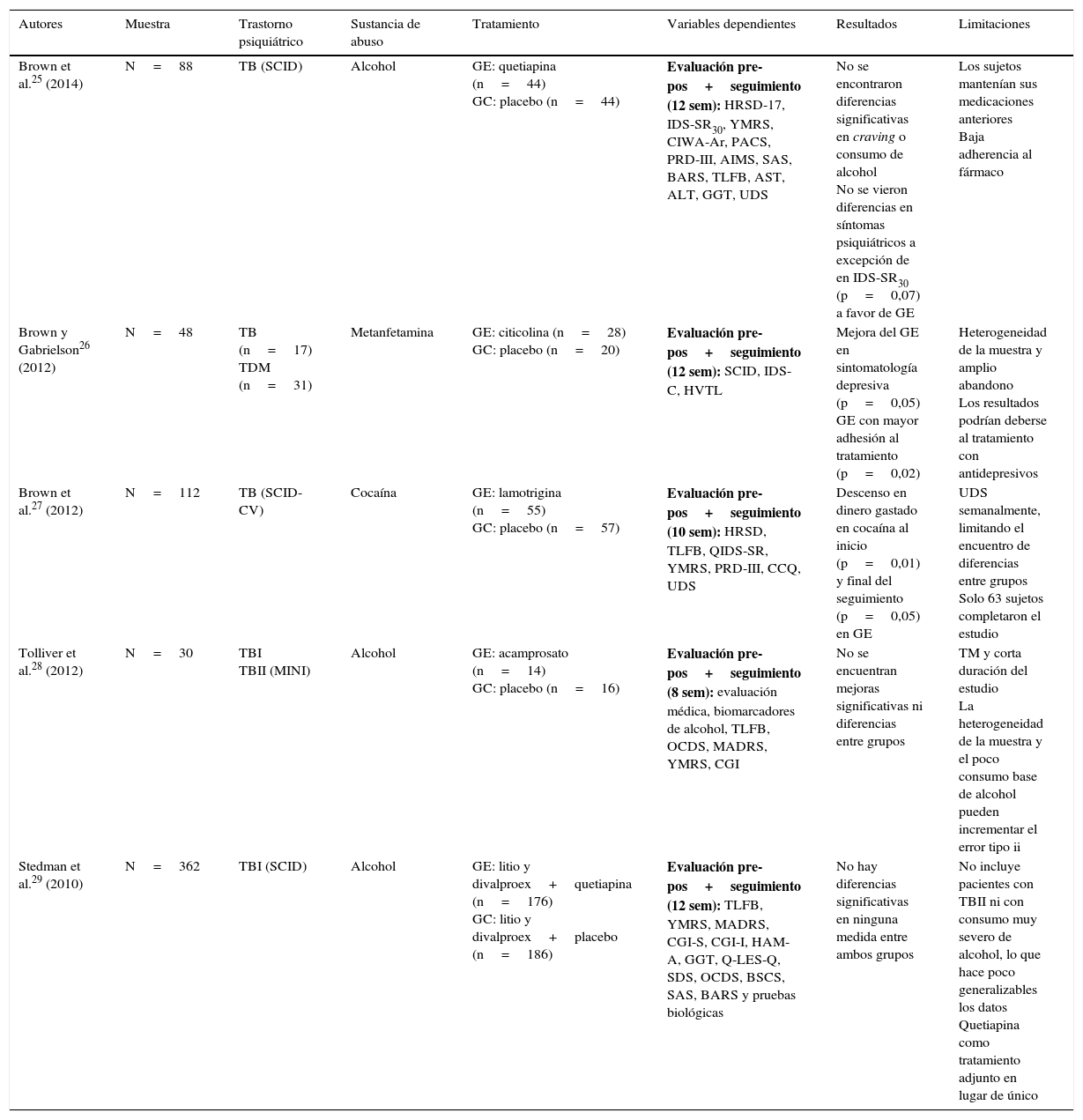
Entre los estudios de intervenciones farmacológicas revisados, divalproex, quetiapina y lamotrigina son los fármacos más habitualmente empleados. La problemática del TB en comorbilidad con el consumo de alcohol se analiza en 6 estudios, y otros 4 trabajos atienden al consumo de otras drogas. En todos los casos se utiliza un diseño doble ciego aleatorizado, controlado con placebo25–34 (tabla 1).
Estudios experimentales aleatorizados, con grupo control placebo y diseño doble ciego
| Autores | Muestra | Trastorno psiquiátrico | Sustancia de abuso | Tratamiento | Variables dependientes | Resultados | Limitaciones |
|---|---|---|---|---|---|---|---|
| Brown et al.25 (2014) | N=88 | TB (SCID) | Alcohol | GE: quetiapina (n=44) GC: placebo (n=44) | Evaluación pre-pos+seguimiento (12 sem): HRSD-17, IDS-SR30, YMRS, CIWA-Ar, PACS, PRD-III, AIMS, SAS, BARS, TLFB, AST, ALT, GGT, UDS | No se encontraron diferencias significativas en craving o consumo de alcohol No se vieron diferencias en síntomas psiquiátricos a excepción de en IDS-SR30 (p=0,07) a favor de GE | Los sujetos mantenían sus medicaciones anteriores Baja adherencia al fármaco |
| Brown y Gabrielson26 (2012) | N=48 | TB (n=17) TDM (n=31) | Metanfetamina | GE: citicolina (n=28) GC: placebo (n=20) | Evaluación pre-pos+seguimiento (12 sem): SCID, IDS-C, HVTL | Mejora del GE en sintomatología depresiva (p=0,05) GE con mayor adhesión al tratamiento (p=0,02) | Heterogeneidad de la muestra y amplio abandono Los resultados podrían deberse al tratamiento con antidepresivos |
| Brown et al.27 (2012) | N=112 | TB (SCID-CV) | Cocaína | GE: lamotrigina (n=55) GC: placebo (n=57) | Evaluación pre-pos+seguimiento (10 sem): HRSD, TLFB, QIDS-SR, YMRS, PRD-III, CCQ, UDS | Descenso en dinero gastado en cocaína al inicio (p=0,01) y final del seguimiento (p=0,05) en GE | UDS semanalmente, limitando el encuentro de diferencias entre grupos Solo 63 sujetos completaron el estudio |
| Tolliver et al.28 (2012) | N=30 | TBI TBII (MINI) | Alcohol | GE: acamprosato (n=14) GC: placebo (n=16) | Evaluación pre-pos+seguimiento (8 sem): evaluación médica, biomarcadores de alcohol, TLFB, OCDS, MADRS, YMRS, CGI | No se encuentran mejoras significativas ni diferencias entre grupos | TM y corta duración del estudio La heterogeneidad de la muestra y el poco consumo base de alcohol pueden incrementar el error tipo ii |
| Stedman et al.29 (2010) | N=362 | TBI (SCID) | Alcohol | GE: litio y divalproex+quetiapina (n=176) GC: litio y divalproex+placebo (n=186) | Evaluación pre-pos+seguimiento (12 sem): TLFB, YMRS, MADRS, CGI-S, CGI-I, HAM-A, GGT, Q-LES-Q, SDS, OCDS, BSCS, SAS, BARS y pruebas biológicas | No hay diferencias significativas en ninguna medida entre ambos grupos | No incluye pacientes con TBII ni con consumo muy severo de alcohol, lo que hace poco generalizables los datos Quetiapina como tratamiento adjunto en lugar de único |
| Wang et al.30 (2010) | N=36 | Ciclación rápida TBI/TBII (DSM-IV y MINI) | No especificado | GE: litio y divalproex+lamotrigina (n=8) GC: litio y divalproex+placebo (n=8) | Evaluación pre-pos+seguimiento (12 sem): MADRS, YMRS, CGI, GAF, ASI | No hay diferencias significativas en sintomatología psiquiátrica ni en funcionamiento general | TM y gran abandono del tratamiento (N final=16) Inclusión únicamente de sujetos de ciclación rápida y farmacorresistentes al tratamiento inicial |
| Brown et al.31 (2009) | N=43 | TBI TBII (MINI y SCID) | Alcohol | GE: CBT+naltrexona (n=20) GC: CBT+placebo (n=23) | Evaluación pre-pos+seguimiento (12 sem): MINI, HAM-D, IDS-SR30, YMRS, PACS, PRD-III, ASI y pruebas biológicas | No se encontraron diferencias significativas entre los grupos | TM y abandono de tratamiento (N final=26) Resultados confusos por uso de medicación concomitante y CBT |
| Brown et al.32 (2008) | N=102 | TBI (n=50) TBII (n=52) (MINI) | Alcohol | GE: quetiapina (n=52) GC: placebo (n=50) | Evaluación pre-pos+seguimiento (12 sem): HAM-D, YMRS, PACS, TLFB for recent drinking, AIMS, SAS y BAS | Mejora en sintomatología depresiva favoreciendo al GE (p<0,05), pero no en maníaca ni en consumo de alcohol | Heterogeneidad de la muestra y bajo nivel de consumo de alcohol al comienzo del estudio Sin especificación de tratamiento complementario |
| Brown et al.33 (2007) | N=44 | TBI (n=35) TBII (n=3) SAD-TB (n=6) (MINI) | Cocaína | GE: citicolina (n=23) GC: placebo (n=21) | Evaluación pre-pos+seguimiento (12 sem): IDS-SR30, YMRS, RAVLT, PRD-III, UDS | GE con mejor ejecución en lista alternativa de palabras del RAVLT (p=0,006) Menor probabilidad del GE de consumir cocaína (p=0,026) | TM y poca adherencia al tratamiento Gran variedad de tratamiento concomitante Heterogeneidad de la muestra |
| Salloum et al.34 (2005) | N=59 | TBI (SCID) | Alcohol | GE: litio+valproato (n=29) GC: litio+placebo (n=30) | Evaluación pre-pos+seguimiento (12 sem): BRMS, HRSD-25, GAS, TLFB for recent drinking, MQACS, WSHAQ, SCMAF, BAC y UDS | Menos días de consumo abusivo de alcohol (p=0,02) y períodos mayores hasta recaída (p=0,048) en el GE con respecto al GC | TM y falta de potencia estadística para detectar diferencias entre los tratamientos No distinción entre episodio (maníaco, depresivo o mixto) al inicio del estudio |
AIMS: Abnormal Involuntary Movement Scale; ALT: alanine aminotranferase; ASI: Addiction Severity Index; AST: aspartate aminotransferase; BAC: breath alcohol concentration; BARS: Barnes Akathisia Rating Scale; BAS: Barnes Akathisia Scale; BSCS: Brief Substance Craving Scale; BRMS: Bech-Rafaelsen Mania Scale; CBT: Cognitive Behavioral Therapy; CCQ: Cocaine Craving Questionnaire; CGI: Clinical Global Impression (Severity [CGI-S] and Improvement [CGI-I]); CIWA-Ar: Clinical Institute Withdrawal Assessment of Alcohol revised; DSM-IV: Diagnostic and Statistical Manual of Mental Disorders, 4th edition; GAF: Global Assessment of Functioning Scale; GAS: Global Assessment Scale; GC: grupo control; GE: grupo experimental; GGT: gamma-glutamyltranferase; HAM-A: Hamilton Rating Scale for Anxiety; HAM-D: Hamilton Scale for Depression; HRSD-17: Hamilton Rating Scale for Depression-17; HRSD-25: Hamilton Rating Scale for Depression; HVTL: Hopkins Auditory Verbal Learning Test; IDS-C: Inventory of Depressive Symptomatology Clinician-rated; IDS-SR30: Inventory of Depressive Symptomatology-Self-Report 30-item version; MADRS: Montgomery-Asberg Depression Rating Scale-25; MINI: Mini International Neuropsychiatric Interview; MQACS: Modified Quantitative Alcohol Inventory/Craving Scales; OCDS: Obsessive Compulsive Drinking Scale; PACS: Penn Alcohol Craving Scale; PRD-III: Psychobiology of Recovery in Depression III-Somatic Symptom Scale; QIDS-SR: Quick Inventory of Depressive Symptomatology; Q-LES-Q: Quality of Life Enjoyment and Satisfaction Questionnaire; RAVLT: Rey Auditory-Verbal Learning Test; SAD-TB: trastorno bipolar + trastorno esquizoafectivo; SAS: Simpson-Angus Scale; SCID: Structured Clinical Interview (DSM-IV); SCID-CV: Structured Clinical Interview-Clinical Version (DSM-IV); SCMAF: Symptoms Checklist and Medication Adherence Form; SDS: Sheehan Disability Scale; TB: trastorno bipolar; TBI: trastorno bipolar tipo I; TBII: trastorno bipolar tipo II; TDM: trastorno depresión mayor; TLFB: timeline follow-back; TM: tamaño muestral; UDS: Urine Drug Screens; WSHAQ: Modified Quantitative Alcohol Inventory/Craving Scales; YMRS: Young Mania Rating Scale.
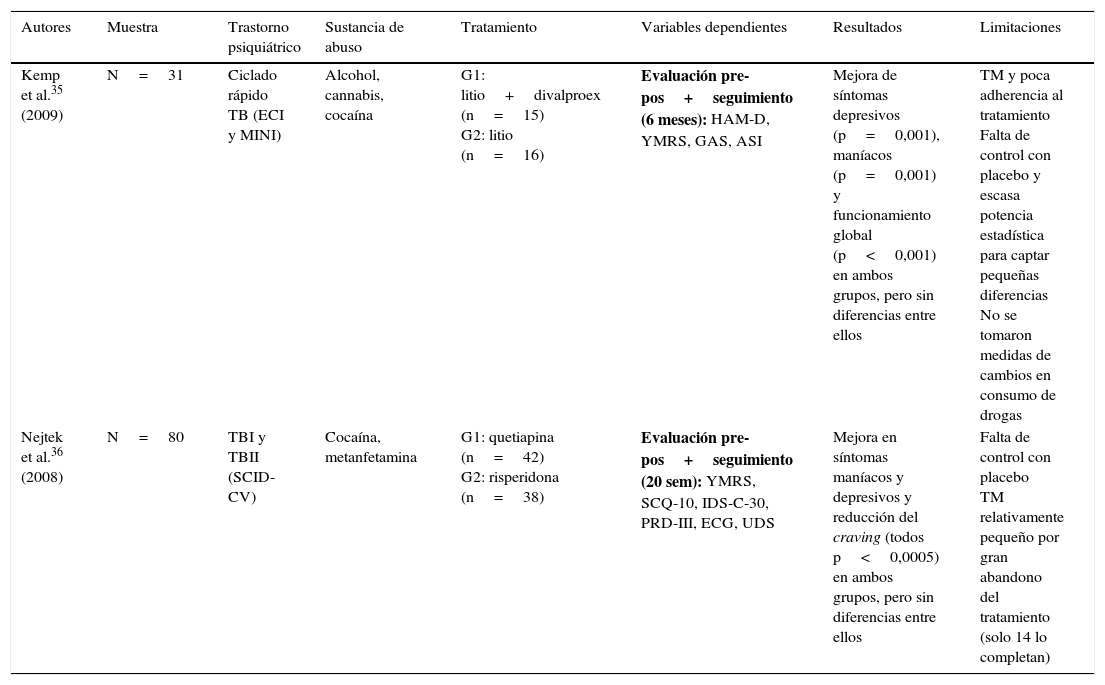
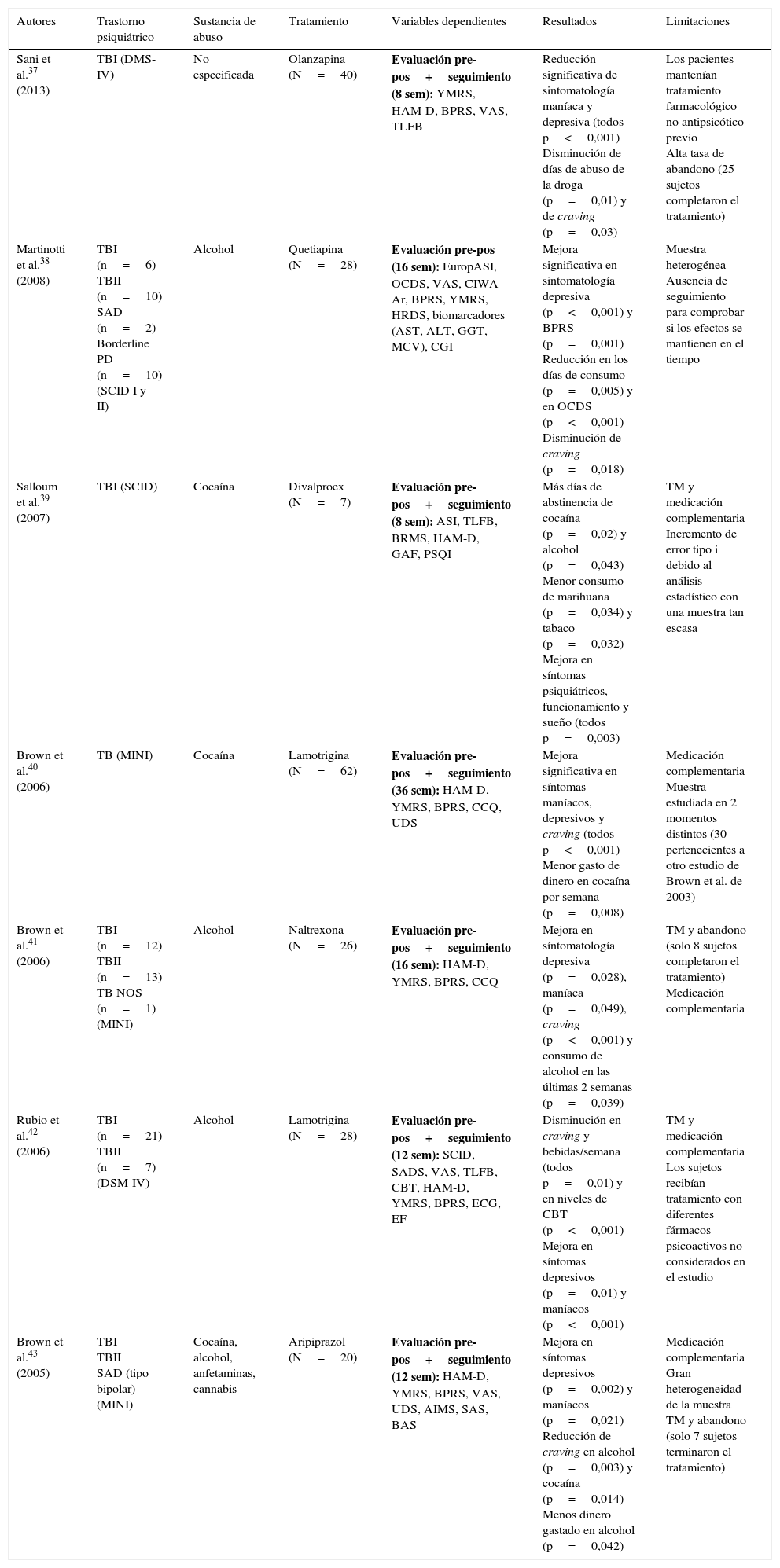
Únicamente se hallaron 2 estudios experimentales de comparación entre grupos con diseño aleatorizado doble ciego35,36, cuyos resultados se muestran en la tabla 2. Por último, se identificaron 7 trabajos cuasiexperimentales no controlados que ofrecen mejores resultados en la reducción de la sintomatología psiquiátrica y el consumo de drogas y craving, pero con mayores limitaciones a nivel metodológico37–43 (tabla 3).
Estudios experimentales aleatorizados, con grupos paralelos y diseño doble ciego
| Autores | Muestra | Trastorno psiquiátrico | Sustancia de abuso | Tratamiento | Variables dependientes | Resultados | Limitaciones |
|---|---|---|---|---|---|---|---|
| Kemp et al.35 (2009) | N=31 | Ciclado rápido TB (ECI y MINI) | Alcohol, cannabis, cocaína | G1: litio+divalproex (n=15) G2: litio (n=16) | Evaluación pre-pos+seguimiento (6 meses): HAM-D, YMRS, GAS, ASI | Mejora de síntomas depresivos (p=0,001), maníacos (p=0,001) y funcionamiento global (p<0,001) en ambos grupos, pero sin diferencias entre ellos | TM y poca adherencia al tratamiento Falta de control con placebo y escasa potencia estadística para captar pequeñas diferencias No se tomaron medidas de cambios en consumo de drogas |
| Nejtek et al.36 (2008) | N=80 | TBI y TBII (SCID-CV) | Cocaína, metanfetamina | G1: quetiapina (n=42) G2: risperidona (n=38) | Evaluación pre-pos+seguimiento (20 sem): YMRS, SCQ-10, IDS-C-30, PRD-III, ECG, UDS | Mejora en síntomas maníacos y depresivos y reducción del craving (todos p<0,0005) en ambos grupos, pero sin diferencias entre ellos | Falta de control con placebo TM relativamente pequeño por gran abandono del tratamiento (solo 14 lo completan) |
ASI: Addiction Severity Index; ECG: electrocardiograma; ECI: Extensive Clinical Interview; GAS: Global Assessment Scale; HAM-D: Hamilton Scale for Depression; IDS-C-30: 30-item Inventory of Depressive Symptomatology-Clinician-rated; MINI: Mini International Neuropsychiatric Interview; SCID-CV: Structured Clinical Interview-Clinical Version (DSM-IV); SCQ-10: 10-item self-reported Stimulant Craving Questionnaire; PRD-III:Psychobiology of Recovery in Depression III; TB: trastorno bipolar; TBI: trastorno bipolar tipo I; TBII: trastorno bipolar tipo II; TM: tamaño muestral; UDS: Urine Drug Screens; YMRS: Young Mania Rating Scale.
Estudios farmacológicos cuasiexperimentales
| Autores | Trastorno psiquiátrico | Sustancia de abuso | Tratamiento | Variables dependientes | Resultados | Limitaciones |
|---|---|---|---|---|---|---|
| Sani et al.37 (2013) | TBI (DMS-IV) | No especificada | Olanzapina (N=40) | Evaluación pre-pos+seguimiento (8 sem): YMRS, HAM-D, BPRS, VAS, TLFB | Reducción significativa de sintomatología maníaca y depresiva (todos p<0,001) Disminución de días de abuso de la droga (p=0,01) y de craving (p=0,03) | Los pacientes mantenían tratamiento farmacológico no antipsicótico previo Alta tasa de abandono (25 sujetos completaron el tratamiento) |
| Martinotti et al.38 (2008) | TBI (n=6) TBII (n=10) SAD (n=2) Borderline PD (n=10) (SCID I y II) | Alcohol | Quetiapina (N=28) | Evaluación pre-pos (16 sem): EuropASI, OCDS, VAS, CIWA-Ar, BPRS, YMRS, HRDS, biomarcadores (AST, ALT, GGT, MCV), CGI | Mejora significativa en sintomatología depresiva (p<0,001) y BPRS (p=0,001) Reducción en los días de consumo (p=0,005) y en OCDS (p<0,001) Disminución de craving (p=0,018) | Muestra heterogénea Ausencia de seguimiento para comprobar si los efectos se mantienen en el tiempo |
| Salloum et al.39 (2007) | TBI (SCID) | Cocaína | Divalproex (N=7) | Evaluación pre-pos+seguimiento (8 sem): ASI, TLFB, BRMS, HAM-D, GAF, PSQI | Más días de abstinencia de cocaína (p=0,02) y alcohol (p=0,043) Menor consumo de marihuana (p=0,034) y tabaco (p=0,032) Mejora en síntomas psiquiátricos, funcionamiento y sueño (todos p=0,003) | TM y medicación complementaria Incremento de error tipo i debido al análisis estadístico con una muestra tan escasa |
| Brown et al.40 (2006) | TB (MINI) | Cocaína | Lamotrigina (N=62) | Evaluación pre-pos+seguimiento (36 sem): HAM-D, YMRS, BPRS, CCQ, UDS | Mejora significativa en síntomas maníacos, depresivos y craving (todos p<0,001) Menor gasto de dinero en cocaína por semana (p=0,008) | Medicación complementaria Muestra estudiada en 2 momentos distintos (30 pertenecientes a otro estudio de Brown et al. de 2003) |
| Brown et al.41 (2006) | TBI (n=12) TBII (n=13) TB NOS (n=1) (MINI) | Alcohol | Naltrexona (N=26) | Evaluación pre-pos+seguimiento (16 sem): HAM-D, YMRS, BPRS, CCQ | Mejora en síntomatología depresiva (p=0,028), maníaca (p=0,049), craving (p<0,001) y consumo de alcohol en las últimas 2 semanas (p=0,039) | TM y abandono (solo 8 sujetos completaron el tratamiento) Medicación complementaria |
| Rubio et al.42 (2006) | TBI (n=21) TBII (n=7) (DSM-IV) | Alcohol | Lamotrigina (N=28) | Evaluación pre-pos+seguimiento (12 sem): SCID, SADS, VAS, TLFB, CBT, HAM-D, YMRS, BPRS, ECG, EF | Disminución en craving y bebidas/semana (todos p=0,01) y en niveles de CBT (p<0,001) Mejora en síntomas depresivos (p=0,01) y maníacos (p<0,001) | TM y medicación complementaria Los sujetos recibían tratamiento con diferentes fármacos psicoactivos no considerados en el estudio |
| Brown et al.43 (2005) | TBI TBII SAD (tipo bipolar) (MINI) | Cocaína, alcohol, anfetaminas, cannabis | Aripiprazol (N=20) | Evaluación pre-pos+seguimiento (12 sem): HAM-D, YMRS, BPRS, VAS, UDS, AIMS, SAS, BAS | Mejora en síntomas depresivos (p=0,002) y maníacos (p=0,021) Reducción de craving en alcohol (p=0,003) y cocaína (p=0,014) Menos dinero gastado en alcohol (p=0,042) | Medicación complementaria Gran heterogeneidad de la muestra TM y abandono (solo 7 sujetos terminaron el tratamiento) |
AIMS: Abnormal Involuntary Movement Scale; ALT: alanine aminotranferase; AST: aspartate aminotransferase; BAS: Barnes Akathisia Scale; Borderline PD: borderline personality disorder; BPRS: Brief Psychiatric Rating Scale; BRMS: Bech-Rafaelsen Mania Scale; CBT: Cognitive Behavioral Therapy; CCQ: Cocaine Craving Questionnaire; CGI: Clinical Global Impression (Severity [CGI-S] and Improvement [CGI-I]); CIWA-Ar: Clinical Institute Withdrawal Assessment of Alcohol revised; DSM-IV: Diagnostic and Statistical Manual of Mental Disorders, 4th edition; ECG: electrocardiograma; EF: evaluación física; EuropASI: European Addiction Severity Index; GAF: Global Assessment of Functioning Scale; GGT: gamma-glutamyltranferase; HAM-D: Hamilton Scale for Depression; MCV: mean cellular volume; MINI: Mini International Neuropsychiatric Interview; OCDS: Obsessive Compulsive Drinking Scale; PSQI: Pittsburgh Sleep Quality Index; SAD: trastorno esquizoafectivo; SADS: Severity of Alcohol Dependence Scale; SAS: Simpson-Angus Scale; SCID: Structured Clinical Interview (DSM-IV); SCID I: Structured Clinical Interview Axis I (DSM-IV); SCID II: Structured Clinical Interview Axis II (DSM-IV); TB: trastorno bipolar; TB NOS: trastorno bipolar sin especificar; TBI: trastorno bipolar tipo I; trastorno bipolar tipo II; TLFB: timeline follow-back; TM: tamaño muestral; UDS: Urine Drug Screens; VAS: Visual Analogue Scale; YMRS: Young Mania Rating Scale.
En lo que respecta al tratamiento psicológico, no parece haber un patrón claro de tratamiento. En la tabla 4 se recogen 4 trabajos experimentales aleatorizados con grupos paralelos que examinan la eficacia de diferentes técnicas44–47, mientras que la tabla 5 agrupa 7 investigaciones que proponen y evalúan intervenciones específicas48–54. Sin embargo, estos estudios adolecen de grupo control y otras garantías metodológicas.
Estudios experimentales aleatorizados con grupos paralelos
| Autores | Muestra | Trastorno psiquiátrico | Sustancia de abuso | Tratamiento | Variables dependientes | Resultados | Limitaciones |
|---|---|---|---|---|---|---|---|
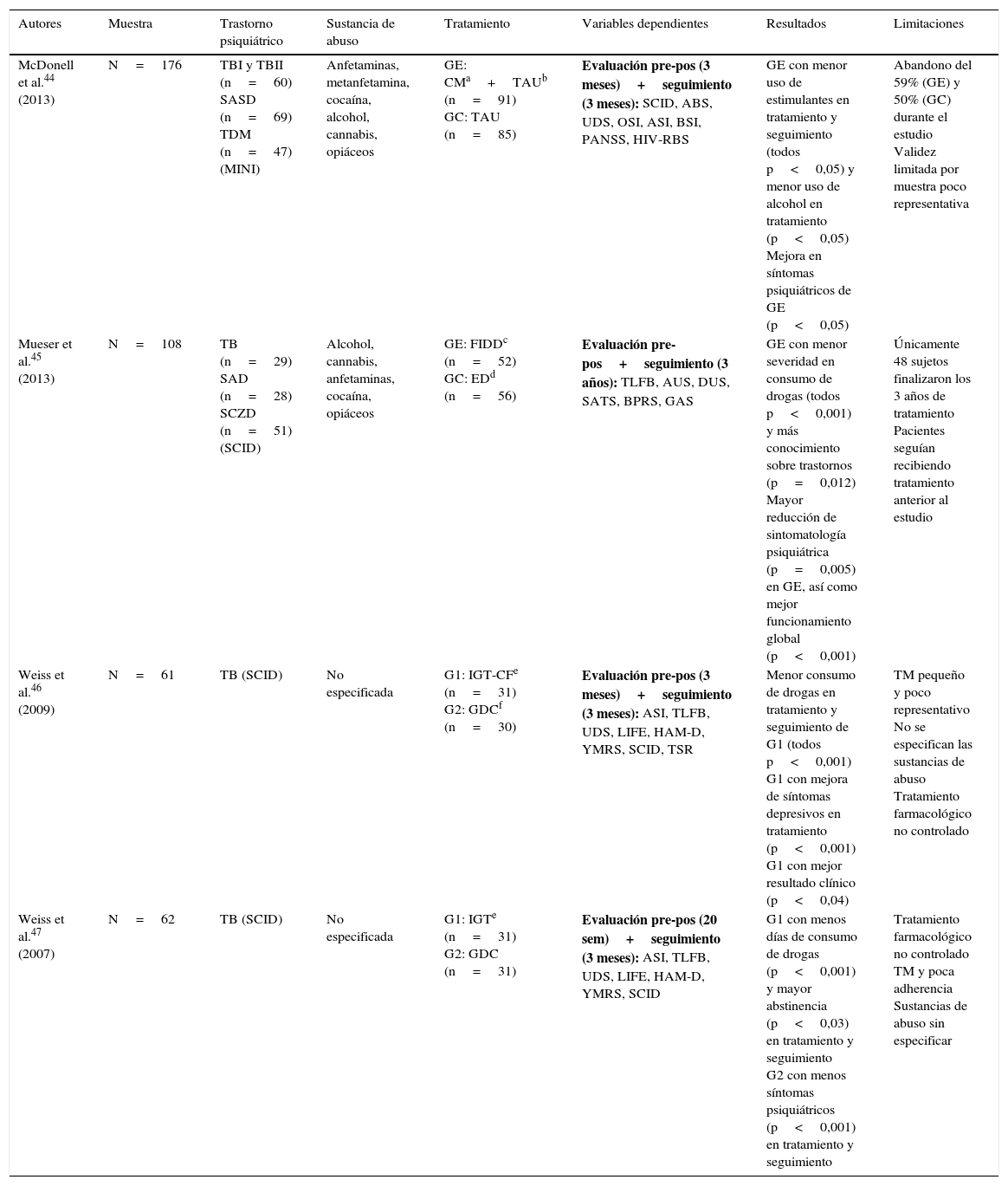
| McDonell et al.44 (2013) | N=176 | TBI y TBII (n=60) SASD (n=69) TDM (n=47) (MINI) | Anfetaminas, metanfetamina, cocaína, alcohol, cannabis, opiáceos | GE: CMa+TAUb (n=91) GC: TAU (n=85) | Evaluación pre-pos (3 meses)+seguimiento (3 meses): SCID, ABS, UDS, OSI, ASI, BSI, PANSS, HIV-RBS | GE con menor uso de estimulantes en tratamiento y seguimiento (todos p<0,05) y menor uso de alcohol en tratamiento (p<0,05) Mejora en síntomas psiquiátricos de GE (p<0,05) | Abandono del 59% (GE) y 50% (GC) durante el estudio Validez limitada por muestra poco representativa |
| Mueser et al.45 (2013) | N=108 | TB (n=29) SAD (n=28) SCZD (n=51) (SCID) | Alcohol, cannabis, anfetaminas, cocaína, opiáceos | GE: FIDDc (n=52) GC: EDd (n=56) | Evaluación pre-pos+seguimiento (3 años): TLFB, AUS, DUS, SATS, BPRS, GAS | GE con menor severidad en consumo de drogas (todos p<0,001) y más conocimiento sobre trastornos (p=0,012) Mayor reducción de sintomatología psiquiátrica (p=0,005) en GE, así como mejor funcionamiento global (p<0,001) | Únicamente 48 sujetos finalizaron los 3 años de tratamiento Pacientes seguían recibiendo tratamiento anterior al estudio |
| Weiss et al.46 (2009) | N=61 | TB (SCID) | No especificada | G1: IGT-CFe (n=31) G2: GDCf (n=30) | Evaluación pre-pos (3 meses)+seguimiento (3 meses): ASI, TLFB, UDS, LIFE, HAM-D, YMRS, SCID, TSR | Menor consumo de drogas en tratamiento y seguimiento de G1 (todos p<0,001) G1 con mejora de síntomas depresivos en tratamiento (p<0,001) G1 con mejor resultado clínico (p<0,04) | TM pequeño y poco representativo No se especifican las sustancias de abuso Tratamiento farmacológico no controlado |
| Weiss et al.47 (2007) | N=62 | TB (SCID) | No especificada | G1: IGTe (n=31) G2: GDC (n=31) | Evaluación pre-pos (20 sem)+seguimiento (3 meses): ASI, TLFB, UDS, LIFE, HAM-D, YMRS, SCID | G1 con menos días de consumo de drogas (p<0,001) y mayor abstinencia (p<0,03) en tratamiento y seguimiento G2 con menos síntomas psiquiátricos (p<0,001) en tratamiento y seguimiento | Tratamiento farmacológico no controlado TM y poca adherencia Sustancias de abuso sin especificar |
ABS: Alcohol Breath Samples; ASI: Addiction Severity Index; AUS: Alcohol Use Scale; BPRS: Brief Psychiatric Rating Scale; BSI: Brief Symptom Inventory; CM: contingency management; DUS: Drug Use Scale; ED: Family Education Program; FIDD: Family Intervention for Dual Diagnosis; GAS: Global Assessment Scale; GC: grupo control; GDC: Group Drug Counseling; GE: grupo experimental; HAM-D: Hamilton Rating Scale for Depression; HIV-RBS: HIV Risk Behavior Scale; IGT: integrated group therapy; IGT-CF: integrated group therapy community friendly; LIFE: longitudinal interval follow-up evaluation; MDD: trastorno depresión mayor; MINI: Mini International Neuropsychiatric Interview; OSI: on-site immunoassays; PANSS: Positive and Negative Syndrome Scale; SAD: trastorno esquizoafectivo; SASD: schizoaffective-spectrum disorder; SATS: Substance Abuse Treatment Scale; SCID: Structured Clinical Interview (DSM-IV); SCZD: esquizofrenia; TAU: treatment as usual; TB: trastorno bipolar; TBI: trastorno bipolar tipo I; TBII: trastorno bipolar tipo II; TDM: trastorno depresión mayor; TLFB: timeline follow-back; TM: tamaño muestral; TSR: treatment services review; UDS: Urine Drug Screens; YMRS: Young Mania Rating Scale.
Atención semanal de servicios sociales y de salud mental con medicación psiquiátrica y terapia grupal (sin especificar fármacos o terapias concretas).
Compuesta de psicoeducación, entrenamiento en habilidades de comunicación y solución de problemas, role-playing, entrevista motivacional, prevención de recaídas. Actúa sobre ambos diagnósticos.
Formada por psicoeducación extensa (trastornos, modelo vulnerabilidad-estrés, experiencias personales, presentación didáctica de información, discusiones, etc.).
Estudios psicológicos cuasiexperimentales
| Autores | Muestra | Trastorno psiquiátrico | Sustancia de abuso | Tratamiento | Variables dependientes | Resultados | Limitaciones |
|---|---|---|---|---|---|---|---|
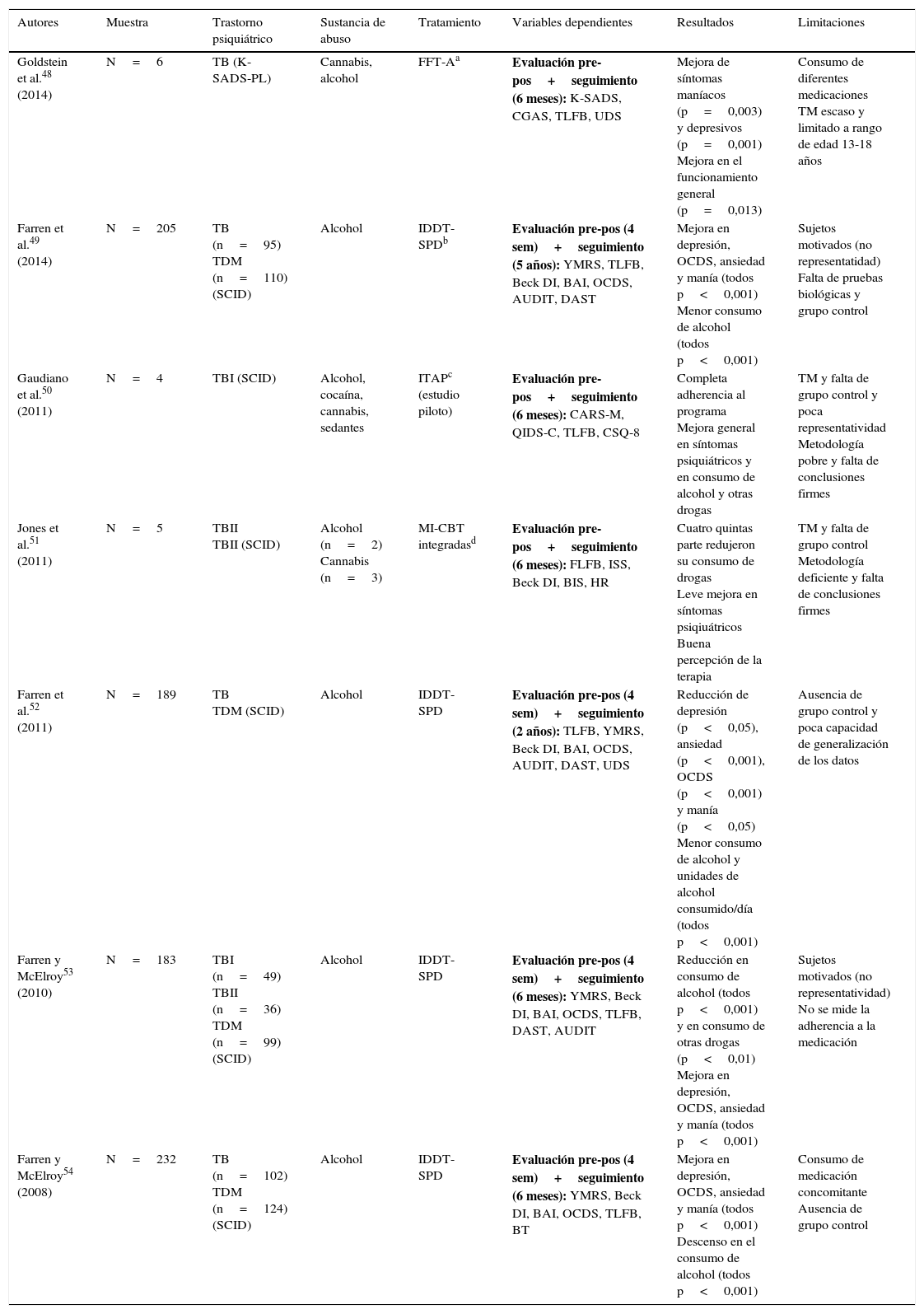
| Goldstein et al.48 (2014) | N=6 | TB (K-SADS-PL) | Cannabis, alcohol | FFT-Aa | Evaluación pre-pos+seguimiento (6 meses): K-SADS, CGAS, TLFB, UDS | Mejora de síntomas maníacos (p=0,003) y depresivos (p=0,001) Mejora en el funcionamiento general (p=0,013) | Consumo de diferentes medicaciones TM escaso y limitado a rango de edad 13-18 años |
| Farren et al.49 (2014) | N=205 | TB (n=95) TDM (n=110) (SCID) | Alcohol | IDDT-SPDb | Evaluación pre-pos (4 sem)+seguimiento (5 años): YMRS, TLFB, Beck DI, BAI, OCDS, AUDIT, DAST | Mejora en depresión, OCDS, ansiedad y manía (todos p<0,001) Menor consumo de alcohol (todos p<0,001) | Sujetos motivados (no representatidad) Falta de pruebas biológicas y grupo control |
| Gaudiano et al.50 (2011) | N=4 | TBI (SCID) | Alcohol, cocaína, cannabis, sedantes | ITAPc (estudio piloto) | Evaluación pre-pos+seguimiento (6 meses): CARS-M, QIDS-C, TLFB, CSQ-8 | Completa adherencia al programa Mejora general en síntomas psiquiátricos y en consumo de alcohol y otras drogas | TM y falta de grupo control y poca representatividad Metodología pobre y falta de conclusiones firmes |
| Jones et al.51 (2011) | N=5 | TBII TBII (SCID) | Alcohol (n=2) Cannabis (n=3) | MI-CBT integradasd | Evaluación pre-pos+seguimiento (6 meses): FLFB, ISS, Beck DI, BIS, HR | Cuatro quintas parte redujeron su consumo de drogas Leve mejora en síntomas psiqiuátricos Buena percepción de la terapia | TM y falta de grupo control Metodología deficiente y falta de conclusiones firmes |
| Farren et al.52 (2011) | N=189 | TB TDM (SCID) | Alcohol | IDDT-SPD | Evaluación pre-pos (4 sem)+seguimiento (2 años): TLFB, YMRS, Beck DI, BAI, OCDS, AUDIT, DAST, UDS | Reducción de depresión (p<0,05), ansiedad (p<0,001), OCDS (p<0,001) y manía (p<0,05) Menor consumo de alcohol y unidades de alcohol consumido/día (todos p<0,001) | Ausencia de grupo control y poca capacidad de generalización de los datos |
| Farren y McElroy53 (2010) | N=183 | TBI (n=49) TBII (n=36) TDM (n=99) (SCID) | Alcohol | IDDT-SPD | Evaluación pre-pos (4 sem)+seguimiento (6 meses): YMRS, Beck DI, BAI, OCDS, TLFB, DAST, AUDIT | Reducción en consumo de alcohol (todos p<0,001) y en consumo de otras drogas (p<0,01) Mejora en depresión, OCDS, ansiedad y manía (todos p<0,001) | Sujetos motivados (no representatividad) No se mide la adherencia a la medicación |
| Farren y McElroy54 (2008) | N=232 | TB (n=102) TDM (n=124) (SCID) | Alcohol | IDDT-SPD | Evaluación pre-pos (4 sem)+seguimiento (6 meses): YMRS, Beck DI, BAI, OCDS, TLFB, BT | Mejora en depresión, OCDS, ansiedad y manía (todos p<0,001) Descenso en el consumo de alcohol (todos p<0,001) | Consumo de medicación concomitante Ausencia de grupo control |
AUDIT: Alcohol Use Disorder Identification Test; BAI: Beck Anxiety Inventory; Beck DI: Beck Depression Inventory; BIS: Barratt Impulsiveness Scale; BT: Blood Test; CARS-M: Clinician-Administered Rating Scale for Mania; CBT: Cognitive Behavioral Therapy; CGAS: Children's Global Assessment Scale; CSQ-8: Client Satisfaction Questionnaire-8; DAST: Drub Abuse Screening Test; FFT-A: Family-Focused Treatment for Adolescents; HR: Helpfulness Ratings; IDDT-SPD: Integrated Dual Diagnosis Treatment (St. Patrick, Dublin); ISS: Internal States Scale; ITAP: Improving Treatment Adherence Program; K-SADS: Schedule for Affective Disorders and Schizophrenia; K-SADS-PL: Schedule for Affective Disorders and Schizophrenia-Present and Lifetime Version; MDD: trastorno depresión mayor; MI-CBT: Motivational Interviewing-Cognitive Behavioral Therapy; OCDS: Obsessive Compulsive Drinking Scale; QIDS-C: Quick Inventory of Depressive Symptomatology-Clinician Version; SCID: Structured Clinical Interview (DSM-IV); TB: trastorno bipolar; TBI: trastorno bipolar tipo I; trastorno bipolar tipo II; TDM: trastorno depresión mayor; TLFB: timeline follow-back; TM: tamaño muestral; UDS: Urine Drug Screens; YMRS: Young Mania Rating Scale.
Formada de psicoeducación, entrenamiento en comunicación, solución de problemas, prevención de recaídas, implicando a familiares y allegados. Actúa sobre ambos diagnósticos, fomentando adherencia a fármacos (9meses).
Basado en FIRESIDE. Se compone de una primera fase de estabilización y desintoxicación, seguida de otra de psicoeducación, terapia individual interpersonal y de apoyo, sesiones de AA y otros grupos de discusión, y prevención de recaídas (7-8 meses).
La mayor parte de los estudios analizados centran sus resultados en medidas de la sintomatología psiquiátrica y el consumo de sustancias. Entre las pruebas utilizadas para cuantificar estas variables parece haber un gran consenso en el uso del Young Mania Rating Scale55, habiendo gran disparidad en los instrumentos de medida sobre consumo de drogas y depresión y escasa información sobre las garantías de estas pruebas. Sin embargo, se desatienden otra serie de cuestiones, como la adhesión al tratamiento o la percepción de eficacia de los propios participantes y su satisfacción con la intervención, condiciones que resultan de especial importancia, considerando la alta tasa de abandono del tratamiento y la falta de implicación y motivación en la intervención.
DiscusiónEsta revisión pretende mostrar el panorama terapéutico actual en el abordaje de los casos de TB con TUS. Desde el análisis de las garantías metodológicas de los estudios experimentales publicados en la última década, se valora la utilidad de las intervenciones farmacológicas y psicológicas. Así, se ha visto que el valproato34 y la lamotrigina27 pueden ser útiles para frenar el consumo de alcohol y otras drogas, respectivamente. Para aliviar síntomas psiquiátricos y el craving, la quetiapina como fármaco único o principal32,36,38 y la risperidona36 o la olanzapina37 también han ofrecido buenos resultados. Sin embargo, la citicolina ha demostrado abordar estos síntomas además de favorecer una mayor adhesión al tratamiento26, aunque estos resultados no se confirman por otros grupos de trabajo33. En estudios con pacientes con TB de ciclación rápida donde la lamotrigina no ha resultado efectiva27, el tratamiento clásico con litio sí ha demostrado serlo en lo que respecta a la sintomatología psiquiátrica33. Estas investigaciones fundamentan sus conclusiones en la utilización de grupo control y el empleo de pruebas o instrumentos similares para medir las variables dependientes, a pesar de adolecer de muestras en ocasiones escasas y de grandes tasas de abandono.
Se podría decir, a la vista de los resultados estudiados, que la quetiapina es el fármaco más sólidamente ligado a una mejora en la sintomatología psiquiátrica para el TB, y la combinación litio-valproato, la más eficaz para la reducción del consumo de alcohol y las recaídas. Aun así, muchos trabajos resultan contradictorios y utilizan diferentes formas de medir las variables y distintas muestras y medicaciones concomitantes, lo que podría explicar dichas diferencias. Los estudios que carecen de un diseño doble ciego ofrecen resultados prometedores para todos los fármacos, lo cual podría deberse a un menor control de la situación experimental y, por tanto, a una menor validez interna. Por ello, es recomendable verificar dichos resultados con estudios más sólidos metodológicamente antes de afirmar la eficacia de los tratamientos.
Por lo que respecta a las intervenciones psicológicas, además de ser más escasas que las farmacológicas, cabe destacar que se ponen a prueba en estudios más modestos y con mayores limitaciones metodológicas. En muchas ocasiones, carecen de grupo control y cuentan con muestras pequeñas y gran muerte experimental. Comparando diferentes intervenciones, se ha visto que la terapia integrada de grupo community friendly resulta más eficaz que el grupo de asesoramiento sobre drogas, ayudando a reducir el consumo de sustancias, la sintomatología psiquiátrica y dando un mejor resultado clínico general46. No obstante, tanto el grupo de asesoramiento sobre drogas como la terapia integrada de grupo muestran una aparente eficacia en el abordaje del trastorno dual47. El manejo de contingencias también resultó adecuado para atenuar el consumo de alcohol y estimulantes, además de para incrementar la mejoría en síntomas maníacos y depresivos44. Asimismo, la intervención familiar para patología dual resultó más beneficiosa en educación sobre los trastornos, sintomatología psiquiátrica y severidad de consumo que la educación familiar45. Otros estudios sin grupo de comparación también han aportado resultados prometedores, pero al igual que en el caso de los fármacos, son necesarios estudios con mayor rigor metodológico para poder concluir su eficacia.
Prácticamente la totalidad de las intervenciones psicológicas abogan por un acercamiento integrado que actúe sobre ambos diagnósticos. Varios autores44,45 apoyan también estos principios, ya que se entiende que en la práctica clínica resulta más acertado considerar ambos diagnósticos como interrelacionados dada su frecuente aparición conjunta1–3. Sorprende, a la vista de esta aparentemente extendida premisa, que no existan estudios que traten de evaluar la eficacia de tratamientos igualmente integrados, que conjuguen los efectos de la terapia farmacológica y la psicológica para compararlos con los resultantes de un tratamiento único aislado. Parece razonable pensar que, debido a la complejidad de la psicopatología y al presunto consenso por un abordaje integrado, una intervención complementaria que actúe con amplitud sobre todos los aspectos de la problemática podría ser la mejor actuación.
Es destacable también el hecho de que todos estos tratamientos psicológicos forman parte de las terapias llamadas «multicomponente». Esto quiere decir que todas ellas están conformadas de varios componentes activos que, juntos, tratan de abordar todos los aspectos posibles de la intervención. Sin embargo, esto supone una limitación importante, ya que es imposible saber a qué componentes se debe la eficacia mostrada. Esto es un problema recurrente aún no resuelto en el estudio de algunas intervenciones psicológicas, invitando a los investigadores a aislar dichos ingredientes terapéuticos y a comprobar los beneficios que ofrecen o no al resultado final.
Una gran limitación de todos los estudios revisados que puede explicar, en parte, las diferencias en los resultados es la falta de consideración de la fase –depresiva, maníaca o mixta– en la que se encuentran los sujetos en cada momento de la intervención (inicio, durante, final, o en el seguimiento). Se sabe que, dependiendo de la fase en la que el paciente se encuentre, son más adecuados unos fármacos que otros. Kosten y Kosten56 dan las claves de una medicación ideal para estos casos: bajo riesgo, dosis infrecuentes, buena tolerancia y con pocos efectos secundarios. Proponen, así, el valproato o la carbamazepina como fármacos adecuados para la fase maníaca, mientras que para la depresiva consideran más acertado el uso de antidepresivos. Sin embargo, el efecto de estos fármacos no ha sido puesto a prueba en comparación con los tratamientos psicológicos, así como tampoco se ha evaluado suficientemente la mejora que puede suponer el tratamiento combinado con respecto a uno que solo incluya fármacos o terapia psicológica.
La falta de control experimental en muchos casos también constituye una limitación importante que puede distorsionar los resultados, habiendo incluso estudios con una pobre especificación de las variables medidas o de la significación de los datos57, o el empleo de fármacos concomitantes que no se tienen en cuenta a la hora de extraer conclusiones, así como la diferencia en la dosis administrada a cada sujeto en función de la severidad del trastorno. Cabe resaltar aquí también que no es frecuente especificar en estos estudios la severidad de la sintomatología de los pacientes, por lo que incluirlos a todos en la misma investigación puede modificar la fidelidad de los datos aportados. Lo mismo ocurre con las drogas, ya que la mayoría de los sujetos son politoxicómanos y con diferentes niveles de abuso o dependencia, y se obvia el hecho de que las diferentes drogas son consideradas equivalentes al no ser separadas en los análisis de resultados.
Otro gran problema de las investigaciones revisadas, quizá el mayor, es la amplia tasa de abandono, algo presente en la totalidad de los estudios revisados y ya tratado ampliamente como una importante limitación del trastorno dual en general58. Se han descrito incluso predictores del abandono, como la presencia de un episodio maníaco, depresivo o mixto reciente y el pobre nivel educativo59, así como la presencia de trastornos de la personalidad, síntomas psicóticos o el tratamiento con litio60. El diseño de un programa específico que forme e implique al sujeto en el tratamiento podría suponer una mejora cualitativa para favorecer su estabilidad y su apego a este. La creación de una intervención complementaria que beneficie la adhesión al tratamiento principal, como es el caso del programa para la mejora de la adherencia, también podría resultar útil50.
Por tanto, parece de especial interés el desarrollo de nuevas investigaciones que profundicen en la eficacia de diferentes abordajes que traten el trastorno psiquiátrico al mismo tiempo que tratan de promover la abstinencia temprana y la desintoxicación de las drogas de consumo13. En este sentido, será también conveniente la detección previa y la prevención atendiendo a factores de riesgo sociodemográficos, como el sexo masculino, la juventud, el bajo nivel educativo, el diagnóstico previo de trastorno del ánimo o una historia parental de TUS61–63, así como a otros más recientemente planteados: la historia de abuso físico o sexual64.
A modo de conclusión, se pone de relieve la necesidad de implementar el rigor metodológico de las investigaciones a realizar, especificando las variables e instrumentos de medida, utilizando muestras grandes y con grupo control, controlando variables contaminadoras como los tratamientos complementarios o la pobre delimitación de la gravedad de los sujetos, midiendo rigurosamente la adhesión al tratamiento y la potencial influencia de algunos aspectos de la intervención en su abandono, así como la unificación de los criterios y métodos empleados para cuantificar el consumo de drogas o la sintomatología psiquiátrica. Como tratamiento de elección, la quetiapina y el valproato han demostrado superioridad en la mejora de los síntomas psiquiátricos y en la reducción del consumo de alcohol, respectivamente, mientras que las terapias psicológicas grupales con psicoeducación, prevención de recaídas e inclusión de la familia también han resultado beneficiosas a la hora de reducir la sintomatología y favorecer la abstinencia y la adherencia al tratamiento. A pesar de la presencia de estudios que señalan estas pautas de intervención como preferentes, la literatura actual evidencia que no existe un tratamiento bien establecido para el abordaje de esta afección.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.