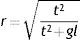Verificar o efeito agudo do exercício aeróbio vigoroso sobre o controle inibitório em adolescentes.
MétodosEstudo controlado e randomizado com delineamento cruzado. Vinte púberes foram submetidos a duas sessões de 30 minutos: 1) sessão exercício aeróbio feito entre 65‐75% da frequência cardíaca de reserva, com cinco minutos para aquecimento, 20 minutos na intensidade alvo e cinco minutos de volta à calma; e 2) sessão controle assistindo a desenho animado. Previamente e após as sessões, o teste de Stroop computadorizado (Testinpacs®) foi aplicado para avaliar o controle inibitório. O tempo de reação (ms) e os erros cometidos (n) foram registrados.
ResultadosO tempo de reação da sessão controle não apresentou diferença significativa. Por outro lado, o tempo de reação da sessão exercício diminuiu após a intervenção (p<0,001). Os erros cometidos na sessão exercício foram menores do que na sessão controle (p=0,011). Adicionalmente, houve associação positiva do tempo de reação (Δ) da sessão exercício com a idade (r2=0,404; p=0,003).
ConclusõesO exercício aeróbio vigoroso parece promover melhoria aguda no controle inibitório em adolescentes. O efeito do exercício sobre o desempenho do controle inibitório foi associado à idade e demonstrou ser reduzido em faixas etárias mais altas.
To assess the acute effect of vigorous aerobic exercise on the inhibitory control in adolescents.
MethodsControlled, randomized study with crossover design. Twenty pubertal individuals underwent two 30‐minute sessions: 1) aerobic exercise session performed between 65%‐75% of heart rate reserve, divided into 5minutes of warm‐up, 20minutes at the target intensity and 5minutes of cool down; and 2) control session watching a cartoon. Before and after the sessions, the computerized Stroop test–Testinpacs™ was applied to evaluate the inhibitory control. Reaction time (ms) and errors (n) were recorded.
ResultsThe control session reaction time showed no significant difference. On the other hand, the reaction time of the exercise session decreased after the intervention (p<0.001). The number of errors made at the exercise session were lower than in the control session (p=0.011). Additionally, there was a positive association between reaction time (Δ) of the exercise session and age (r2=0.404, p=0.003).
ConclusionsVigorous aerobic exercise seems to promote acute improvement in the inhibitory control in adolescents. The effect of exercise on the inhibitory control performance was associated with age, showing that it was reduced at older age ranges.
O controle executivo (ou funções executivas) se refere a processos cognitivos de uma ordem superior que gerenciam o controle de outras funções cognitivas mais básicas e orientam o comportamento ideal para alcançar comportamentos dirigidos a objetivos. De modo geral, o controle executivo é subdivido em controle inibitório (CI), memória de trabalho e flexibilidade cognitiva.1 O CI é considerado o domínio principal do controle executivo e um fator determinante do sucesso escolar, uma vez que controla a atenção, o comportamento, o pensamento e/ou emoção para sobrepor uma forte predisposição interna ou atração externa e adaptar‐se a situações conflituosas.1
Atividades escolares são um modelo de solicitação ambiental referente à autonomia e ao controle das funções atencionais, de organização e de planejamento, o que demanda um desempenho eficiente do CI.2 Evidências apontam que o desenvolvimento das habilidades do CI durante a infância promove uma crescente capacidade para o sucesso no desenvolvimento da teoria da mente – facilita a reflexão e a aprendizagem –,3 bem como um melhor desempenho em tarefas de raciocínio contrafactual4 e estratégico.5 O CI também tem sido fortemente associado ao nível de inteligência6 e desempenho escolar.7
Ambas as regiões frontais, corticais e subcorticais, subservem o controle executivo. O córtex pré‐frontal (CPF) é que desempenha papel‐chave.8 Aumento da atividade cerebral do CPF foi observado durante a feitura de tarefa do CI (teste de Stroop).9 O CPF compreende um quarto a um terço do córtex cerebral e contém ricas conexões recíprocas consigo mesmo, com outras áreas corticais e com regiões subcorticais e límbicas.10 O desempenho do controle executivo se desenvolve desde a primeira infância, ao longo da adolescência, até a idade adulta,11 concomitantemente com as mudanças neuroanatômicas, funcionais12 e de perfusão sanguínea13 do cérebro, incluindo regiões do CPF.
O exercício físico tem sido considerado um importante fator ambiental para o neurodesenvolvimento,14 para a promoção da saúde cognitiva e cerebral,15 bem como para um melhor desempenho do controle executivo e escolar.7 Apenas uma única sessão de exercício aeróbio tem demonstrado aprimorar a eficiência do CI em crianças16 e adultos jovens,17‐19 ao contrário do que foi observado em adolescentes logo após 20 minutos de exercício aeróbio feito no cicloergômetro a 60% da frequência cardíaca máxima (FCmáx).20 O desempenho cognitivo pós‐exercício agudo parece ser dependente da intensidade.21 Na metanálise de Chang et al.,21 os estudos que usaram baixa intensidade, <50% da FCmáx, apresentaram um efeito negativo sobre o desempenho cognitivo. Por outro lado, em estudos com intensidades >64% da FCmáx, os efeitos foram positivos.
Uma possível hipótese fisiológica que pode explicar o efeito agudo da intensidade do exercício sobre o CI se deve ao aumento do fluxo sanguíneo cerebral gerado pelo esforço do exercício, o que pode reverberar sobre o desempenho cognitivo pós‐exercício.17‐19 No estudo de Yanagisawa et al.,19 houve um aumento do fluxo sanguíneo cerebral (↑ hemoglobina oxigenada) no CPF e melhoria do desempenho no teste de Stroop em adultos jovens após 10 minutos de exercício aeróbio a 50% do consumo de oxigênio pico (VO2pico). O mesmo efeito foi observado em experimentos semelhantes conduzidos com adultos jovens após 20 minutos de exercício entre 60‐70% da FCmáx18 e após 15 minutos de exercício a 40% da carga máxima, respectivamente,17 e em crianças após 20 minutos de exercício aeróbio entre 65‐75% da FCmáx.16
Entretanto, ainda existe uma lacuna do conhecimento se uma sessão de exercício aeróbio vigoroso pode aprimorar o CI em adolescentes, o que pode ser importante, na medida em que têm o CPF em maturação. É um período de mudanças estruturais, funcionais12 e de perfusão sanguínea.13 A hipótese do estudo é que a adoção de uma prescrição do exercício aeróbio com controle da intensidade, volume e outros fatores de confusão associados ao aprimoramento cognitivo pelo exercício agudo possa favorecer os mecanismos fisiológicos cerebrais induzidos pelo exercício e reverberar sobre o desempenho do CI pós‐exercício, conforme evidenciado em crianças16 e adultos jovens.17‐19 Portanto, o objetivo do presente estudo foi investigar o efeito agudo do exercício aeróbio vigoroso sobre o CI em adolescentes. A intensidade e o volume do exercício foram prescritos conforme as recomendações de exercícios vigorosos para adolescentes da Organização Mundial de Saúde22 e de acordo com o melhor efeito obtido pela metanálise de Chang et al.21 Outros fatores de controle, como o horário do exercício e o intervalo do tempo para a aplicação do teste cognitivo pós‐exercício, foram igualmente ancorados pela metanálise de Chang et al.21
MétodoEstudo controlado e randomizado com delineamento cruzado, conduzido em ambiente praiano do município de Icapuí (CE). O efeito agudo do protocolo de prescrição do exercício foi testado por duas sessões, com intervalo mínimo de 48horas, a saber: (1) sessão de exercício aeróbio vigoroso; e (2) sessão controle assistindo a desenho animado próprio para a idade. Metade dos participantes, aleatoriamente, recebeu primeiro o tratamento experimental e depois o de controle, enquanto a outra metade recebeu primeiro o controle e depois o experimental. Por fim, a avaliação do desempenho do CI foi feita previamente e após as sessões.
O tamanho amostral foi calculado com o poder estatístico (1‐β) a priori, com a análise de variância adotada no desfecho principal do estudo (Split Plot Anova), com um effect size de f=0,333 (considerado médio) e um alfa de 0,05. O poder estatístico conferido à presente amostra, independentemente do sexo, foi de 80% (G*Power®, versão 3.1.9.2; Institute for Experimental Psychology in Dusseldorf, Alemanha).
Vinte adolescentes (tabela 1) de ambos os sexos e fisicamente ativos, entre 10 e 16 anos, foram recrutados aleatoriamente nas escolas públicas de ensino fundamental do município de Icapuí. Cartazes sobre a pesquisa foram fixados nos murais informativos das escolas para recrutar os voluntários e uma palestra foi feita em dia e local pré‐determinado para os interessados. Os critérios de inclusão foram: i) disponibilidade de comparecer à avaliação inicial e às sessões controle e exercício no período matutino; ii) ser fisicamente ativo, ou seja, estar matriculado e assíduo (≥1 ano e ≥2×/semana, respectivamente) em programas esportivos extracurriculares que ocorrem nas próprias escolas no contraturno; iii) cumprir os critérios do questionário de prontidão para a atividade física (PAR‐Q); iv) classificado como “púbere” (estágios de 2 a 4 do critério de Tanner);23 e v) não apresentar deficiência física ou intelectual e/ou contraindicações clínicas, neuromotoras, psicológicas e/ou cognitivas.
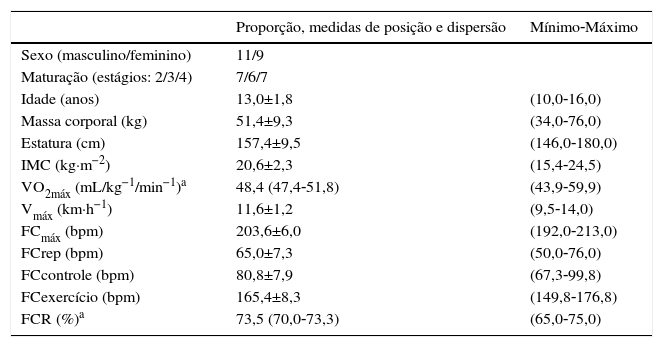
Caracterização da amostra de adolescentes (n=20). Dados expressos em média e desvio padrão para as variáveis paramétricas, mediana e intervalo de confiança de 95% para não paramétricas e amplitude de variação (mínimo‐máximo)
| Proporção, medidas de posição e dispersão | Mínimo‐Máximo | |
|---|---|---|
| Sexo (masculino/feminino) | 11/9 | |
| Maturação (estágios: 2/3/4) | 7/6/7 | |
| Idade (anos) | 13,0±1,8 | (10,0‐16,0) |
| Massa corporal (kg) | 51,4±9,3 | (34,0‐76,0) |
| Estatura (cm) | 157,4±9,5 | (146,0‐180,0) |
| IMC (kg·m−2) | 20,6±2,3 | (15,4‐24,5) |
| VO2máx (mL/kg−1/min−1)a | 48,4 (47,4‐51,8) | (43,9‐59,9) |
| Vmáx (km·h−1) | 11,6±1,2 | (9,5‐14,0) |
| FCmáx (bpm) | 203,6±6,0 | (192,0‐213,0) |
| FCrep (bpm) | 65,0±7,3 | (50,0‐76,0) |
| FCcontrole (bpm) | 80,8±7,9 | (67,3‐99,8) |
| FCexercício (bpm) | 165,4±8,3 | (149,8‐176,8) |
| FCR (%)a | 73,5 (70,0‐73,3) | (65,0‐75,0) |
FCcontrole, frequência cardíaca média da sessão controle; FCexercício, frequência cardíaca média da sessão exercício; FCmáx, frequência cardíaca máxima; FCR, percentual da frequência cardíaca de reserva da sessão exercício; FCrep, frequência cardíaca de repouso; IMC, índice de massa corporal; Vmáx, velocidade máxima; VO2máx, consumo máximo de oxigênio.
O projeto de pesquisa foi aprovado pelo Comitê de Ética em Pesquisa da Universidade Federal do Rio Grande do Norte (protocolo n° 876.286/2014 CEP/UFRN), em consonância com a Declaração de Helsinque e a Resolução n° 466/2012 do Conselho Nacional de Saúde. Todos os adolescentes selecionados apresentaram o termo de consentimento livre e esclarecido, termo de assentimento, PAR‐Q e questionário histórico‐médico preenchidos e devidamente assinados.
A massa corporal e a estatura foram mensuradas por uma balança mecânica (G‐Tech®) e um estadiômetro fixo na parede (Sanny®), respectivamente. O índice de massa corporal (IMC) foi calculado pela fórmula: [IMC = massa corporal(kg)×estatura(m)−2].24
A maturação sexual foi avaliada pelas pranchas de Tanner23 para distinguir a pré‐puberdade da puberdade como critério de inclusão no estudo.25 As pranchas consistem em imagens com legendas que caracterizam a genitália e a pilosidade no caso dos rapazes e as mamas e a pilosidade no caso das moças. Foram explicados o método e sua finalidade individualmente e, por meio de autoavaliação, o adolescente assinalou em uma ficha privativa com qual das imagens sua condição mais se assemelhava. O estágio puberal foi classificado em uma escala entre 1 e 5, a saber: 1=pré‐púbere; 2‐4=púbere; e 5=pós‐púbere.
O teste de corrida progressivo de esforço máximo26 foi aplicado para obtenção da FCmáx. Esse teste foi conduzido em quadra poliesportiva coberta (entre 7‐10h) e consiste de corridas em vaivém em uma distância de 20 metros. A velocidade foi controlada pelo áudio de um metrônomo. A velocidade inicial foi de 8,5 km/h, seguida de incrementos de 0,5 km/h a cada estágio de um minuto. A frequência cardíaca (FC) foi monitorada durante todo o teste por um cardiofrequencímetro (Beurer®, Alemanha). A FCmáx foi considerada como a maior FC atingida durante o teste, válida apenas quando observados sinais de esforço intenso.27 Os participantes foram encorajados verbalmente a se manter pelo maior tempo possível. O teste foi mantido até a exaustão voluntária. A velocidade máxima (Vmáx) foi usada para estimar o consumo máximo de oxigênio (VO2máx) pela equação de Léger et al.28
A FC de repouso (FCrep) foi verificada com o avaliado na posição supino em repouso por cinco minutos. Foi considerada a menor FC obtida. A FC de reserva (FCR) foi a diferença entre a FCmáx e a FCrep (FCR=FCmáx‐FCrep). Para determinar as FCs‐alvo para a prescrição do exercício, usou‐se o percentual da FCR. O percentual da FCR foi somado à FCrep para determinar a FC‐alvo em exercício: FC‐alvo=(% intensidade (em decimal)×FCR)+FCrep.24
Em dia distinto à sessão exercício, os avaliados foram familiarizados com a intensidade do exercício e como permanecer na FC‐alvo. Na sessão exercício, foi feito um aquecimento de cinco minutos com caminhada, seguido de 20 minutos de corrida em intensidade vigorosa (65‐75%da FCR) e cinco minutos de volta à calma, totalizando 30 minutos. A FC foi controlada durante toda a sessão por um cardiofrequencímetro (Beurer®, Alemanha), a fim de que o participante permanecesse na FC‐alvo. Além do controle individual do próprio participante, conforme orientações durante a familiarização, a FC foi monitorada e registrada a cada três minutos. Se necessário, orientações verbais eram fornecidas para ajuste da intensidade. O exercício foi feito na areia da praia (areia úmida, maré baixa e terreno plano), com os avaliados descalços. As sessões foram feitas entre 7‐10h com uma temperatura e umidade do ar entre 26°‐30°C e 52%‐74%, respectivamente.
Durante a sessão‐controle, os avaliados permaneceram sentados por 30 minutos no laboratório de informática da escola assistindo a desenho animado próprio para a idade (Kung Fu Panda). A FC foi monitorada e registrada a cada três minutos por um cardiofrequencímetro (Beurer®, Alemanha).
O desempenho do CI foi avaliado pelo teste de Stroop computadorizado (Testinpacs®), com auxílio de um desktop e monitor de 14 polegadas.29 Rememoramento foi feito previamente a cada sessão. O teste foi aplicado antes e após 10 minutos de cada sessão. O instrumento tem três etapas, as duas primeiras congruentes e a última incongruente. Os dedos indicador e médio da mão direita permaneceram sobre as teclas das setas da esquerda (←) e da direita (→), respectivamente, que foram acionadas conforme cada estímulo. Na etapa 1, retângulos nas cores verde, azul, preto e vermelho foram apresentados, individualmente, no centro do monitor. Nos cantos inferiores do monitor, respostas em correspondência ou não com a cor do retângulo foram exibidas até que o participante respondesse à tentativa pressionando as teclas ← ou →. Na etapa 2, tanto os estímulos quanto as respostas foram exibidos na condição de palavras, sempre em cor branca. Computava‐se como acerto quando o estímulo e a resposta coincidiam. Por último, na etapa 3, a palavra de uma das quatro cores era exibida em cor incompatível. O avaliado foi instruído a pressionar a tecla correspondente à cor da palavra e inibir a resposta para a identidade da palavra. Em todas as etapas os estímulos foram apresentados de forma automática e aleatória, 12 tentativas por etapa. O tempo de reação (TR) em milissegundos (ms) e a quantidade de erros (n) cometidos em cada etapa foram registrados.
Os procedimentos estatísticos foram feitos com auxílio do SPSS for Win/v.19.0 (Statistical Package for Social Sciences, Chicago, IL, USA) e G*Power versão 3.1.9.2 (Institute for Experimental Psychology in Dusseldorf, Alemanha). A normalidade e a homogeneidade das variâncias dos dados foram testadas pelos testes de Shapiro‐Wilk e Levene, respectivamente. As variáveis paramétricas foram apresentadas em média e desvio padrão ou erro padrão e as não paramétricas em média ou mediana e seus respectivos intervalos de confiança de 95%. O nível de significância foi fixado em p<0,05.
A confiabilidade do teste de Stroop (TR) entre os valores basais (pré×pré) foi verificada pelo coeficiente alfa de Cronbach (α). O teste t para amostras independentes foi aplicado para comparar o TR basal entre as condições (pré×pré). Split‐Plot Anova, ajustada pela idade cronológica, foi aplicada na comparação intra e entre condições (2×2) do TR. A hipótese de esfericidade foi verificada pelo teste de Mauchly e, quando violada, os graus de liberdade foram corrigidos pelas estimativas de Greenhouse‐Geisser. O tamanho do efeito das variâncias foi calculado pelo eta quadrado (η2). O teste t pareado foi aplicado para cada grupo separadamente, a fim de se localizarem as diferenças observadas na Split‐Plot. O tamanho do efeito foi calculado pela equação:
ANCOVA não paramétrica de Quade com ajuste pela idade cronológica foi aplicada para comparar os deltas (Δ=pré‐pós) da quantidade de erros cometidos entre as condições (controle×exercício). Após análise da normalidade e homogeneidade das variâncias dos resíduos, a regressão linear simples (r2) e o coeficiente de correlação de Pearson (r) foram aplicados para associar o delta do TR (Δ=pré‐pós) da etapa 3 incongruente com a idade cronológica.
ResultadosEntre os adolescentes selecionados para o estudo, foi verificado que 65% eram repetentes na fase escolar. Na tabela 1 estão apresentadas as variáveis de caracterização da amostra, maturação sexual, medidas antropométricas, variáveis estimadas e obtidas pelo teste de corrida progressivo de esforço máximo (VO2máx, Vmáx e FCmáx) e média da FC das sessões controle e exercício. Além disso, foi apresentada a média do %FCR em que os adolescentes permaneceram durante a sessão exercício.
O TR das etapas 1, 2 e 3 do teste de Stroop entre os valores basais (pré×pré) apresentaram confiabilidade de α=0,502; α=0,493; α=0,752; respectivamente. Não houve diferença entre os valores basais do TR (pré×pré) na etapa 1 (t[38]=‐0,567; p=0,574), na etapa 2 (t [38]=‐0,740; p=0,464) e na etapa 3 (t[38]=‐0,665; p=0,510).
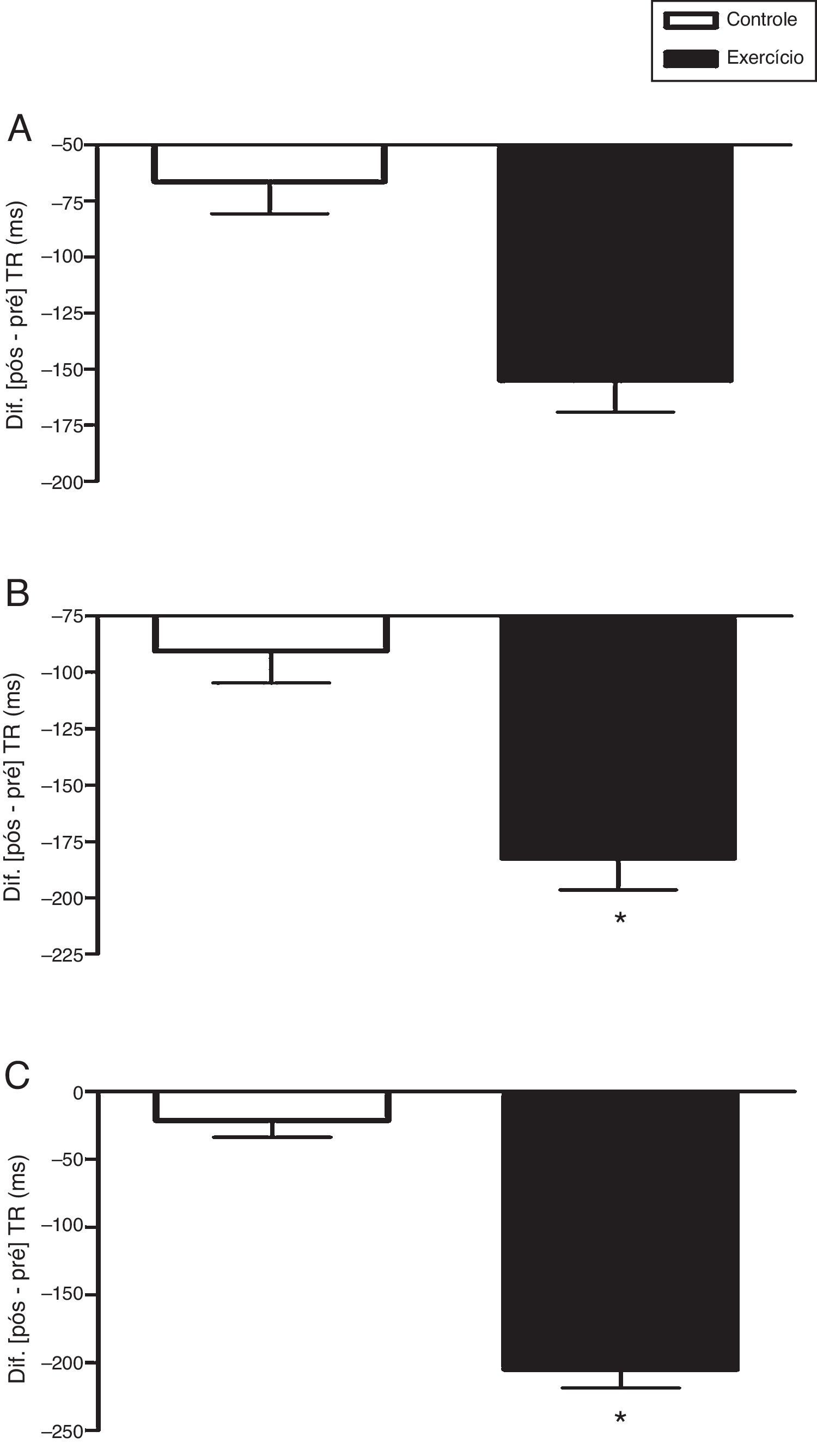
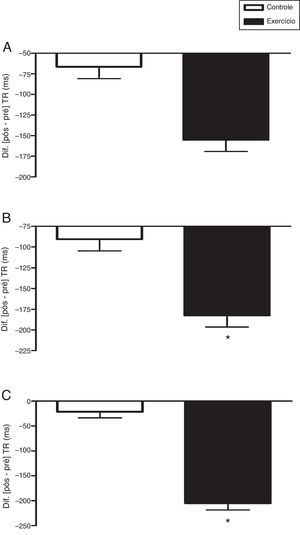
Na etapa 1 congruente do teste de Stroop, a interação tempo×condições, ajustada pela idade, não diferiu estatisticamente, F(1, 37)=1,98; p=0,168; η2=0,051. Não houve diferença entre as condições, F(1, 37)=0,00; p=0,982; η2=0,000. Também não houve um efeito significativo no tempo, F(1, 37)=2,79; p=0,103; η2=0,070 (fig. 1A).
Efeito agudo do exercício aeróbio vigoroso sobre o tempo de reação (TR) nas etapas 1 (A), 2 (B) e 3 (C) do teste de Stroop computadorizado (Testinpacs®). Split Plot Anova ajustado pela idade cronológica aplicada na comparação intra e entre condições (2×2). Os dados do delta (Δ=pós‐pré) são apresentados em média e erro padrão. *p<0,001; pré×pós.
A segunda etapa congruente, etapa 2, não mostrou diferença estatística na interação tempo×condições, ajustada pela idade, F(1, 37)=2,28; p=0,139; η2=0,058. Não houve diferença entre as condições, F(1, 37)=0,00; p=0,955; η2=0,000. Houve um efeito significante no tempo, F(1, 37)=4,66; p=0,037; η2=0,112. Por meio do teste t pareado (pré×pós) verificou‐se que a condição controle não diferiu, t(19)=2,05; p=0,055; r=0,43; mas a condição exercício diferiu de modo significativo, t(19)=4,20; p<0,001; r=0,69 (fig. 1B).
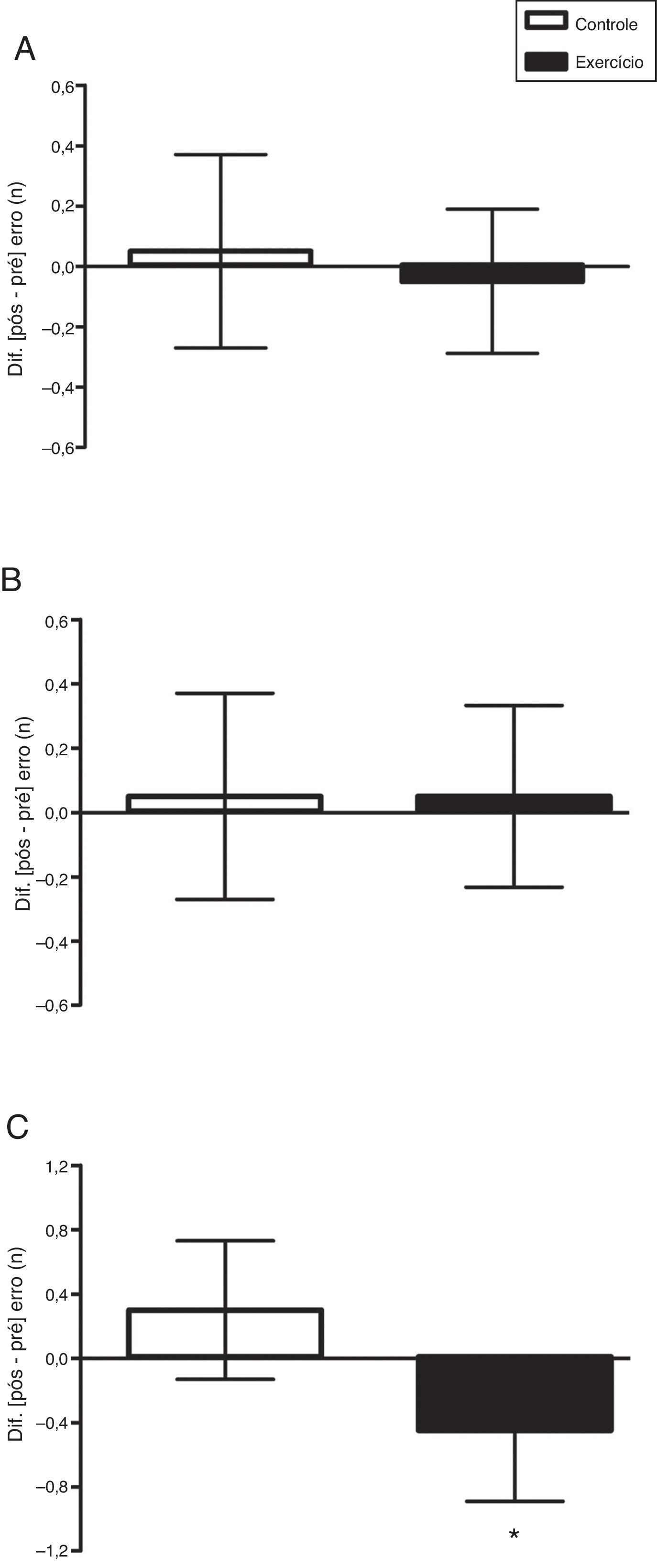
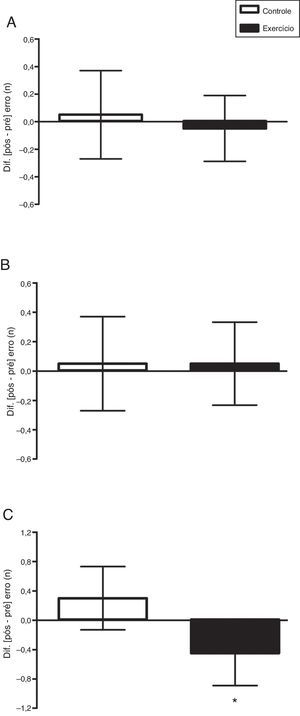
Já na fase incongruente, etapa 3, houve uma interação tempo × condições estatisticamente significativa, ajustada pela idade, F(1, 37)=12,49; p=0,001; η2=0,252. Não houve diferença entre as condições, F(1, 37)=0,134; p=0,716; η2=0,004. Houve um efeito significativo no tempo, F(1, 37)=5,64; p=0,023; η2=0,132. Por meio do teste t pareado (pré×pós) verificou‐se que a condição controle não diferiu, t(19)=0,64; p=0,532; r=0,15; mas a condição exercício diferiu de modo significativo, t(19)=4,94; p<0,001; r=0,75 (fig. 1C). Os erros cometidos, ajustados pela idade, não diferiram entre as condições controle×exercício na etapa 1 [F(1, 38)=0,105; p=0,748 (fig. 2A)] e na etapa 2 [F(1, 38)=0,045; p=0,834 (fig. 2B)], mas na etapa 3 houve diferença significativa [F(1, 38)=7,162; p=0,011 (fig. 2C)].
Efeito agudo do exercício aeróbio vigoroso sobre os erros cometidos nas etapas 1 (A), 2 (B) e 3 (C) do teste de Stroop computadorizado (Testinpacs®). ANCOVA não paramétrica ajustada pela idade cronológica aplicada na comparação entre as condições. Os dados do delta (Δ=pós‐pré) são apresentados em média e intervalo de confiança de 95%. *p=0,011; controle×exercício.
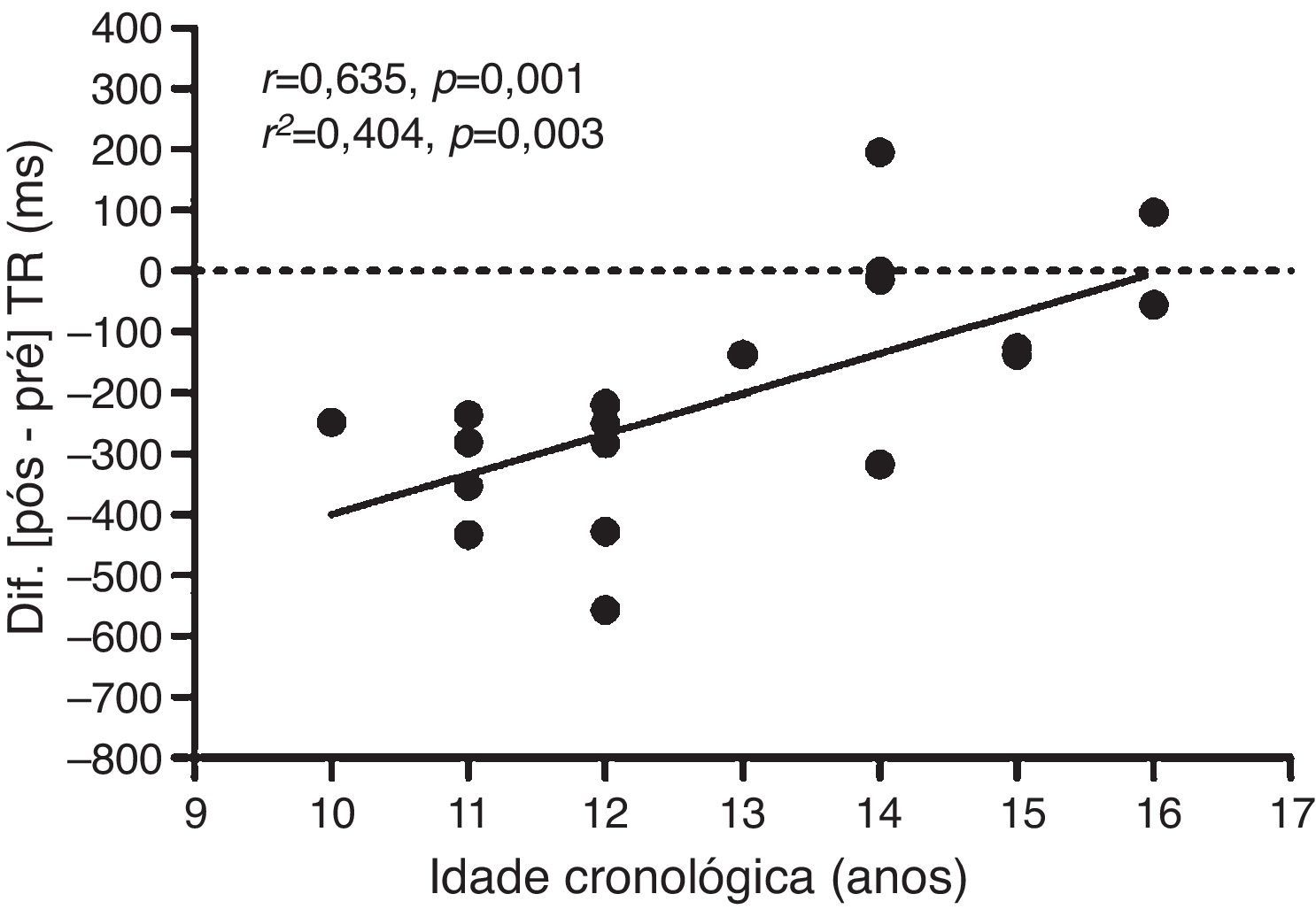
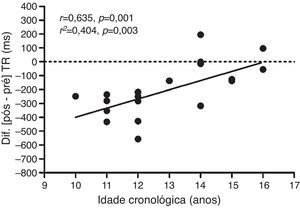
Como análise secundária, foi verificada associação positiva (p=0,003) do ΔTR da etapa 3 incongruente da condição exercício com a idade cronológica (fig. 3). Por outro lado, não houve associação do ΔTR da etapa 3da condição controle com a idade cronológica (r2=0,021; p=0,545). O cálculo amostral a posteriori da análise de associação foi conduzido com um alfa de 0,05, tamanho amostral de 20 sujeitos e um coeficiente de correlação de 0,635. O poder estatístico conferido na análise foi de 88%.
Regressão linear (r2) e coeficiente de correlação de Pearson (r) entre o delta (Δ=pós–pré) do tempo de reação (TR) da etapa 3 incongruente do teste de Stroop da sessão exercício com a idade cronológica.
O presente estudo investigou o efeito agudo do exercício aeróbio vigoroso sobre o CI em adolescentes. Os principais achados sugerem que o exercício aeróbio vigoroso, agudamente, aprimora o desempenho do CI, visto que houve uma melhoria sobre a interferência Stroop (inibiçãoda resposta) observada pela diminuição no TR da fase incongruente (fig. 1C), com um efeito focal considerado grande (r=0,75), acompanhado por menores erros cometidos (fig. 2C). Esses resultados podem ser de grande importância para elucidar a influência do exercício sobre a eficiência do CI e, por conseguinte, contribuir para o processo de aprendizagem em ambiente escolar.2
A influência que o exercício promoveu no desempenho do CI está de acordo com as evidências de estudos conduzidos com crianças16 e adultos jovens saudáveis.17‐19 Como a intensidade do exercício é um fator importante para potencializar o desempenho cognitivo pós‐exercício,21 adotou‐se, no presente estudo, um protocolo de exercício em intensidade vigorosa, que, além de ser indicada pela Organização Mundial de Saúde para adolescentes,22 seria adequada para induzir os mecanismos fisiológicos responsáveis a favorecer o desempenho cognitivo.21 Por exemplo, em uma metanálise, a intensidade do exercício teve uma influência significativa tal que o exercício prescrito<50% da FCmáx resultou em um efeito negativo significativo (d=−0,113) sobre o desempenho cognitivo, mas quando prescrito em 64‐76% ou 77‐93% da FCmáx os resultados foram positivos, com um efeito de 0,202 e 0,268 respectivamente.21
Além da intensidade do exercício, outros fatores controlados podem ter sido igualmente importantes para que o exercício pudesse favorecer os benefícios cognitivos, entre eles o volume e o horário do exercício, assim como o intervalo de tempo para a aplicação do teste cognitivo pós‐exercício. Nesse sentido, o volume de exercício também foi ajustado conforme as recomendações da Organização Mundial de Saúde22 sobre o volume de exercícios vigorosos para adolescentes e conforme outros estudos que evidenciaram benefícios cognitivos após 20 minutos de exercício aeróbio em crianças16 e adultos jovens.18
O intervalo de tempo para aplicação do teste cognitivo foi definido entre 10 e 20 min pós‐exercício, conforme o melhor tamanho do efeito obtido pela metanálise de Chang et al.,21 na qual esse fator de controle foi considerado um moderador primário dos benefícios cognitivos. Por exemplo, Chang et al.21 categorizaram o tempo para aplicação dos testes cognitivos em 0‐10 min; 11‐20 min ou >20 min após o exercício e obtiveram um tamanho de efeito de ‐0,060, 0,262 e 0,171, respectivamente. Ou seja, o tempo de aplicação pós‐exercício influenciou significativamente no tamanho do efeito. Os efeitos positivos foram observados somente a partir de 11 minutos pós‐exercício.
Os achados estatísticos da metanálise de Chang et al.21 sobre o intervalo de tempo para a aplicação de testes cognitivos pós‐exercício tem coerência com o modelo da hipofrontalidade de ativação reticular proposto por Dietrich e Audiffren,30 em que é sugerida uma diminuição da ativação cerebral em regiões não associadas diretamente com o exercício físico (i.e., CPF) para o suprimento de regiões diretamente associadas. Corroborando esse entendimento, no estudo de Wang et al.31 foi observado um declínio no desempenho do CI durante o exercício aeróbio vigoroso, o que poderia reverberar na eficiência do CI imediatamente após o exercício. Assim, esses estudos e esse modelo teórico concordam com a necessidade de um lapso temporal entre o fim do exercício físico e o início de uma tarefa cognitiva para que ocorra uma homeostasia em nível cerebral, mais especificamente no CPF.
Nossos dados demonstram que o exercício aeróbio parece ter sido uma ferramenta capaz de influenciar agudamente os mecanismos fisiológicos responsáveis a favorecer o desempenho do CI. Os mecanismos ainda são um tanto controversos e pouco explorados, porém a principal hipótese fisiológica que pode explicar esses efeitos se refere ao aumento do fluxo sanguíneo cerebral, o que poderia reverberar sobre o desempenho cognitivo pós‐exercício.17‐19 Por exemplo, Yanagisawa et al.,19 com o uso da espectroscopia de infravermelho próximo (NIRS), avaliaram a ativação cortical durante o teste de Stroop feito antes e após 10 minutos de exercício aeróbio a 50% do VO2pico em 20 adultos jovens. De fato, houve aumento do fluxo sanguíneo do CPF lateral em ambos os hemisférios (↑ hemoglobina oxigenada) devido à interferência Stroop (incongruência). Em contrapartida, essa ativação foi significativamente aumentada no CPF dorsolateral esquerdo e coincidiu com a melhoria do desempenho na tarefa cognitiva (↓TR).
Como análise secundária, evidenciou‐se associação do ΔTR da fase incongruente (etapa 3) da condição exercício com a idade cronológica (r2=0,404) (fig. 3). Ou seja, o aprimoramento do CI pós‐exercício foi reduzido em maiores faixas etárias. A análise de regressão demonstra que 40,4% da variabilidade encontrada no desempenho do CI pós‐exercício pode ser explicada pela idade cronológica. Nesse sentido, devido às evidências de que um dos mecanismos fisiológicos responsáveis pelo aprimoramento do CI pós‐exercício pode ser o aumento do fluxo sanguíneo cerebral,17‐19 a variabilidade no Δ pode estar relacionada à maturação do mecanismo de perfusão cerebral durante a adolescência.13 Notadamente, Satterthwaite et al.13 observaram um grande impacto da puberdade sobre o desenvolvimento da perfusão cerebral. Os autores avaliaram o fluxo sanguíneo cerebral de 922 jovens entre oito e 22 anos e observaram que, ao longo da adolescência, o fluxo cerebral em todo o córtex diminui consideravelmente, inclusive no CPF. O fluxo cerebral da massa cinzenta média sofreu um declínio acentuado no fim da infância e início da adolescência até cerca dos 16‐18 anos, seguido por um ligeiro aumento durante o início da fase adulta.
Apesar de original, o presente estudo apresenta limitações, uma delas não ter avaliado o desempenho do CI combinado com uma técnica de neuroimagem, o que poderia promover maior suporte na confirmação das evidências. Apesar disso, diversos estudos já confirmaram que o exercício aeróbio, de forma aguda, pode aprimorar o CI em nível macroneural, visto promover impacto significativo sobre a atividade cerebral do CPF durante a feitura de tarefa do CI após 10‐20 minutos de exercício aeróbio em crianças16 e adultos jovens.17,18
O uso do procedimento de autoavaliação da maturação sexual para distinguir a pré‐puberdade da puberdade como critério de inclusão também é considerado um fator limitante. A avaliação por inspeção visual por avaliador treinado é o método indireto mais confiável.25 Contudo, pode‐se justificar que a amostra foi composta, em sua maioria, por adolescentes na fase da puberdade.25 No estudo de Rasmussen et al.,25 conduzido com 898 crianças e adolescentes, a autoavaliação da maturação sexual demonstrou ser uma técnica suficientemente precisa para uma simples distinção entre pré‐puberdade e puberdade. O estágio mamário foi avaliado corretamente por 44,9% das moças (κ=0,28; r=0,74; p<0,001) e o genital por 54,7% dos rapazes (κ=0,33; r=0,61; p<0,001). Já a pilosidade pubiana foi de 66,8% pelas moças (κ=0,55; r=0,80; p<0,001) e 66,1% pelos rapazes (κ=0,46; r=0,70; p<0,001).
Vale ressaltar que o presente estudo é pioneiro na investigação dos efeitos agudos do exercício aeróbio vigoroso sobre o CI em adolescentes e contribui para elucidar os efeitos do exercício aeróbio para essa população, que tem o desempenho do controle executivo11 e funções, estruturas12 e perfusão cerebral13 em maturação. Além disso, o estudo teve a premissa de controlar as variáveis possíveis, como a quantidade homogênea de adolescentes de ambos os sexos, a obtenção da FCmáx por um teste de corrida progressivo de esforço máximo, a intensidade e o volume do exercício da condição experimental, o horário dos exercícios físicos, a adoção de um teste cognitivo computadorizado, que registra o desempenho em milissegundos, e o tempo para aplicação do teste cognitivo pós‐exercício. Diante disso, o estudo pode fornecer subsídios para a aplicabilidade desse protocolo de exercício aeróbio no contexto escolar.32
Em conclusão, uma sessão de exercício aeróbio vigoroso feito por 20 minutos parece promover melhoria na capacidade do CI em adolescentes. Adicionalmente, o efeito do exercício sobre o desempenho do CI foi associado à idade cronológica. Isso evidencia que os benefícios do exercício foram reduzidos em faixas etárias mais elevadas. Como implicações práticas, os achados deste estudo contribuem para justificar a inclusão das aulas de educação física no turno escolar, ou seja, entre as outras disciplinas curriculares (i.e., português e matemática). Assim como para a inclusão de um recreio/intervalo fisicamente ativo, uma vez que 20 minutos de exercício aeróbio vigoroso podem favorecer a eficiência do CI e, por conseguinte, contribuir para a melhoria da aprendizagem logo após 10 minutos de recuperação pós‐exercício.
FinanciamentoBolsa de estudo em nível de mestrado acadêmico concedida pelo Programa de Demanda Social (DS) da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes) ao primeiro autor (R.A.V. Browne).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Ao Prof.¿ Antônio José da Costa, que proporcionou anuência e acolhimento para que a pesquisa fosse feita in loco na instituição educacional que coordena, a Escola de Ensino Fundamental Prof.ª Joana Marques Bezerra, do município de Icapuí (CE).