Introducción
La enfermedad pulmonar obstructiva crónica (EPOC) es la cuarta causa de muerte en el mundo1 y son conocidos sus importantes compromisos sistémicos, entre los que se incluye la debilidad muscular2. Esto constituye un problema mayor ya que contribuye a la intolerancia al ejercicio, influye en la calidad de vida y supone un factor predictor de mortalidad3. Esta debilidad afecta con primacía a los músculos esqueléticos periféricos con preferencia por los de las extremidades inferiores. La alteración muscular se aprecia incluso en estadios iniciales asintomáticos con actividad física normal4 y es independiente de las variables de función pulmonar y datos antropométricos5,6.
Las pérdidas de fuerza y potencia muscular en la EPOC han sido atribuidas a múltiples factores, mecánicos, inflamatorios, de estrés oxidativo, alteraciones nutricionales, hipoxia e hipercapnia, determinados fármacos y a factores endocrinos7 que conducen a una alteración del equilibrio síntesis/catabolismo proteico en el músculo por predominio de este último8.
La EPOC afecta a un número de población cada vez mayor, de ahí la importancia de desarrollar estrategias para la detección precoz del deterioro de la función muscular y su prevención y de encontrar un marcador susceptible de aplicación en la clínica diaria.
El body wass index (B), the degree of airflow obstruction (O), dyspnea (D), exercise capacity (E) o índice BODE9 utilizado como evaluador pronóstico incluye, como elementos de medida que pueden estar en relación con la función muscular, los metros recorridos en la prueba de la marcha de los seis minutos y la medida del índice de masa corporal (IMC). La prueba de la marcha de los seis minutos puede estar vinculada no solo a la insuficiencia en la eficiencia muscular sino a otros trastornos, como la insuficiencia respiratoria o cardiaca tantas veces presentes en la EPOC. El IMC es un valor fraudulento en cuanto a la realidad de la masa magra ya que es susceptible de ocultar franco déficit de ésta sin apartarse de los rangos de normalidad3,4. Por tanto, estas pruebas constituyen aproximaciones excesivamente burdas y tardías en orden a detectar la afectación temprana de la función muscular en la EPOC.
Para ello se propone la utilización de la medida de 5-ribosil uracilo o pseudouridina, un metabolito urinario estable del RNA, que ha sido utilizado como un índice de la destrucción de proteínas musculares10.
La pseudouridina es un producto final del catabolismo de tRNA, no se ve afectada por la dieta, no se reutiliza ni se degrada posteriormente, por lo que es idóneo para ser utilizado como marcador en procesos que pueden afectar al catabolismo muscular, y su medida está contrastada por su utilización en otras enfermedades que cursan con elevada inflamación sistémica11
Se puede medir la pseudouridina en muestras de orina, recogidas al azar, siempre que la pseudouridina se estandarice con la concentración de creatinina (μmol/mmol de creatinina) para evitar efectos de dilución, y por lo tanto la posibilidad de ser capaces de detectar en una sola muestra de orina el índice pseudouridina/creatinina (Psu/Crea) mediante cromatografía líquida nos puede permitir evaluar el comportamiento del catabolismo muscular en la población con EPOC de una manera sencilla y económica, con una sola muestra de orina de 5 ml.
Pretendemos analizar la cantidad de pseudouridina excretada en orina, como marcador de la situación del catabolismo muscular en una población con EPOC y analizar la posible influencia en dicho índice de la edad y el sexo.
Material y método
Este trabajo es un análisis prospectivo y aleatorio de un estudio de dos poblaciones reclutadas en distintas fuentes. Los sujetos controles fueron personas sanas provenientes de un centro de reconocimiento laboral, seleccionadas de forma aleatoria, que fueron sometidas a un exhaustivo estudio clínico y analítico para descartar comorbilidades. Se exigió la normalidad dentro de los parámetros analíticos referidos más adelante así como en el resultado de los estudios espirométricos, electrocardiográficos y electromiográficos.
La población enferma procede de una consulta ambulatoria de neumología y está compuesta de personas con diagnóstico de EPOC según los criterios establecidos por la Global Initiative for Chronic Pulmonary Disease12. La edad en los dos grupos estaba comprendida entre los 31 y los 88 años. A todos ellos se les practicó estudio clínico y analítico. Se aplicaron los siguientes criterios:
1. Criterios de inclusión: para el grupo control, no padecer enfermedad.
2. Criterios de exclusión para el grupo control, ser fumador o exfumador, padecer alguna enfermedad orgánica, psicológica, dental, tomar fármacos o presentar cualquier alteración analítica fuera de los rangos admitidos como normales.
Se consideraron valores normales:
presión arterial inferior a 140/90 mmHg en condiciones basales.
El IMC debía estar comprendido entre 20 y 25 kg/m2.
Valores hemáticos y bioquímicos comprendidos entre los siguientes rangos: leucocitos: (4-10,8)103/μl, hematíes: (3,6-5,4)106/μl, hemoglobina: 11,5-16 g/dl, volumen corpuscular medio: 80-99 fl, glucosa: 76-110 mg/ dl, acido úrico: 2,3-8 mg/dl, urea: 17-60 mg/dl, creatinina: 0,5-1,4 mg/dl, triglicéridos: 50-180 mg/dl, colesterol: 110-220) mg/dl, HDL: 35-60 mg/dl, AST: 5-45, U/l, ALT: 5-43 U/l, GGT: 6-69 U/l.
1. Los criterios de inclusión para el grupo de pacientes diagnosticados de EPOC fueron: estar en situación estable, por lo menos los seis meses anteriores, en cualquiera de los estadios de la clasificación GOLD12; no estar sometidos a tratamiento permanente con corticoides orales ni padecer ninguna otra enfermedad activa miopática o de carácter caqueptizante.
2. Ninguno de estos pacientes padecía insuficiencia renal o miopatía ni estaba sometido a pautas orales de corticoides de forma habitual.
La espirometría se efectuó según normativa de la Sociedad Española de Aparato Respiratorio y Cirugía Torácica (SEPAR) y los estadios de la EPOC se establecieron según criterios GOLD12. El volumen espiratorio forzado en el primer segundo (FEV1) post-broncodilatación, capacidad vital forzada (FVC), FEV1/FVC se determinó utilizando un espirómetro MasterLab 9.20 (Jaegger, Würtzburg, Alemania).
Se descartó miopatía (lesión muscular primaria) mediante un estudio neurofisiológico, en el que se efectuó electromiografía con electrodo coaxial de aguja en músculo cuadriceps, se cuantificaron al menos 20 potenciales de unidad motora (PUM), se determinó la duración de cada uno de dichos potenciales, así como la media de todos ellos y el porcentaje de PUM polifásicos. También se valoró la existencia de reclutamiento facilitado así como el trazado de máximo esfuerzo. Este estudio se realizó mediante un equipo de electromiografía modelo Synergy de Oxford S.A.
Se consideró como criterio diagnóstico de miopatía la existencia de una disminución de al menos un 20% de la duración media de 20 PUM aislados. También se consideró la presencia mayor de un 25% de polifasia entre los 20 PUM, la existencia de reclutamiento facilitado y de la amplitud media disminuida del registro de máximo esfuerzo. Los parámetros de normalidad que se han considerado fueron los de nuestro laboratorio.
En ninguno de los pacientes se evidenciaron indicios neurofisiológicos compatibles con miopatía.
La determinación simultánea de pseudouridina y creatinina en orina se realiza por un método de cromatografía líquida de alta resolución (HPLC)13. El sistema cromatográfico es un modelo integrado de Beckman Coulter formado por una bomba modelo 126, autoinyector 508, detector espectrofotométrico de diodos en mosaico modelo 508 y estación de control sobre IBM PC 300. La columna utilizada es una Li-CHrospher® 100 RP-18 (5 μm) LiCHroCART® 250-4 (Merck) y precolumna LiCHrospher® 100 RP-18 (5 μm) LiCHroCART® 50-4 (Merck), como fase móvil se utilizó tampón fosfato (pH 6,1) 0,01 M, y ácido octanosulfónico 2,5 mM, como agente de par iónico. Detección UV a 250 nm. La velocidad de flujo es de 1 ml/min, se trabaja a temperatura ambiente.
Las muestras de orina fueron recogidas al azar, se almacenaron a -20 °C, para su análisis, se centrifugaron a 10.900 g durante 40 minutos, se filtraronn a través de una membrana de 0,45 μm; 25 μl son diluidos al 10% y se inyectan 20 μl en el sistema cromatográfico. Las muestras fueron procesadas en un tiempo no superior a un mes desde su recogida.
La validación del método se realizó mediante análisis de series con concentraciones conocidas de pseudouridina y creatinina, el cálculo de especificidad, linealidad, exactitud y precisión se realizaron según los requerimientos de la International Conference of Harmonisation of technical requirements for registration of pharmaceutical for human use (ICH)14. Mostraron un índice de repetibilidad satisfactorio con coeficientes de variación de 0,67-2,39%, al igual que la precisión intermedia, con coeficientes de variación de 3,4-7,16%. En cuanto a la exactitud, las recuperaciones fueron superiores al 89,80%. La sensibilidad de la técnica también había resultado satisfactoria con un límite de cuantificación (LOQ) inferior a 0,0035 para pseudouridina y a 0,1718 para creatinina.
Todos los sujetos permanecieron en una actividad ordinaria el día anterior y la muestra se obtuvo después de un periodo de reposo.
El presente estudio se adhiere a las recomendaciones de la Declaración de Helsinki sobre aspectos éticos en la investigación biomédica. La justificación ética del estudio está basada en la gran importancia de la enfermeda que se investiga. El estudio fue aprobado por el Comité de Ética del Hospital Central de la Defensa Gómez Ulla. Todos los participantes fueron informados en presencia de un testigo y dado que la información recogida tiene carácter confidencial, fue transmitida y almacenada según lo dictado en la Ley orgánica 15/1999, de 13 de diciembre, de Protección de Datos.
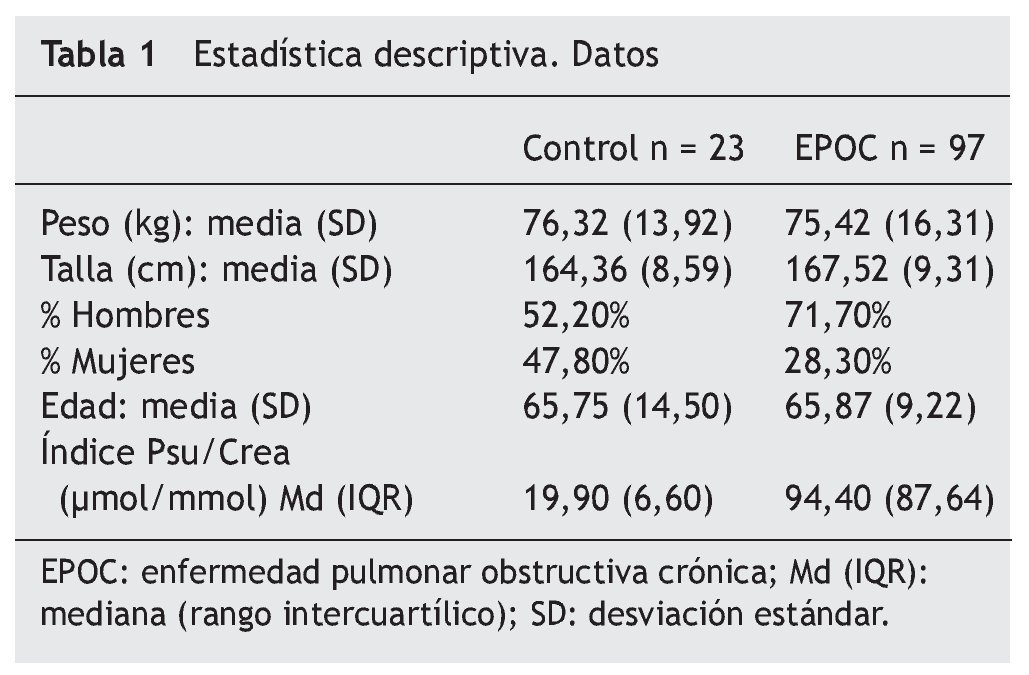
Las variables cualitativas se presentan como frecuencias absolutas y relativas en porcentaje, media (desviación estándar) o mediana (rango intercuartílico) dependiendo de que la distribución fuera normal o no, respectivamente. Para explorar diferencias entre el grupo control y pacientes de EPOC, se realizó una prueba de Mann Whitney. Para analizar el índice Psu/Crea en los distintos grupos de edad se realizó una prueba de Kruskal Wallis. Las correlaciones se estimaron usando los coeficientes lineales bivariados de correlación de Pearson o de Spearman dependiendo de la distribución normal o no de las variables, respectivamente. Un valor de p < 0,05 se consideró estadísticamente significativo para todos los análisis. El poder discriminatorio de las variables para el índice Psu/Crea, en relación a un catabolismo normal frente a otro al terado, se verificó mediante una curva ROC. Se calcularon igualmente la sensibilidad y especificidad para diversos puntos de corte. El análisis estadístico se realizó mediante el programa SPSS® para Windows (Chicago, Illinois).
Resultados
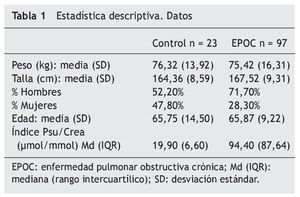
Ambos grupos son homogéneos en edad, sexo, talla y peso. En cuanto al tratamiento seguido por los pacientes con EPOC, el 71,8% de los pacientes del grupo EPOC estaba siendo tratado con anticolinérgicos inhalados y el 56,9% con corticoides inhalados. Al 15,5% se le administraron corticoides orales en cortos intervalos durante las exacerbaciones. El 42,42% recibía b2 agonistas de acción prolongada.
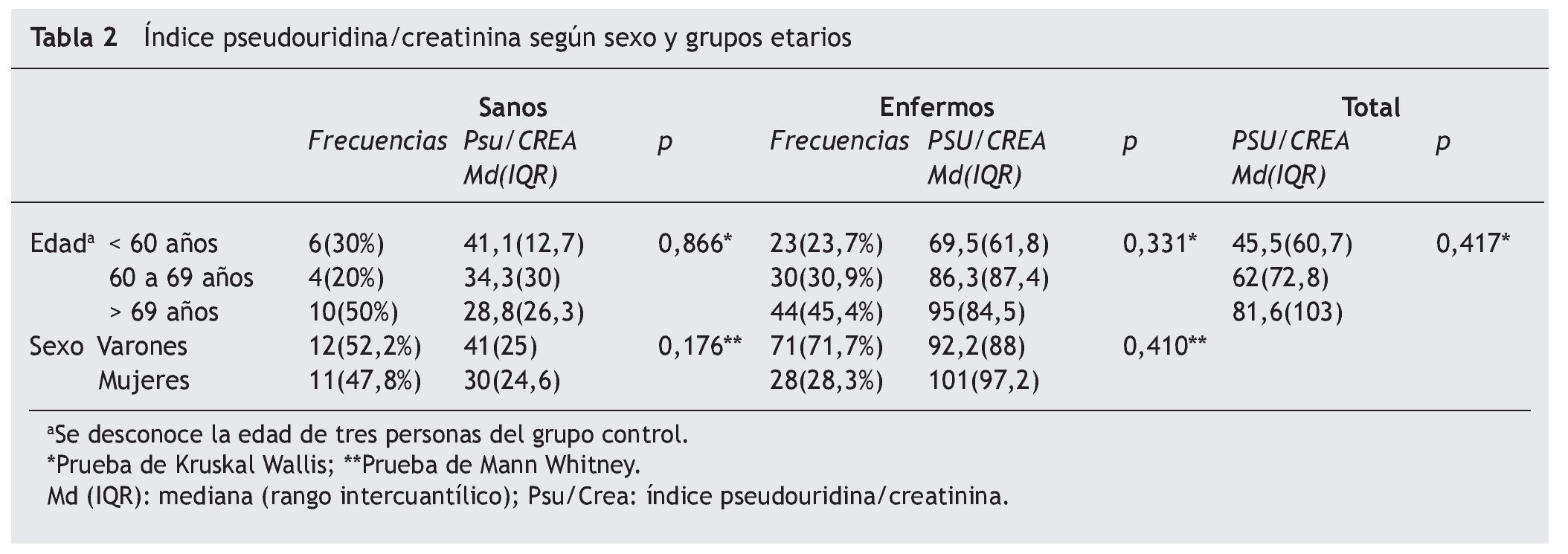
No se observa una correlación estadísticamente significativa entre la edad y la pseudoridina excretada ni en los controles con una media de edad de 65,75 (14,50) ni en el grupo de EPOC, 65,87 (9,22); p > 0,05 (tabla 1).
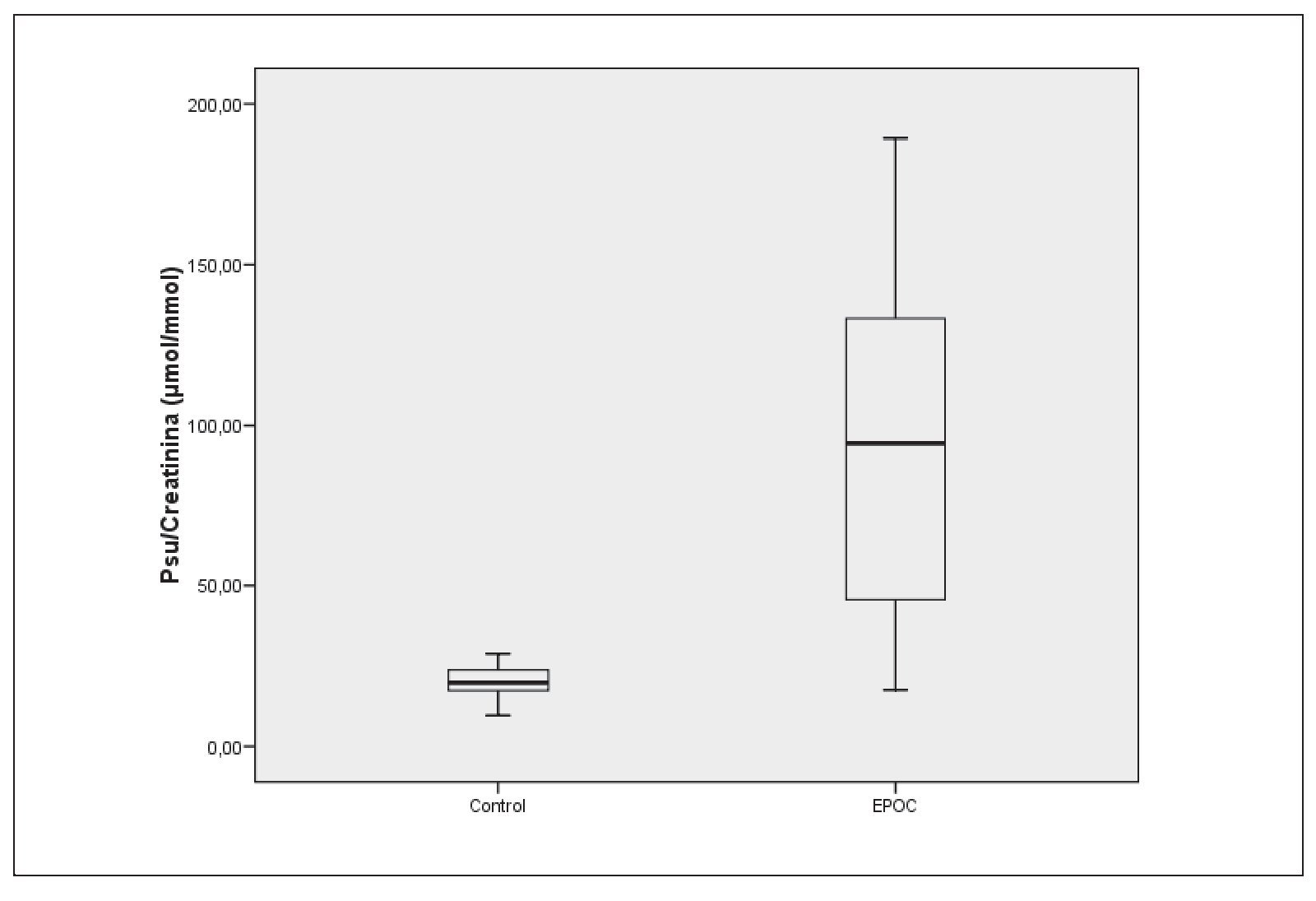
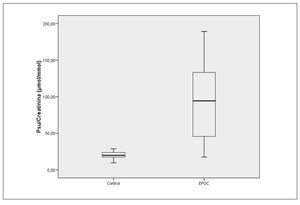
Se observan diferencias estadísticamente significativas (p < 0,001) en la excreción de pseudouridina, entre el grupo control y el grupo con EPOC: Md(IQR): controles 19,9 (6,6) μmol/mmol; EPOC: 94,4 (87,64) μmol/mmol (fig. 1).
Figura 1 Índice pseudouridina/creatinina. Control y enfermedad pulmonar obstructiva crónica.
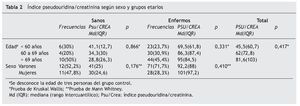
No se observaron diferencias estadísticamente significativas en la excreción de pseudouridina con respecto al sexo, ni en el grupo control ni en el grupo con EPOC (tabla 2).
Si analizamos el comportamiento de la pseudouridina en tres grupos de edades: menores de 60 años, entre 60 y 69 años, y mayores de 69 años, observamos que, en el grupo control, la cuantía de la excreción de pseudouridina no varía en función de la edad, como tampoco lo hace en el grupo EPOC (tabla 2).
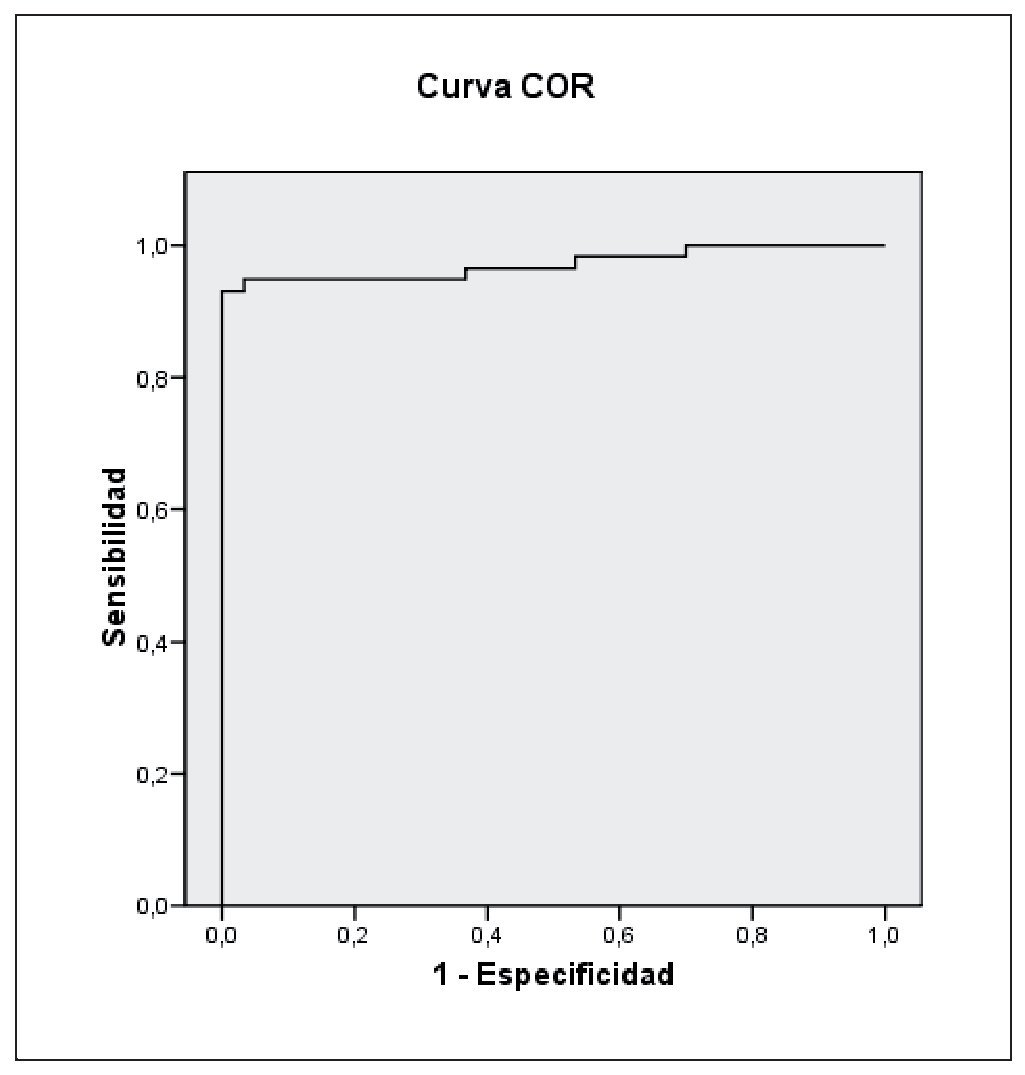
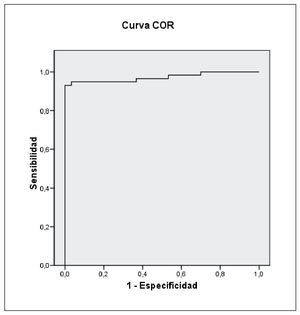
Al realizar la curva ROC para el índice Psu/Crea (μmol/ mmol) se obtuvo un punto de corte, que combina la mejor sensibilidad y especificidad, de 29,39 μmol/mmol (sensibilidad 93,1% y especificidad 100%) siendo el área bajo la curva 0,972 (IC 95%: 0,939-100) (fig. 2).
Figura 2 Curva operativa del receptor (COR) para el índice pseudouridina/creatinina.
DiscusiónNos encontramos con un método analítico susceptible de darnos orientación sobre la situación del catabolismo proteico muscular, de fácil aplicabilidad clínica.
Está demostrado por algunos autores15 que la pseudoridina de orina de 8 h se correlaciona con la de 24 h. De cualquier modo es más sencillo recoger muestras al azar, en cuyo caso es obligada su estandarización por la concentración de creatinina para corregir el efecto del posible factor de dilución (μmol de pseudouridina/mmol de creatinina) y del ritmo circadiano, tal como refieren Seidel et al16. La primera conclusión que se desprende del estudio es su aplicabilidad en la práctica clínica para orientar sobre la situación del catabolismo muscular en un determinado momento.
Los valores medios de pseudouridina publicados muestran unas cifras medias de 20-27 μmol/mmol17. Nuestros valores en la población control han sido de 19,9 (6,6) μmol/mmol inferiores a los descritos por Bolton et al17 y superiores a los referidos en otras publicaciones15,18. Estas diferencias pueden obedecer a factores de raza y selección de la población estudiada. En nuestro caso, la población control fue exhaustivamente examinada por motivos laborales lo que permitió descartar cualquier factor contaminante.
En la población con EPOC en nuestro estudio, la excreción de pseudoridina se muestra claramente aumentada con respecto a la población control, lo que coincide con otros autores como Bolton et al17. El aumento de su valor en la EPOC se justifica en cuanto la EPOC viene definida como un proceso inflamatorio, en el que además se incluyen fenómenos de estrés, sedentarismo, fármacos, todos ellos capaces de producir afectación muscular, influyendo en el desequilibrio anabolismo/catabolismo con predominio de este último18-20, sin que el tabaquismo influya en ello, pues ya en un anterior estudio demostramos la ausencia de relación entre tabaquismo y la cuantificación de pseudoridina en orina21.
La gran dispersión de valores en la población con EPOC en nuestro estudio se debe, a nuestro juicio, a que en ellas se incluyen pacientes en diferentes estadios evolutivos de la enfermedad así como a diferentes fenotipos de la misma.
Los caminos bioquímicos que conducen al desarrollo de la disfunción muscular no están completamente identificados y comprendidos pues existe una controversia en los resultados sobre el desequilibrio entre la actividad catabólica y de síntesis de las proteínas y enzimas musculares. Mientras algunos destacan que la causa es un defecto en la síntesis de proteína22-24 otros afirman que la causa es el predominio del catabolismo25. La elevación de pseudouridina cuantifica el incremento del catabolismo en el caso de la población con EPOC.
El hallazgo de un punto de corte en la curva ROC para pseudouridina de 29,39 μmol/mmol (sensibilidad: 93,1%; especificidad: 100%), tiene suficiente capacidad como para poder recomendar el uso de este índice en la práctica clínica para analizar la situación del catabolismo muscular en la población con EPOC y, en general, en otros procesos que cursen con un aumento de catabolismo, como han descrito otros autores15,17,19,20.
Hemos comprobado la evolución de la excreción urinaria de pseudouridina con la edad. Es conocido que la edad influye en la masa muscular26,27. La pérdida de masa muscular en relación con la edad es casi el doble en los hombres que en las mujeres y su pérdida natural puede verse incrementada por una inadecuada nutrición, inactividad, cambios hormonales, fármacos, estrés y procesos inflamatorios, entre otros.
El mantenimiento de la excreción urinaria de pseudouridina, con independencia de la edad en el grupo control, contrasta con el hecho de que en los más ancianos hay una importante disminución de la masa muscular y de su síntesis proteica27,28. Es decir, a pesar de que en el curso de los años disminuye la masa muscular y la síntesis proteica, se mantiene sin variación el índice catabólico. En la «cuenta muscular» baja el «haber» y se mantiene el «debe».
En conclusión, la medida de la excreción urinaria de pseudouridina es útil para cuantificar el comportamiento del catabolismo muscular, y puede ser utilizada como control del mismo en la EPOC, haciendo posible su detección temprana. En nuestro estudio, el punto de corte obtenido para una sensibilidad 93,1% y una especificidad del 100%, siendo el área bajo la curva de 0,972 (IC95%: 0,939-100) es 29,39 μmol/mmol y corresponderá a individuos que presenten un incremento del catabolismo en la EPOC.
Por otra parte, en la población estudiada, el grado de afectación del catabolismo muscular en la EPOC es independiente de la edad y del sexo.
*Autor para correspondencia.
Correo electrónico:pmonal@oc.mde.es (P. Montenegro Álvarez de Tejera).
Recibido el 25 de octubre de 2010;
aceptado el 28 de febrero de 2011